JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Microglial 프로세스 매력 ATP 또는 급성 뇌 조각에 세로토닌의 2 광자 영상
* 이 저자들은 동등하게 기여했습니다
요약
Microglia, 두뇌의 거주 면역 세포 그들의 환경의 수정에 형태학 변화 신속 하 게 응답. 이 프로토콜 2 광자 현미경을 사용 하 여 쥐의 급성 뇌 조각에서 세로토닌 또는 ATP microglial 프로세스의 매력을 공부 하는 방법을 설명 합니다.
초록
Microglial 세포는 상주 타고 난 면역 세포는 뇌의 지속적으로 그들의 긴 프로세스와 그들의 환경을 스캔 하 고, 항상성 장애 시 빠른 형태학 상 변화를 받 다. 예를 들어 레이저 병 변 몇 분에 상해의 사이트를 향해 "방향 운동" 라고도 하는 microglial 프로세스의 중심된 성장을 유도 합니다. 로컬 ATP 또는 세로토닌 (5-hydroxytryptamine [5-HT])를 제공 하 여 비슷한 효과 얻을 수 있습니다. 이 문서에서는, 우리는 프로토콜 ATP 또는 5-젊은 성인 쥐의 급성 뇌 조각에 HT의 로컬 응용 프로그램으로 microglial 프로세스의 방향 성장을 유도 하 고 시간이 지남에 따라이 매력 multiphoton 현미경 검사 법에 의해 이미지를 설명 합니다. 무료 및 오픈 소스 이미지 분석 소프트웨어와 정량화의 간단한 방법을 제안 했다. 여전히 급성 뇌 조각 특징 도전은 감소 하는 세포 생리 상태에 남아 나이 제한 된 시간 이다. 이 프로토콜, 따라서, 특히 성인 쥐에서 조각에에서 몇 시간 동안 microglial 세포의 생존 능력을 최적화 겨냥 한 몇 가지 기술적인 개선 (중간, 공기-액체 인터페이스 챔버, 이중 관류와 챔버 이미징) 하이라이트.
서문
Microglial 세포 두뇌의 주민 대 식 세포는 고 두 생리 및 병 적인 조건1,2에 역할. 그들은 높게 분기 형태와는 끊임없이 확장 있고 그들의 프로세스3,4를 제거. 이 "스캔" 문제가 관련 되며 그들의 주위에의 조사에 필요한 여겨진다. Microglia의 형태소가 소성 세 가지 모드에 표시 됩니다. 첫째, 일부 화합물 빠르게 microglial 형태학을 조절: ATP5,6 또는 급성 뇌 조각 입욕 하는 매체에 NMDA5,7 microglial 파급 효과의 복잡성 증가 반면 norepinephrine 그것6감소 한다. 이러한 효과 직접 (대 한 ATP 및 norepinephrine) microglial 수용 체에 의해 중재 하거나 신경 세포에서 ATP 릴리스 (NMDA)에 대 한 필요 합니다. 둘째, 운동 성 또는 "감시", microglial 프로세스의 성장과 수축 속도 extracellular 요인8, 항상성 중단9,10또는 돌연변이9에 의해 영향을 받을 수합니다 있습니다. 10,11. 셋째, 있을 뿐만 아니라 이러한 등방성의 형태와 운동 성 microglia ATP3,5,12, 를 제공 하는 피 펫으로 향해 그들의 프로세스를 확장 하는 수 용량이 있다 13 , 14, 급성 뇌 조각 또는 vivo에서, 또는 제공 5-HT 급성 뇌 조각15문화입니다. 방향 운동 성, 라고도 하는 microglial 프로세스의 이러한 지향된 성장 처음 로컬 레이저 병 변3,4에 대 한 응답으로 설명 했다. 따라서, 순수, 그것은 상해에 대 한 응답을 관련 되거나 시 냅 스를 향해 microglial 프로세스를 타겟팅에 필요한 또는 두뇌 지역 개발15,16, 동안 또는 생리17 가지 치기를 요구 ,,1819 또는 성인 기에 병 적인 상황9,18,,1920 . 세 가지 유형의 형태학 변화 다른 세포내 메커니즘11,,1320에 의존 하 고 한 주어진된 화합물 반드시 그들 (예를 들어, NMDA에 직접 역할을 하는 모두 변조 하지 않습니다. microglia, 형태에 영향을 하지만 방향 운동 성5,7을 유도 하지 않습니다). 따라서 때 microglia에 화합물, 돌연변이 또는 한 병 리의 효과 특성화를 목표로, 그들의 형태학 소성의 세 가지 구성 요소 특성 중요 하다. 여기, 우리는, 여기의 화합물, 로컬 소스, ATP 또는 5-HT microglial 프로세스의 방향 성장 연구 하는 방법을 설명 합니다.
일부의 모델이 microglia 프로세스 매력 공부: 3D 환경6,,1819, 급성 뇌 조각6,,1315, 그리고 vivo에서 주 문화 3,13이미지입니다. Vivo에서 접근 microglia의 생리 상태를 보존 하는 최고입니다. 그러나, 깊은 지역 intravital 이미징 필요 복잡 한 수술 과정 그리고, 그러므로, 그것은 종종 피상적 대뇌 피 질의 층으로 제한. Microglia 기본 문화권을 사용 하는 많은 동물의 제한 된 수를 가진 조건 테스트를 쉬운 기술입니다. 그럼에도 불구 하 고, 비보, 에서처럼 같은 셀 형태를 얻을 수는 없습니다 그리고 셀 손실 신경와 이다 그들의 생리 적인 상호 작용. 급성 뇌 조각이 두 가지 방법 사이 타협을 대표 한다. 이 모델 transcranial 현미경 검사 법은 주로 성인에서 수행 하는 반면 어려운 도달 vivo에서, 높은 해상도 이미지 하 고 신생아 단계에서 분할 영역을 조사 하는 뇌 구조를 연구 하는 연구자를 수 있습니다. 마지막으로, 그것은 지역 마약 응용 프로그램의 효과 실시간으로 관찰 하 고 실험 동물의 제한 된 수를 사용 하 여 반복 수 있습니다. 그럼에도 불구 하 고, 급성 뇌 조각 문제는 제한 된 시간 (몇 시간) 동안 셀21,22에 2 주, 그리고 microglia 형태학의 잠재적인 변화 보다 더 오래 된 쥐에서 조각을 위해 특히 살아 남아 .
여기, 우리는 젊은이 성인 Cx3cr1의 급성 뇌 슬라이스를 준비 하는 프로토콜을 설명GFP / + 마우스를 2 개월, 몇 시간 동안 microglia 형태 및 운동 성의 보존. 우리, 그럼, ATP 또는 5-HT 같은 화합물으로 microglial 프로세스의 매력을이 분할 영역을 사용 하는 방법을 설명 합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 실험 지역 윤리 위원회에 의해 승인 되었다 (다윈 위원회, 계약 # 1170와 #10921).
1. 유리 Micropipettes 화합물의 로컬 응용 프로그램에 대 한 준비
- 준비 붕에서 펫 전극 끌어당기는 사람와 얇은 유리 모 세관. 그들의 말단에 4-5 µ m 직경을 가진 펫을 얻기 위해 매개 변수를 조정 합니다. 그림 2D 낮은 확대율에서 대물에 한 피 펫을 보여줍니다.
2입니다. 솔루션
- 압력솥 사이클에 의해 청소 하는 유일한 유리를 확인 하십시오, 뒤에 헹 구는 2 x-초순, 3 x 사용 됩니다. 절대 사용 유리 paraformaldehyde 접촉 되었습니다.
-
2 mol·를 준비 L-1 14.7 mg CaCl2·2H2O 고 순도의 물 50 mL에 용 해 하 여 CaCl2 재고 솔루션 (초순, 저항 18.2 m ω, 증류수 또는 수돗물에 금속의 흔적 차선 슬라이스 품질 때문에 발생할 수 있습니다 프로 산화 효과)입니다.
- 한 달의 최대 실내 온도에이 재고 솔루션을 저장 합니다.
-
실험 당일, 그 조성은 110 mmol· 콜린-실제 (인공 척수) 솔루션의 1 리터를 준비 L-1 콜린 Cl, 25 mmol· L-1 포도 당, 25 mmol· L-1 NaHCO3, 7 mmol· L-1 MgCl2, 11.6 mmol· L-1 의약품, 3.1 mmol· L-1 나트륨 pyruvate, 2.5 mmol· L-1 KCl, 1.25 mmol· L-1 NaH2포4및 0.5 mmol· L-1 CaCl2, 0.5.
- 이 솔루션을 준비 하려면 추가, 다음 순서 대로, 졸업 1 L 플라스 크: KCl의 0.186 g, NaH2포40.195 g, ascorbic acid의 2.04 g, NaHCO3, 2.1 g 및 포도 당 4.5 g.
- 마지막 볼륨의 절반을 채워 초순 고 완전 한 해체까지 저 어.
- 0.34 g 나트륨 pyruvate와 콜린 Cl의 15.36 g를 추가 합니다.
참고: 첫 번째 디졸브 단계 2.3.2에서에서 전체 솔루션에 그것을 추가 하기 전에 준비 하는 솔루션의 5 ~ 10 mL와 콜린 Cl에 편리 하다. - 1 mol·의 7 mL을 추가 L-1 MgCl2 와 2 mol·의 250 µ L L-1 CaCl2 (준비 단계 2.2에서에서) 솔루션.
- 초순에 졸업된 플라스 크 1 L 채우십시오.
- 증기 압력 osmometer와는 osmolarity 300과 310 m ω 사이 인지 확인 합니다. 그렇지 않은 경우에 포도 당으로 조정.
- Carbogenation (즉,: "carbogen"와 버블링, 95% O2/5% CO2의 혼합) 후 pH를 확인 하 고, 필요에 따라 7.3-7.4 10 M NaOH로 조정.
- 저장용 유리 병에 솔루션을 전송 합니다. 사용 (3.1 단계)까지 냉장고에 있는 병을 유지.
참고: 실험 당일 신선한 솔루션을 확인 하는 것이 좋습니다. 그러나, 필요한 경우, 콜린-실제 저장 될 수 4 ° c.에 2 일에
-
실험 당일, 그 조성은 124 mmol·는 실제 솔루션의 1 리터를 준비 L-1 NaCl, 26.2 mmol· L-1 NaHCO3, 25 mmol· L-1 포도 당, 2.5 mmol· L-1 KCl, 2 mmol· L-1 CaCl2, 1 mmol· L-1 MgCl2및 1.25 mmol· L-1 NaH2포4.
- 이 솔루션을 준비 하려면 추가, 다음 순서 대로, 졸업된 플라스 크: NaH2포40.150 g, KCl의 0.186 g, NaHCO3의 2.2 g, 포도 당의 4.5 g, NaCl의 7.3 g. 초순 물 1 L의 볼륨에는 솔루션을가지고 고 저 어 접시에 적극적으로 그것을 저 어.
- 1 mol·의 1 mL을 추가 L-1 MgCl2 와 2 mol·의 1 mL L-1 CaCl2 솔루션 및 스토리지에 대 한 유리 병에 전송 실제 솔루션.
- osmolarity 300-310 mΩ· 인지 확인 L-1 경우, 포도 당으로 그것을 조정 하는 고.
- Carbogenation 후 pH를 확인 (즉, "carbogen"와 버블링) 7.3-7.4 10 M NaOH와 함께 필요한 경우, 그것을 조정 하 고.
- 저장용 유리 병에 솔루션을 전송 합니다. 사용 (3.1 단계)까지 냉장고에 있는 병을 유지.
참고: 실험 당일 신선한 솔루션을 확인 하는 것이 좋습니다. 그러나, 4 ° c.에 더 이상 1 주일 동안 저장 될 수 있다 최종 농도 x 10에 NaCl, NaHCO3, KCl, 및 NaH2PO4 를 포함 하는 재고 솔루션 x 10을 준비 하는 대신 초순 물으로 10 배 재고 솔루션을 희석 하 고 포도 당, CaCl2, MgCl2를 추가 하 여 실험의 날짜에 마지막 실제를 확인 합니다.
- 실험 당일 마약 솔루션을 준비 합니다. 실제 솔루션을 사용 하 여 최종 농도, 여기, 500 µmol·에 그들을 L-1 ATP와 5 µmol· 5-HT에 대 한 L-1
참고: ATP, 재고 솔루션 준비 하실 수 있습니다 (예를 들어, 50 m m 물에서 ATP),-20 ° C에 aliquoted 형태로 저장 하 고 실제 실험 당일 최종 농도에 희석. 반면, 5-HT (세로토닌-HCl) 솔루션 1 mg·mL-1 물에서 실험의 하루에 분말에서 준비, 5-HT 산화를 피하기 위해 4 ° C에서 보관이 고 실험의 때에 실제에 희석 있습니다.
3입니다. 급성 뇌 조각의 준비
-
절 개 면의 준비
- 얼음 심장 관류, 급속 한 뇌의 냉각 및 자르는 데에 80 mL 비이 커에 얼음 처럼 차가운 콜린-실제의 70 mL를 준비 합니다. 150 mL 200 ml 접시, 32 ° c.에 유지 온수 물 욕조에 배치를 crystallizing 콜린-실제의 준비 슬라이스를 유지 하는 장소 crystallizing 접시에 나일론 메쉬 스 트레이너. 이 조각 슬라이스 후 10 분 동안 복구할 수 있도록 사용 됩니다.
- (3.2 단원), 해 부를 시작 하기 전에 적어도 30 분 시작 이러한 두 가지 솔루션 (얼음에 콜린-실제의 70 mL)와 콜린-실제 32 ° C에서의 150 mL carbogen와 버블링. 전체 절차 동안 상수 carbogenation를 유지 합니다.
- 그들의 사용까지 분할 영역을 유지 하는 데 사용 됩니다 인터페이스 챔버 장치 (그림 1C)을 준비 합니다.
- 봉인 된 음식 상자에 (10 x 10 cm 또는 10 cm 직경, 높이 8cm)는 자력에 설치 장소 바 접시 crystallizing 200 mL 자석.
- Crystallizing 접시에 실제의 200 mL를 추가 하 고 3D 인쇄 인터페이스 슬라이스 홀더 (인터페이스 슬라이스 홀더는 서로 그림 1A, B뻗어 폴 리아 미드 메쉬 부분의 두 완벽 하 게 피팅, 구성) 위에 놓습니다.
- 인터페이스 조각 소유자의 메쉬를 포함 하는 솔루션의 얇은 필름만 계속 crystallizing 접시에서 초과 볼륨을 제거 합니다. 이것은 나중 좋은 변죽 슬라이스를 둘러싼 솔루션의 (하지만) 그들을 취재 하지 않고 만듭니다.
- 실제의 몇 밀리미터 음식 상자 아래쪽에 넣고 carbogen와 버블링 시작 (처음 사용 시 확인 작은 구멍 봉인된 음식 상자 벽 튜브 박스를 입력할 수 있는지 확인).
- 상수 carbogenation를 유지 하면서 봉인 된 상자를 닫습니다. 습도 95% O2/5% CO2 풍부한 환경을 있는 조각 콜린-실제에 그들의 회복 후 전송 되며 그들은 군데는 전에 유지 만들어집니다. 이 장치는 라 함 "인터페이스 챔버" (그림 1C).
-
뇌 해 부 및 슬라이스
- Anesthetize 50 mg·mL-1 pentobarbital (0.15 mL/20 g 마우스 몸 무게)의 복 주사와 마우스, 그것을 고정, 마음, 노출 및 수행의 얼음 처럼 차가운, 10 mL와 함께 심장 관류 carbogenated, 콜린-실제 (단계를 참조 하십시오 3.1.1), 연동 펌프. 좋은 관류의 지표로 서 간 증상을 관찰 합니다. 관류 5 분 미만 지속 한다.
- 목을 벨 마우스와 두개골을 폭로 하는 피부를 잘라. 큰가 위, 큰 구멍 및 1 개의 긴 화살 컷에서 두 횡단 상처를 적용 하 고 두개골 플레이트를 제거 미세 집게를 사용 하 여.
- 신속 하 고 부드럽게 (1 분 미만)에 두뇌를 추출 하 고 그것을 진정 위하여는 나머지 (~ 60 mL) 얼음 처럼 차가운 콜린-실제 (여전히 아래 상수 carbogenation)를 포함 하는 80 mL 비 커에 1 분 동안 그것을 배치.
- 전송 이전 실제와 젖은 필터 종이에 두뇌.
- 두뇌의 뇌 영역 및 슬 라이 싱의 기본 각도 잘라. 예를 들어 시상 또는 코로나 조각에 해 마 이미지를 잘라 메스 칼 날 소 뇌 그리고, 두뇌의 rostral와 꼬리 말단에서 m m 2에 대 한.
참고: 너무 rostral 또는 꼬리 너무 뇌 부분을 제거 하는 것이 중요 하다 때문에 관심의 영역에 도달 하기 전에 트림을 작은 지역 빨리 자르는. 단계에 대 한 조각화 (3.2.7) 미만 20 분의 총 시간 것이 좋습니다. - 코로나 슬라이스 및 진동 슬라이서의 커팅 블록에 붙어 10 cm 배양 접시에 두뇌의 꼬리 얼굴 (cyanoacrylate 접착제)와 접착제 놓고 큰 약 실에서 진동 슬라이서의 저수지 상공에 위치 얼음으로 가득합니다. 그런 다음 페 트리 접시 채울 모든는 나머지 얼음 콜린-실제.
- 95% O2/5% CO2 일정 유지 하면서 300 µ m 두께 코로나 조각 잘라 차가운 콜린-실제의 버블링 (속도: 0.08 mm·s-1, 블레이드 진동: 60 Hz, 진동 진폭: 1mm).
- 넓은 입 (지름 4 mm) 일회용와 뇌 조각 플라스틱 수집 블레이드, 독성 구성 요소 조각 주변에 의해 발표의 축적을 피하기 위하여의 모든 단일 패스 후 하나 하나. 복구에 대 한 약 10 분 동안 32 ° C에서 콜린 실제에 각 분할 영역을 전송 하는 동안 공기 거품을 피하기 위해 주의.
- 전송 피 펫과 함께 자리를 렌즈 청소의 조각에는 조각 종이 콜린-실제의 한 방울으로 장식. 콜린-실제의 초과 발음 하 고, 주걱, 조각, 실 온에서 carbogenated 실제를 포함 하는 인터페이스 챔버의 메쉬에 렌즈 청소 조직에 배치할 (3.1.3.5 참조). 적어도 30 분 동안이 환경에서 복구 하는 분할 하자.
참고: 이 후, 슬라이스 준비 하며 2 개월 오래 된 성인에서 뇌 추출 후 microglia 영에서 뇌 추출 후 최대 6 h에 대 한 이미징 (미만 1 개월) 마우스 및 최대 4 h 사용할 수 있습니다.
4. 2-광자 현미경
- 매개 변수 설정
- Multiphoton 시스템 (하이브리드 탐지기, 레이저 스캐너, 전기 광학 변조기, 현미경)에 전환.
- 920에서 레이저 조정 nm, 레이저 모드 고정 고 5%-15%와 10%에서 이득에 전원을 설정 확인. 이 목표 아래 3-5 mW의 파워에 해당합니다. Nondescanned 감지기는 종사 하는 적절 한 방출 및 여기 필터 설치 확인 합니다.
- 이미징 소프트웨어의 매개 변수는 다음 값으로 설정: 프레임 크기, 295.07 µ m; x 295.07의 지역에 해당 하는 1024 x 1024 픽셀에 대 한 확대, 2에 대 한. 신호가 아주 시끄러운 경우에, 2의 선 평균을 적용 합니다. 픽셀 역학에 대 한 이미징 소프트웨어 12 비트 이상으로 설정 합니다.
참고: 높은 비트 값으로 이미지 낮은 비트 값으로 이미지 보다 형광 강도에 작은 차이 구별 하는 연구자 수: 8 비트 이미지에 회색 값 256 회색 및 12 비트에서 16 회색 값의 변화에 대응할 것입니다 하나의 변화 나 값 n 16 비트 이미지를. 따라서, 더 높은 비트 이미지는 정량 분석에 더 적합 하지만 그들의 크기가 증가 비트 깊이, 저장 용량, 그리고 컴퓨팅 파워 제한 될 수 있습니다. - 스캔 모드 XYZT Z 간격 범위 2 µ m와 T-2 분의 간격을 선택 합니다.
참고: X, y 및 z 해상도 나이 키스 트 샘플링 정리에 의해 결정 됩니다. Microglia 프로세스를 해결 하기 위해 최적의 것입니다 0.8 주위 Z 스텝 크기 (직경의 < 1 µ m), multiphoton 현미경의 광학 해상도 제한 하지만 (920에서 0.95 나 목적으로 nm, 축 분해능은 1 µ m 주위). 그 위에 물리적 장벽, 라이브 이미징 실험, 감도 또는 신호 대 잡음 비율, 해상도, 속도, 그리고 총 관찰 시간 문제에서 했다. 이러한 모든 매개이 변수, 2 µ m (수많은 연구3,,1114)로, 1024 x 1024 픽셀의 이미지 크기와 유압 감지기 (그것에 결합 된 공명 스캐너를 사용 하 여 고속 수집의 z 단계를 고려 15 정도 소요 50 z-계획을 취득 하는 s) 여기에 선정 됐다. 취득의 주파수 1 XYZT 시리즈 마다 2 분 이며 총 기간은 30 분. 설정 하지 않으면 빠른 또는 충분히 민감한, 그것 (512 x 512) 아래로 측면 해상도 또는 z 조각의 수를 줄이기 위해 가능 하다 (강한 형광을 전시 하는 z 깊이에서 독점적으로 이미징 하 여 [즉, 아니라 깊은 z-조각 어디 형광은 희미 한]), 또는 스캐너의 속도 감소. 축 해상도 또한 3 µ m, 최대 z 단계 증가 의해 감소 될 수 있습니다 하지만이 정량화에 영향을 미칠 수, 비교할 모든 실험 같은 z-단계와 수행 되어야 한다.
참고: 그것은 CX3CR1creER YFP 쥐18, microglia만, 유전 삭제를 유도 하 고 어떤 microglia constitutively 노란 형광 성 단백질 (YFP) 표현 하는 데 사용 하는 마우스 선 조각에 비슷한 실험을 수행할 수 있습니다. 그러나, YFP 식 수준은 매우 낮은 CX3CR1에 녹색 형광 단백질 (GFP)에 비해GFP / + 쥐; 따라서, 이미징 가능 하지만 도전 하며 인수 매개 변수의 최적화. 다음과 같이 그들을 조정 하는 것이 좋습니다. - 970에서 레이저 조정 nm (920 보다 YFP 여기에 맞게 더 나은 nm), 50%, 그리고 50%, 5-6 mW의 목표 아래 레이저 파워에 해당에서 이득에 전원.
- 신호 대 잡음 비율을 개선 하기 위해 4 (또는 이상)의 선 평균을 설정 합니다.
- 위치는 슬라이스 및 유리 제 micropipette 및 화합물의 로컬 응용 프로그램의
- 녹음 실, 녹음을 시작 하기 전에 30 분을 연동 펌프를 연결 합니다. 초순의 50 mL와 함께 전체 관류 시스템을 청소 후 실제 (50 mL) 상수 carbogenation 아래 유리 비 커에 포함 된 녹음 실의 관류를 시작 합니다. 실험을 통해 순환 실제 인라인 microheater 또는 Peltier 히터와 32 ° C를 유지.
참고: 위쪽 및 아래쪽 관류와 특정 관류 챔버는 조각의 양쪽에 산소를 최적화 하기 위해 설계 되었습니다. 관류 챔버 두 완벽 하 게 피팅 부품, 폴 리아 미드 메쉬 (그림 2A, B)을 서로 뻗어 구성 됩니다. 챔버, 어디 조각 유리 coverslip에 직접 누워 있다의 다른 종류에 비해이 챔버 조각의 하단 부분에 있는 신경 죽음을 감소, 생존, 향상과 팽창에 의해 유도 된 조각 움직임을 감소. - 넓은 입 일회용 전송 피 펫과 뇌 조각 렌즈 종이 제거, 싱크 (증거로 아무 공기 방울이 연결 되어), 및 녹음 (관류) 약 실에 그것을 전송 실제 비 커에 이미지를 전송 합니다.
- 관류 흐름 때문 슬라이스 움직임을 최소화 하기 위해 조각에 조각 홀더 (플래티넘의 병렬 나일론 스레드 합류 하는 두 가지로 만든 헤어핀)를 배치 합니다.
- 밝은 분야 조명을 사용 하 여 관심 뇌 영역을 대상 (노출 시간: 50 ~ 80 ms) (5 X 또는 10 X) 낮은 배율 목표를 사용 하 여. 높은 배율 (25 x 0.35 x 렌즈) 물 침수 목적을 전환 하 고 위치를 조정 합니다.
참고: 그들은 빛을 차단 하 고 로컬로 슬라이스를 변형 수 조각 보유자의 나일론 스레드 가까운 이미지 필드를 피하십시오. 관심 영역 평면 있는지 확인 합니다. 필요한 경우 분할 위치를 조정 하려면 분할 영역 홀더 또는 슬라이스 홀더를 제거 합니다. - 필드에 이미지를 형광 microglial 세포를 사용 하는 형광 조명 (노출 시간: 250-500 ms).
참고: 이 단계 연구자를 관심과 그들의 형광 강도의 지역에 있는 세포의 존재를 확인 하 고 세포질 파편의 양을 제어할 수 있습니다. - 백필 실제의 10 µ L 피펫으로 ATP, 함께 5-HT, 또는 그것의 최종 농도에 대 한 관심의 마약. 포인트 팁 아래와 부드럽게 흔들어 약물 가득 피 펫 팁에 갇혀 모든 기포를 제거 하.
참고: 주입을 솔루션 폼 거품 경향이, 내부 필 라 멘 트와 함께 붕 규 산 펫을 사용 하십시오. 피펫으로에서 ATP의 누설도 주사 하기 전에 microglial 프로세스를 유치 할 수 있습니다 (이 경우, 그것은 볼 수 분석 단계에서). 이 ATP 농도와 적당 한 있어야 지만 사용 (500 µmol· L-1), 문제 라면, 고려는 micropipette ATP (또는 다른 화합물)를 추가 하기 전에 실제의 2 mL와 함께 prefilling 단계 4.2.6 솔루션. - 5 mL 위치에 위치 하는 플런저와 함께 투명 한 튜브 5 mL 주사기를 연결 하는 피 펫 홀더에서 채워진된 피 펫을 탑재 합니다. 자체 피 펫 홀더 3 축 micromanipulator에 거치 된다.
- 필드 밝은 조명 아래는 micromanipulator 피펫으로 필드의 중앙에 위치를 사용 합니다. 재현성 및 최적의 중심, 표시 및 눈금자를 사용 하 여 이미지에.
- 낮은 조각으로 부드럽게 피 펫, 제어 하 고 가볍게 피 펫 팁까지 동시에 목표를 조정 접촉 조각의 표면. 그것은 조각을 만져 볼 수는 피 펫의 강하를 막을 수 80-100 µ m의 조각의 표면 침투 피 펫 팁 ( 그림 3B참조).
- 레이저 튜닝 (위의 매개 변수 참조) 현미경 multiphoton 모드로 전환. 모든 광원 (예를 들어, 컴퓨터 화면)에서 챔버 상영은 다는 것을 확인 하십시오. Nondescanned 감지기에 전환 하 고 이득을 설정 합니다. 색으로 구분 된 상한 룩 업 테이블 (LUT)를 사용 하 여 이미지의 픽셀을 포화를 피하기 위해.
- 이미지 수를 슬라이스의 두께 결정 (즉, 상위 및 하위 z-위치 형광은 [총에서 220와 290 µ m] 사이 보통 감지).
참고: 조각의 표면에 조각의 내부에 비해 특이 한 형태와 종종 microglia 가능성이 프로세스의 증가 밀도가 있다. 이 축적 시간 (즉,., 이미지 수를 첫 번째 뇌 조각에 보다 마지막에 눈에 보이는) 더 눈에 띄는 것입니다. 따라서, 처음 ~ 30 µ m에서 z-비행기 분석을 위해 사용 하지 않아야 하 고 인수에도 건너뛸 수 있습니다. - 30 분 (또는 원하는 경우 더)의 전체 기간 동안 기록 시작 하 고 5 분 기준 후 로컬로 적용 (방해는 이미징) 없이 테스트할 화합물. 이렇게 하려면 1 mL 위치에 5 mL에서 micropipette에 연결 하는 주사기의 플런저를 눌러 천천히 (약 5에서 s). 플런저를 눌러 때 즉시 느낄 수 있어야 합니다. 그렇지 않은 경우에 팁 깨진 수 있습니다.
참고: 훈련 된 실험에 대 한이 방법으로 주사 재현할 수, 있지만 또는 주사기의 수동 조작에 피펫으로 수 연결할 배달 볼륨의 더 나은 제어를 허용 하는 자동된 압력 배출 시스템. 주사는 주사의 사이트에서 조각의 물리적 왜곡을 만듭니다. 이 왜곡 표시 됩니다 첫 번째 두 개 또는 세에서 귀납적 주입 후 이미지 하지만 4 번째 이미지 (즉, 주입 후 8 분)에 표시 해서는 안됩니다. 그것은 지속 되 면, 피 펫 준비에 대 한 매개 변수를 변경 하는 것이 좋습니다. - 수집 (30 분)의 끝에는 micropipette 삭제 하 고 분할을 제거 합니다. 원하는 경우 조각을 더 immunolabeling에 대 한 수정. 예를 들어 스냅숏 메서드는 고정에 대 한 최적화 하 고23조각 두께의 얼룩.
- 새 분할 영역을 이미지, 2D 영화 (섹션 5.1) 해당 microglia를 확인 하기 위해 확인을 시작 하기 전에 정상적인 형태 하 고는 이동 하 고, 따라서, 슬라이스는 건강 한.
- 녹음 실, 녹음을 시작 하기 전에 30 분을 연동 펌프를 연결 합니다. 초순의 50 mL와 함께 전체 관류 시스템을 청소 후 실제 (50 mL) 상수 carbogenation 아래 유리 비 커에 포함 된 녹음 실의 관류를 시작 합니다. 실험을 통해 순환 실제 인라인 microheater 또는 Peltier 히터와 32 ° C를 유지.
5. Microglial 프로세스의 매력 분석
-
2D 투영 및 드리프트 보정
- 파일 (. LIF) 피지24.
- 필요한 경우만 z-비행기 관심의와 substack (이미지/스택/도구/확인 Substack)을 확인 합니다. 예를 들어 z-비행기 획득 되지만 분석에 사용할 수 없습니다 하는 경우에 해당 하는 조각의 표면 제외 (단계 4.2.11 후 메모 참조)와 아무 형광과 깊은 z 비행기. 최종 스택 90-110 z-조각 (180-220 µ m)에 일반적으로 포함 되어 있습니다.
- Z 프로젝트 기능 실행 (이미지/스택/Z 프로젝트") 고 z 스택의 각 시간 지점에서 인수 계획을 최대 강도 프로젝션 유형을 선택 합니다.
- MultiStackReg 플러그인 (플러그인/등록/MultiStackReg), 실행 선택 작업 1: 정렬 및 변환: 강 체 인수 하는 동안 발생 한 수 있습니다 약간의 드리프트를 해결 하기 위해. 새 파일 (.tiff)로이 2D 영화를 저장 합니다.
-
데이터 처리
- 얼음25를 가진이 새 파일을 엽니다.
- 35 µ m 직경, 사출 사이트 (특히 피펫으로 주입의 때에 만든 왜곡의 그림자에 의해 식별 됨)에 중심에 관심 (ROI)의 원형 R1 영역을 그립니다.
- 투자 수익 강도 진화 플러그인을 사용 하 고 r 1에서 시간이 지남에 평균 강도 측정.
- 결과를 저장 한. XLS 파일입니다.
-
정량화 및 결과의 표현
- 시간이 지남에 따라 microglial 응답을 계량 하려면 각 시간 지점에서 결정
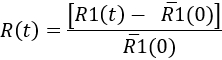
Here,'R1(0) 주사 하기 전에 R1(t) 값의 평균입니다. 그런 다음, 결과 microglial 응답의 운동으로 대표 될 수 있다 또는 특정 시간에 포인트 ( 그림 7참조).
- 시간이 지남에 따라 microglial 응답을 계량 하려면 각 시간 지점에서 결정
Access restricted. Please log in or start a trial to view this content.
결과
이 프로토콜 유도, 관찰, 및 로컬로 적용된 화합물 향해 microglial 프로세스의 중심된 성장 계량 하는 방법에 설명 합니다, 예를 들어 ATP 또는 5-HT, 급성 뇌에 영 또는 성인에서 조각 (적어도 까지의 2 개월) 쥐. 몇 시간 동안 건강 한 상태에서 성인 동물에서 뇌 조각을 유지에 기여 하는 요인 들 중 프로토콜의 2 단계에서 세포 생존을 최적화 하도록 설계 된 두 개의 도구를 사용...
Access restricted. Please log in or start a trial to view this content.
토론
유지, 달리에서 해리 또는 organotypic 슬라이스 문화, 구조적 무결성 제한 된 네트워크 조정, 급성 뇌 조각 허용 microglia 그들의 생리 적인 환경에서 공부 하는 연구자. 그러나, 주요 한계 중 하나는 조각화 절차 빠르게 특히 성인 두뇌에서에서 뉴런의 생존 능력을 손상 시킬 수 있는 부상 만듭니다 사실 이다. Microglia 특히 세포 손상에 반응으로, 그것은 가능한 그들의 생리 적인 상태에 가까운 microglia?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 없다.
감사의 말
우리는 세포와 조직의 이미징 시설 인 뒤 Fer à 무 랑, 어디 모든 이미지 수집 및 분석 수행 되었습니다 감사 합니다. 이 작품 일부는 센터 국립 드 라 검색 사이언스 인 국립 드 라 건강에 의해 지원 되었습니다 동부 표준시 드 라 공 들인 Médicale, 소 르 본 대학교 과학 그리고 소 르 본 Universités-피에르에서 교부 금에 의해 외 마리 퀴리 대학 ( Emergence-UPMC 프로그램 2011/2014)는 Fondation 부 la Recherche 쉬르 르 Cerveau, Fondation 드 프랑스에서 Fondation 라 검색 Médicale "Equipe FRM DEQ2014039529", 연구 (직원 회 부 라 Recherche 프랑스 정부, ANR-17-CE16-0008 및 Investissements d'Avenir 프로그램 "바이오 싸이 Labex" ANR-11-IDEX-0004-02) 및 전산 신경 과학 프로그램, 연구를 위한 국립 과학 재단/프랑스 국가 기관에서에서 공동 연구 (번호: 1515686). 모든 저자는 연구 제휴는 파리 학교 신경 (ENP) 바이오 싸이 Labex의 구성원을 그룹화 합니다. F.E. 소 르 본 대학교, Collège 박사, F-75005 파리, 프랑스, 제휴 박사 학생 이며 바이오 싸이 Labex에 의해 자금이 다. V.M.은 박사 후 연구원 전산 신경 과학 프로그램, 국립 과학 재단/프랑스 국립 기관 연구에 대 한 공동 연구에 의해 투자 (번호: 1515686). 저자는 프로젝트의 개시에 참가 마르타 Kolodziejczak 감사 합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| for pipettes preparation | |||
| Clark Borosilicate Thin Wall Capillaries | Harvard Apparatus | 30-0065 | Borosilicate Thin Wall without Filament, 1.5 mm OD, 1.17 mm ID, 75 mm L , Pkg. of 225 |
| DMZ Universal Puller | Zeitz Instrumente | ||
| Name | Company | Catalog Number | Comments |
| for solutions | |||
| Calcium Chloride dihydrate (CaCl2) | Sigma | C5080 | |
| Choline Chloride | Sigma | C7527 | |
| D-(+)-Glucose | Sigma | G8270 | |
| L-Ascorbic acid | Sigma | A5960 | |
| Magnesium Chloride solution 1 M (MgCl2) | Sigma | 63020 | |
| Potassium chloride SigmaUltra >99.0% (KCl) | Sigma | P9333 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium Chloride (NaCl) | Sigma | S5886 | |
| Sodium phosphate monobasic | Sigma | S5011 | |
| Sodium pyruvate | Sigma | P2256 | |
| Ultrapure water | MilliQ | for all the solutions | |
| Name | Company | Catalog Number | Comments |
| for slice preparation | |||
| 2x 200 mL crystalizing dishes | |||
| 80 mL Pyrex beaker | |||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For mice perfusion and 2-photon chamber perfusion (aCSF) |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | ||
| Dolethal | Vetoquinol | Dolethal 50 mg/mL | |
| Filter papers (Whatman) | Sigma | WHA1001042 | Whatman qualitative filter paper, Grade 1 (Pore size: 11µM) |
| Fine Scissors - Sharp | Fine Science Tools | 14060-60 | |
| Food box 10 cm diameter, 8 cm Height | |||
| glue (ethyl cyanoacrylate) | Loctite | super glue 3 power flex | |
| Hippocampal Tool (spatula) | Fine Science Tools | 10099-15 | The largest extremity has to be angled at 90° |
| Ice | |||
| Iris Forceps (curved) | Moria | MC31 | |
| Lens cleaning tissue | THOR LABS | ||
| Nylon mesh strainer | diameter 7 cm | ||
| Razor blades | Electron Microscopy Sciences | 72000 | For the slicer |
| scalpel blade | |||
| Slice interface holder | home-made, the file for 3D printing is provided in Supplemental Material | ||
| Surgical Scissors - Sharp | Fine Science Tools | 14002-14 | |
| Vibrating slicer | Thermo Scientific | 720-2709 | Model: HM 650V (Vibrating blade microtome) |
| Water bath | Set at 32 °C (first recovery step) | ||
| Name | Company | Catalog Number | Comments |
| for slice imaging | |||
| × 25 0.95 NA water-immersion objective | Leica Microsystems (Germany) | HCX Irapo | |
| 2-photon MP5 upright microscope with resonant scanners (8 kHz) and two HyD Hybrid detectors | Leica Microsystems (Germany) | ||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For 2-photon chamber perfusion with aCSF |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | I1501L50R2A001 | |
| Chameleon Ultra2 Ti:sapphire laser | Coherent (Germany) | ||
| disposable transfer pipettes , wide mouth | ThermoFischer scientific | for example : 232-11 | 5.8 mL with fin tip, but we cut it (approx 7 cm) to have a 4 mm diameter mouth |
| emission filter SP680 | Leica Microsystems (Germany) | ||
| fluorescent cube containing a 525/50 emission filter and a 560 dichroic filter (for fluorescence collection) | Leica Microsystems (Germany) | ||
| glass beaker with 50 mL of ACSF to maintain constant perfusion of the slice | |||
| Heating system | Warner Instrument Corporation | Automatic Heater Controller TC-324B | to maintain perfusion solution at 32 °C |
| perfusion chamber | home-made, the file for 3D printing is provided in Supplemental Material | ||
| slice holder ("harp") | home made : hairpin made of platinum with the two branches joined by parallel nylon threads | ||
| Name | Company | Catalog Number | Comments |
| for slice stimulation | |||
| Adenosine 5′-triphosphate disodium salt hydrate (ATP) | Sigma | A-26209 | to be prepared ex-temporaneously : 1 mg/mL (3 mM) stock solution prepared the day of the experiment, kept at 4 °C (a few hours) and diluted just before use |
| Fluorescein (optional) | Sigma | F-6377 | use at 1 µM final |
| Micromanipulator | Luigs and Neumann | SM7 | connected to the micropipette holde |
| Micropipette holder | same as for eletrophysiology | ||
| Serotonin hydrochloride | Sigma | H-9523 | aliquots of 50mM stock solution in H20 kept at -20 °C. 500 µM solution prepared the day of the experiment. |
| Syringe 5 mL (without needle) | Terumo medical products | SS+05S1 | |
| Transparent tubing | Fischer Scientific | 11750105 | Saint Gobain Performance Plastics™ Tygon™ E-3603 Non-DEHP Tubing |
| Name | Company | Catalog Number | Comments |
| for image analysis | |||
| Fiji | https://fiji.sc | Schindelin, J. et al Nat. Methods (2012) doi 10.1038 | |
| Icy | Institut Pasteur | http://icy.bioimageanalysis.org | de Chaumont, F. et al. Nat. Methods (2012) |
| Name | Company | Catalog Number | Comments |
| mice | |||
| CX3CR1-GFP mice | Jung et al, 2000 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. | |
| CX3CR1creER-YFP mice | Parkhurst et al 2013 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. |
참고문헌
- Salter, M. W., Stevens, B. Microglia emerge as central players in brain disease. Nature Publishing Group. 23 (9), 1018-1027 (2017).
- Tay, T. L., Savage, J., Hui, C. W., Bisht, K., Tremblay, M. -È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. , (2016).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Dissing-Olesen, L., et al. Activation of neuronal NMDA receptors triggers transient ATP-mediated microglial process outgrowth. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10511-10527 (2014).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. Journal of Biological Chemistry. 288 (21), 15291-15302 (2013).
- Eyo, U. B., et al. Neuronal hyperactivity recruits microglial processes via neuronal NMDA receptors and microglial P2Y12 receptors after status epilepticus. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10528-10540 (2014).
- Hristovska, I., Pascual, O. Deciphering Resting Microglial Morphology and Process Motility from a Synaptic Prospect. Frontiers in Integrative Neuroscience. 9, 1231(2016).
- Avignone, E., Lepleux, M., Angibaud, J., Nägerl, U. V. Altered morphological dynamics of activated microglia after induction of status epilepticus. Journal of Neuroinflammation. 12, 202(2015).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biology. 14 (5), e1002466(2016).
- Madry, C., et al. Microglial Ramification, Surveillance, and Interleukin-1β Release Are Regulated by the Two-Pore Domain K+Channel THIK-1. Neuron. 97 (2), 299-312 (2018).
- Honda, S., et al. Extracellular ATP or ADP induce chemotaxis of cultured microglia through Gi/o-coupled P2Y receptors. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 21 (6), 1975-1982 (2001).
- Haynes, S. E., et al. The P2Y12 receptor regulates microglial activation by extracellular nucleotides. Nature Neuroscience. 9 (12), 1512-1519 (2006).
- Wu, L. -J., Vadakkan, K. I., Zhuo, M. ATP-induced chemotaxis of microglial processes requires P2Y receptor-activated initiation of outward potassium currents. Glia. 55 (8), 810-821 (2007).
- Kolodziejczak, M., et al. Serotonin Modulates Developmental Microglia via 5-HT 2BReceptors: Potential Implication during Synaptic Refinement of Retinogeniculate Projections. ACS Chemical Neuroscience. 6 (7), 1219-1230 (2015).
- Schafer, D. P., et al. Microglia Sculpt Postnatal Neural Circuits in an Activity and Complement-Dependent Manner. Neuron. 74 (4), 691-705 (2012).
- Pfeiffer, T., Avignone, E., Nägerl, U. V. Induction of hippocampal long-term potentiation increases the morphological dynamics of microglial processes and prolongs their contacts with dendritic spines. Scientific Reports. 6, 32422(2016).
- Parkhurst, C. N., et al. Microglia Promote Learning-Dependent Synapse Formation through Brain-Derived Neurotrophic Factor. Cell. 155 (7), 1596-1609 (2013).
- Wu, Y., Dissing-Olesen, L., Macvicar, B. A., Stevens, B. Microglia: Dynamic Mediators of Synapse Development and Plasticity. Trends in Immunology. 36 (10), 605-613 (2015).
- Ohsawa, K., et al. P2Y12 receptor-mediated integrin-beta1 activation regulates microglial process extension induced by ATP. Glia. 58 (7), 790-801 (2010).
- Kurpius, D., Wilson, N., Fuller, L., Hoffman, A., Dailey, M. E. Early activation, motility, and homing of neonatal microglia to injured neurons does not require protein synthesis. Glia. 54 (1), 58-70 (2006).
- Stence, N., Waite, M., Dailey, M. E. Dynamics of microglial activation: a confocal time-lapse analysis in hippocampal slices. Glia. 33 (3), 256-266 (2001).
- Dissing-Olesen, L., Macvicar, B. A. Fixation and Immunolabeling of Brain Slices: SNAPSHOT Method. Current Protocols in Neuroscience. 71, 1.23.1-12 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- Aitken, P. G., et al. Preparative methods for brain slices: a discussion. Journal of Neuroscience Methods. 59 (1), 139-149 (1995).
- Paris, I., et al. ProMoIJ: A new tool for automatic three-dimensional analysis of microglial process motility. Glia. 66 (4), 828-845 (2018).
- Pagani, F., et al. Defective microglial development in the hippocampus of Cx3cr1 deficient mice. Frontiers in Cellular Neuroscience. 9 (229), 111(2015).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. , Clifton, NJ. 221-242 (2014).
- Mainen, Z. F., et al. Two-photon imaging in living brain slices. Methods. 18 (2), San Diego, CA. 231-239 (1999).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Gyoneva, S., et al. Systemic inflammation regulates microglial responses to tissue damage in vivo. Glia. 62 (8), 1345-1360 (2014).
- Heindl, S., et al. Automated Morphological Analysis of Microglia After Stroke. Frontiers in Cellular Neuroscience. 12, 106(2018).
- Dailey, M. E., Eyo, U., Fuller, L., Hass, J., Kurpius, D. Imaging microglia in brain slices and slice cultures. Cold Spring Harbor Protocols. 12 (12), 1142-1148 (2013).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유