Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mikroglial süreçleri cazibe ATP veya Serotonin akut beyin dilimleri içinde doğru iki fotonlu görüntüleme
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Microglia, yerleşik bağışıklık hücreleri beynin, çabuk morfolojik değişiklikler ile çevrenin değişiklikler cevap. Bu protokol iki fotonlu mikroskobu serotonin veya ATP doğru mikroglial süreçlerinde fareler dilim akut beyin cazibe çalışmak için nasıl kullanılacağını açıklar.
Özet
Sürekli onların çevre onların uzun süreçleri ile inceden inceye gözden geçirmek ve homeostasis kesintiye uğraması, hızlı morfolojik değişiklikleri meydana ikamet doğuştan gelen bağışıklık hücreleri beynin mikroglial hücrelerdir. Örneğin, bir lazer lezyon birkaç dakika içinde bir odaklı büyüme yaralanma site doğru "yön hareketliliği" olarak da adlandırılır mikroglial süreçlerin neden olmaktadır. ATP veya serotonin (5-hydroxytryptamine [5-HT]) yerel olarak sunarak benzer bir etki elde edilebilir. Bu makalede, biz mikroglial işlemlerin ATP veya 5-HT genç ve yetişkin mice akut beyin dilim içinde yerel bir uygulama doğru bir yön büyümesini teşvik ve zaman içinde bu cazibe tarafından multiphoton mikroskopi olabilir görüntü için bir iletişim kuralı tanımlamak. Miktar ücretsiz ve açık kaynak görüntü analiz yazılımı ile basit bir yöntem önerdi. Hala akut beyin dilimleri karakterize bir meydan okuma ile yaş sırasında hücreleri fizyolojik bir durumda kalır, azalan sınırlı zamanı. Bu iletişim kuralı, böylece, mikroglial hücre canlılığı başta dilimleri yetişkin fareler üzerinden birkaç saat içinde en iyi duruma getirme bazı teknik gelişmeler (orta, hava-sıvı arayüzey odası, oda bir çift kişilik perfüzyon ile görüntüleme) yönelik vurgular.
Giriş
Mikroglial hücreleri beynin ikamet makrofajlar vardır ve her iki fizyolojik ve patolojik koşulları1,2' bir rol oynamaktadır. Onlar çok dallı bir kara delik var ve sürekli genişletme ve onların işlemleri3,4geri çeker. "Tarama" Bu davranış ilgili ve onların çevre araştırması için gerekli olduğuna inanılıyor. Microglia morfolojik plastisite üç modda ifade edilir. İlk olarak, bazı bileşikler modüle hızla mikroglial Morfoloji: ATP5,6 veya NMDA5,7 akut beyin dilimleri banyo orta eklenmesi mikroglial etkileri, karmaşıklığını artırır Oysa norepinefrin6azalır. Bu efektleri (ATP ve norepinefrin) mikroglial reseptörler tarafından doğrudan aracılı veya nöronlar bir ATP sürümü (NMDA) gerektirir. İkinci olarak, mikroglial işlemleri, motilite veya "gözetim", olarak adlandırılan büyüme ve geri çekme hızı hücre dışı Etkenler8, homeostasis kesintileri9,10veya mutasyonlar9tarafından etkilenebilir, 10,11. Üçüncü olarak, Morfoloji ve hareketliliği bu izotropik değişikliklerin yanı sıra, onların oluşum directionally bir pipet ATP3,5,12, teslim doğru genişletmek için kapasite var microglia 13 , 14, kültür, akut beyin dilimler veya içinde vivo veya teslim 5-HT akut beyin dilimleri15dakika sonra. Tür odaklı büyüme yönlü hareketliliği, adı da verilen mikroglial süreçlerinin ilk yerel lazer lezyon3,4yanıt olarak tanımlanmıştır. Böylece, fizyolojik olarak, yanıt sakatlığı ile ilgili veya olabilir mikroglial süreçleri sinapslarda doğru hedeflemek için gerekli veya ayıklama geliştirme15,16sırasında veya fizyolojik17 gerektiren beyin bölgeleri ,18,19 veya erişkin dönemde patolojik durumlar9,18,19,20 . Morfolojik değişiklikler üç tür farklı hücre içi mekanizmalar11,13,20tarihinde itimat ve bir verilen bileşik mutlaka hepsini (dolaylı olarak üzerinde hareket eden Örneğin, NMDA, modüle değil microglia, kara delik üzerinde bir etkisi yoktur ancak yön hareketliliği5,7teşvik değil). Bu nedenle, bir bileşik, bir mutasyon veya bir patoloji etkisi microglia karakterize amaçlayan zaman onların morfolojik plastisite üç bileşenden karakterize etmek önemlidir. Burada, mikroglial işlemleri burada olan bir yerel kaynak bileşik, ATP veya 5-HT doğru yönlü gelişimini incelemek için bir yöntem açıklanmaktadır.
Microglia süreçleri cazibe çalışmaya çeşitli modelleri vardır: birincil kültürler 3D çevre6,18,19, akut beyin dilimleri6,13,15ve vivo 3,13görüntüleme. İçinde vivo yaklaşım en iyisi microglia fizyolojik durumunu korumak için. Ancak, derin bölgeler intravital görüntüleme karmaşık cerrahi işlemler gerektirir ve bu nedenle, bu kez yüzeysel kortikal katmanlara sınırlıdır. Microglia birincil kültür koşulları ile sınırlı sayıda hayvan, çok sayıda test etmek için en kolay tekniği kullanılır. Yine de, aynı hücre morfolojisi vivo olduğu gibi elde edebilmek mümkün değildir ve fizyolojik ilişkileri nöronlar ve astrocytes hücreleri kaybetmek. Bu iki yaklaşım arasında bir uzlaşma akut beyin dilimleri temsil eder. Bu modeli araştırmacılar Transkraniyal mikroskobu çoğunlukla yetişkinlik gerçekleştirilir, ancak Aksi takdirde zor ulaşmak için ve içinde vivo yüksek çözünürlükte görüntü ve dilimleri yenidoğan aşamaları, üzerinden araştırmak için beyin yapıları çalışmaya izin verir. Son olarak, bu gerçek zamanlı olarak yerel uyuşturucu uygulama etkilerini gözlemlemek ve deney hayvanları sınırlı sayıda kullanırken tekrar mümkün kılar. Yine de, hangi sırasında kalmak hücreleri saat21,22 canlı fareler iki hafta ve microglia morfoloji olası değişikliği büyük dilim için özellikle sınırlı bir süre (birkaç saat) akut beyin dilimleri ile ilgili bir sorun olduğunu .
Burada, biz genç ve yetişkin Cx3cr1 dilim akut beyin hazırlamak için bir protokol tarifGFP / + fareler eski microglia Morfoloji ve motilite korunması için birkaç saat ile iki aya kadar. Biz, sonra bu dilimler mikroglial süreçleri ATP veya 5-HT gibi bileşikler doğru cazibe çalışma için nasıl kullanılacağını açıklar.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm deneyleri yerel etik kurul tarafından kabul edildi (Darwin Komitesi, anlaşmalar #1170 ve #10921).
1. hazırlanması cam Mikropipetler bileşiklerin yerel uygulama için
- Pipetler borosilikat üzerinden ince çeperli cam kılcal bir elektrot çektirme ile hazırlayın. Pipetler 4-5 µm çapında onların ekstremite, elde etmek için parametreler ayarlayın. Şekil 2B bir pipet aydınlık alan düşük büyütmede gösterir.
2. çözümler
- Otoklav çevriminin tarafından temizlendi bu tek cam sağlamak, durulama 2 x - takip Ultrasaf Su ile 3 x kullanılacaktır. Paraformaldehyde ile temas halinde olduğu asla kullanım Züccaciye Mağazaları.
-
2 mol· hazırlamak L-1 CaCl2 hisse senedi çözüm 14.7 mg CaCl2·2H2O 50 mL saf su içinde eriterek tarafından (Ultrasaf Su, direnci 18,2 MΩ; distile su veya musluk suyu metal izleri suboptimal dilim kalitesi nedeniyle yol açabilir Pro-oksidatif etkiler).
- Bu hisse senedi çözüm en fazla bir ay için oda sıcaklığında saklayın.
-
Deneme günü, Kolin-aCSF (yapay serebrospinal sıvı) çözüm olan kompozisyon 110 mmol·, 1 litre hazırlamak L-1 Kolin Cl, 25 mmol· L-1 glikoz, 25 mmol· L-1 NaHCO3, 7 mmol· L-1 MgCl2, 11,6 mmol· L-1 askorbik asit, 3.1 mmol· L-1 sodyum pyruvate, 2.5 mmol· L-1 KCl, 1.25 mmol· L-1 NaH2PO4ve 0.5 mmol· L-1 CaCl2, 0,5.
- Bu çözüm hazırlamak için bir 1 L mezun şişesi için aşağıdaki sırayla ekleyin: 0,186 g KCl, NaH2PO40.195 g, asit 2.04 g, NaHCO32.1 g ve 4,5 g glikoz.
- Son hacim yaklaşık yarısı Ultrasaf Su ile doldurun ve tam dağılmasına kadar karıştırın.
- 0,34 g sodyum pyruvate ve kolin Cl 15.36 g ekleyin.
Not: Bu ilk erime 2.3.2. adımda tüm çözüm eklemeden önce hazırlanan solüsyona 5-10 mL ile Kolin Cl için uygundur. - 1 mol· 7 mL ekleyin L-1 MgCl2 ve 2 mol· 250 µL L-1 (adım 2.2 hazır) CaCl2 çözüm için.
- 1 L mezun şişeye Ultrasaf Su ile doldurun.
- Buhar basıncı osmometer ile Osmolarite 300 ve 310 mΩ arasında olup olmadığını kontrol edin. Eğer değilse, glikoz ile ayarlayın.
- PH ("carbogen" köpüren, % 95'i O2/5% CO2karışımı) carbogenation sonra kontrol edin ve, gerekirse 7,3-7,4 10 M NaOH ile ayarlayın.
- Bir cam şişe depolama için çözüm aktarın. Şişe kadar kullanmak (adım 3.1) buzdolabında tutun.
Not: Bu denemenin gün taze bir çözüm sağlamak için önerilir. Ancak, gerekirse, Kolin-aCSF 4 ° C'de iki gün saklanabilir
-
Deneme günü, 1 L olan kompozisyon 124 mmol· ise aCSF çözümünün hazırlamak L-1 NaCl, 26.2 mmol· L-1 NaHCO3, 25 mmol· L-1 glikoz, 2.5 mmol· L-1 KCl, 2 mmol· L-1 CaCl2, 1 mmol· L-1 MgCl2ve 1.25 mmol· L-1 NaH2PO4.
- Bu çözüm hazırlamak, mezun olunan bir şişesi için aşağıdaki sırayla ekleyin: NaH2PO40,150 g, KCl 0,186 g, NaHCO32,2 g, 4,5 g glikoz ve 7.3 gr NaCl. 1 L birimi Ultrasaf Su ile bir çözüm getirmek ve heyecan tabağa karistirin.
- 1 mol· 1 mL ekleyin L-1 MgCl2 ve 2 mol· 1 mL L-1 CaCl2 çözüm ve depolama için bir cam şişe aCSF çözüm aktarmak için.
- OSMOLARİTE 300-310 mΩ· olup olmadığını kontrol edin L-1 ve değilse, glikoz ile ayarlayın.
- Carbogenation sonra pH kontrol (yani, "carbogen" köpüren) ve, gerekirse 7,3-7,4 10 M NaOH ile ayarlayın.
- Bir cam şişe depolama için çözüm aktarın. Şişe kadar kullanmak (adım 3.1) buzdolabında tutun.
Not: Bu denemenin gün taze bir çözüm sağlamak için önerilir. Ancak, 10 x 10 x için en fazla bir hafta 4 ° C'de depolanan son konsantrasyonu, NaCl, NaHCO3, KCl ve NaH2PO4 içeren stok çözüm hazırlamak için bir alternatif olduğunu Son aCSF deneme günü Ultrasaf Su ile 10 x hisse senedi çözüm sulandrarak ve glikoz, CaCl2ve MgCl2ekleme yapmak.
- Uyuşturucu çözümler deneme günü hazırlamak. Onları hangi 500 µmol· burada son konsantrasyonları getirmek için aCSF çözüm kullanın L-1 ATP ve 5 µmol· için L-1 5-HT için.
Not: ATP için hisse senedi bir çözüm hazırlanabilir (örneğin, 50 mM ATP su),-20 ° C'de bölünmemeli formunda depolanan ve aCSF deneme günü son konsantrasyonu ile seyreltilmiş. Buna ek olarak, 5-HT (serotonin-HCl) çözüm gerekir denemeyi, 1 mg·mL-1 su gününde toz hazırlanan 4 ° C 5-HT oksidasyonu önlemek için tutulur ve deneme anda aCSF içinde seyreltilmiş.
3. akut beyin dilimleri hazırlanması
-
Diseksiyon alanının hazırlanması
- Buz gibi Kolin-aCSF buz kardiyak perfüzyon, beyni hızlı soğutma ve dilimleme için kullanılmak üzere, yerleştirilen bir 80 mL ölçek 70 mL hazırlayın. Kolin-aCSF 200 bir çanak, 32 ° C'de tutulan bir ısıtmalı su banyosu yerleştirilen crystallizing ml 150 mL hazırlamak Dilimleri korumak için bir yer crystallizing çanağı bir naylon mesh süzgeç. Bu sadece Dilimleme sonra 10 dakikadır kurtarmak dilimleri bildirmek için kullanılacaktır.
- Diseksiyon (Bölüm 3.2), başlamadan önce en az 30 dakika başlatmak bu iki çözüm (Kolin-aCSF buz üzerinde 70 mL) ve 150 mL Kolin-aCSF 32° c carbogen ile köpüren. Sürekli carbogenation tüm işlem sırasında korumak.
- Dilimleri kullanımları kadar tutmak için kullanılır (Şekil 1 c), arabirim odası cihazını hazırlayın.
- Manyetik karıştırıcı üzerinde yüklü bir mühürlü gıda (10 x 10 cm veya 10 cm çapında, 8 cm yükseklik), 200 mL bir bar ile yemek crystallizing yerleştirin mıknatıs.
- Bu crystallizing yemek aCSF 200 mL ekleyin ve arabirimi 3D baskılı dilim tutucu (arabirimi dilim sahibi aralarında Şekil 1A, Bgergin bir poliamid Fileli iki mükemmel uygun bölümden oluşmaktadır) üstüne yerleştirin.
- Aşırı ses arabirimi dilim tutucu mesh kapsayan çözüm sadece ince bir film tutmak için crystallizing yemek kaldırın. Bu daha sonra iyi bir RIM dilimleri çevreleyen çözüm (ancak bunları kapsayan olmadan) oluşturur.
- ACSF birkaç milimetre yiyecek kutusunun altında koymak ve carbogen ile köpüren başlar (ilk kullanımda tüp-ebilmek girmek belgili tanımlık kutu emin olmak için kapalı yemek kutusu duvarda küçük bir delik açmak).
- Sürekli carbogenation koruyarak mühürlü kutusunu kapatın. Bu hangi dilimleri olacak Kolin-aCSF onların kurtarma sonra transfer ve onlar yansıma önce tutulan oksijen % 95'i O2/5% CO2 zengin bir ortam oluşturur. Bu aygıt bundan sonra "arabirimi odası" adlandırılır (Şekil 1 c).
-
Beyin diseksiyon ve dilimleme
- Fare mayi 50 mg·mL-1 Fentobarbital (0,15 mL/20 g fare vücut ağırlığının) enjeksiyonu ile anestezi, o hareketsiz, kalp ortaya çıkarmak ve buz gibi bir kalp bir perfüzyon 10 mL ile gerçekleştirmek carbogenated, Kolin-aCSF (bkz. adım 3.1.1), peristaltik pompa ile. Solgunluk karaciğer iyi bir perfüzyon bir göstergesi olarak görüyoruz. Perfüzyon az 5 dk sürer.
- Fare başını kesmek ve kafatası ortaya çıkarmak için deriyi kesme. Büyük makas ile büyük deliği ve bir uzun sagittal kesik iki enine keser uygulamak ve iyi forseps kullanarak, kafatası plakaları kaldırmak.
- Hızlı ve yavaş beyin (ve az 1 dk) hulâsa ve serin aşağı için kalan (~ 60 mL) buz gibi Kolin-aCSF (hala altında sürekli carbogenation), içeren 80 mL ölçek 1 dk. için yer.
- Beyin daha önce aCSF ile ıslak bir filtre kağıdı üzerine aktarın.
- Beyin beyin bölgesi ilgi ve tercih edilen açı Dilimleme göre kesip. Örneğin, talamus veya hipokampus koronal dilimleri üzerinde görüntü için bir neşter bıçak beyincik ile ve daha sonra 2 mm den beyin rostral ve kaudal ekstremite hakkında kes şunu.
Not: Çok rostral veya çok kaudal beyin bölümleri kaldırmak önemlidir çünkü ilgi, alan ulaşmadan önce kırpmaya da o kadar az bölge daha hızlı dilimleme. Dilimleme (adım 3.2.7) daha az 20 min Toplam süre önerilir. - Koronal dilimleri, getirin ve (siyanoakrilat yapıştırıcı ile) kaudal yüz beyin üzerine bir 10 titreşimli bir dilimleyici kesme blok yapıştırılmış cm Petri dish, tutkal ve büyük bir odasında konumlandırılır titreşimli dilimleyici rezervuar TMMOB yerleştirin buz dolu. Daha sonra Petri kabına tüm kalan buz gibi Kolin-aCSF ile doldurun.
- % 95'i O2/5% CO2 sabit tutarken 300 µm kalınlığında koronal dilim kesilmiş buz gibi Kolin aCSF, köpüren (hız: 0,08 mm·s-1, bıçak titreşim: 60 Hz, titreşim genlik: 1 mm).
- Toplamak bir geniş ağız (4 mm çapında) tek kullanımlık transfer beyin dilimlerle pipet, tek tek her geçiş toksik bileşenler dilimleri çevre tarafından yayımlanan birikimi önlemek için bıçak, sonra. Aktarım sırasında hava kabarcıklarını önlemek ve kurtarma için yaklaşık 10 dakika için 32 ° C'de Kolin aCSF her dilim yer için dikkat ediniz.
- Transfer pipet ile lens temizleme parçaları üzerine dilimler yerleştirin kağıt Kolin-aCSF bir damla ile tepesinde. Kolin-aCSF fazlalığı Aspire edin ve spatula ile lens temizleme doku carbogenated aCSF oda sıcaklığında içeren arabirimi odası mesh üzerinde koydu dilimleri yerleştirin (3.1.3.5 bakın). Bu ortam için en az 30 dk içinde kurtarmak dilim ver.
Not: Bundan sonra dilimleri hazır ve microglia en fazla 6 saat sonra genç beyin çıkarma için görüntüleme (daha az bir aylık) fareler için ve en fazla 4 s 2 ay önceki yetişkin beyin çıkarma sonra kullanılabilir.
4. iki fotonlu mikroskobu
- Parametreleri ayarlama
- Multiphoton sistemde (melez dedektörleri, lazer, tarayıcı, elektro-optik modülatör, mikroskop) geçin.
- 920, lazer ayarlamak nm, lazer modu-kilitli ve % 5 - % 15 ve % 10 kazanç gücü ayarla onay. Bu 3-5 mW amaç altında gücüne karşılık gelir. Nondescanned dedektörleri başlattık ve uygun emisyon ve uyarma filtreleri yüklü emin olun.
- Set parametrelerini görüntüleme yazılımı için aşağıdaki değerleri: çerçeve boyutu 1024 x 1024 piksel x 295.07 µm; 295.07 yüzölçümü karşılık gelen için zoom için 2. Sinyal çok gürültülü bir hattı ortalama 2 uygulayın. Piksel dynamics için görüntüleme yazılımı 12 bit veya daha fazla küme.
Not: Daha yüksek bir bit değeri ile görüntüleri araştırmacılar görüntülerden daha düşük bir bit değeri ile floresan yoğunluğu daha küçük farklılıkları ayırt etmek için izin: Ben değerleri değiştiğinde bir 8-bit resimdeki gri değeri 12 bit 16 gri değerleri ve 256 gri değişklik karşılık n bir 16-bit görüntü. Bu nedenle, daha yüksek bit görüntüleri kantitatif analiz için daha uygundur, ama onların boyutu bit derinliği, depolama kapasitesi ve bilgisayar ile arttıkça güç sınırlayıcı olabilir. - Bir Z-aralığı aralığı 2 µm ve T aralığını 2 dk ile XYZT tarama modunu seçin.
Not: X, y ve z çözünürlük Nyquist örnekleme teoremi tarafından belirlenir. Bir Z-adım boyu 0,8 çevresinde microglia işlemleri çözümlemek için en uygun olurdu (çapında < 1 µm), ama multiphoton mikroskobu optik çözünürlük sınırlama (920, nm 0.95 NA amacı ile eksenel çözümlemesidir 1 µm). Bunun üzerine fiziksel bariyer, canlı görüntüleme deneyi, duyarlılık veya sinyal-gürültü oranı, çözünürlük, hızı ve toplam gözlem zaman sorun. Dikkate alarak bu parametreler, bir z-adım 2 µm (olduğu gibi çok sayıda çalışmalar3,11,14), bir görüntü boyutu 1024 x 1024 piksel ve yüksek hızlı bir edinimi HyD dedektörleri (It birleştiğinde bir rezonans tarayıcı kullanma yaklaşık 15 alır s 50 z-planları almak için) burada seçildi. Satın alma sıklığı bir XYZT serisi her 2 dk ve toplam süresi 30 dk. Kurulum hızlı ya da yeterince duyarlı değilse, yanal çözünürlük (aşağı 512 x 512) veya z-dilim sayısını azaltmak mümkündür (yanında düşsel sadece içinde en güçlü floresans sergileyen z-derinlik [Yani, en derin z-dilimler nerede floresans zayıf]), veya tarayıcının hızını azaltmak için. Aksiyel çözünürlük de 3 µm z hızlandırmaya artırarak Azaltılabilecek ama bu miktar etkisi gibi aynı z-adım ile karşılaştırılmak üzere tüm deneyler yapılmalıdır.
Not: CX3CR1creER-YFP fareler18, eskiden sadece microglia şekilde genetik silinmesine neden ve hangi microglia yapısal Sarı floresan protein (YFP) hızlı bir fare çizgi dilimleri üzerinde benzer deneyler gerçekleştirmek mümkündür. Ancak, ifade YFP CX3CR1 yeşil flüoresan protein (GFP) göre çok düşüktürGFP / + fareler; Böylece, düşsel mümkün ama zorlu ve edinme parametrelerinin optimizasyonu gerektirir. Bu şekilde ayarlamak için tavsiye edilir. - 970, lazer ayarlamak nm (hangi daha iyi olduğunu YFP uyarma 920 daha adapte nm), % 50 ve % 50 altında amacı, 5-6 mW lazer güç karşılık gelen kazanç güçte.
- Bir satır ortalama 4 (veya daha fazla) sinyal-gürültü oranı artırmak için ayarlayın.
- Dilimin ve cam micropipette ve yerel uygulama bahçedeki konumlandırma
- Peristaltik pompa kayıt odası, kayıt başlamadan önce 30 dk bağlayın. Ultrasaf Su bütün perfüzyon sistemi 50 mL ile temizlendikten sonra kayıt odası perfüzyon bir cam kabı sürekli carbogenation altında yer alan aCSF (50 mL) ile başlayın. Deney boyunca dolaşan aCSF ile 32 ° C arasında bir satır içi microheater veya Peltier bir ısıtıcı ile tutun.
Not: Belirli perfüzyon odası üst ve alt perfüzyon ile her iki tarafta oksijenasyonu dilimin optimize etmek üzere tasarlanmıştır. Perfüzyon odası iki mükemmel uygun bölümden, aralarında (Şekil 2A, B) gergin bir poliamid Fileli oluşur. Bu odayı chambers, nerede dilimi doğrudan bir cam coverslip yatıyor, diğer türleri ile karşılaştırıldığında alt kısmında dilimin nöronal ölüm azaltır, canlılığı artırır ve onun şişme tarafından indüklenen dilim hareketleri azaltır. - Geniş ağız tek kullanımlık transfer pipet ile objektif kağıdı çıkarın, lavabo (hiçbir hava kabarcığı bağlı olduğu bir kanıtı olarak) ve kayıt (perfüzyon) odasına aktar izin aCSF kabı için yansıması için beyin dilim aktarın.
- Dilim dilim hareketi perfüzyon akışı nedeniyle en aza indirmek için bir dilim tutucu (Platin paralel naylon iş parçacıkları tarafından katıldı iki dalı ile yapılan bir saç tokası) getirin.
- Beyin bölgesi ilgi hedeflemek için alan parlak aydınlatma kullanın (pozlama süresi: 50-80 ms) bir düşük büyütme objektif (5 X veya 10 X) kullanarak. Yüksek büyütme (25 x 0,35 x lens ile) su daldırma amaç için geçiş ve pozisyonunu ayarlayýn.
Not: Onlar ışık engellemek ve yerel olarak deforme dilim dilim sahibinin naylon konu yakın görüntü alanları için kaçının. İlgi alanı düz olduğundan emin olun. Gerekirse, dilimi yeniden konumlandırmak için dilim sahibi ve/veya dilim tutucu kaldırın. - Floresan aydınlatma alanında yansıması için floresan mikroglial hücreleri bulmak için kullanın (çekim hızı: 250-500 ms).
Not: Bu adımı araştırmacılar faiz ve onların floresan yoğunluğu bölgedeki hücreler varlığını kontrol ve miktarı için hücresel enkaz denetlemenize olanak sağlar. - Is aCSF 10 µL ile pipet ile ATP, 5-HT veya ilgi onun son konsantrasyonu, uyuşturucu. Noktası ucu aşağıya doğru ve yavaşça salla ipucunda tuzağa herhangi bir hava kabarcıkları kaldırmak için uyuşturucu dolu pipet.
Not: Form baloncuklar için enjekte edilir çözüm eğilimi, borosilikat Pipetler ile bir iç filaman kullanmayı göz önünde bulundurun. ATP kaçağı pipet dışarı mikroglial süreçleri bile önce enjeksiyon çekmek (Bu durumda, bu analiz adımda görülebilir). Her ne kadar bu ATP konsantrasyon ile orta olmalıdır (500 µmol· kullanılan L-1), bir sorun olursa, ATP (veya diğer bileşik) eklemeden önce aCSF 2 mL ile micropipette prefilling göz önünde bulundurun çözüm adımda 4.2.6. - 5 mL konumunda konumlandırılmış bir dalgıç ile 5 mL şırınga için Saydam tüp ile bağlı bir pipet tutucu dolu pipet bağlayın. Pipet sahibi üç eksenli micromanipulator monte edilir.
- Alan parlak aydınlatma altında micromanipulator pipet alanın ortasına yerleştirmek için kullanın. Bir tekrarlanabilir ve en uygun merkezleme için görüntüleyebilir ve görüntüde cetvelleri kullanabilirsiniz.
- Pipet dilimi doğru yavaşça indir, kontrol ve ayarlama amaç pipet ucu kadar aynı zamanda hafifçe dilimin yüzeyine dokunduğundan. En kısa zamanda dilimi dokundu tarafından görülebilmesi pipet kökenli durdurma 80-100 µm dilimi ve yüzey nüfuz pipet ucu sağlar (bkz. Şekil 3B).
- Lazer ayarlamak (bkz: Yukarıdaki parametreler) ve mikroskop multiphoton moduna geçin. Odası herhangi bir ışık kaynağı (örneğin, bir bilgisayar ekranında) ekranlı emin olun. Nondescanned dedektörleri geçin ve kazanç ayarla. Bir arama iş tablo (LUT) ile renk kodlu bir üst sınır görüntüdeki piksellerin doyurarak önlemek için kullanın.
- Yansıması için dilim kalınlığı belirler (yani, alt ve üst z-floresan nerede [genellikle arasındaki Toplam 220 ve 290 µm] tespit pozisyonları).
Not: Dilimi yüzeyde, süreçleri ve muhtemelen microglia, sık sık ile karşılaştırıldığında dilim içine alışılmadık bir morfoloji ile artan bir yoğunluk var. Bu birikimi zamanla (i.e., daha ilk beyin dilimin yansıması son görünür) daha fazla çarpıcı olacak. Bu nedenle, z-uçak ilk ~ 30 µm analiz için kullanılmamalıdır ve hatta satın alma için-ebilmek var olmak kaptan. - 30 dk (veya daha fazla arzu edilirse) toplam süresi için kaydetmeye başlamak ve 5 min temel sonra yerel olarak (görüntüleme kesintiye uğratmadan) test edilecek bileşik uygulayabilirsiniz. Bunu yapmak için yavaş yavaş micropipette için bağlı 5 mL 1 mL konuma--dan belgili tanımlık tenkıye pistonu basın (yaklaşık 5 s). Pistonu basarken direnç hemen hissettim gerekir. Eğer değilse, ucu kırılmış olabilir.
Not: Eğitimli bir deneyci için bu yöntemle enjeksiyonları tekrarlanabilir ama alternatif olarak bir şırınga manuel manipülasyon, pipet teslim biriminin daha iyi bir denetim olanağı sağlamak için otomatik basınç Fırlatma sistemi için bağlı olabilir. Enjeksiyon, enjeksiyon yerinde dilimi fiziksel bozulma oluşturur. Bu bozulma görülür bir sonsal ilk iki veya üç görüntüleri sonra enjeksiyon ama dördüncü görüntüde, (yani, 8 dk sonra enjeksiyon) görünür olmaması gerekir. Eğer bu devam ederse, pipet hazırlık parametrelerini değiştirmeyi düşünün. - Edinme (30 dakika) sonunda, micropipette atmak ve dilimi kaldırın. İsterseniz, daha fazla immunolabeling için dilim düzeltmek. Örneğin, anlık görüntü yöntemi fiksasyon için optimize edilmiş ve kalın boyama23dilimler.
- Yeni bir dilim resim, bu microglia kontrol için 2D film (Bölüm 5.1) yapmak önce başlayan bir normal morfoloji ve hareket ediyor ve bu nedenle dilimler sağlıklı olur.
- Peristaltik pompa kayıt odası, kayıt başlamadan önce 30 dk bağlayın. Ultrasaf Su bütün perfüzyon sistemi 50 mL ile temizlendikten sonra kayıt odası perfüzyon bir cam kabı sürekli carbogenation altında yer alan aCSF (50 mL) ile başlayın. Deney boyunca dolaşan aCSF ile 32 ° C arasında bir satır içi microheater veya Peltier bir ısıtıcı ile tutun.
5. mikroglial cazibe analizini işler
-
2D projeksiyon ve drift Düzeltme
- Açık belgili tanımlık eğe (. LIF) Fiji24ile.
- Gerekiyorsa, bir substack (Resim/yığınları/Araçlar/yapmak Substack) sadece z-uçaklar ile ilgi yapın. Örneğin, Eğer onlar elde etmiş ama analiz için kullanılmak üzere dilim yüzeyine karşılık gelen z-uçak çıkarmak (-den sonra adım 4.2.11 nota bakın) ve hiçbir floresan en derin z uçakla. Son yığını genellikle 90-110 z-dilimler (180-220 µm) içerir.
- Z proje işlevini başlatmak (Resim/yığınları/Z projesi") ve her zaman noktası elde z yığının projeksiyonlar yapmak için Max yoğunluk projeksiyon türü seçin.
- MultiStackReg eklentisi (Eklenti/kayıt/MultiStackReg), denize indirmek seçerek eylem 1: hizalama ve dönüşümü: katı vücut satın alma sırasında oluşan hafif sürüklenir düzeltmek için. Bu 2D film yeni bir dosya (.tiff) olarak kaydedin.
-
Veri işleme
- Bu yeni dosyayı buzlu25ile açın.
- Faiz (ROI) dairesel R1 bölgenin çapı, (özellikle pipet ve enjeksiyon zamanında oluşturulan distorsiyon gölgesi tanımlanır) enjeksiyon izi merkezli 35 µm çizin.
- Kullanma belgili tanımlık tapa ROI yoğunluğu evrim ve zaman içinde R1 ortalama yoğunluğu ölçün.
- Sağlamaları için bir. XLS dosyası.
-
Miktar ve sonuçları temsil
- Mikroglial yanıt zaman içinde ölçmek için her zaman noktası belirleyin
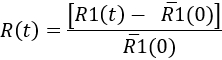
Here,'R1(0) enjeksiyon önce R1(t) değerlerini ortalamasıdır. Sonra sonuçları bir kinetik mikroglial yanıt temsil edilebilir veya belirli bir zamanda (bkz. Şekil 7) üzerine gelin.
- Mikroglial yanıt zaman içinde ölçmek için her zaman noktası belirleyin
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu iletişim kuralı ikna etmek, gözlemlemek ve yerel olarak uygulanan bir bileşik doğru mikroglial süreçlerin odaklı büyüme ölçmek için bir yöntem açıklanır, örneğin, ATP veya 5-HT, akut beyin genç veya yetişkin dilimler (hiç olmazsa ilâ iki aylık) fareler. Beyin dilimleri sağlıklı bir devlet yetişkin hayvanlardan birkaç saat için korumak açısından katkıda bulunan etkenleri arasında iki araçları hücre hayatta kalma iki adım at Protokolü'nün en iyi d...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
İçinde ayrışmış aksine tutarak, veya organotypic dilim kültür, yapısal bütünlük ve sınırlı bir ağ ayarlamaları, akut beyin dilimleri araştırmacılar microglia fizyolojik onların ortamında çalışmaya izin. Ancak, bir büyük sınırlamaları Dilimleme yordam hızla özellikle yetişkin beyindeki nöronların canlılığı olumsuz etkileyebilir yaralanma oluşturur gerçektir. Microglia olduğu gibi özellikle hücre hasarı için reaktif nöronal hücre ölümü microglia fizyolojik durumlarına yak...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Biz hücre ve doku Imaging tesis Institut du Fer à Moulin, nerede tüm resim alma ve analiz gerçekleştirilmiş, teşekkür ederim. Bu eser kısmen Centre National de la tarafından Recherche Scientifique, Institut National de la Santé desteklenen et de la Recherche Médicale, Sorbonne Université Bilimler ve hibe Sorbonne Universités Pierre tarafından et Marie Curie Üniversitesi () Emergence-UPMC programı 2011/2014), Fondation pour la Recherche sur le Cerveau, Fondation de France, Fondation pour la Recherche Médicale "Equipe FRM DEQ2014039529", araştırma (Agence Nationale pour la Recherche Fransız Bakanı ANR-17-CE16-0008 ve Investissements d'Avenir "Biyo-Psy Labex" ANR-11-IDEX-0004-02 program) ve bir ortak araştırma Ulusal Bilim Vakfı/Fransız Ulusal Ajansı araştırmaları için Hesaplamalı nörolojik programında (sayı: 1515686). Her yazarlar araştırma için bağlı olan Grup üyeleri Paris Okulu Neuroscience (ENP) ve biyo-Psy Labex olan. Fe bağlı Sorbonne Université, Collège doktora, F-75005 Paris, Fransa, ile bir doktora öğrencisi ve biyo-Psy Labex tarafından finanse edilmektedir. M. olan Ulusal Bilim Vakfı/Fransız Ulusal Ajansı araştırmaları için Hesaplamalı nörolojik programında ortak araştırma tarafından finanse edilen bir Post-Doktora Bursu (sayı: 1515686). Yazarlar proje başlama katılan Marta Kolodziejczak teşekkür ederim.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| for pipettes preparation | |||
| Clark Borosilicate Thin Wall Capillaries | Harvard Apparatus | 30-0065 | Borosilicate Thin Wall without Filament, 1.5 mm OD, 1.17 mm ID, 75 mm L , Pkg. of 225 |
| DMZ Universal Puller | Zeitz Instrumente | ||
| Name | Company | Catalog Number | Comments |
| for solutions | |||
| Calcium Chloride dihydrate (CaCl2) | Sigma | C5080 | |
| Choline Chloride | Sigma | C7527 | |
| D-(+)-Glucose | Sigma | G8270 | |
| L-Ascorbic acid | Sigma | A5960 | |
| Magnesium Chloride solution 1 M (MgCl2) | Sigma | 63020 | |
| Potassium chloride SigmaUltra >99.0% (KCl) | Sigma | P9333 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium Chloride (NaCl) | Sigma | S5886 | |
| Sodium phosphate monobasic | Sigma | S5011 | |
| Sodium pyruvate | Sigma | P2256 | |
| Ultrapure water | MilliQ | for all the solutions | |
| Name | Company | Catalog Number | Comments |
| for slice preparation | |||
| 2x 200 mL crystalizing dishes | |||
| 80 mL Pyrex beaker | |||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For mice perfusion and 2-photon chamber perfusion (aCSF) |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | ||
| Dolethal | Vetoquinol | Dolethal 50 mg/mL | |
| Filter papers (Whatman) | Sigma | WHA1001042 | Whatman qualitative filter paper, Grade 1 (Pore size: 11µM) |
| Fine Scissors - Sharp | Fine Science Tools | 14060-60 | |
| Food box 10 cm diameter, 8 cm Height | |||
| glue (ethyl cyanoacrylate) | Loctite | super glue 3 power flex | |
| Hippocampal Tool (spatula) | Fine Science Tools | 10099-15 | The largest extremity has to be angled at 90° |
| Ice | |||
| Iris Forceps (curved) | Moria | MC31 | |
| Lens cleaning tissue | THOR LABS | ||
| Nylon mesh strainer | diameter 7 cm | ||
| Razor blades | Electron Microscopy Sciences | 72000 | For the slicer |
| scalpel blade | |||
| Slice interface holder | home-made, the file for 3D printing is provided in Supplemental Material | ||
| Surgical Scissors - Sharp | Fine Science Tools | 14002-14 | |
| Vibrating slicer | Thermo Scientific | 720-2709 | Model: HM 650V (Vibrating blade microtome) |
| Water bath | Set at 32 °C (first recovery step) | ||
| Name | Company | Catalog Number | Comments |
| for slice imaging | |||
| × 25 0.95 NA water-immersion objective | Leica Microsystems (Germany) | HCX Irapo | |
| 2-photon MP5 upright microscope with resonant scanners (8 kHz) and two HyD Hybrid detectors | Leica Microsystems (Germany) | ||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For 2-photon chamber perfusion with aCSF |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | I1501L50R2A001 | |
| Chameleon Ultra2 Ti:sapphire laser | Coherent (Germany) | ||
| disposable transfer pipettes , wide mouth | ThermoFischer scientific | for example : 232-11 | 5.8 mL with fin tip, but we cut it (approx 7 cm) to have a 4 mm diameter mouth |
| emission filter SP680 | Leica Microsystems (Germany) | ||
| fluorescent cube containing a 525/50 emission filter and a 560 dichroic filter (for fluorescence collection) | Leica Microsystems (Germany) | ||
| glass beaker with 50 mL of ACSF to maintain constant perfusion of the slice | |||
| Heating system | Warner Instrument Corporation | Automatic Heater Controller TC-324B | to maintain perfusion solution at 32 °C |
| perfusion chamber | home-made, the file for 3D printing is provided in Supplemental Material | ||
| slice holder ("harp") | home made : hairpin made of platinum with the two branches joined by parallel nylon threads | ||
| Name | Company | Catalog Number | Comments |
| for slice stimulation | |||
| Adenosine 5′-triphosphate disodium salt hydrate (ATP) | Sigma | A-26209 | to be prepared ex-temporaneously : 1 mg/mL (3 mM) stock solution prepared the day of the experiment, kept at 4 °C (a few hours) and diluted just before use |
| Fluorescein (optional) | Sigma | F-6377 | use at 1 µM final |
| Micromanipulator | Luigs and Neumann | SM7 | connected to the micropipette holde |
| Micropipette holder | same as for eletrophysiology | ||
| Serotonin hydrochloride | Sigma | H-9523 | aliquots of 50mM stock solution in H20 kept at -20 °C. 500 µM solution prepared the day of the experiment. |
| Syringe 5 mL (without needle) | Terumo medical products | SS+05S1 | |
| Transparent tubing | Fischer Scientific | 11750105 | Saint Gobain Performance Plastics™ Tygon™ E-3603 Non-DEHP Tubing |
| Name | Company | Catalog Number | Comments |
| for image analysis | |||
| Fiji | https://fiji.sc | Schindelin, J. et al Nat. Methods (2012) doi 10.1038 | |
| Icy | Institut Pasteur | http://icy.bioimageanalysis.org | de Chaumont, F. et al. Nat. Methods (2012) |
| Name | Company | Catalog Number | Comments |
| mice | |||
| CX3CR1-GFP mice | Jung et al, 2000 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. | |
| CX3CR1creER-YFP mice | Parkhurst et al 2013 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. |
Referanslar
- Salter, M. W., Stevens, B. Microglia emerge as central players in brain disease. Nature Publishing Group. 23 (9), 1018-1027 (2017).
- Tay, T. L., Savage, J., Hui, C. W., Bisht, K., Tremblay, M. -È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. , (2016).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Dissing-Olesen, L., et al. Activation of neuronal NMDA receptors triggers transient ATP-mediated microglial process outgrowth. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10511-10527 (2014).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. Journal of Biological Chemistry. 288 (21), 15291-15302 (2013).
- Eyo, U. B., et al. Neuronal hyperactivity recruits microglial processes via neuronal NMDA receptors and microglial P2Y12 receptors after status epilepticus. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10528-10540 (2014).
- Hristovska, I., Pascual, O. Deciphering Resting Microglial Morphology and Process Motility from a Synaptic Prospect. Frontiers in Integrative Neuroscience. 9, 1231(2016).
- Avignone, E., Lepleux, M., Angibaud, J., Nägerl, U. V. Altered morphological dynamics of activated microglia after induction of status epilepticus. Journal of Neuroinflammation. 12, 202(2015).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biology. 14 (5), e1002466(2016).
- Madry, C., et al. Microglial Ramification, Surveillance, and Interleukin-1β Release Are Regulated by the Two-Pore Domain K+Channel THIK-1. Neuron. 97 (2), 299-312 (2018).
- Honda, S., et al. Extracellular ATP or ADP induce chemotaxis of cultured microglia through Gi/o-coupled P2Y receptors. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 21 (6), 1975-1982 (2001).
- Haynes, S. E., et al. The P2Y12 receptor regulates microglial activation by extracellular nucleotides. Nature Neuroscience. 9 (12), 1512-1519 (2006).
- Wu, L. -J., Vadakkan, K. I., Zhuo, M. ATP-induced chemotaxis of microglial processes requires P2Y receptor-activated initiation of outward potassium currents. Glia. 55 (8), 810-821 (2007).
- Kolodziejczak, M., et al. Serotonin Modulates Developmental Microglia via 5-HT 2BReceptors: Potential Implication during Synaptic Refinement of Retinogeniculate Projections. ACS Chemical Neuroscience. 6 (7), 1219-1230 (2015).
- Schafer, D. P., et al. Microglia Sculpt Postnatal Neural Circuits in an Activity and Complement-Dependent Manner. Neuron. 74 (4), 691-705 (2012).
- Pfeiffer, T., Avignone, E., Nägerl, U. V. Induction of hippocampal long-term potentiation increases the morphological dynamics of microglial processes and prolongs their contacts with dendritic spines. Scientific Reports. 6, 32422(2016).
- Parkhurst, C. N., et al. Microglia Promote Learning-Dependent Synapse Formation through Brain-Derived Neurotrophic Factor. Cell. 155 (7), 1596-1609 (2013).
- Wu, Y., Dissing-Olesen, L., Macvicar, B. A., Stevens, B. Microglia: Dynamic Mediators of Synapse Development and Plasticity. Trends in Immunology. 36 (10), 605-613 (2015).
- Ohsawa, K., et al. P2Y12 receptor-mediated integrin-beta1 activation regulates microglial process extension induced by ATP. Glia. 58 (7), 790-801 (2010).
- Kurpius, D., Wilson, N., Fuller, L., Hoffman, A., Dailey, M. E. Early activation, motility, and homing of neonatal microglia to injured neurons does not require protein synthesis. Glia. 54 (1), 58-70 (2006).
- Stence, N., Waite, M., Dailey, M. E. Dynamics of microglial activation: a confocal time-lapse analysis in hippocampal slices. Glia. 33 (3), 256-266 (2001).
- Dissing-Olesen, L., Macvicar, B. A. Fixation and Immunolabeling of Brain Slices: SNAPSHOT Method. Current Protocols in Neuroscience. 71, 1.23.1-12 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- Aitken, P. G., et al. Preparative methods for brain slices: a discussion. Journal of Neuroscience Methods. 59 (1), 139-149 (1995).
- Paris, I., et al. ProMoIJ: A new tool for automatic three-dimensional analysis of microglial process motility. Glia. 66 (4), 828-845 (2018).
- Pagani, F., et al. Defective microglial development in the hippocampus of Cx3cr1 deficient mice. Frontiers in Cellular Neuroscience. 9 (229), 111(2015).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. , Clifton, NJ. 221-242 (2014).
- Mainen, Z. F., et al. Two-photon imaging in living brain slices. Methods. 18 (2), San Diego, CA. 231-239 (1999).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Gyoneva, S., et al. Systemic inflammation regulates microglial responses to tissue damage in vivo. Glia. 62 (8), 1345-1360 (2014).
- Heindl, S., et al. Automated Morphological Analysis of Microglia After Stroke. Frontiers in Cellular Neuroscience. 12, 106(2018).
- Dailey, M. E., Eyo, U., Fuller, L., Hass, J., Kurpius, D. Imaging microglia in brain slices and slice cultures. Cold Spring Harbor Protocols. 12 (12), 1142-1148 (2013).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır