Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Двух Фотон изображений микроглии процессов притяжения к СПС или серотонина в острой мозга фрагментов
* Эти авторы внесли равный вклад
В этой статье
Резюме
Микроглии, резидентов иммунных клеток головного мозга, быстро реагировать с морфологические изменения изменения окружающей их среды. Этот протокол описывает, как использовать двух Фотон микроскопии для изучения притяжения микроглии процессов к серотонина или АТФ в кусочки острый мозга мышей.
Аннотация
Клетки микроглии являются резидентов врожденные иммунные клетки головного мозга, которые постоянно сканировать их окружающей среды с их длинные процессы и, после нарушения гомеостаза, претерпевают быстрое морфологические изменения. Например лазер поражением индуцирует в течение нескольких минут ориентированный рост микроглии процессов, также называется «направленного подвижности», к месту травмы. Подобный эффект можно получить путем предоставления локально АТФ или серотонина (5-гидрокситриптамин [5-HT]). В этой статье мы опишем протокол побудить направленный рост микроглии процессов к местного применения СПС или 5-HT в острой мозга ломтики молодых и взрослых мышей и образ этот аттракцион с течением времени путем multiphoton микроскопии. Предложен простой метод количественной оценки с бесплатным и открытым исходным кодом изображения анализа программного обеспечения. Задача, которая по-прежнему характеризует кусочки острый мозга является ограниченное время, уменьшается с возрастом, в ходе которой клетки остаются в состоянии физиологического. Этот протокол, таким образом, освещаются некоторые технические усовершенствования (средний, воздух жидкий интерфейс камеры, изображение камеры с двойной перфузии), направленные на оптимизацию жизнеспособность Микроглии клеток в течение нескольких часов, особенно в ломтики от взрослых мышей.
Введение
Микроглии клетки мозга-резидентов макрофаги и играть определенную роль в обоих физиологических и патологических условиях1,2. Они имеют весьма разветвленная Словотолкование и постоянно расширяя и втягивания их процессы3,4. Это «сканирования» поведение считается соответствующие и необходимые для обследования их окружение. Морфологическая пластичность микроглии выражается в трех режимах. Во-первых, некоторые соединения быстро модулировать микроглии Морфология: ATP5,6 или NMDA5,7 в средне-купание кусочки острый мозга увеличивает сложность микроглии последствия, в то время как норадреналина уменьшает его6. Эти эффекты являются непосредственно при посредничестве микроглии рецепторов (для СПС и норадреналина) или требуют АТФ-релиз от нейронов (NMDA). Во-вторых скорость роста и втягивание микроглии процессов, называемый подвижности или «надзор», могут быть затронуты внеклеточных факторов8,9,нарушения гомеостаза10или мутации9, 10,11. В-третьих помимо эти изотропной изменения морфологии и моторики, микроглии имеют потенциал для расширения их процессы направленно к пипетки доставки СПС3,5,12, 13 , 14, в культуре, в острой мозга ломтиками или в естественных условиях, или доставки 5-HT в острой мозга ломтики15. Такой ориентированный рост микроглии процессов, также называемый направленного моторики, впервые был описан как ответ на местные лазерной поражения3,4. Таким образом, физиологически, он может быть связанных с ответ на травмы или необходимых для ориентации микроглии процессов к синапсов или регионах мозга, требующие обрезки во время развития15,16, или в физиологических17 ,18,19 или патологических ситуаций9,18,19,20 в зрелом возрасте. Три типа морфологических изменений полагаются на различных внутриклеточных механизмов11,13,20, и один из данного соединения не обязательно модулировать все из них (например, NMDA, который действует косвенно на Микроглии, имеет влияние на морфологию, но не побудить направленного моторики5,7). Поэтому когда целью охарактеризовать воздействие соединение, мутации или патологии на микроглии, важно характеризуют три составляющих их морфологическая пластичность. Здесь мы описываем метод для изучения направления роста микроглии процессов к локальный источник соединения, который находится, здесь, АТФ или 5-HT.
Существует несколько моделей для изучения процессов микроглии притяжения: основных культур в 3D среде6,18,19, острый мозга ломтиками6,13,15и в естественных условиях изображение3,13. В естественных условиях подход является лучшим для сохранения физиологического государств микроглии. Однако прижизненной визуализации глубоких регионов требует сложных хирургических процедур, и, таким образом, это часто ограничивается поверхностных корковых слоев. Использование основной культуры микроглии является простой способ проверить большое количество условий с ограниченным количество животных. Тем не менее это невозможно для получения же морфологии клеток как в естественных условиях, и клетки теряют их физиологические взаимодействия нейронов и астроциты. Острый мозга фрагменты представляют собой компромисс между этими двумя подходами. Эта модель позволяет исследователям для изучения структуры мозга, которые иначе трудно достичь и изображений с высоким разрешением в естественных условиях и расследовать кусочки от новорожденных этапах, тогда как транскраниальной микроскопии осуществляется главным образом в зрелом возрасте. Наконец он делает его возможным для наблюдения в режиме реального времени эффекты применения местных наркотиков и повторить эксперименты, используя ограниченное количество животных. Тем не менее проблема с ломтиками острой мозга является ограниченное время (несколько часов), во время которой клетки остаются живы, особенно для фрагментов от мышей, старше, чем две недели и потенциальные изменения морфологии микроглии течение времени21,22 .
Здесь мы описываем протокол подготовить острый мозга ломтики молодых и взрослых Cx3cr1GFP / + мышей до двух месяцев, с сохранением микроглии морфологии и подвижность на несколько часов. Затем, мы, описывают, как использовать эти фрагменты для изучения притяжения микроглии процессов к соединений, как АТФ или 5-HT.
Access restricted. Please log in or start a trial to view this content.
протокол
Все эксперименты были утверждены местным этическим Комитетом (Darwin Комитет, соглашений #1170 и #10921).
1. Подготовка стекла Micropipettes для местного применения соединений
- Подготовьте пипетки из боросиликатного стекла тонкостенных капилляров с съемника электродный. Отрегулируйте значения параметров для получения пипетки с диаметром 4-5 мкм на их конечности. 2D рисунок показывает один из пипетки в brightfield при низком увеличении.
2. решения
- Убедитесь, что только посуда, которая была очищена от автоклавный цикл, следуют промывки 2 x - 3 x с ультрачистая вода, будет использоваться. Никогда не используйте посуда, которая соприкасалась с параформальдегида.
-
Готовить 2 mol· L-1 CaCl2 Стоковый раствор путем растворения 14,7 мг CaCl2·2H2O в 50 мл воды высокой чистоты (ультрачистая вода, сопротивление 18.2 MΩ; следы металла в дистиллированной или водопроводной воды может привести к неоптимальной ломтик качества из-за про окислительная эффекты).
- Храните этот раствор при комнатной температуре не более одного месяца.
-
В день эксперимента Подготовьте 1 Л раствора холин Фаго (искусственные спинномозговой жидкости), состав которого является 110 mmol· L-1 холина Cl, 25 mmol· L-1 глюкозы, 25 mmol· L-1 NaHCO3, 7 mmol· L-1 MgCl2, 11,6 mmol· L-1 аскорбиновой кислоты, 3.1 mmol· L-1 пируват натрия, 2,5 mmol· L-1 KCl, 1,25 mmol· L-1 NaH2PO4и 0,5 mmol· L-1 CaCl2, 0,5.
- Подготовить этот решение, добавить, в следующем порядке, чтобы флакон 1 Л закончил: 0,186 г KCl, 0,195 g NaH2PO4, 2.04 g кислота аскорбиновая, 2.1 g NaHCO3и 4,5 г глюкозы.
- Заполнить около половины окончательного объема сверхчистый водой и перемешать до полного растворения.
- Добавление 0,34 г пируват натрия и 15.36 g холина Cl.
Примечание: Это удобно для первого растворить холина Cl с 5 до 10 мл раствора, подготовленную на этапе 2.3.2 перед его добавлением в целом решение. - Добавление 7 мл 1 mol· L-1 MgCl2 и 250 мкл 2 mol· L-1 CaCl2 (подготовленных на шаге 2.2) в решение.
- Заполните окончил колбу до 1 L с ультрачистая вода.
- С давлением пара осмометре проверьте, что осмолярности между 300 и 310 mΩ. Если нет, то настроить его с глюкозой.
- Проверить рН после carbogenation (то есть пузырьков с «Карбоген», смесь 95% O2/5% CO2) и настроить его, при необходимости, 7.3-7.4 с 10 M NaOH.
- Передача решения в стеклянной бутылке для хранения. Держите бутылку в холодильник до использования (шаг 3.1).
Примечание: Рекомендуется сделать свежий раствор в день эксперимента. Однако при необходимости, холин фаго может храниться до двух дней при 4 ° C.
-
В день эксперимента Подготовьте 1 Л раствора фаго, состав которого является 124 mmol· L-1 NaCl, 26.2 mmol· L-1 NaHCO3, 25 mmol· L-1 глюкозы, 2,5 mmol· L-1 KCl, 2 mmol· L-1 CaCl2, 1 mmol· L-1 MgCl2и 1,25 mmol· L-1 NaH2PO4.
- Подготовить этот решение, добавить, в следующем порядке, окончил колбу: 0.150 g NaH2PO4, 0,186 г KCl, 2,2 g NaHCO3, 4,5 г глюкозы и 7,3 г NaCl. Принести решение объемом 1 Л с ультрачистая вода и размешивать энергично на табличке, перемешать.
- Добавьте 1 mL 1 mol· L-1 MgCl2 и 1 мл 2 mol· L-1 CaCl2 решения и передачи решения фаго стеклянной бутылки для хранения.
- Проверьте, является ли осмолярности 300-310 mΩ· L-1 и если нет, измените его с глюкозой.
- Проверить рН после carbogenation (то есть пузырьков с «Карбоген») и настроить его, при необходимости, 7.3-7.4 с 10 M NaOH.
- Передача решения в стеклянной бутылке для хранения. Держите бутылку в холодильник до использования (шаг 3.1).
Примечание: Рекомендуется сделать свежий раствор в день эксперимента. Однако в качестве альтернативы можно подготовить 10 x запасов раствор, содержащий NaCl, NaHCO3, KCl и NaH2PO4 10 x конечной концентрации, которые могут храниться в течение не более чем за одну неделю на 4 ° C. Сделайте окончательный фаго в день эксперимента разбавления 10 x Стоковый раствор с ультрачистая вода и добавляя глюкозы, CaCl2и MgCl2.
- Подготовка решений наркотиков в день эксперимента. Используйте фаго решение довести их до окончательного концентрации, которые здесь 500 µmol· L-1 для СПС и 5 µmol· L-1 для 5-HT.
Примечание: Для ATP, может быть подготовлен Стоковый раствор (например, 50 мм АТФ в воде), хранится в aliquoted форме при-20 ° C и разбавляют фаго до конечной концентрации в день эксперимента. В противоположность этому решение 5-HT (серотонин HCl) должны готовится из порошка в день эксперимента, в 1 mg·mL-1 в воде, хранить при 4 ° C, чтобы избежать окисления 5-HT и разводят в фаго во время эксперимента.
3. подготовка мозга, острый ломтиками
-
Подготовка области рассечение
- Подготовьте 70 мл ледяной холин фаго в 80 мл стакан, размещены на льду, использоваться для сердца перфузии, быстрого охлаждения мозга и нарезки. Подготовка 150 мл холин фаго в 200 мл кристаллизующийся блюдо, помещены в ванну с подогретой водой, поддерживается на 32 ° C. Место сетчатый нейлон в кристаллизации блюдо сохранить срезы. Это будет использоваться, чтобы восстановить за 10 мин после нарезки ломтиков.
- По крайней мере 30 минут до начала рассечение (статья 3.2), начало восходящей эти два решения (70 мл холин фаго на льду) и 150 мл холин фаго 32 ° c с Карбоген. Поддерживать постоянное carbogenation в течение всей процедуры.
- Подготовьте устройство камеры интерфейса (рис. 1 c), который будет использоваться для сохранения фрагментов до их использования.
- В запечатанных пищи поле (10 x 10 см или 10 см в диаметре, 8 см в высоту), установленных на магнитной мешалкой, место 200 мл кристаллизующийся блюдо с баром магнит.
- Добавить 200 мл фаго в этом кристаллизации блюдо и место держатель фрагмент 3D-печати интерфейс поверх него (интерфейс ломтик держатель состоит из двух совершенно установку частей, полиамид сеткой, натянутой между ними, Рисунок 1A, B).
- Удалите избыточный объем из кристаллизации блюдо держать только тонкая пленка решения, охватывающего сетки держателя фрагмент интерфейса. Позднее это создаст тонкой оправе раствора вокруг ломтики (но без покрытия их).
- Положите несколько миллиметров фаго в нижней части окна продовольствия и начать кипит Карбоген (при первом использовании, сделать небольшое отверстие в стене ящик запечатанных пищи чтобы убедиться, что трубы можно ввести поле).
- Закройте окно запечатанном при сохранении постоянной carbogenation. Это создаст увлажненные 95% O2/5% CO2 богатую среду в котором ломтики будут переведены после их восстановления в холин фаго и поддерживается до того, как они отражаются. Это устройство далее именуемые как «интерфейс палата» (рис. 1 c).
-
Рассечение мозга и нарезки
- Анестезировать мыши с внутрибрюшинной инъекции-1 Пентобарбитал 50 mg·mL (0,15 мл/20 г веса тела мыши), обездвижить его, разоблачить сердце и выполнять сердечной перфузии с 10 мл ледяной, carbogenated, холин Фаго (см. шаг 3.1.1), с перистальтического насоса. Наблюдать за бледность печени как показатель хорошего перфузии. Перфузии длится менее чем за 5 мин.
- Обезглавить мыши и вырезать кожу подвергать черепа. С большой ножницами применяются два поперечных разрезов от большого отверстия и один длинный Сагиттальный разрез и, с помощью тонкой щипцы, удалите череп пластины.
- Быстро и аккуратно извлечь мозга (в менее 1 мин) и поместите его на 1 мин в стакан 80 мл, содержащий остальные (~ 60 мл) ледяной холин Фаго (все еще под постоянным carbogenation), для того чтобы охладить его.
- Передача мозг на фильтровальной бумаги, ранее промокните фаго.
- Вырежьте мозг мозга регионе интереса и нужного угла нарезки. Например для изображения таламуса или гиппокампа на корональные срезы, вырежьте с лезвием скальпеля мозжечка и, затем, примерно 2 мм от ростральной и хвостового конечностей, головного мозга.
Примечание: Важно удалить части мозга, которые слишком ростральной или слишком хвостового потому что чем меньше региона обрезать до достижения области интересов, тем быстрее нарезки. Рекомендуется общее время для нарезки (шаг 3.2.7) менее чем за 20 мин. - Для корональные срезы позиции и клей (с Цианакрилатный клей) хвостовой лицом мозга на 10 см Петри, наклеенных на режущий блок вибрирующий срез и расположите его в водохранилище палаты вибрирующий срез, который позиционируется в камере более заполненный льдом. Затем заполните чашку Петри с все оставшиеся ледяной холин фаго.
- При сохранении постоянной 95% O2/5% CO2 журчание ледяной холин фаго, вырезать 300 µm толщиной корональные срезы (скорость: 0.08 mm·s-1, лезвие вибрации: 60 Гц, амплитуда колебаний: 1 мм).
- Собирать фрагменты мозга с одноразовой передачи широкий рот (4 мм в диаметре) Пипетка, один за другим после каждого один проход ножа, чтобы избежать накопления токсичных компонентов, выпущенных на периферии ломтики. Позаботьтесь, чтобы избежать воздушных пузырей во время передачи и место каждый ломтик в холин фаго на 32 ° C около 10 минут для восстановления.
- С передачи пипетку, место ломтики на куски чистки объектива бумаги, увенчанный капля холин фаго. Аспирационная избыток холин фаго и шпателем, место ломтики, положил на объектив очистки ткани, сетки интерфейс камеры, содержащие carbogenated фаго при комнатной температуре (см. 3.1.3.5). Пусть срез восстановить в этой среде для по крайней мере 30 минут.
Примечание: После этого ломтики готовы и могут использоваться для микроглии изображений для до 6 ч после извлечения мозг от молодых (меньш чем один месяц старый) мышах и до 4 ч после извлечения мозг от взрослых два месяца назад.
4. два Фотон микроскопии
- Настройка параметров
- Переключитесь на системе multiphoton (гибридный детекторы, лазер, сканер, электро оптического модулятора, Микроскоп).
- Настройка лазера на 920 Нм, проверьте, что лазер locked режиме и установить власть в 5% - 15% и увеличение на 10%. Это соответствует мощности 3-5 МВт в рамках задачи. Убедитесь, что занимаются nondescanned детекторы и установлены соответствующие фильтры выбросов и возбуждения.
- Задать параметры обработки изображений программное обеспечение на следующие значения: размер кадра, 1024 x 1024 пикселей, соответствующий области 295.07 x 295.07 мкм; для масштабирования, 2. Если сигнал очень шумно, примените линии в среднем 2. Для пикселей динамики установите изображений программное обеспечение в 12 бит или более.
Примечание: Изображения с более высоким значением бит позволяют исследователям различать небольшие различия в интенсивности флуоресценции чем изображения с более низким значением бит: изменение одного серого значение в 8-битного изображения будет соответствовать изменения 16 серый ценностей в 12-bit и 256 серый значения i n 16-битные изображения. Таким образом выше битные изображения больше подходят для количественного анализа, но как их размер увеличивается с битовой глубиной, емкость и вычислительной мощности может стать ограничение. - Выберите режим сканирования XYZT с диапазоном Z-интервал в 2 мкм и T-интервал 2 мин.
Примечание: X, y и z резолюции определяются теоремой Найквиста выборки. Z-шаг размер около 0,8 будет оптимальным для решения микроглии процессы (с диаметром < 1 мкм), но ограничение оптическое разрешение multiphoton микроскопии (на 920 Нм с 0,95 цель NA, осевой резолюция является около 1 мкм). На вершине, что физический барьер, в эксперимент жить изображений, чувствительности или сигнал шум коэффициент, резолюции, скорость и время вопрос общего наблюдения. Принимая во внимание все эти параметры, z шаг 2 мкм (как и многочисленные исследования3,,1114), размер изображения 1024 x 1024 пикселей и высокоскоростного сбора данных с использованием резонансный сканер сочетании HyD детекторы (он занимает около 15 s, чтобы приобрести 50 z планов) были отобраны здесь. Частота поглощения является одной серии XYZT каждые 2 мин и общая продолжительность 30 мин. Если настройки не быстрый или достаточно чувствительным, это можно уменьшить латеральное разрешение (до 512 x 512) или количество z срезов (у Вообразимый исключительно в z глубина, которая exhibits сильные флуоресценции [т.е., не глубокие z ломтики где флуоресценции слабый]), или уменьшить скорость сканера. Осевой резолюции также может быть уменьшена путем увеличения z шаг до 3 мкм, но как это может повлиять на количественной оценке, все эксперименты для сравнения должно выполняться с такой же z шаг.
Примечание: Это позволяет выполнять аналогичные эксперименты на ломтики CX3CR1creER-рекламы ЯФП мышей18, мыши линия используется для вызвать генетические удаления в микроглии только и в котором микроглии конститутивно Экспресс желтый флуоресцентный белок (рекламы ЯФП). Однако, уровень экспрессии рекламы ЯФП является очень низким по сравнению с зеленого флуоресцентного белка (ГФП) в CX3CR1GFP / + мышей; Таким образом изображений можно, но сложной и требует оптимизации параметров их получения. Рекомендуется скорректировать их следующим образом. - Настройка лазера на 970 нм (который лучше приспособлен для рекламы ЯФП возбуждения чем 920 Нм), мощность на 50% и увеличение на 50%, что соответствует мощности лазера в рамках цели 5-6 МВт.
- Установка линии в среднем 4 (или более), чтобы улучшить соотношение сигнал шум.
- Размещение фрагмента и микропипеткой стекла, и местного применения комплекса
- Подключите Перистальтический насос к записи камеры, 30 мин до начала записи. После очистки вся перфузии системы с 50 мл ультрачистая вода, начните с Фаго (50 мл), содержащихся в стеклянный стакан под постоянным carbogenation перфузии запись камеры. На протяжении всего эксперимента сохранить циркулирующей фаго до 32 ° C с inline microheater или Пельтье нагреватель.
Примечание: Конкретные перфузии камеры с верхней и нижней перфузии предназначена для оптимизации оксигенации на обе стороны фрагмента. Перфузии Камера состоит из двух совершенно установку частей, полиамид сеткой, натянутой между ними (рис. 2а, Б). По сравнению с другими типами камер, где срез непосредственно лежит на coverslip стекла, эта камера снижает нейрональных смерти в нижней части диаграммы, повышает жизнеспособность и уменьшает срез движений, вызванных его отек. - С пипеткой широкий рот одноразовой передачи передачи срез мозга к записи образа к фаго стакан удалить объектив бумагу, пусть он раковина (как доказательство того, что нет пузырьков воздуха прилагается) и передать его в палату записи (перфузии).
- Положение фрагмента держатель (шпильки, сделанные из платины с двумя ответвлениями, соединены параллельно Нейлоновая нить) на срез для сведения к минимуму движения фрагмента из-за потока перфузии.
- Используйте светлые области освещения для мозга регионе интереса (время экспозиции: 50-80 мс) с помощью малое увеличение цель (5 X-10 X). Перейти к более высокой цели погружения воды масштаб (25 x с объективом 0,35 x) и отрегулируйте положение.
Примечание: Избегайте изображения поля недалеко от держателя срез Нейлоновая нить как они могут блокировать свет и локально деформировать срез. Убедитесь, что область интересов является плоской. При необходимости удалите фрагмент держатель для того, чтобы переместить фрагмент и/или держателя срез. - Использовать для поиска флуоресцентные Микроглии клеток для отображаемого в поле флуоресцентной подсветки (время экспозиции: 250-500 мс).
Примечание: Этот шаг позволяет исследователям проверять наличие клеток в регионе интересов и их интенсивности флуоресценции и контролировать на сумму сотовой мусора. - Засыпки пипетку с 10 мкл фаго с СПС, 5-HT, или препарат интерес в его заключительном концентрации. Точка, наконечник вниз и осторожно встряхнуть наркотиков заполнены Пипетка Удалить все пузырьки воздуха, захваченных в кончик.
Примечание: Если раствор для инъекций, как правило, в виде пузырьков, рассмотрите возможность использования боросиликатное пипетки с внутренней накаливания. Утечки АТФ из пипетки может привлечь микроглии процессы даже до инъекции (если это произойдет, она будет видна на этапе анализа). Хотя это должно быть умеренной концентрации ATP использовано (500 µmol· L-1), если это является проблемой, считают prefilling микропипеткой с 2 мл фаго перед добавлением АТФ (или другие соединения) решения на этапе 4.2.6. - Смонтируйте заполненную пипетку в пипетку держатель, связанные с прозрачной трубки в шприц 5 мл, с поршень находится в положении 5 мл. Держатель пипетки, сам установлен на микроманипулятор 3 оси.
- Под ярко поле освещения используйте микроманипулятор для размещения пипеткой в центре поля. Для воспроизводимых и оптимальное центрирование, отображать и использовать правителей на изображении.
- Нижний пипеткой плавно спускающемся срез, управление и регулировка цели в то же время, до кончика пипетки слегка касается поверхности среза. Остановка происхождения пипеткой, сразу видно, что срез были затронуты позволяет наконечник пипетки проникнуть 80-100 мкм поверхности среза (см. рисунок 3B).
- Настроить лазер (см. параметры выше) и переключитесь multiphoton режим Микроскоп. Убедитесь, что камера изолированы от любого источника света (например, экран компьютера). Включите nondescanned детекторы и установить коэффициент усиления. Используйте таблицу подстановки (LUT) с цветом верхний предел, чтобы избежать насыщения пикселов в изображении.
- Определить толщину среза для записи образа (т.е., верхняя и Нижняя z позиции где флуоресценции обнаружению [обычно между 220 и 290 мкм в общей сложности]).
Примечание: На поверхности среза есть увеличение плотности процессов и возможно микроглии, часто с необычным морфологии, по сравнению с внутри фрагмента. Это накопление будет более впечатляющим с течением времени (т.е.., более заметной в последние чем в первый срез мозга к записи образа). Таким образом z самолеты в первый ~ 30 мкм не должны использоваться для анализа и даже может быть пропущен для приобретения. - Начать запись для общей продолжительностью 30 минут (или больше по желанию) и после 5 мин базовых, локально применить соединение для проверки (не прерывая воображения). Для этого, медленно нажать поршень шприца, подключенных к микропипеткой, от 5 мл в 1 мл положение (около 5 s). Сопротивление при нажатии на поршень должен ощущаться сразу. Если нет, то Совет может быть нарушена.
Примечание: Для подготовленных экспериментатора инъекции с помощью этого метода являются воспроизводимость, но альтернативно для ручного манипулирования шприц, дозатор может быть связано с автоматизированной давление выброса системы позволяют лучше контролировать объем доставки. Инъекции создает физические искажения фрагмента в месте инъекции. Это искажение виден posteriori в первые два или три фото после инъекции, но не должно быть видно на четвертом изображении, (то есть 8 мин после инъекции). Если это повторится, рассмотрите возможность изменения параметров для подготовки пипеткой. - В конце приобретения (30 мин) отменить микропипеткой и удалить фрагмент. При необходимости, исправьте фрагмент для дальнейшего immunolabeling. Например метод моментального СНИМКА оптимизирована для фиксации и окрашивание толстых ломтиков23.
- До начала нового фрагмента изображения, сделать 2D фильм (раздел 5.1) для того чтобы проверить что Микроглии есть нормальной морфологии и движемся и, таким образом, что фрагменты являются здоровыми.
- Подключите Перистальтический насос к записи камеры, 30 мин до начала записи. После очистки вся перфузии системы с 50 мл ультрачистая вода, начните с Фаго (50 мл), содержащихся в стеклянный стакан под постоянным carbogenation перфузии запись камеры. На протяжении всего эксперимента сохранить циркулирующей фаго до 32 ° C с inline microheater или Пельтье нагреватель.
5. анализ привлекательности микроглии процессов
-
2D-проекции и коррекции дрейф
- Откройте файл (. LIF) с Фиджи24.
- При необходимости, сделайте substack (Image/стеки/инструменты/сделать Substack) с только z самолеты интерес. Например, исключить z самолеты, соответствующие на поверхности среза, если они были приобретены, но они не должны использоваться для анализа (см. Примечание после шага 4.2.11) и глубокие z самолеты с не флуоресценции. Окончательный стека обычно содержит 90-110 z ломтики (180-220 мкм).
- Запустите функцию Z проекта (Image/стеки/Z проекта») и выберите тип проекции Макс интенсивности сделать прогнозы z стека, приобретенных в каждый момент времени.
- Запуск MultiStackReg плагин (Плагин/регистрация/MultiStackReg), выбор действий 1: выравнивание и преобразования: твердого тела исправить небольшие сугробы, которые могут произойти во время приобретения. Сохраните этот 2D фильм как новый файл (.tiff).
-
Обработка данных
- Откройте новый файл с ледяной25.
- Нарисуйте круговой R1 региона интерес (ROI) 35 мкм в диаметре, сосредоточены на месте инъекции (выявленные особенности тени пипетки и искажения, созданные во время инъекции).
- Использовать плагин ROI интенсивности эволюции и измерения средней интенсивности с течением времени в R1.
- Сохранить результаты. XLS файла.
-
Количественная оценка и представление результатов
- Для количественного определения микроглии ответ с течением времени, определите, в каждый момент времени
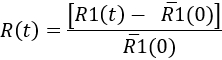
Here,'R1(0)-это среднее значение R1(t) перед инъекцией. Затем результаты могут быть представлены как кинетическая микроглии ответа, или в определенное время точки (см. Рисунок 7).
- Для количественного определения микроглии ответ с течением времени, определите, в каждый момент времени
Access restricted. Please log in or start a trial to view this content.
Результаты
Этот протокол описывает метод для того чтобы побудить, наблюдать и количественного определения ориентированных на рост микроглии процессов к локально прикладной соединения, например, АТФ или 5-HT, в острой мозга кусочки от молодых или взрослых (по крайней мере до двух м...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Поддерживая, в отличие от в отрыве или organotypic срез культуры, структурной целостности с ограниченной сети корректировок, острый мозга фрагменты позволяют исследователям изучить микроглии в их физиологической среде. Однако один из основных недостатков является тот факт, что нарезки про?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим клеток и тканей Imaging Institut du Fer à Мулен, где были выполнены все изображения сбора и анализа данных. Эта работа частично поддержали центр Национальной де ла Recherche Scientifique, Институт национального de la Santé et de la Recherche сообщала, наук университета Сорбонна и грантов университеты-Пьер Sorbonne et Мари Кюри университета ( Emergence-UPMC программа 2011-2014), Фонд pour la исследований sur le мозг, Фонд-де-Франс, Фонд pour la Recherche сообщала «Реактор FRM DEQ2014039529», Министерство научных исследований (Agence Nationale pour la исследований Франции Программа «Био-ПСИ Labex» АНР-11-IDEX-0004-02 ANR-17-CE16-0008 и будущее Investissements) и совместных исследований в программе вычислительных нейронаук, национальной науки фонд/французский Национальное агентство для исследований (число: 1515686). Все авторы связаны в исследовательских групп, которые являются членами Парижской школы нейронаук (ENP) и био-ПСИ Labex. Отвязка является аспирантом, аффилированным с Sorbonne Université Collège докторские, F-75005 Париж, Франция и финансируется био-ПСИ-Labex. В.м. является членом после защиты докторской диссертации, финансируемых совместных исследований в программе вычислительных нейронаук, национальной науки фонд/французский Национальное агентство для исследований (число: 1515686). Авторы благодарят Marta Kolodziejczak, которые участвовали в начало проекта.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| for pipettes preparation | |||
| Clark Borosilicate Thin Wall Capillaries | Harvard Apparatus | 30-0065 | Borosilicate Thin Wall without Filament, 1.5 mm OD, 1.17 mm ID, 75 mm L , Pkg. of 225 |
| DMZ Universal Puller | Zeitz Instrumente | ||
| Name | Company | Catalog Number | Comments |
| for solutions | |||
| Calcium Chloride dihydrate (CaCl2) | Sigma | C5080 | |
| Choline Chloride | Sigma | C7527 | |
| D-(+)-Glucose | Sigma | G8270 | |
| L-Ascorbic acid | Sigma | A5960 | |
| Magnesium Chloride solution 1 M (MgCl2) | Sigma | 63020 | |
| Potassium chloride SigmaUltra >99.0% (KCl) | Sigma | P9333 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium Chloride (NaCl) | Sigma | S5886 | |
| Sodium phosphate monobasic | Sigma | S5011 | |
| Sodium pyruvate | Sigma | P2256 | |
| Ultrapure water | MilliQ | for all the solutions | |
| Name | Company | Catalog Number | Comments |
| for slice preparation | |||
| 2x 200 mL crystalizing dishes | |||
| 80 mL Pyrex beaker | |||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For mice perfusion and 2-photon chamber perfusion (aCSF) |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | ||
| Dolethal | Vetoquinol | Dolethal 50 mg/mL | |
| Filter papers (Whatman) | Sigma | WHA1001042 | Whatman qualitative filter paper, Grade 1 (Pore size: 11µM) |
| Fine Scissors - Sharp | Fine Science Tools | 14060-60 | |
| Food box 10 cm diameter, 8 cm Height | |||
| glue (ethyl cyanoacrylate) | Loctite | super glue 3 power flex | |
| Hippocampal Tool (spatula) | Fine Science Tools | 10099-15 | The largest extremity has to be angled at 90° |
| Ice | |||
| Iris Forceps (curved) | Moria | MC31 | |
| Lens cleaning tissue | THOR LABS | ||
| Nylon mesh strainer | diameter 7 cm | ||
| Razor blades | Electron Microscopy Sciences | 72000 | For the slicer |
| scalpel blade | |||
| Slice interface holder | home-made, the file for 3D printing is provided in Supplemental Material | ||
| Surgical Scissors - Sharp | Fine Science Tools | 14002-14 | |
| Vibrating slicer | Thermo Scientific | 720-2709 | Model: HM 650V (Vibrating blade microtome) |
| Water bath | Set at 32 °C (first recovery step) | ||
| Name | Company | Catalog Number | Comments |
| for slice imaging | |||
| × 25 0.95 NA water-immersion objective | Leica Microsystems (Germany) | HCX Irapo | |
| 2-photon MP5 upright microscope with resonant scanners (8 kHz) and two HyD Hybrid detectors | Leica Microsystems (Germany) | ||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For 2-photon chamber perfusion with aCSF |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | I1501L50R2A001 | |
| Chameleon Ultra2 Ti:sapphire laser | Coherent (Germany) | ||
| disposable transfer pipettes , wide mouth | ThermoFischer scientific | for example : 232-11 | 5.8 mL with fin tip, but we cut it (approx 7 cm) to have a 4 mm diameter mouth |
| emission filter SP680 | Leica Microsystems (Germany) | ||
| fluorescent cube containing a 525/50 emission filter and a 560 dichroic filter (for fluorescence collection) | Leica Microsystems (Germany) | ||
| glass beaker with 50 mL of ACSF to maintain constant perfusion of the slice | |||
| Heating system | Warner Instrument Corporation | Automatic Heater Controller TC-324B | to maintain perfusion solution at 32 °C |
| perfusion chamber | home-made, the file for 3D printing is provided in Supplemental Material | ||
| slice holder ("harp") | home made : hairpin made of platinum with the two branches joined by parallel nylon threads | ||
| Name | Company | Catalog Number | Comments |
| for slice stimulation | |||
| Adenosine 5′-triphosphate disodium salt hydrate (ATP) | Sigma | A-26209 | to be prepared ex-temporaneously : 1 mg/mL (3 mM) stock solution prepared the day of the experiment, kept at 4 °C (a few hours) and diluted just before use |
| Fluorescein (optional) | Sigma | F-6377 | use at 1 µM final |
| Micromanipulator | Luigs and Neumann | SM7 | connected to the micropipette holde |
| Micropipette holder | same as for eletrophysiology | ||
| Serotonin hydrochloride | Sigma | H-9523 | aliquots of 50mM stock solution in H20 kept at -20 °C. 500 µM solution prepared the day of the experiment. |
| Syringe 5 mL (without needle) | Terumo medical products | SS+05S1 | |
| Transparent tubing | Fischer Scientific | 11750105 | Saint Gobain Performance Plastics™ Tygon™ E-3603 Non-DEHP Tubing |
| Name | Company | Catalog Number | Comments |
| for image analysis | |||
| Fiji | https://fiji.sc | Schindelin, J. et al Nat. Methods (2012) doi 10.1038 | |
| Icy | Institut Pasteur | http://icy.bioimageanalysis.org | de Chaumont, F. et al. Nat. Methods (2012) |
| Name | Company | Catalog Number | Comments |
| mice | |||
| CX3CR1-GFP mice | Jung et al, 2000 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. | |
| CX3CR1creER-YFP mice | Parkhurst et al 2013 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. |
Ссылки
- Salter, M. W., Stevens, B. Microglia emerge as central players in brain disease. Nature Publishing Group. 23 (9), 1018-1027 (2017).
- Tay, T. L., Savage, J., Hui, C. W., Bisht, K., Tremblay, M. -È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. , (2016).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Dissing-Olesen, L., et al. Activation of neuronal NMDA receptors triggers transient ATP-mediated microglial process outgrowth. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10511-10527 (2014).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. Journal of Biological Chemistry. 288 (21), 15291-15302 (2013).
- Eyo, U. B., et al. Neuronal hyperactivity recruits microglial processes via neuronal NMDA receptors and microglial P2Y12 receptors after status epilepticus. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10528-10540 (2014).
- Hristovska, I., Pascual, O. Deciphering Resting Microglial Morphology and Process Motility from a Synaptic Prospect. Frontiers in Integrative Neuroscience. 9, 1231(2016).
- Avignone, E., Lepleux, M., Angibaud, J., Nägerl, U. V. Altered morphological dynamics of activated microglia after induction of status epilepticus. Journal of Neuroinflammation. 12, 202(2015).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biology. 14 (5), e1002466(2016).
- Madry, C., et al. Microglial Ramification, Surveillance, and Interleukin-1β Release Are Regulated by the Two-Pore Domain K+Channel THIK-1. Neuron. 97 (2), 299-312 (2018).
- Honda, S., et al. Extracellular ATP or ADP induce chemotaxis of cultured microglia through Gi/o-coupled P2Y receptors. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 21 (6), 1975-1982 (2001).
- Haynes, S. E., et al. The P2Y12 receptor regulates microglial activation by extracellular nucleotides. Nature Neuroscience. 9 (12), 1512-1519 (2006).
- Wu, L. -J., Vadakkan, K. I., Zhuo, M. ATP-induced chemotaxis of microglial processes requires P2Y receptor-activated initiation of outward potassium currents. Glia. 55 (8), 810-821 (2007).
- Kolodziejczak, M., et al. Serotonin Modulates Developmental Microglia via 5-HT 2BReceptors: Potential Implication during Synaptic Refinement of Retinogeniculate Projections. ACS Chemical Neuroscience. 6 (7), 1219-1230 (2015).
- Schafer, D. P., et al. Microglia Sculpt Postnatal Neural Circuits in an Activity and Complement-Dependent Manner. Neuron. 74 (4), 691-705 (2012).
- Pfeiffer, T., Avignone, E., Nägerl, U. V. Induction of hippocampal long-term potentiation increases the morphological dynamics of microglial processes and prolongs their contacts with dendritic spines. Scientific Reports. 6, 32422(2016).
- Parkhurst, C. N., et al. Microglia Promote Learning-Dependent Synapse Formation through Brain-Derived Neurotrophic Factor. Cell. 155 (7), 1596-1609 (2013).
- Wu, Y., Dissing-Olesen, L., Macvicar, B. A., Stevens, B. Microglia: Dynamic Mediators of Synapse Development and Plasticity. Trends in Immunology. 36 (10), 605-613 (2015).
- Ohsawa, K., et al. P2Y12 receptor-mediated integrin-beta1 activation regulates microglial process extension induced by ATP. Glia. 58 (7), 790-801 (2010).
- Kurpius, D., Wilson, N., Fuller, L., Hoffman, A., Dailey, M. E. Early activation, motility, and homing of neonatal microglia to injured neurons does not require protein synthesis. Glia. 54 (1), 58-70 (2006).
- Stence, N., Waite, M., Dailey, M. E. Dynamics of microglial activation: a confocal time-lapse analysis in hippocampal slices. Glia. 33 (3), 256-266 (2001).
- Dissing-Olesen, L., Macvicar, B. A. Fixation and Immunolabeling of Brain Slices: SNAPSHOT Method. Current Protocols in Neuroscience. 71, 1.23.1-12 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- Aitken, P. G., et al. Preparative methods for brain slices: a discussion. Journal of Neuroscience Methods. 59 (1), 139-149 (1995).
- Paris, I., et al. ProMoIJ: A new tool for automatic three-dimensional analysis of microglial process motility. Glia. 66 (4), 828-845 (2018).
- Pagani, F., et al. Defective microglial development in the hippocampus of Cx3cr1 deficient mice. Frontiers in Cellular Neuroscience. 9 (229), 111(2015).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. , Clifton, NJ. 221-242 (2014).
- Mainen, Z. F., et al. Two-photon imaging in living brain slices. Methods. 18 (2), San Diego, CA. 231-239 (1999).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Gyoneva, S., et al. Systemic inflammation regulates microglial responses to tissue damage in vivo. Glia. 62 (8), 1345-1360 (2014).
- Heindl, S., et al. Automated Morphological Analysis of Microglia After Stroke. Frontiers in Cellular Neuroscience. 12, 106(2018).
- Dailey, M. E., Eyo, U., Fuller, L., Hass, J., Kurpius, D. Imaging microglia in brain slices and slice cultures. Cold Spring Harbor Protocols. 12 (12), 1142-1148 (2013).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены