このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ATP または急性脳スライスにおけるセロトニンに対するミクログリアのプロセスの魅力の二光子励起イメージング
* これらの著者は同等に貢献しました
要約
住民の免疫細胞、脳の小膠細胞, は、形態学的変化と彼らの環境の変更に迅速に対応します。このプロトコルでは、2 光子励起顕微鏡を使用して、マウスの急性脳スライスにおけるセロトニンや ATP に向かってミクログリア プロセスの魅力を研究する方法について説明します。
要約
ミクログリア細胞は常駐自然免疫系細胞、脳の常に長いプロセスの環境をスキャンし、恒常性の中断時に急激な形態学的変化を受けます。たとえば、レーザー病変は、数分で、傷害の現場に向かって「方向運動」とも呼ばれるミクログリア プロセスの配向成長を誘発します。ATP またはセロトニン (5-ヒドロキシトリプタミン [5-HT]) ローカルで提供することにより同様の効果が得られます。この資料では、ATP や若くて大人のマウスの急性脳スライスにおける 5 HT のローカル アプリケーションに向けたミクログリア プロセスの一方向成長を誘引し、多光子顕微鏡による時間の経過とともにこの魅力をイメージするプロトコルについて述べる.無料とオープン ソースの画像解析ソフトウェアと定量化の手法を提案する.まだ急性期脳スライスを特徴付けるチャレンジは限られた時間の中にセルの生理学的状態のまま、年齢とともに減少します。このプロトコル、したがって、大人のマウスからスライスを中心に、数時間にわたってミクログリア細胞の生存率を最適化することを目的としたいくつかの技術的な改善 (媒体、空気液体インターフェイス室、ダブル灌室をイメージング) ハイライト。
概要
ミクログリア細胞は脳のマクロファージ、両方生理学的および病理学的条件1,2の役割を果たします。彼ら高分岐形態し常に拡張され、そのプロセス3,4を取り消します。この「スキャニング」現象は関連とその周辺調査必要と思われます。ミクログリアの形態的可塑性は、3 つのモードで表現されます。最初に、いくつかの化合物は急速に調節するミクログリアの形態: ATP5,6または NMDA5,7急性脳スライスを入浴中のまたミクログリア影響の複雑さが増大一方、ノルエピネフリンはそれに6を減少させます。これらの効果は、直接 (ATP のノルエピネフリン) ミクログリアの受容器によって仲介されるか、(NMDA) の神経細胞からの ATP 放出を必要とします。第二に、運動や「監視」と呼ばれる、ミクログリアのプロセスの成長と後退速度は細胞外要因8恒常性混乱9,10、または突然変異9、によって影響を受けます 10,11。第三に、形態と運動のこれらの等方性の変更に加えてミクログリアは ATP3,5,12,を提供するピペットの方向に向かってそのプロセスを拡張する能力を持っています。13,14、文化、急性脳スライスまたは急性脳内 5-HT の生体内で、または提供する15 をスライスします。このような配向成長方向運動とも呼ばれるミクログリア プロセスの最初ローカル レーザー病変3,4への応答として記述されていた。したがって、生理学的、それが傷害に応答に関連またはシナプスに向かってミクログリア プロセスをターゲットに必要なまたは開発15,16中、または生理学的な17 に剪定を必要とする脳の領域 ,18,19 , 病理学的状況9,18,19,20成人。形態学的変化の 3 つのタイプはさまざまな細胞内メカニズム11,13、20に依存し、1 つの特定の化合物は必ずしもすべてのそれら (例えば、NMDA、ない直接に作用を調節しません。ミクログリア、形態に及ぼす影響が方向運動5,7を誘発しない)。したがって、ミクログリアに及ぼす化合物、突然変異または病理学の特徴を目指している、その形態的可塑性の 3 つのコンポーネントの特性評価に重要です。ここでは、ミクログリアのプロセスは、ここで、化合物のローカル源、ATP または 5 HT への一方向の成長を調査する手法について述べる.
ミクログリアのプロセスの魅力を研究するいくつかのモデルがあります: 3 D 環境6,18,19, 急性期脳スライス6,13,15、及び生体内で初代培養3,13をイメージングします。生体内でのアプローチがミクログリアの生理状態を維持するために最適です。ただし、深い領域の生体イメージングは、複雑な手術を必要とし、したがって、皮質表層に限られます。ミクログリア培養の使用は、多数の動物の限られた数の条件をテストする最も簡単な手法です。それにもかかわらず、それは生体のように同じ細胞の形態を得ることが可能ではなく、細胞はニューロンとアストロ サイトの生理学的な相互作用を失います。急性脳スライスは、これらの 2 つのアプローチ間の妥協を表します。このモデルに到達するために生体内で、高解像度の画像と新生児の段階からスライスを調査するが難しいがそれ以外の場合経頭蓋顕微鏡はほとんど成人で行われます、脳の構造の研究に研究できます。最後に、薬剤の局所適用の効果をリアルタイムで観察して動物の限られた数を使用しながら実験を繰り返す可能となります。それにもかかわらず、急性脳スライスの問題は限られた時間 (数時間) 中にセルのまま生きている、特に 2 週間やミクログリアの形態の潜在的な変更よりも古いマウスからスライス時間21,22 以上.
ここでは、若者や大人 Cx3cr1 の急性脳スライスを準備するためのプロトコルについて述べるGFP/+マウス 2 ヶ月古い、ミクログリアの形態や運動のいくつかの時間のための保全と。我々 は、その後、これらのスライスを使用して ATP または 5 HT のような化合物に向けたミクログリア プロセスの魅力を研究する方法をについて説明します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
すべての実験は、ローカル倫理委員会で承認された (ダーウィン委員会、契約 #1170 と #10921)。
1. 化合物のローカル アプリケーション用ガラス マイクロ ピペットの準備
- 薄肉・ ガラス管電極引き手とホウケイ酸塩からピペットを準備します。四肢の運動で 4-5 μ m 径のピペットを取得するパラメーターを調整します。図 2 Dは、低倍率で明視野で 1 つピペットを示しています。
2. ソリューション
- オートクレーブ サイクルによって掃除されているその唯一の硝子を確保するため、すすぎ 2 x - 続いて超純水、3 x が使用されます。パラホルムアルデヒドと接触されているガラスを決して使用。
-
2 mol· を準備します。L-1 CaCl2·2H の2O 高純度の水 50 mL で 14.7 mg を溶解して CaCl2原液 (超純水、抵抗 18.2 MΩ; 蒸留水や水道水の金属のトレース品質最適なスライスにつながることができますプロ酸化作用)。
- この原液常温 1 ヶ月の最大値を格納します。
-
実験の日、その組成は 110 mmol· コリン アプライド (人工髄液) ソリューションの 1 L を準備します。L-1コリン Cl、25 mmol·L-1グルコース、25 mmol·L-1 NaHCO3、7 mmol·L-1 MgCl2、11.6 mmol·L-1アスコルビン酸、3.1 mmol·ピルビン酸ナトリウム-1 L、2.5 mmol·L-1 KCl、1.25 mmol·L-1 NaH2PO4と 0.5 mmol·L-1 CaCl20.5。
- 準備するこのソリューションに追加、卒業 1 L フラスコに、次の順序で: グルコースの 4.5 g、NaHCO3、2.1 g 酸アスコルビンの 2.04 g NaH2PO4の 0.195 g KCl の 0.186 g。
- 純水で最終巻の約半分を記入し、完全な解散になるまでかき混ぜます。
- ピルビン酸ナトリウムとコリン Cl 15.36 g 0.34 g を追加します。
注: 最初のディゾルブ全体のソリューションにそれを追加する前に手順 2.3.2 では、溶液の 5 ~ 10 mL で Cl コリンに便利です。 - 1 mol· 7 mL を加えるL-1 MgCl2と 2 mol· の 250 μ LL-1 CaCl2 (手順 2.2 で準備) ソリューション。
- 純水で 1 L まで卒業のフラスコを埋めます。
- 蒸気圧 osmometer と 300 と 310 mΩ 間浸透圧であることを確認します。ない場合は、血糖値を調整します。
- Carbogenation (すなわち、「カーボゲン ・」に沸き立って、95% O25 CO2のミックス) 後 pH を確認し 10 M NaOH で 7.3 7.4 に、必要に応じてそれを調整します。
- ソリューションを保存用のガラス瓶に転送します。(ステップ 3.1) に使用されるまで冷蔵庫の中にボトルを維持します。
注:実験の日に新鮮なソリューションを作成することをお勧めします。ただし、必要に応じて、コリン アプライドに格納できる 4 ° C で 2 日に
-
実験の日、その組成は 124 mmol· アプライド ソリューションの 1 L を準備します。L-1 NaCl、26.2 mmol·L-1 NaHCO3、25 mmol·L-1グルコース、2.5 mmol·L-1 KCl、2 mmol·L-1 CaCl2、1 mmol·L-1 MgCl2、および 1.25 mmol·L-1 NaH2PO4。
- 準備するこのソリューションに追加、卒業のフラスコに、次の順序で: 7.3 g の塩化ナトリウム、ブドウ糖、4.5 g NaHCO32.2 g KCl の 0.186 g NaH2PO40.150 g。純水で 1 L のボリュームにソリューションをもたらすと撹拌プレートに混ぜ。
- 1 mol· の 1 つの mL を追加します。L-1 MgCl2と 2 mol· 1 mLL-1 CaCl2ソリューション、ストレージ用のガラス瓶への転送アプライド ソリューション。
- 浸透圧が 300 310 mΩ· であるかどうかを確認してください。L-1そうでない場合はグルコースでそれを調整します。
- Carbogenation 後、pH をチェック (すなわち、「カーボゲン ・」とバブル) と 10 M NaOH で 7.3 7.4 に、必要に応じて、それを調整。
- ソリューションを保存用のガラス瓶に転送します。(ステップ 3.1) に使用されるまで冷蔵庫の中にボトルを維持します。
注:実験の日に新鮮なソリューションを作成することをお勧めします。しかし、代わりに、ストック溶液塩化ナトリウム、NaHCO3KCl、NaH2PO4 4 ° C で 1 週間以上保存することができます最終的な濃度 x 10 x 10 を準備するには純水を 10 倍原液を希釈してグルコース、CaCl2MgCl2を追加実験の日に最終的なアプライドを作る。
- 実験日医薬ソリューションを準備します。最終濃度は、ここでは、500 µmol· をさせるアプライド ソリューションを使用します。ATP と 5 µmol· L-1L-1 5 HT。
注:ATP の貯蔵液を準備すること (例えば、50 mM 水の ATP)、-20 ° C で検体のフォームに格納され、実験の日に最終濃度にアプライドで希釈します。対照的に、5-HT (セロトニン HCl) ソリューションする必要があります準備粉から 1 mg·mL-1水の中で、実験の日に、5 HT の酸化を避けるために 4 ° C で保管し、実験の時にアプライドで希釈しました。
3. 急性脳スライスの準備
-
郭清範囲の準備
- 心臓血流、脳の急速な冷却とスライスに使用する氷は、80 mL のビーカーに冷たいコリン アプライドの 70 mL を準備します。コリン-アプライド結晶皿、32 ° C で維持される温水のお風呂は、200 mL で 150 mL を準備します。スライスを保持する結晶皿にナイロン メッシュのストレーナを配置します。これは、スライス スライス直後後 10 分の回復に使用されます。
- (セクション 3.2)、郭清を開始する前に、少なくとも 30 分は、カーボゲン ・と 2 つのソリューション (氷上コリン アプライドの 70 mL) と 150 mL 32 ° C でコリン アプライドのバブルを開始します。全体の手順中に定数 carbogenation を維持します。
- その使用までスライスを保つために使用されるインターフェイス商工会議所デバイス (図 1) を準備します。
- 磁性攪拌器にインストールされている密封された食品ボックス (10 × 10 cm、高さ 8 cm、直径 10 cm) で位置にバーが付いている皿を結晶 200 mL マグネット。
- この結晶皿にアプライドの 200 mL を追加し、(インターフェイス スライス ホルダーは、図 1 a B間延伸ポリアミド メッシュに 2 つの完全に継ぎ手部分、) それの上に 3 D プリント インターフェイス スライス ホルダーを配置します。
- インターフェイス スライス ホルダーのメッシュ カバーの薄膜のみを維持する結晶皿から余分なボリュームを削除します。これは後で (しかしそれらをカバーすることがなく) スライスを取り巻くソリューションの良い縁が作成されます。
- フード ボックスの下部にアプライドの数ミリを入れて、カーボゲン ・でバブリングを開始 (最初の使用時に小さな穴チューブ ボックスを入力することができますように密封された食品ボックス壁)。
- 定数 carbogenation を維持しながら密閉ボックスを閉じます。加湿 95% O25% CO2豊かな環境、スライスはコリン アプライドで回復した後に転送されが作成されます前に維持されますが作成されます。このデバイスは、「インターフェイスの部屋」として以下が (図 1)。
-
脳解剖とスライス
- 50 mg·mL-1ペントバルビ タール (マウス体重 0.15 mL/20 g) の腹腔内注入マウスを麻酔、それを固定、心を公開、冷たいの 10 mL で心筋灌流を実行 carbogenated、コリン アプライド (手順を参照してください。3.1.1) 蠕動性ポンプで。良い血流の指標として肝の青白さを観察します。灌流は、5 分以内を持続させます。
- マウスの首をはねるし、頭蓋骨を公開する皮膚をカットします。大きなハサミには、大孔と 1 つの長い矢状切口から 2 つ横のカットを適用し、スカル プレート微細鉗子を使用して、削除します。
- 迅速かつ優しく (1 分以内) の脳を抽出し、それを冷却するために、残り (〜 60 mL) 冷たいコリン-アプライド (まだ下で定数 carbogenation) を含む 80 mL ビーカーで 1 分の場所します。
- アプライドで以前ウェット フィルター紙の上に脳に転送します。
- 興味の脳の領域とスライスの設定角度によると脳を切り取る。たとえば、視床や辺縁系の海馬をイメージするカット、メスの刃、小脳と、その後、脳の吻側と尾側の四肢から mm 2 について。
注:吻側またはあまりにも尾にある脳の部分を削除することが重要ですので、関心のある領域に到達する前にトリムするより小さい地域高速スライスします。スライス (3.2.7) のステップ 20 分以内の所要時間をお勧めします。 - コロナのスライスの位置し振動スライサーの切断ブロックの接着 10 cm シャーレに脳の尾の顔 (シアノアクリ レート系接着剤) で接着剤し、貯水池商工会議所より大きい商工会議所に配置される振動のスライサーの位置氷で満ちています。次に、すべて、残り冷たいコリン-アプライドでペトリ皿を記入します。
- 95% O25% CO2を一定維持しながら冷たいコリン-アプライドのバブル 300 μ m の厚さにコロナ スライスをカット (速度: 0.08 mm·s-1, 翼振動: 振動振幅 60 Hz: 1 mm)。
- 広口 (直径 4 mm) 使い捨て転送と脳スライスのピペット収集、スライスの周囲が発表した有害成分の蓄積を避けるために、ブレードのすべての単一パスの後一人ずつ。世話を転送中に空気の泡を避けるために、約 10 分間の回復のための 32 ° C でコリン アプライドで各スライスを配置します。
- 転送ピペットとレンズ クリーニングの部分にスライスを配置紙コリン アプライドのドロップをトッピングします。コリン アプライドの過剰を吸引、ヘラとの室温で carbogenated アプライドを含むインターフェイス チャンバーのメッシュで、レンズ クリーニング ティッシュの上に置いたスライスを配置 (3.1.3.5 を参照)。スライスは、少なくとも 30 分間、この環境で回復をしましょう。
注:この後、スライスは準備ができているし、生後 2 ヶ月の大人からの脳抽出後ミクログリア 6 h まで若いから脳の抽出後のイメージング (より小さい 1 ヶ) マウスと 4 h まで使用できます。
4. 2 光子顕微鏡
- パラメーターの設定
- 多光子システム (ハイブリッド検出器、レーザー、スキャナー、電気光学変調器、顕微鏡) に切り替えます。
- 920 でレーザーを調整 nm、レーザー モード ロックは、電力を 5%-15% と 10% でゲイン設定とチェック。これは目的の下で 3-5 mW の力に対応します。Nondescanned 探知機を従事している適切な発光と励起フィルターがインストールされていることを確認します。
- 次の値には、イメージング ソフトウェアのパラメーターを設定: フレームのサイズは、1024 x 1024 ピクセル 295.07 μ m x 295.07 の領域に対応します。ズーム、2。信号に非常にノイズが多い場合は、2 ラインの平均値を適用します。ピクセル ダイナミクスの 12 ビット以上では、イメージング ソフトウェアを設定します。
注:ビット価値の高い画像が低いビット値を持つイメージよりも蛍光強度の小さい相違を区別するために研究者を許可する: 8 ビット イメージのグレー値が 256 のグレーの 12 ビットの 16 の灰色の値の変更に対応する 1 つの変更の値私n 16 ビット イメージ。したがって、高ビット画像は定量分析に適していますが、制限のサイズも拡大ビット深度、ストレージ容量、およびコンピューティング電力がなることができます。 - スキャン モード XYZT 2 μ m と 2 分の T 間隔で Z 間隔の範囲を選択します。
注:X、y および z の解像度は、ナイキストのサンプリング定理によって決まります。約 0.8 Z ステップ サイズはミクログリアのプロセスを解決するが最適だろう (直径の < 1 μ m)、多光子顕微鏡の光学解像度を制限することが、(920 で 0.95 NA 目的 nm、軸の分解能は 1 μ m 周辺)。その上で物理的な障壁、ライブ イメージング実験、感度解析スタディまたは信号対雑音比、解像度、速度、および全観測時間の問題で。これらのパラメーターはすべて、(多数研究3,11,14) のように 2 μ m、1024 x 1024 ピクセルのイメージ サイズ、HyD 探知器 (それに結合共振型スキャナーを使用してください。 高速集録の z ステップを考慮してください。約 15 を取る 50 z 計画を取得する s) ここに選ばれました。買収の頻度 1 つ XYZT シリーズ 2 分ごと、所要時間は 30 分です。場合セットアップは、高速または十分な区別には、水平解像度 (512 x 512) または z スライスの数を減らすことが可能だ (最も強い蛍光性を表わす z 深度における排他的イメージングを用いた [すなわち、ない深い z スライス、蛍光、かすかな]) またはスキャナーの速度が低下します。軸方向の解像度は、3 μ m まで z ステップを増やすことによって減らすことができますが、比較するすべての実験が同じ z ステップと実行が必要と定量化に影響を与える可能性があります。
注:CX3CR1creER YFP マウス18、ミクログリアだけで遺伝子の欠失を誘発し、ミクログリアの恒常黄色い蛍光蛋白質 (YFP) を表現するために使用マウス線からスライスで同様の実験を行うことが可能です。ただし、YFP の発現レベルが非常に低い CX3CR1 における緑色蛍光タンパク質 (GFP) と比較してGFP/+マウス;したがって、イメージングは可能ですが困難なアクイジション ・ パラメーターの最適化が必要です。それらを次のように調整することをお勧めします。 - 970 でレーザーを調整 nm (YFP 励起 920 よりも優れている適応 nm)、50% で 5-6 mW を目的としてレーザー電源に対応する 50% の利得パワー。
- 信号対雑音比を改善するために 4 (またはそれ以上) のラインの平均値を設定します。
- ガラス マイクロ ピペットと化合物のローカル アプリケーションのスライスの位置決め
- 録音を開始する前に 30 分録音室に蠕動性ポンプを接続します。純水の 50 mL で全体の灌流システムを洗浄した後定数 carbogenation の下でガラス ビーカーに含まれるアプライド (50 mL) と録音室の灌流を開始します。実験を通して循環アプライドをインライン マイクロヒータとペルチェ ヒーター 32 ° C に保ちます。
注:上部と下部の血流を特定の灌流チェンバはスライスの両側に酸素化を最適化するために設計されています。灌流チェンバは 2 つの完全に継手部品、それら (図 2 a B) の間延伸ポリアミド メッシュで構成されます。スライスは直接ガラス基盤上に敷設されて、部屋の他のタイプと比較してこの室削減されスライスの下の部分に神経細胞死、生存率を向上させると膨潤によるスライスの動き。 - 広口使い捨て可能な移動のピペット レンズ ペーパーを削除、それが (空気の泡がアタッチされていない証拠) としてシンク、および記録 (血流) 室に転送するアプライド ビーカーにイメージングされる脳スライスを転送します。
- 灌流によるスライスの動きを最小限にスライス スライス ホルダー (並列ナイロン スレッドによって参加している 2 つの枝を持つプラチナ製ヘアピン) に配置します。
- 明視野照明を使用して興味の脳の領域をターゲットに (露出時間: 50 に 80 ms) 低倍率の目的 (5 X 10 X) を使用します。高倍率 (0.35 x レンズで 25 倍) 水浸対物レンズを切り替えるし、位置を調整します。
注:光を遮断でき、ローカル変形スライス スライス ホルダーのナイロン スレッドに近いイメージ フィールドに避けてください。関心のある領域はフラットであることを確認します。必要であればスライスの位置を変更するためにスライス ホルダー、スライス ホルダーを取り外します。 - 蛍光照明を使用して、フィールドにイメージを作成する蛍光ミクログリア細胞を見つけます (露出時間: 250-500 ms)。
注:この手順では、研究者の関心とその蛍光強度領域における細胞の存在を確認して細胞の残骸の量を制御することができます。 - ATP とバックフィル アプライドの 10 μ L をピペット 5-HT またはその最終濃度で興味の薬剤。下方の先端をポイントし、先端に閉じ込められている空気の泡を削除する薬物を充填ピペットを軽く振る。
注:注入するソリューションは気泡を形成する傾向がある場合、は、内部のフィラメントとホウケイ酸ピペットの使用を検討します。ピペットから ATP の漏れは注射の前にもミクログリア プロセスを引き付けることができる (このような場合、それは解析ステップで表示されます)。これは ATP の濃度と適当にする必要があります使用 (500 µmol·L-1)、問題は場合、は、ATP (または他の化合物) を追加する前にアプライドの 2 ml ピペットを設定しやすくなってすることを検討してくださいステップ 4.2.6 でソリューション。 - 5 mL の位置に配置されプランジャーと 5 mL の注射器に透明チューブを接続、ピペット ホルダーにいっぱいピペットをマウントします。ピペット ホルダー自体は三次元マイクロマニピュレーターにマウントされます。
- 明視野照明下でピペットをフィールドの中央に位置するのにマニピュレーターを使用します。再現性と最適な中心、表示し、画像を定規を使用します。
- 制御およびピペット チップまで、同時に目的を軽く調整するスライスの表面に触れて、スライスに向かって優しくピペットを下げなさい。スライス面の 80-100 μ m を貫通するピペット チップ スライスに触れたが表示されてすぐにピペットの降下を停止することができます (図 3B参照)。
- レーザーを調整 (上記のパラメーターを参照) と顕微鏡を多光子モードに切り替えます。商工会議所は任意の光源 (コンピューター画面など) から上映されていることを確認します。Nondescanned 検出器に切り替え、ゲインを設定します。色分けされた上限値とイメージのピクセルの飽和を避けるためにルックアップ テーブル (LUT) を使用します。
- イメージを作成するスライスの厚さを決定する (すなわち、上限と下限の z 位置蛍光は [合計 220 と 290 μ m] の間に通常検出)。
注:スライスの表面、密度増加プロセスのおそらくミクログリア、スライスの内側と比較しての異常な形態であります。この蓄積は、時間 (すなわち.、イメージを作成する最初の脳スライス内のより最後のほうが目立つ) とより顕著になります。したがって、まず 〜 30 μ m で z 平面解析には使用しないでください、買収についても省略できます。 - 30 分 (またはそれ以上必要な場合) の合計時間の録音を開始し、5 分ベースライン後ローカル (イメージングを妨げず) テストする化合物を適用します。これを行うには、マイクロ ピペット、1 mL の位置に 5 mL から接続シリンジのプランジャーを押してゆっくりと (約 5 秒)。プランジャーを押すときの抵抗を直に触れられる必要があります。されていない場合は、先端が壊れることがあります。
注:訓練を受けた実験者のこの方法で注射は再現できるが、また注射器の手動操作、するに、ピペットを配信量のよりよい制御を許可する自動圧力放出システムにリンクする可能性があります。注入は、注入のサイトでスライスの物理的な歪みを作成します。この歪みが表示される最初の 2 つまたは 3 つの事後注入後画像しますが、ない (すなわち、注入後 8 分)、4 番目の画像上に表示する必要があります。それが解決しない場合は、ピペットの準備のためのパラメーターを変更してみます。 - 取得 (30 分) の終わりに、マイクロ ピペットを破棄し、スライスを削除します。必要な場合は、さらに反応のスライスを修正します。たとえば、スナップショット メソッドの最適化を固定用、23のスライス厚の染色します。
- 新しいスライスをイメージ、そのミクログリアをチェックするために (セクション 5.1) の 2 D の映画を作る起動する前に通常形態と動いているため、スライスが正常であります。
- 録音を開始する前に 30 分録音室に蠕動性ポンプを接続します。純水の 50 mL で全体の灌流システムを洗浄した後定数 carbogenation の下でガラス ビーカーに含まれるアプライド (50 mL) と録音室の灌流を開始します。実験を通して循環アプライドをインライン マイクロヒータとペルチェ ヒーター 32 ° C に保ちます。
5. ミクログリアの魅力解析処理します。
-
2 D 投影とドリフト補正
- ファイルを開く (。LIF) フィジー24。
- 必要な場合のみ興味の z 平面を使用して substack (スタック/ツール/確認/画像 Substack) を作る。たとえば、彼らは取得されているが、分析に使用することが場合、スライスの表面に対応する z 平面を除外 (4.2.11 の手順の後のメモを参照) と no 蛍光と深い z 平面。最後のスタックには、90-110 z スライス (180-220 μ m) 一般に含まれています。
- Z プロジェクト機能を起動 (画像/スタック/Z プロジェクト」)、時間の各ポイントで取得した z のプロジェクションを行うこと最大強度投影タイプを選択。
- MultiStackRegプラグイン (プラグイン/登録/MultiStackReg) の起動を選択するアクション 1: 配置と変換: 剛体買収時に発生したわずかなドリフトを修正します。新しいファイル (.tiff) としてこの 2 D のムービーを保存します。
-
データ処理
- 氷25とこの新しいファイルを開きます。
- (特にピペットと射出の時に作成された歪みの影によって識別される) 注射部位を中心とした直径 35 μ m の利益 (率 ROI) の円形R1領域を描画します。
- 投資収益率強度進化プラグインを使用して、R1 で時間の経過と共に平均強度を測定します。
- 結果を保存します。XLS ファイル。
-
定量化と結果の表現
- 時間をかけてミクログリア応答を定量化するには、各時点で決定します。
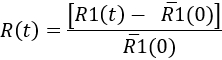
Here,'R1(0) は、注射前に R1(t) 値の平均です。その後、結果ミクログリア応答の運動として表すことができます。 または特定の時間ポイント (図 7参照)。
- 時間をかけてミクログリア応答を定量化するには、各時点で決定します。
Access restricted. Please log in or start a trial to view this content.
結果
このプロトコルを誘発する、観察、およびミクログリア プロセス ローカルで適用される化合物への配向成長を定量化する方法を記述する、たとえば、ATP または急性脳内の 5-HT を若者や大人からスライス (少なくともまで 2 ヶ) マウス。正常な状態の大人動物から脳スライスを数時間維持に寄与する要因はプロトコルの 2 つの手順で細胞の生存を最適化するために設計...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
図りとは違っての解離や切片スライス文化、限られたネットワーク調整と構造健全性急性脳スライス許可彼らの生理学的環境におけるミクログリアの研究に研究。しかし、主な制限の 1 つはスライス手順が急速に特に成体脳におけるニューロンの生存を危険にさらすことができます傷害を作成するという事実です。ミクログリア細胞の損傷に特に反応、神経細胞死の生理学的状態に近いミク?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者が明らかに何もありません。
謝辞
我々 感謝細胞と組織イメージング施設インスティトゥート du Fer à ムーラン、すべての画像の取得と解析が行われているのです。センター国民 de の la Recherche 日仏 Institut 国立デ ラ健康にこの作品の一部でサポート エ デ ラ抜き Médicale ソルボンヌ大学科学とソルボンヌ Universités ピエールからの補助金によって et マリー キュリー大学 (Emergence-UPMC プログラム 2011/2014) こそ注ぐラ凝ったシュル ル Cerveau、財団・ ド ・ フランス、こそ注ぐラ凝った Médicale「エキップ FRM DEQ2014039529」、フランス語研究 (Agence 国立注ぐラ凝った省ANR-17-CE16-0008 ・ Investissements d'Avenir プログラム「バイオ買う Psy Labex「ANR-11-アイデックス-0004-02) および計算の神経科学プログラム、国立科学財団/フランス国立研究機関における共同研究 (番号: 1515686).すべて著者が所属して研究グループ (ENP) 神経科学のパリ校とバイオ買う Psy の Labex のメンバーであります。F. e. 提携してソルボンヌ大学、Collège 博士、F-75005、パリ、博士課程の学生でありバイオ買う Psy の Labex によって資金を供給されます。V. m. は計算神経科学プログラム、国立科学財団/フランス国立研究機関での共同研究によって資金を供給される博士研究員 (番号: 1515686)。著者らは、プロジェクトの開始に参加したマルタ [コロジエチャク] をありがとうございます。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| for pipettes preparation | |||
| Clark Borosilicate Thin Wall Capillaries | Harvard Apparatus | 30-0065 | Borosilicate Thin Wall without Filament, 1.5 mm OD, 1.17 mm ID, 75 mm L , Pkg. of 225 |
| DMZ Universal Puller | Zeitz Instrumente | ||
| Name | Company | Catalog Number | Comments |
| for solutions | |||
| Calcium Chloride dihydrate (CaCl2) | Sigma | C5080 | |
| Choline Chloride | Sigma | C7527 | |
| D-(+)-Glucose | Sigma | G8270 | |
| L-Ascorbic acid | Sigma | A5960 | |
| Magnesium Chloride solution 1 M (MgCl2) | Sigma | 63020 | |
| Potassium chloride SigmaUltra >99.0% (KCl) | Sigma | P9333 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium Chloride (NaCl) | Sigma | S5886 | |
| Sodium phosphate monobasic | Sigma | S5011 | |
| Sodium pyruvate | Sigma | P2256 | |
| Ultrapure water | MilliQ | for all the solutions | |
| Name | Company | Catalog Number | Comments |
| for slice preparation | |||
| 2x 200 mL crystalizing dishes | |||
| 80 mL Pyrex beaker | |||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For mice perfusion and 2-photon chamber perfusion (aCSF) |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | ||
| Dolethal | Vetoquinol | Dolethal 50 mg/mL | |
| Filter papers (Whatman) | Sigma | WHA1001042 | Whatman qualitative filter paper, Grade 1 (Pore size: 11µM) |
| Fine Scissors - Sharp | Fine Science Tools | 14060-60 | |
| Food box 10 cm diameter, 8 cm Height | |||
| glue (ethyl cyanoacrylate) | Loctite | super glue 3 power flex | |
| Hippocampal Tool (spatula) | Fine Science Tools | 10099-15 | The largest extremity has to be angled at 90° |
| Ice | |||
| Iris Forceps (curved) | Moria | MC31 | |
| Lens cleaning tissue | THOR LABS | ||
| Nylon mesh strainer | diameter 7 cm | ||
| Razor blades | Electron Microscopy Sciences | 72000 | For the slicer |
| scalpel blade | |||
| Slice interface holder | home-made, the file for 3D printing is provided in Supplemental Material | ||
| Surgical Scissors - Sharp | Fine Science Tools | 14002-14 | |
| Vibrating slicer | Thermo Scientific | 720-2709 | Model: HM 650V (Vibrating blade microtome) |
| Water bath | Set at 32 °C (first recovery step) | ||
| Name | Company | Catalog Number | Comments |
| for slice imaging | |||
| × 25 0.95 NA water-immersion objective | Leica Microsystems (Germany) | HCX Irapo | |
| 2-photon MP5 upright microscope with resonant scanners (8 kHz) and two HyD Hybrid detectors | Leica Microsystems (Germany) | ||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For 2-photon chamber perfusion with aCSF |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | I1501L50R2A001 | |
| Chameleon Ultra2 Ti:sapphire laser | Coherent (Germany) | ||
| disposable transfer pipettes , wide mouth | ThermoFischer scientific | for example : 232-11 | 5.8 mL with fin tip, but we cut it (approx 7 cm) to have a 4 mm diameter mouth |
| emission filter SP680 | Leica Microsystems (Germany) | ||
| fluorescent cube containing a 525/50 emission filter and a 560 dichroic filter (for fluorescence collection) | Leica Microsystems (Germany) | ||
| glass beaker with 50 mL of ACSF to maintain constant perfusion of the slice | |||
| Heating system | Warner Instrument Corporation | Automatic Heater Controller TC-324B | to maintain perfusion solution at 32 °C |
| perfusion chamber | home-made, the file for 3D printing is provided in Supplemental Material | ||
| slice holder ("harp") | home made : hairpin made of platinum with the two branches joined by parallel nylon threads | ||
| Name | Company | Catalog Number | Comments |
| for slice stimulation | |||
| Adenosine 5′-triphosphate disodium salt hydrate (ATP) | Sigma | A-26209 | to be prepared ex-temporaneously : 1 mg/mL (3 mM) stock solution prepared the day of the experiment, kept at 4 °C (a few hours) and diluted just before use |
| Fluorescein (optional) | Sigma | F-6377 | use at 1 µM final |
| Micromanipulator | Luigs and Neumann | SM7 | connected to the micropipette holde |
| Micropipette holder | same as for eletrophysiology | ||
| Serotonin hydrochloride | Sigma | H-9523 | aliquots of 50mM stock solution in H20 kept at -20 °C. 500 µM solution prepared the day of the experiment. |
| Syringe 5 mL (without needle) | Terumo medical products | SS+05S1 | |
| Transparent tubing | Fischer Scientific | 11750105 | Saint Gobain Performance Plastics™ Tygon™ E-3603 Non-DEHP Tubing |
| Name | Company | Catalog Number | Comments |
| for image analysis | |||
| Fiji | https://fiji.sc | Schindelin, J. et al Nat. Methods (2012) doi 10.1038 | |
| Icy | Institut Pasteur | http://icy.bioimageanalysis.org | de Chaumont, F. et al. Nat. Methods (2012) |
| Name | Company | Catalog Number | Comments |
| mice | |||
| CX3CR1-GFP mice | Jung et al, 2000 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. | |
| CX3CR1creER-YFP mice | Parkhurst et al 2013 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. |
参考文献
- Salter, M. W., Stevens, B. Microglia emerge as central players in brain disease. Nature Publishing Group. 23 (9), 1018-1027 (2017).
- Tay, T. L., Savage, J., Hui, C. W., Bisht, K., Tremblay, M. -È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. , (2016).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Dissing-Olesen, L., et al. Activation of neuronal NMDA receptors triggers transient ATP-mediated microglial process outgrowth. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10511-10527 (2014).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. Journal of Biological Chemistry. 288 (21), 15291-15302 (2013).
- Eyo, U. B., et al. Neuronal hyperactivity recruits microglial processes via neuronal NMDA receptors and microglial P2Y12 receptors after status epilepticus. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10528-10540 (2014).
- Hristovska, I., Pascual, O. Deciphering Resting Microglial Morphology and Process Motility from a Synaptic Prospect. Frontiers in Integrative Neuroscience. 9, 1231(2016).
- Avignone, E., Lepleux, M., Angibaud, J., Nägerl, U. V. Altered morphological dynamics of activated microglia after induction of status epilepticus. Journal of Neuroinflammation. 12, 202(2015).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biology. 14 (5), e1002466(2016).
- Madry, C., et al. Microglial Ramification, Surveillance, and Interleukin-1β Release Are Regulated by the Two-Pore Domain K+Channel THIK-1. Neuron. 97 (2), 299-312 (2018).
- Honda, S., et al. Extracellular ATP or ADP induce chemotaxis of cultured microglia through Gi/o-coupled P2Y receptors. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 21 (6), 1975-1982 (2001).
- Haynes, S. E., et al. The P2Y12 receptor regulates microglial activation by extracellular nucleotides. Nature Neuroscience. 9 (12), 1512-1519 (2006).
- Wu, L. -J., Vadakkan, K. I., Zhuo, M. ATP-induced chemotaxis of microglial processes requires P2Y receptor-activated initiation of outward potassium currents. Glia. 55 (8), 810-821 (2007).
- Kolodziejczak, M., et al. Serotonin Modulates Developmental Microglia via 5-HT 2BReceptors: Potential Implication during Synaptic Refinement of Retinogeniculate Projections. ACS Chemical Neuroscience. 6 (7), 1219-1230 (2015).
- Schafer, D. P., et al. Microglia Sculpt Postnatal Neural Circuits in an Activity and Complement-Dependent Manner. Neuron. 74 (4), 691-705 (2012).
- Pfeiffer, T., Avignone, E., Nägerl, U. V. Induction of hippocampal long-term potentiation increases the morphological dynamics of microglial processes and prolongs their contacts with dendritic spines. Scientific Reports. 6, 32422(2016).
- Parkhurst, C. N., et al. Microglia Promote Learning-Dependent Synapse Formation through Brain-Derived Neurotrophic Factor. Cell. 155 (7), 1596-1609 (2013).
- Wu, Y., Dissing-Olesen, L., Macvicar, B. A., Stevens, B. Microglia: Dynamic Mediators of Synapse Development and Plasticity. Trends in Immunology. 36 (10), 605-613 (2015).
- Ohsawa, K., et al. P2Y12 receptor-mediated integrin-beta1 activation regulates microglial process extension induced by ATP. Glia. 58 (7), 790-801 (2010).
- Kurpius, D., Wilson, N., Fuller, L., Hoffman, A., Dailey, M. E. Early activation, motility, and homing of neonatal microglia to injured neurons does not require protein synthesis. Glia. 54 (1), 58-70 (2006).
- Stence, N., Waite, M., Dailey, M. E. Dynamics of microglial activation: a confocal time-lapse analysis in hippocampal slices. Glia. 33 (3), 256-266 (2001).
- Dissing-Olesen, L., Macvicar, B. A. Fixation and Immunolabeling of Brain Slices: SNAPSHOT Method. Current Protocols in Neuroscience. 71, 1.23.1-12 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- Aitken, P. G., et al. Preparative methods for brain slices: a discussion. Journal of Neuroscience Methods. 59 (1), 139-149 (1995).
- Paris, I., et al. ProMoIJ: A new tool for automatic three-dimensional analysis of microglial process motility. Glia. 66 (4), 828-845 (2018).
- Pagani, F., et al. Defective microglial development in the hippocampus of Cx3cr1 deficient mice. Frontiers in Cellular Neuroscience. 9 (229), 111(2015).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. , Clifton, NJ. 221-242 (2014).
- Mainen, Z. F., et al. Two-photon imaging in living brain slices. Methods. 18 (2), San Diego, CA. 231-239 (1999).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Gyoneva, S., et al. Systemic inflammation regulates microglial responses to tissue damage in vivo. Glia. 62 (8), 1345-1360 (2014).
- Heindl, S., et al. Automated Morphological Analysis of Microglia After Stroke. Frontiers in Cellular Neuroscience. 12, 106(2018).
- Dailey, M. E., Eyo, U., Fuller, L., Hass, J., Kurpius, D. Imaging microglia in brain slices and slice cultures. Cold Spring Harbor Protocols. 12 (12), 1142-1148 (2013).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved