需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
微胶质过程对急性脑片 atp 或血清素的双光子成像
* 这些作者具有相同的贡献
摘要
小胶质细胞是大脑中的常驻免疫细胞, 随着环境变化的形态变化而迅速反应。该协议描述了如何使用双光子显微镜研究微胶质过程对血清素或 atp 的吸引力, 在急性脑切片的小鼠。
摘要
微胶质细胞是大脑中的固有免疫细胞, 它们在长时间的过程中不断地扫描它们的环境, 并在破坏稳态时经历快速的形态变化。例如, 激光病变在几分钟内诱导一个定向的微胶质过程的生长, 也被称为 "定向动力", 向受伤部位。通过局部 atp 或血清素 (5-羟基色胺 [5-ht]), 也可以获得类似的效果。在本文中, 我们描述了一种方案, 以诱导微胶质过程的定向生长, 向局部应用 atp 或5-ht 在急性脑片的急性脑片的年轻和成年小鼠, 并通过多光子显微镜图像这种吸引力随着时间的推移。提出了一种利用自由和开源图像分析软件进行量化的简单方法。急性脑片的一个特点仍然是时间有限, 随着年龄的推移而减少, 在此期间, 细胞保持生理状态。因此, 该协议强调了一些技术改进 (介质、气液界面室、双灌注成像室), 旨在在几个小时内优化微胶质细胞的活力, 特别是在成年小鼠的切片中。
引言
微胶质细胞是大脑的巨噬细胞, 在生理和病理条件 1,2中都起着一定的作用.它们具有高度分枝的形态, 并不断扩展和收缩其过程3,4。这种 "扫描" 行为被认为与对周围环境的调查有关, 也是必要的。微胶质细胞的形态可塑性以三种模式表示。首先, 一些化合物迅速调节微胶质细胞的形态: 在中浴急性脑片中加入 atp5、6或 nmda5, 7 增加了微胶质细胞影响的复杂性,而去甲肾上腺素会降低它 6。这些效应要么是由微胶质受体 (atp 和去甲肾上腺素) 直接介导的, 要么是需要神经元的 atp 释放 (对于 nmda)。第二, 微胶质过程的生长和收缩速度, 称为 "动力或监视", 可以受到细胞外因子8, 稳态中断9,10,或突变9, 10,11。第三, 除了这些各向同性的形态和动力的变化, 微胶质细胞有能力将其过程定向扩展到提供 atp3,5,12的移液器,13,14、在培养中、在急性脑片或体内, 或在急性脑片15中提供5-ht。这种微胶质过程的定向生长, 也被称为定向运动, 首先被描述为对局部激光病变3,4的反应。因此, 从生理上讲, 它可能与受伤的反应有关, 也可能与针对微胶质过程的目标, 以突触或大脑区域为目标, 在发育15、16或生理上17需要修剪 ,18,19或病理情况9,18,19,20在成年。三种类型的形态变化依赖于不同的细胞内机制11,13, 20 和一个给定的化合物不一定调节所有这些机制 (例如, nmda, 间接作用于微胶质细胞, 对形态有影响, 但不会引起方向动力5,7)。因此, 当目标是表征化合物、突变或病理对微胶质细胞的影响时, 重要的是要表征其形态可塑性的三个组成部分。在这里, 我们描述了一种方法来研究微胶质过程的定向生长向一个局部来源的化合物, 这是, 在这里, atp 或5-ht。
研究微胶质细胞过程吸引力的模型有几个: 三维环境中的初级培养 6、18、19、急性大脑切片 6、13、15和体内成像3,13。体内入路是保存微胶质细胞生理状态的最佳方法。然而, 深部区域的宫内成像需要复杂的外科手术, 因此, 它往往被限制在浅层皮质层。使用微胶质原代培养是用数量有限的动物测试大量条件的最简单的技术。然而, 它是不可能获得相同的细胞形态在体内, 细胞失去其与神经元和星形胶质细胞的生理相互作用。急性脑片代表了这两种方法之间的妥协。该模型允许研究人员研究在体内难以到达的大脑结构和高分辨率的图像, 并从新生儿阶段的切片进行研究, 而经颅显微镜主要是在成年时进行的。最后, 可以实时观察局部药物应用的效果, 并在使用数量有限的动物的同时重复实验。然而, 急性脑片的一个问题是细胞存活的时间有限 (几个小时), 特别是两周以上小鼠的切片, 以及随着时间的推移, 微胶质细胞形态可能发生变化.
在这里, 我们描述了一个方案, 以准备急性脑片的年轻和成人 cx3cr1gfp/c + 小鼠长达两个月大, 保持微胶质的形态和运动几个小时。然后, 我们描述如何使用这些切片来研究微胶质过程对 atp 或5-ht 等化合物的吸引力。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有实验都得到了地方道德委员会 (达尔文委员会、协议 #1170 和 #10921) 的批准。
1. 用于局部应用的玻璃微管的制备
- 用电极拉拔器从硼硅酸盐薄壁玻璃毛细管中准备移液器。调整参数以获得在其末端直径为4-5 微米的移液器。图 2d显示了一个低放大倍率的明亮场移液器。
2. 解决方案
- 确保只使用通过高压灭菌器循环清洗过的玻璃器皿, 然后用超纯水冲洗 2x-1 x。切勿使用与甲醛接触过的玻璃器皿。
-
准备一个2摩尔·l-1 ccl 2 库存溶液通过溶解14.7 毫克的 ccl2·2o在50 毫升的高纯度水 (超纯水, 电阻 18.2 mL; 蒸馏水或自来水中的金属痕迹可以导致亚优的切片质量, 由于促进氧化作用)。
- 将此库存解决方案存放在室温下, 最长一个月。
-
在实验当天, 准备1升胆碱-acsf (人工脑脊液) 溶液, 其成分为 110 mmol·l-1胆碱 cl, 25 mmol·l-1葡萄糖, 25 mmol·l-1纳哈科3, 7 mmol·l-1 mgcl2, 11.6 mmol·l-1抗坏血酸, 3.1 mmol·l-1丙酮酸钠, 2.5 mmol·l-1 kcl, 1.25 mmol·l-1 nah2po4和 0.5 mmol·l-1 ccl2, 0.5。
- 要准备此溶液, 请按以下顺序在1升级瓶中添加: 0.186 克 kcl、0.186 g nah2 po 4、2.04 g酸性抗坏血酸、2.1 克 nahco3和 4.5 g 葡萄糖.
- 用超纯水填充约一半的最终体积, 搅拌至完全溶解。
- 加入0.34 克丙酮酸钠和15.36 克胆碱 cl。
注: 在将胆碱溶液添加到整个溶液中之前, 先将其溶解2.3.2 步骤制备的溶液为5至10毫升, 是方便的。 - 添加7毫升1摩尔·l-1 mgcl2和250μl 的2摩尔·l-1 ccl2 (在步骤2.2 中准备) 到溶液中。
- 用超纯水填充刻度瓶, 最高可达1升。
- 使用蒸汽压力渗透计, 检查渗透度是否在300和 310 mω之间。如果没有, 用葡萄糖调整。
- 检查碳化后的 ph 值 (即, 用 "碳原" 冒泡, 混合 95% o 2/5% co2), 并在必要时将其调整为7.3-7.4 和 10 m naoh。
- 将溶液转移到玻璃瓶上存放。将瓶子放在冰箱中, 直至使用 (step 3.1)。
请注意:建议在实验当天做一个新的溶液。但是, 如有必要, 胆碱-csf 可在4°c 下存储长达两天。
-
在实验当天, 准备一个 acsf 溶液的 1 l, 其组成是 124 mmol·l-1氯化钠, 26.2 mmol·l-1 纳哈科 3, 25 mmol·l-1葡萄糖, 2.5 mmol·l-1 kcl, 2 mmol·l-1 ccl2, 1 mmol·l-1 mgcl2和 1.25 mmol·l-1 nah2po 4。
- 为了准备这种解决方案, 在刻度瓶中添加以下顺序: 0.150 克的 nah2 po 4、0.150克的 kcl、2.2 克的 nahco3、4.5 g 的葡萄糖和7.3 克的 nocl。将溶液带到1升的超纯水中, 并在搅拌板上大力搅拌。
- 添加1毫升1摩尔·l-1 mgcl2和 1 ml 2 mol ·l-1 ccl2到溶液中, 并将 acsf 溶液转移到玻璃瓶中存放。
- 检查渗透度是否为 300-310 mω·l-1 , 如果没有, 则用葡萄糖调整。
- 检查加气后的 ph 值 (即, 用 "加气原" 冒泡), 并在必要时将其调整为 7.3-7.4, 并使用 10 m naoh。
- 将溶液转移到玻璃瓶上存放。将瓶子放在冰箱里, 直到使用 (步骤 3.1)。
请注意:建议在实验当天做一个新的溶液。然而, 另一种方法是在最终浓度的10倍处制备含有氯化钠、nhco3、kcl 和 nah2po 4的10倍库存溶液, 在4°c 下可储存不超过一周。在实验当天, 通过用水稀释10倍的库存溶液, 加入葡萄糖、ccl2和 mgcl2, 进行最后的 ccsf。
- 在实验当天准备药物溶液。使用 acsf 溶液将它们带到最终浓度, 在这里, 500μmol·l-1为 atp 和5μmol·l-1为5-ht。
请注意:对于 atp, 可以制备库存溶液 (例如, 水中 50 mm atp), 以-20°c 的化名形式储存, 并在实验当天用 csf 稀释到最终浓度。相反, 5-ht (血清素-hcl) 溶液必须在实验当天用粉末制备, 在水中为 1 mg·ml-1, 保持在 4°c, 以避免5-ht 氧化, 并在实验时在 acsf 中稀释.
3. 急性脑片的制备
-
解剖区域的准备
- 准备70毫升的冰凉胆碱-抗脑脊液在一个80毫升的烧杯放置在冰上, 用于心脏灌注, 大脑的快速冷却, 和切片。准备150毫升的胆碱-抗 unsf 在一个200毫升的结晶盘, 放置在一个加热的水浴, 保持在32°c。在结晶盘中放置尼龙网过滤器以保留切片。这将用于让切片在切片后恢复10分钟。
- 在开始解剖之前至少 30分钟 (3.2 节), 开始用碳原泡泡这两种溶液 (冰上的胆碱-胆碱-csf 70 毫升和胆碱-csf 150 毫升)。在整个过程中保持持续的碳化。
- 准备接口腔设备 (图 1c), 该装置将用于保存切片, 直到它们使用。
- 安装在磁性搅拌器上的密封食品盒 (直径 10 x 10 厘米或10厘米, 高度8厘米) 中, 将 200 ml 结晶盘与棒状磁铁放在一起。
- 在这个结晶盘中添加200毫升的 acsf, 并将3d 打印的接口片支架放在其顶部 (接口切片支架由两个完美拟合的部分组成, 它们之间有一个聚酰胺网格,图 1a. b).
- 从结晶盘中去除多余的体积, 以便只保留一层薄薄的溶液, 覆盖界面片支架的网格。这将在以后围绕切片创建一个很好的解决方案边缘 (但不覆盖它们)。
- 在食品盒底部放几毫米的 acsf, 开始用碳原起泡 (第一次使用时, 在密封的食品盒壁上打一个小孔, 以确保管材能够进入盒子)。
- 关闭密封盒, 同时保持恒定的加气。这将创建一个加湿 95% o2/5% 二氧化碳丰富的环境, 其中切片将转移后, 他们恢复在胆碱-csf 和维护之前, 他们被成像之前.此设备以下简称 "接口室" (图 1c)。
-
脑解剖和切片
- 用50毫克·ml-1 五巴比妥 (小鼠体重 0.15 ml/2 g)的腹腔内注射麻醉小鼠, 固定它, 暴露心脏, 并用10毫升的冰凉、加气、胆碱-acsf 进行心脏灌注 (见步骤)3.1.1), 用蠕动泵。观察肝脏的苍白, 作为一个良好的灌注的指标。灌注持续不到5分钟。
- 将鼠标斩首, 并切割皮肤以暴露头骨。用大剪刀, 从大孔和一个长的矢状切口应用两个横向切割, 并使用精细的钳子, 删除头骨板。
- 快速和轻轻地提取大脑 (不到 1分钟), 并将其放置在80毫升烧杯中 1分钟, 其中含有剩余的 (~ 60 毫升) 冰凉的胆碱-胆碱-csf (仍在持续的加气下), 以便将其冷却。
- 将大脑转移到以前用 csf 湿的滤纸上。
- 根据大脑感兴趣的区域和首选的切片角度切掉大脑。例如, 要在日冕切片上对丘脑或海马体进行成像, 用手术刀将小脑切掉, 然后, 从大脑的根和尾端大约2毫米。
请注意:重要的是要删除大脑中过于倾向或过于尾端的部分, 因为在到达感兴趣的区域之前, 要修剪的区域越小, 切片速度就越快。建议将切片 (步骤 3.2.7) 的总时间小于20分钟。 - 对于日冕切片, 位置和胶水 (与氰基丙烯酸酯胶) 大脑的尾端面到一个10厘米的培养皿, 粘在振动切片器的切割块上, 并将其放置在振动切片器的储罐中, 该腔位于较大的腔中充满了冰。然后, 在培养皿中充满所有剩余的冰凉胆碱-抗 csf。
- 在保持恒定的 95% o 2/5% co2 冒泡的冰凉胆碱-acsf, 削减300μm 厚的冠状片 (速度: 0.08 m·s-1, 叶片振动:60 赫兹, 振动振幅: 1 毫米).
- 用宽口 (直径4毫米) 一次性输送移液器收集大脑切片, 每次一次接一个地通过刀片, 以避免切片外围释放的有毒成分的积累。注意避免在转移过程中出现气泡, 并在32°c 的胆肠-反核细胞中放置每片, 约 10分钟, 以便恢复。
- 通过转移移液器, 将切片放在镜头清洗纸上, 上面有一滴胆碱-抗脑脊液。吸收过量的胆碱-抗 csf, 并与铲子一起, 将放置在镜片清洁组织上的切片, 放在含有加压性 acsf 的界面室的网格上 (见 3.1.3.5)。让切片在此环境中恢复至少30分钟。
请注意:之后, 切片已准备就绪, 可用于大脑从年轻 (不到一个月) 小鼠身上提取后6小时的微胶质细胞成像, 以及从2个月大的成年人身上提取大脑后长达4小时的微胶质细胞成像。
4. 双光子显微镜
- 参数设置
- 打开多光子系统 (混合探测器、激光、扫描仪、电光调制器、显微镜)。
- 将激光调整为920纳米, 检查激光是否锁模, 并将功率设置为 5%-15%, 增益设置为10%。这对应于目标下的 3-5 mw 的功率。确保采用非脱罐探测器, 并安装适当的排放和励磁过滤器。
- 将成像软件的参数设置为以下值: 对于帧大小, 1024 x 1024 像素对应于 295.07 x 295.07 微米的面积;为变焦, 2。如果信号非常嘈杂, 则应用平均为2的线。对于像素动态, 将成像软件设置为12位或更小。
请注意:比特值较高的图像使研究人员能够区分比具有较低位值的图像更小的荧光强度差异: 8位图像中一个灰度值的变化将对应于12位中16个灰度值和256个灰度值 i 的更改n 16位图像。因此, 较高的位图像更适合于定量分析, 但随着位深度、存储容量和计算能力的增加, 它们的大小可能会变得有限。 - 选择 z 间隔范围为2μm、t 间隔为2分钟的扫描模式 xyzt。
请注意:x、y 和 z 分辨率由尼奎斯特采样定理确定。z 步长约0.8 将是解决微胶质化过程 (直径为 lt;1 微米) 的最佳选择, 但多光子显微镜的光学分辨率是有限的 (在920纳米, 具有 0.95 na 目标时, 轴向分辨率约为 1μm)。在物理屏障的基础上, 在实时成像实验中, 灵敏度或信噪比、分辨率、速度和总观测时间都很重要。考虑到所有这些参数, 2μm 的 z 步 (如许多研究3、11、14)、1024 x 1024 像素的图像大小以及使用与 hyd 探测器耦合的谐振扫描仪进行高速采集 (需要大约15秒获得 50 z 计划) 在这里被选中。采集频率为每2分钟一个 xyzt 系列, 总持续时间为30分钟。如果设置不够快或不够敏感, 则可以将横向分辨率 (下降到 512 x 512) 或 z 切片数 (仅在显示最强荧光的 z 深度进行成像) [即,而不是最深的 z 片。荧光微弱)), 或降低扫描仪的速度。轴向分辨率也可以通过将 z 步长增加到3μm 来降低, 但由于这可能会影响量化, 因此所有要比较的实验都应使用相同的 z 步长进行。
请注意:可以对 cx3cr1creer-yfp小鼠 18的切片进行类似的实验, 这是一种仅用于诱导微胶质细胞遗传缺失的小鼠系, 在这种小白细胞中, 微胶质细胞本构表达黄色荧光蛋白 (yfp)。然而, 与绿色荧光蛋白 (gfp) 相比, yfp 在 cx3cr1gfp/c + 小鼠中的表达水平很低;因此, 成像是可能的, 但具有挑战性, 需要优化采集参数。建议按如下方式调整它们。 - 将激光调整为 970 nm (比970纳米更适合 yfp 激发), 功率为 50%, 增益为 50%, 这对应于 5-6 mw 目标下的激光功率。
- 设置 4 (或更多) 的线平均值, 以提高信噪比。
- 切片和玻璃微移液器的定位及化合物的局部应用
- 将蠕动泵连接到记录室, 30分钟后才开始录音。用50毫升的超纯水清洗整个灌注系统后, 在不断的碳化条件下, 用玻璃烧杯中包含的 acsf (50 毫升) 开始记录室的灌注。在整个实验过程中, 使用内联微加热器或 peltier 加热器将循环 acsf 保持在32°c。
请注意:设计了一种具有顶部和底部灌注的特定灌注室, 以优化切片两侧的氧合。灌注室由两个完美拟合的部分组成, 它们之间拉伸了一个聚酰胺网 (图 2a. b)。与其他类型的室相比, 切片直接放置在玻璃覆盖板上, 这个腔体减少了切片底部的神经元死亡, 提高了生存能力, 并减少了其肿胀引起的切片运动。 - 使用广口一次性转移移液器, 将被成像的大脑切片转移到 acsf 烧杯上, 以取出镜头纸, 让它下沉 (作为没有气泡连接的证据), 并将其转移到记录 (灌注) 室。
- 将切片支架 (由铂金制成的发夹, 由两个分支由平行尼龙螺纹连接) 放置在切片上, 以最大限度地减少由于灌注流而导致的切片运动。
- 使用明亮的字段照明, 使用低放大倍率目标 (5倍或 10倍), 以目标定位感兴趣的大脑区域 (曝光时间:50 至80毫秒)。切换到较高的放大倍率 (25 x 与 0.35 x 镜头) 水浸没目标, 并调整位置。
请注意:避免将图像字段靠近切片支架的尼龙线, 因为它们会阻挡光线并在本地变形切片。确保感兴趣的区域是平坦的。如有必要, 请取出切片支架, 以便重新定位切片和/或切片支架。 - 使用荧光照明定位要在野外成像的荧光微胶质细胞 (曝光时间: 250-500 毫秒)。
请注意:这一步使研究人员能够检查感兴趣区域中是否存在细胞及其荧光强度, 并控制细胞碎片的数量。 - 用 atp、5-ht 或最后浓度感兴趣的药物将移液器填充10μl 的 acsf。将尖端向下, 轻轻摇晃充满毒品的移液器, 以去除任何被困在尖端的气泡。
请注意:如果要注入的溶液倾向于形成气泡, 请考虑使用带有内部灯丝的硼硅酸盐移液器。即使在注射之前, atp 从移液器中泄漏也会吸引微胶质过程 (如果发生这种情况, 在分析步骤中就会可见)。虽然这应该是适度的以 atp 浓度使用 (500μmol ·l-1), 如果有问题, 请考虑在步骤4.2.6 上添加 atp (或其他化合物) 溶液之前, 先将微移液器预填2毫升的 acsf。 - 将填充的移液器安装在移液器支架中, 用透明的管道连接到5毫升注射器上, 柱塞位于5毫升位置。移液器支架本身安装在一个三轴微型机械手上。
- 在明亮的字段照明下, 使用微机械手将移液器放置在场的中心。要获得可重现和最佳的居中, 请显示和使用图像上的标尺。
- 将移液器轻轻朝切片下, 同时控制和调整目标, 直到移液器尖端轻轻接触到切片表面。一旦看到所接触的切片, 就停止移液器的下降, 使移液器尖端能够穿透切片表面的80-100 微米 (见图 3b)。
- 调整激光 (请参见上面的参数), 并将显微镜切换到多光子模式。确保从任何光源 (例如计算机屏幕) 对腔体进行屏蔽。打开非脱壳探测器并设置增益。使用带有颜色编码上限的查找表 (lut), 以避免图像中的像素饱和。
- 确定要成像的切片的厚度 (即可检测荧光的上、下 z 位置 [通常在220至290微米之间])。
请注意:在切片的表面, 与切片的内部相比, 过程的密度增加, 可能还有微胶质细胞的密度, 通常具有不寻常的形态。随着时间的推移, 这种积累将更加引人注目(即在最后一个过程中比在第一个被成像的大脑切片中更明显)。因此, 在前 ~ 30μm 中的 z 平面不应用于分析, 甚至可以跳过进行采集。 - 开始记录总持续时间为 30分钟 (或更多 (如果需要), 并在5分钟基线之后, 在本地应用要测试的化合物 (不中断成像)。为此, 请慢慢按下连接到微移液器的注射器柱塞, 从5毫升到 1 ml 位置 (约 5秒)。按压柱塞时必须立即感觉到阻力。否则, 提示可能会被破坏。
请注意:对于受过训练的实验者, 这种方法的注射是可重复的, 但对于注射器的手动操作, 移液器可以连接到自动压力喷射系统, 以便更好地控制交付的体积。注射在注射部位会造成切片的物理变形。这种失真在注射后的前两到三个图像中是后验可见的, 但在第四张图像上不应可见, 即注射后 8分钟)。如果它仍然存在, 请考虑更改移液器制备的参数。 - 在采集结束时 (30分钟), 丢弃微移液器并取出切片。如果需要, 请修复切片以进一步进行免疫标记。例如, 通过对星期日拍摄方法进行了优化, 以确定和染色厚片 23。
- 在开始拍摄新切片之前, 制作2d 影片 (第5.1 节), 以检查微胶质细胞是否具有正常形态并正在移动, 从而确保切片正常运行。
- 将蠕动泵连接到记录室, 30分钟后才开始录音。用50毫升的超纯水清洗整个灌注系统后, 在不断的碳化条件下, 用玻璃烧杯中包含的 acsf (50 毫升) 开始记录室的灌注。在整个实验过程中, 使用内联微加热器或 peltier 加热器将循环 acsf 保持在32°c。
5. 微胶质过程吸引力分析
-
二维投影和漂移校正
- 打开该文件 (。lif) 与斐济24。
- 如有必要, 仅使用感兴趣的 z 平面进行子堆栈 (image\ stacks\ tootss自身)。例如, 如果已获取与切片表面相对应的 z 平面, 但不用于分析 (请参阅4.2.11 的说明) 和没有荧光的最深 z 平面。最终堆栈通常包含 90-110 z 片 (180-220 微米)。
- 启动z 项目函数 (image/stacksssz 项目"), 并选择"最大强度投影类型 ", 以使在每个时间点获得的 z 堆栈的投影。
- 启动"多斯塔克瑞格" 插件(插件/注册/多堆叠), 选择"操作 1: 对齐和转换: 刚体" 以纠正在采集过程中可能发生的轻微漂移。将此2d 影片另存为新文件 (. tiff)。
-
数据处理
- 打开这个新文件与 "冰25"。
- 绘制直径为35μm 的圆形r1感兴趣区域 (roi), 以注射部位为中心 (主要由移液器的阴影和注射时产生的变形来识别)。
- 使用插件roi 强度演化,测量 r1 中的平均强度。
- 将结果保存到。文件。
-
结果的量化和表示
- 要量化随着时间的推移的微胶质反应, 确定在每个时间点
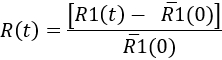
Here,'R1(0) 是注入前 R1(t) 值的平均值。然后, 结果可以表示为微胶质反应的动力学, 也可以表示为特定时间点 (见图 7)。
- 要量化随着时间的推移的微胶质反应, 确定在每个时间点
Access restricted. Please log in or start a trial to view this content.
结果
该协议描述了一种方法, 以诱导, 观察和量化定向生长的微胶质过程向局部应用的化合物, 例如 atp 或 5-ht, 急性脑切片从年轻或成人 (至少两个月) 小鼠。在有助于将成年动物的大脑切片保持在健康状态数小时的因素中, 使用了两个工具, 旨在在协议的两个步骤中优化细胞存活率。首先, 接口腔中的界面片支架 (图 1) 改善了切割后切片的保存。其次, 记录?...
Access restricted. Please log in or start a trial to view this content.
讨论
急性脑片通过保持一种结构完整性和有限的网络调整, 与离解或有机切片培养不同, 使研究人员能够在其生理环境中研究微胶质细胞。然而, 其中一个主要的限制是, 切片程序造成的伤害, 可以迅速损害神经元的生存能力, 特别是在成人大脑。由于微胶质细胞对细胞损伤的反应特别严重, 因此尽可能地限制神经元细胞死亡以保持微胶质细胞接近其生理状态是很重要的。这反过来又通过良性循环有助于
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
我们感谢穆林研究所的细胞和组织成像设施, 在那里进行了所有的图像采集和分析。这项工作得到了国家科学研究中心、国家研究和研究研究所、索邦大学科学研究所以及索邦大学-皮埃尔·玛丽·居里大学赠款的部分支持 (emargemce-upmc 方案, Recherche sur le cerveau 基金会, 法国基金会, "equipe frm deq2010" 基金会, 法国研究部 (国家研究机构, Recherche)anr-17-ce16-008 和 "bio-psy labex" anr-11-idex-000-02) 和计算神经科学方案合作研究, 国家科学基金会/法国国家研究机构 (编号: 1515686)。所有作者都附属于巴黎神经科学学院 (enp) 和 bio-psy labex 的研究小组。f. e. 是法国巴黎 f-75005 索邦大学附属博士生, 由 bio-psy labex 资助。v. m. 是由法国国家科学基金会/法国国家研究机构计算神经科学合作研究项目资助的博士后研究员 (编号: 1515686)。提交人感谢参与启动该项目的 marta kolodziejczak。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| for pipettes preparation | |||
| Clark Borosilicate Thin Wall Capillaries | Harvard Apparatus | 30-0065 | Borosilicate Thin Wall without Filament, 1.5 mm OD, 1.17 mm ID, 75 mm L , Pkg. of 225 |
| DMZ Universal Puller | Zeitz Instrumente | ||
| Name | Company | Catalog Number | Comments |
| for solutions | |||
| Calcium Chloride dihydrate (CaCl2) | Sigma | C5080 | |
| Choline Chloride | Sigma | C7527 | |
| D-(+)-Glucose | Sigma | G8270 | |
| L-Ascorbic acid | Sigma | A5960 | |
| Magnesium Chloride solution 1 M (MgCl2) | Sigma | 63020 | |
| Potassium chloride SigmaUltra >99.0% (KCl) | Sigma | P9333 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium Chloride (NaCl) | Sigma | S5886 | |
| Sodium phosphate monobasic | Sigma | S5011 | |
| Sodium pyruvate | Sigma | P2256 | |
| Ultrapure water | MilliQ | for all the solutions | |
| Name | Company | Catalog Number | Comments |
| for slice preparation | |||
| 2x 200 mL crystalizing dishes | |||
| 80 mL Pyrex beaker | |||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For mice perfusion and 2-photon chamber perfusion (aCSF) |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | ||
| Dolethal | Vetoquinol | Dolethal 50 mg/mL | |
| Filter papers (Whatman) | Sigma | WHA1001042 | Whatman qualitative filter paper, Grade 1 (Pore size: 11µM) |
| Fine Scissors - Sharp | Fine Science Tools | 14060-60 | |
| Food box 10 cm diameter, 8 cm Height | |||
| glue (ethyl cyanoacrylate) | Loctite | super glue 3 power flex | |
| Hippocampal Tool (spatula) | Fine Science Tools | 10099-15 | The largest extremity has to be angled at 90° |
| Ice | |||
| Iris Forceps (curved) | Moria | MC31 | |
| Lens cleaning tissue | THOR LABS | ||
| Nylon mesh strainer | diameter 7 cm | ||
| Razor blades | Electron Microscopy Sciences | 72000 | For the slicer |
| scalpel blade | |||
| Slice interface holder | home-made, the file for 3D printing is provided in Supplemental Material | ||
| Surgical Scissors - Sharp | Fine Science Tools | 14002-14 | |
| Vibrating slicer | Thermo Scientific | 720-2709 | Model: HM 650V (Vibrating blade microtome) |
| Water bath | Set at 32 °C (first recovery step) | ||
| Name | Company | Catalog Number | Comments |
| for slice imaging | |||
| × 25 0.95 NA water-immersion objective | Leica Microsystems (Germany) | HCX Irapo | |
| 2-photon MP5 upright microscope with resonant scanners (8 kHz) and two HyD Hybrid detectors | Leica Microsystems (Germany) | ||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For 2-photon chamber perfusion with aCSF |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | I1501L50R2A001 | |
| Chameleon Ultra2 Ti:sapphire laser | Coherent (Germany) | ||
| disposable transfer pipettes , wide mouth | ThermoFischer scientific | for example : 232-11 | 5.8 mL with fin tip, but we cut it (approx 7 cm) to have a 4 mm diameter mouth |
| emission filter SP680 | Leica Microsystems (Germany) | ||
| fluorescent cube containing a 525/50 emission filter and a 560 dichroic filter (for fluorescence collection) | Leica Microsystems (Germany) | ||
| glass beaker with 50 mL of ACSF to maintain constant perfusion of the slice | |||
| Heating system | Warner Instrument Corporation | Automatic Heater Controller TC-324B | to maintain perfusion solution at 32 °C |
| perfusion chamber | home-made, the file for 3D printing is provided in Supplemental Material | ||
| slice holder ("harp") | home made : hairpin made of platinum with the two branches joined by parallel nylon threads | ||
| Name | Company | Catalog Number | Comments |
| for slice stimulation | |||
| Adenosine 5′-triphosphate disodium salt hydrate (ATP) | Sigma | A-26209 | to be prepared ex-temporaneously : 1 mg/mL (3 mM) stock solution prepared the day of the experiment, kept at 4 °C (a few hours) and diluted just before use |
| Fluorescein (optional) | Sigma | F-6377 | use at 1 µM final |
| Micromanipulator | Luigs and Neumann | SM7 | connected to the micropipette holde |
| Micropipette holder | same as for eletrophysiology | ||
| Serotonin hydrochloride | Sigma | H-9523 | aliquots of 50mM stock solution in H20 kept at -20 °C. 500 µM solution prepared the day of the experiment. |
| Syringe 5 mL (without needle) | Terumo medical products | SS+05S1 | |
| Transparent tubing | Fischer Scientific | 11750105 | Saint Gobain Performance Plastics™ Tygon™ E-3603 Non-DEHP Tubing |
| Name | Company | Catalog Number | Comments |
| for image analysis | |||
| Fiji | https://fiji.sc | Schindelin, J. et al Nat. Methods (2012) doi 10.1038 | |
| Icy | Institut Pasteur | http://icy.bioimageanalysis.org | de Chaumont, F. et al. Nat. Methods (2012) |
| Name | Company | Catalog Number | Comments |
| mice | |||
| CX3CR1-GFP mice | Jung et al, 2000 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. | |
| CX3CR1creER-YFP mice | Parkhurst et al 2013 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. |
参考文献
- Salter, M. W., Stevens, B. Microglia emerge as central players in brain disease. Nature Publishing Group. 23 (9), 1018-1027 (2017).
- Tay, T. L., Savage, J., Hui, C. W., Bisht, K., Tremblay, M. -È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. , (2016).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Dissing-Olesen, L., et al. Activation of neuronal NMDA receptors triggers transient ATP-mediated microglial process outgrowth. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10511-10527 (2014).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. Journal of Biological Chemistry. 288 (21), 15291-15302 (2013).
- Eyo, U. B., et al. Neuronal hyperactivity recruits microglial processes via neuronal NMDA receptors and microglial P2Y12 receptors after status epilepticus. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10528-10540 (2014).
- Hristovska, I., Pascual, O. Deciphering Resting Microglial Morphology and Process Motility from a Synaptic Prospect. Frontiers in Integrative Neuroscience. 9, 1231(2016).
- Avignone, E., Lepleux, M., Angibaud, J., Nägerl, U. V. Altered morphological dynamics of activated microglia after induction of status epilepticus. Journal of Neuroinflammation. 12, 202(2015).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biology. 14 (5), e1002466(2016).
- Madry, C., et al. Microglial Ramification, Surveillance, and Interleukin-1β Release Are Regulated by the Two-Pore Domain K+Channel THIK-1. Neuron. 97 (2), 299-312 (2018).
- Honda, S., et al. Extracellular ATP or ADP induce chemotaxis of cultured microglia through Gi/o-coupled P2Y receptors. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 21 (6), 1975-1982 (2001).
- Haynes, S. E., et al. The P2Y12 receptor regulates microglial activation by extracellular nucleotides. Nature Neuroscience. 9 (12), 1512-1519 (2006).
- Wu, L. -J., Vadakkan, K. I., Zhuo, M. ATP-induced chemotaxis of microglial processes requires P2Y receptor-activated initiation of outward potassium currents. Glia. 55 (8), 810-821 (2007).
- Kolodziejczak, M., et al. Serotonin Modulates Developmental Microglia via 5-HT 2BReceptors: Potential Implication during Synaptic Refinement of Retinogeniculate Projections. ACS Chemical Neuroscience. 6 (7), 1219-1230 (2015).
- Schafer, D. P., et al. Microglia Sculpt Postnatal Neural Circuits in an Activity and Complement-Dependent Manner. Neuron. 74 (4), 691-705 (2012).
- Pfeiffer, T., Avignone, E., Nägerl, U. V. Induction of hippocampal long-term potentiation increases the morphological dynamics of microglial processes and prolongs their contacts with dendritic spines. Scientific Reports. 6, 32422(2016).
- Parkhurst, C. N., et al. Microglia Promote Learning-Dependent Synapse Formation through Brain-Derived Neurotrophic Factor. Cell. 155 (7), 1596-1609 (2013).
- Wu, Y., Dissing-Olesen, L., Macvicar, B. A., Stevens, B. Microglia: Dynamic Mediators of Synapse Development and Plasticity. Trends in Immunology. 36 (10), 605-613 (2015).
- Ohsawa, K., et al. P2Y12 receptor-mediated integrin-beta1 activation regulates microglial process extension induced by ATP. Glia. 58 (7), 790-801 (2010).
- Kurpius, D., Wilson, N., Fuller, L., Hoffman, A., Dailey, M. E. Early activation, motility, and homing of neonatal microglia to injured neurons does not require protein synthesis. Glia. 54 (1), 58-70 (2006).
- Stence, N., Waite, M., Dailey, M. E. Dynamics of microglial activation: a confocal time-lapse analysis in hippocampal slices. Glia. 33 (3), 256-266 (2001).
- Dissing-Olesen, L., Macvicar, B. A. Fixation and Immunolabeling of Brain Slices: SNAPSHOT Method. Current Protocols in Neuroscience. 71, 1.23.1-12 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- Aitken, P. G., et al. Preparative methods for brain slices: a discussion. Journal of Neuroscience Methods. 59 (1), 139-149 (1995).
- Paris, I., et al. ProMoIJ: A new tool for automatic three-dimensional analysis of microglial process motility. Glia. 66 (4), 828-845 (2018).
- Pagani, F., et al. Defective microglial development in the hippocampus of Cx3cr1 deficient mice. Frontiers in Cellular Neuroscience. 9 (229), 111(2015).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. , Clifton, NJ. 221-242 (2014).
- Mainen, Z. F., et al. Two-photon imaging in living brain slices. Methods. 18 (2), San Diego, CA. 231-239 (1999).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Gyoneva, S., et al. Systemic inflammation regulates microglial responses to tissue damage in vivo. Glia. 62 (8), 1345-1360 (2014).
- Heindl, S., et al. Automated Morphological Analysis of Microglia After Stroke. Frontiers in Cellular Neuroscience. 12, 106(2018).
- Dailey, M. E., Eyo, U., Fuller, L., Hass, J., Kurpius, D. Imaging microglia in brain slices and slice cultures. Cold Spring Harbor Protocols. 12 (12), 1142-1148 (2013).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。