A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שני הפוטונים הדמיה של תהליכים Microglial המשיכה לכיוון ATP או סרוטונין המוח חריפה פרוסות
* These authors contributed equally
In This Article
Summary
מיקרוגלייה, תאים חיסוניים תושב של המוח, להגיב במהירות עם שינויים מורפולוגיים שינויים של סביבתם. פרוטוקול זה מתאר כיצד להשתמש מיקרוסקופ שני הפוטונים כדי לחקור את המשיכה של תהליכים microglial לכיוון סרוטונין או ATP פרוסות המוח חריפה של עכברים.
Abstract
Microglial תאים הם תושב מולדת תאים חיסוניים של המוח ללא הרף לסרוק את הסביבה שלהם עם תהליכים ארוכים שלהם, על הפרעה של הומאוסטזיס, עוברים שינויים מורפולוגיים מהירה. לדוגמה, פצע הלייזר גורם בעוד כמה דקות גידול מונחה של תהליכים microglial, נקרא גם "תנועתיות כיוונית", לכיוון האתר של פציעה. ניתן להשיג אפקט דומה על-ידי אספקת מקומית ATP או סרוטונין (5-hydroxytryptamine [5-HT]). במאמר זה, אנו מתארים פרוטוקול לזירוז גידול כיוונית של תהליכים microglial לקראת יישום מקומי של ATP או 5-HT-פרוסות המוח חריפה של עכברים צעירים וכדי תמונה משיכה זו לאורך זמן על ידי מיקרוסקופ multiphoton. שיטה פשוטה של כימות עם תוכנת ניתוח תמונות בחינם, קוד פתוח מוצע. אתגר המאפיינת עדיין פרוסות המוח חריפה זה הזמן מוגבל, יורד עם הגיל, במהלכו התאים ישארו במצב פיזיולוגי. פרוטוקול זה, לפיכך, מדגיש כמה שיפורים טכניים (חדר בינוני, אוויר נוזלי ממשק, הדמיה קאמרית עם זלוף כפול) שמטרתם ייעול הכדאיות של תאים microglial על פני מספר שעות, במיוחד בפרוסות של עכברים בוגרים.
Introduction
Microglial תאים מקרופאגים תושב של המוח, לשחק תפקיד שני מצבים פיזיולוגיים ופתולוגיים1,2. הם יש מורפולוגיה מסועף מאוד ואני כל הזמן הארכת, היציבה שלהם3,של תהליכים4. זו התנהגות "סריקה" הוא האמין להיות קשורים צורך הסקר של סביבתם. הפלסטיות מורפולוגי של מיקרוגלייה מתבטאת בשלושה מצבים. ראשית, תרכובות מסוימות במהירות לווסת את microglial מורפולוגיה: התוספת של ATP5,6 או5,NMDA7 במדיום רחצה פרוסות המוח חריפה מגביר את המורכבות של השלכות microglial, ואילו נוראדרנלין מקטין אותה6. תופעות אלה הן ישירות מתווך על ידי קולטנים microglial (עבור ATP ונוראפינפרין) או לדרוש שחרור ATP של נוירונים (עבור NMDA). שנית, מהירות הצמיחה, הכחשה של תהליכים microglial, שנקרא תנועתיות או "מעקב", יושפעו על-ידי גורמים חוץ-תאית8, הומאוסטזיס שיבושים9,10או מוטציות9, 10,11. שלישית, שבנוסף לשינויים איזוטרופיות הללו של חיות וצורות מיקרוגלייה יש את היכולת להרחיב את תהליכי שלהם directionally לכיוון פיפטה אספקת ATP3,5,12, 13 , 14, בתרבות, פרוסות המוח חריפה או ויוו, או מתן 5-HT-במוח חריפה פרוסות15. כזה הצמיחה אוריינטציה של תהליכים microglial, הנקרא גם תנועתיות כיוונית, תוארה לראשונה בתגובה המקומית לייזר הנגע3,4. לכן, מבחינה פיזיולוגית, זה ייתכן הקשורים התגובה לפגיעה או נדרש מיקוד microglial תהליכים לכיוון הסינפסות או אזורים במוח הדורשים גיזום במהלך פיתוח15,16, או פיזיולוגיות17 ,18,19 -מצבים פתולוגיים9,18,19,20 בבגרות. שלושת סוגי שינויים מורפולוגיים להסתמך על מנגנונים תאיים שונים11,13,20, מתחם נתון אחד לא בהכרח לווסת את כולן (למשל, NMDA, אשר פועל בעקיפין על מיקרוגלייה, יש השפעה על מורפולוגיה אבל לא לגרום תנועתיות כיוונית5,7). לכן, כאשר, במטרה לאפיין את ההשפעה של תרכובת, מוטציה או פתולוגיה על מיקרוגלייה חשוב לאפיין את שלושת המרכיבים של פלסטיות מורפולוגית שלהם. כאן, אנו מתארים שיטה ללמוד את צמיחת microglial תהליכים לכיוון מקור מקומי של המתחם, אשר, כאן, ATP או 5-HT-כיוונית.
ישנם מספר מודלים ללמוד משיכה מיקרוגלייה תהליכים: תרבויות ראשי בסביבה תלת-ממד6,18,19, המוח חריפה פרוסות6,13,15, וב -vivo הדמיה3,13. הגישה ויוו הוא הטוב ביותר כדי לשמר את מצב פיזיולוגי מיקרוגלייה. עם זאת, intravital הדמיה של אזורים עמוקים דורש הליכים כירורגיים מורכבים, לכן לעיתים קרובות מוגבל לשכבות קורטיקלית שטחית. השימוש מיקרוגלייה התרבות העיקרית היא הטכניקה הפשוטה ביותר לבדוק מספר רב של מצבים עם מספר מצומצם של בעלי חיים. בכל זאת, זה אפשרי להשיג המורפולוגיה תא אותו כמו vivo, תאים לאבד את יחסי הגומלין פיזיולוגיים נוירונים, האסטרוציטים. פרוסות המוח חריפה מייצגים מעין פשרה בין שתי גישות אלה. דגם זה מאפשר לחוקרים ללמוד מבנים במוח אשר אחרת קשה להגיע, כדי תמונה עם רזולוציה גבוהה ויוו, וכדי לחקור פרוסות שלבים neonatal, ואילו טראנס מיקרוסקופית מבוצע בעיקר-לבגרות. בסופו של דבר, זה מאפשר להתבונן בזמן אמת את ההשפעות של סמים מקומי יישום, וכדי לחזור על ניסויים תוך שימוש במספר מצומצם של בעלי חיים. למרות זאת, בעיה עם פרוסות המוח חריפה זה הזמן מוגבל (מספר שעות) במהלכו התאים נשארים בחיים, ובמיוחד עבור פרוסות של עכברים שגילן עולה על שבועיים, ואת השינוי פוטנציאליים מיקרוגלייה מורפולוגיה של מעל הזמן21,22 .
כאן, אנו מתארים את פרוטוקול להכין פרוסות המוח חריפה של צעירים ומבוגרים Cx3cr1GFP / + עכברים זקנים, עם שימור מיקרוגלייה וצורות למשך מספר שעות עד חודשיים. ואז, נתאר כיצד להשתמש פרוסות אלה ללמוד האטרקציה של תהליכים microglial לכיוון תרכובות כמו ATP או 5-HT.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל ניסויים אושרו על-ידי הוועדה המקומית אתית (דרווין הוועדה, הסכמי #1170, #10921).
1. הכנת Micropipettes זכוכית עבור יישום מקומי של תרכובות
- להכין פיפטות מ בורוסיליקט נימים דק-קיר זכוכית עם פולר אלקטרודה. כוונן את הפרמטרים כדי להשיג פיפטות בקוטר 4-5 מיקרומטר ב ממעמדם. איור דו-ממדי מציג פיפטה אחד brightfield בהגדלה נמוכה.
2. פתרונות
- ודא את כלי זכוכית היחיד זה נוקה על ידי מחזור החיטוי, ואחריו השטיפה x 2 - 3 x עם מים הנדסה גנטית, ייעשה שימוש. אף פעם לא השתמש זכוכית שהיה במגע עם paraformaldehyde.
-
להכין את mol· 2 L-1 2 CaCl פתרון מניות על ידי המסת 14.7 מ"ג CaCl2·2H2O ב- 50 מיליליטר מים של טוהר גבוהה (מים הנדסה גנטית, התנגדות 18.2 MΩ; את שאריות מתכת מים מזוקקים או מי ברז יכול להוביל פרוסה שיוצרת איכות תופיפצה אפקטים pro-חמצוני).
- חנות פתרון מניות זה בטמפרטורת החדר במשך חודש לכל היותר.
-
ביום של הניסוי, להכין 1 ליטר של פתרון כולין-כלנית חדד (נוזל מוחי שדרתי מלאכותי), קומפוזיציה של מי הוא 110 mmol· כולין-1 L קלרנית, 25 mmol· L-1 גלוקוז, 25 mmol· L-1 NaHCO3, 7 mmol· L-1 MgCl2, 11.6 mmol· L חומצה אסקורבית-1 , 3.1 mmol· L-1 נתרן פירובט, 2.5 mmol· L-1 אשלגן כלורי, 1.25 mmol· 2PO NaH-1 L4ו- 0.5 mmol· L-1 CaCl2, 0.5.
- כדי להכין פתרון זה, להוסיף, לפי הסדר הבא, אל בקבוק 1 ליטר בוגר: g 0.186 של אשלגן כלורי, 0.195 גר' NaH2PO4, 2.04 g של חומצה אסקורבית, g 2.1 של NaHCO3ו- 4.5 גר' גלוקוז.
- למלא בערך חצי נפח סופי עם הנדסה גנטית מים ומערבבים עד התפרקות מוחלטת.
- הוסף 0.34 g של פירובט נתרן ו- g 15.36 של כולין Cl.
הערה: זה נוח יותר התמוססות הראשון כולין Cl עם 5-10 מ"ל של הפתרון מוכן בשלב 2.3.2 לפני הוספתם הפתרון השלם. - להוסיף 7 מ ל 1 mol· L-1 MgCl2 ו- 250 µL של 2 mol· L-1 CaCl2 (להכין בשלב 2.2) לפתרון.
- למלא את הבקבוק הדרגתי עד 1 L במים הנדסה גנטית.
- עם osmometer לחץ אדים, בדוק osmolarity בין mΩ 300 ו- 310. אם לא, להתאים אותו עם גלוקוז.
- בדוק את ה-pH לאחר carbogenation (קרי, מבעבעים עם "carbogen", שילוב של 95% או2/5% CO2) ולהתאים אותו, אם יש צורך, 7.3-7.4 עם 10 M NaOH.
- העברת הפתרון לבקבוק זכוכית לאחסון. לשמור את הבקבוק במקרר עד לשימוש (שלב 3.1).
הערה: מומלץ להכין פתרון טרי ביום של הניסוי. עם זאת, במידת הצורך, כולין-כלנית חדד ניתן לאחסן יומיים ב 4 º C.
-
ביום של הניסוי, להכין 1 ליטר של פתרון כלנית חדד, קומפוזיציה של מי הוא 124 mmol· L-1 NaCl, 26.2 mmol· L-1 NaHCO3, 25 mmol· L-1 גלוקוז, 2.5 mmol· L-1 אשלגן כלורי, 2 mmol· L-1 CaCl2, 1 mmol· MgCl-1 L2ו- 1.25 mmol· L-1 NaH2PO4.
- כדי להכין פתרון זה, להוסיף, לפי הסדר הבא, אל בקבוק בוגר: g 0.150 NaH2PO4, g 0.186 של אשלגן כלורי, 2.2 גר' NaHCO3, 4.5 גר' גלוקוז ו- 7.3 גרם של NaCl. להביא את הפתרון נפח של 1 ליטר עם הנדסה גנטית מים ומערבבים אותו נמרצות על צלחת מערבבים.
- להוסיף 1 מ"ל של 1 mol· L-1 MgCl2 ו- 1 מ"ל של 2 mol· L-1 CaCl2 פתרון, העברת הפתרון חנה המבר לבקבוק זכוכית לאחסון.
- לבדוק אם osmolarity mΩ· 300-310 L-1 , אם לא, להתאים אותו עם גלוקוז.
- בדוק את ה-pH לאחר carbogenation (קרי, מבעבעים עם "carbogen") ולהתאים אותו, אם יש צורך, 7.3-7.4 עם 10 M NaOH.
- העברת הפתרון לבקבוק זכוכית לאחסון. לשמור את הבקבוק במקרר עד לשימוש (שלב 3.1).
הערה: מומלץ להכין פתרון טרי ביום של הניסוי. עם זאת, דרך חלופית היא להכין 10 x מניות לאודנום2PO NaCl,3NaHCO, אשלגן כלורי, ו NaH4 -10 x הריכוז הסופי, שבו ניתן לאחסן במשך שבוע אחד לא יותר מ- 4 מעלות צלזיוס. להפוך את חנה המבר הסופי ביום של הניסוי על-ידי דילול הפתרון מניות 10 x עם הנדסה גנטית מים והוספת של גלוקוז, CaCl2ו MgCl2.
- הכינו את הפתרונות סמים ביום של הניסוי. השימוש הפתרון חנה המבר להביא להם ריכוזי הסופי אשר, כאן, 500 µmol· L-1 עבור ATP ו- 5 µmol· L-1 עבור 5-HT.
הערה: עבור ATP, ניתן להכין פתרון מניות (למשל, 50 מ מ ATP במים), המאוחסנים בצורה aliquoted ב-20 ° C, מדולל עם חנה המבר לריכוז סופי ביום של הניסוי. לעומת זאת, הפתרון 5-HT (סרוטונין-HCl) חייב להיות שהוכנו אבקת ביום של הניסוי, ב- 1 mg·mL-1 במים, שמרו ב 4 ° C כדי למנוע חמצון 5-HT, מעורבבת עם חנה המבר בזמנו של הניסוי.
3. הכנת פרוסות המוח חריפה
-
הכנת האזור לנתיחה
- להכין 70 מ של קרח כולין-חנה המבר בתוך 80 מ ל הניח על קרח, כדי לשמש עבור הלב זלוף, צינון מהיר של המוח ו חותך. להכין 150 מ ל כולין-כלנית חדד ב 200 מ ל, התגבשות המנה, מניחים באמבט מים מחומם ומתוחזק על 32 מעלות צלזיוס. מניחים מסננת רשת ניילון בצלחת crystallizing לשמר את הפרוסות. זה ישמש כדי לאפשר את הפרוסות לשחזר למשך 10 דקות רק לאחר בציעת.
- לפחות 30 דקות לפני שמתחילים את הקרע (סעיף 3.2), להתחיל מבעבעים שני פתרונות אלו (70 מ של כולין-כלנית חדד על קרח), 150 מ ל כולין-כלנית חדד ב 32 ° C עם carbogen. לשמור על carbogenation קבועה במהלך ההליך כולו.
- הכן את התקן קאמרית ממשק (איור 1C), אשר ישמש לשמור על פרוסות עד השימוש שלהם.
- במקום מזון אטום תיבה (10 x 10 ס"מ או 10 ס"מ בקוטר 8 ס"מ גובה), מותקן על פגים, 200 מ ל, התגבשות צלחת עם בר מגנט.
- מוסיפים 200 מ של חנה המבר זה מאכל crystallizing, מקום בעל פרוסה ממשק 3D מודפס על גבי זה (בעל ממשק פרוסה מורכב משני לחלוטין התאמת חלקים, עם רשת פוליאמיד נמתח ביניהם, איור 1A, B).
- להסיר עודף נפח מתוך קערה crystallizing לשמור רק בשכבה דקיקה של הפתרון מכסה את רשת השינוי של בעל ממשק פרוסה. פעולה זו תיצור מאוחר יותר של rim בסדר של הפתרון המקיף את הפרוסות (אך ללא כיסוי אותם).
- לשים כמה מילימטרים של חנה המבר בתחתית תיבת האוכל ולהתחיל מבעבע זה עם carbogen (בשימוש הראשון, עושים חור קטן בתוך הקיר תיבת האוכל אטום כדי לוודא הצנרור באפשרותך להזין בתיבת).
- סגור את תיבת אטום תוך שמירה על carbogenation קבועה. פעולה זו תיצור humidified 95% O2/5% CO2 עשיר סביבה שבה הפרוסות להיות מועברים לאחר ההחלמה שלהם בכולין-חנה המבר ומתוחזק לפני שהם נמצאים עם תמונה. מכשיר זה הוא ןלהל תא"ממשק" (איור 1C).
-
ניתוח מוחי וחלוקת
- עזים ומתנגד את העכבר עם זריקה בקרום הבטן של mg·mL 50-1 פנטוברביטל (0.15 מ ל/20 גרם של משקל הגוף העכבר), לשתק אותו, לחשוף את הלב, ולבצע זלוף לב עם 10 מ"ל של קר כקרח, carbogenated, כולין-כלנית חדד (ראה שלב 3.1.1), עם משאבה סחרור. לבחון את חיוורון של הכבד כמחוון של זלוף טוב. זלוף נמשך פחות מ 5 דקות.
- לערוף את העכבר, לחתוך את העור כדי לחשוף את הגולגולת. עם מספריים גדולים, להחיל שני חתכים חציה של נקב גדול, ביתור הסאגיטלי זמן אחד, באמצעות מלקחיים בסדר, להסיר את הלוחות הגולגולת.
- במהירות ובעדינות לחלץ את המוח (ב פחות מ 1 דקות) ומניחים אותו על 1 דקות במיכל 80 מ ל המכיל את הנותרים (~ 60 מ"ל) קרה כקרח כולין-כלנית חדד (עדיין תחת carbogenation קבוע), כדי לקרר אותו.
- להעביר את המוח על גבי נייר סינון רטוב בעבר עם חנה המבר.
- לגזור המוח לפי האזור במוח עניין וזווית מועדף עם פרוסות. לדוגמה, לשיקוף התלמוס או ההיפוקמפוס על פרוסות הילתית, לחתוך עם סכין האזמל הקטן, ואז, על 2 מ מ מתוך הגפיים rostral, סימטרית של המוח.
הערה: זה חשוב להסיר חלקים במוח גם rostral או סימטרית גם כי קטן יותר לאזור כדי לקצץ לפני שהגיע האזור של עניין, מהר יותר לחתוך. סה כ זמן עם פרוסות (שלב 3.2.7) של פחות מ 20 דקות מומלץ. - עבור הילתית פרוסות, הצב, דבק (עם דבק cyanoacrylate) סימטרית הפנים של המוח על גבי 10 ס מ פטרי, מודבקים על הבלוק חיתוך של מילות הקסם רוטטת ומקם אותה בבית הבליעה מאגר של בפורס רוטטת, אשר ממוקם בחדר גדול יותר מלא קרח. לאחר מכן, למלא הפטרי כל הנותרים כקרח כולין-כלנית חדד.
- תוך שמירה מתמדת על 95% או2/5% CO2 מבעבעים של קר כקרח כולין-כלנית חדד, חותכים פרוסות הילתית מיקרומטר בעובי 300 (מהירות: 0.08 mm·s-1, רטט להב: 60 Hz, תנודות משרעת: 1 מ מ).
- לאסוף פרוסות המוח עם העברה חד פעמיות רחב-הפה (4 מ מ קוטר) פיפטה, אחד לאחר כל מעבר יחיד של הלהב, כדי למנוע ההצטברות של רכיבים רעילים שפורסמו על ידי הפריפריה של הפרוסות. לטפל כדי למנוע בועות אוויר במהלך ההעברה ולמקם כל פרוסה כולין-כלנית חדד-32 מעלות צלזיוס במשך כ- 10 דקות להתאוששות.
- עם העברת הפיפטה מניחים את הפרוסות על גבי חתיכות של ניקוי העדשה נייר עקף עם טיפה של כולין-כלנית חדד. האחות עודף של כולין-כלנית חדד, עם המרית, מניחים את הפרוסות, הניח על הרקמה לניקוי עדשות, על רשת השינוי לשכת ממשק המכיל כלנית חדד carbogenated בטמפרטורת החדר (ראו 3.1.3.5). תן את הפרוסה לשחזר בסביבה זו במשך לפחות 30 דקות.
הערה: אחרי זה, הפרוסות מוכנות, ניתן להשתמש עבור עכברים מיקרוגלייה הדמיה עבור עד 6 שעות אחרי החילוץ המוח הצעירים (פחות מבן חודש אחד) ועד 4 שעות אחרי החילוץ המוח ממבוגרים בת שני חודשים.
4. שני הפוטונים מיקרוסקופ
- הגדרת פרמטרים
- . אדליק את המערכת multiphoton (גלאי היברידית, לייזר, סורק, אפנן אלקטרו-אופטיים, מיקרוסקופ).
- לכוון את הלייזר-920 ננומטר, לבדוק כי הלייזר הוא נעול במצב, להגדיר את הכוח ב 5% - 15% ורווח ב-10%. זה מקביל כוח של 3-5 מגוואט תחת המטרה. ודא גלאי nondescanned עוסקים המסננים המתאימים פליטה ו עירור מותקן.
- הגדרת פרמטרים של תוכנת הדמיה בערכים הבאים: עבור גודל מסגרת, 1024 x 1024 פיקסלים שטח של 295.07 x 295.07 מיקרומטר; עבור מרחק מתצוגה, 2. אם האות רועש מאוד, להחיל ממוצע של קו 2. הדינמיקות פיקסל, להגדיר את תוכנת הדמיה ב 12 סיביות או יותר.
הערה: תמונות עם ערך מעט גבוה יותר מאפשרים להבחין בין הבדלים קטנים יותר עוצמת קרינה פלואורסצנטית מאשר תמונות עם ערך סיביות נמוך יותר: שינוי של אחד ערך האפור בתמונה 8 סיביות מתכתב לשינוי של ערכי אפור 16 ב 12 סיביות ושל 256 אפור ערכים אני n תמונה של 16 סיביות. לכן, תמונות סיביות גבוה יותר מתאימים יותר עבור ניתוח כמותי, אך גודלם גודלת עם עומק סיביות, קיבולת אחסון, מחשוב כוח יכול להיות הגבלת. - בחר את מצב סריקה XYZT עם מגוון Z-מרווח ב 2 מיקרומטר ו T-מרווח זמן של 2 דקות.
הערה: ה-x, y ו- z רזולוציה נקבעים על-ידי משפט הדגימה נייקוויסט. גודל Z-צעד סביב 0.8 יהיה אופטימלי לפתור תהליכים מיקרוגלייה (בקוטר של < 1 מיקרומטר), אך מגבילה רזולוציה אופטית של מיקרוסקופ multiphoton (ב- 920 nm עם יעד נה 0.95, הרזולוציה צירית היא בסביבות 1 מיקרומטר). בנוסף לכך במכשול פיזי, ב ניסוי הדמיית לחיות, היחס רגישות או אות לרעש, הרזולוציה, המהירות, והחומר תצפית סה כ זמן. אם ניקח בחשבון כל הפרמטרים הללו, z-שלב של 2 מיקרומטר (כמו אינספור מחקרים3,11,14), גודל תמונה של 1024 x 1024 פיקסלים של רכישת במהירות גבוהה משתמש בסורק תהודה מצמידים גלאי HyD (it לוקח בסביבות 15 s כדי לרכוש 50 z-תוכניות) נבחרו כאן. תדירות רכישות היא סדרת XYZT אחת כל 2 דקות והוא משך הפעילות הכולל 30 דקות. אם הסידור אינו רגיש מספיק, או מהיר, זה אפשרי להפחית את הרזולוציה לרוחב (עד 512 x 512) או את מספר הפרוסות-z (על ידי הדמיה באופן בלעדי z-עומק אשר מוצגים על ידי קרינה פלואורסצנטית החזק ביותר [קרי, לא את העמוק z-הפרוסות איפה הוא חלש]), או להקטין את המהירות של הסורק. ניתן להקטין את הרזולוציה צירית גם על ידי הגדלת את z-צעד עד מיקרומטר 3, אבל גם זה עשוי להשפיע כימות, כל ניסויים לצורך השוואה יש לבצע עם אותו z-השלב.
הערה: זה אפשרי לביצוע ניסויים דומים על פרוסות של עכברים CX3CR1creER-YFP18, קו עכבר להשתמש זירוז מחיקה גנטי מיקרוגלייה רק של-אילו מיקרוגלייה צורונים אקספרס צהוב חלבון פלואורסצנטי (YFP). עם זאת, רמת הביטוי של YFP נמוכה מאוד לעומת חלבון פלואורסצנטי ירוק (GFP) ב- CX3CR1GFP / + עכברים; לפיכך, הדמיה הוא אפשרי אך מאתגר ודורש אופטימיזציה של הפרמטרים רכישה. מומלץ להתאים אותם כדלקמן. - לכוון את הלייזר-970 nm (מה עדיף המותאמים YFP עירור מאשר 920 nm), הכוח ב 50%, ורווח ב-50%, המתאים כוח לייזר תחת המטרה של mW 5-6.
- הגדר ממוצע של קו 4 (או יותר) כדי לשפר את יחס אות לרעש.
- מיצוב של הפרוסה, את micropipette זכוכית, יישום מקומי של המתחם
- לחבר את משאבת סחרור לחדר ההקלטה, 30 דקות לפני תחילת ההקלטות. לאחר ניקוי המערכת זלוף שלם עם 50 מ של מים הנדסה גנטית, להתחיל את זלוף לשכת הקלטה עם כלנית חדד (50 מ"ל) הכלול גביע זכוכית תחת carbogenation קבוע. לאורך כל הניסוי, לשמור את חנה המבר במחזור 32 ° C עם microheater בתוך השורה או תנור Peltier.
הערה: תא זלוף ספציפי עם העליון והתחתון זלוף נועד לייעל את חמצון משני הצדדים של הפרוסה. תא זלוף מורכב משני לחלוטין התאמת חלקים, עם רשת פוליאמיד נמתח ביניהם (איור 2 א, ב'). לעומת סוגים אחרים של צ'יימברס, איפה הפרוסה ישירות הנחת coverslip של זכוכית, החדר הזה מפחית עצביים מוות בחלק התחתון של הפרוסה, משפר את יכולת הקיום, מפחית את התנועות פרוסה המושרה על ידי נפיחות שלה. - עם פיפטה העברה חד פעמיות רחב-הפה, להעביר את הפרוסה המוח לדימות כדי כשהספל חנה המבר כדי להסיר את הנייר עדשה, תני לזה לשקוע (כהוכחה כי אין בועת האוויר מחובר), ולהעביר אותו לחדר ההקלטה (זלוף).
- הצב בעל פרוסה (סיכת ראש עשוי פלטינה עם שני ענפי הצטרפו חוטי ניילון מקבילים) על הפרוסה כדי למזער את הפרוסה תנועה בשל הזרם זלוף.
- להשתמש את ההארה בהיר-שדה כדי להתמקד באזור המוח עניין (זמן החשיפה: 50 עד 80 ms) באמצעות מטרה הגדלה נמוכה (5 X או 10 X). עבור אל המטרה גבוה יותר של טבילה במים ההגדלה (25 x עם עדשה 0.35 x) ולאחר לכוונן את המיקום.
הערה: להימנע שדות תמונה קרובים חוטי ניילון של המחזיק פרוסה כפי שהם יכולים לחסום את האור באופן מקומי לעוות את הפרוסה. ודא כי האזור עניין הוא שטוח. במידת הצורך, הסר את המחזיק פרוסה כדי למקם מחדש את הפרוסה ו/או המחזיק פרוסה. - להשתמש את ההארה זריחה כדי לאתר תאים microglial פלורסנט השיקוף בשדה (זמן החשיפה: 250-500 ms).
הערה: שלב זה מאפשר לחוקרים לבדוק הנוכחות של תאים באזור של ריבית ושל עצמתם פלורסצנטיות, וכדי לשלוט עבור כמות פסולת הסלולר. - מילוי פיפטה עם 10 µL של חנה המבר עם ATP, 5-HT, או את התרופה עניין-הריכוז הסופי שלו. נקודת הקצה כלפי מטה וללחוץ בעדינות על פיפטה מלא סמים כדי להסיר את כל הבועות אוויר לכוד בקצה.
הערה: אם הפתרון כדי להיות מוזרק נוטה ליצור בועות, שקול להשתמש בורוסיליקט פיפטות עם הלהט הפנימי. דליפה של ATP מחוץ פיפטה יכול למשוך תהליכים microglial עוד לפני הזריקה (במקרה זה, ניתן לראות בשלב ניתוח). למרות זה צריך להיות מתון, ריכוז ATP המשמש (500 µmol· L-1), אם זה בעיה, שקול prefilling את micropipette עם 2 מ של חנה המבר לפני הוספת מ- ATP (או מתחם אחרת) פתרון שלב 4.2.6. - הר של פיפטה מלא ב בעל פיפטה, מחובר עם צינורות שקופים כדי מזרק 5 מ ל, עם פומפה ממוקם במיקום מ. המחזיק פיפטה עצמו הוא רכוב על micromanipulator שלושה צירים.
- תחת תאורה בהירים-שדה, השתמש micromanipulator את כדי למקם את פיפטה במרכז השדה. למרכוז האופטימלית הדירים, להציג ולהשתמש הסרגלים על התמונה.
- הנמך את פיפטה בעדינות לכיוון הפרוסה, שליטה של התאמת המטרה בו זמנית, עד קצה פיפטה בקלילות נוגע השטח של הפרוסה. לעצור את ירידת פיפטה ברגע זה נראה לעין כי כבר נגע הפרוסה מאפשר את הטיפ פיפטה לחדור 80-100 מיקרומטר של פני השטח של הפרוסה (ראה איור 3B).
- לכוון את הלייזר (ראה את הפרמטרים לעיל) ולעבור המיקרוסקופ למצב multiphoton. ודא כי החדר מוקרן מכל מקור אור (למשל, מסך המחשב). . הפעילי את גלאי nondescanned ולהגדיר את הרווח. השתמש טבלת בדיקת מידע (LUT) עם גבול עליון בצבע כדי להימנע להרוות את הפיקסלים בתמונה.
- לקבוע את עובי הפרוסה לדימות (קרי, העליונים והתחתונים z-עמדות איפה הוא לזיהוי [בדרך כלל בין 220 ו- 290 מיקרומטר סה כ]).
הערה: פני השטח של הפרוסה, יש צפיפות מוגברת של תהליכים ושל ואולי מיקרוגלייה, לעיתים קרובות עם מורפולוגיה יוצא דופן, בהשוואה הפנימי של הפרוסה. הצטברות זו יהיה מדהים עוד יותר עם הזמן (כלומר., גלוי יותר בחודש האחרון מאשר בתוך הפרוסה הראשונה המוח לדימות). לכן, המטוסים-z ב- הראשון ~ 30 מיקרומטר צריך לשמש לניתוח, ניתן לדלג אפילו עבור הרכישה. - התחל הקלטה עבור משך סך של 30 דקות (או יותר אם רוצים) ולהחיל לאחר תוכנית בסיסית 5 דקות, באופן מקומי את המתחם להיבדק (מבלי להפריע ההדמיה). כדי לעשות זאת, לאט לחצו הבוכנה של המזרק מחובר את micropipette, מ- 5 mL למיקום 1 מ"ל (בערך 5 s). ההתנגדות לאחר הקשה על הבוכנה חייבים להיות מורגשים מייד. אם לא, הטיפ יופרו.
הערה: עבור הנסיין מיומן, הזריקות בשיטה זו לשחזור, אבל לחילופין כדי מניפולציה ידנית של מזרק, פיפטה יכולים להיות קשורים למערכת הפליטה אוטומטי לחץ כדי לאפשר על שליטה טובה יותר של אמצעי האחסון נמסר. הזריקה יוצר עיוות הפיזי של הפרוסה באתר של הזריקה. זו העיוות הוא גלוי posteriori השניים הראשונים או שלוש תמונות אחרי הזריקה אבל לא צריך להיות גלויה בתמונה הרביעית, (קרי: 8 דקות לאחר ההזרקה). אם זה נמשכת, שקול לשנות את הפרמטרים עבור הכנת פיפטה. - בקצה של רכישת (30 דקות), למחוק את micropipette ולהסיר את הפרוסה. אם רצונך בכך, לתקן את הפרוסה על עוד יותר immunolabeling. לדוגמה, שיטת תמונה ממוטבת עבורו הקיבעון, מכתים של עבים פרוסות23.
- לפני הפעלת תמונה פרוסה חדשה, להפוך את הסרט 2D (סעיף 5.1) על מנת לבדוק את מיקרוגלייה יש מורפולוגיה תקינה ופועלים, ולפיכך, כי הפרוסות הם בריאים.
- לחבר את משאבת סחרור לחדר ההקלטה, 30 דקות לפני תחילת ההקלטות. לאחר ניקוי המערכת זלוף שלם עם 50 מ של מים הנדסה גנטית, להתחיל את זלוף לשכת הקלטה עם כלנית חדד (50 מ"ל) הכלול גביע זכוכית תחת carbogenation קבוע. לאורך כל הניסוי, לשמור את חנה המבר במחזור 32 ° C עם microheater בתוך השורה או תנור Peltier.
5. ניתוח של האטרקציה של תהליכים Microglial
-
הקרנה 2D ותיקון סחיפה
- פתח את הקובץ (. LIF) עם פיג'י24.
- במידת הצורך, הופכים substack (תמונה/אוספים/כלים/הפוך Substack) עם רק את z-המטוסים עניין. לדוגמה, אל תכלול את z-המטוסים המתאים אל פני השטח של הפרוסה, אם הם כבר שרכשו אבל הם לא אמור לשמש לניתוח (ראה ההערה לאחר שלב 4.2.11) ו- z-המטוסים העמוקה עם אין קרינה פלואורסצנטית. הערימה הסופי בדרך כלל מכיל 90-110 z-פרוסות (180-220 מיקרומטר).
- להפעיל את הפונקציה Z פרוייקט (תמונה/אוספים/ת פרוייקט"), בחר את סוג ההקרנה מקס עוצמה כדי להפוך את ההקרנות של הערימה-z רכשה בכל נקודה בזמן.
- להפעיל את התוסף MultiStackReg (תוסף/רישום/MultiStackReg), בחירת פעולה 1: יישר ו טרנספורמציה: גוף קשיח לתיקון נשתל קלה שאירעו במהלך רכישת. שמור את הסרט 2D כקובץ חדש (.tiff).
-
עיבוד נתונים
- לפתוח קובץ חדש זה אייסי25.
- צייר אזור R1 מעגלית עניין (ROI) של מיקרומטר 35 קוטר, שבמרכזה ההזרקה (המזוהה בעיקר על ידי הצל על פיפטה, העיוות שנוצר בזמן ההזרקה).
- להשתמש תוסף רועי בעוצמה האבולוציה , למדוד את עוצמת רשע לאורך זמן ב- R1.
- שמור את התוצאות. קובץ XLS.
-
כימות וייצוג של תוצאות
- כדי לכמת את התגובה microglial לאורך זמן, לקבוע בכל נקודה בזמן
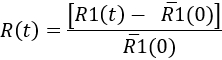
Here,'R1(0) הוא הממוצע של הערכים R1(t) לפני הזריקה. לאחר מכן, התוצאות יכול להיות מיוצג כפי קינטי של התגובה microglial, או בזמן מסוים הצבע (ראה איור 7).
- כדי לכמת את התגובה microglial לאורך זמן, לקבוע בכל נקודה בזמן
Access restricted. Please log in or start a trial to view this content.
תוצאות
פרוטוקול זה מתאר שיטה כדי לגרום, להתבונן, לכמת את הצמיחה אוריינטציה של תהליכים microglial לכיוון מתחם מקומית יישומית, לדוגמה, ATP או 5-HT, במוח חריפה פרוסות צעיר או מבוגר (לפחות עד בן חודש שני) עכברים. בין הגורמים התורמים לשמירה על המוח פרוסות מחיות למבוגרים במצב בריא במשך כמה שעות ...
Access restricted. Please log in or start a trial to view this content.
Discussion
על ידי שמירה על, שלא כמו בחלופה מועדפת או organotypic לחתוך תרבות, המבנית עם התאמות רשת מוגבל, פרוסות המוח חריפה לאפשר לחוקרים ללמוד מיקרוגלייה בסביבה הפיזיולוגית שלהם. עם זאת, אחת המגבלות הגדולות היא העובדה כי ההליך עם פרוסות יוצר פציעות במהירות יכול לסכן את הכדאיות של נוירונים, במיוחד במוח למב...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים את התא ואת רקמת מתקן הדמיה של ה-Institut du Fer à מולן, איפה כל ייבוא תמונות וניתוח בוצעו. עבודה זו בתמיכתם באופן חלקי המרכז הלאומי דה לה של רשרש, Santé de la הלאומי אינסטיטוט et de la Médicale רשרש, המדעים אוניברסיטת סורבון, ועל -ידי מענקים מן הסורבון Universités-פייר ואח (מארי קירי אוניברסיטת תוכנית Emergence-UPMC 2011/2014), Fondation למזוג לה Recherche sur le Cerveau, Fondation דה פראנס, שופכים Fondation la Médicale רשרש "Equipe עקרות DEQ2014039529", משרד הצרפתי של מחקר (סוכנות הידיעות נאסיונאל pour la Recherche ANR-17-CE16-0008, d'Avenir Investissements את תוכנית "ביו-פסיכולוגיים Labex" ANR-11-IDEX-0004-02), מחקר שיתופי בתוכנית בנוירוביולוגיה חישובית, לאומי-הסוכנות הלאומית של המדע קרן/צרפתית, למחקר (המספר: 1515686). כל הכותבים מזוהים לחקור קבוצות אשר הם חברים של הספר פריז of Neuroscience (ENP) ושל את Labex ביו-פסיכולוגיים. הקיבולות נשמר תלמיד דוקטורט המזוהה עם אוניברסיטת סורבון, קולז דוקטורט, F-75005 בפריז, צרפת, ממומן על ידי Labex ביו-פסיכולוגיים. V.M. הוא פוסט-דוקטורנט במימון מחקר שיתופי בתוכנית בנוירוביולוגיה חישובית, לאומי-הסוכנות הלאומית של המדע קרן/צרפתית, למחקר (המספר: 1515686). המחברים תודה מרתה Kolodziejczak שהשתתפו אתחול של הפרויקט.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| for pipettes preparation | |||
| Clark Borosilicate Thin Wall Capillaries | Harvard Apparatus | 30-0065 | Borosilicate Thin Wall without Filament, 1.5 mm OD, 1.17 mm ID, 75 mm L , Pkg. of 225 |
| DMZ Universal Puller | Zeitz Instrumente | ||
| Name | Company | Catalog Number | Comments |
| for solutions | |||
| Calcium Chloride dihydrate (CaCl2) | Sigma | C5080 | |
| Choline Chloride | Sigma | C7527 | |
| D-(+)-Glucose | Sigma | G8270 | |
| L-Ascorbic acid | Sigma | A5960 | |
| Magnesium Chloride solution 1 M (MgCl2) | Sigma | 63020 | |
| Potassium chloride SigmaUltra >99.0% (KCl) | Sigma | P9333 | |
| Sodium bicarbonate (NaHCO3) | Sigma | S5761 | |
| Sodium Chloride (NaCl) | Sigma | S5886 | |
| Sodium phosphate monobasic | Sigma | S5011 | |
| Sodium pyruvate | Sigma | P2256 | |
| Ultrapure water | MilliQ | for all the solutions | |
| Name | Company | Catalog Number | Comments |
| for slice preparation | |||
| 2x 200 mL crystalizing dishes | |||
| 80 mL Pyrex beaker | |||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For mice perfusion and 2-photon chamber perfusion (aCSF) |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | ||
| Dolethal | Vetoquinol | Dolethal 50 mg/mL | |
| Filter papers (Whatman) | Sigma | WHA1001042 | Whatman qualitative filter paper, Grade 1 (Pore size: 11µM) |
| Fine Scissors - Sharp | Fine Science Tools | 14060-60 | |
| Food box 10 cm diameter, 8 cm Height | |||
| glue (ethyl cyanoacrylate) | Loctite | super glue 3 power flex | |
| Hippocampal Tool (spatula) | Fine Science Tools | 10099-15 | The largest extremity has to be angled at 90° |
| Ice | |||
| Iris Forceps (curved) | Moria | MC31 | |
| Lens cleaning tissue | THOR LABS | ||
| Nylon mesh strainer | diameter 7 cm | ||
| Razor blades | Electron Microscopy Sciences | 72000 | For the slicer |
| scalpel blade | |||
| Slice interface holder | home-made, the file for 3D printing is provided in Supplemental Material | ||
| Surgical Scissors - Sharp | Fine Science Tools | 14002-14 | |
| Vibrating slicer | Thermo Scientific | 720-2709 | Model: HM 650V (Vibrating blade microtome) |
| Water bath | Set at 32 °C (first recovery step) | ||
| Name | Company | Catalog Number | Comments |
| for slice imaging | |||
| × 25 0.95 NA water-immersion objective | Leica Microsystems (Germany) | HCX Irapo | |
| 2-photon MP5 upright microscope with resonant scanners (8 kHz) and two HyD Hybrid detectors | Leica Microsystems (Germany) | ||
| Antlia-3C Digital Peristaltic pump | DD Biolab | 178961 | For 2-photon chamber perfusion with aCSF |
| Carbogen 5% CO2/95% O2 | Air Liquide France Industrie | I1501L50R2A001 | |
| Chameleon Ultra2 Ti:sapphire laser | Coherent (Germany) | ||
| disposable transfer pipettes , wide mouth | ThermoFischer scientific | for example : 232-11 | 5.8 mL with fin tip, but we cut it (approx 7 cm) to have a 4 mm diameter mouth |
| emission filter SP680 | Leica Microsystems (Germany) | ||
| fluorescent cube containing a 525/50 emission filter and a 560 dichroic filter (for fluorescence collection) | Leica Microsystems (Germany) | ||
| glass beaker with 50 mL of ACSF to maintain constant perfusion of the slice | |||
| Heating system | Warner Instrument Corporation | Automatic Heater Controller TC-324B | to maintain perfusion solution at 32 °C |
| perfusion chamber | home-made, the file for 3D printing is provided in Supplemental Material | ||
| slice holder ("harp") | home made : hairpin made of platinum with the two branches joined by parallel nylon threads | ||
| Name | Company | Catalog Number | Comments |
| for slice stimulation | |||
| Adenosine 5′-triphosphate disodium salt hydrate (ATP) | Sigma | A-26209 | to be prepared ex-temporaneously : 1 mg/mL (3 mM) stock solution prepared the day of the experiment, kept at 4 °C (a few hours) and diluted just before use |
| Fluorescein (optional) | Sigma | F-6377 | use at 1 µM final |
| Micromanipulator | Luigs and Neumann | SM7 | connected to the micropipette holde |
| Micropipette holder | same as for eletrophysiology | ||
| Serotonin hydrochloride | Sigma | H-9523 | aliquots of 50mM stock solution in H20 kept at -20 °C. 500 µM solution prepared the day of the experiment. |
| Syringe 5 mL (without needle) | Terumo medical products | SS+05S1 | |
| Transparent tubing | Fischer Scientific | 11750105 | Saint Gobain Performance Plastics™ Tygon™ E-3603 Non-DEHP Tubing |
| Name | Company | Catalog Number | Comments |
| for image analysis | |||
| Fiji | https://fiji.sc | Schindelin, J. et al Nat. Methods (2012) doi 10.1038 | |
| Icy | Institut Pasteur | http://icy.bioimageanalysis.org | de Chaumont, F. et al. Nat. Methods (2012) |
| Name | Company | Catalog Number | Comments |
| mice | |||
| CX3CR1-GFP mice | Jung et al, 2000 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. | |
| CX3CR1creER-YFP mice | Parkhurst et al 2013 | male or females, P3 to 2 months-old ; we have backcrossed these mice on 129sv background. |
References
- Salter, M. W., Stevens, B. Microglia emerge as central players in brain disease. Nature Publishing Group. 23 (9), 1018-1027 (2017).
- Tay, T. L., Savage, J., Hui, C. W., Bisht, K., Tremblay, M. -È Microglia across the lifespan: from origin to function in brain development, plasticity and cognition. The Journal of Physiology. , (2016).
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8 (6), 752-758 (2005).
- Nimmerjahn, A. Resting Microglial Cells Are Highly Dynamic Surveillants of Brain Parenchyma in Vivo. Science. 308 (5726), 1314-1318 (2005).
- Dissing-Olesen, L., et al. Activation of neuronal NMDA receptors triggers transient ATP-mediated microglial process outgrowth. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10511-10527 (2014).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. Journal of Biological Chemistry. 288 (21), 15291-15302 (2013).
- Eyo, U. B., et al. Neuronal hyperactivity recruits microglial processes via neuronal NMDA receptors and microglial P2Y12 receptors after status epilepticus. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 34 (32), 10528-10540 (2014).
- Hristovska, I., Pascual, O. Deciphering Resting Microglial Morphology and Process Motility from a Synaptic Prospect. Frontiers in Integrative Neuroscience. 9, 1231(2016).
- Avignone, E., Lepleux, M., Angibaud, J., Nägerl, U. V. Altered morphological dynamics of activated microglia after induction of status epilepticus. Journal of Neuroinflammation. 12, 202(2015).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biology. 14 (5), e1002466(2016).
- Madry, C., et al. Microglial Ramification, Surveillance, and Interleukin-1β Release Are Regulated by the Two-Pore Domain K+Channel THIK-1. Neuron. 97 (2), 299-312 (2018).
- Honda, S., et al. Extracellular ATP or ADP induce chemotaxis of cultured microglia through Gi/o-coupled P2Y receptors. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 21 (6), 1975-1982 (2001).
- Haynes, S. E., et al. The P2Y12 receptor regulates microglial activation by extracellular nucleotides. Nature Neuroscience. 9 (12), 1512-1519 (2006).
- Wu, L. -J., Vadakkan, K. I., Zhuo, M. ATP-induced chemotaxis of microglial processes requires P2Y receptor-activated initiation of outward potassium currents. Glia. 55 (8), 810-821 (2007).
- Kolodziejczak, M., et al. Serotonin Modulates Developmental Microglia via 5-HT 2BReceptors: Potential Implication during Synaptic Refinement of Retinogeniculate Projections. ACS Chemical Neuroscience. 6 (7), 1219-1230 (2015).
- Schafer, D. P., et al. Microglia Sculpt Postnatal Neural Circuits in an Activity and Complement-Dependent Manner. Neuron. 74 (4), 691-705 (2012).
- Pfeiffer, T., Avignone, E., Nägerl, U. V. Induction of hippocampal long-term potentiation increases the morphological dynamics of microglial processes and prolongs their contacts with dendritic spines. Scientific Reports. 6, 32422(2016).
- Parkhurst, C. N., et al. Microglia Promote Learning-Dependent Synapse Formation through Brain-Derived Neurotrophic Factor. Cell. 155 (7), 1596-1609 (2013).
- Wu, Y., Dissing-Olesen, L., Macvicar, B. A., Stevens, B. Microglia: Dynamic Mediators of Synapse Development and Plasticity. Trends in Immunology. 36 (10), 605-613 (2015).
- Ohsawa, K., et al. P2Y12 receptor-mediated integrin-beta1 activation regulates microglial process extension induced by ATP. Glia. 58 (7), 790-801 (2010).
- Kurpius, D., Wilson, N., Fuller, L., Hoffman, A., Dailey, M. E. Early activation, motility, and homing of neonatal microglia to injured neurons does not require protein synthesis. Glia. 54 (1), 58-70 (2006).
- Stence, N., Waite, M., Dailey, M. E. Dynamics of microglial activation: a confocal time-lapse analysis in hippocampal slices. Glia. 33 (3), 256-266 (2001).
- Dissing-Olesen, L., Macvicar, B. A. Fixation and Immunolabeling of Brain Slices: SNAPSHOT Method. Current Protocols in Neuroscience. 71, 1.23.1-12 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- Aitken, P. G., et al. Preparative methods for brain slices: a discussion. Journal of Neuroscience Methods. 59 (1), 139-149 (1995).
- Paris, I., et al. ProMoIJ: A new tool for automatic three-dimensional analysis of microglial process motility. Glia. 66 (4), 828-845 (2018).
- Pagani, F., et al. Defective microglial development in the hippocampus of Cx3cr1 deficient mice. Frontiers in Cellular Neuroscience. 9 (229), 111(2015).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. , Clifton, NJ. 221-242 (2014).
- Mainen, Z. F., et al. Two-photon imaging in living brain slices. Methods. 18 (2), San Diego, CA. 231-239 (1999).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Gyoneva, S., et al. Systemic inflammation regulates microglial responses to tissue damage in vivo. Glia. 62 (8), 1345-1360 (2014).
- Heindl, S., et al. Automated Morphological Analysis of Microglia After Stroke. Frontiers in Cellular Neuroscience. 12, 106(2018).
- Dailey, M. E., Eyo, U., Fuller, L., Hass, J., Kurpius, D. Imaging microglia in brain slices and slice cultures. Cold Spring Harbor Protocols. 12 (12), 1142-1148 (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved