Method Article
التعرف على مستقبلات سطح الخلية باستخدام شاشات CRISPR/Cas9 الجينية على مقياس الجينوم
In This Article
Summary
تصف هذه المخطوطة نهج فحص قائم على الخلايا على نطاق الجينوم لتحديد تفاعلات مستقبلات ligand خارج الخلية.
Abstract
الاتصال بين الخلايا بوساطة التفاعلات المباشرة بين مستقبلات سطح الخلية جزءا لا يتجزأ من الغشاء أمر بالغ الأهمية للتنمية العادية وعمل الكائنات متعددة الخلايا. ومع ذلك، لا يزال الكشف عن هذه التفاعلات يشكل تحدياً من الناحية الفنية. تصف هذه المخطوطة نهج فحص وراثي منهجي على نطاق الجينوم CRISPR/Cas9 بالضربة القاضية يكشف عن المسارات الخلوية المطلوبة لأحداث محددة للتعرف على سطح الخلية. يستخدم هذا الفحص البروتينات المؤتلفة المنتجة في نظام التعبير البروتيني الثديي كتحقيقات ملزمة متعطشا لتحديد شركاء التفاعل في شاشة وراثية تعتمد على الخلايا. يمكن استخدام هذه الطريقة لتحديد الجينات اللازمة لتفاعلات سطح الخلية التي تم اكتشافها بواسطة تحقيقات الربط المؤتلفة المقابلة لectodomains من المستقبلات المضمنة في الغشاء. الأهم من ذلك، نظرا لطبيعة مقياس الجينوم من هذا النهج، كما أن لديها ميزة ليس فقط تحديد المستقبلات المباشرة ولكن أيضا المكونات الخلوية المطلوبة لعرض المستقبلات على سطح الخلية، وبالتالي توفير رؤى قيمة في بيولوجيا المستقبلات.
Introduction
التفاعلات خارج الخلية بواسطة البروتينات مستقبلات سطح الخلية مباشرة العمليات البيولوجية الهامة مثل تنظيم الأنسجة، والاعتراف المضيف الممرض، وتنظيم المناعة. إن التحقيق في هذه التفاعلات يهم المجتمع الطبي الحيوي الأوسع، لأن مستقبلات الأغشية هي أهداف قابلة للتنفيذ للعلاجات التي يتم تسليمها بشكل منهجي مثل الأجسام المضادة أحادية النسيلة. وعلى الرغم من أهميتها، لا تزال دراسة هذه التفاعلات صعبة من الناحية التقنية. ويرجع ذلك أساسا إلى أن المستقبلات المدمجة للأغشية هي مستقبلات أمبيباثية، مما يجعل من الصعب عزلها عن الأغشية البيولوجية للتلاعب بالمواد الكيميائية الحيوية، ويتم تصنيف تفاعلاتها من خلال تقارب التفاعل الضعيف(KDs في نطاق μM-mM)1. وبالتالي، العديد من الطرق الشائعة الاستخدام غير مناسبة للكشف عن هذه الفئة من التفاعلاتالبروتين1،2.
وقد وضعت مجموعة من الأساليب للتحقيق على وجه التحديد خارج الخلية مستقبلات ligand التفاعلات التي تأخذ خصائصها الكيميائية الحيوية فريدة من نوعها في الاعتبار3. وينطوي عدد من هذه النهج على التعبير عن كامل نطاق المستقبل كبروتين مؤتلف قابل للذوبان في النظم الثديية أو النظم القائمة على خلايا الحشرات لضمان احتواء هذه البروتينات على تعديلات ما بعد الترجمة ذات الأهمية الهيكلية، مثل الجليكان والروابط اللاكبريتيدة. للتغلب على الربط المنخفض التقارب ، وغالبا ما تكون oligomerized ectodomains لزيادة avidity ملزمة. وقد استخدمت بنجاح ectodomains البروتين متعطشا كتحقيقات ملزمة لتحديد شركاء التفاعل في الشاشات المباشرة التفاعل البروتين البروتيني المؤتلف4،5،6،7. في حين أن ناجحة على نطاق واسع, الأساليب القائمة على البروتين المؤتلف تتطلب أن يتم إنتاج ectodomain من مستقبلات غشاء كبروتين قابل للذوبان. لذلك ، فإنه ينطبق بشكل عام فقط على البروتينات التي تحتوي على منطقة متجاورة خارج الخلية (على سبيل المثال ، من النوع الأول أو النوع الثاني أو GPI الراسية) ولا يصلح بشكل عام لمجمعات المستقبلات وبروتينات الأغشية التي تمتد عبر الغشاء عدة مرات.
كما استخدمت تقنيات استنساخ التعبير التي يتم فيها نقل مكتبة من DNAs التكميلية (cDNAs) إلى الخلايا واختبارها للحصول على نوع ظاهري مربط لتحديد التفاعلات البروتينية والبروتينية خارج الخلية8. وقد سهل توافر مجموعات كبيرة من البلازميد التعبير cDNA المستنسخة وتسلسل في السنوات الأخيرة الطرق التي خطوط الخلايا التي تعبر بشكل مفرط cDNAs مستقبلات سطح الخلية ترميز يتم فحص لربط البروتينات المؤتلفة لتحديد التفاعلات9,10. المقاربات المستندة إلى التعبير المفرط cDNA، على عكس الأساليب المؤتلفة القائمة على البروتين، تتيح إمكانية تحديد التفاعلات في سياق غشاء البلازما. ومع ذلك، فإن نجاح استخدام بناء تعبير cDNA يعتمد على قدرة الخلايا على التعبير عن البروتين في شكل مطوية بشكل صحيح، ولكن هذا غالبا ما يتطلب عوامل التبعي الخلوية مثل الناقلين، المرافقين، والتجمع الأوليغوميريك الصحيح. وبالتالي فإن تحويل cDNA واحد قد لا يكون كافيا لتحقيق تعبير سطح الخلية.
تقنيات الفحص باستخدام بناء cDNA أو تحقيقات البروتين المؤتلف هي كثيفة الموارد وتتطلب مجموعات كبيرة من مكتبات البروتين cDNA أو المؤتلف. وقد استخدمت أساليب مصممة خصيصا الطيف الكتلي في الآونة الأخيرة لتحديد التفاعلات خارج الخلية التي لا تتطلب تجميع المكتبات الكبيرة. ومع ذلك ، تتطلب هذه التقنيات التلاعب الكيميائي لسطح الخلية ، والتي يمكن أن تغير الطبيعة الكيميائية الحيوية للجزيئات الموجودة على سطح الخلايا وتنطبق حاليًا فقط على التفاعلات التي تتوسطها البروتينات الغليكوزيلية11،12. معظم الطرق المتاحة حاليا تركز أيضا بشكل كبير على التفاعلات بين البروتينات مع تجاهل إلى حد كبير مساهمة من البيئة الدقيقة الغشاء، بما في ذلك جزيئات مثل الغليكان، والدهون، والكوليسترول.
وقد مكّن التطور الأخير للاستهداف الثنائي عالي الكفاءة باستخدام النهج القائمة على CRISPR مكتبات على نطاق الجينوم من الخلايا التي تفتقر إلى جينات محددة في تجمع واحد يمكن فحصه بطريقة منهجية وغير متحيزة لتحديد المكونات الخلوية المشاركة في سياقات مختلفة، بما في ذلك تشريح عمليات الإشارات الخلوية ، وتحديد الاضطرابات التي تمنح مقاومة للأدوية والسموم ومسببات الأمراض ، وتحديد خصوصية الأجسام المضادة13،14،15،16. هنا، نحن نصف فحص الخلايا القاضية على مقياس الجينوم CRISPR الذي يوفر بديلاً للنهج الكيميائية الحيوية الحالية لتحديد تفاعلات مستقبلات ligand خارج الخلية. هذا النهج لتحديد التفاعلات التي تتوسط ها من قبل مستقبلات الأغشية بواسطة الشاشات الوراثية هو مناسب بشكل خاص للباحثين الذين لديهم اهتمام مركز على ligands الفردية لأنه يتجنب الحاجة إلى تجميع مكتبات كبيرة من الـ cDNAs أو البروتينات المؤتلفة.
يتكون هذا الفحص من ثلاث خطوات رئيسية: 1) يتم إنتاج تحقيقات ملزمة للبروتين المؤتلف للغاية تتكون من المناطق خارج الخلية لمستقبلات الاهتمام وتستخدم في الاختبارات الملزمة القائمة على التدفق القائم على التدفق القائم على الفلورسينس. 2) وتستخدم المقالات ملزمة لتحديد خط الخلية التي تعبر عن شريك التفاعل من مسبار البروتين المؤتلف؛ 3) يتم إنتاج نسخة من خط الخلية التي تتفاعل مع البروتين المهم وشاشة خروج المغلوب CRISPR/Cas9 المستندة إلى مقياس الجينوم(الشكل 1). في هذه الشاشة الوراثية، يتم استخدام ربط البروتين المؤتلف بخطوط الخلايا كنوع ظاهري قابل للقياس يتم فيه فرز الخلايا داخل مكتبة خروج المغلوب التي فقدت القدرة على ربط المسبار باستخدام فرز الخلايا المنشطة المستندة إلى الفلورسينس (FACS) والجينات التي تسببت في فقدان النمط الظاهري الملزم الذي حدده التسلسل. من حيث المبدأ ، يتم تحديد الجينات ترميز المستقبلات المسؤولة عن ربط التحقيق متعطشا وتلك المطلوبة لعرض سطح الخلية.
الخطوة الأولى من هذا البروتوكول ينطوي على إنتاج تحقيقات البروتين المؤتلف متعطشا تمثل ectodomain من مستقبلات الغشاء ملزمة. ومن المعروف أن هذه المستقبلات للاحتفاظ في كثير من الأحيان وظائفها ملزمة خارج الخلية عندما يتم التعبير عن ectodomains كبروتين قابل للذوبان المؤتلف1. للحصول على بروتين ذو أهمية ، يمكن إنتاج البروتينات المؤتلفة القابلة للذوبان في أي نظام تعبير بروتين يوكاريوتيك مناسب في أي شكل شريطة أن يمكن أن يكون oligomerized لزيادة avidity ملزمة ، وأنه يحتوي على العلامات التي يمكن استخدامها في الاختبارات القائمة على التدفق القائم على الخلايا الفلورية القائمة على المقالات الملزمة (على سبيل المثال ، علامة العلم ، biotin - tag). بروتوكولات مفصلة لإنتاج ectodomains قابلة للذوبان من مستقبلات الأغشية باستخدام نظام التعبير البروتين HEK293، فضلا عن تقنيات متعددة مختلفة ويبني التعبير البروتين لإنتاج كل من البروتينات الخماسية والبروتينات أحادية اللون قد وصفت سابقا1،,17. سوف يصف البروتوكول هنا خطوات توليد المسابير الفلورية متعطشا من البروتينات الحيوية monomeric بالاقتران لهم إلى العقدية مترافق ة إلى الفلوروكروم (على سبيل المثال، phycoerythrin، أو PE)، والتي يمكن استخدامها مباشرة في الخلايا القائمة على الربط المقالات ولديها ميزة عدم الحاجة إلى الأجسام المضادة الثانوية للكشف. وقد سبق وصف البروتوكولات العامة لأداء شاشات مقياس الجينوم20,21, وبالتالي فإن البروتوكول يركز بشكل رئيسي على تفاصيل أداء تدفق القائم على الخلايا المؤتلف ة البروتين المؤتلف ة شاشات الربط باستخدام نظام فحص خروج المغلوب CRISPR/Cas9 باستخدام 55 ("يوسا") مكتبة18.
Protocol
1. إنتاج وتنقية البروتينات ذات العلامات الحيوية
- استخدام نظام التعبير البروتيني القائم على خلايا الثدييات أو الحشرات لإنتاج المؤتلف القابلة للذوبان له الموسومة البروتينات الحيوية ذات الصغر (انظر بنيات البلازميد في الجدول 1).
ملاحظة: يتم وصف بروتوكول مفصل لإنتاج البيوتين أحادي ة والبروتينات الموسومة له باستخدام نظام التعبير الخلية HEK293 من قبل كير وآخرون17. يتم إفراز ectodomains البروتين أعرب باستخدام نظام التعبير HEK293 في الوسط الثقافة. - جمع البروتينات القابلة للذوبان عن طريق الكريات الخلايا عن طريق الطرد المركزي في 3000 × ز لمدة 20 دقيقة.
- تصفية supernatant من خلال مرشح 0.22 ميكرون وإضافة حبات Ni2 +-NTA agarose إلى supernatant البروتين المصفاة في نسبة 1:1000 (أي 50 ميكرولتر من 50٪ من الطين agarose إلى 50 مل من supernatant). احتضان بين عشية وضحاها أو ما لا يقل عن 4-5 ساعة في 4 درجة مئوية على منصة دوارة.
- اغسل عمود البولي بروبلين بإضافة 5 مل من المخزن المؤقت لغسل التنقية. راجع الجدول 2 لكافة التراكيب المخزن المؤقت.
- صب كامل خليط البروتين البزائط في العمود. سوف تتراكم الخرز في القاعدة.
- غسل الخرز 2x مع 15 مل من العازلة غسل. لتجنب تخفيف البروتين، ارسم بعناية عازل الغسيل المتبقي من العمود باستخدام حقنة 5 مل وتخلص منه.
- إضافة بعناية 300-500 ميكرولتر من العازلة التلوري له مباشرة إلى الخرز واحتضان لمدة 1 ساعة على الأقل. جمع البروتين eluted مرة أخرى عن طريق رسم بعناية السائل باستخدام حقنة 1 مل. تبادل المخزن المؤقت elution إلى المخزن المؤقت المطلوب (على سبيل المثال، عادة PBS أو HBS) باستخدام أعمدة إزالة التمليح. تخزين جميع البروتينات في 4 درجة مئوية حتى مزيد من الاستخدام.
2- القياس الكمي واحتكار القلة للبروتين الحيوي أحادي الصغر
ملاحظة: لزيادة avidity ملزمة، oligomerize البروتينات الأحادية القلة الحيوية على tetrameric streptavidin-PE قبل استخدامها في المقالات ملزمة. تحقيق نسب اقتران الأمثل من البروتينات أحادية وtetrameric streptavidin-PE عن طريق اختبار سلسلة مخففة من مونومرات الحيوية صغيرة ضد تركيز ثابت من streptavidin وتجريبيا عن طريق تحديد الحد الأدنى من التخفيف الذي لا يمكن الكشف عن مونومرات حيوية زائدة صغيرة.
- جعل ما لا يقل عن ثمانية تخفيفات المسلسل من عينات البروتين الحيوية tinylated باستخدام عازلة التخفيف المناسبة (إما PBS أو HBS مع 1٪ الزلفي الأبقار [BSA]) في لوحة بئر 96. تأكد من أن الحجم النهائي لكل تخفيف لا يقل عن 200 ميكرولتر.
- جعل لوحة مكررة من العينات عن طريق إزالة 100 ميكرولتر من كل بئر ونقل إلى لوحة بئر 96 جديدة. قم دائمًا بتضمين عنصر تحكم. في هذه الحالة الضوابط هي علامة فقط البروتينات (أي، حيويtinylated له الموسومة له Cd4 المجال 3 +4 البروتين). سيتم استخدام هذا كمسبار تحكم في كافة المقالات الملزمة.
- تمييع العقديات-PE إلى 0.1 ميكروغرام/مل في المخزن المؤقت المخفف.
- على واحد فقط من لوحات، إضافة 100 ميكرولتر من العقدية المخففة-PE. لوحة مكررة ستكون بمثابة عنصر تحكم. إضافة 100 ميكرولتر من العازلة التخفيف في لوحة التحكم لتحقيق المساواة في وحدات التخزين.
- احتضان لمدة 20 دقيقة في درجة حرارة الغرفة (RT). في غضون ذلك، كتلة آبار لوحة مغلفة بالعقد ية مع عازلة التخفيف لمدة 15 دقيقة.
- نقل الحجم الإجمالي للعينة من كلا الطبقتين إلى الآبار الفردية للصفائح المغلفة بالعقديات واحتضان لمدة ساعة واحدة في RT.
- اغسل اللوحة 3x مع 200 ميكرولتر من عازل الغسيل (أي إما PBS أو HBS مع 0.1٪ Tween-20 ، 2٪ BSA). أضف 100 ميكرولتر من 2 ميكروغرام/مل فأرة مضادة للفئران Cd4d3+4 IgG (OX68) واحتضان لمدة ساعة واحدة في RT.
- اغسل اللوحة 3x مع المخزن المؤقت للغسيل. أضف 100 ميكرولتر من اقتران فوسفاتاز القلوية المضادة للفأرة عند 0.2 ميكروغرام/مل لمدة ساعة واحدة في RT.
- اغسل اللوحة 3x مع العازلة غسل و 1x في عازلة تخفيف.
- إعداد فوسفات p-nitrophenyl في 1 ملغ/مل في عازل الديإيثانامين. إضافة 100 ميكرولتر في كل بئر واحتضان لمدة 15 دقيقة.
- تأخذ قراءات امتصاص في 405 نانومتر. استخدام الحد الأدنى من التخفيف الذي لا توجد فيه إشارة على اللوحة كعامل التخفيف المناسب لإنشاء رباعيات(الشكل 2).
- جعل 10x تترامير تلطيخ الحل لجميع العينات والضوابط عن طريق احتضان 4 ميكروغرام / مل streptavidin-PE والبروتين الحيوي التضمين المناسب لتخفيف لمدة 30 دقيقة في RT. تخزين البروتينات الزوجية في أنبوب المحمية الخفيفة في 4 درجة مئوية حتى مزيد من الاستخدام.
3. تدفق القائم على قياس الخلايا الاختبارات ربط الخلية
- للخلايا المعتمّنة، قم بإزالة الوسائط الثقافية واغسل 1x مع PBS بدون التخيرات المقسومة. ثم إضافة حلول مفرزة الخلية (على سبيل المثال، EDTA). السماح للخلايا لفصل لمدة 5-10 دقيقة. اضغط بلطف على قارورة لتحرير الخلايا.
ملاحظة: تجنب استخدام المنتجات المستندة إلى التربسين لأنها يمكن أن تسيل البروتينات سطح الخلية. - جمع الخلايا المنفصلة في أنبوب. بالنسبة للخلايا التي تنمو في التعليق (على سبيل المثال، خلايا HEK293)، قم بجمع الخلايا مباشرة من قارورة الثقافة إلى أنبوب.
- خلايا بيليه في 200 × ز لمدة 5 دقيقة. إزالة supernatant وإعادة تعليق بيليه في العازلة غسل (أي، PBS/1٪ BSA).
- عد الخلايا باستخدام مقياس الهيموكيتومتر وضبط التركيز إلى 2.5 × 105-1 × 106 خلايا / مل. Aliquot 100 μL من مزيج الخلية المعدة على 96 جيدا U - أو V - أسفل لوحة. تدور لوحة لمدة 5 دقيقة في 400 × ز. إزالة supernatant مع ماصة متعددة القنوات.
- إضافة 100 ميكرولتر من الطبيعية الفلورسنت المسمى عالية متعطشا للتحقيقات البروتين والضوابط في لوحات أعدت سابقا مع الخلايا واحتضان لمدة 1 ساعة في 4 درجة مئوية. بعد الربط لمدة 1 ساعة، تدور لوحة في 400 × ز لمدة 5 دقيقة.
- إزالة supernatant وإضافة 200 ميكرولتر من الغسيل المخزن المؤقت (أي برنامج تلفزيوني / 1 ٪ BSA). مزيج جيدا عن طريق الأنابيب صعودا وهبوطا.
- بيليه الخلايا عن طريق الطرد المركزي في 400 × ز لمدة 5 دقيقة. كرر خطوة الغسيل 1x. بعد اثنين من السهو، إزالة تماما supernatant وإعادة تعليق بيليه الخلية في 100 ميكرولتر من برنامج تلفزيوني.
- تحليل الخلايا عن طريق قياس الخلايا التدفق. استخدام الليزر الأصفر والأخضر (أي 561 نانومتر) للكشف عن الفلورسENCE PE.
- أولا تحليل الخلايا التي كانت ملطخة مع التحقيق السيطرة. استنادا إلى توزيع PE fluorescence، رسم بوابة للسكان ملزمة مثل أن ما لا يزيد عن 1٪ من خلية التحكم يقع في هذه البوابة.
- تحليل العينة وتحديد جزء الخلايا التي تقع في بوابة الربط.
ملاحظة: خطوط الخلية التي تعرض مجموعة ربط أعلى مطلوبة للشاشات الوراثية، حيث تحتوي على نسبة أعلى للإشارة إلى الضوضاء. من الناحية المثالية أكثر من 80٪ من الخلايا يجب أن تقع داخل هذه البوابة.
4. تحديد المساهمات الملزمة من epitopes labile الحرارة والسلاسل الجانبية سلفات الهيباران
ملاحظة: نشاط العديد من البروتينات هو labile الحرارة، لذلك فقدان النشاط ملزمة بعد المعالجة الحرارية أمر مشجع. ينصح لتحديد مساهمة من الجليكوسامينوغليكانات المشحونة سلبا، أساسا كبريتات الهيباران (HS)، في التبرّع الملزمة للبروتينات المؤتلفة. وذلك لأن الربط من قبل HS في فحص ربط الخلية المذكورة هنا يمكن أن تكون مضافة بدلا من الاعتماد على مستقبلات أخرى19. وهذا يعني أن الربط الملحوظ يمكن أن يتم بوساطة كاملة من قبل سلاسل جانبية HS من proteoglycans سطح الخلية وليس من قبل مستقبلات محددة. ملزمة لHS على سطح الخلية ليست بالضرورة غير محددة، بل هو خاصية للبروتين، والتي من المفيد أن نعرف قبل إجراء شاشة وراثية كاملة.
- إعداد عينات البروتين المعالجة بالحرارة لاستخدامها في المقالات الملزمة.
- سخني البروتين الأحادي العادي ولكن غير المُقبَّر عند درجة حرارة 80 درجة مئوية لمدة 10 دقيقة.
- اقتران البروتين المعالج بالحرارة إلى العقديات-PE على افتراض نفس نسبة الاقتران مثل نظيرتها غير المعالجة كما تحددها ELISA (راجع القسم 2).
- إعداد عينات البروتين المحظورة الهيبارين.
- إعداد ثمانية 1:3 تخفيف الهيبارين قابل للذوبان في برنامج تلفزيوني مع تركيز يبدأ من 2 ملغ / مل والحجم النهائي من 100 ميكرولتر.
- احتضان 100 ميكرولتر من المسابير الملزمة المعدة في تخفيف الهيبارين لمدة 30 دقيقة على الأقل.
- استخدام البروتين المعالجة بالحرارة وكامل 200 ميكرولتر من خليط الهيبارين / البروتين في المقالات ملزمة وصفها في القسم 3. تظهر النتائج التمثيلية في الشكل 3A, B.
5. اختيار خطوط الخلية تعبر بشكل ثابت Cas9
ملاحظة: قبل خط الخلية التي تربط التحقيق من الفائدة يمكن استخدامها في فحص CRISPR، يجب أولاأن تكون مصممة للتعبير عن nuclease Cas9 واستنساخ نشطة للغاية مختارة19.
- استخدم بروتوكول إنتاج الفيروس العام التالي لإنتاج الفيروس lentivirus باستخدام بناء lentiviral للتعبير Cas9 (راجع الجدول 1).
- الخلايا الثقافة HEK293-FT في DMEM/10% FBS وسائل الإعلام في 37 درجة مئوية و 5% CO2. البذور HEK293-FT الخلايا 1 قبل يوم من التَرَقبحيث ة أن تكون تقريباً 80% تُقِرَب في يوم التَقُوّل.
ملاحظة: خلايا HEK293FT هي ملتصقة بشكل فضفاض; لذلك ، عندما تستخدم لإنتاج الفيروسات اللين ، والنظر في الطلاء لهم على قارورة الثقافة المغلفة مع 0.1 ٪ (ث / الخامس) الجيلاتين لزيادة الالتزام. - إجراء الحلويات في الصباح. إضافة ناقل النقل، ومزيج التعبئة والتغليف، وكاشف الحلويات في وسائط متوافقة مع التسفير اتّضاً مسبقًا (على سبيل المثال، Opti-MEM). مزيج عن طريق عكس أنبوب 10-15x. احتضان لمدة 5 دقيقة في RT. راجع الجدول 3 للحصول على وحدات التخزين الدقيقة.
- إضافة التبرز الحلويات كما اقترح من قبل الشركة المصنعة. تخلط عن طريق الدوامة السريعة. احتضان لمدة 30 دقيقة في RT.
- بعناية فائقة تستنشق المتوسط المستهلك. إضافة وسائط متوافقة التَغَيّق إلى لوحة.
- إضافة التبرز التبرز / الحمض النووي المجمعات dropwise على جانب لوحة وتنتشر ببطء من خلال لوحة من خلال دوامة بلطف جدا.
- احتضان في 37 درجة مئوية لمدة 3-5 ساعة واستبدال المتوسطة مع متوسط D10. احتضان بين عشية وضحاها.
- في اليوم التالي في الصباح، استبدل الوسط بوسيط D10 طازج. احتضان بين عشية وضحاها.
- في اليوم التالي في وقت متأخر من بعد الظهر، وجمع supernatant الفيروسية. تصفية مع مرشح 0.45 ميكرون مع ربط البروتين المنخفض. اختياريا، إضافة جديدة D10 المتوسطة، واحتضان بين عشية وضحاها واستعادة supernatant في اليوم التالي.
- وتستقر المواد الخارقة للفيروسات عند 4 درجات مئوية لبضعة أيام فقط. تخزين هاو80 درجة مئوية للتخزين على المدى الطويل.
ملاحظة: لتوليد إعداد مُركّز للغاية للصفّع، الذي قد يكون مرغوباً فيه لنقل الخلايا التي يصعب نقلها، يمكن أيضاً تركيز الناثرات الخارقة عن طريق الطرد المركزي عند 6000 × غرام بين عشية وضحاها عند 4 درجات مئوية. وضع علامة على بيليه الفيروسية شفافة مع قلم مقاوم للإيثانول وتجاهل supernatant. إعادة تعليق بيليه في 1/100th من الحجم الأصلي لزيادة 100x في التركيز.
- الخلايا الثقافة HEK293-FT في DMEM/10% FBS وسائل الإعلام في 37 درجة مئوية و 5% CO2. البذور HEK293-FT الخلايا 1 قبل يوم من التَرَقبحيث ة أن تكون تقريباً 80% تُقِرَب في يوم التَقُوّل.
- Transduce الخلايا مع الفيروسات lenti.
- لوحة 1 × 106 خلايا لكل بئر في لوحة جيدة 6 مع 3 مل من وسائل الإعلام الثقافة المناسبة. يتم نقل بعض الخلايا بسهولة أكثر من غيرها. لسهولة نقل الخلايا (على سبيل المثال، خلايا HEK)، أضف الفيروس اللارضي مباشرة إلى الخلايا. بالنسبة لخلايا يصعب نقلها، قد يكون من الضروري اتباع بروتوكول غزل انسال كما هو موضح أدناه.
- Aliquot 2 مل من 2-5 × 106 خلايا / مل في أنبوب مخروطي 15 مل.
- إضافة الفيروس lentivirus جنبا إلى جنب مع 8 ميكروغرام / مل بروميد سداسي الديماديترين واحتضان في RT لمدة 30 دقيقة.
- جهاز طرد مركزي لمدة 100 دقيقة عند 800 × غرام عند 32 درجة مئوية. ثم إعادة تعليق الخلايا في نفس الوسائط وإضافة تعليق الخلية إلى قوارير الثقافة المناسبة مع الوسائط المناسبة.
- السماح نقل لا يقل عن 24 ح. بعد إزالة الوسائط التي تحتوي على الفيروس وإضافة المتوسطة الطازجة.
- بعد آخر 24 ساعة، تغيير وسائل الإعلام إلى واحد أن تستكمل مع المضادات الحيوية المناسبة. يحتوي بناء Cas9 على كاسيت مقاومة blasticidin للاختيار.
ملاحظة: يجب تحسين كمية blasticidin لكل خط خلية عن طريق تنفيذ منحنى قتل استجابة الجرعة. وينبغي أن يؤدي تركيز المبيدات اللافجرية بين 2.5-50 ميكروغرام/مل إلى قتل معظم خطوط الخلايا غير المستحثة في غضون 10 أيام من النقل.
- لوحة 1 × 106 خلايا لكل بئر في لوحة جيدة 6 مع 3 مل من وسائل الإعلام الثقافة المناسبة. يتم نقل بعض الخلايا بسهولة أكثر من غيرها. لسهولة نقل الخلايا (على سبيل المثال، خلايا HEK)، أضف الفيروس اللارضي مباشرة إلى الخلايا. بالنسبة لخلايا يصعب نقلها، قد يكون من الضروري اتباع بروتوكول غزل انسال كما هو موضح أدناه.
- إجراء الاختيار حتى يتم قتل جميع الخلايا في لوحة التحكم (أي الخلايا غير المستحثة التي تم علاجها بنفس تركيز المضادات الحيوية الاختيار).
6. اختيار عالية Cas9 النشاط استنساخ
ملاحظة: يمكن استخدام Polyclonal Cas9 لأداء الشاشات الوراثية بنجاح; ومع ذلك، اختيار استنساخ مع نشاط Cas9 عالية يحسن نتائج الفحص18.
- استخدام الحد من تخفيف أو خلية واحدة فرز الخلايا الفردية مقاومة للblasticidin في آبار من ثلاث لوحات بئر 96 التي تحتوي على وسائل الإعلام الثقافة تستكمل blasticidin. سوف تبدأ المستنسخات في الظهور بين 2-4 أسابيع. حدد 10-20 استنساخ وتوسيع في 6 لوحات جيدا.
- افحص المستنسخين لنشاط Cas9 باستخدام نظام GFP-BFP السريع التقييم (بروتين الفلورسنت الأخضر والأزرق الفلوري) ، والذي يستخدم نظام خروج المغلوب الجيني الخارجي الذي يتم فيه نقل الخلايا إما ببنية تعبر عن GFP مع GFP يستهدف gFP أو gRNA فارغ كتحكم18.
- ترتيب المراسل plasmids: GFP-BFP plasmid، Control-BFP plasmid(الجدول 1).
- إنتاج الفيروس lentivirus لكل من بلازميد GFP-BFP وControl-BFP plasmid باستخدام بروتوكول إنتاج الفيروس lentivirus الموضح في القسم 5.1.
- Transduce كل Cas9 التعبير عن خط الخلية استنساخ مع ترميز lentivirus نظام GFP-BFP والتحكم-BFP بشكل منفصل. اتبع البروتوكول في القسم 5.2.
- بعد 3 أيام من النقل، فحص فلورسس GFP-BFP من كل استنساخ باستخدام قياس خلايا التدفق. استخدام ليزر 488 نانومتر وليزر 405 نانومتر للكشف عن GFP و BFP على التوالي.
- كمية نشاط Cas9 في كل استنساخ عن طريق فحص نسبة BFP فقط إلى الخلايا الإيجابية GFP-BFP-double. وينبغي أن يكون من الناحية المثالية خلايا Cas9 نشاط عالية > 95٪ GFP كفاءة خروج المغلوب(الشكل 4).
7. جيل من الجينوم على نطاق واسع CRISPR-Cas9 فحص مكتبة خروج المغلوب
- للفحص على نطاق الجينوم باستخدام مكتبة V1 البشرية18، اطلب المكتبة على نطاق الجينوم (انظر الجدول 1)وإعداد المكتبة البلازميدة من الطعنة البكتيرية باستخدام البروتوكول المقدم تحت "بروتوكولات النسخ المتماثل للمكتبة" في دليل الشركة المصنعة.
- استخدام إعداد البلازميد مكتبة على نطاق الجينوم لإنتاج مكتبة lentiviral ترميز gRNAs لتعطيل المستهدفة من الجينات البشرية باستخدام بروتوكول إنتاج الفيروس lentivirus الموصوفة في القسم 5.1.
ملاحظة: هناك ممارسة جيدة لإنتاج دفعة واحدة من إعداد lentiviral التي تم تحسينها لنقل لتحسين الاتساق التجريبي. - استخدم بروتوكول النقل في القسم 5.2 لإجراء عمليات نقل اختبار صغيرة الحجم لتحديد الكمية المطلوبة من الفيروس لكل خط خلية لتحقيق نقل 30٪. استخدام قياس التدفق الخلوي لتقييم الفلورسان BFP كوكيل لكفاءة النقل.
- لtransduce HEK293 الخلايا، ببساطة إضافة إعداد مُعرّف مسبقاإلى 30-50 × 106 خلايا مثقفة في وسائل الإعلام النمو العادي ل ~ 4 ساعة. ثم إزالة وسائل الإعلام مع lentivirus واستبدال مع وسائل الإعلام النمو جديدة.
- بالنسبة لخطوط الخلايا الأخرى، استخدم بروتوكول السبينفياً في القسم 5.2.1 ولكن على نطاق أوسع، بحيث يتم نقل ما مجموعه 30-50 × 106 خلايا. لهذا، aliquot 2 مل من 5 × 106 خلايا / مل في أنبوب مخروطي 15 مل والمضي قدما على النحو المبين.
- بالنسبة لخطوط الخلايا الملتصقة، حدد الخلايا المنقولة بإضافة البورومايزين 24 ساعة بعد النقل.
ملاحظة: تحسين تركيزات البوروماشين عن طريق تنفيذ منحنى قتل استجابة الجرعة. عادة تركيزات بين 1-10 ميكروغرام / مل يجب أن تقتل الخلايا غير المستحثة في غضون 3-5 أيام. تجنب استخدام تركيزات أعلى من البوروميسين لأن هذا قد يزيد من فرص اختيار الخلايا التي تم نقلها من قبل أكثر من دليل واحد الحمض النووي الريبي (sgRNA). - بالنسبة لخلايا التعليق، حصاد الخلايا المستحثة (أي BFP إيجابية) 3 أيام بعد نقل باستخدام فرز الخلايا وتوليد المكتبات التي تحتوي على ما لا يقل عن 10 × 106 خلايا. مرة واحدة مختارة باستخدام BFP، تنمو الخلايا في وسائل الإعلام المكملة مع كمية مناسبة من puromycin.
ملاحظة: تجنب التحديدات فقط مع puromycin لخطوط الخلايا المعلقة، لأنه من الصعب إزالة الخلايا الميتة والحطام من ثقافات الخلايا المعلقة التي يمكن أن تتداخل مع فرز الخلايا. - ثقافة مكتبة متحولة لمدة 9-16 يوما بعد نقل القنوات مع مرور منتظم كل 2-3 أيام.
8- الفحص الوراثي لارتباط سطح الخلية
- بيليه مكتبة الخلايا المتحولة في 200 × ز لمدة 5 دقيقة وإعادة تعليق الخلايا في برنامج تلفزيوني.
- تقسيم الخلايا إلى أنبوبين مخروطي 15 مل مع ما لا يقل عن 50 × 106 خلايا في كل أنبوب.
- تدور أنبوب مخروطي واحد في 200 × ز لمدة 5 دقيقة، وإزالة supernatant، وتجميد بيليه الخلية في -20 درجة مئوية. هذا هو عدد السكان السيطرة وسيتم معالجتها في وقت لاحق.
- إعادة تعليق بيليه في أنبوب آخر في 10 مل من PBS/1% BSA. وضع جانبا 100 ميكرولتر من الخلايا كتحكم سلبي على لوحة بئر 96.
- إضافة البروتين المؤتلف preconatated المناسب لتعليق الخلية في أنبوب مخروطي والبروتينات السيطرة السلبية إلى لوحة جيدا 96.
- تنفيذ تلطيخ الخلية لمدة 1 ساعة على الأقل في 4 درجة مئوية على الدوار على مقاعد البدلاء مع دوران لطيف (6 دورة في الدقيقة).
- بيليه الخلايا في 200 × ز لمدة 5 دقيقة، وإزالة supernatant. تنفيذ خطوتين غسل، ثم إعادة تعليق الخلايا في 5 مل من برنامج تلفزيوني.
- سلالة الخلايا على الرغم من مصفاة الخلية 30 ميكرون لإزالة مجموعات الخلايا. تحليل باستخدام فرز التدفق.
- استخدم عينة التحكم السلبية لبوابة خلايا BFP+/PE.
- فرز العينة وجمع خلايا BFP +/PE. سوف تعتمد بوابات الفرز على ربط الخلايا بالبروتين ولكن عادة ما يتم جمع 1-5٪ من العينات السلبية PE. يتم توفير مثال لبوابة الفرز في الشكل التكميلي 1.
- جمع 500،000-1،000،000 الخلايا من البوابة المختارة. وبالنظر إلى انخفاض عدد الخلايا، فكر في جمع العينات في أنبوب الطرد المركزي الذي يبلغ 1.5 مل لتقليل الخسائر.
- بيليه الخلايا التي تم فرزها عن طريق الطرد المركزي في 500 × ز لمدة 5 دقيقة. إزالة بعناية supernatant وتجاهل. من الممكن تخزين الكريات عند -20 درجة مئوية لمدة تصل إلى 6 أشهر.
9- استخراج الحمض النووي الجينومي وأول PCR لتخصيب الرنا
- استخراج الحمض النووي الجينومي من السكان عالية التعقيد السيطرة.
- إذا تم تجميد السكان السيطرة في -20 درجة مئوية، إخراج أنبوب مخروطي وإضافة برنامج تلفزيوني. الحفاظ على الجليد لإذابة بيليه.
- استخدام مجموعة تجارية (انظر جدول المواد)باستخدام توصيات الشركة المصنعة لاستخراج الحمض النووي الجينومي من 50 × 106 خلايا. ضبط تركيز الحمض النووي إلى 1 ملغ / مل.
- لكل عينة، قم بإعداد مزيج رئيسي لـ PCR مقابل 72 ميكروغرام من الحمض النووي. Aliquot 50 μL لكل بئر في 36 بئرا من 96 بئر PCR لوحة. يتم سرد التسلسلات التمهيدي ة الضرورية في الجدول 4. استخدم الدليل في الجدول 5 و6.
- حل 5 ميكرولتر من PCR من 6-12 عينات تمثيلية على 2٪ (ث / في) هلام agarose. وينبغي ملاحظة شريط واحد واضح في 250 نقطة با ~. إذا كانت النطاقات خافتة، كرر PCR لدورات إضافية 2-3.
- استخدام ماصة متعددة القنوات لجمع 5 ميكرولتر من منتجات PCR من كل بئر (180 ميكرولتر في المجموع) وتجميعها في خزان مع 900 ميكرولتر من المخزن المؤقت الملزم من مجموعة تجارية (انظر جدول المواد).
- تنقية منتجات PCR باستخدام مجموعة تنقية PCR التجارية. الحمض النووي الملتل إلى 50 ميكرولتر من العازلة elution من مجموعة تجارية (انظر جدول المواد)وقياس تركيز الحمض النووي.
- ومن غير المرجح أن تتألف العينات التي تم فرزها لفقدان النمط الظاهري الملزم من عدد كبير من المستنسخين المستقلين. لذلك ، ليس من الضروري إجراء PCR مع 72 ميكروغرام من الحمض النووي. عزل الحمض النووي باستخدام مجموعة تجارية مناسبة (انظر جدول المواد). إعداد 3-4 تفاعلات PCR باستخدام البروتوكول الموصوف من قبل (القسم 9.1.3) مع 100 نانوغرام/ميكرولتر الحمض النووي. إذا كان عدد الخلايا التي تم فرزها أقل من 100,000 استخدام الخلايا بدلاً من مستحضرات الحمض النووي الجينومي.
- Aliquot ما يقرب من 10،000 الخلايا / جيدا في 96 بئر PCR لوحة.
- بيليه الخلايا في لوحة وإزالة بعناية معظم supernatant. لن تكون الكريات مرئية.
- إضافة 25 ميكرولتر من الماء في كل بئر وتسخين العينات في 95 درجة مئوية لمدة 10 دقيقة.
- أضف 5 ميكرولتر من 2 ملغم/مل بروتيني المخفف الطازج K إلى كل بئر لمدة ساعة واحدة واحتضان عند 56 درجة مئوية. ثم تسخين العينة لمدة 10 دقيقة في 95 درجة مئوية لتعطيل proteinase K.
- استخدام 10 ميكرولتر من خليط الخلية lysate لكل تفاعل PCR. يجب استخدام الليسات في غضون 24 ساعة.
10- الجولة الثانية من PCR لترميز المؤشرات وتسلسلها
- تمييع المنتجات من الدور الأول PCR إلى 40 pg/μL.
- إعداد PCR واحد لكل عينة (استخدم الدليل الوارد في الجدولين 7 و 8). استخدام البوليميراز عالية الدقة مهم لتقليل الأخطاء التي أدخلتها البوليمرات أثناء تضخيم sgRNA.
- حل 5 ميكرولتر من منتجات PCR على 2٪ (ث / v) هلام agarose. وينبغي ملاحظة نطاق واحد واضح في 330 نقطة أساس ~.
- تنقية منتجات PCR باستخدام الخرز شبه المغناطيسي عن طريق إضافة 31.5 ميكرولتر من (0.7x حجم إجمالي) من الخرز إعادة تعليق لمنتجات PCR، وخلط جيدا، واحتضان لمدة 5 دقيقة في RT.
- ضع الأنبوب على رف مغناطيسي لمدة 3 دقيقة. يجب التقاط الخرز على جانب اللوحة وينبغي أن يكون الحل واضحًا. إزالة بعناية وتجاهل supernatant.
- أضف 150 ميكرولتر من 80% من الإيثانول الطازج إلى الأنبوب. احتضان لمدة 30 s، ومن ثم إزالة بعناية وتجاهل supernatant.
- كرر الخطوة 13.6، هذه المرة مع 180 ميكرولتر. ثم يجفف الهواء الخرز لمدة 5 دقيقة.
- إزالة أنبوب من المغناطيس. هدف الحمض النووي الملتمّل من الخرز إلى 35 ميكرولتر من عازل EB المعقم. احتضان لمدة 3 دقيقة، ثم وضع أنبوب مرة أخرى في الرف المغناطيسي لمدة 3 دقيقة.
- نقل ما يقرب من 30 ميكرولتر من supernatant التي تحتوي على منتجات PCR eluted إلى أنبوب نظيف.
- تسلسل العينات على منصة تسلسل الجيل التالي. بالنسبة لمكتبة HumanV1 gRNA، استخدم التمهيدي المخصص المدرج في الجدول 4 لتسلسل 19 bp.
11- تحليل المعلوماتية الحيوية لتحديد المستقبلات والمسارات ذات الصلة
- تسلسلات الخريطة من المحتوى المصنف وغير المصنف إلى المكتبة المرجعية باستخدام دالة العد لـ MAGeCK. سوف تسفر الدالة عن ملف عدد خام(الجدول التكميلي 1).
ملاحظة: ترد التعليمات التفصيلية بشأن تركيب MAGeCK واستخدام وظائف مختلفة داخل MAGeCK في بروتوكول نشر سابقا من قبل وانغ وآخرون20. - تحقق من المعيار الفني لمكتبة التحكم المستخدمة في الشاشة.
- متوسط تطبيع التهم الخام واستخدام حزمة ggplot2 في R21 أو ما يعادلها من البرامج لرسم مؤامرة دالة الكثافة التراكمية التجريبية للأعداد في البلازميد والتحكم في عينات غير مصنفة(الشكل 5A).
- تشغيل دالة -اختبار MAGeCK باستخدام العد من السكان plasmid كـ "تحكم" والعد من عينات التحكم غير المصنفة كعينة "اختبار". الدالة سوف تسفر عن ملف ملخص الجينات(الجدول التكميلي 1).
- افتح ملف ملخص الجينات ورسم توزيع تغييرات طي ة السجل(عمود neg|lfc) للجينات الأساسية وغير الأساسية المصنفة مسبقًا22 (الشكل 5B).
- حدد الجينات المستنفدة بشكل كبير(neg|fdr < 0.05) وإجراء تحليل إثراء المسار باستخدام حزمة المثري23 أو أي حزم إثراء مسار مكافئة في R(الشكل 5C).
- تشغيل دالة -اختبار MAGeCK مع الإعداد الافتراضي. استخدام التهم الخام من عينة التحكم غير المصنفة كما"التحكم"والتهم من عينة فرزها باسم"العلاج"عند إجراء التحليل.
- افتح ملف ملخص الجينات الذي تم إنشاؤه بواسطة MAGeCK ورتب عمود رتبة pos|بترتيب تصاعدي. استخدم FDR (pos|fdr column) < 0.05 كقطع لتحديد الزيارات. عادة ما يتم ترتيب المستقبلات بشكل كبير ، في كثير من الأحيان في المركز الأول.
- رسم قوية الترتيب خوارزمية (RRA) عشرات للاختيار الإيجابي(pos|score)في R أو ما يعادلها من البرامج(الشكل 5D).
- حدد الجين يضرب وإجراء تحليل إثراء المسار باستخدام حزمة التخصيب أو أي حزم إثراء مسار مكافئ ة في R لتحديد المسارات المخصب.
النتائج
وترد بيانات التسلسل المستمدة من شاشتين تمثيليتين بالضربة القاضية على نطاق الجينوم لتحديد الشريك الملزم للـ TNFSF9 البشري وP. falciparum RH5 اللتين أجريتا في خلايا NCI-SNU-1 و HEK293 على التوالي(الجدول التكميلي 1). تأثر السلوك الملزم لRH5 بكل من كبريتات الهيباران ومستقبلاتها المعروفة BSG24 (الشكل 3C)، في حين أن TNFRSF9 ملزمة على وجه التحديد بمستقبلاتها المعروفة TNFSF9 ولم تفقد الربط على الحضانة المسبقة مع الهيبارين القابل للذوبان. يمثل البروتين 3 في الشكل 3B TNFRSF9.
بالنسبة لكلا الخطين الخلويين ، يتم توفير توزيع gRNAs في مكتبة متحولة التحكم بعد 3 أيام (9 و 14 و 16 يومًا بعد النقل)(الجدول التكميلي 1). وكشف توزيع الهيئة أن تعقيد المكتبة استمر طوال فترة التجربة(الشكل 5أ). تم تنفيذ الشاشة الوراثية لتحديد ليغاند لTNFSF9 في اليوم 14 بعد النقل، في حين أن لRH5 تم تنفيذ اليوم 9 بعد النقل. تم تقييم الجودة التقنية للشاشات من خلال فحص توزيع التغيرات المزدوجة الملحوظة لـ gRNAs التي تستهدف مجموعة مرجعية من الجينات غير الأساسية مقارنة بتوزيع المجموعة المرجعية من الجينات الأساسية22 (الشكل 5B). وبالإضافة إلى ذلك، كشف الإثراء على مستوى المسارات أيضا ً عن تحديد المسارات الأساسية المتوقعة وإثراؤها بشكل كبير في السكان "المتسربين" عند مقارنة عينة التحكم بالمكتبة البلازمية الأصلية. مثال على عينة اليوم 14 NCI-SNU-1 هو مبين في الشكل 5C.
تم استخدام توزيع gRNAs في عنصر التحكم مقابل السكان المصنفين باستخدام وظيفة -اختبار MAGeCK (انظر الجدول التكميلي 1 للحصول على إخراج ملخص الجينات من MAGeCK) لتحديد المستقبلات من شاشات الفينوتيبيك. يتم رسم درجة RRA المعدلة التي أبلغ عنها MAGeCK في تحليل مستوى الجينات ضد الجينات المرتبة حسب قيم p. توفر درجة RRA في MAGeCK مقياسًا يتم فيه تصنيف gRNAs بشكل ثابت أعلى من المتوقع. في الشاشة لTNFRSF9، وكان ضرب أعلى TNFSF9، وهو شريك ملزم معروف من TNFRSF9(الشكل 5D). وبالإضافة إلى ذلك، تم أيضا تحديد عدد من الجينات المتصلة بمسار TP53. في حالة RH5 ، بالإضافة إلى المستقبلات المعروفة(BSG)والجين المطلوب لإنتاج GAGs سلفتال(SLC35B2)، تم تحديد جين إضافي(SLC16A1)أيضًا(الشكل 5E). SLC16A1 هو مرافق مطلوب للاتجار BSG إلى سطح الخلايا25. معا، هذه النتائج تثبت قدرة الشاشة على تحديد المستقبلات التفاعل مباشرة والمكونات الخلوية اللازمة لتلك المستقبلات ليتم التعبير عنها على سطح الخلايا في شكل وظيفي.
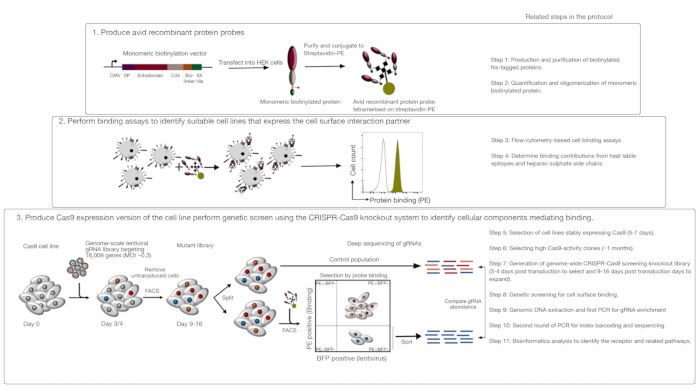
الشكل 1: نظرة عامة على نهج الفحص الجيني لتحديد مستقبلات سطح الخلايا. يتكون هذا الفحص من ثلاث خطوات رئيسية: أولاً، يتم التعبير عن البروتينات المؤتلفة التي تمثل ectodomain من مستقبلات سطح الخلية في خط الخلية التي يمكن أن تضيف تعديلات ما بعد الترجمة الحرجة هيكلياً مثل خلايا HEK293. يتم oligomerized البروتين monomeric ectodomains عن طريق الاقتران إلى streptavidin-PE لزيادة avidity ملزمة. ثانياً، يتم استخدام هذه المسابير المتعطشة في المقالات الخلوية الملزمة حيث يظهر تلطيخ ساطع على خطوط الخلية المشار إليه بتحول بارز في الفلورسال PE (باللون الأخضر) مقارنة بروتين التحكم السلبي (باللون الأسود) وجود شريك ربط سطح الخلية. ثالثاً، يتم اختيار خطوط الخلايا الإيجابية من Cas9 المستقبلة ويتم إجراء فحص على نطاق الجينوم باستخدام gRNAs الذي يستهدف الغالبية العظمى من جينات ترميز البروتين. أثناء توليد المكتبات المتحولة ، من الشائع استخدام كفاءة نقل 30 ٪ ، والتي تستند إلى احتمال توزيع Poisson الذي يضمن حصول كل خلية على gRNA واحد بحيث يعزى النمط الظاهري الناتج إلى ضربة قاضية محددة. يتم استخدام علامة BFP التي تعبر عنها الخلايا المستحثة لتحديد الخلايا التي تحتوي على gRNAs باستخدام FACS. يتم تنفيذ شاشات فينوتيبيك بين 9-16 يوما بعد نقل. في يوم الشاشة، يتم تقسيم إجمالي عدد خلايا المتحولة إلى قسمين. يتم الاحتفاظ نصف واحد كما السكان السيطرة ويتم اختيار النصف الآخر لربط البروتين المؤتلف. يتم فرز الخلايا من المكتبة المتحولة التي لم تعد قادرة على ربط البروتين المؤتلف باستخدام FACS ويستخدم إثراء gRNAs في مجموعة الفئات المصنفة مقابل التحكم لتحديد الجينات المطلوبة لربط سطح الخلية من المسبار متعطشا المسمى. يشار إلى الخطوات في البروتوكول التي تتطلب وقتاً طويلاً. وقد تم تعديل هذا الرقم من شارما وآخرون19. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
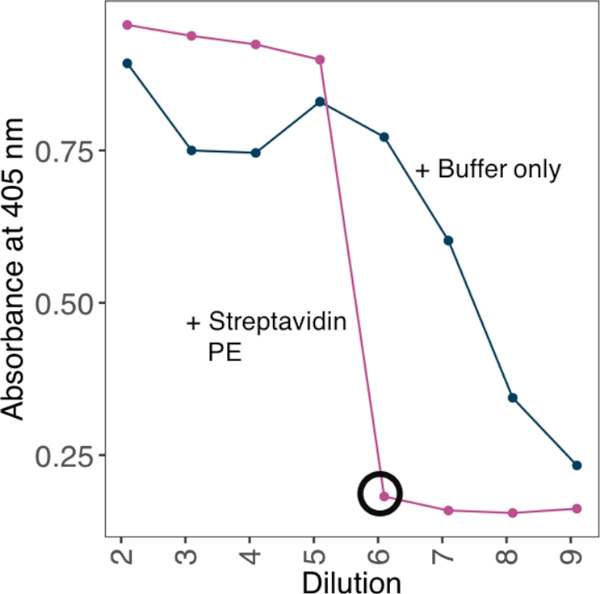
الشكل 2: تحديد نسب البروتين الضئيل بيولوجيا إلى العقديات-PE باستخدام طريقة تستند إلى ELISA. مثال على استراتيجية الاقتران العقدية PE المستخدمة لتوليد مسبار متعطشا من بروتين أحادي الحجم حيوي. تم احتضان سلسلة تخفيف من مونومرات التضمين الحيوي ضد تركيز ثابت من العقديات. تم تحديد الحد الأدنى من التخفيف الذي لا يمكن الكشف عن مونومرات حيوية زائدة من قبل ELISA. تم تنفيذ ELISA مع أو بدون preincubatiing مجموعة من تخفيف البروتين مع 10 نانوغرام من streptavidin-PE. في وجود العقديات-PE، تم حساب الحد الأدنى من التخفيف الذي لم يتم فيه تحديد أي إشارة (سوداء محاطة بدائرة) وكمية البروتين المطلوبة للتشبع لتوليد محلول مخزون 10x مع 4 ميكروغرام/مل ستريبيتافيدان-PE. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
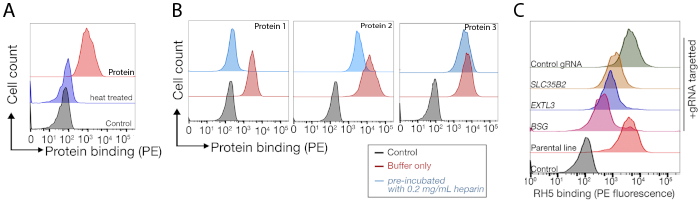
الشكل 3: ربط تمثيل البروتينات بخطوط الخلايا. (أ)كان البروتين ملزمة لخطوط الخلية زيادة واضحة في الفلورسان المرتبطة الخلية مقارنة مع عينة التحكم. المعالجة الحرارية (80 درجة مئوية لمدة 10 دقيقة) من البروتين المؤتلف إلغاء جميع ملزمة مرة أخرى إلى السيطرة السلبية، مما يدل على أن السلوك الملزم كان يعتمد على البروتين مطوية بشكل صحيح. (ب)فئات مختلفة من سلوك ربط البروتين لأسطح الخلايا؛ الاعتماد على GAGs. من اليسار إلى اليمين ، يمكن تصنيف البروتينات إلى ثلاثة أنواع: البروتين من النوع 1 فقط الممتزات إلى HS. هذه البروتينات تفقد ملزمة بعد الحضانة المسبقة مع تركيزات الهيبارين أكثر من 0.2 ملغ / مل. بروتين نوع 2 يرتبط HS بالإضافة إلى مستقبلات محددة. تفقد هذه البروتينات الربط الجزئي في تجارب الحجب المسبق. البروتين نوع 3 لا يربط HS. هذه البروتينات لا تفقد ملزمة بالمقارنة مع خطوط الوالدين. (ج)مثال على البروتين (أي RH5) الذي يرتبط HS ومستقبلات محددة بطريقة مضافة. استهداف إما المستقبلات (أي BSG) أو الإنزيمات اللازمة لتخليق HS (على سبيل المثال، SLC35B2، EXTL3) يقلل جزئيا فقط من ربط RH5 بالخلايا نسبة إلى الضوابط. يمكن استخدام الخطوط متعددة النسيلة المستحثة في مثل هذه التجارب لإنشاء سلوك ملزم. وقد تم تعديل هذا الرقم من شارما وآخرون19. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
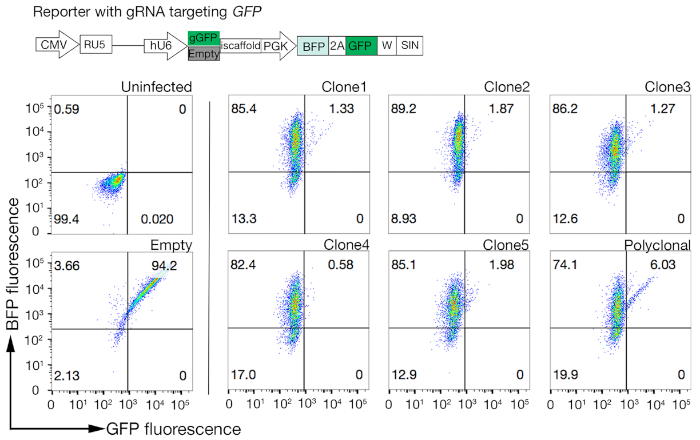
الشكل 4: اختيار خطوط الخلايا الكلونية مع نشاط Cas9 عالية. تم تقييم كفاءة تحرير الجينوم لكل من الخطوط متعددة الكلونات والمستنسخة من خطوط الخلايا NCI-SNU-1 باستخدام نظام مراسل GFP-BFP ، حيث تم نقل خطوط الخلايا بفيروسات مع بلازميد مرمم ة GFP أو بدونه (أي "فارغ"). يتم تصوير مخطط. تم استخدام قياس الخلايا التدفق لاختبار كل من التعبير BFP وGFP بعد نقل ومقارنة مع التحكم غير المصاب. تم استخدام تعبير GFP كوكيل لنشاط Cas9، في حين أن تعبير BFP وضع علامة على الخلايا المستحثة. بدا الملف الشخصي للخلايا المصابة غير المصابة والفارغة مشابهًا لجميع المستنسخين. يتم تصوير الملامح التمثيلية في اللوحة اليسرى. وأظهرت جميع المستنسخين الخمسة من خط الخلية NCI-SNU-1 خسارة أعلى من GFP مقارنة بالخط متعدد الكلونات (اللوحة اليمنى)، مع استنساخ 4 تظهر أعلى كفاءة مع أقل عدد من السكان الانكسار. وقد تم تعديل هذا الرقم من شارما وآخرون19. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
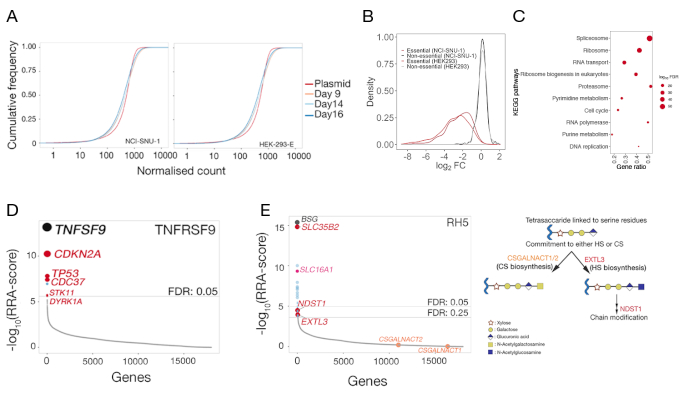
الشكل 5: النتائج التمثيلية من الشاشات الوراثية لتحديد شركاء ربط سطح الخلية. (أ)مخططات دالة التوزيع التراكمي ة التي تقارن وفرة الغرامنا في مكتبة البلازميد بالمكتبات المتحولة لخلايا HEK-293-E و NCI-SNU-1 في اليوم 9 و 14 و 16 يومًا بعد النقل. بالنسبة لأي رقم معين، تقوم دالة الكثافة التراكمية بالإبلاغ عن النسبة المئوية لنقاط البيانات التي كانت أقل من تلك العتبة. يمثل التحول الصغير في عدد الخلايا المتحولة مقارنة بالسكان البلازميد الأصلي الاستنفاد في مجموعة فرعية من gRNAs مقارنة بمكتبة البلازميد. (ب)توزيع التغيرات في الحظيرة في الجينات التي تم تصنيفها سابقا ً على أنها أساسية (حمراء) أو غير ضرورية (سوداء) في خطوط الخلية HEK293 و NCI-SNU-1. تركز توزيع التغيرات المطوية للجينات غير الضرورية في ~ 0 ، في حين أن الجينات الأساسية تحولت إلى اليسار نحو تغييرات أضعاف سلبية. (C)مسارات غنية بشكل كبير في الجينات المستنفدة في NCI-SNU-1 مجموعة التحكم المتحولة 14 يوما بعد النقل. تم تحديد المسارات المعروفة المتوقعة للخلايا الأساسية. (D)خوارزمية رتبة قوية (RRA) - درجة للجينات التي تم إثراؤها في الخلايا التي تم فرزها التي فقدت القدرة على ربط المسبار TNFRSF9. تم تصنيف الجينات وفقا لRRA-النتيجة. تم تحديد شريك التفاعل المعروف TNFSF9 والجينات المتعلقة بمسار TP53 (المسمى باللون الأحمر) في الشاشة. (E)رتب مرتبة RRA-عشرات للجينات المحددة من تحليل الإثراء gRNA المطلوبة لربط RH5 لخلايا HEK293 (اللوحة اليسرى). تم تحديد SLC35B2 و SLC16A1 ضمن عتبة معدل اكتشاف زائف (FDR) من 5٪. تم تحديد جينين إضافيين في مسار التمثيل الحيوي HS (أي EXTL3 و NDST1)داخل FDR من 25٪. التخطيطي الذي يصور مسار التمثيل الحيوي العام لـ GAG مع الجينات ذات الصلة المرسومة إلى الخطوات المقابلة (اللوحة 2). لم يتم تحديد الجينات المطلوبة للالتزام بالتكوين الحيوي لكبريتات الشوندرويتين (أي CSGALNACT1/2)في الشاشة. وقد تم تعديل هذا الرقم من شارما وآخرون19. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
| اسم بلازميد | بلازميد # | استخدام |
| بناء التعبير البروتين: CD200RCD4d3+4-bio-linker-له | Addgene: 36153 | إنتاج البروتين المؤتلف مع CD4d3 +4، البيوتين و6-العلامات له. |
| pMD2.G | أدجين: 12259 | VSV-G مغلف التعبير عن البلازميد; إنتاج الفيروس lentivirus |
| PSPAX2 | Addgene: 12260 | التعبئة والتغليف Lentiviral plasmid، وإنتاج فيروس lentivirus |
| Cas9-بناء: pKLV2-EF1a-Cas9Bsd-W | Addgene: 68343 | إنتاج خط Cas9 المعبر عن الأساسان |
| gRNA بناء التعبير: pKLV2-U6gRNA5 (BbsI)-PGKpuro2ABFP-W | Addgene: 67974 | CRISPR gRNA ناقلات التعبير مع سقالة محسنة وعلامات puro / BFP |
| الإنسان تحسين الجينوم على نطاق مكتبة CRISPR خروج المغلوب | Addgene: 67989 | مكتبة gRNA ضد 18010 الجينات البشرية، مصممة للاستخدام في الفيروس lentivirus. |
| GFP-BFP بناء: pKLV2-U6gRNA5 (gGFP)-PGKBFP2AGFP-W | Addgene: 67980 | Cas9 مراسل النشاط مع BFP وGFP. |
| بناء فارغ: pKLV2-U6gRNA5 (فارغ)-PGKBFP2AGFP-W | Addgene: 67979 | Cas9 نشاط مراسل (مراقبة) مع BFP وGFP. |
الجدول 1: البلازميدات المستخدمة في هذا النهج.
| اسم المخزن المؤقت | مكونات |
| HBS (10X) | 1.5 M NaCl و 200 mM HEPES في مياه MiliQ ، والتكيف مع درجة الحموضة 7.4 |
| برنامج تلفزيوني (10X) | 80 غرام NaCl، 2 غرام KCl، 14.4 غرام نا2HPO4 و 2.4 ز KH2PO4 في مياه MiliQ، والتكيف مع درجة الحموضة 7.4 |
| عازل فوسفات الصوديوم (مخزون 80 mM) | 7.1 غ Na2HPO4.2H2O, 5.55 g NaH2PO4,ضبط لـ pH 7.4 |
| له تنقية ربط المخزن المؤقت | 20 mM الصوديوم الفوسفات المخزن المؤقت، 0.5 M NaCl و 20 mM Imidazole، وضبط لدرجة الحموضة 7.4 |
| له تنقية الحواجز المؤقتة التوطي | 20 mM الصوديوم الفوسفات المخزن المؤقت، 0.5M NaCl و 400 mM Imidazole، وضبط لدرجة الحموضة 7.4 |
| عازل ديإيثانولامين | 10٪ ديإيثانامين و 0.5 mM MgCl2 في المياه MiliQ، والتكيف مع درجة الحموضة 9.2: |
| D10 | DMEM، 1٪ البنسلين-streptomycin (100 وحدة / مل) و 10٪ الحرارة المعطلة FBS |
الجدول 2: المخازن المؤقتة المطلوبة لهذه الدراسة.
| مكونات | طبق بطول 10 سم | 6-جيدا لوحة |
| خلايا 293FT | 70-80% مُحُرّة | 70-80% مُحُرّة |
| وسائط متوافقة مع الترانزستور (Opti-MEM) (الخطوة 5.1.2) | 3 مل | 500 ميكرولتر |
| وسائط متوافقة مع الترانزستور (Opti-MEM) (الخطوة 5.1.4) | 5 مل | 2 مل |
| ناقلات نقل اللينفيس | 3 ميكروغرام | 0.5 ميكروغرام |
| psPax2 (انظر الجدول 1) | 7.4 ميكروغرام | 1.2 ميكروغرام |
| pMD2.G (انظر الجدول 1) | 1.6 ميكروغرام | 0.25 ميكروغرام |
| كاشف PLUS | 12 ميكرولتر | 2 ميكرولتر |
| ليفيفكتامين LTX | 36 ميكرولتر | 6 ميكرولتر |
| D10 (الخطوة 7.1.7) | 5 مل | 1.5 مل |
| D10 (الخطوة 7.1.8 و 7.1.10) | 8 مل | 2 مل |
الجدول 3: كميات وكميات الكواشف لمزيج التعبئة والتغليف lentivirus.
الجدول 4: تسلسل التمهيدي لتضخيم gRNA وNGS. يرجى الضغط هنا لعرض هذا الملف (انقر على الحق للتحميل).
| كاشف | حجم لكل رد فعل | مزيج رئيسي (x38) |
| Q5 الساخنة بداية عالية الإخلاص 2x | 25 ميكرولتر | 950 ميكرولتر |
| مزيج التمهيدي (L1/U1) (10 ميكرومتر لكل منهما) | 1 ميكرولتر | 38 ميكرولتر |
| الحمض النووي الجينومي (1 ملغ/مل) | 2 ميكرولتر | 72 ميكرولتر |
| H2O | 22 ميكرولتر | 1100 ميكرولتر |
| مجموع | 50 ميكرولتر | 1900 ميكرولتر |
الجدول 5: الـ PCR لتضخيم gRNAs من عينات عالية التعقيد.
| رقم الدورة | التشوه | الصلب | ملحق |
| 1 | 98 درجة مئوية، 30s | ||
| 2-24 | 98 درجة مئوية، 10s | 61 درجة مئوية، 15s | 72 درجة مئوية، 20s |
| 25 | 72 درجة مئوية، 2 دقيقة |
الجدول 6: شروط الPCR لأول PCR.
| كاشف | حجم لكل رد فعل |
| كابا هيفي هوت ستارت ReadyMix | 25 ميكرولتر |
| التمهيدي (PE1.0/index التمهيدي) مزيج (5 ميكرومتر لكل منهما) | 2μL |
| أول منتج PCR (40 pg/μL) | 5 ميكرولتر |
| H2O | 18 ميكرولتر |
| مجموع | 50 ميكرولتر |
الجدول 7: PCR لوضع علامات مؤشر sgRNAs من الشاشات الوراثية.
| رقم الدورة | التشوه | الصلب | ملحق |
| 1 | 98 درجة مئوية، 30s | ||
| 2-15 | 98 درجة مئوية، 10s | 66 درجة مئوية، 15s | 72 درجة مئوية، 20s |
| 16 | 72 درجة مئوية، 5 دقيقة |
الجدول 8: شروط PCR لثاني PCR.
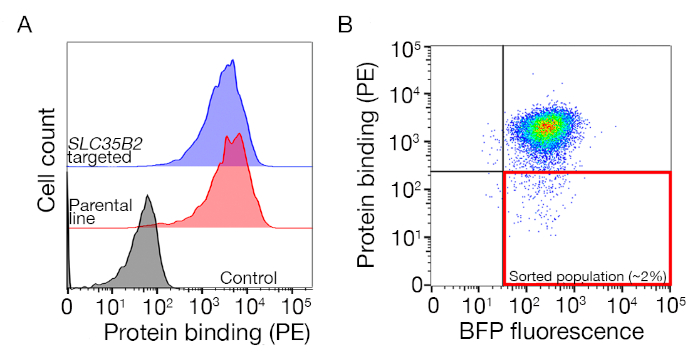
الشكل التكميلي S1: دليل لرسم بوابات لفرز السكان غير الملزمين. (أ)يجب أن يكون المرشح المثالي للبروتين للفحص تحولًا واضحًا في عدد السكان الملزمين مقارنة بالسكان المسيطرين ويجب الاحتفاظ بالربط على الخلايا التي تفتقر إلى الآلات اللازمة للتخليق الحيوي HS. يمكن استخدام تجربة حظر الهيبارين بدلاً من الاختبار على خطوط الخلايا المستهدفة SLC35B2. (ب)تم جمع الخلايا التي تفتقر إلى تلطيخ السطح من ectodomain البروتين ولكن التعبير عن الفلور BFP من نقل اتلافيس. الخلايا المعروضة هي من شاشة لتحديد مستقبلات لGABBR222. وقد تم تعديل هذا الرقم من شارما وآخرون19. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
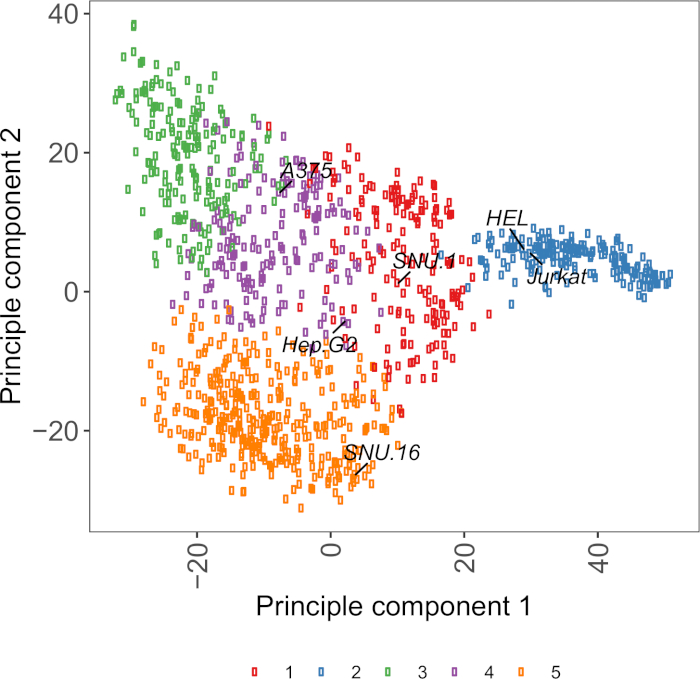
الرقم التكميلي S2: الخلايا السطحية الجليكوبروتين النسخ تستند مؤامرة PCA باستخدام بيانات RNA-seq من أكثر من 1000 خطوط الخلايا السرطانية. تم تجميع خطوط الخلية من Cell Model Passport27 باستخدام K-وسائل التجميع وفقًا لقيم FPKM من البروتينات الجليكوبروتينات السطحية للخلايا 1500~. يتم تسمية خطوط الخلية التمثيلية من كل مجموعة. كانت المجموعة 5 تتكون بالكامل من خطوط الخلايا ذات الأصل الهيماتوبويتيك (انظر أيضا الجدول التكميلي 2). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
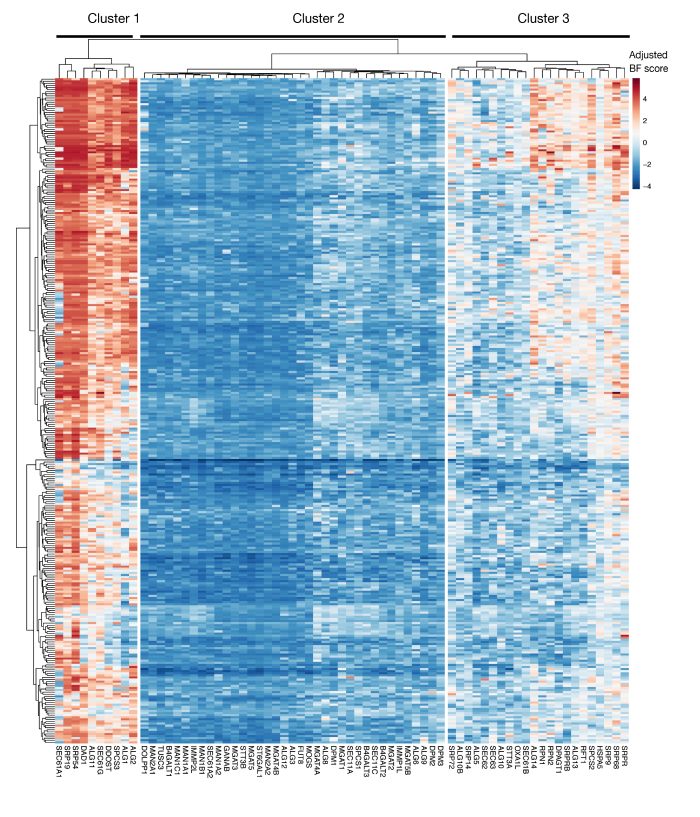
الرقم التكميلي S3: درجات الأهمية لتصدير بروتين KEGG-annotation وجينات glycosylation المرتبطة بـ N من درجات المشروع. يتم رسم درجات أساسيات بايز المعدلة لخطوط الخلايا ~ 330 (أعمدة ، غير المسمى) لجينات تصدير البروتين ومسار glycosylation المرتبطة بـ N (المحور X). عشرات أعلى من 0 تمثل استنزاف كبير في السكان متحولة بالمقارنة مع مكتبة البلازميد الأصلي. يمكن تقسيم الجينات إلى ثلاث مجموعات متميزة تمثل مستويات مختلفة من الأهمية في خطوط الخلية. يمكن استخدام هذا التجميع لتحديد يوم الفرز. إذا تم تنفيذ الشاشة في وقت متأخر من الوقت (اليوم 16)، فمن الممكن أن الجينات التي من المعروف أن تكون ضرورية للخلايا (الكتلتين 1 و 3) لن يتم تحديدها. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي 1: ملفات العد الخام لبرامج MAGeCK التي تم إنشاؤها gene_summary الملفات المتعلقة بالشاشات الوراثية التمثيلية. يرجى الضغط هنا لعرض هذا الملف (انقر على الحق للتحميل).
الجدول التكميلي 2: تجميع خطوط الخلايا وفقًا للتعبير عن مستقبلات سطح الخلية. يرجى الضغط هنا لعرض هذا الملف (انقر على الحق للتحميل).
Discussion
يتم وصف استراتيجية الفحص المستندة إلى CRISPR لتحديد الجينات ترميز المكونات الخلوية المشاركة في التعرف على الخلوية. كما يوفر نهج مماثل باستخدام تنشيط CRISPR بديلا ً جينياً لتحديد مستقبلات البروتينات المؤتلفة المتفاعلة بشكل مباشر دون الحاجة إلى إنشاء مكتبات بروتينكبيرة26. ومع ذلك ، فإن إحدى المزايا الرئيسية لهذا النهج هي أنه ينطبق على التفاعلات التي تتوسط فيها جزيئات السطح المعروضة في الأصل على الخلية ولا تعتمد على التعبير المفرط للمستقبلات ، والتي يمكن أن تؤثر على التفاني الملزم للمستقبلات. على عكس الطرق الأخرى ، لذلك ، لا تقدم هذه التقنية افتراضات بشأن الطبيعة الكيميائية الحيوية أو بيولوجيا الخلايا للمستقبلات وتوفر فرصة لدراسة التفاعلات التي تتوسط فيها البروتينات التي يصعب عادة دراستها باستخدام الأساليب الكيميائية الحيوية ، مثل البروتينات الكبيرة جدًا ، أو تلك التي تجتاز الغشاء عدة مرات أو تشكل مجمعات مع بروتينات أخرى ، وجزيئات أخرى غير البروتينات مثل الجليكان ، والدهون الجليكولوجية ، والفوسفوليبيدات. وبالنظر إلى طبيعة نطاق الجينوم للطريقة ، فإن هذا النهج له ميزة ليس فقط تحديد المستقبلات ولكن أيضًا المكونات الخلوية الإضافية المطلوبة للحدث الملزم ، وبالتالي توفير رؤى حول بيولوجيا الخلية للمستقبلات.
واحدة من القيود الرئيسية لهذه الطريقة عند استخدامها لتحديد مستقبلات البروتين اليتيم هو الشرط الأولي لتحديد خط الخلية الأولى التي ترتبط بالبروتين. هذا ليس من السهل دائماوتحديد خط الخلية التي تعرض النمط الظاهري ملزمة التي هي أيضا متساهلة للشاشات الوراثية يمكن أن تكون الخطوة التي تحدد الوقت لنشر هذا الفحص. بعض خطوط الخلايا تميل إلى ربط المزيد من البروتينات من غيرها. هذا هو ذات الصلة خاصة للبروتينات التي تربط HS، لأن هذه البروتينات تميل إلى ربط أي خط الخلية التي تعرض سلاسل الجانب HS، بغض النظر عن سياق الربط الأصلي. بالإضافة إلى ذلك ، لاحظنا أن رفع تنظيم syndecans (أي البروتيوغليكانات التي تحتوي على HS) في خطوط الخلايا يؤدي إلى زيادة ربط البروتينات الملزمة HS26. قد يكون هذا عاملاً يجب أخذه في الاعتبار عند اختيار خط الخلية للفحص. ومع ذلك، من المهم أيضا أن نلاحظ أن الربط المضافة من HS لا تتداخل مع ملزمة لمستقبلات محددة. وهذا يعني أنه إذا لوحظ الربط، فمن الممكن أن يتم التوسط فقط من قبل HS لأن الربط بوساطة HS في هذا القول المضافة بدلاً من الاعتماد المشترك19. في مثل هذا السيناريو ، يمكن لنهج منع الهيبارين الموصوف تحديد مثل هذه السلوكيات دون الحاجة إلى إجراء شاشة جينية كاملة.
مورد مفيد لاختيار خطوط الخلية هو جواز سفر نموذج الخلية، الذي يحتوي على علم الجينوم، transcriptomics، ومعلومات حالة الثقافة ل ~ 1000 خطوط الخلايا السرطانية27. اعتمادا على السياق البيولوجي، يمكن اختيار الخلايا على أساس ملامح التعبير الخاصة بهم. للمساعدة في اختيار خطوط الخلية ، قمنا بتجميع ~ 1000 خط خلية في جواز سفر نموذج الخلية وفقًا للتعبير عن ~ 1500 بروتينات سطح الخلية البشرية المبوطة28 (الشكل التكميلي 2؛ يتم توفير معلومات الكتلة لكل خط خلية مع ظروف النمو في الجدول التكميلي 2). عند اختبار ربط بروتين مع وظيفة غير معروفة، فمن المفيد لتحديد لوحة من خطوط الخلية التمثيلية من كل مجموعة لزيادة فرصة تغطية مجموعة واسعة من المستقبلات. نظرا للاختيار، فمن المستحسن لاختيار خطوط الخلية التي هي سهلة للثقافة وسهلة لtransduce. وبما أن خطوط الخلايا هذه ستستخدم في الفحص على نطاق الجينوم، فمن الأفضل أن تزرع بسهولة بكميات كبيرة وتكون متساهلة مع نقل الفيروس، لأنها الطريقة الأكثر شيوعاً المتاحة لتسليم sgRNA للفحص الجيني القائم على CRISPR في الخطوات اللاحقة.
بشكل عام، يتم تنفيذ تحديدات النمط الظاهري في فرز واحد. ومع ذلك ، يتم تحديد هذا من خلال سطوع عدد الخلايا الملطخة مقارنة بعنصر التحكم. ويمكن اعتماد جولات تكرارية من التحديدات للسيناريوهات التي تكون فيها نسبة الإشارة إلى الضوضاء في النمط الظاهري المطلوب منخفضة، أو عندما يكون الهدف من الشاشة هو تحديد المسوخ التي لها أنماط ظاهرية قوية. عند استخدام نهج الاختيار التكراري للشاشات المستندة إلى FACS ، من المهم اعتبار أن عملية الفرز يمكن أن تسبب موت الخلايا ، ويرجع ذلك بشكل رئيسي إلى القوة المطلقة للفرز. وبالتالي، لن يتم تمثيل جميع الخلايا التي تم جمعها في الجولة التالية من الفرز.
تعقيد المكتبة هو عامل مهم جدا في أداء الشاشات الوراثية الناجحة، وخاصة بالنسبة لشاشات الاختيار السلبية لأن مدى الاستنفاد في هذه لا يمكن تحديده إلا من خلال مقارنة النتائج بما كان موجودا في مكتبة البداية. بالنسبة لشاشات التحديد السلبية، من الشائع الحفاظ على مكتبات بتعقيد 500-1000 x. ومع ذلك، فإن شاشات الاختيار الإيجابي أكثر قوة لأحجام المكتبات، لأنه في مثل هذه الشاشات لا يتوقع اختيار سوى عدد صغير من المسوخ لنوع ظاهري معين. لذلك ، في شاشة التحديد الإيجابي الموضحة هنا ، يمكن تقليل حجم المكتبة إلى تعقيد 50-100x دون المساس بجودة الشاشة. بالإضافة إلى ذلك ، في هذه الشاشات من الممكن أيضًا استخدام مكتبة تحكم لخط خلية معين في يوم معين كـ "عنصر تحكم عام" لجميع العينات التي تم فرزها في اليوم لهذا الخط الخلوي المحدد. سيؤدي ذلك إلى تقليل عدد مكتبات التحكم التي تحتاج إلى إنتاجها وتسلسلها.
ومن الاعتبارات الهامة الأخرى لاستخدام هذا النهج القيود المفروضة على شاشات فقدان الوظيفة في تحديد الجينات الضرورية لنمو الخلايا المختبرية. توقيت الشاشات أمر بالغ الأهمية في هذا الصدد ، حيث كلما طالت الخلايا المتحولة في الثقافة ، كلما زاد احتمال أن تصبح الخلايا ذات الطفرات في الجينات الأساسية غير قابلة للحياة ولم تعد ممثلة في المكتبة المتحولة. الشاشات الوراثية الأخيرة التي أجريت كجزء من مبادرة نقاط المشروع في أكثر من 300 خطوط الخلايا تظهر أن الجينات المتعددة في إفراز البروتين المشروح KEGG ومسار N-glycosylation غالبا ما يتم تحديدها على أنها ضرورية لعدد من خطوط الخلايا(الشكل التكميلي 3)29. ويمكن أن يؤخذ ذلك في الاعتبار عند تصميم الشاشات إذا كان تأثير الجينات المطلوبة للانتشار والجدوى هو التحقيق في سياق عملية التعرف على الخلايا. وفي هذه الحالة، يكون من المناسب عموماً تنفيذ الشاشات في وقت مبكر (على سبيل المثال، اليوم 9 بعد النقل). ومع ذلك، إذا تم استخدام النهج لتحديد عدد قليل من الأهداف ذات الآثار القوية الحجم بدلاً من المسارات الخلوية العامة، فقد يكون من المناسب إجراء الشاشات في وقت لاحق (على سبيل المثال، اليوم 15-16 بعد النقل).
نتائج الفحص قوية جداً. في ثماني شاشات ربط البروتين المؤتلف أجريت في الماضي، وكان مستقبلات سطح الخلية ضرب أعلى في كل حالة19. عند استخدام هذا النهج لتحديد شريك التفاعل، ينبغي للمرء أن يتوقع لذلك المستقبلات والعوامل التي تسهم في عرضه على السطح أن يتم تحديدها مع ثقة إحصائية عالية. بمجرد تنفيذ الشاشة والتحقق من صحة ضرب باستخدام ضربة قاضية gRNA واحدة، يمكن إجراء المزيد من المتابعة باستخدام الأساليب الكيميائية الحيوية القائمة مثل AVEXIS4 والربط المباشر قابل للإشباع من البروتينات النقية باستخدام صدى البلازمون السطحي. النهج الموصوف هنا ينطبق على جميع البروتينات التي من الممكن توليد مسبار ملزم قابل للذوبان.
باختصار ، هذا هو نهج خروج المغلوب CRISPR على نطاق الجينوم لتحديد التفاعلات التي تتوسط ها من قبل البروتينات سطح الخلية. تنطبق هذه الطريقة بشكل عام لتحديد المسارات الخلوية اللازمة للتعرف على سطح الخلية في مجموعة واسعة من السياقات البيولوجية المختلفة، بما في ذلك بين خلايا الكائن الحي نفسه (مثل التعرف العصبي والمناعة)، وكذلك بين الخلايا المضيفة والبروتينات المسببة للأمراض. توفر هذه الطريقة بديلاً جينياً للنهج البيوكيميائية المصممة لتحديد المستقبلات، ولأنها لا تتطلب أي افتراضات مسبقة فيما يتعلق بالطبيعة الكيميائية الحيوية أو بيولوجيا الخلايا للمستقبلات، فإن لديها إمكانات كبيرة لتحقيق اكتشافات غير متوقعة تماماً.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل منحة ويلكوم تراست رقم 206194 الممنوح لشركة GJW. نشكر منشأة Cytometry Core: Bee Ling Ng ، جنيفر غراهام ، سام طومسون ، وكريستوفر هول للمساعدة في FACS.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-mouse alkaline phosphatase | Sigma | A4656 | |
| Blasticidin | Chem-Cruz | SC-204655 | |
| Blood & Cell Culture DNA Maxi Kit | Qiagen | 13362 | |
| BSA | Sigma | A9647-100G | |
| Diethanolamine | Sigma | 398179 | |
| DMEM | Gibco | 31966-021 | |
| Dneasy Blood and Tissue kit | Qiagen | 69504 | |
| DynaMag-96 Side Magnet | Invitrogen | 12331D | |
| HEK293T packaging cells | ATCC | CRL-3216 | |
| Heparin | Sigma | H4784-1G | |
| KAPA HiFi HotStart ReadyMix | Kapa | KK2602 | |
| Lipofectamine LTX with PLUS reagent | Invitrogen | 15338100 | |
| MoFlo XDP cell sorter | BD | ||
| Ni2+-NTA agarose beads | Jena Bioscience | AC-501-25 | |
| OPTI-MEM | Life Technologies | 31985-070 | |
| OX-68 antibody | AbD Serotec | MCA1022R | |
| p-nitrophenyl phosphate | Sigma | 1040-506 | |
| PD-10 desalting columns | GE healthcare | 17085101 | |
| Polybrene | Millipore | TR-1003-G | |
| Polypropylene tubes with 5 mL bed volume | Qiagen | 34964 | |
| Proteinase K, recombinant, PCR Grade | Roche | 3115879001 | |
| Puromycin | Gibco | A11138-03 | |
| Q5 Hot Start High-Fidelity 2× Master Mix | NEB | M0494L | |
| QIAquick PCR purification kit | Qiagen | 28104 | |
| SCFA filter | Nalgene | 190-2545 | |
| Sony Cell sorter | Sony | ||
| SPRI beads (Agencourt AMPure XP beads) | Beckman | A63881 | |
| Streptavidin-coated microtitre plates | Nalgene | 734-1284 | |
| Streptavidin-PE | Biolegend | 405204 |
References
- Wright, G. J. Signal initiation in biological systems: the properties and detection of transient extracellular protein interactions. Molecular bioSystems. 5 (12), 1405-1412 (2009).
- van der Merwe, P. A., Barclay, A. N. Transient intercellular adhesion: the importance of weak protein-protein interactions. Trends in Biochemical Sciences. 19 (9), 354-358 (1994).
- Wood, L., Wright, G. J. Approaches to identify extracellular receptor-ligand interactions. Current Opinion in Structural Biology. 56, 28-36 (2019).
- Bushell, K. M., Söllner, C., Schuster-Boeckler, B., Bateman, A., Wright, G. J. Large-scale screening for novel low-affinity extracellular protein interactions. Genome Research. 18 (4), 622-630 (2008).
- Visser, J. J., et al. An extracellular biochemical screen reveals that FLRTs and Unc5s mediate neuronal subtype recognition in the retina. eLife. 4, e08149 (2015).
- Özkan, E., et al. An extracellular interactome of immunoglobulin and LRR proteins reveals receptor-ligand networks. Cell. 154 (1), 228-239 (2013).
- Martinez-Martin, N., et al. An Unbiased Screen for Human Cytomegalovirus Identifies Neuropilin-2 as a Central Viral Receptor. Cell. 174 (5), 1158-1171 (2018).
- Bianchi, E., Doe, B., Goulding, D., Wright, G. J. Juno is the egg Izumo receptor and is essential for mammalian fertilization. Nature. 508 (7497), 483-487 (2014).
- Mullican, S. E., et al. GFRAL is the receptor for GDF15 and the ligand promotes weight loss in mice and nonhuman primates. Nature Medicine. 23 (10), 1150-1157 (2017).
- Turner, L., et al. Severe malaria is associated with parasite binding to endothelial protein C receptor. Nature. 498 (7455), 502-505 (2013).
- Frei, A. P., et al. Direct identification of ligand-receptor interactions on living cells and tissues. Nature Biotechnology. 30 (10), 997-1001 (2012).
- Sobotzki, N., et al. HATRIC-based identification of receptors for orphan ligands. Nature Communications. 9 (1), 1519 (2018).
- Sharma, S., Petsalaki, E. Application of CRISPR-Cas9 Based Genome-Wide Screening Approaches to Study Cellular Signalling Mechanisms. International Journal of Molecular Sciences. 19 (4), (2018).
- Gebre, M., Nomburg, J. L., Gewurz, B. E. CRISPR-Cas9 Genetic Analysis of Virus-Host Interactions. Viruses. 10 (2), (2018).
- Zotova, A., Zotov, I., Filatov, A., Mazurov, D. Determining antigen specificity of a monoclonal antibody using genome-scale CRISPR-Cas9 knockout library. Journal of Immunological Methods. 439, 8-14 (2016).
- Puschnik, A. S., Majzoub, K., Ooi, Y. S., Carette, J. E. A CRISPR toolbox to study virus-host interactions. Nature Reviews. Microbiology. 15 (6), 351-364 (2017).
- Kerr, J. S., Wright, G. J. Avidity-based extracellular interaction screening (AVEXIS) for the scalable detection of low-affinity extracellular receptor-ligand interactions. Journal of Visualized Experiments. (61), e3881 (2012).
- Tzelepis, K., et al. A CRISPR Dropout Screen Identifies Genetic Vulnerabilities and Therapeutic Targets in Acute Myeloid Leukemia. Cell Reports. 17 (4), 1193-1205 (2016).
- Sharma, S., Bartholdson, S. J., Couch, A. C. M., Yusa, K., Wright, G. J. Genome-scale identification of cellular pathways required for cell surface recognition. Genome Research. 28 (9), 1372-1382 (2018).
- Wang, B., et al. Integrative analysis of pooled CRISPR genetic screens using MAGeCKFlute. Nature Protocols. 14 (3), 756-780 (2019).
- Hart, T., et al. Evaluation and Design of Genome-Wide CRISPR/SpCas9 Knockout Screens. G3. 7 (8), 2719-2727 (2017).
- Kuleshov, M. V., et al. Enrichr: a comprehensive gene set enrichment analysis web server 2016 update. Nucleic Acids Research. 44 (W1), W90-W97 (2016).
- Crosnier, C., et al. Basigin is a receptor essential for erythrocyte invasion by Plasmodium falciparum. Nature. 480 (7378), 534-537 (2011).
- Kirk, P., et al. CD147 is tightly associated with lactate transporters MCT1 and MCT4 and facilitates their cell surface expression. The EMBO Journal. 19 (15), 3896-3904 (2000).
- Chong, Z. S., Ohnishi, S., Yusa, K., Wright, G. J. Pooled extracellular receptor-ligand interaction screening using CRISPR activation. Genome Biology. 19 (1), 205 (2018).
- van der Meer, D., et al. Cell Model Passports-a hub for clinical, genetic and functional datasets of preclinical cancer models. Nucleic Acids Research. 47 (D1), D923-D929 (2019).
- Bausch-Fluck, D., et al. A mass spectrometric-derived cell surface protein atlas. PloS One. 10 (3), e0121314 (2015).
- Behan, F. M., et al. Prioritization of cancer therapeutic targets using CRISPR-Cas9 screens. Nature. 568 (7753), 511-516 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved