Method Article
זיהוי של פני שטח התא באמצעות הגנום בקנה מידה CRISPR/Cas9 מסכים גנטיים
In This Article
Summary
כתב יד זה מתאר גישה מבוססת הגנום בקנה מידה מבוססי לזהות קולטן מסחטות-ליגניות ואינטראקציות.
Abstract
תקשורת בין-תאית מתווכת על ידי אינטראקציות ישיר בין קולטני מוטבע משטח התא קולטנים הוא חיוני לפיתוח נורמלי ותפקוד של אורגניזמים רב-תאיים. עם זאת, מזהה האינטראקציות האלה נשאר מאתגר מבחינה טכנית. כתב יד זה מתאר מיקוד שיטתי הגנום CRISPR/Cas9 הסתרה גישה גנטית המתאר מסלולים סלולריים הדרושים לאירועי זיהוי משטח התא ספציפיים. שיטה זו מנצלת חלבונים רקומביננטי המיוצרים במערכת ביטוי חלבון היונקים כמו בדיקה מחייבת מושבע כדי לזהות שותפים אינטראקציה במסך גנטי מבוסס תא. ניתן להשתמש בשיטה זו כדי לזהות את הגנים הנחוצים לאינטראקציות משטח התא שזוהו על ידי רקומביננטי מחייב בבדיקות המתאימות לתחומי ectodomains של קולטנים מוטבעים ממברנה. חשוב מכך, בהתחשב הטבע בקנה מידה הגנום של גישה זו, יש לו גם את היתרון של לא רק לזהות את הקולטן ישיר אלא גם את הרכיבים הסלולריים הדרושים עבור המצגת של הקולטן על פני השטח התא, ובכך לספק תובנות יקרות לתוך הביולוגיה של הקולטן.
Introduction
אינטראקציות של מסחטות על ידי קולטן פני השטח תאים חלבונים ישיר תהליכים ביולוגיים חשובים כגון ארגון רקמות, מארח-זיהוי פתוגן, ורגולציה החיסונית. חקירת אינטראקציות אלה מעניינת את הקהילה הביו-רפואית הרחבה יותר, משום שקולטני ממברנה הם מטרות שנועדו לtherapeutics באופן שיטתי כגון נוגדנים חד-שבטיים. למרות החשיבות שלהם, לימוד האינטראקציות האלה נשאר מאתגר מבחינה טכנית. הסיבה לכך היא בעיקר מכיוון שקולטנים מוטבעים הממברנה הם אמפיפתיים, מה שמקשה על בידוד מקרומים ביולוגיים לטיפול ביולוגי, והאינטראקציות שלהם מתוערכות על-ידי הקשרים החלשים באינטראקציה (KDs בטווח μm-mM)1. כתוצאה מכך, הרבה שיטות נפוצות אינן מתאימים לזיהוי מחלקה זו של אינטראקציות חלבונים1,2.
מגוון של שיטות פותחו במיוחד כדי לחקור באופן ספציפי קולטן ואינטראקציות ליגיוטיים לקחת את המאפיינים הביוכימיים הייחודיים שלהם לתוך התחשבות3. מספר גישות אלה כרוכות בהבעת ectodomain כולה של קולטן כחלבון רקומביננטי מסיס במערכות מבוססות היונקים או תא חרקים כדי להבטיח כי חלבונים אלה מכילים שינויים מבחינה מבנית החשובים באופן מרכזי, כגון גליקנים ואיגרות חוב דיסולניות. כדי להתגבר על הקשירה החלשה, הפקונים לעתים קרובות oligomerized כדי להגדיל את האוויקות שלהם מחייב. חלבון Avid ectodomains השתמשו בהצלחה כאיגוד הבדיקות כדי לזהות שותפים אינטראקציה ישירה רקומביננטי חלבון-חלבון אינטראקציה מסכי4,5,6,7. בעוד שיטות מוצלחות ומבוססות חלבון מרקומביננטי מחייבות את הפקדומיין של קולטן ממברנה כחלבון מסיס. לכן, זה חל רק בדרך כלל על חלבונים המכילים אזור מגלואי רציף (למשל, מעבר יחיד סוג I, סוג II, או GPI-מעוגן) והוא לא מתאים בדרך כלל עבור מתחמי קולטן חלבונים ממברנה לאורך הקרום פעמים מרובות.
ביטוי טכניקות שכפול שבו ספריה של DNAs משלימים (cDNAs) הוא מנוכר לתוך תאים ונבדק לקבלת פנוטיפ של מחייב יש גם שימשו כדי לזהות אינטראקציות חלבונים-חלבון מושג8. הזמינות של אוספים גדולים של ביטוי cdna משוכפל ורציף בשנים האחרונות יש הנחה שיטות שבהן קווי התאים המביעים מחדש את קולטני משטח הקידוד של cdnas מוקרן עבור איגוד של רקומביננטי חלבונים כדי לזהות אינטראקציות9,10. מבוססי cDNA גישות מבוססות, שלא כמו רקומביננטי חלבון שיטות, להרשות לעצמם את האפשרות לזהות אינטראקציות בהקשר של קרום הפלזמה. עם זאת, ההצלחה של שימוש במבנים ביטוי cDNA תלוי ביכולת של התאים כדי לבטא את החלבון בצורה נכונה מקופל, אבל זה דורש לעתים קרובות גורמי עזר סלולריים כגון מובילים, מלווים, והרכבה הנכון oligomeric. העברה של cDNA בודד עשויה לפיכך לא להיות מספיק כדי להשיג את הביטוי פני השטח התא.
טכניקות הקרנה באמצעות cDNA בנייה או בדיקות חלבון רקומביננטי הם עתירי משאבים דורשים אוספים גדולים של cDNA או רקומביננטי ספריות חלבון. מתוכנן במיוחד שיטות מבוססות-ספקטרומטר מסה מנוצלים לאחרונה כדי לזהות אינטראקציות של מסחטות שאינן דורשות הרכבה של ספריות גדולות. עם זאת, טכניקות אלה דורשות מניפולציה כימית של משטח התא, אשר יכול לשנות את הטבע הביוכימי של המולקולות הקיימות על פני השטח של התאים והם כרגע חלים רק על אינטראקציות בתיווך על ידי חלבונים גליסיתיים11,12. רוב השיטות הזמינות כרגע גם להתמקד בכבדות על האינטראקציות בין חלבונים תוך התעלמות מרובה מתוך מיקרואקולוגיה קרום, כולל מולקולות כגון גליקנים, שומנים וכולסטרול.
הפיתוח האחרון של פילוח bialleleic יעיל מאוד באמצעות הגישות מבוססי crispr אפשרה הגנום בקנה מידה ספריות של תאים חסר גנים מוגדרים בבריכה אחת שניתן לוקרן בדרך סיסטמטית ולא משוחדת לזהות רכיבים סלולריים המעורבים ההקשרים שונים, כולל ניתוח של תהליכי איתות סלולריים, זיהוי של רטבאליות המקנים עמידות לסמים, רעלים ופתוגנים, וקביעת ספציפיות של נוגדנים13,14,15,16. כאן, אנו מתארים הגנום בקנה מידה CRISPR מבוססי הסתרה תא הקרנה הסריקה המספקת חלופה הגישה הביוכימית הנוכחית כדי לזהות קולטן החילוץ-ליגונות ואינטראקציות. גישה זו של זיהוי אינטראקציות מתווכת על ידי קולטני ממברנה על ידי מסכים גנטיים מתאימה במיוחד עבור חוקרים שיש להם עניין ממוקד על ליגניות בודדים משום שהוא מונע את הצורך לקמפל ספריות גדולות של cDNAs או חלבונים רקומביננטי.
שיטת הפעולה מורכבת משלושה שלבים עיקריים: 1) מאוד נלהב רקומביננטי חלבון מחייב בדיקה המורכבת של אזורים מסחטות של קולטן של עניין מיוצרים ומשמשים בזרימה מבוססת-פלואורסצנטית מבוססי כריכה המבוססת על הכריכה. 2) הכריכה משמשת לזיהוי קו תא המבטא את שותף האינטראקציה של בדיקת החלבון הרקומביננטי; 3) גירסת Cas9 המבטאת את קו התא היוצר אינטראקציה עם חלבון הריבית מופקת ומבוצע באמצעות מסך הסתרה מבוסס-הגנום CRISPR/Cas9 המבוסס על מבצע (איור 1). במסך זה גנטי, קשירה של חלבון רקומביננטי לקווי התאים משמש כפנוטיפ למדידה שבה תאים בתוך ספריית ההסתרה כי איבדו את היכולת לאגד את החללית ממוינים באמצעות מיון מבוסס-פלואורסצנטית תא המופעל (FACS) ואת הגנים שגרמו לאובדן של האיגוד המחייב מזוהה על ידי רצף. בעיקרון, הגנים לקודד את הקולטן האחראי קשירה לבדוק נלהב ואת אלה הדרושים לתצוגה משטח התא שלה מזוהים.
השלב הראשון של פרוטוקול זה כרוך בייצור של מושבע רקומביננטי בדיקה חלבונים המייצגים ectodomain של קולטני מאוגד קרום. קולטנים אלה ידועים לעתים קרובות לשמור על שלהם פונקציות כריכת כריכה כאשר ectodomains שלהם מבוטא רקומביננטי מסיסים חלבון1. עבור חלבון של עניין, חלבונים מסיסים רקומביננטי יכול להיות מיוצר בכל מערכת חלבון איקריוטית מתאים בפורמט כלשהו בתנאי שהוא יכול להיות oligomerized עבור avidity מוגברת הכריכה, והוא מכיל תגים שניתן להשתמש בזרימה מבוססי-פלואורסצנטית מבוססי cy, מבוסס האיגוד המבוסס (g., דגל פרוטוקולים מפורטים לייצור ectodomains מסיסים של קולטני קרום באמצעות מערכת ביטוי חלבון HEK293, כמו גם טכניקות שונות של multimerization וביטוי חלבון בונה לייצור של שני חלבונים pentameric ו-monomeric חלבונים תוארו בעבר1,17. הפרוטוקול כאן יתאר את השלבים ליצירת בדיקות מושבע פלורסנט מן החלבונים biotinylated מונאואריק על ידי מעלה אותם streptavidin מצועם ל fluorochrome (למשל, phyco, או PE), אשר ניתן להשתמש ישירות בתוך תא מבוסס הכריכה מבוססת ויש לו את היתרון של לא צורך נוגדן משני לאיתור. פרוטוקולים כלליים לביצוע מסכי הגנום בקנה מידה כבר תיאר20,21, ולכן הפרוטוקול בעיקר להתמקד הפרטים של ביצוע הזרמת cy, מבוססי חלבון רקומביננטי מסכי המערכת באמצעות ההקרנה crispr/Cas9 הסתרה באמצעות האדם V1 ("yusa") הספרייה18.
Protocol
1. הייצור והטיהור של הביוטילנטי-חלבונים מתויגים
- השתמש במערכת ביטוי חלבון מבוסס היונקים או תא החרקים כדי לייצר רקומביננטי מסיסים חלבונים biotinylated (ראה פלמיד מבנים בטבלה 1).
הערה: פרוטוקול מפורט לייצור ביוטין ביוטין וחלבונים מתויגים שלו באמצעות מערכת הביטוי HEK293 cell מתואר על ידי קר ואח'. החלבון ectodomains הביע באמצעות מערכת הביטוי HEK293 מופרש לתוך מדיום התרבות. - לאסוף את החלבונים מסיסים על ידי הפלטינג התאים על ידי צנטריפוגה ב 3,000 x g עבור 20 דקות.
- לסנן את supernatant באמצעות מסנן 0.22 יקרומטר ולהוסיף את החרוזים Ni2 +-נ. ת. ע. לחלבון מסונן supernatant ב 1:1000 יחס (כלומר, 50 μl של 50% agarose לתוך 50 mL של סופרנטאנט). המלון משלב בין לילה או לפחות 4-5 h ב -4 ° c על מצע מסתובב.
- שטוף את עמודת פוליפרופילן על-ידי הוספת 5 מ ל של מאגר שטיפת הטיהור שלו. עיין בטבלה 2 עבור כל קומפוזיציות המאגר.
- יוצקים את התערובת השלמה של חלבון מחרוז לתוך הטור. . החרוזים יצטברו בבסיס
- שטוף את החרוזים 2x עם 15 מ ל של מאגר לשטוף. כדי למנוע דילול חלבונים, לצייר בזהירות את מאגר לשטוף שיורית מהעמודה עם מזרק 5 מ ל ולהשליך.
- בקפידה להוסיף 300-500 μL של שלו-טיהור מאגר הימנעות ישירות חרוזים ו-הדגירה עבור לפחות 1 h. לאסוף את החלבון מחורץ שוב בזהירות לצייר את הנוזל באמצעות מזרק 1 mL. החלף את המאגר למאגר הרצוי (לדוגמה, בדרך כלל PBS או HBS) באמצעות עמודות התפלה. אחסן את כל החלבונים ב-4 ° צ' עד לשימוש נוסף.
2. חלבון ביולוגי ואוליפיקציה של חלבונים מונמטוריים
הערה: כדי להגביר את האוויקות הbinding, חלבונים monomerize ביולוגית על tetrameric streptavidin-PE לפני השימוש בהם בכריכה אספרית. השג יחסי בניינים אופטימליים של חלבונים monomeric ו tetrameric streptavidin-PE על ידי בדיקת סדרת דילול של monomylated מונטילס נגד ריכוז קבוע של streptavidin ועל ידי הקמת מדעית את הדילול המינימלי שבו לא ניתן לזהות monomylated עודף ביולוגי.
- לעשות לפחות שמונה מדלל סדרתי של דגימות חלבון biotinylated באמצעות מאגר דילול המתאים (או PBS או HBS עם 1% סרום בקון [BSA]) ב 96 צלחת. ודא שעוצמת הקול הסופית של כל דילול היא לפחות 200 μL.
- לעשות צלחת כפולה של דגימות על ידי הסרת 100 μL מכל באר והעברת לצלחת חדשה 96 היטב. כלול תמיד פקד. במקרה זה הפקדים הם חלבונים בלבד (כלומר, biotinylated שלו-מתויג Cd4 תחום 3 +4 חלבון). זה ישמש כמקדח שליטה בכל assays מחייב.
- לדלל streptavidin-PE כדי 0.1 μg/mL במאגר הדילול.
- על אחד הצלחות, להוסיף 100 μL של streptavidin-PE מדולל. הלוח המשוכפל ישמש כפקד. הוסף 100 μL של מאגר הדילול בלוח הבקרה לאיזון אמצעי אחסון.
- דגירה של 20 דקות בטמפרטורת החדר (RT). בינתיים, לחסום את הבארות של צלחת מצופה streptavidin עם מאגר הדילול עבור 15 דקות.
- העבר את הנפח הכולל של המדגם משני הצלחות לבארות בודדות של לוחות מצופים streptavidin ו-מודטה עבור 1 h ב RT.
- לשטוף את צלחת 3x עם 200 μL של מאגר לשטוף (כלומר, או PBS או HBS עם 0.1% רצף-20, 2% BSA). הוסף 100 μL של 2 μg/mL עכבר נגד עכברוש Cd4d3 + 4 IgG (OX68) ו-דגירה עבור 1 h ב RT.
- שטוף את הצלחת 3x עם מאגר הכביסה. הוסף 100 μL של אנטי-עכבר בסיסי פוספספטאז המשלים ב 0.2 μg/mL עבור 1 h ב RT.
- לשטוף את צלחת 3x עם מאגר לשטוף 1 x במאגר דילול.
- הכינו p-ניטרופניל פוספט ב 1 מ"ג/mL ב diethanolamine מאגר. הוסף 100 μL בכל הבאר ו מארג עבור 15 דקות.
- לקחת קריאות ספיגה ב 405 ננומטר. השתמש בדילול המינימלי שבו אין אות על הצלחת כגורם הדילול המתאים ליצירת טטרמרים (איור 2).
- הפוך פתרון 10x הטטרמר עבור כל הדגימות והפקדים על-ידי דגירה 4 μg/mL streptavidin-PE ואת דילול חלבון biotinylated המתאים עבור 30 דקות ב-RT. חנות חלבונים מצופחת בצינור מוגן באור ב -4 ° c עד שימוש נוסף.
3. הזרמת כריכת תאים המבוססת על הזרם cy,
- לתאים מחסיד, הסר את מדיית התרבות ושטוף את 1x עם ה-PBS ללא התיונים לא-מדידים. לאחר מכן הוסף פתרונות ניתוק תאים (לדוגמה, EDTA). אפשר לתאים להתנתק במשך 5-10 דקות. להקיש בעדינות על הבקבוקון כדי לשחרר את התאים.
הערה: הימנע משימוש במוצרים מבוססי טריפסין כאשר הם יכולים לדבוק בחלבונים במשטח התאים. - לאסוף תאים מנותקים לתוך צינור. עבור תאים הגדלים בהשעיה (למשל, HEK293 תאים), ישירות לאסוף את התאים מצלוחיות תרבות לתוך צינור.
- התאים גלולה ב 200 x g עבור 5 דקות. הסר את supernatant ולהשעות את הגלולה בכביסה מאגר (כלומר, PBS/1% bsa).
- לספור את התאים באמצעות הומוציטוטומטר ולהתאים את הריכוז כדי 2.5 x 105-1 x 106 תאים/mL. Aliquot 100 μL של שילוב תאים מוכן על הלוח 96 היטב U-או V-התחתית. ספין הצלחת עבור 5 דקות ב 400 x g. הסר את הסופרנטנט עם פיפטה רב-ערוצית.
- הוסף 100 μL של מנורמל מתויג מאוד בדיקה חלבונים בעלי מוטיבציה ופקדים לתוך לוחיות שהוכנו בעבר עם תאים ו-דגירה של 1 h ב 4 ° c. לאחר כריכה עבור 1 h, לסובב את הצלחת ב 400 x g עבור 5 דקות.
- הסר את הסופרנטאנט והוסף 200 μL של מאגר הכביסה (כלומר, PBS/1% BSA). מערבבים היטב על ידי ליטוף למעלה ולמטה.
- גלולה את התאים על ידי צנטריפוגה ב 400 x g עבור 5 דקות. לחזור על השלב השטיפה 1x. לאחר שני שטיפת, לחלוטין להסיר את supernatant ולהשעות מחדש את הגלולה תא ב 100 μL של PBS.
- לנתח את התאים על ידי הזרמת cy, לנסות. השתמש בלייזר צהוב-ירוק (כלומר, 561 nm) כדי לזהות פלואורסצנטית PE.
- תחילה לנתח את התאים שהיו מוכתם עם לווין הבקרה. בהתבסס על התפלגות הזריחה של PE, צייר שער לאוכלוסיה מחייבת כגון שאין יותר מאחוז אחד מתא הבקרה נופל בשער זה.
- נתח את המדגם וקבע את החלק של התאים הנופלים בשער הכריכה.
הערה: שורות תאים המציגות אוכלוסיית איגוד גבוהה יותר מבוקשת עבור מסכים גנטיים, מכיוון שיש להם יחס גבוה יותר של אות לרעש. באופן אידיאלי מעל 80% של התאים צריך ליפול בתוך השער הזה.
4. קביעת תרומות מחייבות מאפיאוסקופים מחממים ומחראן גופרתי
הערה: הפעילות של חלבונים רבים היא החום labile, כך אובדן פעילות האיגוד לאחר הטיפול בחום הוא מעודד. מומלץ לקבוע את התרומה מפני שלילי מחויב גליסמוייגליקנים, בעיקר הפאראן סולפט (HS), בכריכת מדיה של חלבונים רקומביננטי. הסיבה לכך היא כי הכריכה על ידי HS בתוך שיטת הכריכה של התא המתואר כאן יכולה להיות מוספים ולא תלויה בקולטנים אחרים19. משמעות הדבר היא כי הכריכה נצפתה יכול להיות מתווכת לחלוטין על ידי שרשראות בצד HS של משטח התא מתחת לפני הקרקע ולא על ידי קולטן מסוים. כריכה ל-HS על משטח התא אינה בהכרח ספציפית, אלא תכונה של חלבון, אשר שימושי לדעת לפני ביצוע מסך גנטי מלא.
- הכינו דגימות חלבון שטופלו בחום לשימוש בכריכה.
- מחממים את חלבון monomeric מנורמל אך בלתי מעלה ב 80 ° c עבור 10 דקות.
- המשלים את החלבון שטיפל בחום ל streptavidin-PE בהנחה את אותו יחס הקונטוייתי כמו עמיתו מטופל כפי שנקבע על ידי אליסה (להתייחס לסעיף 2).
- הכינו את דגימות החלבונים. שחסמו את הפארין
- הכינו שמונה 1:3 דילול של הפארין מסיסים ב-PBS עם ריכוז התחלתי של 2 מ"ג/mL ו הנפח הסופי של 100 μL.
- מודלת 100 μL של בדיקה מחייבת של מחייב בהפרין לפחות 30 דקות.
- שימוש בחלבון שטופלו בחום והמלא 200 μL של תערובת הפארין/חלבון בכריכת הכריכה המתוארת בסעיף 3. תוצאות הנציג מוצגות באיור 3א, ב.
5. בחירת קווי התא באופן בלתי נשכח Cas9
הערה: לפני קו התא המחבר את בדיקת הריבית ניתן להשתמש בהקרנה crispr, זה חייב להיות מתוכנן תחילה כדי לבטא את Cas9 נוקלאז ושיבוט פעיל מאוד שנבחר19.
- השתמשו בפרוטוקול הייצור הכללי של הנגיף הראשי כדי לייצר וירוס באמצעות המבנה הCas9 ביותר לביטוי (עיין בטבלה 1).
- תרבות HEK293-FT תאים בזיכרון/10% FBS מדיה ב 37 ° צ' ו 5% CO2. זרע HEK293-FT תאים 1 יום לפני החצייה, כך שהם ~ 80% בצורה שוטפת ביום ההעברה.
הערה: תאים HEK293FT הם מחסיד באופן רופף; לכן, כאשר הם משמשים לייצור של וירוסים, לשקול ציפוי אותם על מבחנות התרבות מצופה עם 0.1% (w/v) ג'לטין כדי להגביר את הדבקות. - . לבצע פעולות העברה בבוקר הוסף וקטור העברה, ערבוב אריזות, והעברת החוצה למדיה תואמת לאמצעי האחסון (לדוגמה, Opti-הגברת). מערבבים על ידי היפוך הצינור 10-15x. דגירה עבור 5 דקות ב RT. פנה לטבלה 3 עבור אמצעי אחסון מדויקים.
- הוסף את מגיב ההעברה כפי שהוצע על-ידי היצרן. מערבבים על ידי הורטקנג מהיר. דגירה עבור 30 דקות ב RT.
- מאוד בזהירות ממנה. את המדיום המושקע הוסף מדיה תואמת לצלחת.
- הוסף את התרגום הכימי/מכלולי דנ א של המעבר על הצד של הצלחת ולהתפשט לאט דרך הצלחת על ידי מתערבל בעדינות רבה.
- מודטה ב 37 ° c עבור 3-5 h ולהחליף את המדיום עם D10 medium. . מכאן בלילה
- למחרת בבוקר, החליפו את המדיום במדיום D10 טרייה. . מכאן בלילה
- ביום שלמחרת אחר הצהריים, אספו את הסופרנטאנט הנגיפי. סנן עם מסנן 0.45 יקרומטר עם כריכת חלבון נמוכה. באופן אופציונלי, להוסיף טרי D10 בינונית, מודלת לילה וזוכר את supernatant למחרת.
- הווירוסים הרבים יציבים ב -4 מעלות צלזיוס רק לכמה ימים. חנות at-80 ° צ' לאחסון לטווח ארוך.
הערה: כדי ליצור הכנה מרוכזת ביותר, שעשויה להיות רצויה לצורך התמרה של תאים קשים להכנה, ניתן גם להתרכז על ידי הצנטריפוגה ב-6,000 x g לילה ב -4 ° c. סמנו את הגלולה הנגיפית השקופה עם עט חסין אתנול והשמט את הסופרנטאנט. השהה מחדש את הגלולה ב-1/100th של אמצעי האחסון המקורי עבור גידול של 100th בריכוז.
- תרבות HEK293-FT תאים בזיכרון/10% FBS מדיה ב 37 ° צ' ו 5% CO2. זרע HEK293-FT תאים 1 יום לפני החצייה, כך שהם ~ 80% בצורה שוטפת ביום ההעברה.
- העבר את התאים באמצעות וירוסים.
- צלחת 1 x 106 תאים לכל באר ב 6 היטב צלחת עם 3 מ ל של מדיה התרבות המתאימה. תאים מסוימים מתתמרים בקלות רבה יותר מאחרים. כדי להקל על תאים (למשל, תאי HEK), להוסיף ישירות את הווירוס לתאים. בכדי להקשות על התאים, ייתכן שיהיה צורך לעקוב אחר פרוטוקול מספילי כמתואר להלן.
- מחלק 2 mL של 2-5 x 106 תאים/mL בצינור 15 מ ל חרוט.
- הוסף וירוס ביחד עם 8 μg/mL הקסאדין ברומיד ו דגירה ב RT עבור 30 דקות.
- צנטריפוגה עבור 100 דקות ב 800 x g ב 32 ° c. לאחר מכן השהה מחדש את התאים באותו מדיה והוסף את ההשעיה התא לתוך מבחנות התרבות המתאים עם המדיה המתאימה.
- אפשר התמרה לפחות 24 שעות ביממה לאחר מכן להסיר את המדיה המכילה את הווירוס ולהוסיף מדיום טרי.
- אחרי עוד 24 שעות, לשנות את המדיה לאחד שיושלם עם אנטיביוטיקה המתאים. המבנה הCas9 מכיל קלטת התנגדות בלטות לבחירה.
הערה: על כמות הבלטושים להיות ממוטבת עבור כל קו תא על-ידי ביצוע עקומת הריגה של תגובת מינון. ריכוז בלופידין בין 2.5-50 μg/mL צריך להרוג את קווי התאים הבלתי מצטלבים בתוך 10 ימים של התמרה.
- צלחת 1 x 106 תאים לכל באר ב 6 היטב צלחת עם 3 מ ל של מדיה התרבות המתאימה. תאים מסוימים מתתמרים בקלות רבה יותר מאחרים. כדי להקל על תאים (למשל, תאי HEK), להוסיף ישירות את הווירוס לתאים. בכדי להקשות על התאים, ייתכן שיהיה צורך לעקוב אחר פרוטוקול מספילי כמתואר להלן.
- בצע את הבחירה עד שכל התאים בלוח הבקרה (כלומר, תאים שאינם מתתמרים שטופלו באותו ריכוז של אנטיביוטיקה בחירה) נהרגים.
6. בחירת גבוהה Cas9-פעילות שיבוטים
הערה: Cas9 שבטים עשויים לשמש כדי לבצע בהצלחה מסכי גנטיות; עם זאת, בחירת שיבוט עם פעילות high Cas9 משפרת את תוצאות ההקרנה18.
- השתמש הגבלת דילול או תא יחיד מיון תאים עמידים בפני בארות בבארות של 3 96 לוחות המכילים התקשורת התרבותית הכוללת עם בלטות. שיבוטים יתחילו לצאת בין 2-4 שבועות. בחר 10-20 שיבוטים ולהרחיב ב 6 צלחות היטב.
- שיטה שיבוטים עבור פעילות Cas9 באמצעות מהיר להעריך GFP-BFP (חלבון פלורסנט ירוק-חלבון כחול פלורסנט) מערכת, אשר משתמשת מערכת הסתרה הפצצה אקסוסוגני שבו תאים מתתמרים או עם בונה ביטוי GFP עם gRNA-פילוח GFP ריק או gRNA ריקה כפקד18.
- הזמנת כתבת פלמידים: GFP-BFP, בקרה-בקרת פלמיד (שולחן 1).
- התוצרת האנטי וירוס עבור שני GFP-BFP ובקרה-BFP באמצעות פרוטוקול ייצור וירוס המתואר בסעיף 5.1.
- לאחר כל הCas9 ביטוי קו תא כפיל עם הווירוס לקודד את GFP-BFP בקרת-BFP בנפרד. בצע את הפרוטוקול בסעיף 5.2.
- לאחר 3 ימים של התמרה, לבחון את הזריחה GFP-BFP של כל שיבוט באמצעות הזרמת cy, לנסות. השתמש 488 ננומטר לייזר ו 405 לייזר nm כדי לזהות GFP ו BFP בהתאמה.
- קוונטייט הפעילות Cas9 בכל שיבוט על ידי בחינת היחס של BFP רק כדי GFP-BFP-בשני תאים חיוביים. פעילות גבוהה Cas9 תאים צריך באופן אידיאלי יש > 95% GFP הנוקאאוט יעילות (איור 4).
7. הדור של הגנום הרחב CRISPR-Cas9 הסינון הספרייה
- להקרנה הגנום הרחב באמצעות הספריה V1 האדם18, להזמין את הספרייה ברחבי הגנום (להתייחס לטבלה 1) ולהכין את ספריית הפלביניים מן הדקירה החיידקית באמצעות הפרוטוקול המסופק תחת "פרוטוקולים עבור שכפול הספרייה" במדריך של היצרן.
- השתמש הגנום-wide הספריה הכנת הספרייה כדי לייצר הספרייה לקידוד לעדשה gRNAs לשיבוש ממוקד של גנים אנושיים באמצעות פרוטוקול ייצור וירוס המתואר בסעיף 5.1.
הערה: שיטה טובה היא ליצור אצווה אחת של הכנה מיטבית הממוטבת לצורך התמרה כדי לשפר את העקביות הניסיונית. - השתמש בפרוטוקול התמרה בסעיף 5.2 כדי לבצע התמרה בדיקות בקנה מידה קטן כדי לקבוע את הכמות הנדרשת של וירוס עבור כל קו תא כדי להשיג התמרה של 30%. השתמש cy, לנסות להעריך את הזריחה BFP כפרוקסי עבור יעילות התמרה.
- כדי לשנות את התאים HEK293, פשוט להוסיף את ההכנה הקבועה מראש של ויראלי כדי 30-50 x 106 תאים המתורבת במדיית צמיחה רגילה עבור ~ 4 h. לאחר מכן הסירו את המדיה בעזרת הנגיף והחליפו במדיית גדילה טרייה.
- עבור קווי תאים אחרים, השתמש בפרוטוקול spinoculation בסעיף 5.2.1 אך בקנה מידה גדול יותר, כגון סך של 30-50 x 106 תאים מתתמרים. בשביל זה, סדרת מחלקים 2 מ ' של 5 x 106 תאים/mL בתוך 15 מ"ל צינור חרוט ולהמשיך כפי שצוין.
- עבור קווי תאים מחסיד, בחר תאים מתתמרים על ידי הוספת puromycin 24 h לאחר התמרה.
הערה: למטב את ריכוזי puromycin על ידי ביצוע התגובה מינון עקומת להרוג. בדרך כלל ריכוזים בין 1-10 μg/mL צריך להרוג תאים שאינם מתתמרים בתוך 3-5 ימים. הימנע משימוש ריכוזים גבוהים יותר של puromycin כי זה עשוי להגדיל את הסיכויים לבחור תאים שעברו התמרה על ידי יותר מאשר אחד מדריך יחיד RNA (sgRNA). - עבור תאים ההשעיה, הקציר התמרה (כלומר, BFP חיוביים) תאים 3 ימים התמרה באמצעות סדרן התא וליצור ספריות המכילות לפחות 10 x 106 תאים. לאחר שנבחר באמצעות BFP, לגדול את התאים במדיה בתוספת עם כמות מתאימה של puromycin.
הערה: הימנע מבחירות רק עם puromycin עבור קווי התא ההשעיה, כי קשה להסיר תאים מתים ופסולת מתרבויות התא ההשעיה שיכולים להפריע מיון התא. - הספריה של מוטציות תרבות עבור 9-16 ימים התמרה עם מעבר רגיל כל 2-3 ימים.
8. הקרנה גנטית לכריכת משטח התא
- גלולה הספריה תא מוטציה ב 200 x g עבור 5 דקות ולהשעות את התאים ב-PBS.
- לחלק את התאים לתוך 2 15 מ"ל צינורות חרוט עם לפחות 50 x 106 תאים בכל צינור.
- ספין צינור חרוט אחד ב 200 x g עבור 5 דקות, להסיר את supernatant, ולהקפיא את הגלולה תא ב-20 ° c. זוהי אוכלוסיית הבקרה והיא תעובד מאוחר יותר.
- השהה מחדש את הגלולה בצינור השני ב-10 מ ל של PBS/1% BSA. להניח בצד 100 μL של תאים כפקד שלילי על צלחת הבאר 96.
- הוסיפו את החלבון הרקומביננטי המתאים מראש להשעיה של התא בצינור החרוט וחלבונים שליליים לשלוט על 96 צלחת הבאר.
- לבצע צביעת תא עבור לפחות 1 h ב 4 ° c על הרוטור שחקן ספסל עם סיבוב עדין (6 סל ד).
- גלולה את התאים ב 200 x g עבור 5 דקות, להסיר את supernatant. לבצע שני צעדים לשטוף, ואז להשהות את התאים ב 5 מ ל של PBS.
- מסננים את התאים למרות מסננת תא 30 יקרומטר כדי להסיר אשכולות תאים. לנתח באמצעות סדרן זרימה.
- השתמש בדגימת הבקרה השלילית לשער עבור BFP +/pei תאים.
- מיין את המדגם ולאסוף את BFP +/PE-תאים. שערי מיון יהיה תלוי הכריכה של התאים לחלבון אבל הוא בדרך כלל 1-5% מדגימות שליליות PE נאספים. דוגמה לשער מיון מסופקת באיור המשלים 1.
- לאסוף תאים 500000-1000000 מהשער שנבחר. בהינתן מספר נמוך של תאים, לשקול איסוף דגימות 1.5 mL צנטריפוגה שפופרת כדי למזער את ההפסדים.
- גלולה את התאים הממוינים על ידי תפרידו ב 500 x g עבור 5 דקות. בזהירות להסיר את supernatant ולהיפטר. ניתן לאחסן את הגלולה ב-20 ° c עד 6 חודשים.
9. הוצאת דנ א גנומית הראשון PCR עבור העשרה gRNA
- לחלץ דנ א גנומית של אוכלוסיית בקרת מורכבות גבוהה.
- אם אוכלוסיית הבקרה הוקפאה ב-20 ° c, הוציא את צינורית החרוט והוסף את ה-PBS. . לשמור על הקרח כדי להפשיר את הגלולה
- השתמש בערכה מסחרית (ראה טבלת חומרים) באמצעות ההמלצות של היצרן כדי לחלץ DNA גנומית מ 50 x 106 תאים. להתאים את ריכוז ה-DNA ל 1 מ"ג/mL.
- עבור כל דוגמה, להגדיר תערובת הורים עבור PCR המתאים 72 μg של ה-DNA. Aliquot 50 μL לכל טוב ב 36 בארות של 96 היטב PCR צלחת. הרצפים הדרושים מפורטים בטבלה 4. השתמש במדריך בטבלה 5 ו- 6.
- לפתור 5 μL של ה-PCR מ 6-12 מדגמים מייצגים על 2% (w/v) ג'ל צמח. להקה ברורה אחת ב ~ 250 bp יש לצפות. אם הלהקות מחלשות, חזרו על ה-PCR ל2-3 מחזורים נוספים.
- השתמש בצנרת רב-ערוצית כדי לאסוף 5 μL של מוצרים PCR מכל באר (180 μL בסך הכל) ובריכה אותם במאגר עם 900 μL של מאגר איגוד מערכה מסחרית (ראה טבלת חומרים).
- טיהור מוצרי ה-PCR באמצעות ערכת טיהור מסחרית של ה-PCR. ה-DNA elute לתוך 50 μL של מאגר הימנעות מערכה מסחרית (ראה טבלת חומרים) ולמדוד את ריכוז ה-dna.
- דגימות כי כבר ממוינים עבור אובדן של הפנוטיפ הכריכה לא סביר להיות מורכב ממספר רב של שיבוטים עצמאיים. לכן, אין צורך לבצע PCR עם 72 μg של דנ א. לבודד את ה-DNA באמצעות ערכת מסחרית מתאימה (ראה טבלת חומרים). הגדרת 3-4 התגובות PCR באמצעות הפרוטוקול המתואר לפני (סעיף 9.1.3) עם 100 ng/μL DNA. אם מספר התא ממוין קטן מ 100,000 להשתמש לפני התאים במקום ההכנות DNA גנומית.
- Aliquot כ 10,000 תאים/גם בצלחת 96 היטב PCR.
- מצנלת את התאים בצלחת ומסירים בזהירות את רוב הסופרנטאנט. . הגלולה לא תהיה גלויה
- הוסף 25 μL של מים בכל באר ולחמם את הדגימות ב 95 ° c עבור 10 דקות.
- הוסף 5 μL של 2 מ"ג/mL טרי מדולל פרוטטינואז K לכל טוב עבור 1 h ו-דגירה ב 56 ° c. לאחר מכן לחמם את המדגם עבור 10 דקות ב 95 ° צ' כדי להשבית את הפרוטאינאז K.
- השתמש ב-10 μL של שילוב תאים לכל תגובת ה-PCR. יש להשתמש ב-lysates בתוך 24 שעות.
10. הסבב השני של ה-PCR לקידוד ולרצפי האינדקסים
- לדלל את המוצרים מן הסיבוב הראשון PCR כדי 40 pg/μL.
- הגדר PCR אחד לכל מדגם (השתמש במדריך המסופק בטבלאות 7 ו- 8). השימוש של פולימראז באיכות גבוהה חשוב למזער שגיאות שהוצגו על ידי הפילמור במהלך הגברה sgRNA.
- לפתור 5 μL של מוצרי PCR על 2% (w/v) ג'ל צמח. יש לצפות ברצועה ברורה אחת ב-~ 330 bps.
- לטהר את מוצרי ה-PCR באמצעות חרוזי פאראמגנטים על ידי הוספת 31.5 μL של (0.7 x כולל נפח) של חרוזים מושעה למוצרי ה-PCR, ערבוב היטב, ו דגירה עבור 5 דקות ב RT.
- הניחו את השפופרת על מדף מגנטי במשך 3 דקות. יש ללכוד את החרוזים בצד הצלחת והפתרון צריך להיות ברור. הסר והשמט בזהירות את הסופרנטאנט.
- הוסף 150 μl של 80% אתנול טרי מוכן לצינור. דגירה של 30 s, ולאחר מכן בזהירות להסיר ולמחוק את supernatant.
- חזור על שלב 13.6, הפעם עם 180 μL. לאחר מכן האוויר יבש את החרוזים עבור 5 דקות.
- . תסיר את השפופרת מהמגנט אליוט היעד DNA מ חרוזים לתוך 35 μL של מאגר EB. דגירה עבור 3 דקות, ואז לשים את הצינור בחזרה למדף המגנטי עבור 3 דקות.
- העבר כ 30 μL של הסופרנטנט המכיל את מוצרי ה-PCR לצינור נקי.
- מסדרת את הדגימות. על פלטפורמת רצף הדור הבא עבור הספריה HumanV1 gRNA, השתמש בפריימר מותאם אישית המפורטים בטבלה 4 לרצף 19 bp.
11. ביואינפורמטיקה ניתוח לזיהוי הקולטן ומסלולים נלווים
- מיפוי רצפים מאוכלוסיה ממוינת וממוינת לספריית הייחוס באמצעות הפונקציה count של MAGeCK. הפונקציה תניב קובץ ספירת raw (טבלה משלימה 1).
הערה: הוראות מפורטות על ההתקנה של MAGeCK והשימוש בפונקציות שונות בתוך MAGeCK מתוארים בפרוטוקול שפורסם בעבר על ידי וואנג et al.20. - בדוק את התקן הטכני של ספריית הבקרה הנמצאת בשימוש במסך.
- חציון מנרמל את הספירות הגולמי ומשתמשים בחבילת ggplot2 ב-R21 או בתוכנה שוות-ערך כדי להתוות מגרש של פונקציית צפיפות מצטברת של הספירות בפלסמיד ובקרה על דגימות לא ממוינות (איור 5א).
- הפעל את הפונקציה -test של mageck באמצעות ספירות מתוך האוכלוסייה הפלביניים כמו "בקרת" ואת ספירות של דגימות בקרה לא ממוין כמו "בדיקת" המדגם. הפונקציה תניב קובץ סיכום גנטי (טבלה משלימה 1).
- פתח את קובץ הסיכום של הגן וצייר את התפלגות השינויים בקיפול היומן (עמודהמינוס | lfc ) עבור הגנים החיוניים והלא-חיוניים הקודמים שחולקו לקטגוריות22 (איור 5ב).
- בחר את הגנים המרודלים באופן משמעותי (שלילי | רוזוולט < 0.05) ובצע ניתוח העשרה של מסלול באמצעות חבילת enrichr23 או כל חבילות העשרה במסלול המקביל ב-R (איור 5ג).
- הפעל את פונקציית הבדיקה של mageck עם הגדרת ברירת מחדל. השתמש בספירות raw מדגימת בקרה שאינה ממוינתכ"פקד" וסופרת ממדגם ממויןכ"טיפול" בעת ביצוע הניתוח.
- פתח את קובץ סיכום הגנים שנוצר על-ידי MAGeCK ודרג את עמודת ה- pos | לדירוג בסדר עולה. השתמש בעמודת רוזוולט (pos | ) < 0.05 כניתוק לזיהוי כניסות. הקולטן מדורגת בדרך כלל מאוד, לעתים קרובות בתנוחה הראשונה.
- התווה את הציונים החזקים של אלגוריתם (RRA) עבור בחירה חיובית (pos | score) ב-R או בתוכנה מקבילה (איור 5D).
- בחר את כניסות הגן ולבצע ניתוח העשרה מסלול באמצעות חבילת enrichr או כל חבילות העשרה המקבילה המסלול ב R כדי לזהות את המסלולים מועשר.
תוצאות
רצף נתונים משני מסכי הגנום מייצגים בקנה מידה לזיהוי של שותף האיגוד של האדם TNFSF9 ו P. falciparum RH5 ביצע NCI-snu-1 ו HEK293 תאים בהתאמה מסופקים (טבלה משלימה 1). התנהגות הכריכה של RH5 הושפעה על ידי ההיראן סולפט והקולטן הידוע שלה bsg24 (איור 3ג), בעוד TNFRSF9 מאוגד באופן ספציפי TNFSF9 הקולטן הידוע ולא איבד מחייב על טרום דגירה עם הפרין מסיסים. חלבון 3 באיור 3ב' מייצג את TNFRSF9.
עבור שני הקווים הסלולריים, התפלגות gRNAs בספריית מוטציה של הפקד לאחר 3 ימים (9, 14 ו-16 ימים של התמרה) מסופקים גם (טבלה משלימה 1). התפלגות gRNA גילתה כי מורכבות הספרייה נשמרה במהלך הניסוי (איור 5א). המסך הגנטי לזיהוי ליגולי עבור TNFSF9 התבצע ביום 14 התמרה, בעוד שעבור RH5 בוצעה יום 9 התמרה. האיכות הטכנית של המסכים הוערך על ידי בחינת התפלגות של שינויי קיפול שנצפו של gRNAs מיקוד מערכת התייחסות של גנים לא חיוניים לעומת התפלגות עבור ערכת התייחסות של גנים חיוניים22 (איור 5ב). בנוסף, העשרה ברמת המסלול חשפה גם שמסלולים חיוניים צפויים זוהו והעשירו באופן משמעותי באוכלוסיית "השחרור" בעת השוואת דגימת הבקרה לספרייה המקורית של הפלביניים. דוגמה ליום 14 NCI-SNU-1 מתוארת באיור 5ג.
התפלגות gRNAs בפקד לעומת אוכלוסיה ממוינת באמצעות הפונקציה -test של mageck (ראה טבלה משלימה 1 עבור פלט סיכום הגנים מ-mageck) שימש כדי לזהות את הקולטן של מסכי פנוטיפקס. הציון RRA שונה שדווחו על ידי MAGeCK בניתוח ברמת הגן מותווים נגד הגנים מדורגת על ידי ערכי p. הציון RRA ב-MAGeCK מספק מידה שבה gRNAs מדורגים באופן עקבי גבוה יותר מהצפוי. במסך עבור TNFRSF9, הלהיט העליון היה TNFSF9, שהוא שותף מחייב ידוע של TNFRSF9 (איור 5ד). בנוסף, מספר גנים הקשורים מסלול TP53 זוהו גם. במקרה של RH5, בנוסף לקולטן הידוע (Bsg) ואת הגן הנדרש לייצור של בדיחות Sulfated (SLC35B2), גן נוסף (SLC16A1) זוהה גם (איור 5E). SLC16A1 היא המלווה הנדרש עבור סחר BSG על פני השטח של תאים25. יחד, תוצאות אלה להפגין את היכולת של המסך כדי לזהות קולטנים אינטראקציה ישירה ואת הרכיבים הסלולריים הדרושים קולטן זה להתבטא על פני השטח של התאים בצורה תפקודית.
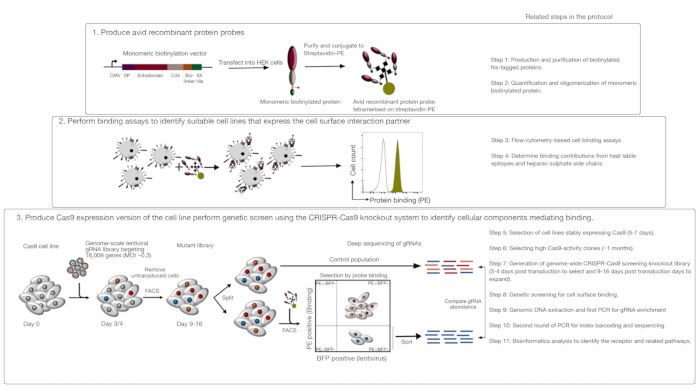
איור 1: סקירה של גישת ההקרנה הגנטית כדי לזהות קולטני משטח התא. שיטת הפעולה מורכבת משלושה שלבים עיקריים: ראשית, חלבונים רקומביננטי המייצגים את ectodomain של קולטני שטח התא מבוטאים בקו תא שיכול להוסיף שינויים קריטיים בבחינה מבנית כגון תאים HEK293. החלבון של מונומאריק מונותחומים הם oligomerized ידי מעלה מעלה כדי streptavidin-PE כדי להגביר את האוויקות שלהם מחייב. שנית, אלה בדיקה נלהבים משמשים מחייב הסלולר בחני איפה בוהק מכתים על קווי התא המצוין על ידי משמרת בולטת של אור השמש (בירוק) לעומת חלבון שליטה שלילית (בשחור) מדגים את נוכחותו של שותף משטח התא הכריכה. שלישית, קולטן חיובי Cas9-המבטא קווים מסומנים ההקרנה בקנה מידה הגנום באמצעות gRNAs מיקוד הרוב המכריע של גנים קידוד החלבונים מבוצע. במהלך יצירת ספריות מוטציות, מקובל להשתמש ביעילות של 30% התייעלות, המבוססת על ההסתברות להתפלגות פואסון המבטיחה שכל תא יקבל gRNA יחיד, כך שהטיפ-מייחס מיוחס לנוקאאוט מסוים. סמן BFP המבוטא על ידי תאים מתתמרים משמש לבחירת תאים המכילים gRNAs באמצעות FACS. מסכי פנוטיפקס מתבצעים בין 9-16 ימים לאחר התמרה. ביום המסך, האוכלוסיה הכוללת של תאי המוטציות מחולקת לשתיים. חצי אחד נשמר כאוכלוסיית השליטה והחצי השני נבחר עבור כריכת חלבון רקומביננטי. התאים מספריית מוטציה כי הם כבר לא מסוגלים לאגד את חלבון רקומביננטי ממוינים באמצעות FACS ואת העשרת gRNAs ב מיון לעומת אוכלוסיית השליטה משמש כדי לזהות גנים הדרושים לכריכה של משטח התא של המחקר מושבע בתווית. השלבים בפרוטוקול הדורשים זמן ניכר מצוינים. דמות זו השתנתה מארמה ואח '19. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
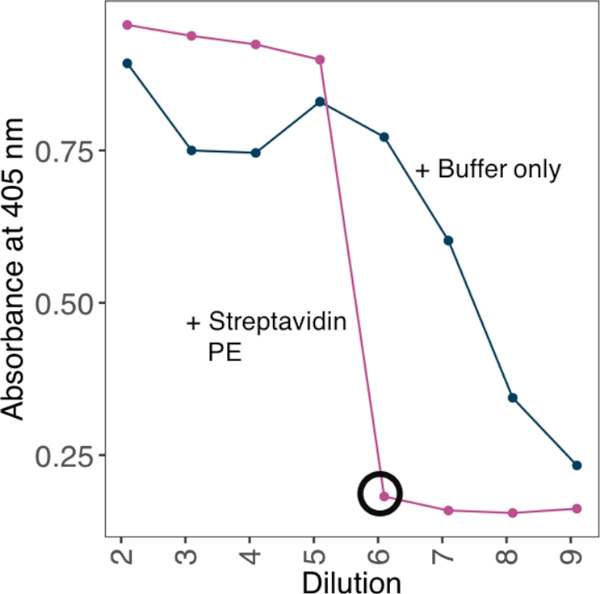
איור 2: לבסס את היחס של חלבון biotinylated ל streptavidin-PE באמצעות שיטה מבוססת אליסה. דוגמה לאסטרטגיה הstreptavidin-PE המשמש להפקת בדיקה נלהבת מחלבון monomylated ביולוגי. סדרת דילול של מונומרים ביולוגיים הייתה מודורה כנגד ריכוז קבוע של streptavidin. הדילול המינימלי שבו ניתן להבחין במונטירים מיותרים, נקבע על ידי אליסה. אליסה בוצעה עם או בלי לקדם מגוון של מדלל חלבונים עם 10 ng של streptavidin-PE. בנוכחות streptavidin-PE, הדילול המינימלי שבו לא זוהה אות (שחור מקיף) וכמות החלבון הנדרש עבור הרוויה חושבה כדי ליצור פתרון מניות 10x עם 4 μg/mL streptavidin-PE. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
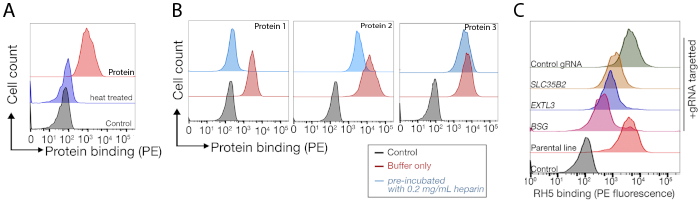
איור 3: איגוד מייצג של חלבונים לקווי תאים. (A) כריכת חלבון לקווי התא היתה עלייה ברורה הקשורים בתאי הזריחה לעומת דגימת הבקרה. טיפול בחום (80 ° c במשך 10 דקות) של חלבון רקומביננטי מכיל את כל הכריכה חזרה לשליטה שלילית, והפגינו כי התנהגות האיגוד הייתה תלויה בחלבון מקופל כראוי. (ב) מחלקות שונות של התנהגות איגוד חלבונים למשטחי תאים; תלות ב-בדיחות. משמאל לימין, החלבונים ניתן לסווג לשלושה סוגים: חלבון סוג 1 adsorbs רק ל HS. חלבונים אלה לאבד את הכריכה שלהם לאחר טרום דגירה עם ריכוזי הפארין מעל 0.2 mg/mL. סוג חלבון 2 נקשר ל-HS בנוסף לקולטן מסוימת. חלבונים אלה מאבדים כריכה חלקית בניסויים החוסמים. חלבון סוג 3 אינו לאגד HS. חלבונים אלה לא לאבד מחייב לעומת קווי הורים. (ג) דוגמה לחלבון (כלומר, RH5) הנקשר ל-HS ולקולטן מסוימת באופן מוספים. מיקוד או הקולטן (כלומר, BSG) או אנזימים הנדרשים עבור סינתזה HS (למשל, SLC35B2, EXTL3) מפחית רק באופן חלקי את הכריכה של RH5 לתאים יחסית לפקדים. התמרה קווי רב שבטיים ניתן להשתמש בניסויים כאלה כדי ליצור התנהגות מחייבת. דמות זו השתנתה מארמה ואח '19. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
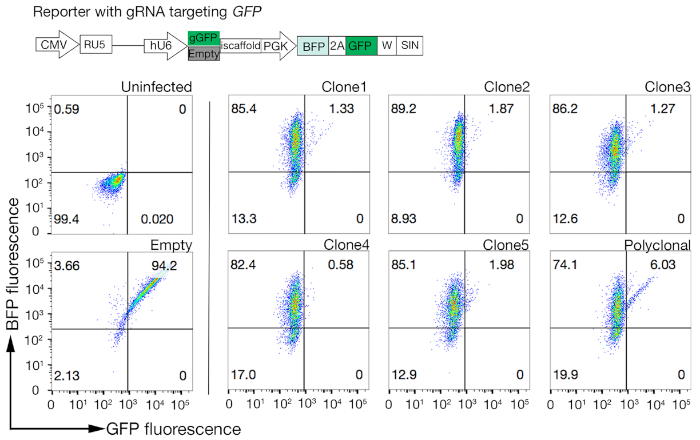
איור 4: בחירת קווים של תא שבטים עם פעילות Cas9 גבוהה. הגנום-עריכת יעילות של שני שבטים משוכפל קווים של NCI-SNU-1 קווי תא העריכו באמצעות GFP-BFP הכתב מערכת, שבו קווי התאים התעברו עם וירוסים עם gRNA-פילוח מקודד של GFP או ללא (כלומר, "ריק"). מתוארת סכמטית. Cy, Flow הזרימה שימש כדי לבדוק הן BFP ו-GFP ביטוי לאחר התמרה ולעומת שליטה נגוע. ביטוי GFP שימש proxy עבור פעילות Cas9, ואילו ביטוי BFP המסומנים תאים התמרה. הפרופיל של תאים נגועים וריקים נגוע נראה דומה עבור כל המשובטים. פרופילי מייצגים מתוארים בלוח השמאלי. כל חמשת שיבוטים של NCI-SNU-1 קו התא הראה אובדן גבוה יותר של GFP לעומת הקו הפוליפבטיים (הפאנל הימני), עם שיבוט 4 מראה את היעילות הגבוהה ביותר עם האוכלוסיה עקשן הנמוך ביותר. דמות זו השתנתה מארמה ואח '19. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
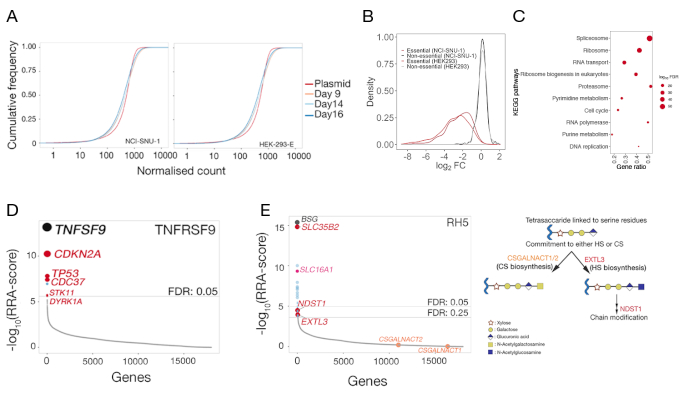
איור 5: הנציגה נובעת ממסכים גנטיים לזיהוי שותפי הכריכה של משטח התא. (א) מגרשיםשל פונקציית ההתפלגות המצטברת השוואת השפע grna בספריית הפלביניים לספריות המוטציות של hek-293-E ו-NCI-snu-1 תאים ביום 9, 14, ו 16 ימים התמרה. עבור כל מספר נתון, פונקציית צפיפות מצטברת מדווחת על אחוז נקודות הנתונים שהיו מתחת לסף זה. השינוי הקטן של אוכלוסיית תאי המוטציות בהשוואה לאוכלוסיית הפלביניים המקורית מייצגת את הדלדול בקבוצת משנה של gRNAs בהשוואה לספריית הפלביניים. (ב) הפצת שינויים בקיפול היומן בגנים שסווגו בעבר כחיוניים (אדום) או לא-חיוניים (שחור) בקווי התא HEK293 ו-NCI-snu-1. התפלגות של שינויי קיפול עבור גנים לא חיוניים ממורכז ~ 0, בעוד כי עבור גנים חיוניים העביר שמאלה לכיוון שינויי קיפול שלילי. (ג) מסלולים העשירו באופן משמעותי בגנים המרודלים ב-NCI-snu-1 שליטה באוכלוסיית המוטציות 14 ימים שלאחר התמרה. צפוי מסלולים ידועים התא הידוע זוהו. (ד) מדרג חזק אלגוריתם (rra)-ציון עבור גנים שהיו מועשר בתאים ממוינים שאיבדו את היכולת לאגד את TNFRSF9 לחקור. הגנים דורגו על פי. הניקוד הגבוה שותף האינטראקציה הידוע TNFSF9 וגנים הקשורים מסלול TP53 (המסומן באדום) זוהו במסך. (ה) דרג-הורה rra-ציונים עבור גנים שזוהו מניתוח העשרה grna הנדרש עבור RH5 HEK293 תאים (שמאל פאנל). SLC35B2 ו SLC16A1 זוהו בתוך סף גילוי שווא (רוזוולט) של 5%. שני גנים נוספים במסלול הביוסינתזה של HS (כלומר, EXTL3 ו- NDST1) זוהו ברדיוס של 25%. סכמטי המתאר את מסלול הביוסינתזה הכללי עם הגנים הרלוונטיים הממופים לשלבים המתאימים (פאנל 2). גנים הנדרשים למחויבות כונדרויטין סולפט ביוגנזה (כלומר, CSGALNACT1/2) לא זוהו במסך. דמות זו השתנתה מארמה ואח '19. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| שם פלמיד | פלסמיד # | השתמש |
| ביטוי חלבון לבנות: CD200RCD4d3 +4-bio-מקשר-שלו | כיצד להגן על: 36153 | ייצור חלבון רקומביננטי עם CD4d3 + 4, ביוטין ו -6-התגים שלו. |
| pMD2. ג'י | כיצד להגן על: 12259 | VSV-G מעטפה המבטא פלסמיד; ייצור של הנגיף |
| psPAX2 | כיצד להגן על: 12260 | מארז פלסטיק לעדשה, ייצור וירוס |
| Cas9-בניית: pKLV2-EF1a-Cas9Bsd-W | כיצד להגן על: 68343 | הפקה של קו Cas9 מבחינה חוקתית |
| הביטוי gRNA לבנות: pKLV2-U6gRNA5 (BbsI)-PGKpuro2ABFP-W | כיצד להגן על: 67974 | וקטור של ביטוי Grspr עם פיגום משופר וסמני puro/BFP |
| ספריה משופרת של הגנום האנושי | כיצד להגן על: 67989 | ספריית gRNA נגד 18,010 הגנים האנושיים, המיועדים לשימוש ב-הנגיף. |
| GFP-BFP לבנות: pKLV2-U6gRNA5 (gGFP)-PGKBFP2AGFP-W | כיצד להגן על: 67980 | Cas9 כתבת פעילות עם BFP ו-GFP. |
| מבנה ריק: pKLV2-U6gRNA5 (ריק)-PGKBFP2AGFP-W | כיצד להגן על: 67979 | Cas9 כתבת פעילות (בקרה) עם BFP ו-GFP. |
שולחן 1: פלמידים המשמשים בגישה זו.
| שם המאגר | רכיבים |
| HBS (10X) | 1.5 M היום ו 200 מ"מ HEPES במים מיליקיו, להתאים ל-pH 7.4 |
| ערוץ הPBS (10X) | 80 g היאl, 2 גרם KCl, 14.4 g Na2hpo4 ו 2.4 g KH2PO4 ב מיליקיו מים, להתאים ל-pH 7.4 |
| נתרן פוספט מאגר (מלאי 80mM) | 7.1 g Na2hpo4. 2h2O, 5.55 g נה2פו4, להתאים ל-pH 7.4 |
| מאגר כריכת הטיהור שלו | 20 מ"מ סודיום פוספט מאגר, 0.5 M היום ו 20 מ"מ סרמדול, להתאים ל-pH 7.4 |
| מאגר הימנעות מטיהור | 20 מ"מ נתרן פוספט מאגר, 0.5 M הנאל ו 400 מ"מ הסרמדול, התאם ל-pH 7.4 |
| מאגר דיאתיאנאמין | 10% diethanolamine ו 0.5 mM MgCl2 ב מים מיליקיו, להתאים ל-pH 9.2: |
| D10 | DMEM, 1% פניצילין-סטרפטומיצין (100 יחידות/mL) ו-10% חום הפעלה FBS |
טבלה 2: מאגרים הדרושים למחקר זה.
| רכיבים | 10 ס מ צלחת | צלחת 6-באר |
| 293FT תאים | 70 – 80% שוטפת | 70 – 80% שוטפת |
| מדיה תואמת החצייה (Opti-זיכרון) (שלב 5.1.2) | 3 מ ל | 500 מיקרומטר |
| מדיה תואמת החצייה (Opti-זיכרון) (שלב 5.1.4) | 5 מ ל | 2 מ ל |
| וקטור העברת לנטינגיי | 3 מיקרומטר | 0.5 μg |
| psPax2 (ראה טבלה 1) | 7.4 μg | 1.2 μg |
| pMD2 (ראו טבלה 1) | 1.6 μg | 0.25 μg |
| מגיב פלוס | 12 מיקרומטר | 2 מיקרומטר |
| Lipofectamine LTX | 36 מיקרומטר | 6 מיקרומטר |
| D10 (שלב 7.1.7) | 5 מ ל | 1.5 מ ל |
| D10 (שלב 7.1.8 ו7.1.10) | 8 מ ל | 2 מ ל |
שולחן 3: סכומים וכמויות של ריאגנטים עבור ערבוב אריזות וירוס.
שולחן 4: פריימר רצפים עבור הגברה gRNA ו-NGS. אנא לחץ כאן כדי להציג קובץ זה (לחץ לחיצה ימנית כדי להוריד).
| ריאגנט | נפח לכל תגובה | מיקס מאסטר (x38) |
| Q5 חם באיכות גבוהה התחלה 2x | 25 μL | 950 מיקרומטר |
| פריימר (L1/U1) מערבבים (10 μM כל אחד) | 1 ליטר | 38 מיקרומטר |
| דנ א גנומית (1 מ"ג/mL) | 2 מיקרומטר | 72 מיקרומטר |
| H2O | 22 μL | 1100 מיקרומטר |
| כולל | 50 מיקרומטר | 1900 מיקרומטר |
שולחן 5: PCR לצורך הגברה של gRNAs מתוך דגימות מורכבות גבוהה.
| מספר מחזור | הספרות הדנית | ריפוי | סיומת |
| 1 | 98 ° c, שנות ה -30 | ||
| 2-24 | 98 ° c, 10s | 61 ° c, 15s | 72 ° c, שנות ה -20 |
| 25 | 72 ° צ', 2 דקות |
שולחן 6: התנאים של ה-PCR ל-PCR הראשון.
| ריאגנט | נפח לכל תגובה |
| כנפי החמה | 25 μL |
| פריימר (PE 1.0/פריימר אינדקס) מערבבים (5 μM כל אחד) | 2μL |
| המוצר הראשון PCR (40 pg/μL) | 5 מיקרומטר |
| H2O | 18 מיקרומטר |
| כולל | 50 מיקרומטר |
טבלה 7: PCR עבור תיוג האינדקס של sgRNAs ממסכים גנטיים.
| מספר מחזור | הספרות הדנית | ריפוי | סיומת |
| 1 | 98 ° c, שנות ה -30 | ||
| 2-15 | 98 ° c, 10s | 66 ° c, 15s | 72 ° c, שנות ה -20 |
| 16 | 72 ° c, 5 דקות |
שולחן 8: תנאי PCR עבור ה-PCR השני.
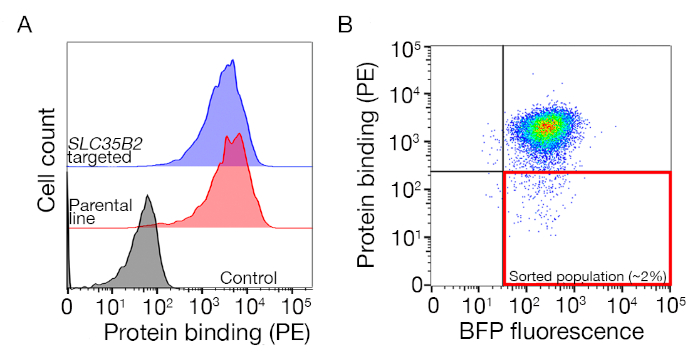
איור משלים S1: מדריך לרישום שערים למיון האוכלוסיה שאינה מחייבת. (א) מועמד חלבון אידיאלי להקרנה צריך להיות משמרת ברורה של אוכלוסיית הכריכה בהשוואה לאוכלוסיית השליטה והכריכה צריכה להישמר בתאים חסרי מכונות עבור BIOSYNTHESIS HS. ניסוי חסימת הפארין יכול לשמש במקום בדיקה על SLC35B2 קווי ממוקדות. (ב) תאים החסרים את פני השטח מפני החלבון ectodomain, אך המבטא זריחה bfp מפני התמרה ויראלית שנאספו. התאים המוצגים הם ממסך לזיהוי קולטן עבור GABBR222. דמות זו השתנתה מארמה ואח '19. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
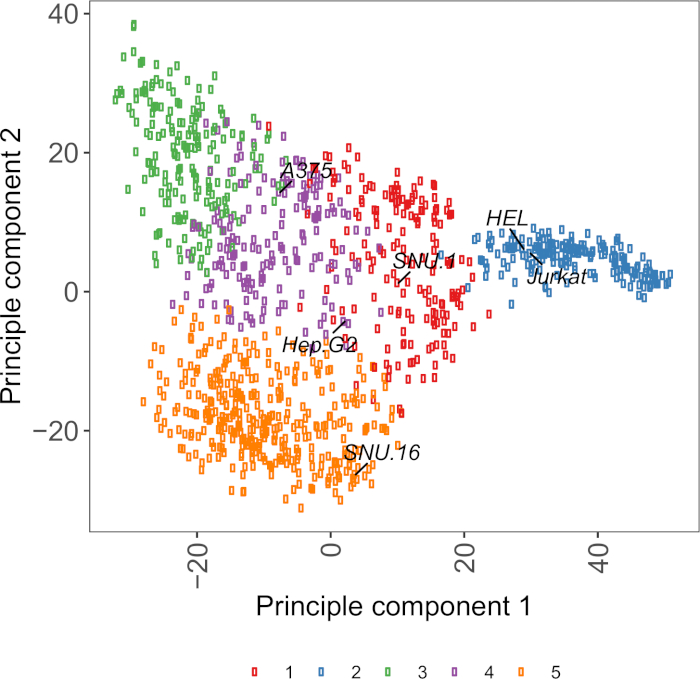
איור משלים S2: שטח תא גליקופרוטאין הטרנס מבוסס PCA מבוססי העלילה באמצעות הנתונים RNA-seq ממעל 1,000 שורות תאים סרטניים. קווי תא מדגם תא מודל27 הקובצים באשכולות באמצעות ה-K-אמצעי קיבוץ, בהתאם לערכי FPKM של ~ 1,500 משטח התא גליקורופנס. שורות תאים מייצגים מכל אשכול מסומנות בתווית. אשכול 5 היה מורכב לחלוטין מקווי תאים של מוצא המטפאות (ראה גם טבלה משלימה 2). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
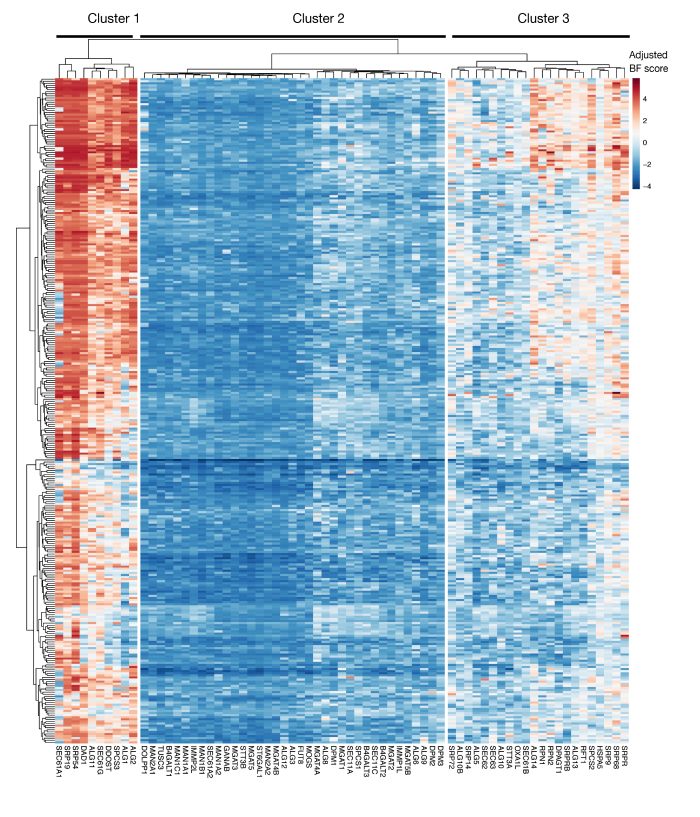
S3 דמות משלימה: תוצאות מהואליות עבור ייצוא חלבון KEGG-ביאור וגנים מקושרים לגליקוזילציה מתוצאות הפרוייקט. מותאם Bayes-המוני ציונים עבור ~ 330 קווי תא (עמודות, לא מתויג) מותווים עבור גנים של ייצוא חלבון ו-N המקושרים מסלול גליקוציה (X-ציר). ציונים גבוהים מ -0 מייצגים דלדול משמעותי באוכלוסיית המוטציות בהשוואה לספריית הפלביניים המקורית. הגנים יכולים להיות מחולקים לשלושה אשכולות ברורים המייצגים רמות שונות של המואליות בקווי התא. ניתן להשתמש בקיבוץ באשכולות זה כדי להחליט מהו יום המיון. אם המסך מבוצע בנקודת זמן מאוחרת (יום 16), ייתכן שגנים הידועים כחיוניים לתאים (אשכולות 1 ו-3) לא יזוהו. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
טבלה משלימה 1: קבצי ספירת Raw עבור ותוכנה MAGeCK שנוצר gene_summary קבצים הקשורים למסכים הגנטי נציג. אנא לחץ כאן כדי להציג קובץ זה (לחץ לחיצה ימנית כדי להוריד).
טבלה משלימה 2: קיבוץ באשכולות של קווי תאים לפי ביטוי של קולטני פני שטח תא. אנא לחץ כאן כדי להציג קובץ זה (לחץ לחיצה ימנית כדי להוריד).
Discussion
אסטרטגיית הקרנה מבוססת CRISPR כדי לזהות גנים הקידוד רכיבים סלולריים המעורבים זיהוי תאי מתואר. גישה דומה באמצעות הפעלת CRISPR גם מספק חלופה גנטית לזהות קולטני אינטראקציה ישירה של חלבונים רקומביננטי ללא צורך לייצר ספריות חלבון גדול26. עם זאת, אחד היתרונות העיקריים של גישה זו היא שהיא ישימה אינטראקציות התיווך על ידי מולקולות פני השטח המוצגות באופן מקורי על התא ואינו תלוי בביטוי יתר של קולטנים, אשר יכולים להשפיע על האיגוד המחייב של הקולטן. שלא כמו שיטות אחרות, לכן, טכניקה זו אינה מהווה הנחות לגבי הטבע הביוכימי או ביולוגיה התא של הקולטנים ומספקת הזדמנות ללמוד אינטראקציות בתיווך על ידי חלבונים המתקשים בדרך כלל ללמוד באמצעות גישות ביוכימיות, כגון חלבונים גדולים מאוד, או כאלה החוצה את הקרום פעמים רבות או מכלולי טפסים עם חלבונים אחרים, ומולקולות מלבד חלבונים לאור הגנום בקנה מידה של השיטה, גישה זו גם יש את היתרון של לא רק זיהוי הקולטן אלא גם רכיבים סלולריים נוספים הדרושים עבור האירוע מחייב, ובכך לספק תובנות לתוך הביולוגיה התא של הקולטן.
אחת המגבלות העיקריות של שיטה זו בעת השימוש בו כדי לזהות את הקולטן של חלבון יתום היא הדרישה הראשונית לזהות תחילה קו תא הנקשר לחלבון. זה לא תמיד קל לזהות קו תא המציג פנוטיפ כריכה כי הוא גם מתירני למסכים גנטיים יכול להיות צעד מגביל זמן לפריסת הרשת. קווי תאים מסוימים נוטים לאגד ליותר חלבונים מאחרים. הדבר רלוונטי במיוחד לחלבונים שתאגד HS, מכיוון שחלבונים אלה נוטים לאגד כל קו תאים המציג רשתות מובילות של HS, ללא קשר להקשר הכריכה המקורי. בנוסף, הבחנו כי upregulation של syndecans (כלומר, פרוטאוגליקנים המכילים HS) בקווי תאים מוביל לכריכה מוגברת של חלבונים מבוססי-HS26. זה יכול להיות גורם לקחת בחשבון בעת בחירת קו התא להקרנה. עם זאת, חשוב גם לציין כי הכריכה התוסף של HS אינה מפריעה לכריכה לקולטן מסוימת. משמעות הדבר היא שאם הכריכה נצפתה, ייתכן שהוא מתווך אך ורק על-ידי ה-HS משום שהכריכה מתווכת על-ידי HS בתוך שיטת הפעולה הזאת היא תוסף במקום19בלתי תלוי. בתרחיש כזה, הגישה לחסימת הפארין מתוארת יכולה לזהות התנהגויות כאלה מבלי שיהיה צורך לבצע מסך גנטי מלא.
משאב שימושי לבחירת קווי התא הוא תא דגם Passport, אשר מכיל גנומיקה, transcript, ומידע על תנאי התרבות עבור ~ 1,000 סרטן שורות התאים27. בהתאם להקשר הביולוגי, ניתן לבחור תאים בהתבסס על פרופילי הביטוי שלהם. כדי לסייע לבחירה של קווי התא, אנו מקובצים באשכולות ~ 1,000 שורות התא בדרכון תא מודל בהתאם לביטוי של ~ 1,500 מתחת לפני השטח של תא האדם גליקורופטינס28 (איור משלים 2; מידע אשכול עבור כל קו תא יחד עם תנאי גדילה מסופקים בטבלה השלמה 2). כאשר אתה בוחן את הכריכה של חלבון עם פונקציה לא ידועה, הוא שימושי לבחור פאנל של קווי התאים הנציג מכל אשכול כדי להגדיל את הסיכוי לכסות מגוון רחב של קולטנים. בהינתן בחירה, מומלץ לבחור קווי תאים קלים לתרבות וקל לשנות את האפשרויות. כמו קווי תא אלה ישמשו בהקרנה בקנה מידה הגנום, עדיף שהם יכולים להיות מגודלים בקלות בכמויות גדולות הם מתירני כדי לשנות את התמרה, כי היא השיטה הנפוצה ביותר למסירה של sgRNA עבור CRISPR מבוססי ההקרנה גנטית בשלבים מאוחרים יותר.
באופן כללי, בחירת הפנוטיפים מבוצעת במיון אחד. עם זאת, זה נקבע על ידי בהירות של אוכלוסיית התאים המוכתמת לעומת השליטה. סיבובים איטרטיביים של בחירות יכולים להיות מאומצים עבור תרחישים בהם יחס אות לרעש של הפנוטיפ הרצוי נמוך, או כאשר מטרת המסך היא לזהות מוטציות בעלי פנוטיפים חזקים. בעת שימוש בגישת בחירה איטראטיבית למסכים מבוססי FACS, חשוב לשקול שתהליך המיון עלול לגרום למוות בתאים, בעיקר בשל הכוח המוחלט של הסדרן. כך, לא כל התאים שנאספו יוצג בסיבוב הבא של מיון.
מורכבות הספרייה היא גורם חשוב מאוד בביצוע מסכים גנטיים מוצלחים, במיוחד עבור מסכי בחירה שלילית, מכיוון שהיקף המחסור באלה יכול להיקבע רק על ידי השוואת התוצאות למה שהיה קיים בספריית ההתחלה. עבור מסכי בחירה שליליים, מקובל לשמור על ספריות במורכבות של 500-1000 x. מסכי בחירה חיוביים, עם זאת, חזקים יותר לגדלי הספרייה, כי במסכים כאלה רק מספר קטן של מוטציות צפויים להיבחר פנוטיפים מסוימים. לכן, במסך הבחירה החיובית המתוארת כאן, ניתן להקטין את גודל הספרייה למורכבות של 50-100x מבלי להתפשר על איכות המסך. בנוסף, במסכים אלה ניתן גם להשתמש בספריית בקרה עבור קו תא נתון ביום נתון כ"פקד כללי" עבור כל הדגימות הממוינים ביום עבור קו הטלפון הנתון. פעולה זו תקטין את מספר ספריות הבקרה שיש להפיק ולסדר את הרצף.
שיקול חשוב נוסף לשימוש בגישה זו הוא המגבלות של מסכי אובדן התפקוד בזיהוי גנים החיוניים לצמיחת תאי מבחנה. העיתוי של המסכים הוא חיוני בהקשר זה, ככל שתאי מוטציה נשמרים בתרבות, גבוה יותר את הסבירות כי תאים עם מוטציות בגנים חיוניים להפוך לא קיימא ואינם מיוצגים עוד בספריית המוטציות. המסכים הגנטיים האחרונים שבוצעו כחלק מיוזמת הניקוד של הפרויקט ביותר מ-300 קווי התאים מראים כי גנים מרובים בפרשת החלבון KEGG-מוערת ומסלול N-גליליציה מזוהים לעתים קרובות כחיוניים למספר קווי תאים (איור 3)29. זה יכול להילקח בחשבון כאשר לעצב מסכי אם ההשפעה של גנים הדרושים התפשטות הכדאיות היא להיחקר בהקשר של תהליך זיהוי תאי. במקרה זה, ביצוע מסכי בנקודת זמן מוקדמת (לדוגמה, יום 9 התמרה) יהיה מתאים בדרך כלל. עם זאת, אם הגישה משמשת כדי לזהות מטרות מסוימות עם אפקטים בגודל חזק ולא מסלולים סלולריים כללי, זה עשוי להיות מתאים לבצע מסכי בשלב מאוחר יותר (למשל, יום 15-16 התמרה).
התוצאות מההקרנה חזקות מאוד; בשמונה רקומביננטי חלבון מסכי כריכה שבוצעו בעבר, קולטן פני השטח היה הלהיט העליון בכל מקרה19. כאשר משתמשים בגישה זו כדי לזהות את השותף לאינטראקציה, יש לצפות לפיכך לקולטן ולגורמים התורמים להצגתו על פני השטח להיות מזוהים עם ביטחון סטטיסטי גבוה. לאחר המסך מבוצע, להיט מאומת באמצעות הסתרה gRNA יחיד, מעקב אחר קופצים ניתן לבצע באמצעות שיטות הביוכימיות הקיימות כגון AVEXIS4 וכריכה ישירה מדומה של חלבונים מטוהרים באמצעות התהודה משטח הפלזמה. הגישה המתוארת כאן היא ישימה עבור כל החלבונים שעבורם ניתן ליצור בדיקה רקומביננטי מסיס מחייב.
לסיכום, זהו מרחב הגנום CRISPR הגישה הסתרה כדי לזהות אינטראקציות מתווכת על ידי משטח תאים חלבונים. שיטה זו ישימה בדרך כלל כדי לזהות מסלולים סלולריים הנדרשים לזיהוי שטח התא במגוון רחב של הקשרים ביולוגיים שונים, כולל בין תאים משלו של האורגניזם (למשל, הכרה עצבית ואימונולוגיים), כמו גם בין תאים מארחים וחלבונים הפתוגן. שיטה זו מספקת חלופה גנטית לגישות ביוכימיות שנועדו לזיהוי הקולטן, ומכיוון שהיא אינה דורשת שום הנחות קודמות לגבי הטבע הביוכימי או ביולוגיה התא של הקולטנים יש לו פוטנציאל גדול לעשות תגליות בלתי צפויות לחלוטין.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו נתמכת על ידי מענק ברוכים המספרים מספר 206194 הוענק GJW. אנו מודים למרכז Cy, Try Core: דבורה לינג Ng, ג'ניפר גרהם, סם תומפסון, וכריסטופר הול לעזרה עם FACS.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-mouse alkaline phosphatase | Sigma | A4656 | |
| Blasticidin | Chem-Cruz | SC-204655 | |
| Blood & Cell Culture DNA Maxi Kit | Qiagen | 13362 | |
| BSA | Sigma | A9647-100G | |
| Diethanolamine | Sigma | 398179 | |
| DMEM | Gibco | 31966-021 | |
| Dneasy Blood and Tissue kit | Qiagen | 69504 | |
| DynaMag-96 Side Magnet | Invitrogen | 12331D | |
| HEK293T packaging cells | ATCC | CRL-3216 | |
| Heparin | Sigma | H4784-1G | |
| KAPA HiFi HotStart ReadyMix | Kapa | KK2602 | |
| Lipofectamine LTX with PLUS reagent | Invitrogen | 15338100 | |
| MoFlo XDP cell sorter | BD | ||
| Ni2+-NTA agarose beads | Jena Bioscience | AC-501-25 | |
| OPTI-MEM | Life Technologies | 31985-070 | |
| OX-68 antibody | AbD Serotec | MCA1022R | |
| p-nitrophenyl phosphate | Sigma | 1040-506 | |
| PD-10 desalting columns | GE healthcare | 17085101 | |
| Polybrene | Millipore | TR-1003-G | |
| Polypropylene tubes with 5 mL bed volume | Qiagen | 34964 | |
| Proteinase K, recombinant, PCR Grade | Roche | 3115879001 | |
| Puromycin | Gibco | A11138-03 | |
| Q5 Hot Start High-Fidelity 2× Master Mix | NEB | M0494L | |
| QIAquick PCR purification kit | Qiagen | 28104 | |
| SCFA filter | Nalgene | 190-2545 | |
| Sony Cell sorter | Sony | ||
| SPRI beads (Agencourt AMPure XP beads) | Beckman | A63881 | |
| Streptavidin-coated microtitre plates | Nalgene | 734-1284 | |
| Streptavidin-PE | Biolegend | 405204 |
References
- Wright, G. J. Signal initiation in biological systems: the properties and detection of transient extracellular protein interactions. Molecular bioSystems. 5 (12), 1405-1412 (2009).
- van der Merwe, P. A., Barclay, A. N. Transient intercellular adhesion: the importance of weak protein-protein interactions. Trends in Biochemical Sciences. 19 (9), 354-358 (1994).
- Wood, L., Wright, G. J. Approaches to identify extracellular receptor-ligand interactions. Current Opinion in Structural Biology. 56, 28-36 (2019).
- Bushell, K. M., Söllner, C., Schuster-Boeckler, B., Bateman, A., Wright, G. J. Large-scale screening for novel low-affinity extracellular protein interactions. Genome Research. 18 (4), 622-630 (2008).
- Visser, J. J., et al. An extracellular biochemical screen reveals that FLRTs and Unc5s mediate neuronal subtype recognition in the retina. eLife. 4, e08149 (2015).
- Özkan, E., et al. An extracellular interactome of immunoglobulin and LRR proteins reveals receptor-ligand networks. Cell. 154 (1), 228-239 (2013).
- Martinez-Martin, N., et al. An Unbiased Screen for Human Cytomegalovirus Identifies Neuropilin-2 as a Central Viral Receptor. Cell. 174 (5), 1158-1171 (2018).
- Bianchi, E., Doe, B., Goulding, D., Wright, G. J. Juno is the egg Izumo receptor and is essential for mammalian fertilization. Nature. 508 (7497), 483-487 (2014).
- Mullican, S. E., et al. GFRAL is the receptor for GDF15 and the ligand promotes weight loss in mice and nonhuman primates. Nature Medicine. 23 (10), 1150-1157 (2017).
- Turner, L., et al. Severe malaria is associated with parasite binding to endothelial protein C receptor. Nature. 498 (7455), 502-505 (2013).
- Frei, A. P., et al. Direct identification of ligand-receptor interactions on living cells and tissues. Nature Biotechnology. 30 (10), 997-1001 (2012).
- Sobotzki, N., et al. HATRIC-based identification of receptors for orphan ligands. Nature Communications. 9 (1), 1519 (2018).
- Sharma, S., Petsalaki, E. Application of CRISPR-Cas9 Based Genome-Wide Screening Approaches to Study Cellular Signalling Mechanisms. International Journal of Molecular Sciences. 19 (4), (2018).
- Gebre, M., Nomburg, J. L., Gewurz, B. E. CRISPR-Cas9 Genetic Analysis of Virus-Host Interactions. Viruses. 10 (2), (2018).
- Zotova, A., Zotov, I., Filatov, A., Mazurov, D. Determining antigen specificity of a monoclonal antibody using genome-scale CRISPR-Cas9 knockout library. Journal of Immunological Methods. 439, 8-14 (2016).
- Puschnik, A. S., Majzoub, K., Ooi, Y. S., Carette, J. E. A CRISPR toolbox to study virus-host interactions. Nature Reviews. Microbiology. 15 (6), 351-364 (2017).
- Kerr, J. S., Wright, G. J. Avidity-based extracellular interaction screening (AVEXIS) for the scalable detection of low-affinity extracellular receptor-ligand interactions. Journal of Visualized Experiments. (61), e3881 (2012).
- Tzelepis, K., et al. A CRISPR Dropout Screen Identifies Genetic Vulnerabilities and Therapeutic Targets in Acute Myeloid Leukemia. Cell Reports. 17 (4), 1193-1205 (2016).
- Sharma, S., Bartholdson, S. J., Couch, A. C. M., Yusa, K., Wright, G. J. Genome-scale identification of cellular pathways required for cell surface recognition. Genome Research. 28 (9), 1372-1382 (2018).
- Wang, B., et al. Integrative analysis of pooled CRISPR genetic screens using MAGeCKFlute. Nature Protocols. 14 (3), 756-780 (2019).
- Hart, T., et al. Evaluation and Design of Genome-Wide CRISPR/SpCas9 Knockout Screens. G3. 7 (8), 2719-2727 (2017).
- Kuleshov, M. V., et al. Enrichr: a comprehensive gene set enrichment analysis web server 2016 update. Nucleic Acids Research. 44 (W1), W90-W97 (2016).
- Crosnier, C., et al. Basigin is a receptor essential for erythrocyte invasion by Plasmodium falciparum. Nature. 480 (7378), 534-537 (2011).
- Kirk, P., et al. CD147 is tightly associated with lactate transporters MCT1 and MCT4 and facilitates their cell surface expression. The EMBO Journal. 19 (15), 3896-3904 (2000).
- Chong, Z. S., Ohnishi, S., Yusa, K., Wright, G. J. Pooled extracellular receptor-ligand interaction screening using CRISPR activation. Genome Biology. 19 (1), 205 (2018).
- van der Meer, D., et al. Cell Model Passports-a hub for clinical, genetic and functional datasets of preclinical cancer models. Nucleic Acids Research. 47 (D1), D923-D929 (2019).
- Bausch-Fluck, D., et al. A mass spectrometric-derived cell surface protein atlas. PloS One. 10 (3), e0121314 (2015).
- Behan, F. M., et al. Prioritization of cancer therapeutic targets using CRISPR-Cas9 screens. Nature. 568 (7753), 511-516 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved