Method Article
게놈 규모 CRISPR/Cas9 유전 스크린을 이용한 세포 표면 수용체 식별
요약
이 원고는 세포외 수용체-리간드 상호 작용을 확인하기 위해 게놈 규모의 세포 기반 스크리닝 접근법을 기술한다.
초록
막 내장 된 세포 표면 수용체 사이의 직접적인 상호 작용에 의해 매개 된 세포 간 통신은 다세포 유기체의 정상적인 발달및 기능에 매우 중요합니다. 그러나 이러한 상호 작용을 감지하는 것은 기술적으로 어려운 일입니다. 이 원고는 특정 세포 표면 인식 사건에 필요한 세포 경로를 밝히는 체계적인 게놈 규모 CRISPR/Cas9 녹아웃 유전자 스크리닝 접근법을 설명합니다. 이 분석법은 포유류 단백질 발현 시스템에서 생성된 재조합 단백질을 열렬한 결합 프로브로서 세포 기반 유전자 화면에서 상호작용 파트너를 식별합니다. 이 방법은 막-임베디드 수용체의 ectodomains에 대응하는 재조합 결합 프로브에 의해 검출된 세포 표면 상호작용에 필요한 유전자를 식별하는데 사용될 수 있다. 중요한 것은, 이 접근법의 게놈 스케일 특성을 감안할 때, 또한 직접 수용체뿐만 아니라 세포 표면에서 수용체의 프리젠테이션에 필요한 세포 성분을 식별할 뿐만 아니라, 수용체의 생물학에 대한 귀중한 통찰력을 제공한다는 장점이 있다.
서문
세포 표면 수용체 단백질에 의한 세포 외 상호 작용은 조직 조직, 호스트 병원체 인식 및 면역 조절과 같은 중요한 생물학적 과정을 지시합니다. 막 수용체가 단클론 항체와 같은 체계적으로 전달된 치료제의 실행 가능한 표적이기 때문에 이러한 상호 작용을 조사하는 것은 더 넓은 생물 의학 사회에 흥미를 가지고 있습니다. 그들의 중요성에도 불구 하 고, 이러한 상호 작용을 공부 하는 것은 기술적으로 도전 남아. 이는 주로 막 내장 수용체가 양과병성이기 때문에 생화학적 조작을 위해 생물학적 막으로부터 분리하기 어렵고, 이들의 상호작용은 약한 상호작용 친화도(μM-mM 범위의KDs)에의해 대표되기 때문이다1. 따라서, 많은 일반적으로 사용되는 방법은 단백질 상호작용의이클래스를 검출하기에 적합하지 않습니다1,2.
다양한 방법이 특별히 그들의 독특한 생화학적 특성을 고려한 세포외 수용체-리간드 상호작용을 조사하기 위해 개발되었다3. 이러한 접근법의 숫자는 이러한 단백질이 글리칸 및 이황화 결합과 같은 구조적으로 중요한 번역 후 변형을 포함하도록 포유류 또는 곤충 세포 기반 시스템에서 수용성 재조합 단백질로서 수용체의 전체 ectodomain을 발현하는 것을 포함한다. 낮은 친화성 결합을 극복하기 위해, ectodomains는 종종 그들의 결합 열력을 증가시키기 위해 올리고머화된다. 열렬한 단백질 ectodomains는 성공적으로 직접 재조합 단백질 상호 작용 스크린4,,5,,6,,7에서상호 작용 파트너를 확인하기 위해 결합 프로브로 사용되었습니다. 광범위하게 성공하는 동안, 재조합 단백질 기반 방법은 막 수용체의 ectodomain가 수용성 단백질로서 생산될 것을 요구한다. 따라서, 인접 한 세포 외 영역 (예를 들어, 단일 패스 유형 I, 유형 II, 또는 GPI-고정)을 포함 하는 단백질에만 일반적으로 적용 가능 하 고 일반적으로 수용 체 복합체 복합체 및 막 여러 번 에 걸쳐 막 단백질에 적합 하지 않습니다.
상보성 DNA(cDNO)의 라이브러리가 세포내로 형질 전환되고 결합의 이득 표현형을 시험하는 발현 복제 기술은 또한 세포외 단백질 상호작용을 식별하기 위해 사용되어왔다 8. 최근 몇 년 동안 복제 되고 서열화된 cDNA 발현 플라스미드의 큰 컬렉션의 가용성은 cDNAs 인코딩 세포 표면 수용체를 과발현하는 세포주들이 상호작용을 확인하기 위해 재조합 단백질의 결합을 위해 스크리닝되는 방법을 용이하게 한다9,,10. cDNA 과발현 기반 접근법은 재조합 단백질 기반 방법과 달리 혈장 막의 맥락에서 상호 작용을 식별할 수 있는 가능성을 제공합니다. 그러나 cDNA 발현 구성을 사용하는 성공은 올바르게 접힌 형태로 단백질을 과발현하는 세포의 능력에 달려 있지만, 이것은 종종 수송기, 샤페론 및 올바른 올리고머 어셈블리와 같은 세포 액세서리 요인이 필요합니다. 단 하나 cDNA를 transfecting는 그러므로 세포 표면 표현을 달성하기 위하여 충분하지 않을 지도 모릅니다.
cDNA 구성또는 재조합 단백질 프로브를 이용한 스크리닝 기술은 자원 집약적이며 cDNA 또는 재조합 단백질 라이브러리의 대규모 수집이 필요합니다. 특별히 설계된 질량 분석 기반 방법은 최근에 큰 라이브러리의 조립을 필요로하지 않는 세포외 상호 작용을 식별하기 위해 활용되었습니다. 그러나, 이들 기술은 세포 표면의 화학적 조작을 필요로 하며, 이는 세포의 표면에 존재하는 분자의 생화학적 성질을 변화시킬 수 있으며 현재 는 당화 단백질11,,12에의해 매개된 상호작용에만 적용가능하다. 현재 유효한 방법의 대다수는 또한 크게 글리칸 지질 및 콜레스테롤과 같은 분자를 포함하여 막 미세 환경에서 기여를 무시하는 동안 단백질 사이 상호 작용에 집중합니다.
CRISPR 기반 접근법을 사용하여 고효율 이중 알레온 표적화의 최근 개발은 다른 맥락에서 관련된 세포 구성 요소를 식별하기 위해 체계적이고 편견없는 방법으로 선별 할 수있는 단일 풀에서 정의 된 유전자가 부족한 세포의 게놈 스케일 라이브러리를 가능하게했습니다. 세포 신호 처리 과정 해부, 약물, 독소 및 병원균에 대한 내성을 부여하는 교란의 식별, 항체의 특이성 결정13,,14,,15,,16을포함한다. 여기에서, 우리는 세포외 수용체-리간드 상호작용을 확인하기 위하여 현재 생화확적인 접근에 대안을 제공하는 게놈 규모 CRISPR 기지를 둔 녹아웃 세포 검열 분석법을 기술합니다. 유전 스크린에 의해 막 수용체에 의해 중재된 상호 작용을 확인하는 이 접근은 cDNAs 또는 재조합 단백질의 큰 라이브러리를 컴파일할 필요를 피하기 때문에 개별 리간드에 초점을 맞춘 관심사를 가진 연구원을 위해 특히 적당합니다.
이 분석법은 세 가지 주요 단계로 구성되어 있습니다: 1) 관심 있는 수용체의 세포외 영역으로 구성된 고도로 열렬한 재조합 단백질 결합 프로브가 형광계 유세포계 계 결합 분석에서 생산및 사용; 2) 결합 세포는 재조합 단백질 프로브의 상호작용 파트너를 발현하는 세포수를 식별하는데 사용된다; 3) 관심 있는 단백질과 상호작용하는 세포주의 Cas9 발현 버전이 생성되고 게놈 스케일 CRISPR/Cas9 기반 녹아웃 스크린이 수행된다(도1). 이러한 유전자 화면에서, 재조합 단백질을 세포주로 결합하는 것은 프로브를 결합하는 능력을 상실한 녹아웃 라이브러리 내의 세포가 형광 계활성 세포 선별(FACS) 및 시퀀싱에 의해 확인된 결합 표현형의 손실을 야기한 유전자를 사용하여 분류되는 측정 가능한 표현형으로서 사용된다. 원칙적으로, 열렬한 프로브와 그 세포 표면 디스플레이에 필요한 결합을 담당하는 수용체를 코딩하는 유전자가 확인된다.
이 프로토콜의 첫 번째 단계는 막 결합 수용체의 ectodomain을 나타내는 열렬한 재조합 단백질 프로브의 생산을 포함한다. 이들 수용체는 그들의 ectodomains가 재조합 수용성 단백질1로발현될 때 그들의 세포외 결합 기능을 자주 유지하는 것으로 알려져 있다. 관심 있는 단백질을 위해, 수용성 재조합 단백질은 결합 열력을 증가시키기 위해 올리고머화될 수 있고, 형광계 세포측정 기반 결합 분석(예를 들어, FLAG-tag, 비오틴 태그)에 사용될 수 있는 태그를 함유하는 임의의 형식에서 임의의 적합한 진핵 단백질 발현 시스템에서 제조될 수 있다. HEK293 단백질 발현 시스템을 이용한 막 수용체의 수용성 외피 도메인의 생산을 위한 상세한 프로토콜은 다양한 다중화 기술뿐만 아니라 펜타머 성 단백질 및 단일성 단백질의 생산을 위한 단백질 발현 구문들모두의양체단백질 및 단일성 단백질의 생산을 위한 컨셉티클 생성을 위해 이전에 설명된1,17. 여기서 프로토콜은 불소화(예를 들어, 피코에리트린, 또는 PE)에 공액화된 스트렙타비딘을 공액화함으로써 단조로운 생체면역 단백질로부터 형광 열렬한 프로브를 생성하는 단계를 설명할 것이며, 이는 세포 기반 결합 분석에서 직접 사용될 수 있고 검출을 위한 이차 항체를 필요로 하지 않는다는 장점이 있다. 게놈 스케일 스크린을 수행하기 위한 일반적인 프로토콜은 이미20,,21,따라서 프로토콜은 주로 인간 V1("Yusa")라이브러리를사용하는 CRISPR/Cas9 녹아웃 스크리닝 시스템을 사용하여 유세포분석 기반 재조합 단백질 결합 스크린을 수행하는 특이성에 초점을 맞추고 있다.
프로토콜
1. 생체태깅 단백질의 생산 및 정제
- 포유류 또는 곤충 세포 계 단백질 발현 시스템을 사용하여 수용성 재조합 그의 태그가 붙은 생체 면역 단백질을 생성한다(표 1의플라스미드 구성 참조).
참고: HEK293 세포 발현 시스템을 사용하여 단모성 비오틴 및 그의 태그가 붙은 단백질의 생산을 위한 상세한 프로토콜은 Kerr et al.17에의해 설명된다. HEK293 발현 시스템을 사용하여 발현된 단백질 ectodomains는 배양 배지 내로 분비된다. - 수용성 단백질을 3,000 x g에서 원심분리하여 20분 동안 펠릿하여 수집합니다.
- 0.22 μm 필터를 통해 상류체를 걸러내고 Ni2+-NTA 아가로즈 비드를 여과된 단백질 상층부액에 1:1,000 비율로 첨가합니다(즉, 50% 아가로즈 슬러리를 50 mL의 상복부에) 회전 플랫폼에서 4°C에서 하룻밤 또는 적어도 4-5시간 배양한다.
- 폴리프로필렌 컬럼을 5 mL의 정화 세척 버퍼를 추가하여 세척합니다. 모든 버퍼 컴포지션에 대한 표 2를 참조하십시오.
- 전체 비드-단백질 상급 혼합물을 컬럼에 붓습니다. 구슬은 기지에 축적됩니다.
- 15 mL의 세척 버퍼로 구슬을 2 x 씻으하십시오. 단백질 희석을 방지하려면 5 mL 주사기로 컬럼에서 잔류 세척 버퍼를 조심스럽게 그려 버리고 폐기하십시오.
- 조심스럽게 구슬에 직접 자신의 정제 용출 완충제의 300-500 μL을 추가하고 적어도 1 시간 동안 배양. 1 mL 주사기를 사용하여 액체를 다시 조심스럽게 뽑아 서 용출 된 단백질을 수집합니다. 용출 버퍼를 탈염 컬럼을 사용하여 원하는 버퍼(예: 일반적으로 PBS 또는 HBS)로 교환합니다. 모든 단백질을 4°C에서 추가로 사용할 때까지 보관하십시오.
2. 단모성 생체 면역 단백질의 정량화 및 올리고머화
참고 : 결합 열력을 높이기 위해, 결합 검충에 사용하기 전에 tetrameric 연쇄상 구균 -PE에 생체 면역 화된 단일 성 단백질을 올리고 메리화. 단면성 단백질과 테트라메릭 스트렙타비딘-PE의 최적 접합 비를 달성하여 고정 된 농도의 스트렙타비딘에 대해 생물질화 단량체의 희석 시리즈를 테스트하고 경험적으로 과도한 생체 티니제 단량체가 검출될 수 없는 최소 희석을 확립합니다.
- 적절한 희석 완충제(1% 소 혈청 알부민[BSA]를 가진 PBS 또는 HBS)를 사용하여 생체 질화된 단백질 샘플의 적어도 8개의 직렬 희석을 96웰 플레이트에 확인합니다. 각 희석의 최종 부피가 200 μL 이상인지 확인합니다.
- 각 우물에서 100 μL을 제거하고 새로운 96 웰 플레이트로 옮겨 샘플의 중복 플레이트를 만듭니다. 항상 컨트롤을 포함합니다. 이 경우 대조군(즉, 생체티니제화된 Cd4 도메인 3+4 단백질)이 태그 전용 단백질이다. 이것은 모든 결합 검매에서 대조군 프로브로서 사용될 것이다.
- 희석 완충액에서 스트렙타비딘-PE를 0.1 μg/mL로 희석한다.
- 접시 중 하나에 희석 된 스트렙타비딘 -PE 100 μL을 추가하십시오. 중복 플레이트는 컨트롤역할을 합니다. 100 μL의 희석 버퍼를 제어 판에 추가하여 볼륨을 균등화합니다.
- 실온(RT)에서 20분 동안 배양합니다. 그 동안, 15 분 동안 희석 버퍼로 스트렙타비딘 코팅 플레이트의 우물을 차단합니다.
- 두 플레이트에서 스트렙타비딘 코팅 플레이트의 개별 우물로 샘플의 총 부피를 전송하고 RT에서 1 시간 동안 배양하십시오.
- 플레이트를 200 μL의 세척 버퍼로 3x 세척하십시오 (즉, 0.1 % 트웬-20, 2 % BSA로 PBS 또는 HBS). 2 μg/mL 마우스 안티 래트 Cd4d3+4 IgG(OX68)의 100 μL을 추가하고 RT에서 1시간 동안 배양합니다.
- 세척 버퍼로 플레이트를 3x 세척합니다. RT에서 1시간 동안 0.2 μg/mL에 항마우스 알칼리성 인산염 컨쥬게이트 100 μL을 첨가합니다.
- 세척 버퍼로 플레이트를 3x, 희석 버퍼에서 1x로 세척합니다.
- 디에탄올아민 완충제에서 1 mg/mL에서 p-니트로페닐 인산염을 준비합니다. 각 우물에 100 μL을 넣고 15 분 동안 배양하십시오.
- 405 nm에서 흡광도 판독값을 가져 가라. 테트라머를 생성하기 위한 적절한 희석 계수로서 플레이트에 신호가 없는 최소 희석을 사용하십시오(그림2).
- 4 μg/mL 스트렙타비딘-PE와 30분 동안 적절한 생체티니얼 단백질 희석을 인큐베이팅하여 모든 시료 및 대조군을 위한 10x 테트라머 염색 용액을 RT. Store 에서 4°C의 광 보호 튜브에 공액 단백질을 추가 사용하십시오.
3. 유세포 분석 계 세포 결합 분석
- 부착 세포의 경우 배양 매체를 제거하고 DIVALENT 양이온없이 PBS로 1x를 씻으하십시오. 그런 다음 셀 분리 솔루션(예: EDTA)을 추가합니다. 세포가 5-10 분 동안 분리되도록 하십시오.
참고: 트립신 기반 제품은 세포 표면 단백질을 갈라놓을 수 있기 때문에 사용하지 마십시오. - 분리된 세포를 튜브에 모읍시다. 현탁액에서 성장하는 세포의 경우(예를 들어, HEK293 세포), 배양 플라스크로부터 직접 튜브내로 세포를 수집한다.
- 펠릿 세포는 5분 동안 200 x g에서 상류를 제거하고 펠릿을 세척 완충제(즉, PBS/1% BSA)에 다시 놓습니다.
- 혈세포계를 사용하여 세포를 계산하고 농도를 2.5 x 105 -1x 106 세포 /mL로 조정합니다. 96 개의 웰 U-또는 V-바닥 플레이트상에 제조된 셀 믹스의 Aliquot 100 μL. 400 x g에서5 분 동안 접시를 돌이기 . 멀티채널 파이펫으로 상급체를 제거합니다.
- 정규화된 형광성 으로 표지된 100 μL을 세포가 있는 이전에 준비된 플레이트에 넣고 4°C에서 1시간 동안 배양합니다. 1 시간 동안 바인딩 한 후 400 x g에서 5 분 동안 플레이트를 돌이꿉습니다.
- 상급체를 제거하고 세척 버퍼 200 μL(즉, PBS/1% BSA)를 추가합니다. 위아래로 파이펫팅하여 잘 섞으세요.
- 400 x g에서 원심분리하여 세포를 5분 동안 펠렛합니다. 2번의 세안 후, 상류자를 완전히 제거하고 100 μL의 PBS에서 세포 펠릿을 다시 중단시켰다.
- 유세포측정으로 세포를 분석합니다. 노란색-녹색 레이저(즉, 561 nm)를 사용하여 PE 형광을 검출합니다.
- 먼저 제어 프로브로 염색된 세포를 분석합니다. PE 형광의 분포에 기초하여, 제어 셀의 1% 이상이 이 게이트에 빠지지 않는 등 결합 집단에 대한 게이트를 그립니다.
- 샘플을 분석하고 결합 게이트에 속하는 셀의 분율을 결정합니다.
참고: 더 높은 결합 인구를 표시하는 세포주는 더 높은 신호 대 잡음 비율을 갖기 때문에 유전 스크린을 위해 요구됩니다. 이상적으로 세포의 80% 이상이 이 문 안에 있어야 합니다.
4. 열 비질 에피토프 및 헤파란 황산염 사이드체인의 결합 기여도 결정
참고 : 많은 단백질의 활성은 열 불안정, 그래서 열처리 다음 바인딩 활동의 손실은 고무적이다. 재조합 단백질의 결합을 중재하는 데 부정적인 전하 글리코사미노 글리칸, 주로 헤파란 황산염 (HS)의 기여도를 결정하는 것이 좋습니다. 이는 여기에 기재된 세포 결합 분석에서 HS에 의한 결합이 다른수용체(19)에동의존적이지 않고 첨가제가 될 수 있기 때문이다. 이는 관찰된 결합이 특정 수용체에 의해서가 아니라 세포 표면 프로테오글리칸의 HS 측사슬에 의해 완전히 매개될 수 있음을 의미한다. 세포 표면상에서 HS에 결합하는 것은 반드시 비특이적일 필요는 없으며, 오히려 단백질의 성질이며, 이는 완전한 유전적 스크린을 수행하기 전에 아는 것이 유용하다.
- 결합 검정에 사용하기 위하여 열처리한 단백질 견본을 준비하십시오.
- 정규화되었지만 비콩액성 단조 단백질을 80°C에서 10분 동안 가열합니다.
- ELISA에 의해 결정된 것과 동일한 접합비를 가정하여 스트렙타비딘-PE에 열처리 된 단백질을 접합합니다 (섹션 2 참조).
- 헤파린으로 막힌 단백질 샘플을 준비합니다.
- 2 mg/mL의 시작 농도와 100 μL의 최종 부피로 PBS에서 수용성 헤파린 8개를 1:3 희석합니다.
- 헤파린 희석물에서 제조된 결합 프로브의 100 μL을 적어도 30분 동안 인큐베이트한다.
- 열처리된 단백질과 섹션 3에 기재된 결합 분석법에서 헤파린/단백질 혼합물의 전체 200 μL을 사용하십시오. 대표적인 결과는 그림 3A, B에나와 있습니다.
5. 안정적으로 Cas9를 표현하는 세포주 선택
참고: 관심 있는 프로브를 결합하는 세포주가 CRISPR 스크리닝에 사용될 수 있기 전에, 먼저 Cas9 뉴클레아제 및 고활성클론선택(19)을발현하도록 설계되어야 한다.
- Cas9 발현에 대한 렌티바이러스 구제를 사용하여 렌티바이러스를 생산하기 위해 다음의 일반적인 렌티바이러스 생산 프로토콜을 사용한다(표 1참조).
- 37°C 및 5%CO2에서DMEM/10% FBS 배지에서 배양 HEK293-FT 세포. 종자 HEK293-FT 세포는 형질전환 1일 전에 형질전환 당일 ~80% 수렴되도록 하였다.
참고 : HEK293FT 세포는 느슨하게 부착됩니다. 따라서 렌티바이러스 생산에 사용될 때 순응도를 높이기 위해 0.1 % (w / v) 젤라틴으로 코팅 된 배양 플라스크에 도금을하는 것을 고려하십시오. - 아침에 형질 전환을 수행합니다. 전사 벡터, 패키징 믹스 및 트랜스펙션 시약을 미리 온화된 트랜스펙션 호환 매체(예: Opti-MEM)에 추가합니다. 튜브를 10-15x 반전시켜 섞는다. RT에서 5분 동안 인큐베이팅하십시오. Table 3
- 제조업체에서 제안한 대로 형질감염 시약을 추가합니다. 빠른 소용돌이로 섞으세요. RT에서 30 분 동안 인큐베이션하십시오.
- 매우 신중하게 소비 매체를 흡인. 플레이트에 트랜스펙션 호환 용지를 추가합니다.
- 형질감염 시약/DNA 복합체를 플레이트 측면에 떨어뜨리고 매우 부드럽게 소용돌이치면서 플레이트를 통해 천천히 퍼집니다.
- 3-5 h에 대해 37 °C에서 배양하고 배지를 D10 배지로 대체합니다. 하룻밤 동안 배양하십시오.
- 다음날 아침에 는 매체를 신선한 D10 매체로 교체하십시오. 하룻밤 동안 배양하십시오.
- 다음날 오후 늦게, 바이러스 성 상한자를 수집하십시오. 단백질 결합이 낮은 0.45 μm 필터로 걸러내. 선택적으로, 신선한 D10 배지를 추가하고, 밤새 배양하고 다음날 상급을 회수하십시오.
- 바이러스 상피제는 며칠 동안만 4°C에서 안정하다. 장기 보관을 위해 -80°C에서 보관하십시오.
참고 : 세포를 변환하기 어려운 의 전이에 바람직 할 수있는 고농축 렌티 바이러스 제제를 생성하기 위해, 초자연자는 또한 4 °C에서 하룻밤 6,000 x g에서 원심 분리에 의해 집중 될 수있다. 에탄올 내성 펜으로 반투명 바이러스 성 펠릿을 표시하고 상한제를 버립니다. 농도가 100배 증가하기 위해 원래 부피의 1/100에서 펠릿을 다시 일시 중단합니다.
- 37°C 및 5%CO2에서DMEM/10% FBS 배지에서 배양 HEK293-FT 세포. 종자 HEK293-FT 세포는 형질전환 1일 전에 형질전환 당일 ~80% 수렴되도록 하였다.
- 렌티 바이러스로 세포를 변환합니다.
- 플레이트 1 x 106 세포를 6 웰 플레이트에서 3 mL의 적절한 배양 배지를 갖는다. 일부 세포는 다른 세포보다 더 쉽게 변환됩니다. 세포(예: HEK 세포)를 쉽게 변환하기 위해 렌티바이러스를 세포에 직접 추가하십시오. 세포를 변환하기 어려운 경우, 아래에 설명된 바와 같이 척추 분석 프로토콜을 따라야 할 수도 있습니다.
- 15 mL 원엽 튜브에서 2-5 x 106 세포 / mL의 2 mL.
- 렌티바이러스를 8 μg/mL 헥사디메트린 브로마이드와 함께 넣고 RT에서 30분 동안 배양합니다.
- 32 °C에서 800 x g에서 100 분 동안 원심 분리기. 그런 다음 동일한 배지에서 세포를 다시 중단하고 적절한 배지를 가진 적절한 배양 플라스크에 세포 현탁액을 추가합니다.
- 적어도 24 시간 동안 환관을 허용하십시오. 그 후 바이러스를 포함하는 매체를 제거하고 신선한 매체를 추가하십시오.
- 또 다른 24 시간 후, 적절한 항생제로 보충되는 것으로 미디어를 변경하십시오. Cas9 구성에는 선택을 위한 블라스카디딘 저항 카세트가 포함되어 있습니다.
참고: 배스티치딘의 양은 투여량 응답 킬 곡선을 수행하여 각 세포주에 대해 최적화되어야 합니다. 2.5-50 μg/mL 사이의 블라스타시딘 농도는 트랜스덕트 10일 이내에 대부분의 전이되지 않은 세포주를 죽여야 합니다.
- 플레이트 1 x 106 세포를 6 웰 플레이트에서 3 mL의 적절한 배양 배지를 갖는다. 일부 세포는 다른 세포보다 더 쉽게 변환됩니다. 세포(예: HEK 세포)를 쉽게 변환하기 위해 렌티바이러스를 세포에 직접 추가하십시오. 세포를 변환하기 어려운 경우, 아래에 설명된 바와 같이 척추 분석 프로토콜을 따라야 할 수도 있습니다.
- 대조판에 있는 모든 세포(즉, 동일한 선택 항생제 농도로 처리된 비트랜스듀베이션 세포)가 죽을 때까지 선택을 수행한다.
6. 높은 Cas9 활동 클론 선택
참고 : 폴리 클로날 Cas9는 성공적으로 유전 스크린을 수행하는 데 사용할 수 있습니다; 그러나, 높은 Cas9 활성을 가진 클론을 선택하면 스크리닝 결과가18향상된다.
- 희석 또는 단세포 정렬 개별 블라스치디딘 내성 세포를 블라스티딘으로 보충된 배양 배지를 함유하는 3개의 96웰 플레이트의 우물로 제한사용. 클론은 2-4 주 사이에 등장하기 시작합니다. 10-20개의 클론을 선택하고 6개의 웰 플레이트로 확장합니다.
- 빠른 평가 GFP-BFP(녹색 형광 단백질-청색 형광 단백질) 시스템을 사용하여 Cas9 활성에 대한 클론을 분석하는 것은 세포가 gRNA 표적화 GFP 또는 빈 gRNA를 대조군으로 GFP를 발현하는 구성으로 변환되는 외인성 유전자 녹아웃 시스템을 사용하는18.
- 주문 리포터 플라스미드: GFP-BFP 플라스미드, 컨트롤-BFP 플라스미드(표 1).
- 섹션 5.1에 기재된 렌티바이러스 생산 프로토콜을 사용하여 GFP-BFP 플라스미드 및 대조군-BFP 플라스미드 모두에 대한 렌티바이러스를 생산한다.
- GFP-BFP 시스템 및 제어-BFP를 별도로 인코딩하는 렌티바이러스로 각 Cas9 발현 세포주 클론을 트랜스듀싱한다. 섹션 5.2의 프로토콜을 따르십시오.
- 3일간의 환전 후, 유세포측정을 사용하여 각 클론의 GFP-BFP 형광을 검사한다. 488 nm 레이저와 405 nm 레이저를 사용하여 GFP와 BFP를 각각 검출하십시오.
- GFP-BFP-이중 양성 세포에 대해서만 BFP의 비율을 조사하여 각 클론에서 Cas9 활성을 정량화한다. 높은 활성 Cas9 세포는 이상적으로 >95% GFP 녹아웃 효율을 가져야 한다(그림 4).
7. 게놈 전체 CRISPR-Cas9 스크리닝 녹아웃 라이브러리 생성
- 인간 V1라이브러리(18)를이용한 게놈 전체 스크리닝의 경우, 게놈 폭 라이브러리(표 1참조)를 주문하고 제조자 매뉴얼의 "라이브러리 복제를 위한 프로토콜"에 제공된 프로토콜을 사용하여 박테리아 스탭으로부터 플라스미드 라이브러리를 제조한다.
- 섹션 5.1에 기재된 렌티바이러스 생산 프로토콜을 사용하여 인간 유전자의 표적 중단에 대한 gRNA를 코딩하는 렌티바이러스 라이브러리를 생성하기 위해 게놈 전체 라이브러리 플라스미드 제제를 사용한다.
참고 : 좋은 방법은 실험 일관성을 개선하기 위해 전염에 최적화 된 렌티 바이러스 제제의 단일 배치를 생산하는 것입니다. - 섹션 5.2의 트랜스덕션 프로토콜을 사용하여 소규모 테스트 변환을 수행하여 각 세포주마다 필요한 바이러스 양을 결정하여 30% 트랜스덕션을 달성합니다. 유세포 측정을 사용하여 BFP 형광을 형광 효율의 프록시로 평가합니다.
- HEK293 세포를 트랜스듀싱하기 위해, 30-50 x 106 세포에 미리 정해진 렌티바이러스 제제를 첨가하여 ~4시간 동안 정상 성장 배지에서 배양하였다. 그런 다음 렌티바이러스로 미디어를 제거하고 신선한 성장 매체로 교체하십시오.
- 다른 세포주의 경우, 섹션 5.2.1에서 척추 분석 프로토콜을 사용하지만 더 큰 규모로 총 30-50 x 106 개의 셀이 변환되도록합니다. 이를 위해, 15 mL 원추형 튜브에서 5 x 106 세포/mL의 2 mL을 aliquot하고 지시된 대로 진행한다.
- 부착 된 세포주, 변환 후 puromycin 24 h를 추가하여 변환 된 세포를 선택합니다.
참고: 용량 응답 킬 곡선을 수행하여 푸로마이신 농도를 최적화합니다. 일반적으로 1-10 μg/mL 사이의 농도는 3-5 일 이내에 비 트랜스 듀스 세포를 죽여야합니다. 이 하나 이상의 단일 가이드 RNA (sgRNA)에 의해 변환 된 세포를 선택의 기회를 증가 시킬 수 있기 때문에 puromycin의 높은 농도 사용 하지 마십시오. - 현탁액 세포의 경우, 수확형(즉, BFP 양성) 세포는 세포 선별기를 사용하여 3일 후 트랜스덕트 및 적어도 10 x 106 세포를 포함하는 라이브러리를 생성한다. 일단 BFP를 사용하여 선택되면, 적당한 양의 퓨로마이신을 보충한 매체에서 세포를 성장시다.
참고: 세포 분류를 방해할 수 있는 현탁액 세포 배양물에서 죽은 세포와 이물질을 제거하기가 어렵기 때문에 현탁액 세포주에 대해서만 puromycin을 사용하여 선택을 피하십시오. - 배양 돌연변이 라이브러리 9-16 일 동안 장시간 2-3 일마다 일반 통로로 전이 후.
8. 세포 표면 결합을 위한 유전 검열
- 돌연변이 세포 라이브러리를 200 x g에서 5분 동안 펠렛하고 PBS에서 세포를 다시 중단시켰다.
- 각 튜브에 적어도 50 x 106 셀을 가진 2개의 15 mL 원엽 관으로 세포를 분할합니다.
- 원뿔형 튜브 1개를 200 x g에서 5분 동안 돌리고 상한체를 제거하고 세포 펠릿을 -20°C에서 동결시.합니다. 이것은 제어 채우기이며 나중에 처리됩니다.
- PBS/1% BSA의 10 mL에서 다른 튜브에 펠릿을 다시 일시 중단합니다. 96 웰 플레이트에 음성 대조군으로 세포의 100 μL을 따로 둡니다.
- 원추형 튜브 및 음성 대조군 단백질을 96웰 플레이트에 세포 현탁액에 적절한 preconjugated 재조합 단백질을 첨가한다.
- 부드러운 회전 (6 rpm)와 벤치 탑 로터에 4 °C에서 적어도 1 시간 동안 세포 염색을 수행합니다.
- 5 분 동안 200 x g에서 세포를 펠렛하고 상류를 제거하십시오. 두 번의 세척 단계를 수행한 다음 5 mL의 PBS에서 세포를 다시 일시 중단합니다.
- 세포 클러스터를 제거하기 위해 30 μm 세포 스트레이너를 통해 세포를 변형시. 흐름 선별기를 사용하여 분석합니다.
- BFP+/PE-셀에 대한 게이트에 음의 제어 샘플을 사용합니다.
- 샘플을 정렬하고 BFP+/PE-셀을 수집합니다. 정렬 게이트는 단백질에 대한 세포의 결합에 의존하지만 일반적으로 PE 음성 샘플의 1-5 %가 수집됩니다. 정렬 게이트의 예는 추가 그림 1에제공됩니다.
- 선택한 게이트에서 500,000-1,000,000셀을 수집합니다. 적은 수의 세포를 감안할 때, 손실을 최소화하기 위해 1.5 mL 원심분리관에서 샘플을 수집하는 것이 좋습니다.
- 500 x g에서 5 분 동안 원심 분리하여 분류 된 세포를 펠렛하십시오. 펠릿을 최대 6개월 동안 -20°C에 보관할 수 있습니다.
9. GRNA 농축을 위한 게놈 DNA 추출 및 첫번째 PCR
- 고복잡성 조절 집단에서 게놈 DNA를 추출합니다.
- 대조군이 -20°C에서 동결된 경우, 원엽 튜브를 꺼내 PBS를 첨가한다. 펠릿을 해동하기 위해 얼음에 보관하십시오.
- 50 x 106 세포에서 게놈 DNA를 추출하기 위해 제조업체의 권장 사항을 사용하여 상업용 키트(재료 표참조)를 사용합니다. DNA 농도를 1 mg/mL로 조정합니다.
- 각 샘플에 대해 72 μg의 DNA에 해당하는 PCR에 대한 마스터 믹스를 설정합니다. Aliquot 50 μL 웰 당 36 웰 의 96 웰 PCR 플레이트. 필요한 프라이머 서열은 표 4에나열되어 있습니다. 표 5 및 6의가이드를 사용합니다.
- 6-12개의 대표적인 샘플에서 2%(v)의 아가로즈 젤로 PCR 5 μL을 해결합니다. ~ 250 bp에서 단일 명확한 밴드를 관찰해야한다. 밴드가 희미한 경우 PCR을 추가로 2-3주기 동안 반복합니다.
- 멀티채널 파이펫을 사용하여 각 웰(총 180 μL)에서 5μL의 PCR 제품을 수집하고 상업용 키트에서 900 μL의 바인딩 버퍼가 있는 저장소에 풀링합니다(재료 표참조).
- 상용 PCR 정제 키트를 사용하여 PCR 제품을 정화합니다. 상용 키트로부터 50 μL의 용출 완충액으로 DNA를 용출하고(재료 표참조) DNA 농도를 측정합니다.
- 결합 표현형의 손실을 위해 분류된 견본은 독립적인 클론의 다수로 구성될 확률이 낮습니다. 따라서 72 μg의 DNA로 PCR을 수행 할 필요가 없습니다. 적절한 상용 키트를 사용하여 DNA를 분리합니다(재료 표참조). 100 ng/μL DNA로 전에 기술된 프로토콜(섹션 9.1.3)을 사용하여 3-4개의 PCR 반응을 설정합니다. 정렬된 세포 수가 100,000 미만이면 게놈 DNA 제제 대신 세포 용해를 사용한다.
- Aliquot 약 10,000 세포 /잘 96 잘 PCR 플레이트에.
- 접시에 세포를 펠렛하고 조심스럽게 상류물의 대부분을 제거합니다. 펠릿이 표시되지 않습니다.
- 각 우물에 25 μL의 물을 넣고 샘플을 95°C에서 10분 동안 가열합니다.
- 5 μL 의 2 mg/mL 갓 희석된 단백질나아제 K를 각각 1시간 동안 잘 넣고 56°C에서 배양합니다. 그런 다음 95°C에서 10분 동안 샘플을 가열하여 단백질Ase K를 비활성화합니다.
- PCR 반응당 세포 용해수분 혼합물 10 μL을 사용하십시오. 용해제는 24 시간 이내에 사용해야합니다.
10. 인덱스 바코드 및 시퀀싱을 위한 두 번째 PCR 라운드
- 첫 번째 라운드 PCR에서 40 pg/μL로 제품을 희석합니다.
- 샘플당 하나의 PCR을 설정합니다(표 7 및 8에제공된 가이드 사용). 고충실도 폴리머라제의 사용은 sgRNA 증폭 동안 중합효소에 의해 유입되는 오류를 최소화하는 데 중요하다.
- 아가로즈 젤을 2% (v/v)로 5 μL의 PCR 제품을 해결하십시오. ~ 330 bps에서 단일 명확한 밴드를 관찰해야한다.
- 파라마그네틱 비드를 사용하여 PCR 제품을 정화하여 31.5 μL의 (총 부피 0.7배)를 PCR 제품에 재팽창구슬을 추가하고, 잘 혼합하고, RT에서 5분 동안 배양합니다.
- 튜브를 마그네틱 랙에 3분 동안 놓습니다. 구슬은 플레이트의 측면에 캡처해야하며 용액은 명확해야합니다. 조심스럽게 제거하고 상급을 폐기.
- 튜브에 80% 갓 준비된 에탄올 150 μl을 넣습니다. 30 초 동안 배양 한 다음 조심스럽게 제거하고 상한을 버립니다.
- 13.6단계를 반복하고, 이번에는 180 μL로 반복한다. 그런 다음 5 분 동안 구슬을 건조시고 있습니다.
- 자석에서 튜브를 분리합니다. 비드에서 35 μL의 멸균 EB 완충제에 DNA 표적을 용출합니다. 3 분 동안 배양 한 다음 튜브를 자기 랙에 3 분 동안 다시 넣습니다.
- 용출된 PCR 제품을 함유하는 상급물의 약 30 μL을 깨끗한 튜브로 옮김.
- 차세대 시퀀싱 플랫폼에서 샘플을 시퀀싱합니다. HumanV1 gRNA 라이브러리의 경우, 표 4에 나열된 맞춤형 프라이머를 사용하여 19 bp를 시퀀스한다.
11. 수용체 및 관련 경로를 확인하기 위한 생물정보학 분석
- MAGeCK의 개수 함수를 사용하여 정렬및 정렬되지 않은 모집단에서 참조 라이브러리로 시퀀스를 매핑합니다. 함수는 원시 개수 파일을 생성합니다(보충표 1).
참고 : MAGeCK의 설치 및 MAGeCK 내에서 다른 기능의 사용에 대한 자세한 지침은 왕 등20에의해 이전에 게시 된 프로토콜에 설명되어 있습니다. - 화면에 사용된 제어 라이브러리의 기술 표준을 확인합니다.
- 중간값은 원시 카운트를 정규화하고 R21 또는 동등한 소프트웨어의 ggplot2 패키지를 사용하여 플라스미드에서 카운트의 경험적 누적 밀도 함수 플롯을 플롯하고 정렬되지 않은 샘플을 제어합니다(그림5A).
- 플라스미드 모집단의 개수를 "제어"로 사용하고 정렬되지 않은 제어 샘플의 개수를 "테스트" 샘플로 사용하여 MAGeCK의 -test 함수를 실행합니다. 이 함수는 유전자 요약 파일을산출한다(보충 표 1).
- 유전자 요약 파일을 열고 이전에 분류된 필수 및 불필요한 유전자에 대한 로그 폴드변경(neg@lfc column)의 분포를그립니다(그림 5B).
- 현저하게 고갈된유전자(neg|fdr & 0.05)를 선택하고R(그림 5C)의 농축기23 패키지 또는 이에 상응하는 경로 농축 패키지를 사용하여 경로 농축 분석을 수행합니다.
- 기본 설정으로 MAGeCK의 -test 함수를 실행합니다. 분류되지 않은 제어 샘플의 원시 개수를"제어"로사용하고 분석을 수행할 때 정렬된 샘플에서"처리"로계산합니다.
- MAGeCK에서 생성된 유전자 요약 파일을 열고 pos|순위 열의 순위를 오름차순으로 지정합니다. FDR (pos@fdr 열) < 0.05를 적중 식별을 위한 컷오프로 사용합니다. 수용 체는 일반적으로 높은 순위, 종종 첫 번째 위치에.
- R 또는 이에 상응하는소프트웨어(그림5D)에서양수선택(pos|score)에대한 견고한 순위 알고리즘(RRA) 점수를 플로팅합니다.
- 유전자 히트를 선택하고 농축 된 경로를 식별하기 위해 R의 농축 기 패키지 또는 동등한 경로 농축 패키지를 사용하여 경로 농축 분석을 수행합니다.
결과
NCI-SNU-1 및 HEK293 세포에서 각각 수행된 인간 TNFSF9 및 P. falciparum RH5의 결합 파트너의 식별을 위한 두 가지 대표적인 게놈 스케일 녹아웃 스크린으로부터의 시퀀싱 데이터가 각각 제공된다(보충표 1). RH5의 결합 거동은 헤파란 설페이트 및 그것의 알려진 수용체 BSG24 (그림 3C)에의해 영향을 받았고, 반면 TNFRSF9은 특히 알려진 수용체 TNFSF9에 결합하고 수용성 헤파린과의 사전 입양에 결합을 잃지 않았다. 도3B에서 단백질 3은 TNFRSF9를 나타낸다.
두 세포주 모두에 대해, 3일 후(9, 14, 및 16일 후) 대조군 돌연변이 라이브러리에서 gRNAs의 분포도제공된다(보충표 1). gRNA 분포는 실험 과정 전반에 걸쳐 라이브러리 복잡성이 유지되었다는 것을밝혔다(도 5A). TNFSF9에 대한 리간드의 식별을 위한 유전자 스크린은 14일째에 수행되었고, 반면 RH5에 대한 9일째 후 환전을 수행했다. 스크린의 기술적 품질은 필수유전자22의 기준 세트에 대한 분포와 비교하여 불필요한 유전자의 기준 세트를 표적화하는 gRNAs의 관찰된 접이식 변화의 분포를 조사함으로써 평가되었다(도5B). 또한, 경로 수준 농축은 또한 제어 샘플을 원래 플라스미드 라이브러리와 비교할 때 예상되는 필수 경로가 "드롭 아웃" 집단에서 확인되고 크게 풍부해진 것으로 나타났습니다. 14일식 NCI-SNU-1 샘플의 예는 그림5C에도시되어 있습니다.
MAGeCK의 -test 함수를 사용하여 대조군에서 gRNAs의 분포(MAGeCK로부터의 유전자 요약 출력에 대한 보충 표 1 참조)를 사용하여 자형질 스크린으로부터 수용체를 식별하는데 사용되었다. 유전자 수준 분석에서 MAGeCK에 의해 보고된 변형된 RRA 점수는 p 값에 의해 순위가 매겨진 유전자에 대하여 플롯된다. MAGeCK의 RRA 점수는 gRNA가 예상보다 일관되게 높은 순위를 차지하는 척도를 제공합니다. TNFRSF9의 화면에서, 최고 히트는 TNFRSF9의 알려진 결합 파트너인 TNFSF9(그림5D)이었다. 또한, TP53 경로와 관련된 다수의 유전자도 확인되었다. RH5의 경우, 공지된수용체(BSG)및 황산 GAGs(SLC35B2)의SLC35B2제조에 필요한 유전자 외에, 추가의유전자(SLC16A1)도확인되었다(도 5E). SLC16A1은 BSG를세포(25)의표면으로 인신매매하는 데 필요한 샤페론이다. 함께, 이러한 결과는 기능적인 형태로 세포의 표면에 발현되는 수용체 및 그 수용체에 필요한 세포 성분을 직접 상호 작용하는 수용체 및 식별하는 스크린의 능력을 입증한다.
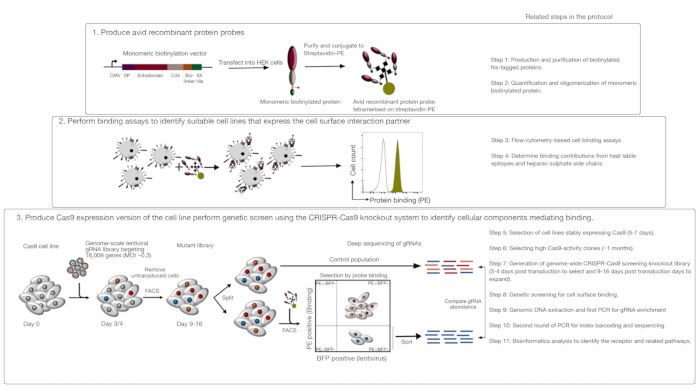
도 1: 세포 표면 수용체를 확인하기 위한 유전자 스크리닝 접근법의 개요. 이 분석은 세 가지 주요 단계로 구성됩니다: 첫째, 세포 표면 수용체의 ectodomain을 나타내는 재조합 단백질은 HEK293 세포와 같은 구조적으로 중요한 번역 후 변형을 추가할 수 있는 세포주에서 발현된다. 단조 단백질 ectodomains는 그들의 결합 열력을 증가시키기 위하여 스트렙타비딘-PE에 공액에 의해 올리고머화됩니다. 둘째, 이러한 열렬한 프로브는 음성 대조단백질(검은색)에 비해 PE 형광(녹색)의 눈에 띄는 변화에 의해 지시된 세포주상에 밝은 염색이 세포 표면 결합 파트너의 존재를 입증하는 세포 결합 분석에서 사용된다. 셋째, 수용체 양성 Cas9 발현 세포주를 선택시키고 대부분의 단백질 코딩 유전자를 표적화하는 gRNAs를 이용한 게놈 스케일 스크리닝이 수행된다. 돌연변이 라이브러리를 생성하는 동안, 각 세포가 특정 녹아웃에 기인하도록 각 세포가 단일 gRNA를 수신하도록 보장하는 푸아송 분포 확률에 기초한 30% 형편 전환 효율을 사용하는 것이 일반적이다. 형질전환된 세포에 의해 발현된 BFP 마커는 FACS를 사용하여 gRNAs를 함유하는 세포를 선택하는데 사용된다. Phenotypic 스크린은 9-16 일 후에 수행됩니다. 화면의 날에, 총 돌연변이 세포 집단은 2로 나뉩니다. 절반은 대조군으로 유지되고 다른 절반은 재조합 단백질 결합을 위해 선택된다. 재조합 단백질을 더 이상 결합할 수 없는 돌연변이 라이브러리로부터의 세포는 FACS를 사용하여 분류되고 대조군 집단에서 gRNA의 농축은 표지된 열렬한 프로브의 세포 표면 결합에 필요한 유전자를 식별하는데 사용된다. 상당한 시간이 필요한 프로토콜의 단계가 표시됩니다. 이 그림은 샤르마 외19에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
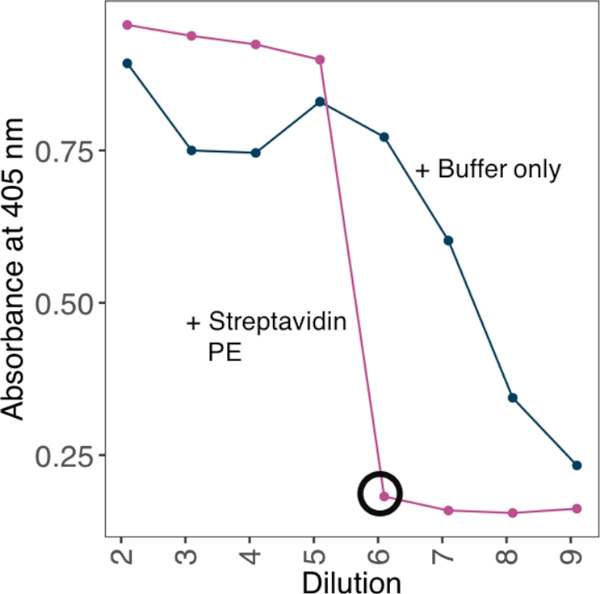
그림 2: ELISA 기반 방법을 사용하여 스트렙타비딘-PE에 대한 생체 단백질의 비율을 확립합니다. 생체 면역 단백질로부터 열렬한 프로브를 생성하는 데 사용되는 스트렙타비딘-PE 컨쥬게이션 전략의 예. 생물성 단량체의 희석 시리즈는 스트렙타비딘의 고정 농도에 대해 배양되었다. 과잉 생체 티니제 단량체가 검출될 수 없는 최소 희석은 ELISA에 의해 결정되었다. ELISA는 스트렙타비딘-PE 10 ng로 다양한 단백질 희석제를 사전 인큐베이팅하거나 없이 수행하였다. 스트렙타비딘-PE의 존재에서, 신호가 확인되지 않은 최소 희석(원형 검정)과 포화에 필요한 단백질의 양은 4 μg/mL 스트렙타비딘-PE를 가진 10x 스톡 용액을 생성하도록 계산되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
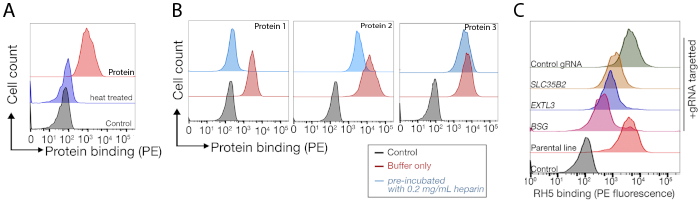
도 3: 세포주단백질의 대표적인 결합체. (a)세포주에 결합하는 단백질은 대조군 샘플에 비해 세포 관련 형광이 뚜렷하게 증가하였다. 재조합 단백질의 열처리(10분 동안 80°C)는 모든 결합을 다시 음성 대조군으로 폐지하여, 결합 거동이 올바르게 접힌 단백질에 의존한다는 것을 입증하였다. (B)세포 표면에 단백질 결합 행동의 다른 클래스; GGS에 의존합니다. 왼쪽에서 오른쪽으로, 단백질은 세 가지 유형으로 분류 될 수있다: 단백질 유형 1 만 HS에 부속. 이 단백질은 0.2 mg/mL 이상의 헤파린 농도로 사전 인큐베이션 후 결합을 잃습니다. 단백질 타입 2는 특정 수용체 이외에 HS에 묶습니다. 이 단백질은 사전 차단 실험에서 부분 결합을 잃습니다. 단백질 타입 3은 HS를 결합하지 않습니다. 이 단백질은 부모 라인에 비해 결합을 잃지 않습니다. (C)HS 및 특정 수용체에 첨가제 방식으로 결합하는 단백질(즉, RH5)의 예. HS 합성에 필요한 수용체(즉, BSG) 또는 효소(예를 들어, SLC35B2, EXTL3)를 표적화하는 것은 대조군을 기준으로 세포에 대한 RH5의 결합을 부분적으로 감소시킨다. 이러한 실험에서 변환된 폴리클로날 라인을 사용하여 바인딩 동작을 설정할 수 있습니다. 이 그림은 샤르마 외19에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
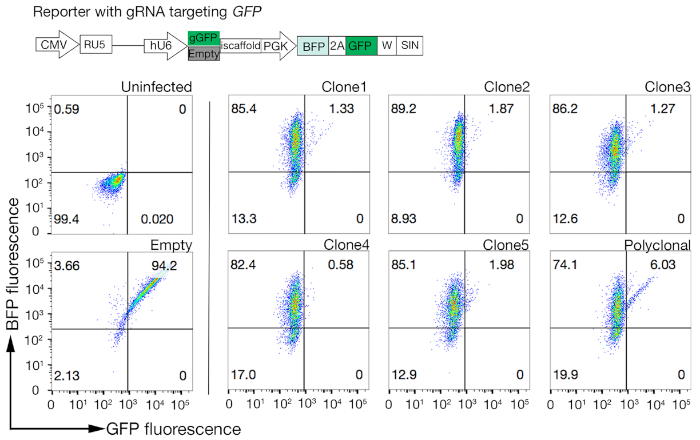
그림 4: Cas9 활성이 높은 클론 세포주 선택. NCI-SNU-1 세포주 둘 다의 폴리클로날 및 복제 된 라인의 게놈 편집 효율은 GFP-BFP 리포터 시스템을 사용하여 평가되었으며, 이 시스템에서 세포주는 GRNA 표적화 플라스미드 인코딩 된 GFP 또는 없이 바이러스로 변환되었습니다 (즉, "빈"). 회로도가 묘사됩니다. 유세포측정을 사용하여 형질전환 후 BFP 및 GFP 발현을 모두 테스트하고 감염되지 않은 대조군과 비교하였습니다. GFP 발현은 Cas9 활성에 대한 프록시로서 사용되었던 반면, BFP 발현은 형질전환 세포를 표시하였다. 감염되지 않은 및 빈 감염된 세포에 대한 프로필은 모든 클론에 대해 유사하게 보였습니다. 대표 프로필은 왼쪽 패널에 표시됩니다. NCI-SNU-1 세포주 중 5개의 클론은 모두 폴리클로날 라인(오른쪽 패널)에 비해 GFP의 손실이 더 높았으며, 클론 4는 가장 낮은 내화 성 모집단으로 가장 높은 효율을 보였다. 이 그림은 샤르마 외19에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
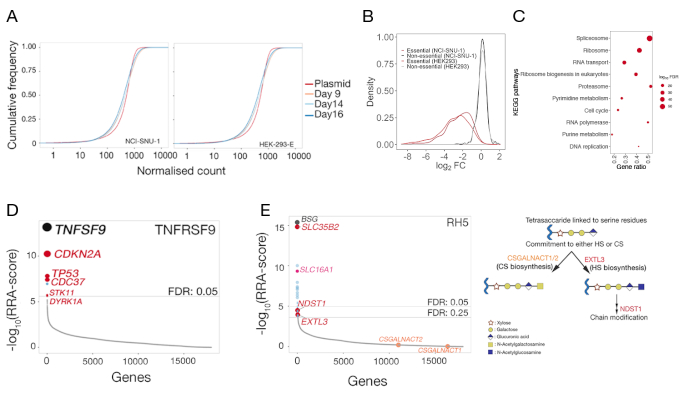
도 5: 세포 표면 결합 파트너의 식별을 위한 유전 스크린으로부터의 대표적인 결과. (a)누적 분포 함수플롯은 9일, 14일 및 16일째에 혈-293-E 및 NCI-SNU-1 세포의 돌연변이 라이브러리와 플라스미드 라이브러리의 gRNA 풍부도를 비교한다. 지정된 수에 대해 누적 밀도 함수는 해당 임계값 미만인 데이터 요소의 백분율을 보고합니다. 원래 플라스미드 집단에 비해 돌연변이 세포 집단의 작은 변화는 플라스미드 라이브러리에 비해 gRNAs의 서브세트에서 고갈을 나타낸다. (b)HEK293 및 NCI-SNU-1 세포주에서 이전에 필수적(적색) 또는 필수적이지 않은(검정)으로 분류된 유전자의 로그 폴드 변화의 분포. 필수 유전자에 대한 부정적인 배 변경을 향해 왼쪽으로 이동하는 반면, ~ 0을 중심으로 비필수 유전자에 대한 접이식 변화의 분포. (C)NCI-SNU-1 돌연변이 조절 집단에서 고갈된 유전자의 경로가 현저히 풍부해진 14일 후 예상되는 알려진 세포 필수 경로가 확인되었다. (D)TNFRSF9 프로브를 결합하는 능력을 상실한 정렬된 세포에서 농축된 유전자에 대한 견고한 랭크 알고리즘(RRA)-스코어. 유전자는 RRA 점수에 따라 순위가 매겨졌습니다. 공지된 상호작용 파트너 TNFSF9 및 TP53 통로와 관련된 유전자(빨간색으로 표지됨)가 화면에서 확인되었다. (e)HEK293 세포(좌측 패널)에 대한 RH5 결합에 필요한 gRNA 농축 분석으로부터 확인된 유전자에 대한 랭크 정렬 RRA 점수. SLC35B2 및 SLC16A1은 5%의 거짓 발견 률(FDR) 임계값 내에서 확인되었다. HS 생합성 경로(즉, EXTL3 및 NDST1)에서2개의 추가 유전자가 FDR 25%내에서 확인되었다. 관련 유전자를 가진 일반적인 GAG 생합성 경로를 상응단계(패널 2)에 매핑하는 개그성합성 경로를 도표화하는 회로도. 콘드로이틴 설페이트 생물발생에 대한 헌신에 필요한 유전자(즉, CSGALNACT1/2)는화면에서 확인되지 않았다. 이 그림은 샤르마 외19에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 플라스미드 이름 | 플라스 미드 # | 사용 |
| 단백질 발현 구조: CD200RCD4d3+4-바이오 링커-그의 | 애드진: 36153 | CD4d3+4, 비오틴 및 6-그의 태그를 가진 재조합 단백질의 생산. |
| pMD2.G | 애드진: 12259 | VSV-G 봉투 플라스미드 를 표현; 렌티 바이러스의 생산 |
| psPAX2 | 애드진: 12260 | 렌티 바이러스 포장 플라스미드, 렌티 바이러스의 생산 |
| Cas9-construct: pKLV2-EF1a-Cas9Bsd-W | 애드진: 68343 | Cas9 라인을 구성적으로 표현하는 생산 |
| gRNA 발현 구성: pKLV2-U6gRNA5(BbsI)-PGKpuro2ABFP-W | 애드진: 67974 | 개선된 스캐폴드 및 푸로/BFP 마커를 가진 CRISPR gRNA 발현 벡터 |
| 인간 개선 된 게놈 전체 녹아웃 CRISPR 라이브러리 | 애드진: 67989 | 렌티바이러스에 사용하도록 설계된 18,010개의 인간 유전자에 대한 gRNA 라이브러리. |
| GFP-BFP 구성: pKLV2-U6gRNA5(gGFP)-PGKBFP2AGFP-W | 애드진: 67980 | BFP와 GFP와 Cas9 활동 기자. |
| 빈 구성: pKLV2-U6gRNA5(빈)-PGKBFP2AGFP-W | 애드진: 67979 | BFP 및 GFP를 가진 Cas9 활동 리포터 (제어). |
표 1: 이 접근법에 사용되는 플라스미드.
| 버퍼 이름 | 구성 요소 |
| HBS (10X) | 1.5 M NaCl 및 밀리크 물에서 200 mM HEPES, pH 7.4로 조정 |
| PBS (10X) | 80g NaCl, 2 g KCl, 14.4 g Na2HPO4 및 2.4 g KH2PO4 밀리크 물, pH 7.4로 조정 |
| 나트륨 인산염 버퍼 (80mM 재고) | 7.1 g Na2HPO4.2H2O, 5.55 g NaH2PO4,pH 7.4로 조정 |
| 그의 정제 바인딩 버퍼 | 20 mM 나트륨 인산염 버퍼, 0.5 M NaCl 및 20 mM 이미다졸, pH 7.4로 조정 |
| 그의 정제 용출 버퍼 | 20 mM 나트륨 인산염 버퍼, 0.5M NaCl 및 400 mM 이미다졸, pH 7.4로 조정 |
| 디에탄올아민 완충제 | 10% 디에탄올아민과 밀리Q 물에서 0.5 mM MgCl2, pH 9.2로 조정: |
| D10 | DMEM, 1% 페니실린-스트렙토마이신(100 단위/mL) 및 10% 열 불활성화 FBS |
표 2: 이 연구에 필요한 버퍼입니다.
| 구성 요소 | 10cm 접시 | 6웰 플레이트 |
| 293FT 셀 | 70~80% 동류 | 70~80% 동류 |
| 형질감염 호환 미디어(Opti-MEM) (5.1.2단계) | 3 mL | 500 μL |
| 형질감염 호환 미디어(Opti-MEM) (5.1.4단계) | 5 mL | 2 mL |
| 렌티바이러스 전사 벡터 | 3 μg | 0.5 μg |
| psPax2 (표 1 참조) | 7.4 μg | 1.2 μg |
| pMD2.G (표 1 참조) | 1.6 μg | 0.25 μg |
| 플러스 시약 | 12 μL | 2 μL |
| 리포펙타민 LTX | 36 μL | 6 μL |
| D10(7.1.7단계) | 5 mL | 1.5 mL |
| D10(7.1.8 및 7.1.10 단계) | 8mL | 2 mL |
표 3: 렌티바이러스 포장 혼합물을 위한 시약의 양 및 부피.
표 4: gRNA 및 NGS 증폭을 위한 프라이머 서열. 이 파일을 보려면 여기를 클릭하십시오 (다운로드 오른쪽 버튼을 클릭하십시오).
| 시약 | 반응당 부피 | 마스터 믹스 (x38) |
| Q5 핫 스타트 하이-피델리티 2x | 25 μL | 950 μL |
| 프라이머 (L1 / U1) 믹스 (각 10 μM) | 1 μL | 38 μL |
| 게놈 DNA (1 mg /mL) | 2 μL | 72 μL |
| H2O | 22 μL | 1100 μL |
| 총 | 50 μL | 1900 μL |
표 5: 고복잡성 샘플로부터 gRNAs의 증폭을 위한 PCR.
| 사이클 번호 | 변성 | 어 닐 링 | 확장 |
| 1 | 98 °C, 30대 | ||
| 2-24 | 98 °C, 10s | 61 °C, 15s | 72 °C, 20대 |
| 25 | 72 °C, 2 분 |
표 6: 첫 번째 PCR에 대한 PCR 조건.
| 시약 | 반응당 부피 |
| 카파 하이파이 핫스타트 레디믹스 | 25 μL |
| 프라이머 (PE1.0 / 인덱스 프라이머) 혼합 (5 μM 각) | 2μL |
| 최초의 PCR 제품(40 pg/μL) | 5 μL |
| H2O | 18 μL |
| 총 | 50 μL |
표 7: 유전자 스크린으로부터 sgRNAs의 인덱스 태깅에 대한 PCR.
| 사이클 번호 | 변성 | 어 닐 링 | 확장 |
| 1 | 98 °C, 30대 | ||
| 2-15 | 98 °C, 10s | 66 °C, 15s | 72 °C, 20대 |
| 16 | 72 °C, 5 분 |
표 8: 두 번째 PCR에 대한 PCR 조건.
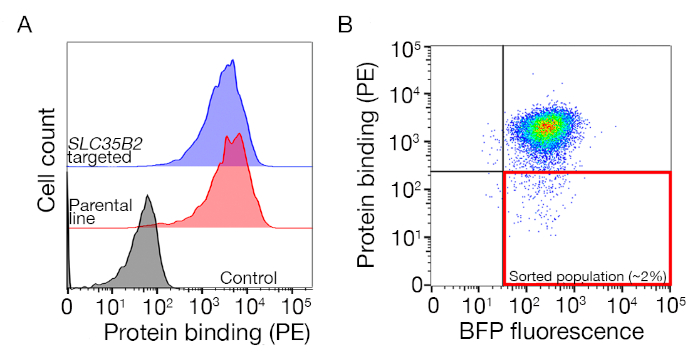
보조 그림 S1: 구속력이 없는 모집단을 정렬하기 위한 게이트 그리기 가이드입니다. (a)스크리닝을 위한 이상적인 단백질 후보는 대조군 과 비교하여 결합 인구의 명확한 이동을 가져야 하며, 결합은 HS 생합성을 위한 기계가 결여된 세포에 유지되어야 한다. 헤파린 차단 실험은 SLC35B2 표적 세포주에서 의시험 대신에 사용될 수 있다. (b)단백질 외토도메인으로부터 표면 염색이 결여된 세포는 렌티바이러스 형질전환으로부터 BFP 형광을 발현하지만 수집하였다. 표시된 세포는 GABBR222에대한 수용체의 식별을 위한 화면에서 이다. 이 그림은 샤르마 외19에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
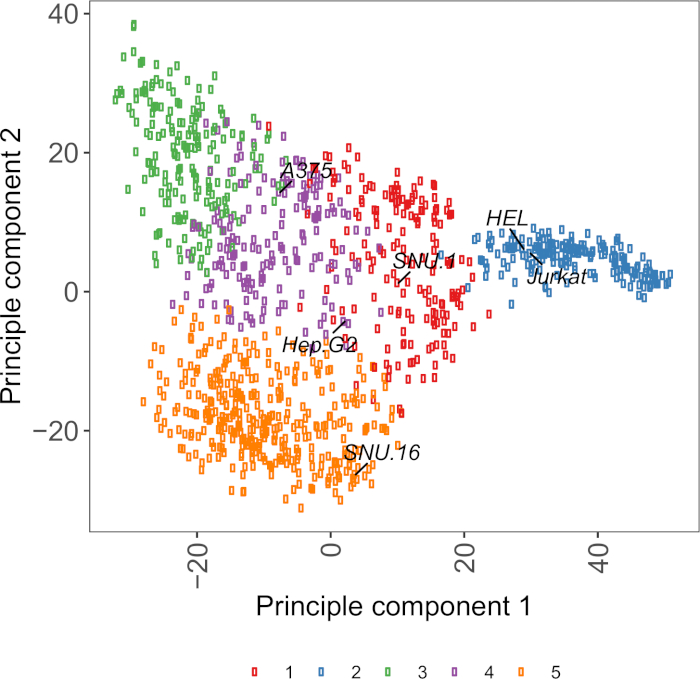
보충 도 면 S2: 1,000개 이상의 암 세포주로부터의 RNA-seq 데이터를 이용한 세포 표면 당단백질 전사체 기반 PCA 플롯. 세포모델패스포트(27)로부터의 세포주들은 ~1,500개의 세포 표면 당단백질의 FPKM 값에 따라 K-평균 군집을 사용하여 군집되었다. 각 클러스터의 대표 세포주레이블이 지정됩니다. 클러스터 5는 조혈 기원의 세포주들로 전적으로 구성되었다(보충표 2참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
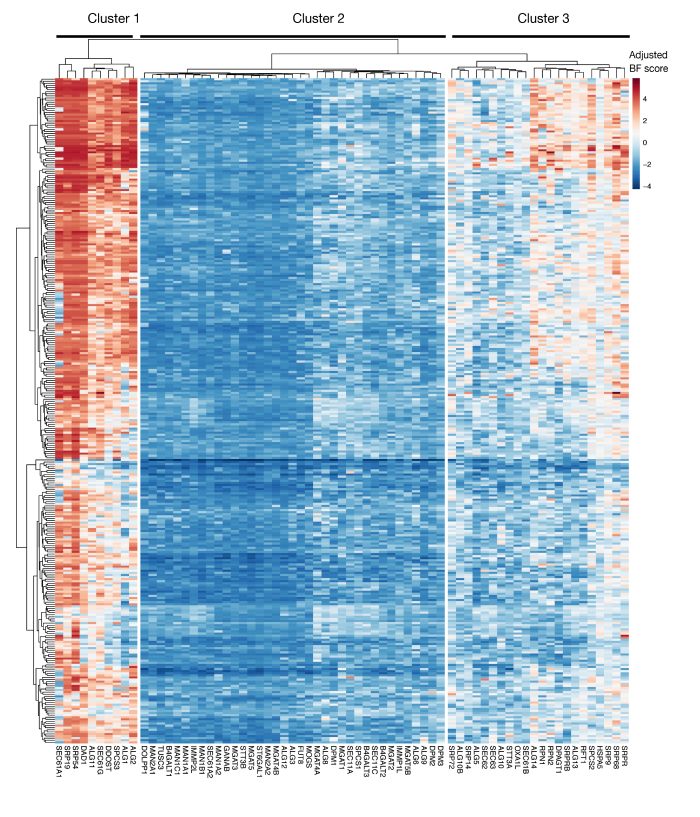
보충 도면 S3: 프로젝트 점수에서 KEGG-어노션 단백질 수출 및 N-연결된 글리코실화 유전자에 대한 필수성 점수. ~ 330 세포주 (열, 표지되지 않음)에 대한 조정 된 Bayes- 필수 점수는 단백질 수출 및 N 연결된 글리코실화 경로 (X 축)의 유전자에 대해 플롯됩니다. 0보다 높은 점수는 원래 플라스미드 라이브러리에 비해 돌연변이 집단에서 상당한 고갈을 나타낸다. 유전자는 세포주에서 서로 다른 수준의 본질성을 나타내는 3개의 별개의 군집으로 나눌 수 있습니다. 이 클러스터링은 정렬 일을 결정하는 데 사용할 수 있습니다. 스크린이 늦은 시점(16일째)에 수행되는 경우, 세포(클러스터 1 및 3)에 필수적인 것으로 알려진 유전자가 식별되지 않을 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1: 대표 유전 스크린과 관련된 gene_summary 파일을 생성한 MAGeCK 소프트웨어에 대한 원시 카운트 파일. 이 파일을 보려면 여기를 클릭하십시오 (다운로드 오른쪽 버튼을 클릭하십시오).
보충 표 2: 세포 표면 수용체의 발현에 따른 세포주의 군집화. 이 파일을 보려면 여기를 클릭하십시오 (다운로드 오른쪽 버튼을 클릭하십시오).
토론
세포 인식에 관여하는 세포 성분을 코딩하는 유전자를 식별하기 위한 CRISPR 기반 스크리닝 전략이 설명되어 있습니다. CRISPR 활성화를 이용한 유사한 접근법은 또한 큰 단백질라이브러리(26)를생성할 필요 없이 재조합 단백질의 직접 상호 작용하는 수용체를 식별하는 유전적 대안을 제공한다. 그러나, 이 접근법의 한 가지 주요 장점은 세포상에 기본적으로 표시되는 표면 분자에 의해 매개되는 상호작용에 적용 가능하고 수용체의 과발현에 의존하지 않으며, 이는 수용체의 결합 열성에 영향을 미칠 수 있다는 것이다. 다른 방법과는 달리, 따라서, 이 기술은 수용체의 생화학적 성질 또는 세포 생물학에 관하여 아무 가정도 하지 않으며 아주 큰 단백질과 같은 생화확적인 접근을 사용하여 공부하기 일반적으로 어려운 단백질에 의해 중재된 상호 작용을 공부하는 기회를 제공합니다, 또는 그 막을 여러 번 통과하거나 그밖 단백질을 가진 복합체를 형성하고, 글리칸, 글리콜리피및 피피등 단백질 이외에 분자. 방법의 게놈 스케일 특성을 감안할 때, 이 접근법은 또한 수용체뿐만 아니라 결합 이벤트에 필요한 추가세포 성분을 식별할 뿐만 아니라, 수용체의 세포 생물학에 대한 통찰력을 제공한다는 장점이 있다.
고아 단백질의 수용체를 확인하기 위하여 그것을 사용할 때 이 방법의 중요한 한계의 한은 단백질에 묶는 세포줄을 첫째로 확인하기 위하여 처음 필요조건입니다. 이는 항상 쉬운 것은 아니며 유전적 스크린에도 허용되는 결합 표현형을 표시하는 세포주를 식별하는 것은 이러한 분석을 전개하기 위한 시간 제한 단계가 될 수 있다. 몇몇 세포주는 그 외 보다는 더 많은 단백질에 묶는 경향이 있습니다. 이것은 HS를 묶는 단백질을 위해 특히 관련이 있습니다, 이 단백질은 네이티브 결합 문맥에 관계없이 HS 측사슬을 표시하는 어떤 세포주든지에 결합하는 경향이 있기 때문에. 추가적으로, 우리는 세포주에서 신데칸(즉, HS를 포함하는 프로테오글리칸)의 상향 조절이 HS 결합 단백질26의증가된 결합으로 이어진다는 것을 관찰하였다. 이것은 스크리닝을 위한 세포주 선택 시 고려할 요인이 될 수 있다. 그러나, 또한 주목해야 할 점은 HS의 첨가제 결합이 특정 수용체에 대한 결합을 방해하지 않는다는 것입니다. 이는 결합이 관찰되는 경우, 이러한 분석에서 HS에 의해 매개된 결합이 공동의존적(19)이아닌 첨가제이기 때문에 HS에 의해서만 매개될 수 있음을 의미한다. 이러한 시나리오에서, 설명된 헤파린 차단 접근법은 전체 유전자 스크린을 수행할 필요 없이 이러한 동작을 식별할 수 있다.
세포주 선택에 유용한 자원은 ~1,000암 세포주27에대한 유전체학, 전사학 및 배양 상태 정보를 포함하는 세포 모델 패스포트이다. 생물학적 맥락에 따라, 세포는 그들의 발현 단면도에 근거를 둔 선택될 수 있다. 세포주의 선택을 돕기 위해, 우리는 ~1,500 미리 된 인간 세포 표면 당단백질28의 발현에 따라 세포 모델 여권에서 ~ 1,000 세포주를 클러스터화하였다(보충 도 2;성장 조건과 함께 각 세포주에 대한 클러스터 정보는 보충 표 2에제공된다). 알 수없는 기능을 가진 단백질의 결합을 테스트 할 때, 수용체의 넓은 범위를 커버의 기회를 증가시키기 위해 각 클러스터에서 대표 세포주의 패널을 선택하는 것이 유용하다. 선택의 여지가 주어지면 배양하기 쉽고 변환하기 쉬운 세포주를 선택하는 것이 좋습니다. 이들 세포주는 게놈 스케일 스크리닝에 사용될 것이기 때문에, 그들은 다량으로 쉽게 성장될 수 있고 렌티바이러스 전달에 허용되는 것이 바람직하며, 이는 이후 단계에서 CRISPR 기반 유전자 스크리닝을 위한 sgRNA의 전달을 위한 가장 일반적으로 이용가능한 방법이기 때문이다.
일반적으로 표현형 선택은 단일 방식으로 수행됩니다. 그러나, 이것은 대조군과 비교하여 염색된 세포 집단의 밝기에 의해 결정된다. 선택의 반복적인 라운드는 원하는 표현형의 신호 대 잡음 비율이 낮은 시나리오에 채택될 수 있고, 또는 스크린의 목적은 강한 표현형이 있는 돌연변이를 확인하는 것입니다. FACS 기반 스크린에 대한 반복선택 접근법을 사용하는 경우, 선별기의 순수한 힘으로 인해 선별 과정이 세포 사멸을 유발할 수 있다는 점을 고려하는 것이 중요합니다. 따라서 수집된 모든 셀이 다음 정렬 라운드에서 나타나지는 않습니다.
라이브러리 복잡성은 성공적인 유전 스크린을 수행하는 데 매우 중요한 요소이며, 특히 부정적인 선택 스크린의 경우 이러한 고갈 의 정도는 시작 라이브러리에 있는 것과 결과를 비교하여 결정될 수 있기 때문입니다. 네거티브 선택 화면의 경우 500-1,000 x 복잡성의 라이브러리를 유지하는 것이 일반적입니다. 긍정적 인 선택 화면은, 그러나, 라이브러리 크기에 더 강력한, 이러한 화면에서 돌연변이의 작은 수는 특정 표현형에 대해 선택 될 것으로 예상되기 때문에. 따라서 여기에 설명된 양수 선택 화면에서 라이브러리 크기는 화면 품질을 손상시키지 않으면서 50-100배 복잡성으로 감소할 수 있습니다. 또한, 이들 스크린에서 주어진 세포주들에 대해 당일 에 정렬된 모든 샘플에 대해 "일반 대조군"으로서 주어진 세포주들에 대한 제어 라이브러리를 사용할 수도 있다. 이렇게 하면 생성 및 순서를 설정해야 하는 컨트롤 라이브러리의 수가 줄어듭니다.
이 접근을 사용하기 위한 또 다른 중요한 고려 사항은 시험관 내 세포 성장에 필수적인 유전자를 확인하는 기능 상실 스크린의 한계입니다. 스크린의 타이밍은 이 점에서 결정적입니다, 돌연변이 세포가 배양에서 더 이상 유지되기 때문에, 필수 유전자에 있는 돌연변이를 가진 세포가 불가능하게 되고 돌연변이 도서관에서 더 이상 표현되지 않는 확률이 높습니다. 300개 이상의 세포주에서 프로젝트 스코어 이니셔티브의 일환으로 수행된 최근 유전자 스크린은 KEGG 에이버레이션된 단백질 분비 및 N-글리코실화 경로내의 여러 유전자가 종종 다수의 세포주(보충도 3)에 필수적인 것으로 확인됨을보여준다(보충도 3)29. 이는 세포 인식 과정의 맥락에서 증식 및 생존에 필요한 유전자의 효과를 조사할 경우 스크린을 설계할 때 고려될 수 있다. 이 경우 초기 시점(예: 9일째 후 환전)에서 화면을 수행하는 것이 일반적으로 적절합니다. 그러나, 접근이 일반적인 세포 통로 보다는 오히려 강한 크기 효력을 가진 몇몇 표적을 확인하기 위하여 이용되는 경우에, 나중에 시점 (예를 들면, 15-16 사후 변환)에 스크린을 능력을 발휘하는 것이 적절할 지도 모릅니다.
스크리닝의 결과는 매우 강력합니다. 과거에 수행된 8개의 재조합 단백질 결합 스크린에서, 세포 표면 수용체는 모든 경우에19에서최고 히트였다. 상호 작용 파트너를 확인하기 위하여 이 접근을 사용하는 경우에, 사람은 그러므로 수용체 및 표면에 그것의 프리젠테이션에 기여하는 요인이 높은 통계적인 신뢰로 확인될 것을 기대해야 한다. 스크린이 수행되고 히트가 단일 gRNA 녹아웃을 사용하여 검증되면, 추가 후속은 표면 플라스몬 공명을 사용하여 정제 된 단백질의 직접 포화 결합과 같은 AVEXIS4와 같은 기존의 생화학 적 방법을 사용하여 수행 할 수 있습니다. 여기서 기재된 접근법은 수용성 재조합 결합 프로브를 생성할 수 있는 모든 단백질에 적용가능하다.
요약하면, 이것은 세포 표면 단백질에 의해 매개되는 상호 작용을 확인하기 위한 게놈 규모 CRISPR 녹아웃 접근법입니다. 이 방법은 일반적으로 유기체의 자신의 세포 (예를 들어, 신경 및 면역 학적 인식) 뿐만 아니라 숙주 세포와 병원체 단백질 사이를 포함하여 다양한 생물학적 맥락에서 세포 표면 인식에 필요한 세포 경로를 식별하기 위해 적용 가능하다. 이 방법은 수용체 식별을 위해 설계된 생화학적 접근법에 대한 유전적 대안을 제공하며, 수용체의 생화학적 성질 또는 세포 생물학에 관한 어떠한 사전 가정을 필요로 하지 않기 때문에 완전히 예상치 못한 발견을 할 수 있는 큰 잠재력을 가지고 있다.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 웰컴 트러스트 보조금 번호 206194에 의해 지원되었다 GJW에 수여. 우리는 세포 분석 코어 시설 감사합니다: 꿀벌 링 Ng, 제니퍼 그레이엄, 샘 톰슨, 그리고 크리스토퍼 홀 FACS에 도움.
자료
| Name | Company | Catalog Number | Comments |
| Anti-mouse alkaline phosphatase | Sigma | A4656 | |
| Blasticidin | Chem-Cruz | SC-204655 | |
| Blood & Cell Culture DNA Maxi Kit | Qiagen | 13362 | |
| BSA | Sigma | A9647-100G | |
| Diethanolamine | Sigma | 398179 | |
| DMEM | Gibco | 31966-021 | |
| Dneasy Blood and Tissue kit | Qiagen | 69504 | |
| DynaMag-96 Side Magnet | Invitrogen | 12331D | |
| HEK293T packaging cells | ATCC | CRL-3216 | |
| Heparin | Sigma | H4784-1G | |
| KAPA HiFi HotStart ReadyMix | Kapa | KK2602 | |
| Lipofectamine LTX with PLUS reagent | Invitrogen | 15338100 | |
| MoFlo XDP cell sorter | BD | ||
| Ni2+-NTA agarose beads | Jena Bioscience | AC-501-25 | |
| OPTI-MEM | Life Technologies | 31985-070 | |
| OX-68 antibody | AbD Serotec | MCA1022R | |
| p-nitrophenyl phosphate | Sigma | 1040-506 | |
| PD-10 desalting columns | GE healthcare | 17085101 | |
| Polybrene | Millipore | TR-1003-G | |
| Polypropylene tubes with 5 mL bed volume | Qiagen | 34964 | |
| Proteinase K, recombinant, PCR Grade | Roche | 3115879001 | |
| Puromycin | Gibco | A11138-03 | |
| Q5 Hot Start High-Fidelity 2× Master Mix | NEB | M0494L | |
| QIAquick PCR purification kit | Qiagen | 28104 | |
| SCFA filter | Nalgene | 190-2545 | |
| Sony Cell sorter | Sony | ||
| SPRI beads (Agencourt AMPure XP beads) | Beckman | A63881 | |
| Streptavidin-coated microtitre plates | Nalgene | 734-1284 | |
| Streptavidin-PE | Biolegend | 405204 |
참고문헌
- Wright, G. J. Signal initiation in biological systems: the properties and detection of transient extracellular protein interactions. Molecular bioSystems. 5 (12), 1405-1412 (2009).
- van der Merwe, P. A., Barclay, A. N. Transient intercellular adhesion: the importance of weak protein-protein interactions. Trends in Biochemical Sciences. 19 (9), 354-358 (1994).
- Wood, L., Wright, G. J. Approaches to identify extracellular receptor-ligand interactions. Current Opinion in Structural Biology. 56, 28-36 (2019).
- Bushell, K. M., Söllner, C., Schuster-Boeckler, B., Bateman, A., Wright, G. J. Large-scale screening for novel low-affinity extracellular protein interactions. Genome Research. 18 (4), 622-630 (2008).
- Visser, J. J., et al. An extracellular biochemical screen reveals that FLRTs and Unc5s mediate neuronal subtype recognition in the retina. eLife. 4, e08149 (2015).
- Özkan, E., et al. An extracellular interactome of immunoglobulin and LRR proteins reveals receptor-ligand networks. Cell. 154 (1), 228-239 (2013).
- Martinez-Martin, N., et al. An Unbiased Screen for Human Cytomegalovirus Identifies Neuropilin-2 as a Central Viral Receptor. Cell. 174 (5), 1158-1171 (2018).
- Bianchi, E., Doe, B., Goulding, D., Wright, G. J. Juno is the egg Izumo receptor and is essential for mammalian fertilization. Nature. 508 (7497), 483-487 (2014).
- Mullican, S. E., et al. GFRAL is the receptor for GDF15 and the ligand promotes weight loss in mice and nonhuman primates. Nature Medicine. 23 (10), 1150-1157 (2017).
- Turner, L., et al. Severe malaria is associated with parasite binding to endothelial protein C receptor. Nature. 498 (7455), 502-505 (2013).
- Frei, A. P., et al. Direct identification of ligand-receptor interactions on living cells and tissues. Nature Biotechnology. 30 (10), 997-1001 (2012).
- Sobotzki, N., et al. HATRIC-based identification of receptors for orphan ligands. Nature Communications. 9 (1), 1519 (2018).
- Sharma, S., Petsalaki, E. Application of CRISPR-Cas9 Based Genome-Wide Screening Approaches to Study Cellular Signalling Mechanisms. International Journal of Molecular Sciences. 19 (4), (2018).
- Gebre, M., Nomburg, J. L., Gewurz, B. E. CRISPR-Cas9 Genetic Analysis of Virus-Host Interactions. Viruses. 10 (2), (2018).
- Zotova, A., Zotov, I., Filatov, A., Mazurov, D. Determining antigen specificity of a monoclonal antibody using genome-scale CRISPR-Cas9 knockout library. Journal of Immunological Methods. 439, 8-14 (2016).
- Puschnik, A. S., Majzoub, K., Ooi, Y. S., Carette, J. E. A CRISPR toolbox to study virus-host interactions. Nature Reviews. Microbiology. 15 (6), 351-364 (2017).
- Kerr, J. S., Wright, G. J. Avidity-based extracellular interaction screening (AVEXIS) for the scalable detection of low-affinity extracellular receptor-ligand interactions. Journal of Visualized Experiments. (61), e3881 (2012).
- Tzelepis, K., et al. A CRISPR Dropout Screen Identifies Genetic Vulnerabilities and Therapeutic Targets in Acute Myeloid Leukemia. Cell Reports. 17 (4), 1193-1205 (2016).
- Sharma, S., Bartholdson, S. J., Couch, A. C. M., Yusa, K., Wright, G. J. Genome-scale identification of cellular pathways required for cell surface recognition. Genome Research. 28 (9), 1372-1382 (2018).
- Wang, B., et al. Integrative analysis of pooled CRISPR genetic screens using MAGeCKFlute. Nature Protocols. 14 (3), 756-780 (2019).
- Hart, T., et al. Evaluation and Design of Genome-Wide CRISPR/SpCas9 Knockout Screens. G3. 7 (8), 2719-2727 (2017).
- Kuleshov, M. V., et al. Enrichr: a comprehensive gene set enrichment analysis web server 2016 update. Nucleic Acids Research. 44 (W1), W90-W97 (2016).
- Crosnier, C., et al. Basigin is a receptor essential for erythrocyte invasion by Plasmodium falciparum. Nature. 480 (7378), 534-537 (2011).
- Kirk, P., et al. CD147 is tightly associated with lactate transporters MCT1 and MCT4 and facilitates their cell surface expression. The EMBO Journal. 19 (15), 3896-3904 (2000).
- Chong, Z. S., Ohnishi, S., Yusa, K., Wright, G. J. Pooled extracellular receptor-ligand interaction screening using CRISPR activation. Genome Biology. 19 (1), 205 (2018).
- van der Meer, D., et al. Cell Model Passports-a hub for clinical, genetic and functional datasets of preclinical cancer models. Nucleic Acids Research. 47 (D1), D923-D929 (2019).
- Bausch-Fluck, D., et al. A mass spectrometric-derived cell surface protein atlas. PloS One. 10 (3), e0121314 (2015).
- Behan, F. M., et al. Prioritization of cancer therapeutic targets using CRISPR-Cas9 screens. Nature. 568 (7753), 511-516 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유