A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
سلالة تسيطر عليها من هيدروجيلس 3D تحت التصوير المجهري لايف
In This Article
Summary
تتضمن الطريقة المقدمة التمدد الأحادي من الهيدروجيلات الناعمة ثلاثية الأبعاد المضمنة في مطاط السيليكون مع السماح بالفحص المجهري البؤري الحي. يتم توضيح توصيف سلالات الهيدروجيل الخارجية والداخلية وكذلك محاذاة الألياف. الجهاز والبروتوكول وضعت يمكن تقييم استجابة الخلايا لمختلف أنظمة سلالة.
Abstract
القوى الخارجية هي عامل مهم في تكوين الأنسجة، والتنمية، والصيانة. وغالبا ما تدرس آثار هذه القوى باستخدام أساليب متخصصة في تمديد المختبر. تستخدم مختلف الأنظمة المتاحة نقالات تعتمد على الركيزة ثلاثية الأبعاد ، في حين أن إمكانية الوصول إلى التقنيات ثلاثية الأبعاد لإجهاد الهيدروجيلات الناعمة ، أكثر تقييدا. هنا، ونحن نصف الطريقة التي تسمح تمتد الخارجية من الهيدروجيل لينة من محيطها، وذلك باستخدام شريط سيليكون مرنة كما الناقل عينة. تم بناء نظام التمدد المستخدمة في هذا البروتوكول من أجزاء مطبوعة ثلاثية الأبعاد وإلكترونيات منخفضة التكلفة ، مما يجعل من السهل والسهل تكرارها في مختبرات أخرى. تبدأ العملية التجريبية مع البلمرة سميكة (>100 ميكرومتر) هيدروجيلس الفيبرين لينة (معامل مرن من ~ 100 السلطة الفلسطينية) في قطع التدريجي في وسط قطاع السيليكون. ثم يتم إرفاق بنى السيليكون هلام إلى الجهاز المطبوع تمتد ووضعها على مرحلة المجهر confocal. تحت المجهر الحي يتم تنشيط جهاز التمدد ، ويتم تصوير المواد الهلامية ب مقادير مختلفة للتمدد. ثم يتم استخدام معالجة الصور لتحديد تشوهات الجل الناتجة ، مما يدل على سلالات متجانسة نسبيا ومحاذاة الألياف في جميع أنحاء سمك الجل ثلاثي الأبعاد(Z-axis). وتشمل مزايا هذه الطريقة القدرة على إجهاد الهيدروجيلات الناعمة للغاية في 3D أثناء تنفيذ المجهر في الموقع ، وحرية التلاعب في هندسة وحجم العينة وفقا لاحتياجات المستخدم. بالإضافة إلى ذلك ، مع التكيف السليم ، يمكن استخدام هذه الطريقة لتمديد أنواع أخرى من الهيدروجيل (على سبيل المثال ، الكولاجين أو البولي أكريلاميد أو البولي إيثيلين غليكول) ويمكن أن تسمح بتحليل استجابة الخلايا والأنسجة للقوى الخارجية في ظل ظروف ثلاثية الأبعاد أكثر محاكاة بيولوجيا.
Introduction
استجابة الأنسجة للقوى الميكانيكية هي جزء لا يتجزأ من مجموعة واسعة من الوظائف البيولوجية، بما في ذلك التعبير الجيني1،تمايز الخلايا2،وإعادة عرض الأنسجة3. وعلاوة على ذلك، يمكن أن تؤثر التغيرات الناجمة عن القوة في المصفوفة خارج الخلية (ECM) مثل محاذاة الألياف والتكثيف على سلوك الخلية وتكوين الأنسجة4و5و6. هيكل شبكة ليفية في ECM له خصائص ميكانيكية مثيرة للاهتمام، مثل مرونة غير خطية، تشوه غير affine والتشوهات البلاستيكية7،8،9،10،11،12. تؤثر هذه الخصائص على كيفية استجابة الخلايا والبيئة الدقيقة المحيطة بها للقوى الميكانيكية الخارجية13و14. إن فهم كيفية استجابة ECM والأنسجة للقوى الميكانيكية سيمكن من التقدم في مجال هندسة الأنسجة وفي تطوير نماذج حسابية ونظرية أكثر دقة.
وقد ركزت الطرق الأكثر شيوعا لتمديد العينات ميكانيكيا على الركائز 2D محملة بالخلايا لاستكشاف الآثار على سلوك الخلية. وتشمل هذه، على سبيل المثال، تطبيق سلالة على ركائز البوليديميثيلسيلوكسيان (PDMS) وتحليل زوايا إعادة توجيه الخلية فيما يتعلق اتجاه التمدد15،16،17،18،19. ومع ذلك ، فإن الأساليب التي تحقق في استجابة الهيدروجيلات المدمجة في الخلايا ثلاثية الأبعاد للتمدد الخارجي ، وهي حالة تحاكي بشكل وثيق البيئة الدقيقة للأنسجة ، هي أكثر محدودية. التقدم نحو طرق التمدد ثلاثي الأبعاد ذات أهمية خاصة لأن الخلايا تتصرف بشكل مختلف على الركائز 2D بالمقارنة مع المصفوفات ثلاثية الأبعاد20. وتشمل هذه السلوكيات إعادة تنظيم الخلوية, مستويات التعبير البروتين, وأنماط الهجرة21,22,23.
وتشمل الأساليب والأجهزة التي تسمح لتمتد عينة 3D على حد سواء المتاحة تجاريا24،25،26،27،28 وتلك التي وضعت للبحوث المختبرية29. هذه الأساليب استخدام أنابيب السيليكون distensible30، غرف متعددةالآبار 31، المشابك26،32، المفاعلات الحيوية11،33، cantilevers34،35،36، والمغناطيس37،38. بعض التقنيات تولد تمتد أن تشوه محليا هيدروجيلس 3D، على سبيل المثال عن طريق سحب الإبر من نقطتين واحدة في هلام5،في حين أن البعض الآخر يسمح لتشوه الجزء الأكبر بأكمله من هلام16. وعلاوة على ذلك، تركز معظم هذه النظم على تحليل حقل السلالة في الطائرة X-Y، مع معلومات محدودة عن حقل السلالة في الاتجاه Z. بالإضافة إلى ذلك ، فقط عدد قليل من هذه الأجهزة قادرة على التصوير المجهري في الموقع. التحدي الرئيسي مع التصوير عالي التكبير في الموقع (على سبيل المثال ، المجهر confocal) هو مسافة عمل محدودة من بضع مئات من الميكرونات من العدسة الموضوعية إلى العينة. الأجهزة التي تسمح بالتصوير الحي أثناء التمدد تضحي بتوحيد السلالة في المحور Zأو معقدة نسبيا ويصعب تكاثرها في مختبرات أخرى39،40.
هذا النهج لتمتد هيدروجيلس 3D يسمح لسلالة أحادية ساكسية ثابتة أو دورية خلال المجهر الكونف البؤري الحية. تم إنشاء جهاز التمدد (المشار إليه باسم "نقالة أحادية ساكسال ذكية - SCyUS") باستخدام أجزاء مطبوعة ثلاثية الأبعاد وأجهزة منخفضة التكلفة ، مما يسمح بالاستنساخ السهل في مختبرات أخرى. تعلق على الجهاز هو المطاط السيليكون المتاحة تجاريا مع قطع هندسية التدريجي في وسطها. يتم بلمرة مكونات هيدروجيل لملء قطع التدريجي. أثناء البلمرة ، تلتزم الهيدروجيلات البيولوجية ، مثل الفيبرين أو الكولاجين ، بشكل طبيعي بالجدران الداخلية للقطع. باستخدام SCyUS ، يتم تمديد قطاع السيليكون بشكل غير ضروري ، ونقل السلالات الخاضعة للرقابة إلى هيدروجيل 3Dالمضمنة 41.
هذا النظام يسمح لمزيج فريد من الميزات والمزايا مقارنة مع غيرها من الأساليب القائمة. أولا، يسمح النظام بتمديد أحادي ساكسال الهيدروجيلات الناعمة ثلاثية الأبعاد السميكة (سمك >100 ميكرومتر، <1 كيلو باسكال صلابة) من أطرافها، مع تشوه Z-متجانسفي جميع أنحاء الهيدروجيل. هذه الهيدروجيلات لينة جدا لتكون مسيطرة وامتدت من قبل تقنيات الشد التقليدية. ثانيا، يمكن تكرار جهاز التمدد بسهولة في مختبرات أخرى لأن الطباعة ثلاثية الأبعاد متاحة بسهولة للباحثين والإلكترونيات المستخدمة في التصميم منخفضة التكلفة. ثالثا، وربما الميزة الأكثر جاذبية، يمكن التلاعب بسهولة الهندسة وحجم القطع في قطاع السيليكون، مما يسمح لتدرجات سلالة غير قادر وظروف الحدود، فضلا عن استخدام مجموعة متنوعة من أحجام العينة، وصولا الى عدد قليل من microliters.
البروتوكول المقدم يتكون من صب هلام الفيبرين إلى أقراص قطرها ~ 2 ملم في شرائط مطاطية سميكة سيليكون 0.5 ملم التي شرع فيها تمتد أحادية الجنس تحت المجهر الكونفوكوكال الحية. فيما يلي يناقش بالتفصيل الإجراءات التجريبية لقياس وتحليل السلالات التي تعمل على قطع هندسية التدريجي، وسلالات الداخلية وضعت في هيدروجيل، فضلا عن محاذاة الألياف الناتجة بعد التلاعب تمتد مختلفة. وأخيرا، تتم مناقشة إمكانية تضمين الخلايا في الهيدروجيل وتعريضها للتمدد الخارجي الخاضع للرقابة.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. إعداد الحل (ليتم تنفيذه مسبقا)
- فيبرينوجين وضع العلامات
ملاحظة: مطلوب خطوة وضع العلامات فقط إذا كان تحليل تشوه هلام الفيبرين هو المطلوب. للتجارب الخلوية، فمن الممكن استخدام هلام غير تسمية.- إضافة 38 ميكرولتر من 10 ملغم / مل من صبغة إستر الفلورسنت (المذابة في DMSO) إلى 1.5 مل من محلول الفيبرينوجين 15 ملغم / مل (نسبة الضرس من 5:1) في أنبوب الطرد المركزي 50 مل ووضعها على شاكر لمدة ساعة واحدة في درجة حرارة الغرفة. بعد ذلك، ضع الأنبوب في جهاز الطرد المركزي لمدة 3 دقائق عند 800 × ز (درجة حرارة الغرفة).
- تصفية supernatant من الخطوة السابقة من خلال عمود تحلية معبأة مع الراتنج هلام dextran (جدول المواد) لفصل صبغة غير منقحة،42 باتباع هذه الخطوات.
- قبل غسل العمود مع 25 مل من العازلة الفيبرينوجين.
- قم بحقن الفيبرينوجين المسمى ببطء من الخطوة 1.1.1 في العمود، مع التأكد من عدم وجود فقاعات تدخل الفلتر. تجاهل أول ~ 0.3 مل من محلول eluted (4-6 قطرات من السائل الملون باهتة). ثم جمع التالية 1.0-1.5 مل من الحل المنقى (اتبع بروتوكول الشركة المصنعة للحصول على مزيد من التفاصيل المحددة).
- الانتهاء من عملية الترشيح عن طريق تعقيم محلول تنقية الناتجة باستخدام مرشح حقنة يحركها (0.22-0.45 ميكرومتر).
- لتنظيف العمود وإعادة تدويره، اغسله ب 20 مل من حاجز الفيبرينوجين، ثم قم بتخزينه في 25 مل من الإيثانول بنسبة 20٪.
- بعد elution، تقسيم الناتجة المنقى المسمى-الفيبرينوجين إلى aliquots صغيرة من ~ 7-50 ميكرولتر، اعتمادا على العدد المطلوب من المواد الهلامية امتدت. لكل هلام دائرة قطرها 2 مم، قم بإعداد حوالي 3.5 ميكرولتر من الفيبرينوجين (سيتم استخدام 2.5 ميكرولتر لكل هلام + 1 ميكرولتر للأخطاء في الأنابيب).
- تخزين aliquots في الفريزر -20 درجة مئوية. ويمكن استخدامها لمدة تصل إلى حوالي سنة واحدة (لا ينصح بالذوبان والتجميد مرة أخرى).
- بالنسبة لبقية هذا البروتوكول، احتفظ بما يقرب من 7 ميكرولتر من الفيبرينوجين المسمى المنقى في الثلاجة (4 درجات مئوية) حتى الخطوة 4. ويهدف هذا الحجم لإنشاء اثنين من المواد الهلامية امتدت (هناك حاجة 2.5 ميكرولتر لكل هلام، ويستخدم حجم إضافي من 1 ميكرولتر لحساب الأخطاء في إعداد العينة).
ملاحظة: هذا الإجراء التصفية يخفف عادة الأولي 15 ملغم/ مل فيبرينوجين حل لتركيز النهائي من حوالي 10 ملغم/ مل. يعتمد عامل التخفيف على الحجم الأولي وتركيز الفيبرينوجين ، على النحو المحدد في بروتوكول الشركة المصنعة.
- إعداد 7 ميكرولتر من محلول الثرومبين (تمييع باستخدام العازلة thrombin إلى 2 وحدات / مل، جدول المواد) والاحتفاظ بها في الثلاجة (4 درجة مئوية) حتى الخطوة 4. ويهدف هذا الحجم لملء القواطع من اثنين من المواد الهلامية امتدت.
ملاحظة: من أجل إجراء تحليل الإجهاد الداخلي، 1 ميكرومتر قطرها حبات كروية فلورية (تم شراؤها كسياق [2٪ المواد الصلبة] في الماء بالإضافة إلى 2 mM NaN3) يجب أن تضاف إلى حل thrombin (ينصح بنسبة 1:25 v/v ٪ من الخرز: thrombin لهدف 40x). يجب تضمين الخرز فقط عندما تكون قياسات السلالة الداخلية مرغوبة ، إما في وجود الخلايا أو غيابها.
2. إعداد قطاع السيليكون
- استرداد المطاط السيليكون 0.5 ملم سميكة وقطع عليه إلى 15 × 80 ملم2 شرائط مع ثقب قطرها 2 ملم في وسط الشريط (الشكل 1). إذا كان ذلك ممكنا، استخدم قاطع ليزر قابل للبرمجة للحصول على دقة عالية. إذا لم تكن الآلات القابلة للبرمجة متوفرة ، فإن المقص يكفي لقطع مخطط الشريط ، كما أن ثقبا صغيرا يكفي لقطع المركز.
ملاحظة: عادة ما يتم شراء المطاط السيليكون التجارية مع غلاف بلاستيكي على كلا الجانبين. الحفاظ على غطاء من البلاستيك الأصلي على جانبي السيليكون إذا كان ذلك ممكنا. إذا إعادة استخدام شرائط السيليكون من تجربة سابقة، وعلاجها مع التريبسين لمدة 0.5 ساعة، نقع في 0.2 M NaOH لمدة 0.5 ساعة، ومن ثم نقع في الإيثانول 70٪ لمدة 1 ساعة. دعهم يجفون قبل الاستخدام. - إعداد ختم الفيلم (مسعور) طبقات مع أبعاد لا تقل عن 20 × 30 ملم2، بحيث تكون أوسع من قطاع السيليكون ، وبالتالي السماح لختم لتشكيل على قطع هندسية كاملة.
- غسل طبق 10 سم مع الإيثانول 70٪، ومن ثم مسح وجافة مع مناديل مهمة حساسة غير لينتينغ (للتجارب العقيمة وغير العقيمة على حد سواء). هذه الخطوة مهمة لأنها تسمح لطبقات الفيلم الختم على التمسك بشكل أفضل لوحة وتقييد حركة العينة أثناء عملية التحضير.
- وضع طبقات الفيلم ختم في طبق غسلها 10 سم حتى لا يكون هناك مساحة كافية لوضع شريطين في كل طبق جنبا إلى جنب (الشكل 2A).
- إزالة غلاف بلاستيكي من جانب واحد من قطاع السيليكون ووضع الجانب المكشوف على طبقة الفيلم ختم بحيث يتم إحاطة قطع التدريجي تماما من قبل طبقة الفيلم ختم (الشكل 2B). ثم اضغط برفق على السيليكون ضد طبقة فيلم الختم من أجل إغلاق المنطقة المحيطة بالقطع، باستخدام أصابع قفاز نظيفة.
ملاحظة: تأكد من عدم وجود جيوب هوائية بين السيليكون وفيلم الختم، خاصة حول القطع. القيام بذلك عن طريق فحص الجانب السفلي من الطبق (الشكل 2C).
- إزالة غلاف بلاستيكي من جانب واحد من قطاع السيليكون ووضع الجانب المكشوف على طبقة الفيلم ختم بحيث يتم إحاطة قطع التدريجي تماما من قبل طبقة الفيلم ختم (الشكل 2B). ثم اضغط برفق على السيليكون ضد طبقة فيلم الختم من أجل إغلاق المنطقة المحيطة بالقطع، باستخدام أصابع قفاز نظيفة.
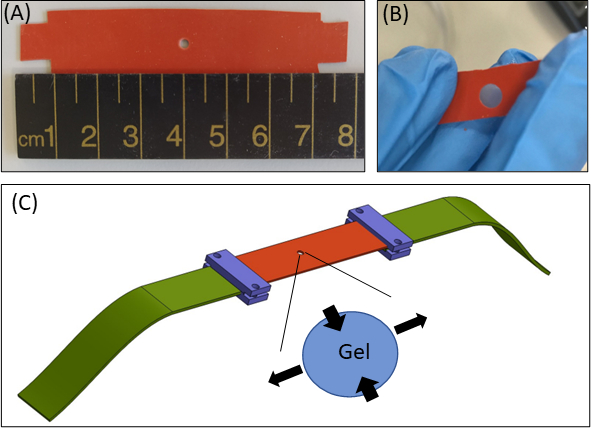
الشكل 1: نهج الإجهاد الهيدروجيل. أ) 15 × 80 مم2 شريط السيليكون مع قطر 2 ملم قطع التدريجي في وسط الشريط (ب) شريط سيليكون مع قطع دائرية التدريجي مع هلام الفيبرين جزءا لا يتجزأ. لأغراض توضيحية ، وقطع التدريجي في السيليكون هو أكبر مما كانت عليه في التجارب الفعلية(C)التخطيطي لنهج تمتد مع قطاع السيليكون (البرتقالي) ، هلام دائري (قطع التدريجي في الوسط) ، وموسعات النسيج (الأخضر) التي تربط السيليكون إلى الجهاز تمتد. تشير المساحة الموسعة من الجل إلى تشوه الجل ، استجابة لتمدد السيليكون أحادي ساكسال. للبساطة، لا يظهر الضغط على طول سمك الجل(Z-axis)في الرسم التوضيحي. تم تكييف الأرقام 1B و 1C من Roitblat Riba وآخرون.

الشكل 2: مثال على الموضع الصحيح لشريط السيليكون على طبقة فيلم الختم قبل بلمرة هلام. (أ) وضع طبقتين من طبقة فيلم الختم في طبق 10 سم (ب) وضع شرائط السيليكون على طبقات فيلم الختم(C)أسفل عرض الطبق ، وعرض ختم الهواء بين السيليكون وطبقة فيلم الختم. اليسار: ختم السليم من طبقة الفيلم ختم إلى قطاع السيليكون حول قطع التدريجي دون جيوب الهواء. الحق: ختم غير لائق من طبقة الفيلم ختم إلى قطاع السيليكون قطع التدريجي مع جيوب الهواء حول حافة قطع التدريجي. وهذا سيؤدي إلى تسرب مكونات الهيدروجيل تحت السيليكون. يشير السهم الأحمر إلى منطقة تشكل فيها جيب هوائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. إعداد الثرومبين مع الخلايا
ملاحظة: تنفيذ هذه الخطوة فقط إذا كان تضمين الخلايا في هيدروجيل هو المطلوب، وفي ظل ظروف معقمة في غطاء محرك السيارة البيولوجية(جدول المواد).
- التعقيم: في اليوم السابق للتجربة الخلوية ، ضع شرائح السيليكون وختم طبقات الأفلام في الإيثانول بنسبة 70٪ بين عشية وضحاها ثم قم بإجراء تعقيم الأشعة فوق البنفسجية لمدة 30 دقيقة على كل جانب (إذا لم تكن أطباق 10 سم معقمة بالفعل ، فيجب أيضا تعقيمها تحت ضوء الأشعة فوق البنفسجية لمدة 30 دقيقة بعد غسل الإيثانول بنسبة 70٪). نظام الأشعة فوق البنفسجية المستخدمة في البروتوكول هو واحد بنيت في غطاء محرك السيارة البيولوجية.
ملاحظة: بدلا من ذلك، يمكن إجراء دورة تعقيم الأوتوكلاف (140 درجة مئوية) على شرائط السيليكون لأنها مقاومة لما يصل إلى 260 درجة مئوية. - إجراء تعداد الخلايا لتحديد تركيز الخلية، ومن ثم الطرد المركزي وإعادة تعليق بيليه الخلية مع 7 ميكرولتر من الثرومبين (2 وحدة / مل) في أنبوب الطرد المركزي 1.5 مل. نوصي بتركيز خلية من 800 خلية / ميكرولتر من الثرومبين. الحفاظ على الخلايا المبردة حتى استخدام (لا تتجاوز أكثر من نصف ساعة لتجنب إتلاف الخلايا).
4. بلمرة من المواد الهلامية الفيبرين
- استرداد 2 وحدة / مل thrombin & 10 ملغ / مل المسمى فيبرينوجين حلول من الثلاجة (أعدت في الخطوة 1) ووضعها على الجليد حيث أنها سوف تكون في متناول.
ملاحظة: يتم الاحتفاظ حلول الباردة قبل عملية خلط من أجل إبطاء حركة تفاعل البلمرة. وهذا يسمح لخلط أكثر تجانسا من البروتينات. - مع الطبق (es) إعداد (الخطوة 2)، استخراج 2.5 ميكرولتر من المسمى-الفيبرينوجين وماصة بشكل موحد في قطع السيليكون التدريجي (مع طبقة فيلم الختم تعلق على الجانب السفلي) بحيث محيط كامل من قطع التدريجي هو على اتصال مع الفيبرينوجين. يجب الحرص على عدم السماح لأي جيوب الهواء أو فقاعات لتشكيل أي مكان في الحل، مع إيلاء اهتمام خاص إلى الحواف السفلية من قطع التدريجي (واجهة بين طبقة الفيلم ختم والسيليكون).
- تأخذ على الفور 2.5 ميكرولتر من الثرومبين (مع أو بدون خلايا / حبات) وماصة مباشرة في حل الفيبرينوجين في قطع التدريجي (الوصول إلى الحجم النهائي من 5 ميكرولتر الفيبرين). ثم خلط بسرعة الحلين عن طريق pipetting بعناية صعودا وهبوطا ~ 10 مرات. أثناء عملية الخلط، قم بتحريك الطرف حول وحدة التخزين بأكملها لإنشاء حل متجانس قدر الإمكان.
- إضافة كمية صغيرة جدا من الفوسفات العازلة المالحة (PBS) [بدلا من ذلك خلية المتوسطة لتجارب الخلية، جدول المواد] على طول حافة كل طبق حتى هيدروجيل لا تجف أثناء عملية البلمرة. تأكد من عدم وجود اتصال بين برنامج تلفزيوني / الخلية المتوسطة والعينات لأن هذا سوف يضر العينة.
- قم بتغطية الطبق (es) ووضعها في الحاضنة عند 37 درجة مئوية لمدة 30 دقيقة.
ملاحظة: يعتمد وقت الحضانة المطلوب على حجم الجل. إذا تم استخدام كميات أكبر ، يجب أن يزيد وقت الحضانة. - إزالة طبق (es) من الحاضنة وإضافة PBS / الخلية المتوسطة إلى الطبق، وغمر كامل هلام السيليكون بناء.
- رفع بعناية عينة يبني واحد في وقت واحد من الطبق التأكد من طبقة الفيلم ختم لا يزال ملتزما الشريط. فصل ببطء طبقة الفيلم الختم من السيليكون عن طريق pealing بلطف من نهاية واحدة من السيليكون إلى أخرى(الشكل 3). تجنب الانسحاب من المناطق القريبة من القطع حيث قد توجد تركيزات الإجهاد (وهذا مهم بشكل رئيسي للهندسات غير الدائرية). تجنب أي اتصال مع قطع التدريجي لأنها سوف تلحق الضرر العينة.
- وضع الشريط مرة أخرى في الطبق مع PBS / الخلية المتوسطة بحيث الشريط هو العائمة في الطبق. ثم تأخذ طبق (es) إلى المجهر معيار خلية الثقافة لتقييم نوعيا حالة كل عينة. يجب أن تكون المواد الهلامية موحدة ومستمرة طوال فترة الانقطاع ، ولا ينبغي أن تكون هناك فقاعات. باستخدام الشكل 4 كدليل، حدد أفضل العينات لمزيد من التحليل.

الشكل 3: إزالة طبقة الفيلم الختم السليم من الجزء السفلي من قطاع السيليكون. وينبغي أن تتم عملية إزالة ببطء حتى هيدروجيل لن المسيل للدموع أو كسر التصاقه مع الجدران الداخلية للقطع التدريجي. يظهر السهم الأبيض اتجاه الإزالة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: المراقبة المجهرية لجل الفيبرين في قطع السيليكون. (أ)مثالين على هلام الفيبرين البوليمر بشكل صحيح. لاحظ التجانس النسبي للجل والالتصاق الكامل إلى حواف القطع(ب)مثالين على فشل البلمرة العينة. أعلى: لاحظ العديد من الفقاعات والمجاميع التي تشكلت على الجانب الأيسر السفلي. أسفل: لاحظ تمزيق الجل من حواف القطع والمجاميع في المنطقة اليسرى السفلى من قطع التدريجي. مقياس الشريط = 300 ميكرومتر الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
5. عينة تحميل على جهاز SCyUS
- ملء الحمام مع برنامج تلفزيوني / الخلية المتوسطة (الشكل 5) ووضع شريط السيليكون تحمل هلام عينة عبر الجزء العلوي حتى ينتهي يجلسون على كل جانب من الحمام. ويهدف الحمام لتجنب أي تجفيف الجل. ضع وشد المشابك (الأرجواني) جنبا إلى جنب مع شرائط النسيج (الأخضر) بحيث يتم توصيل جميع القطع لتشكيل شريط مستقيم واحد مع قطع التدريجي في الوسط(الشكل 5).
- استرداد الجهاز SCyUS وإرفاق السائل الألومنيوم جيدا و22 مم × 40 مم مستطيلة الزجاج coverslip (رقم 1 أو 1.5) (الشكل 6Aiii). إرفاق زلة الغطاء إلى الجزء السفلي من البئر باستخدام مواد الختم (على سبيل المثال، الشحوم فراغ) بحيث يمكن ملء البئر مع السائل دون تسرب.
- ملء البئر مع ~ 1-2 مل من PBS / الخلية المتوسطة ووضع الشريط + النسيج + هلام بناء (الشكل 6B) في الجهاز. المشبك الشريط النسيج (2) في قوس (1) بحيث قطع التدريجي + هلام (5) هو في الوسط كما هو مبين، ثم وضع بعناية إدراج دبوس لأسفل (4) في الجهاز وقفله في مكانه.
- بعد ذلك ، أدخل الجانب الآخر من القماش إلى المغزل (دون إرفاق الجهاز) واغلقه في المغزل(الشكل 6C).
- أدخل جهاز SCyUS مع العينة المرفقة في مرحلة المجهر(الشكل 6C). توصيل المتحكم الدقيق(جدول المواد)بالكمبيوتر عبر كابل USB وتوصيل الجهاز بالتحكم الدقيق. افتح الوحدة النمطية للتحكم SCyUS على الكمبيوتر. العينة جاهزة الآن للتصوير للتحقق من كفاية سمك الجل وتجانس الألياف تحت المجهر الكونفوجكال.
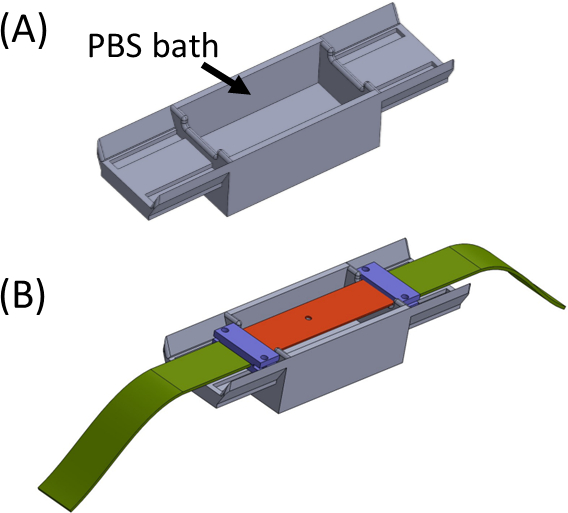
الشكل 5: (أ) Jig تحتوي على حمام PBS (3D المطبوعة) (ب) وضع الشريط على الرقصة لضمان مرفق مناسب في الخط من الأقواس (باللون الأرجواني) ومنع تجفيف الجل. تم تعديل هذا الرقم بإذن من رويتبلات الربا وآخرون41الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
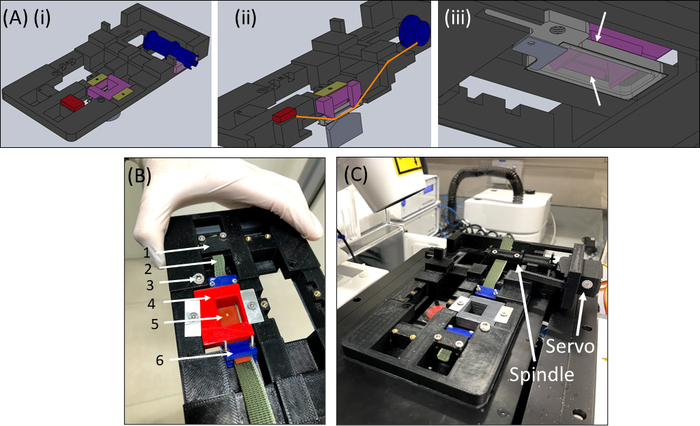
الشكل 6: جهاز SCyUS التمدد. (أ) عدة وجهات النظر لنموذج كندي من الأجزاء الرئيسية من SCyUS: مغزل متصلة سيرفو (الأزرق)، مرساة ثابتة (الأحمر)، إدراج أن دبابيس الشريط السيليكون أسفل (الأرجواني) والمثبتات التي تمنع إدراج من الارتفاع (الأصفر والأخضر). منظر علوي للنظام(Ai)،منظر مقطوع للنظام(Aii)يوضح مسار الشريط (الخط البرتقالي)، ورؤية أسفل(Aiii)لسائل الألومنيوم بشكل جيد مع غطاء زجاجي. يمكن نقل البئر السائل صعودا وهبوطا مع بدوره من المسمار تركيبها في خيوط الرئيسية. الحركة التصاعدية لبخير الألومنيوم محدودة بأجنحة الجانب الارجواني، كما هو مبين في الأسهم البيضاء (ب) النظام الفعلي: (1) مرساة ثابتة (2) نسيج أخضر غير قابل للتمدد (3) المسمار للتحكم في ارتفاع البئر السائل الألومنيوم (4) الأحمر دبوس لأسفل إدراج (5) شريط سيليكون مع قطع دائرية التدريجي (6) الأزرق ربط المشابك (ج) نظام التمدد وضعت على مجهر confocal. يظهر السفوموتور والمغزل بالسهام. تم تعديل هذا الرقم بإذن من رويتبلات الربا وآخرون41الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
6. ضمان هلام كافية لأخذ العينات
- باستخدام المجهر confocal(جدول المواد)اتخاذ منخفضة التكبير (10×) ، وانخفاض القرار (~ 1.4 ميكرومتر × 1.4 ميكرومتر حجم بكسل) confocal Z - كومة (≤10 Z - شرائح مع حجم خطوة تقريبية 10 ميكرومتر كافية) صورة البلاط من هلام كامل باستخدام أشعة الليزر من 488/543/561 لفحص التجانس والالتصاق إلى محيط قطع هندسية في جميع أنحاء سمك السيليكون (الشكل 7A-B). استخدم هذه الصورة Z-المكدسكخريطة للخطوات التالية.
- باستخدام التصوير الحي منخفض الدقة ، قم بمسح الجل وحدد أدنى وضع Zحيث يكون الالتصاق الكامل بالجدران الداخلية للقطع واضحا بدون دموع أو فقاعات ولاحظ موقع Zللمجهر (Zl). لتحديد التصاق كامل من هلام إلى السيليكون في جميع أنحاء محيطه، مسح واجهة التسمية الفلورسنت من هلام وشريط السيليكون (خلفية داكنة) تحت المجهر(الشكل 7C).
- التحرك في الاتجاه Zحتى لم يعد هناك استمرارية في هلام ونلاحظ Z-position (Zu):
- طرح الحد الأعلى (Zu) من Z-direction من الحد الأدنى (Zl). هذا هو سمك المرجعية للعينة (Zس):

إذا Zo ≥ 100 ميكرومتر ثم يعتبر هلام مرضية للتحليل. لاحظ أن سمك قطع السيليكون حوالي 500 ميكرومتر ، ولكن البلمرة الهلامية في القطع عادة ما تؤدي إلى سمك هلام أصغر. 100 ميكرومتر هو الحد الأدنى من سمك الموصى بها لضمان عملية تمتد مستقرة، دون دموع أو مفرزة من هلام من قطع السيليكون التدريجي.
ملاحظة: في مواقع XY المختلفة، يمكن أن يختلف سمك الجل. يقيس هذا القسم من البروتوكول الحد الأدنى لسمك الجل ، مما يسمح لنا بتحديد جودة الجل والإشارة إلى ما إذا كان كافيا للتمدد. بالإضافة إلى ذلك، يوفر العثور على مركز الجل نقطة مرجعية للعودة إلى مرحلة ما بعد التمدد، سواء كانت ثابتة أو ديناميكية.

الشكل 7: تجانس الجل. تم التقاط صور البلاط ومخيط باستخدام برنامج المجهر confocal (جدول المواد) (أ) صورة واحدة مخيط البلاط Z-شريحة من عينة هلام الفيبرين مع كثافة الألياف غير متجانسة نسبيا بسبب الثرومبين غير لائق وخلط الفيبرينوجين قبل البلمرة. هذا الجل لن توفر تحليلا موثوقا به (ب) واحدة مخيط البلاط Z-شريحةصورة عينة هلام الفيبرين مع كثافة الألياف متجانسة نسبيا. هذا هو هلام مقبول للتجارب تمتد. شريط مقياس للصور A & B هو 200 ميكرومتر (C)تكبير الواجهة بين الجل المسمى فلوريا (أحمر) والسيليكون (خلفية سوداء). شريط المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
7. عملية SCyUS ، وتمتد والتصوير
- الآن بعد أن تم تحديد العينة لتكون ذات جودة مرضية ويتم تعيينها على جهاز SCyUS بشكل صحيح ، حدد موضع العينة الممتد مسبقا. ويتحقق ذلك باستخدام التصوير الحي تحت المجهر الكونفوجال (على غرار الخطوة 6.2).
- تأكد من أن الجهاز في موضعه صفر بالنقر فوق الزر الانتقال إلى صفر سيرفو Pos (انقر على الشكل 8A وتأكد من أن الشكل 8B يعرض صفر) وإرفاقه بجهاز التمدد كما رأينا في الشكل 6C.
ملاحظة: القيام بهذه الخطوة ببطء وبعناية كما لا لوضع أي التوتر الزائد على العينة. - أثناء تصوير العينة، حرك المحرك بدرجة واحدة(الشكل 8C)في كل مرة في اتجاه عقارب الساعة عن طريق النقر على زر +1 حتى يتم ملاحظة الجانب الأيمن من القطع للتحرك. ثم عكس الحركة(الشكل 8D)العودة إلى موقف الخطوة قبل الأخيرة من خلال النقر على زر -1. يتحقق هذا من أن العينة تحت التوتر الحد الأدنى. انقر على زر تعيين موقف Min Servo (الشكل 8E) لتعيين الموضع المرجعي. من الممكن العودة إلى الموضع المرجعي في أي وقت من خلال النقر على زر الانتقال إلى مين سيرفو (الشكل 8F).
ملاحظة: من المستحسن استخدام هدف تكبير عالي (≥40×) لهذه الخطوة لتقليل الخطأ. - التقاط عالية التكبير (40×)، عالية الدقة (~ 0.2 ميكرومتر × 0.2 ميكرومتر حجم بكسل)، صورة واحدة Z-شريحة البلاط من منطقة هلام كامل. سيتم استخدام هذا كصورة مرجعية لتحليل ما بعد المعالجة. فمن المستحسن لالتقاط صورة واحدة Z-شريحة في منتصف سمك هلام (باستخدام Zس من Eq. 1)،وهذا سيسمح للعودة إلى ما يقرب من نفس Z-الموقفبعد تمتد. أيضا، تأخذ في الاعتبار أن الصور البلاط عالية الدقة من منطقة هلام كامل يستغرق وقتا طويلا (~ 20-30 دقيقة).
- الآن العينة جاهزة للتمدد الثابت. ضبط servomotor لحجم تمتد المطلوب من خلال التقدم درجة واحدة (الشكل 8C) في وقت واحد في واجهة المستخدم الرسومية (أداء هذا ببطء، حوالي 1 درجة / ثانية).
- تأكد من أن الجهاز في موضعه صفر بالنقر فوق الزر الانتقال إلى صفر سيرفو Pos (انقر على الشكل 8A وتأكد من أن الشكل 8B يعرض صفر) وإرفاقه بجهاز التمدد كما رأينا في الشكل 6C.
- عند كل حجم امتداد حيث يتم إجراء التحليل المطلوب، التقط صورة بلاط أحادية عالية الدقة من Z-slice لمنطقة الجل بأكملها لتحليل ما بعد المعالجة. على غرار الخطوة 6.2، تحقق من أن الجل لم ينفصل عن السيليكون طوال محيطه عن طريق مسح الواجهة بين الجل (الأحمر) والسيليكون (الخلفية الداكنة)، بحثا عن تغييرات في التصاق من حجم الامتداد السابق.
ملاحظة: أثناء تنشيط المحرك، استخدم التصوير المباشر لمتابعة موقع الجل في X-Y (مع إعدادات منخفضة الدقة ومنخفضة التكبير). الهلام تجارب تأثير Z-Poisson حيث يرتفع الجزء السفلي من هلام، وبالتالي ينبغي أيضا تعديل Z-موقفالمجهر إلى المركز التقريبي لسمك هلام لكل حجم تمتد. ويمكن تحقيق ذلك عن طريق إعادة حساب Zo (Eq. 1) لكل حجم امتداد. منذ تمتد في Z-الاتجاه هو متجانس نسبيا، فإنه ليس من الضروري العثور على عمق مركز الدقيق من هلام.
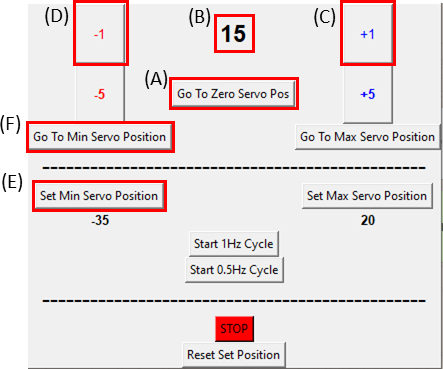
الشكل 8: واجهة المستخدم الرسومية لوحدة التحكم SCyUS. (أ) موضع المحرك بالدرجات. تتراوح القيمة من -90 درجة إلى 90 درجة (B) "تعيين الحد الأدنى لموقف سيرفو". يسمح هذا الزر بوضع الحد الأدنى المحدد مسبقا ، لإعداد موضع مرجعي جديد يختلف عن موضع Zero Servo (C) "زائد 1 درجة" يتحرك زر المحرك servo بدرجة واحدة في اتجاه عقارب الساعة(D)'ناقص 1 درجة' يتحرك زر محرك سيرفو بدرجة واحدة عكس اتجاه عقارب الساعة (ه) 'الذهاب إلى موقف الصفر' زر يحدد موقف servomotor إلى 0 ° ([A] سيتم تعيين إلى الصفر) (واو) 'الذهاب إلى الحد الأدنى موقف سيرفو' زر يتحرك servomotor للمستخدم محددة 'مين' الموقف. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
8. قياسات الإجهاد الخارجي بعد المعالجة
- لقياس السلالات الفعالة للحدود المقطوعة، قم بقياس أطوال من الحافة إلى الحافة في اتجاه التمدد(X-axis)في وسط المحور ص(الشكل 9A).
- تحميل الصورة قبل تمتد إلى برنامج معالجة الصور (ImageJ فيجي43)وقياس المسافة أكبر من الحافة إلى الحافة التي تعرف بأنها طول المحوري للحفرة (
 ) في المركز.
) في المركز. - حدد المسافة الأكبر من الأعلى إلى الأسفل كمسافة عمودية (
 ).
). - كرر هذه العملية لجميع الصور الفاصلة تمتد وحساب المحوري (
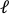 ) وعمودي (
) وعمودي (  ) مسافات من محيط قطع التدريجي(الشكل 9A،أسفل) ومن ثم إجراء الحسابات التالية للعثور على سلالات من حواف قطع التدريجي:
) مسافات من محيط قطع التدريجي(الشكل 9A،أسفل) ومن ثم إجراء الحسابات التالية للعثور على سلالات من حواف قطع التدريجي:
- تحميل الصورة قبل تمتد إلى برنامج معالجة الصور (ImageJ فيجي43)وقياس المسافة أكبر من الحافة إلى الحافة التي تعرف بأنها طول المحوري للحفرة (
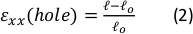

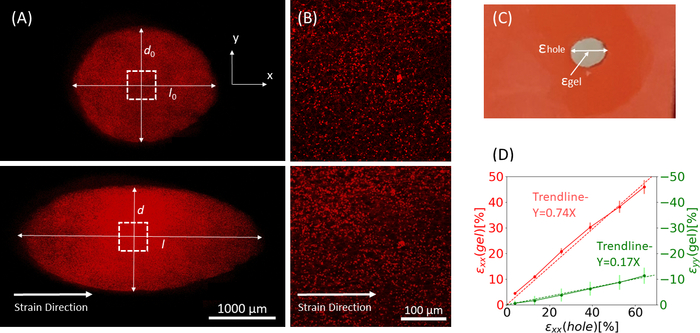
الشكل 9: سلالات جل بسبب التمدد الخارجي لقطاع السيليكون. (أ) X-Y المقطع العرضي من هلام الفيبرين غير امتدت (أعلى)، وبعد تطبيق ثقب ε = 64٪ سلالة على طول الاتجاه x (أسفل). يتم تضمين الجل مع حبات الفلورسنت. يشار إلى أطوال D و l ذات الصلة المستخدمة لحساب ثقب ε في الصور(B)صور التكبير في المنطقة المربعة المتقطعة التي تم وضع علامة عليها في A (C) التوضيح لأنواع السلالة التي تم النظر فيها في هذه الدراسة: εالثقب هو السلالة المحورية للقطع في قطره الأقصى ، وهلام ε هو سلالة المحوري في وسط هلام (كما تقاس المواقع الكلية حبة) (D) تم العثور على علاقة خطية بين ثقب ε وهلام ε في كل من الاتجاه xx (الخط الأحمر) واتجاه yy (الخط الأخضر). تم تعديل هذا الرقم بإذن من رويتلات ربا وآخرون41الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
9. تحليل اتجاه الألياف
- استخدام القياس الكمي للمحاذاة الألياف لتوصيف الاستجابة الهيكلية للجل ليفية لزيادة مقادير تمتد. تحميل صور عالية الدقة إلى برنامج ImageJ FIJI (NIH)43 ثم قم بتحليل باستخدام وحدة OrientationJ (EPFL)44 (الإعدادات: تدرج غاوسي، ونافذة 3 بكسل، الشكل 10).
- حساب المعلمة 2D ترتيب نيماتيكي (NOP) من المدرج التكراري الاتجاه على النحو التالي:45
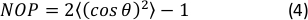
ملاحظة: تشير قيمة NOP = 1 إلى محاذاة مثالية على طول الاتجاه المحوري (الزاوية صفر) و NOP = 0 تشير إلى المحاذاة. زاوية الاتجاه، حاز ، هي زاوية الألياف فيما يتعلق بمحور السلالة (المحور س) التي تم الحصولعليها من خلال تحليل الصورة ومحددة بدقة في وثائق OrientationJ. 44
- حساب المعلمة 2D ترتيب نيماتيكي (NOP) من المدرج التكراري الاتجاه على النحو التالي:45

الشكل 10: تحليل توجه الألياف باستخدام برنامج فيجي إيمجج. (أ) القائمة الرئيسية من ImageJ مع سهم يشير إلى موقع القائمة المنسدلة 'الإضافات' حيث يمكن العثور على 'OrientationJ'. ضمن القائمة الموسعة من "OrientationJ"، انقر على خيار "OrientationJ Distribution"(B)وحدة توزيع OrientationJ. تعيين 'الإطار المحلي σ' إلى 3 بكسل و 'الانحدار' إلى 'غاوسي'. ثم اضغط على زر "تشغيل" (السهم الأحمر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
10. دليل تحليل سلالة هلام الداخلية
- أثناء إجراء تصوير حي عالي التكبير لهيدرجيل مع حبات مضمنة ، حدد موقع منطقة الاهتمام يدويا (ROI) مع ميزات يسهل التعرف عليها (على سبيل المثال ، مجاميع الخرز) ، من أجل العودة إلى نفس الموقع بعد كل حجم امتداد.
ملاحظة: الضغط في اتجاه Z (تأثير بواسون) يمكن أن يؤدي إلى زيادة في كثافة حبة كما يزيد من تمتد، لذلك نقترح اختيار مجاميع حبة كبيرة بما فيه الكفاية، بحيث يمكن التعرف عليها بوضوح. يدعو هذا البروتوكول إلى تحليل المنطقة الوسطى من هلام الفيبرين ، على الرغم من أنه يمكن اختيار أي منطقة. - في موضع ما قبل التمدد (الخطوة 6)، التقط صورة Z-stackعالية الدقة لعائد الاستثمار المحدد. بعد كل فاصل زمني للتمدد المطلوب، ارجع إلى عائد الاستثمار نفسه وكرر عملية التقاط الصور.
- خذ الصور واستوردها إلى ImageJ. في ROI، سجل موقع بكسل X-Y لكل تجميع حبة مرئية. نقل البيانات المسجلة إلى جدول بيانات.
- قياس المسافات بين كل زوج من المجاميع ومقارنتها بمسافات نفس الأزواج في الصورة المرجعية، مما يسمح بحساب السلالات في الاتجاهين س و ص.
ملاحظة: إذا تم تسجيل فيلم مستمر في الوقت الحقيقي أثناء تمديد الجل (بدلا من التقاط صورة ثابتة) ، يمكن إجراء تحليل تلقائي للسلالات باستخدام الصور الرقمية أو الارتباطات بحجم (DIC / DVC) ، كما هو موضح سابقا46،47. ومع ذلك ، تجدر الإشارة إلى أن التحليل التلقائي DIC / DVC يمثل تحديا في هذا الإعداد ، حيث أن Z-stack لا يتحرك فقط في مستوى X-Y ولكن أيضا في اتجاه Zبسبب تأثير Poisson (الضغط) ، مما يمثل انجرافات كبيرة أثناء الفيلم المسجل.
Access restricted. Please log in or start a trial to view this content.
النتائج
وتظهر البيانات التمثيلية من امتداد ثابت من مقادير متزايدة تطبق على قطاع السيليكون تحمل هيدروجيل الفيبرين 3D، جزءا لا يتجزأ مع حبات الفلورسنت 1 ميكرومتر، في الشكل 9. يوضح التحليل تأثير امتداد السيليكون على التغيرات الهندسية للقطع وكذلك السلالات المتقدمة داخل الجل. Z-<...
Access restricted. Please log in or start a trial to view this content.
Discussion
تستند الطريقة والبروتوكول المعروضين هنا إلى حد كبير على دراستنا السابقة من قبل Roitblat Riba وآخرون.
وتشمل المزايا الرئيسية للطريقة المعروضة على النهج القائمة إمكانية إجهاد الهيدروجيلات ثلاثية الأبعاد الناعمة جدا (معامل مرن من ~ 100 باسكال) من محيطها ، وتحت التص...
Access restricted. Please log in or start a trial to view this content.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
وقد تم تكييف بعض الأرقام المدرجة هنا بإذن من مركز إزالة حقوق الطبع والنشر: سبرينغر الطبيعة، حوليات الهندسة الطبية الحيوية. إجهاد الهيدروجيلات ثلاثية الأبعاد بسلالات موحدة من محور z مع تمكين التصوير المجهري الحي ، A. Roitblat Riba ، S. Natan ، A. Kolel ، H. Rushkin ، O. Tchaicheeyan ، A. Lesman ، حقوق الطبع والنشر © (2019).
https://doi.org/10.1007/s10439-019-02426-7
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 546 carboxylic acid, succinimidyl ester | Invitrogen | A20002 | |
| Cell Medium (DMEM High Glucose) | Biological Industries | 01-052-1A | Add 10% FBS, 1% PNS, 1% L-Glutamine, 1% Sodium Pyruvate |
| Cover Slip #1.5 | Bar-Naor Ltd. | BN72204-30 | 22×40 mm |
| DIMETHYL SULPHOXIDE 99.5% GC DMSO | Sigma-Aldrich Inc. | D-5879-500 ML | |
| Dulbecco's Phosphate-Buffered Saline | Biological Industries | 02-023-1A | |
| EVICEL Fibrin Sealant (Human) | Omrix Biopharmaceuticals | 3902 | Fibrinogen: 70 mg/mL, Thrombin: 800-1200 IU/mL |
| Fibrinogen Buffer | N/A | Recipe for 1L: 7g NaCl, 2.94g trisodium citrate dihydrate, 9g glycine, 20g arginine hydrochloride & 0.15g calcium chloride dihydrate. Bring final volume to 1L with PuW (pH 7.0-7.2) | |
| Fluorescent micro-beads FluoSpheres (1 µm) | Invitrogen | F8820 | Orange (540/560) Provided as suspension (2% solids) in water plus 2 mM sodium azide |
| High-Temperature Silicone Rubber | McMaster-Carr | 3788T41 | 580 µm-thick E = 1.5 Mpa Poisson Ratio = 0.48 Tensile Strength = 4.8 MPa Upper limit of stretch = +300% engineering strain |
| HiTrap desalting column 5 mL (Sephadex G-25 packed) | GE Healthcare | 17-1408-01 | |
| HIVAC-G High Vacuum Sealing Compound | Shin-Etsu Chemical Co., Ltd. | HIVAC-G 100 | |
| ImageJ FIJI software39 | National Institute of Health, Bethesda, MD | Version 1.8.0_112 | |
| Microcontroller (Adruino Uno + Adafruit Motorshield v2.3) | Arduino/Adafruit | Arduino-DK001/Adafruit-1438 | |
| MicroVL 21R Centrifuge | Thermo Scientific | 75002470 | |
| Parafilm | Bemis | PM-996 | |
| Primovert Light Microscope | Carl Zeiss Suzhou Co., Ltd. | 491206-0011-000 | |
| SCyUS CAD (Solidworks) | Dassault Systèmes | N/A | |
| SCyUS Code37 | N/A | N/A | |
| Servomotor - TowerPro SG-5010 | Adafruit | 155 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | For 50 mL tubes |
| Sterile 10 cm non-culture plates | Corning | 430167 | |
| Thrombin buffer | N/A | Recipe for 1L: 20g mannitol, 8.77g NaCl, 2.72g sodium acetate trihydrate, 24 mL 25% Human Serum Albumin, 5.88g calcium chloride. Bring final volume to 1L with PuW (pH 7.0) | |
| Trypsin EDTA Solution B (0.25%), EDTA (0.05%) | Biological Industries | 03-052-1B | |
| USB Cable (Type B Male to Type A Male) | N/A | N/A | |
| Zeiss LSM 880 Confocal Microscope | Carl Zeiss AG | 2811000417 | |
| ZEN 2.3 SP1 FP3 (black) | Carl Zeiss AG | Release Version 14.0.0.0 |
References
- Bleuel, J., Zaucke, V., Bruggemann, G. P., Niehoff, A. Effects of cyclic tensile strain on chondrocyte metabolism: a systematic review. PLoS ONE. 10, 0119816(2015).
- Pennisi, C. P., Olesen, C. G., de Zee, M., Rasmussen, J., Zachar, V. Uniaxial cyclic strain drives assembly and differentiation of skeletal myocytes. Tissue Engineering Part A. 17, 2543-2550 (2011).
- Grodzinsky, A. J., Levenston, M. E., Jin, M., Frank, E. H. Cartilage Tissue Remodeling in Response to Mechanical Forces. Annual Review of Biomedical Engineering. 2 (1), 691-713 (2000).
- Munster, S., et al. Strain history dependence of the nonlinear stress response of fibrin and collagen networks. Proceedings of the National Academy of Sciences of the USA. 110, 12197-12202 (2013).
- Vader, D., Kabla, A., Weitz, D., Mahadevan, L. Strain-induced alignment in collagen gels. PLoS ONE. 4, 5902(2009).
- Badylak, S. F. The extracellular matrix as a scaffold for tissue reconstruction. Seminars in Cell & Developmental Biology. 13 (5), 377-383 (2002).
- Natan, S., Koren, Y., Shelah, O., Goren, S., Lesman, A. Molecular Biology of the Cell. 31 (14), 1474-1485 (2020).
- Ban, E., et al. Mechanisms of Plastic Deformation in Collagen Networks Induced by Cellular Forces. Biophysical Journal. 114 (2), 450-461 (2018).
- Kim, J., et al. Stress-induced plasticity of dynamic collagen networks. Nature Communications. 8, 842(2017).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Basu, A., Janmey, P. A., Yodh, A. G. Non-affine deformations in polymer hydrogels. Soft Matter. 8, 8039-8049 (2012).
- Muiznieks, L. D., Keeley, F. W. Molecular assembly and mechanical properties of the extracellular matrix: A fibrous protein perspective. Biochimica et Biophysica Acta. 1832, 866-875 (2012).
- Brown, A. E. X., Litvinov, R. I., Discher, D. E., Purohit, P. K., Weisel, J. W. Multiscale mechanics of fibrin polymer: gel stretching with protein unfolding and loss of water. Science. 325, 741-744 (2009).
- Carroll, S. F., Buckley, C. T., Kelly, D. J. Cyclic tensile strain can play a role in directing both intramembranous and endochondral ossification of mesenchymal stem cells. Frontiers in Bioengineering and Biotechnology. 5, 73(2017).
- Livne, A., Bouchbinder, E., Geiger, B. Cell reorientation under cyclic stretching. Nature Communications. 5, 3938(2014).
- Wang, L., et al. Patterning cellular alignment through stretching hydrogels with programmable strain gradients. ACS Applied Materials & Interfaces. 7, 15088-15097 (2015).
- Xu, G. K., Feng, X. Q., Gao, H. Orientations of Cells on Compliant Substrates under Biaxial Stretches: A Theoretical Study. Biophysical Journal. 114 (3), 701-710 (2017).
- Chagnon-Lessard, S., Jean-Ruel, H., Godin, M., Pelling, A. E. Cellular orientation is guided by strain gradients. Integrative Biology (United Kingdom). 9 (7), 607-618 (2013).
- Lu, J., et al. Cell orientation gradients on an inverse opal substrate. ACS Applied Materials & Interfaces. 7 (19), 10091-10095 (2015).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125, 3015-3024 (2012).
- Bono, N., et al. Unraveling the role of mechanical stimulation on smooth muscle cells: a comparative study between 2D and 3D models. Biotechnology and Bioengineering. 113, 2254-2263 (2016).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8, 839-845 (2007).
- Riehl, B. D., Park, J. H., Kwon, I. K., Lim, J. Y. Mechanical stretching for tissue engineering: two-dimensional and three-dimensional constructs. Tissue Engineering Part B: Reviews. 18, 288-300 (2012).
- Flexcell. Linear Tissue Train Culture Plate. Flexcell. , (2019).
- Flexcell. Tissue Train. Flexcell. , (2019).
- CellScale. MCT6 Stretcher. CellScale. , (2019).
- STREX. STB-150. STREX. , (2019).
- STREX. Stretch Chambers. STREX. , (2019).
- Kamble, H., Barton, M. J., Jun, M., Park, S., Nguyen, N. T. Cell stretching devices as research tools: engineering and biological considerations. Lab on a Chip. 16, 3193-3203 (2016).
- Weidenhamer, N. K., Tranquillo, R. T. Influence of cyclic mechanical stretch and tissue constraints on cellular and collagen alignment in fibroblast-derived cell sheets. Tissue Engineering Part C: Methods. 19, 386-395 (2013).
- Yung, Y. C., Vandenburgh, H., Mooney, D. J. Cellular strain assessment tool (CSAT): precision-controlled cyclic uniaxial tensile loading. Journal of Biomechanics. 42, 178-182 (2009).
- Chen, K., et al. Role of boundary conditions in determining cell alignment in response to stretch. Proceedings of the National Academy of Sciences of the USA. 115, 986-991 (2018).
- Heher, P., et al. A novel bioreactor for the generation of highly aligned 3D skeletal muscle-like constructs through orientation of fibrin via application of static strain. Acta Biomaterialia. 24, 251-265 (2015).
- Foolen, J., Deshpande, V. S., Kanters, F. M. W., Baaijens, F. P. T. The influence of matrix integrity on stress-fiber remodeling in 3D. Biomaterials. 33, 7508-7518 (2012).
- Walker, M., Godin, M., Pelling, A. E. A vacuum-actuated microtissue stretcher for long-term exposure to oscillatory strain within a 3D matrix. Biomedical Microdevices. 20, 43(2018).
- Zhao, R. G., Boudou, T., Wang, W. G., Chen, C. S., Reich, D. H. Decoupling cell and matrix mechanics in engineered microtissues using magnetically actuated microcantilevers. Advanced Materials. 25, 1699-1705 (2013).
- Li, Y. H., et al. Magnetically actuated cell-laden micro-scale hydrogels for probing strain-induced cell responses in three dimensions. NPG Asia Materials. 8, 238(2016).
- Li, Y. H., et al. An approach to quantifying 3D responses of cells to extreme strain. Scientific Reports. 6, 19550(2016).
- Humphrey, J. D., et al. A theoretically-motivated biaxial tissue culture system with intravital microscopy. Biomechanics and Modeling in Mechanobiology. 7, 323-334 (2008).
- Niklason, L. E., et al. Enabling tools for engineering collagenous tissues integrating bioreactors, intravital imaging, and biomechanical modeling. Proceedings of the National Academy of Sciences of the USA. 107, 3335-3339 (2010).
- Roitblat Riba, A., et al. Straining 3D hydrogels with uniform z-axis strains while enabling live microscopy imaging. Annals of Biomedical Engineering. , (2019).
- Gomez, D., Natan, S., Shokef, Y., Lesman, A. Mechanical interaction between cells facilitates molecular transport. Advanced Biosystems. 3 (12), 1900192(2019).
- Schindelin, J., et al. Fiji: an open- source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- EPFL Switzerland. OrientationJ plug in. EPFL Switzerland. , (2019).
- Goren, S., Koren, Y., Xu, X., Lesman, A. Elastic anisotropy governs the decay of cell-induced displacements. Biophysical Journal. 118 (5), 1152-1164 (2019).
- Notbohm, J., Lesman, A., Tirrell, D. A., Ravichandran, G. Quantifying cell-induced matrix deformation in three dimensions based on imaging matrix fibers. Integrative Biology. 7 (10), 1186-1195 (2015).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. Journal of Cell Biology. 205 (2), 155-162 (2014).
- Cha, C. Y., et al. Tailoring Hydrogel Adhesion to Polydimethylsiloxane Substrates Using Polysaccharide Glue. Angewandte Chemie International Edition. 52, 6949-6952 (2019).
- Wirthl, D., et al. Instant tough bonding of hydrogels for soft machines and electronics. Science Advances. 3, (2017).
- Juarez-Moreno, J. A., Avila-Ortega, A., Oliva, A. I., Aviles, F., Cauich-Rodriguez, J. V. Effect of wettability and surface roughness on the adhesion properties of collagen on PDMS films treated by capacitively coupled oxygen plasma. Applied Surface Science. 349, 763-773 (2015).
- Kim, H. T., Jeong, O. C. PDMS surface modification using atmospheric pressure plasma. Microelectronic Engineering. 88, 2281-2285 (2011).
- Prasad, B. R., et al. Controlling cellular activity by manipulating silicone surface roughness. Colloids and Surfaces. 78, 237-242 (2010).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved