Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Canlı Mikroskopi Görüntüleme Altında 3D Hidrojellerin Kontrollü Suşu
Bu Makalede
Özet
Sunulan yöntem, canlı konfokal mikroskopiye izin verirken silikon kauçuğun içine gömülü 3D yumuşak hidrojellerin tek eksenli gerilmesini içerir. Dış ve iç hidrojel suşlarının karakterizasyonu ve fiber hizalaması gösterilmiştir. Geliştirilen cihaz ve protokol, hücrelerin çeşitli gerinim rejimlerine tepkisini değerlendirebilir.
Özet
Dış kuvvetler doku oluşumunda, gelişiminde ve bakımında önemli bir faktördür. Bu kuvvetlerin etkileri genellikle özel in vitro germe yöntemleri kullanılarak incelenir. Mevcut çeşitli sistemler 2D substrat bazlı sedyeler kullanırken, yumuşak hidrojelleri zorlamak için 3D tekniklerin erişilebilirliği daha kısıtlıdır. Burada, yumuşak hidrojellerin çevrelerinden dış gerilmesine izin veren bir yöntemi, numune taşıyıcı olarak elastik bir silikon şerit kullanarak açıklıyoruz. Bu protokolde kullanılan germe sistemi, 3D baskılı parçalardan ve düşük maliyetli elektronikten inşa edilmiştir, bu da diğer laboratuvarlarda çoğaltılmasını basit ve kolay hale getirir. Deneysel süreç, silikon şeridin ortasındaki bir kesmede kalın (>100 μm) yumuşak fibrin hidrojelleri (~100 Pa'nın Elastik Modülü) polimerizasyonu ile başlar. Silikon jel yapılar daha sonra baskılı germe cihazına tutturulur ve konfokal mikroskop aşamasına yerleştirilir. Canlı mikroskopi altında germe cihazı etkinleştirilir ve jeller çeşitli streç büyüklüklerinde görüntülenir. Görüntü işleme daha sonra elde edilen jel deformasyonlarını ölçmek için kullanılır ve jelin 3D kalınlığı(Zekseni) boyunca nispeten homojen suşları ve lif hizalamasını gösterir. Bu yöntemin avantajları arasında in situ mikroskopiyi yürütürken son derece yumuşak hidrojelleri 3D olarak germe yeteneği ve numunenin geometrisini ve boyutunu kullanıcının ihtiyaçlarına göre manipüle etme özgürlüğü yer almaktadır. Ek olarak, uygun adaptasyon ile bu yöntem diğer hidrojel türlerini (örneğin kollajen, poliakrilamid veya polietilen glikol) germek için kullanılabilir ve daha biyomimetik 3D koşullar altında dış kuvvetlere hücrelerin ve doku tepkisinin analizine izin verebilir.
Giriş
Mekanik kuvvetlere doku tepkisi, gen ekspresyasyonu1,hücre farklılaşması2ve doku tadilatı3dahil olmak üzere çok çeşitli biyolojik fonksiyonların ayrılmaz bir parçasıdır. Ayrıca, lif hizalama ve densifikasyon gibi hücre dışı matriste (ECM) kuvvet kaynaklı değişiklikler hücre davranışını ve doku oluşumunu etkileyebilir4,5,6. ECM'nin lifli ağ yapısı, doğrusal olmayan elastikiyet, afin dışı deformasyon ve plastik deformasyonlar 7 , 8 , 9,10,11,12gibi ilgi çekici mekaniközellikleresahiptir. Bu özellikler, hücrelerin ve çevresindeki mikroçevriciliğin dış mekanik kuvvetlere nasıl tepki verdiğini etkiler13,14. ECM ve dokuların mekanik kuvvetlere nasıl tepki verdiğini anlamak, doku mühendisliği alanında ve daha doğru hesaplamalı ve teorik modellerin geliştirilmesinde ilerleme sağlayacaktır.
Örnekleri mekanik olarak germek için en yaygın yöntemler, hücre davranışı üzerindeki etkilerini araştırmak için hücre yüklü 2B substratlara odaklanmıştır. Bunlar, örneğin, polidimetilsiloksan (PDMS) substratlarına gerinim uygulamak ve 15 , 16, 17,18,19streç yönüne göre hücre yeniden yönlendirme açılarını analiz etmektir. Yine de, doku mikroçevrimini daha yakından taklit eden bir durum olan 3D hücre gömülü hidrojellerin dış streçlere yanıtını araştıran yöntemler daha sınırlıdır. 3D germe yöntemlerine yönelik gelişmeler özel bir öneme sahiptir, çünkü hücreler 3B matrisler 20 ile karşılaştırıldığında2Bsubstratlarda farklı davranırlar. Bu davranışlar hücresel yeniden hizalama, protein ifade düzeyleri ve geçişörüntüleri 21,22,23içerir.
3D numune germe için izin veren yöntem ve cihazlar hem ticari olarak mevcut24,25,26,27,28hem de laboratuvar araştırması için geliştirilenleri içerir29. Bu yöntemler,30,çok kuyulu odalar 31, kelepçeler26 , 32, biyoreaktörler11,33,cantilevers34 , 35,36ve mıknatıslar 37,38kullanır. Bazı teknikler, örneğin jel5'tekiiki tek noktadan iğne çekerek 3D hidrojelleri yerel olarak deforme eden streç oluştururken, diğerleri jelin tüm kütlesinin deformasyonuna izin verir16. Ayrıca, bu sistemlerin çoğu X-Y düzleminde gerinim alanının analizine odaklanır ve Zyönündeki gerinim alanı hakkında sınırlı bilgi ile. Ek olarak, bu cihazlardan sadece bir avuç mikroskobik yerinde görüntüleme yeteneğine sahiptir. Yerinde yüksek büyütme görüntüleme (örneğin, konfokal mikroskop) ile temel zorluk, objektif lensten örneğe birkaç yüz mikronun sınırlı çalışma mesafesidir. Esneme sırasında canlı görüntülemeye izin veren cihazlar, Zeksenindeki gerinim homojenliğini feda eder veya nispeten karmaşıktır ve diğer laboratuvarlarda çoğaltilmesi zordur39,40.
3D hidrojelleri germe yaklaşımı, canlı konfokal mikroskopi sırasında statik veya döngüsel tek eksenli gerilme sağlar. Germe cihazı ('Akıllı Döngüsel Tek Eksenli Sedye – SCyUS' olarak adlandırılır) 3D baskılı parçalar ve düşük maliyetli donanım kullanılarak inşa edilir ve diğer laboratuvarlarda kolay üreme sağlar. Cihaza bağlı, merkezinde geometrik bir kesme ile piyasada bulunan bir silikon kauçuktur. Hidrojel bileşenleri, kesmeyi doldurmak için polimerize edilir. Polimerizasyon sırasında, fibrin veya kollajen gibi biyolojik hidrojeller doğal olarak kesmenin iç duvarlarına yapışır. SCyUS kullanılarak, silikon şerit, kontrollü suşları gömülü 3D hidrojel41'eaktararak, cinsel olarak gerilir.
Bu sistem, mevcut diğer yöntemlere kıyasla benzersiz bir özellik ve avantaj kombinasyonu sağlar. İlk olarak, sistem, hidrojel boyunca Z-homojen deformasyon ile çevrelerinden kalın 3D yumuşak hidrojellerin (>100 μm kalınlığında, <1 kPa sertliği) tek eksenli gerilmesine izin verir. Bu hidrojeller geleneksel çekme teknikleri ile kavranamayacak ve uzatılamayacak kadar yumuşaktır. İkincisi, 3D baskı araştırmacılar tarafından kolayca kullanılabildiğinden ve tasarımda kullanılan elektronikler düşük maliyetli olduğundan, germe cihazı diğer laboratuvarlarda kolayca çoğaltılabilir. Üçüncüsü ve belki de en çekici özelliği, silikon şeritteki geometri ve kesmenin boyutu kolayca manipüle edilebilir, bu da ayarlanabilir gerinim gradyanları ve sınır koşullarının yanı sıra birkaç mikrolitreye kadar çeşitli örnek hacimlerin kullanılmasına izin verir.
Sunulan protokol, fibrin jelinin canlı konfokal mikroskopi altında tek eksenli streçle devam eden 0,5 mm kalınlığında silikon kauçuk şeritlerde ~2 mm çapında disklere kalıplanarak çıkarılmasından oluşur. Aşağıda, geometrik kesime etkili olan suşların ölçülmesi ve analiz edilmesi için deneysel prosedürler, hidrojelde geliştirilen iç suşlar ve çeşitli esneme manipülasyonlarından sonra elde edilen lif hizalaması ayrıntılı olarak ele alınmıştır. Son olarak, hücrelerin hidrojel içine gömülmesi ve kontrollü dış streçlere maruz kalma olasılığı tartışılmaktadır.
Protokol
1. Çözelti hazırlama (önceden yapılacaktır)
- Fibrinojen etiketleme
NOT: Etiketleme adımı sadece fibrin jelinin deformasyonunu analiz etmek isteniyorsa gereklidir. Hücresel deneyler için etiketsiz bir jel kullanmak mümkündür.- 50 mL santrifüj tüpüne 15 mg/mL fibrinojen çözeltisinin (molar oranı 5:1) 1,5 mL'ye 10 mg/mL süksinidil ester floresan boyasının (DMSO'da çözünür) 38 μL'yi ekleyin ve oda sıcaklığında 1 saat boyunca bir çalkalayıcıya yerleştirin. Daha sonra, tüpü 800 x g'da (oda sıcaklığı) 3 dakika santrifüje yerleştirin.
- Bu adımları izleyerek42, yayınlanmamış boyayı ayırmak için dektran jel reçinesi (Malzeme Tablosu)ile dolu bir tuzdan arındırma sütunu aracılığıyla bir önceki adımdan süpernatantı filtreleyin.
- Kolonu 25 mL fibrinojen tampon ile önceden yıkayın.
- Etiketli fibrinojeni 1.1.1 adımından sütuna yavaşça enjekte edin ve filtreye giren kabarcık olmadığından emin olun. İlk ~0,3 mL'lik eluted çözeltisini atın (4-6 damla soluk renkli sıvı). Ardından aşağıdaki 1,0-1,5 mL saflaştırılmış çözeltiyi toplayın (daha ayrıntılı bilgi için üreticinin protokolünü izleyin).
- Elde edilen saflaştırılmış çözeltiyi şırıng tahrikli bir filtre (0,22-0,45 μm) kullanarak sterilize ederek filtrasyon işlemini tamamlayın.
- Sütunu temizlemek ve geri dönüştürmek için 20 mL fibrinojen tampon ile yıkayın ve ardından% 20 etanol 25 mL'de saklayın.
- Elution sonra, elde edilen saflaştırılmış etiketli fibrinojeni, istenen gerilmiş jel sayısına bağlı olarak ~ 7-50 μL'lik küçük aliquotlara bölün. Her gerilmiş 2 mm çapında daire jeli için yaklaşık 3,5 μL fibrinojen hazırlayın (borulama hataları için jel başına 2,5 μL + 1 μL kullanılacaktır).
- Aliquotları -20 °C dondurucuda saklayın. Yaklaşık bir yıla kadar kullanılabilirler (tekrar çözülmesi ve dondurulması önerilmez).
- Bu protokolün geri kalanı için, saflaştırılmış etiketli fibrinojenin yaklaşık 7 μL'yi 4. Bu hacim iki gerilmiş jelin oluşturulması için tasarlanmıştır (jel başına 2,5 μL gereklidir ve numune hazırlamadaki hataları hesaba katmak için 1 μL'lik ekstra bir hacim kullanılır).
NOT: Bu filtreleme prosedürü tipik olarak ilk 15 mg/mL fibrinojen çözeltisini yaklaşık 10 mg/mL'lik son konsantrasyona seyrelter. Seyreltme faktörü, üreticinin protokolünde belirtildiği gibi fibrinojenin başlangıç hacmine ve konsantrasyonuna bağlıdır.
- 7 μL trombin çözeltisi hazırlayın (trombin tamponu kullanarak 2 birim / mL'ye seyreltin, Malzeme Masası)ve 4. adıma kadar buzdolabında (4 °C) saklayın. Bu hacim, iki gerilmiş jelin kesimlerini doldurmak için tasarlanmıştır.
NOT: İç gerinim analizi yapmak için, trombin çözeltisine 1 μm çapında floresan küresel boncuk (suda süspansiyon [% 2 katı madde] artı 2 mM NaN3olarak satın alınır) eklenmelidir (40x hedefi için boncuk:trombinin % 1:25 v/v oranı önerilir). Boncuklar sadece hücrelerin varlığında veya yokluğunda iç gerinim ölçümleri istendiğinde dahil edilmelidir.
2. Silikon şerit hazırlığı
- 0,5 mm kalınlığındaki silikon kauçuğa alın ve şeridin ortasında2 mm çapında delik bulunan 15 x 80 mm 2 şerit halinde kesin (Şekil 1). Mümkünse, yüksek hassasiyet için programlanabilir bir lazer kesici kullanın. Programlanabilir makine mevcut değilse, şerit anahattının kesilmesi için makas yeterlidir ve merkez kesme için küçük bir delik delme yeterlidir.
NOT: Ticari silikon kauçuk genellikle her iki tarafta plastik sargı ile satın alınarak satın alındır. Mümkünse silikonun her iki tarafında orijinal plastik kaplama tutun. Silikon şeritleri önceki bir deneyden yeniden kullanıyorsanız, 0,5 saat boyunca tripsinle tedavi edin, 0,5 saat boyunca 0,2 M NaOH'da bekletin ve ardından 1 saat boyunca% 70 etanol içine batırın. Kullanmadan önce kurumasına izin verin. - En az 20 × 30 mm2boyutlarında sızdırmazlık filmi (hidrofobik) katmanları hazırlayın, böylece silikon şeritten daha geniştirler ve böylece tüm geometrik kesim üzerinde bir conta oluşmasını sağlarlar.
- 10 cm'lik bir tabağı% 70 etanol ile yıkayın ve ardından astarsız hassas görev mendilleriyle silin ve kurulayın (hem steril hem de steril olmayan deneyler için). Bu adım, sızdırmazlık filmi katmanlarının plakaya daha iyi yapışmasını ve hazırlık işlemi sırasında numunenin hareketini kısıtlamasını sağladığından önemlidir.
- Sızdırmazlık filmi katmanlarını yıkanmış 10 cm'lik kabın içine yerleştirin, böylece her bir yemeğe yan yana iki şerit yerleştirmek için yeterli alan vardır (Şekil 2A).
- Plastik sargıyı silikon şeridin bir tarafından çıkarın ve açıkta kalan tarafı sızdırmazlık filmi tabakasına yerleştirin, böylece kesim tamamen sızdırmazlık filmi tabakası ile çevrilidir (Şekil 2B). Daha sonra, temiz eldivenli parmaklar kullanarak kesmeyi çevreleyen alanı kapatmak için silikonu sızdırmazlık filmi tabakasına hafifçe bastırın.
NOT: Silikon ve sızdırmazlık filmi arasında, özellikle de kesmenin etrafında hava cepleri olmadığından emin olun. Bunu, çanağın alt tarafını inceleyerek yapın (Şekil 2C).
- Plastik sargıyı silikon şeridin bir tarafından çıkarın ve açıkta kalan tarafı sızdırmazlık filmi tabakasına yerleştirin, böylece kesim tamamen sızdırmazlık filmi tabakası ile çevrilidir (Şekil 2B). Daha sonra, temiz eldivenli parmaklar kullanarak kesmeyi çevreleyen alanı kapatmak için silikonu sızdırmazlık filmi tabakasına hafifçe bastırın.
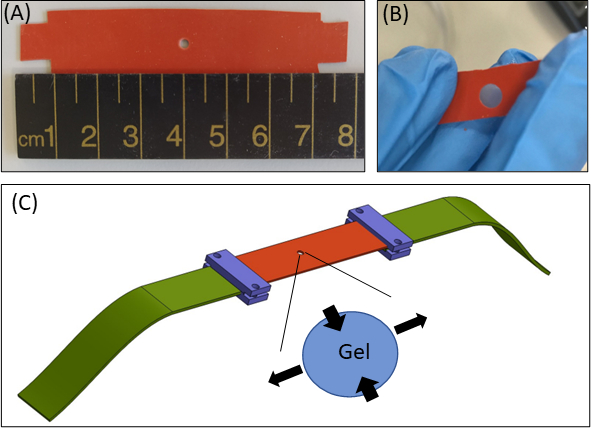
Şekil 1: Hidrojel germe yaklaşımı. (A) 15 × 80 mm2 silikon şerit, şeridin ortasında 2 mm çapında kesilmiş (B) Gömülü fibrin jeli ile dairesel kesilmiş bir silikon şerit. Açıklayıcı amaçlar için, silikondaki kesme, silikon şerit (turuncu), dairesel jel (ortadan kesme) ve silikonu germe cihazına bağlayan kumaş genişleticiler (yeşil) ile germe yaklaşımının gerçek deneylerinden (C) Şematik'ten daha büyüktür. Jelin genişlemiş alanı, silikonun tek eksenli gerilmesine yanıt olarak jelin deformasyonunu gösterir. Basitlik için, jelin kalınlığı boyunca sıkıştırma (Zekseni ) resimde gösterilmez. Şekil 1B ve 1C Roitblat Riba ve ark.41'denuyarlanmıştır.

Şekil 2: Jel polimerizasyondan önce bir sızdırmazlık filmi tabakasına silikon şeridin uygun şekilde yerleştirilmesi örneği. (A) İki sızdırmazlık filmi katmanının 10 cm'lik bir çanağa yerleştirilmesi (B) Silikon şeritlerin sızdırmazlık filmi katmanlarına yerleştirilmesi (C) Kabın alt görünümü, silikon ve sızdırmazlık filmi katmanı arasındaki hava sızdırmazlık gösterir. Sol: Sızdırmazlık filmi tabakasının uygun contası, hava cepleri olmadan kesmenin etrafındaki silikon şeride. Sağ: Sızdırmazlık filmi tabakasının silikon şerit kesimine uygun olmayan sızdırmazlık, kesmenin kenarında hava cepleri ile kesilir. Bu, silikonun altındaki hidrojel bileşenlerinin sızmasına yol açacaktır. Kırmızı ok, hava cebinin oluştuğu bir alanı işaret eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Hücrelerle trombin hazırlama
NOT: Bu adımı yalnızca hidrojel içine hücre gömülmesi isteniyorsa ve steril koşullar altında biyolojik bir davlumbazda(Malzeme Tablası) gerçekleştirin.
- Sterilizasyon: hücresel deneyden bir gün önce, silikon şeritleri ve sızdırmazlık filmi katmanlarını bir gecede% 70 etanol içine yerleştirin ve ardından her iki tarafta 30 dakika boyunca UV sterilizasyonu yapın (10 cm'lik bulaşıklar zaten steril değilse, % 70 etanol yıkamadan sonra 30 dakika boyunca UV ışığı altında sterilize edilmelidir). Protokolde kullanılan UV sistemi biyolojik kaputun içine yerleştirilmiş olandır.
NOT: Alternatif olarak, silikon şeritler üzerinde 260 °C'ye kadar dayanıklı oldukları için bir otoklav sterilizasyon döngüsü (140 °C) yapılabilir. - Hücre konsantrasyonu belirlemek için bir hücre sayımı gerçekleştirin ve ardından hücre peletini 1,5 mL santrifüj tüpünde 7 μL trombin (2 birim/mL) ile santrifüjleyip yeniden askıya alın. 800 hücre/μL trombin hücre konsantrasyonu öneriyoruz. Hücreleri kullanıma kadar soğutun (hücrelere zarar vermemek için yarım saatten fazla tutmayın).
4. Fibrin jellerinin polimerizasyonu
- Buzdolabından 2 Birim/mL trombin & 10 mg/mL etiketli fibrinojen çözeltilerini alın (adım 1'de hazırlanmıştır) ve erişilebilecekleri buzun üzerine yerleştirin.
NOT: Polimerizasyon reaksiyon kinetiğini yavaşlatmak için çözeltiler karıştırma işleminden önce soğuk tutulur. Bu, proteinlerin daha homojen bir şekilde karıştırılmasına izin verir. - Çanak(lar) kuruluyken (adım 2), 2,5 μL etiketli fibrinojen çıkarın ve silikon kesime düzgün bir şekilde borulayın (alt tarafına bağlı sızdırmazlık filmi tabakası ile) böylece kesmenin tüm çevresi fibrinojen ile temas halindedir. Kesmenin alt kenarlarına (sızdırmazlık filmi katmanı ve silikon arasındaki arayüz) özellikle dikkat ederek, çözeltinin herhangi bir yerinde hava ceplerinin veya kabarcıkların oluşmasına izin vermemeye dikkat edin.
- Hemen 2,5 μL trombin alın (hücreli/ boncuksuz) ve pipetle doğrudan kesmedeki fibrinojen çözeltisine (5 μL fibrin son hacme ulaşır). Ardından, ~10 kez dikkatlice yukarı ve aşağı pipetleme yaparak iki çözeltiyi hızlı bir şekilde karıştırın. Karıştırma işlemi sırasında, mümkün olduğunca homojen bir çözüm oluşturmak için ucu tüm birimin etrafında hareket ettinin.
- Polimerizasyon işlemi sırasında hidrojel kurumasın diye her yemeğin kenarına çok az miktarda Fosfat Tampon Salin (PBS) [hücre deneyleri için alternatif olarak hücre ortamı, Malzeme Tablosu]ekleyin. PBS/hücre ortamı ile numuneler arasında temas olmadığından emin olun, çünkü bu numuneye zarar verir.
- Yemeği örtün ve 37 °C'de 30 dakika boyunca inkübatöre yerleştirin.
NOT: Gerekli kuluçka süresi jelin hacmine bağlıdır. Daha büyük hacimler kullanılırsa, kuluçka süresi artmalıdır. - Kabın(lar)ını inkübatörden çıkarın ve tüm jel silikon yapıyı batırarak çanağa PBS/hücre ortamı ekleyin.
- Sızdırmazlık filmi tabakasının şeride yapıştığından emin olarak numune yapılarını tabakadan teker teker dikkatlice kaldırın. Silikonun bir ucundan diğerine hafifçe tavla yaparak sızdırmazlık filmi tabakasını yavaşça silikondan ayırın (Şekil 3). Stres konsantrasyonlarının olabileceği kesime yakın alanlardan çekilmekten kaçının (bu esas olarak dairesel olmayan geometriler için önemlidir). Numuneye zarar vereceğinden, kesme ile herhangi bir temastan kaçının.
- Şeridi, şerit tabakta yüzebilecek şekilde PBS / hücre ortamı ile yemeğe geri yerleştirin. Daha sonra her numunenin durumunu niteliksel olarak değerlendirmek için yemeği (leri) standart bir hücre kültürü mikroskobuna alın. Jeller düzgün olmalı, kesim boyunca sürekli olmalı ve kabarcık olmamalıdır. Şekil 4'ü kılavuz olarak kullanarak, daha fazla analiz için en iyi örnekleri seçin.

Şekil 3: Sızdırmazlık filmi tabakasının silikon şeridin altından uygun şekilde çıkarılması. Kaldırma işlemi yavaşça yapılmalıdır, böylece hidrojel kesmenin iç duvarlarıyla yapışmasını yırtmayacak veya kırmayacaktır. Beyaz ok kaldırma yönünü gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Silikon kesimdeki fibrin jellerinin mikroskobik gözlemi. (A) Düzgün polimerize fibrin jelinin iki örneği. Jelin göreli homojenliğine ve kesme kenarlarına tam yapıştırmaya dikkat edin (B) Örnek polimerizasyon hatasının iki örneği. Üst: Sol alt tarafta oluşan birçok kabarcık ve agregaya dikkat edin. Alt: Jelin kesme kenarlarından ve kesmenin sol alt bölgesindeki agregalardan yırtılmasına dikkat edin. Ölçek çubuğu = 300 μm Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
5. SCyUS cihazına örnek yükleme
- Banyoyu PBS/hücre ortamı ile doldurun (Şekil 5) ve numune jelini taşıyan silikon şeridi üst tarafa yerleştirin, böylece uçlar banyonun her iki tarafında oturur. Banyo, jelin kurumasını önlemek içindir. Kelepçeleri (mor) kumaş şeritlerle (yeşil) birlikte yerleştirin ve sıkın, böylece tüm parçalar merkezde kesimli tek bir düz şerit oluşturacak şekilde bağlanır (Şekil 5).
- SCyUS cihazını alın ve alüminyum sıvıyı iyice ve 22 mm x 40 mm dikdörtgen cam kapak kapağını (No. 1 veya 1.5) takın (Şekil 6Aiii). Kapak fişini sızdırmazlık malzemesi (örneğin vakum yağı) kullanarak kuyunun dibine takın, böylece kuyu sızıntı olmadan sıvı ile doldurulabilir.
- Kuyuyu ~1-2 mL PBS/hücre ortamı ile doldurun ve şerit + kumaş + jel yapıyı (Şekil 6B) cihaza yerleştirin. Kumaş şeridini (2) brakete (1) sıkıştırın, böylece kesme + jel (5) gösterildiği gibi ortadadır, ardından pin-down kesici ucu (4) dikkatlice cihaza yerleştirin ve yerine kilitleyin.
- Ardından, diğer kumaş tarafını mil içine takın (servomotoru takmadan) ve mil içine kilitleyin (Şekil 6C).
- Ekli örnekle birlikte SCyUS cihazını mikroskop aşamasına yerleştirin (Şekil 6C). Mikrodenetleyiciyi (Malzeme Masası) bir USB kablosuyla bilgisayara bağlayın ve servomotor'u mikrodenetleyiciye bağlayın. Bilgisayarda SCyUS denetim modülini açın. Numune artık konfokal mikroskop altında jelin kalınlığının ve lif homojenliğinin yeterliliğini kontrol etmek için görüntülemeye hazırdır.
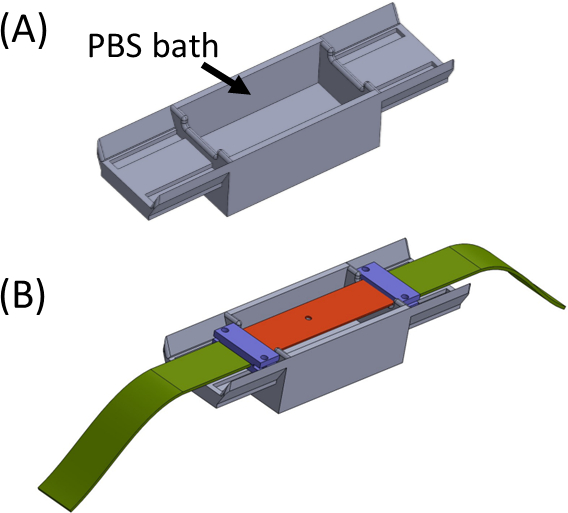
Şekil 5: (A) PBS banyosu içeren jig (3D baskılı) (B) Braketlerin (mor) uygun sıralı bağlanmasını sağlamak ve jelin kurumasını önlemek için jig üzerine şerit yerleşimi. Bu rakam Roitblat Riba ve ark.41'denizinalınarak değiştirilmiştir.
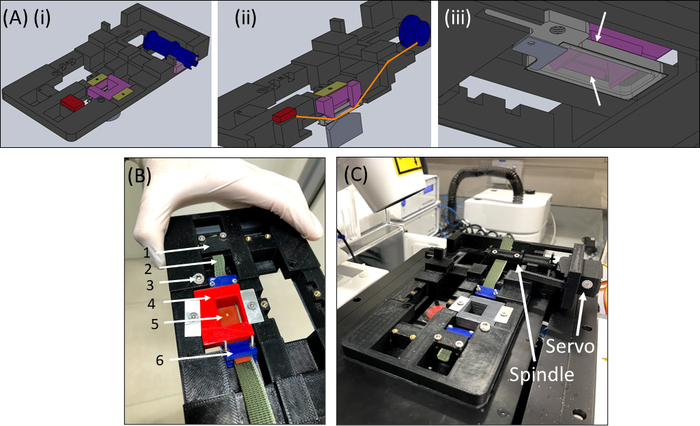
Şekil 6: SCyUS germe cihazı. (A) SCyUS'un ana parçalarının CAD modelinin çeşitli görünümleri: servoya bağlı mil (mavi), statik çapa (kırmızı), silikon şeridi aşağı sabitleyen kesici uç (mor) ve kesici ucun yükselmesini önleyen sabitleyiciler (sarı-yeşil). Sistemin üst görünümü (Ai), şeridin yolunu gösteren sistemin kesik görünümü (Aii) ve cam kapaklı alüminyum sıvı kuyusunun alt görünümü(Aiii). Sıvı kuyusu, ana dişlere takılan bir vidanın dönüşüyle yukarı ve aşağı hareket ettirilebilir. Alüminyum kuyunun yukarı hareketi mor kesici ucun yan kanatları ile sınırlıdır, beyaz oklar tarafından gösterildiği gibi (B) Gerçek sistem: (1) statik çapa (2) yeşil esneyemeyen kumaş (3) alüminyum sıvı kuyu yüksekliği kontrolü için vida (4) kırmızı pin-down kesici uç (5) dairesel kesmeli silikon şerit (6) mavi bağlantı kelepçeleri (C) Konfokal mikroskop üzerine yerleştirilen germe sistemi. Servomotor ve iğ oklarla gösterilir. Bu rakam Roitblat Riba ve ark.41'denizinalınarak değiştirilmiştir.
6. Örnekleme için yeterli jelden emin olun
- Konfokal mikroskobu(Malzeme Tablosu)kullanarak düşük büyütme (10×), düşük çözünürlüklü (~1,4 μm x 1,4 μm piksel boyutu) konfokal Z-yığını (≤10 Z-dilimleri yaklaşık adım boyutuna sahip) alın 10 μm yeterlidir) silikonun kalınlığı boyunca geometrik kesmenin çevresine homojenliği ve yapışıklığı incelemek için 488/543/561 lazerleri kullanarak tüm jelin karo görüntüsü (Şekil 7A-B). Aşağıdaki adımlar için bu Zyığını görüntüsünü harita olarak kullanın.
- Düşük çözünürlüklü canlı görüntüleme kullanarak, jeli tarayın ve kesmenin iç duvarlarına tam yapışıklık gözyaşı veya kabarcık olmadan belirgin olduğu endüşük Z pozisyonunu belirleyin ve mikroskobun Z konumunu (Zl)not edin. Jelin çevresi boyunca silikona tam yapışıklığını belirlemek için, jelin floresan etiketinin arayüzünü ve mikroskop altında silikon şeridini (koyu arka plan) tarayın (Şekil 7C).
- Jelde artık süreklilik kalmadan Zyönünde yukarı hareket edin ve Zkonumuna dikkat edin (Zu):
- Z yönünün üst sınırını (Zu) alt sınırdan (Zl) çıkarın. Bu, numunenin referans kalınlığıdır (Zo):

Zo ≥ 100 μm ise jel analiz için tatmin edici olarak kabul edilir. Silikon kesme kalınlığının yaklaşık 500 μm olduğunu, ancak kesimdeki jel polimerizasyonunun tipik olarak daha küçük bir jel kalınlığı ile sonuçladığını unutmayın. 100 μm, jelin silikon kesimden yırtılması veya kopması olmadan istikrarlı bir germe işlemi sağlamak için önerilen minimum kalınlıktır.
NOT: Farklı XY konumlarında, jelin kalınlığı değişebilir. Protokolün bu bölümü jelin minimum kalınlığını ölçerek jel kalitesini belirlememize ve germe için yeterli olup olmadığını belirtmemize izin verir. Ayrıca, jelin merkezini bulmak, statik veya dinamik olsun, germe sonrasına dönmek için bir referans noktası sağlar.

Şekil 7: Jel homojenliği. Karo görüntüleri, konfokal mikroskop yazılımı (Malzeme Tablosu) (A) Yanlış trombin ve fibrinojen karıştırma pre-polimerizasyonu nedeniyle nispeten inhomogeneöz lif yoğunluğuna sahip bir fibrin jel örneğinin tek dikişli karo Zdilim görüntüsü kullanılarak yakalanmış ve dikilmiştir. Bu jel güvenilir bir analiz sağlamayacaktır (B) Nispeten homojen lif yoğunluğuna sahip bir fibrin jel örneğinin tek bir dikişli karo Zdilim görüntüsü. Bu, esneme deneyleri için kabul edilebilir bir jeldir. Görüntüler için ölçek çubuğu A & B 200 μm (C) Floresan etiketli jel (kırmızı) ve silikon (siyah arka plan) arasındaki arayüzü yakınlaştırın. Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
7. SCyUS operasyonu, germe ve görüntüleme
- Numunenin tatmin edici kalitede olduğu ve SCyUS cihazında düzgün bir şekilde ayarlandıklarına göre, numunenin önceden gerilmiş konumunu belirleyin. Bu, konfokal mikroskop altında canlı görüntüleme kullanılarak elde edilir (adım 6.2'ye benzer).
- Sıfıra Git Servo Pos düğmesine tıklayarak servomotorun sıfır konumunda olduğundan emin olun (Şekil 8A'ya tıklayın ve Şekil 8B'nin sıfır görüntülediğinden emin olun) ve Şekil 6C'degörüldüğü gibi germe cihazına takın.
NOT: Bu adımı, numuneye fazla gerilim koymamak için yavaşça ve dikkatli bir şekilde yapın. - Numuneyi görüntüleme sırasında, kesmenin sağ tarafının hareket ettiği gözlemlenene kadar +1 düğmesine tıklayarak motoru saat yönünde bir derece(Şekil 8C)hareket ettirin. Ardından, -1 düğmesine tıklayarak hareketi (Şekil 8D) sondan bir önceki adım konumuna geri döndür. Bu, örneğin minimum gerilim altında olduğunu doğrular. Referans konumunu ayarlamak için Min Servo Konumunu Ayarla düğmesine (Şekil 8E) tıklayın. Min Servo Konumuna Git düğmesine ( Şekil 8F ) tıklayarak istediğiniz zaman referans konumuna dönmekmümkündür.
NOT: Hatayı en aza indirmek için bu adım için yüksek büyütme hedefi (≥40×) kullanılması önerilir. - Tüm jel alanının tek Z dilimli karo görüntüsünü yüksek büyütme (40×), yüksek çözünürlüklü (~0,2 μm × 0,2 μm piksel boyutu) yakalayın. Bu, işlem sonrası analiz için referans görüntü olarak kullanılacaktır. Jel kalınlığının ortasında tek bir Zdilim görüntüsü yakalamanız önerilir (Eq. 1'den Zo kullanarak), bu, gerildikten sonra yaklaşık olarak aynı Zkonumuna geri dönülmesine izin verecektir. Ayrıca, tüm jel alanının yüksek çözünürlüklü karo görüntülerinin önemli zaman aldığını (~20-30 dk) göz önünde bulundurun.
- Şimdi örnek statik germe için hazır. GUI'de bir seferde bir derece(Şekil 8C)ilerleterek servomotor'u istenen streç büyüklüğüne ayarlayın (bunu yavaşça, yaklaşık 1 derece / saniye gerçekleştirin).
- Sıfıra Git Servo Pos düğmesine tıklayarak servomotorun sıfır konumunda olduğundan emin olun (Şekil 8A'ya tıklayın ve Şekil 8B'nin sıfır görüntülediğinden emin olun) ve Şekil 6C'degörüldüğü gibi germe cihazına takın.
- Analizin istendiği her streç büyüklüğünde, işlem sonrası analiz için tüm jel alanının tek bir Z dilimi yüksek çözünürlüklü karo görüntüsünü yakalayın. 6.2 adımına benzer şekilde, jel (kırmızı) ve silikon (koyu arka plan) arasındaki arayüzü tarayarak, önceki streç büyüklüğündeki yapışıklıkta değişiklikler arayarak, jelin çevresi boyunca silikondan ayrılmadığını doğrulayın.
NOT: Motorun aktivasyonu sırasında, X-Y'deki jel konumunu takip etmek için canlı görüntüleme kullanın (düşük çözünürlüklü, düşük büyütme ayarlarıyla). Jel, jelin tabanının yükseldiği bir Z-Poisson etkisi yaşar, bu nedenle mikroskobun Zkonumu da her streç büyüklüğü için jel kalınlığının yaklaşık merkezine ayarlanmalıdır. Bu, her streç büyüklüğü için Zo (Eq. 1) yeniden hesaplanaarak elde edilebilir. Zyönünde esneme nispeten homojen olduğundan, jelin tam merkez derinliğini bulmak kritik değildir.
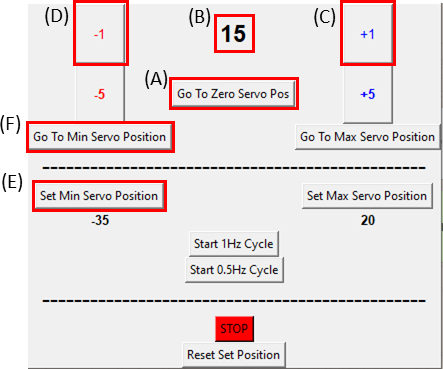
Şekil 8: SCyUS kontrol modülü için GUI. (A) Motorun derece olarak konumu. Değer -90° ile 90° (B) 'Minimum Servo Konumunu Ayarla' arasında değişmektedir. Bu düğme, Sıfır Servo Konumu (C) 'Artı 1°' düğmesinden farklı yeni bir referans konumu ayarlamak için önceden ayarlanmış bir minimum konum sağlar, servo motoru bir derece saat yönünde hareket ettirir (D) 'Eksi 1°' düğmesi servo motoru bir derece hareket ettirir saat yönünün tersine (E) 'Sıfır konumuna git' düğmesi servomotor konumunu 0° olarak ayarlar ([A] sıfıra ayarlanır) (F) 'Minimum servo konumuna git' düğmesi servomotor'u kullanıcı tanımlı 'Min' konumuna taşır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
8. İşlem sonrası dış gerinim ölçümleri
- Kesme sınırlarının etkili suşlarını ölçmek için, kenardan kenara uzunlukları Yekseninin(Şekil 9A)merkezindeki streç yönde(Xekseni) ölçün.
- Esneme öncesi görüntüyü görüntü işleme yazılımına (ImageJ FIJI43)yükleyin ve merkezdeki deliğin eksenel uzunluğu ( ) olarak tanımlanan en büyük kenardan
 kenara mesafeyi ölçün.
kenara mesafeyi ölçün. - Yukarıdan aşağıya en büyük mesafeyi dik mesafe ( ) olarak
 tanımlayın.
tanımlayın. - Tüm esneme aralığı görüntüleri için bu işlemi tekrarlayın ve kesme çevresinin eksenel ( ) ve dik ( ) mesafelerini hesaplayın
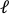
 ( Şekil9A, alt) ve ardından kesme kenarlarının suşlarını bulmak için aşağıdaki hesaplamaları yapın:
( Şekil9A, alt) ve ardından kesme kenarlarının suşlarını bulmak için aşağıdaki hesaplamaları yapın:
- Esneme öncesi görüntüyü görüntü işleme yazılımına (ImageJ FIJI43)yükleyin ve merkezdeki deliğin eksenel uzunluğu ( ) olarak tanımlanan en büyük kenardan
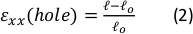

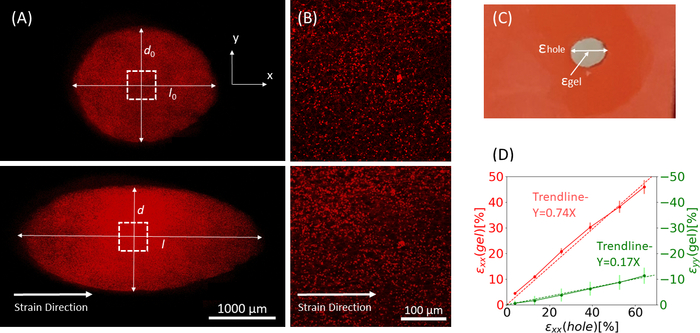
Şekil 9: Silikon şeridin dış gerilmesine bağlı jel suşları. (A) Gerilmemiş bir fibrin jelinin X-Y kesitini (üstte) ve εdeliğin uygulanmasından sonra = x yönü boyunca (altta) % 64 gerinim. Jel floresan boncuklarla gömülüdür. εdeliğin hesaplanmasında kullanılan ilgili d ve l uzunlukları görüntülerde belirtilmiştir (B) A (C) ile işaretlenmiş kesik kare alanın yakınlaştırma görüntüleri Bu çalışmada dikkate alınan gerinim tiplerinin illüstrasyonu: εdelik, maksimum çapta kesimin eksenel zorlanmasıdır, ve ε jeljelin ortasındaki eksenel gerinimdir (boncuk agrega konumları ile ölçüldüğü gibi) (D) εdelik ile εjel arasında hem xx yönünde (kırmızı çizgi) hem de yy yönünde (yeşil çizgi) doğrusal bir ilişki bulunmuştur. Bu rakam Roitblat Riba ve ark.41'denizinalınarak uyarlanmıştır.
9. Fiber oryantasyon analizi
- Lifli jelin artan streç büyüklüklerine yapısal tepkisini karakterize etmek için lif hizalamasının nicelleştirilmesini kullanın. ImageJ FIJI yazılımı (NIH)43'e yüksek çözünürlüklü görüntüler yükleyin ve ardından OrientationJ (EPFL)44 modülünü kullanarak analiz edin (Ayarlar: Gauss degradesi ve 3 piksel penceresi, Şekil 10).
- Yönlendirme histogramının 2D Nematik Düzen Parametresini (NOP) şu şekilde hesaplayın:45
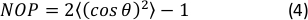
NOT: NOP = 1 değeri eksenel yön boyunca mükemmel hizalamayı (sıfır açısı) ve NOP = 0 izotropiyi gösterir. Yönlendirme açısı, φ, görüntü analizi yoluyla elde edilen ve OrientationJ belgelerinde tam olarak tanımlanan gerinim eksenine (x ekseni) göre fiber açıdır. 44
- Yönlendirme histogramının 2D Nematik Düzen Parametresini (NOP) şu şekilde hesaplayın:45

Şekil 10: FIJI ImageJ yazılımı kullanılarak fiber oryantasyon analizi. (A) 'OrientationJ'in bulunabileceği 'Eklentiler' açılır menüsünün konumunu gösteren bir ok ile ImageJ Ana Menüsü. 'OrientationJ' genişletilmiş menüsünün altında, 'OrientationJ Distribution' seçeneğine tıklayın (B) OrientationJ'in Dağıtım modülü. 'Yerel pencere σ'ı 3 piksele ve 'Degrade'yi 'Gauss' olarak ayarlayın. Ardından 'Çalıştır' düğmesine (kırmızı ok) basın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
10. Manuel iç jel gerinim analizi
- Gömülü boncuklu bir hidrojelin canlı yüksek büyütme görüntülemesini gerçekleştirirken, her streç büyüklüğünden sonra aynı konuma dönmek için kolayca tanınabilir özelliklere (örneğin, boncukların agregaları) sahip bir ilgi alanını (ROI) manuel olarak bulun.
NOT: Z yönünde sıkıştırma (Poisson etkisi), esneme arttıkça boncuk yoğunluğunda bir artışa neden olabilir, bu nedenle yeterince büyük boncuk agregalarını seçmenizi öneririz, bu nedenle açıkça tanımlanabilirler. Bu protokol, fibrin jelinin orta bölgesinin analizini gerektirir, ancak herhangi bir bölge seçilebilir. - Uzatma öncesi konumda (adım 6), seçilen yatırım getirisinin yüksek çözünürlüklü Zyığını görüntüsünü yakalayın. İstenen her esneme aralığından sonra aynı yatırım getirisine dönün ve görüntü yakalama işlemini tekrarlayın.
- Görüntüleri alın ve ImageJ'e aktarın. Yatırım getirisinde, görünür her boncuk toplamının X-Y piksel konumunu kaydedin. Kaydedilen verileri bir elektronik tabloya aktarın.
- Her agrega çifti arasındaki mesafeleri ölçün ve bunları referans görüntüdeki aynı çiftlerin mesafeleriyle karşılaştırın, böylece X ve Y yönlerindeki suşların hesaplanmasına izin verin.
NOT: Jel gerilirken sürekli bir gerçek zamanlı film kaydedilirse (statik görüntü yakalama yerine), daha önce gösterildiği gibi dijital görüntü veya hacim korelasyonları (DIC/DVC) yöntemleriyle gerinimlerin otomatik analiziyapılabilir 46,47. Bununla birlikte, otomatik DIC / DVC analizinin bu ayarda zor olduğu belirtilmelidir, çünkü Zyığını sadece X-Y düzleminde değil, aynı zamanda Poisson etkisi (sıkıştırma) nedeniyle Zyönünde de hareket ediyor ve kaydedilen film sırasında önemli sürüklenmeleri hesaba katıyor.
Sonuçlar
1 μm floresan boncuk ile gömülü 3D fibrin hidrojel taşıyan silikon şeride uygulanan artan büyüklüklerin statik streçlerinden elde edilen temsili veriler Şekil 9'dagösterilmiştir. Analiz, silikon streçlerin, jel içindeki gelişmiş suşların yanı sıra kesmenin geometrik değişiklikleri üzerindeki etkisini göstermektedir. Tüm jelin Z-yığıngörüntüleri, eliptik geometriye kesilmiş orijinal dairenin deformasyonunu değerlendirmek için kullanılır ...
Tartışmalar
Burada sunulan yöntem ve protokol büyük ölçüde Roitblat Riba ve ark.41 tarafından yapılan önceki çalışmamıza dayanmaktadır.
Sunulan yöntemin mevcut yaklaşımlara göre en büyük avantajları arasında çok yumuşak 3D hidrojellerin (~100 Pa'nın Elastik Modülü) çevrelerinden ve canlı konfokal görüntüleme altında zorlanma olasılığı yer almaktadır. Diğer yöntemler genellikle Zekseninde gerinim alanları uygulama ...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Burada yer alan bazı rakamlar Telif Hakkı Temizleme Merkezi'nden izin alarak uyarlanmıştır: Springer Nature, Annals of Biomedical Engineering. Canlı mikroskopi görüntülemeyi mümkün kılarken 3D hidrojelleri tek tip z ekseni suşlarıyla germe, A. Roitblat Riba, S. Natan, A. Kolel, H. Rushkin, O. Tchaicheeyan, A. Lesman, Telif Hakkı© (2019).
https://doi.org/10.1007/s10439-019-02426-7
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 546 carboxylic acid, succinimidyl ester | Invitrogen | A20002 | |
| Cell Medium (DMEM High Glucose) | Biological Industries | 01-052-1A | Add 10% FBS, 1% PNS, 1% L-Glutamine, 1% Sodium Pyruvate |
| Cover Slip #1.5 | Bar-Naor Ltd. | BN72204-30 | 22×40 mm |
| DIMETHYL SULPHOXIDE 99.5% GC DMSO | Sigma-Aldrich Inc. | D-5879-500 ML | |
| Dulbecco's Phosphate-Buffered Saline | Biological Industries | 02-023-1A | |
| EVICEL Fibrin Sealant (Human) | Omrix Biopharmaceuticals | 3902 | Fibrinogen: 70 mg/mL, Thrombin: 800-1200 IU/mL |
| Fibrinogen Buffer | N/A | Recipe for 1L: 7g NaCl, 2.94g trisodium citrate dihydrate, 9g glycine, 20g arginine hydrochloride & 0.15g calcium chloride dihydrate. Bring final volume to 1L with PuW (pH 7.0-7.2) | |
| Fluorescent micro-beads FluoSpheres (1 µm) | Invitrogen | F8820 | Orange (540/560) Provided as suspension (2% solids) in water plus 2 mM sodium azide |
| High-Temperature Silicone Rubber | McMaster-Carr | 3788T41 | 580 µm-thick E = 1.5 Mpa Poisson Ratio = 0.48 Tensile Strength = 4.8 MPa Upper limit of stretch = +300% engineering strain |
| HiTrap desalting column 5 mL (Sephadex G-25 packed) | GE Healthcare | 17-1408-01 | |
| HIVAC-G High Vacuum Sealing Compound | Shin-Etsu Chemical Co., Ltd. | HIVAC-G 100 | |
| ImageJ FIJI software39 | National Institute of Health, Bethesda, MD | Version 1.8.0_112 | |
| Microcontroller (Adruino Uno + Adafruit Motorshield v2.3) | Arduino/Adafruit | Arduino-DK001/Adafruit-1438 | |
| MicroVL 21R Centrifuge | Thermo Scientific | 75002470 | |
| Parafilm | Bemis | PM-996 | |
| Primovert Light Microscope | Carl Zeiss Suzhou Co., Ltd. | 491206-0011-000 | |
| SCyUS CAD (Solidworks) | Dassault Systèmes | N/A | |
| SCyUS Code37 | N/A | N/A | |
| Servomotor - TowerPro SG-5010 | Adafruit | 155 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | For 50 mL tubes |
| Sterile 10 cm non-culture plates | Corning | 430167 | |
| Thrombin buffer | N/A | Recipe for 1L: 20g mannitol, 8.77g NaCl, 2.72g sodium acetate trihydrate, 24 mL 25% Human Serum Albumin, 5.88g calcium chloride. Bring final volume to 1L with PuW (pH 7.0) | |
| Trypsin EDTA Solution B (0.25%), EDTA (0.05%) | Biological Industries | 03-052-1B | |
| USB Cable (Type B Male to Type A Male) | N/A | N/A | |
| Zeiss LSM 880 Confocal Microscope | Carl Zeiss AG | 2811000417 | |
| ZEN 2.3 SP1 FP3 (black) | Carl Zeiss AG | Release Version 14.0.0.0 |
Referanslar
- Bleuel, J., Zaucke, V., Bruggemann, G. P., Niehoff, A. Effects of cyclic tensile strain on chondrocyte metabolism: a systematic review. PLoS ONE. 10, 0119816 (2015).
- Pennisi, C. P., Olesen, C. G., de Zee, M., Rasmussen, J., Zachar, V. Uniaxial cyclic strain drives assembly and differentiation of skeletal myocytes. Tissue Engineering Part A. 17, 2543-2550 (2011).
- Grodzinsky, A. J., Levenston, M. E., Jin, M., Frank, E. H. Cartilage Tissue Remodeling in Response to Mechanical Forces. Annual Review of Biomedical Engineering. 2 (1), 691-713 (2000).
- Munster, S., et al. Strain history dependence of the nonlinear stress response of fibrin and collagen networks. Proceedings of the National Academy of Sciences of the USA. 110, 12197-12202 (2013).
- Vader, D., Kabla, A., Weitz, D., Mahadevan, L. Strain-induced alignment in collagen gels. PLoS ONE. 4, 5902 (2009).
- Badylak, S. F. The extracellular matrix as a scaffold for tissue reconstruction. Seminars in Cell & Developmental Biology. 13 (5), 377-383 (2002).
- Natan, S., Koren, Y., Shelah, O., Goren, S., Lesman, A. . Molecular Biology of the Cell. 31 (14), 1474-1485 (2020).
- Ban, E., et al. Mechanisms of Plastic Deformation in Collagen Networks Induced by Cellular Forces. Biophysical Journal. 114 (2), 450-461 (2018).
- Kim, J., et al. Stress-induced plasticity of dynamic collagen networks. Nature Communications. 8, 842 (2017).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Basu, A., Janmey, P. A., Yodh, A. G. Non-affine deformations in polymer hydrogels. Soft Matter. 8, 8039-8049 (2012).
- Muiznieks, L. D., Keeley, F. W. Molecular assembly and mechanical properties of the extracellular matrix: A fibrous protein perspective. Biochimica et Biophysica Acta. 1832, 866-875 (2012).
- Brown, A. E. X., Litvinov, R. I., Discher, D. E., Purohit, P. K., Weisel, J. W. Multiscale mechanics of fibrin polymer: gel stretching with protein unfolding and loss of water. Science. 325, 741-744 (2009).
- Carroll, S. F., Buckley, C. T., Kelly, D. J. Cyclic tensile strain can play a role in directing both intramembranous and endochondral ossification of mesenchymal stem cells. Frontiers in Bioengineering and Biotechnology. 5, 73 (2017).
- Livne, A., Bouchbinder, E., Geiger, B. Cell reorientation under cyclic stretching. Nature Communications. 5, 3938 (2014).
- Wang, L., et al. Patterning cellular alignment through stretching hydrogels with programmable strain gradients. ACS Applied Materials & Interfaces. 7, 15088-15097 (2015).
- Xu, G. K., Feng, X. Q., Gao, H. Orientations of Cells on Compliant Substrates under Biaxial Stretches: A Theoretical Study. Biophysical Journal. 114 (3), 701-710 (2017).
- Chagnon-Lessard, S., Jean-Ruel, H., Godin, M., Pelling, A. E. Cellular orientation is guided by strain gradients. Integrative Biology (United Kingdom). 9 (7), 607-618 (2013).
- Lu, J., et al. Cell orientation gradients on an inverse opal substrate. ACS Applied Materials & Interfaces. 7 (19), 10091-10095 (2015).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125, 3015-3024 (2012).
- Bono, N., et al. Unraveling the role of mechanical stimulation on smooth muscle cells: a comparative study between 2D and 3D models. Biotechnology and Bioengineering. 113, 2254-2263 (2016).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8, 839-845 (2007).
- Riehl, B. D., Park, J. H., Kwon, I. K., Lim, J. Y. Mechanical stretching for tissue engineering: two-dimensional and three-dimensional constructs. Tissue Engineering Part B: Reviews. 18, 288-300 (2012).
- Flexcell. Linear Tissue Train Culture Plate. Flexcell. , (2019).
- Flexcell. Tissue Train. Flexcell. , (2019).
- CellScale. MCT6 Stretcher. CellScale. , (2019).
- STREX. STB-150. STREX. , (2019).
- STREX. Stretch Chambers. STREX. , (2019).
- Kamble, H., Barton, M. J., Jun, M., Park, S., Nguyen, N. T. Cell stretching devices as research tools: engineering and biological considerations. Lab on a Chip. 16, 3193-3203 (2016).
- Weidenhamer, N. K., Tranquillo, R. T. Influence of cyclic mechanical stretch and tissue constraints on cellular and collagen alignment in fibroblast-derived cell sheets. Tissue Engineering Part C: Methods. 19, 386-395 (2013).
- Yung, Y. C., Vandenburgh, H., Mooney, D. J. Cellular strain assessment tool (CSAT): precision-controlled cyclic uniaxial tensile loading. Journal of Biomechanics. 42, 178-182 (2009).
- Chen, K., et al. Role of boundary conditions in determining cell alignment in response to stretch. Proceedings of the National Academy of Sciences of the USA. 115, 986-991 (2018).
- Heher, P., et al. A novel bioreactor for the generation of highly aligned 3D skeletal muscle-like constructs through orientation of fibrin via application of static strain. Acta Biomaterialia. 24, 251-265 (2015).
- Foolen, J., Deshpande, V. S., Kanters, F. M. W., Baaijens, F. P. T. The influence of matrix integrity on stress-fiber remodeling in 3D. Biomaterials. 33, 7508-7518 (2012).
- Walker, M., Godin, M., Pelling, A. E. A vacuum-actuated microtissue stretcher for long-term exposure to oscillatory strain within a 3D matrix. Biomedical Microdevices. 20, 43 (2018).
- Zhao, R. G., Boudou, T., Wang, W. G., Chen, C. S., Reich, D. H. Decoupling cell and matrix mechanics in engineered microtissues using magnetically actuated microcantilevers. Advanced Materials. 25, 1699-1705 (2013).
- Li, Y. H., et al. Magnetically actuated cell-laden micro-scale hydrogels for probing strain-induced cell responses in three dimensions. NPG Asia Materials. 8, 238 (2016).
- Li, Y. H., et al. An approach to quantifying 3D responses of cells to extreme strain. Scientific Reports. 6, 19550 (2016).
- Humphrey, J. D., et al. A theoretically-motivated biaxial tissue culture system with intravital microscopy. Biomechanics and Modeling in Mechanobiology. 7, 323-334 (2008).
- Niklason, L. E., et al. Enabling tools for engineering collagenous tissues integrating bioreactors, intravital imaging, and biomechanical modeling. Proceedings of the National Academy of Sciences of the USA. 107, 3335-3339 (2010).
- Roitblat Riba, A., et al. Straining 3D hydrogels with uniform z-axis strains while enabling live microscopy imaging. Annals of Biomedical Engineering. , (2019).
- Gomez, D., Natan, S., Shokef, Y., Lesman, A. Mechanical interaction between cells facilitates molecular transport. Advanced Biosystems. 3 (12), 1900192 (2019).
- Schindelin, J., et al. Fiji: an open- source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- EPFL Switzerland. OrientationJ plug in. EPFL Switzerland. , (2019).
- Goren, S., Koren, Y., Xu, X., Lesman, A. Elastic anisotropy governs the decay of cell-induced displacements. Biophysical Journal. 118 (5), 1152-1164 (2019).
- Notbohm, J., Lesman, A., Tirrell, D. A., Ravichandran, G. Quantifying cell-induced matrix deformation in three dimensions based on imaging matrix fibers. Integrative Biology. 7 (10), 1186-1195 (2015).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. Journal of Cell Biology. 205 (2), 155-162 (2014).
- Cha, C. Y., et al. Tailoring Hydrogel Adhesion to Polydimethylsiloxane Substrates Using Polysaccharide Glue. Angewandte Chemie International Edition. 52, 6949-6952 (2019).
- Wirthl, D., et al. Instant tough bonding of hydrogels for soft machines and electronics. Science Advances. 3, (2017).
- Juarez-Moreno, J. A., Avila-Ortega, A., Oliva, A. I., Aviles, F., Cauich-Rodriguez, J. V. Effect of wettability and surface roughness on the adhesion properties of collagen on PDMS films treated by capacitively coupled oxygen plasma. Applied Surface Science. 349, 763-773 (2015).
- Kim, H. T., Jeong, O. C. PDMS surface modification using atmospheric pressure plasma. Microelectronic Engineering. 88, 2281-2285 (2011).
- Prasad, B. R., et al. Controlling cellular activity by manipulating silicone surface roughness. Colloids and Surfaces. 78, 237-242 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır