A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זן מבוקר של הידרוג'ל תלת מימדי תחת הדמיה מיקרוסקופית חיה
In This Article
Summary
השיטה המוצגת כוללת מתיחה חד-אקסיאלית של הידרוג'לים רכים תלת-ממדיים המוטמעים בגומי סיליקון תוך מתן אפשרות למיקרוסקופיה קונפוקלית חיה. אפיון של זני הידרוג'ל חיצוניים ופנימיים, כמו גם יישור סיבים מודגמים. המכשיר והפרוטוקול שפותחו יכולים להעריך את התגובה של תאים למשטרי זנים שונים.
Abstract
כוחות חיצוניים הם גורם חשוב בהיווצרות רקמות, פיתוח ותחזוקה. ההשפעות של כוחות אלה נחקרים לעתים קרובות באמצעות שיטות מתיחות במבחנה מיוחדות. מערכות זמינות שונות משתמשות באלונקות דו-ממדיות מבוססות מצע, בעוד שהנגישות של טכניקות תלת-ממד למאמץ הידרוג'לים רכים מוגבלת יותר. כאן, אנו מתארים שיטה המאפשרת מתיחה חיצונית של הידרוג'לים רכים מהיקפם, תוך שימוש ברצועת סיליקון אלסטית כנשא המדגם. מערכת המתיחה המנוצלת בפרוטוקול זה בנויה מחלקים המודפסים בתלת-ממד ומאלקטרוניקה בעלות נמוכה, מה שהופך אותה לפשוטה וקלה לשכפול במעבדות אחרות. התהליך הניסיוני מתחיל עם polymerizing עבה (>100 מיקרומטר) הידרוג'לים פיברין רך (מודולוס אלסטי של ~ 100 Pa) בחיתוך במרכז רצועת סיליקון. לאחר מכן, מבני ג'ל סיליקון מחוברים למכשיר המתיחה המודפס ומונחים על שלב המיקרוסקופ הקונפוקל. תחת מיקרוסקופיה חיה מופעל מכשיר המתיחה, והג'לים מצולמים בסדרי גודל שונים של מתיחות. לאחר מכן נעשה שימוש בעיבוד תמונה לכימות עיוותי הג'ל הנובעים מכך, תוך הפגנת זנים הומוגניים יחסית ויישור סיבים בעובי התלת-ממדי של הג'ל (ציר Z). היתרונות של שיטה זו כוללים את היכולת להתאמץ הידרוג'לים רכים מאוד בתלת מימד תוך ביצוע במיקרוסקופיה situ, ואת החופש לתפעל את הגיאומטריה ואת גודל המדגם על פי צרכי המשתמש. בנוסף, עם הסתגלות נכונה, שיטה זו יכולה לשמש כדי למתוח סוגים אחרים של הידרוג'לים (למשל, קולגן, פוליאקרילאמיד או פוליאתילן גליקול) והוא יכול לאפשר ניתוח של תאים ותגובת רקמות לכוחות חיצוניים בתנאים ביומטיים יותר 3D.
Introduction
תגובת רקמות לכוחות מכניים היא חלק בלתי נפרד ממגוון רחב של פונקציות ביולוגיות, כולל ביטויגנים 1, התמיינות תאים2, ושיפוץרקמות 3. יתר על כן, שינויים הנגרמים על ידי כוח במטריצה חוץ תאית (ECM) כגון יישור סיבים ו densification יכול להשפיע על התנהגות התא היווצרותרקמות 4,5,6. מבנה הרשת הסיבית של ECM יש תכונות מכניות מסקרנות, כגון גמישות לא ליניארית, עיוות שאינו affine ועיוותים פלסטיק7,8,9,10,11,12. מאפיינים אלה משפיעים על האופן שבו תאים ומיקרו-וירוסים הסובבים אותם מגיבים לכוחות מכניים חיצוניים13,14. הבנת האופן שבו ה-ECM והרקמות מגיבים לכוחות מכניים תאפשר התקדמות בתחום הנדסת הרקמות ובפיתוח מודלים חישוביים ותיאורטיים מדויקים יותר.
השיטות הנפוצות ביותר למתוח דגימות מכני התמקדו מצעים דו-מימדיים עמוסי תאים כדי לחקור את ההשפעות על התנהגות התא. אלה כוללים, למשל, החלת זן על מצעים polydimethylsiloxane (PDMS) וניתוח זוויות כיוונון מחדש של התא ביחס לכיוון המתיחה15,16,17,18,19. עם זאת, שיטות החוקרות את התגובה של הידרוג'לים משובצים בתאים תלת-ממדיים למתיחה חיצונית, מצב המחקה באופן הדוק יותר מיקרו-וירוס רקמות, מוגבלות יותר. ההתקדמות לקראת שיטות מתיחה תלת-ממדיות היא בעלת חשיבות מיוחדת מכיוון שהתאים מתנהגים באופן שונה במצעים דו-ממדיים בהשוואה למטריצות תלת-ממדיות20. התנהגויות אלה כוללות יישור מחדש של התאים, רמות ביטוי חלבון ודפוסיהגירה 21,22,23.
שיטות והתקנים המאפשרים מתיחה מדגם 3D כוללים הן מסחרי זמין24,25,26,27,28 ואלה שפותחו למחקר מעבדה29. שיטות אלה משתמשות בצינורות סיליקון נפוחים30, תאים מרובי בארות31, מלחציים26,32, bioreactors11,33, cantilevers34,35,36, ומגנטים37,38. טכניקות מסוימות יוצרות מתיחה המעוותת באופן מקומי הידרוג'לים תלת-ממדיים, למשל על ידי משיכת מחטים משתי נקודות בודדות בג'ל5, בעוד שאחרות מאפשרות עיוות של כל החלק הארי של הג'ל16. יתר על כן, רוב המערכות הללו מתמקדות בניתוח שדה המתח במישור X-Y, עם מידע מוגבל על שדה המתח בכיוון Z. בנוסף, רק קומץ של התקנים אלה מסוגלים מיקרוסקופי בהדמיה situ. האתגר העיקרי בהדמיית הגדלה גבוהה (למשל, מיקרוסקופ קונפוקל) הוא מרחק העבודה המוגבל של כמה מאות מיקרון מהעדשה האובייקטיבית למדגם. מכשירים המאפשרים הדמיה חיה במהלך מתיחה מקריבים את אחידות המתח בציר Zאו מורכבים יחסית וקשים להתרבות במעבדות אחרות39,40.
גישה זו למתוח הידרוג'לים תלת-ממדיים מאפשרת זן חד-מיני סטטי או מחזורי במהלך מיקרוסקופיה קונפוקלית חיה. מכשיר המתיחה (המכונה 'אלונקה חד-קסיאלית מחזורית חכמה – SCyUS') בנוי באמצעות חלקים מודפסים בתלת-ממד וחומרה בעלות נמוכה, המאפשרים רבייה קלה במעבדות אחרות. מחובר למכשיר גומי סיליקון זמין מסחרית עם חתך גיאומטרי במרכזו. רכיבי הידרוג'ל הם פולימרים כדי למלא את החיתוך. במהלך פילמור, הידרוג'לים ביולוגיים, כגון פיברין או קולגן, דבקים באופן טבעי בקירות הפנימיים של החתך. באמצעות SCyUS, רצועת הסיליקון נמתחת באופן לא סיאקסי, ומעבירה זנים מבוקרים להידרוגל 3D משובץ41.
מערכת זו מאפשרת שילוב ייחודי של תכונות ויתרונות בהשוואה לשיטות קיימות אחרות. ראשית, המערכת מאפשרת מתיחה חד-אקסיאלית של הידרוג'לים עבים של 3D (בעובי >100 מיקרומטר, נוקשות <1 kPa) מהפריפריה שלהם, עם עיוות הומוגני Zברחבי ההידרוגל. הידרוג'לים אלה רכים מכדי להיתפס ולהימתח על ידי טכניקות מתיחה קונבנציונליות. שנית, ניתן לשכפל בקלות את התקן המתיחה במעבדות אחרות מכיוון שהדפסה בתלת-ממד זמינה לחוקרים והאלקטרוניקה המשמשת בתכנון היא בעלות נמוכה. שלישית, ואולי התכונה האטרקטיבית ביותר, ניתן לתמרן בקלות את הגיאומטריה ואת גודל החיתוך ברצועת הסיליקון, מה שמאפשר מעברי מאמץ מתכווננים ותנאי גבול, כמו גם שימוש במגוון נפחי מדגם, עד כמה מיקרוליטרים.
הפרוטוקול המוצג מורכב יציקת ג'ל פיברין לתוך ~ 2 מ"מ קוטר דיסקים ב 0.5 מ"מ עבה רצועות גומי סיליקון המשיך על ידי מתיחה חד-קסיאלית תחת מיקרוסקופיה קונפוקלית חיה. להלן דן בפירוט את ההליכים הניסיוניים למדידה וניתוח של הזנים הפועלים על החיתוך הגיאומטרי, הזנים הפנימיים שפותחו בהידרוגל, כמו גם יישור סיבים וכתוצאה מכך לאחר מניפולציות מתיחה שונות. לבסוף, נדון באפשרות להטמיע תאים בהידרוגל ולחשוף אותם למתיחה חיצונית מבוקרת.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הכנת הפתרון (תבוצע מראש)
- תיוג פיברינוגן
הערה: שלב התיוג נדרש רק אם ניתוח העיוות של ג'ל הפיברין רצוי. לניסויים תאיים, ניתן להשתמש בג'ל ללא תווית.- הוסף 38 μL של 10 מ"ג / מ"ל succinimidyl אסתר צבע פלואורסצנטי (מומס ב DMSO) ל 1.5 מ"ל של 15 מ"ג / מ"ל פיברינוגן פתרון (יחס טוחנת של 5:1) בצינור צנטריפוגה 50 מ"ל ומניחים על שייקר במשך 1 שעה בטמפרטורת החדר. לאחר מכן, מניחים את הצינור בצנטריפוגה במשך 3 דקות ב 800 x גרם (טמפרטורת החדר).
- סנן את supernatant מהשלב הקודם דרך עמודה התפלה ארוז עם שף ג'ל dextran (טבלה של חומרים) כדי להפריד את הצבע unreacted,42 על ידי ביצוע שלבים אלה.
- לשטוף מראש את העמודה עם 25 מ"ל של מאגר פיברינוגן.
- לאט להזריק את התווית-fibrinogen משלב 1.1.1 לתוך העמודה, לוודא כי אין בועות נכנסות למסנן. השלך את הראשון ~ 0.3 מ"ל של פתרון eluted (4-6 טיפות של נוזל צבעוני קלוש). לאחר מכן אסוף את 1.0-1.5 מ"ל הבאים של פתרון מטוהר (בצע את פרוטוקול היצרן לקבלת פרטים ספציפיים יותר).
- סיים את תהליך הסינון על-ידי עיקור הפתרון המטוהר שנוצר באמצעות מסנן מונחה מזרק (0.22-0.45 מיקרומטר).
- כדי לנקות למחזר את העמודה, לשטוף עם 20 מ"ל של מאגר פיברינוגן, ולאחר מכן לאחסן 25 מ"ל של 20% אתנול.
- לאחר elution, לחלק את וכתוצאה מכך מטוהרים שכותרתו-פיברינוגן לתוך aliquots קטן של ~ 7-50 μL, בהתאם למספר הרצוי של ג'לים מתוחים. עבור כל ג'ל מעגלי בקוטר 2 מ"מ מתוח, הכינו כ-3.5 μL של פיברינוגן (2.5 μL ישמשו לכל ג'ל + 1 μL לשגיאות צנרת).
- אחסן את aliquots במקפיא -20 מעלות צלזיוס. הם יכולים לשמש עד כשנה (לא מומלץ להפשיר ולהקפיא שוב).
- לשארית פרוטוקול זה, לשמור על כ 7 μL של פיברינוגן שכותרתו מטוהר במקרר (4 מעלות צלזיוס) עד שלב 4. נפח זה מיועד ליצירת שני ג'לים מתוחים (2.5 μL יש צורך בכל ג'ל, ונפח נוסף של 1 μL משמש כדי להסביר שגיאות בהכנת מדגם).
הערה: הליך סינון זה בדרך כלל מדלל את הפתרון הראשוני של 15 מ"ג/מ"ל פיברינוגן לריכוז סופי של כ-10 מ"ג/מ"ל. גורם הדילול תלוי בנפח ובריכוז הראשוניים של פיברינוגן, כפי שצוין בפרוטוקול היצרן.
- הכן 7 μL של פתרון תרומבין (לדלל באמצעות חיץ תרומבין ל 2 יחידות / מ"ל, שולחן החומרים) ולשמור במקרר (4 מעלות צלזיוס) עד שלב 4. נפח זה נועד למלא את גזרות של שני ג'לים מתוחים.
הערה: על מנת לבצע ניתוח מאמץ פנימי, יש להוסיף חרוזים כדוריים פלואורסצנטיים בקוטר 1 מיקרומטר (שנרכשו כהשעיה [2% מוצקים] במים בתוספת 2 מ"מ NaN3) לפתרון תרומבין (יחס של 1:25 v/v % של חרוז: תרומבין מומלץ למטרה של 40x). חרוזים יש לכלול רק כאשר מדידות מאמץ פנימי רצויות, או בנוכחות או היעדר תאים.
2. הכנת רצועת סיליקון
- החזירו את גומי הסיליקון בעובי 0.5 מ"מ וחתכו אותו לרצועות 15 x 80 מ"מ2 עם חור בקוטר 2 מ"מ במרכז הרצועה (איור 1). במידת האפשר, השתמש חותך לייזר לתכנות לדיוק גבוה. אם מכונות ניתנות לתכנות אינן זמינות, מספריים מספיקים לחיתוך קווי המתאר של הרצועה וניקוב חורים קטן מתאים למרכז החיתוך.
הערה: גומי סיליקון מסחרי נרכש בדרך כלל עם ניילון נצמד משני הצדדים. שמור כיסוי פלסטיק מקורי משני צידי הסיליקון במידת האפשר. אם עושים שימוש חוזר בפסי סיליקון מניסוי קודם, יש לטפל בהם עם טריפסין במשך 0.5 שעות, להשרות ב-0.2 M NaOH למשך 0.5 שעה, ולאחר מכן להשרות ב-70% אתנול למשך שעה. תן להם להתייבש לפני השימוש. - הכן שכבות סרט איטום (הידרופובי) עם מידות של לפחות 20 × 30 מ"מ2, ולכן הם רחבים יותר מרצועת הסיליקון ובכך מאפשר חותם להיווצר על כל החיתוך הגיאומטרי.
- לשטוף צלחת 10 ס"מ עם 70% אתנול, ולאחר מכן לנגב ולייבש עם מגבונים משימה עדינים שאינם מלתוח (עבור ניסויים סטריליים ולא סטריליים). שלב זה חשוב שכן הוא מאפשר לשכבות סרט האיטום להידבק טוב יותר לצלחת ולהגביל את תנועת המדגם במהלך תהליך ההכנה.
- מניחים את שכבות סרט האיטום בכלי שטף 10 ס"מ כך שיש מספיק מקום למקם שתי רצועות בכל מנה זה לצד זה(איור 2A).
- מוציאים את ניילון הניילון מצד אחד של רצועת הסיליקון ומניחים את הצד החשוף על שכבת סרט האיטום כך שהחיתוך מוקף כולו בשכבת סרט האיטום(איור 2B). לאחר מכן, לחצו בעדינות על הסיליקון כנגד שכבת סרט האיטום כדי לאטום את האזור המקיף את החתך, תוך שימוש באצבעות כפפות נקיות.
הערה: ודא שאין כיסי אוויר בין הסיליקון לסרט האיטום, במיוחד סביב החתך. עשו זאת על ידי בחינת הצד התחתון של המנה (איור 2C).
- מוציאים את ניילון הניילון מצד אחד של רצועת הסיליקון ומניחים את הצד החשוף על שכבת סרט האיטום כך שהחיתוך מוקף כולו בשכבת סרט האיטום(איור 2B). לאחר מכן, לחצו בעדינות על הסיליקון כנגד שכבת סרט האיטום כדי לאטום את האזור המקיף את החתך, תוך שימוש באצבעות כפפות נקיות.
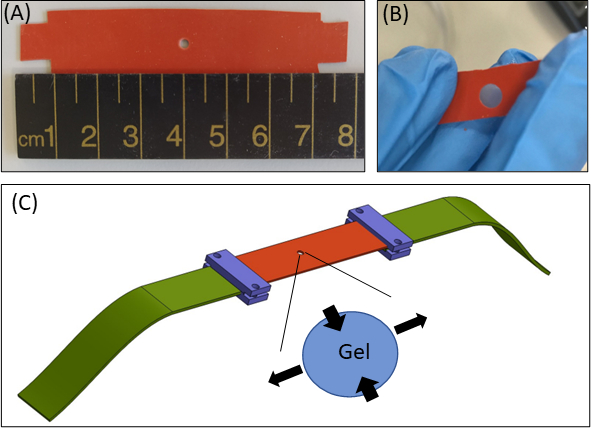
איור 1: גישת מאמץ הידרוג'ל. (A)15 × 80 מ"מ2 רצועת סיליקון עם חתך בקוטר 2 מ"מ במרכז הרצועה(B)רצועת סיליקון עם חתך עגול עם ג'ל פיברין משובץ. להמחשה, החיתוך בסיליקון גדול יותר מאשר בניסויים עצמם(C)סכמטי של גישת המתיחה עם רצועת הסיליקון (כתום), ג'ל עגול (חתוך באמצע) ומאריכי בד (ירוק) המחברים את הסיליקון למכשיר המתיחה. אזור מוגדל של הג'ל מציין את העיוות של הג'ל, בתגובה מתיחה חד-קסיאלית של הסיליקון. לפשטות, הדחיסה לאורך עובי הג'ל(ציר Z)אינה מוצגת באיור. איורים 1B & 1C הותאמו מ Roitblat ריבה ואח'41אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 2: דוגמה למיקום נכון של רצועת סיליקון בשכבת סרט איטום לפני פילמור ג'ל. (A)מיקום שתי שכבות צילום איטום בצלחת 10 ס"מ (B)מיקום של פסי סיליקון על שכבות סרט האיטום(C)מבט תחתון של המנה, המציג את אטום האוויר בין הסיליקון לשכבת סרט האיטום. משמאל: חותם נכון של שכבת סרט האיטום לרצועת הסיליקון סביב החתך ללא כיסי אוויר. מימין: חותם לא תקין של שכבת סרט האיטום לרצועת הסיליקון שנחתכה עם כיסי אוויר סביב קצה החתך. זה יוביל לדליפת רכיבי ההידרוגל מתחת לסיליקון. החץ האדום מצביע על אזור שבו נוצר כיס אוויר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
3. הכנת תרומבין עם תאים
הערה: בצע שלב זה רק אם הטבעת תאים בהידרוגל רצויה, ותחת תנאים סטריליים במכסה המנוע הביולוגי(שולחן החומרים).
- עיקור: יום לפני הניסוי התאי, מניחים את רצועות הסיליקון & אטימה שכבות הסרט 70% אתנול לילה ולאחר מכן לבצע עיקור UV במשך 30 דקות מכל צד (אם הכלים 10 ס"מ הם לא כבר סטריליים, הם צריכים גם להיות מעוקרים תחת אור UV במשך 30 דקות לאחר 70% שטיפת אתנול). מערכת UV מנוצל בפרוטוקול הוא אחד מובנה לתוך מכסה המנוע הביולוגי.
הערה: לחלופין, מחזור עיקור אוטוקלאב (140 °C (140 °C) יכול להתבצע על רצועות סיליקון שכן הם עמידים עד 260 °C (60 °F). - בצע ספירת תאים כדי לקבוע את ריכוז התא, ולאחר מכן צנטריפוגה ולהשעות מחדש את גלולת התא עם 7 μL של תרומבין (2 יחידות / מ"ל) בצינור צנטריפוגה 1.5 מ"ל. אנו ממליצים על ריכוז תאים של 800 תאים / μL של תרומבין. שמור על התאים מצוננים עד השימוש (לא יעלה על יותר מחצי שעה, כדי למנוע פגיעה בתאים).
4. פילמור של ג'ל פיברין
- יש לאחזר את 2 יחידות/מ"ל טרומבין & 10 מ"ג/מ"ל עם תווית-פיברינוגן מהמקרר (שהוכן בשלב 1) ומניחים אותם על קרח במקום בו הם יהיו נגישים.
הערה: הפתרונות נשמרים קרים לפני תהליך הערבוב על מנת להאט את קינטיקה תגובת הפילמור. זה מאפשר ערבוב הומוגני יותר של החלבונים. - עם הכלים (es) להגדיר (שלב 2), לחלץ 2.5 μL של שכותרתו-פיברינוגן פיפטה זה אחיד לתוך סיליקון לגזור (עם שכבת סרט איטום מחובר לצד התחתון שלה) כך כל היקף החיתוך הוא במגע עם פיברינוגן. היזהרו לא לאפשר לכל כיסי אוויר או בועות להיווצר בכל מקום בפתרון, תוך שימת לב במיוחד לקצות התחתונים של החיתוך (הממשק בין שכבת סרט האיטום לסיליקון).
- מיד לקחת 2.5 μL של תרומבין (עם או בלי תאים / חרוזים) ו pipette אותו ישירות לתוך פתרון פיברינוגן בחיתוך החוצה (להגיע נפח סופי של 5 μL פיברין). לאחר מכן לערבב במהירות את שני הפתרונות על ידי צינור בזהירות למעלה ולמטה ~ 10 פעמים. במהלך תהליך הערבוב, להזיז את הקצה סביב אמצעי האחסון כולו כדי ליצור פתרון הומוגני ככל האפשר.
- הוסף כמות קטנה מאוד של מלוחים חוצץ פוספט (PBS) [לחילופין תא בינוני לניסויים בתאים, שולחן החומרים]לאורך הקצה של כל מנה, כך הידרוג'ל לא להתייבש במהלך תהליך פולמור. ודא שאין מגע בין מדיום PBS / תא ואת הדגימות כמו זה יגרום נזק לדגימה.
- מכסים את הכלים ומניחים אותם באינקובטור ב 37 מעלות צלזיוס במשך 30 דקות.
הערה: זמן הדגירה הנדרש תלוי בנפח הג'ל. אם נעשה שימוש באמצעי אחסון גדולים יותר, זמן הדגירה אמור לגדול. - מוציאים את הכלים מהחממה ומוסיפים מדיום PBS/תא למנה, משקעים את כל מבנה הג'ל-סיליקון.
- בזהירות להרים את המדגם בונה אחד בכל פעם מן המנה לוודא שכבת הסרט איטום נשאר דבק ברצועה. נתק באיטיות את שכבת סרט האיטום מהסיליקון על ידי פילינג עדין מקצה אחד של הסיליקון לקצה השני (איור 3). הימנע משיכה מאזורים קרובים לחיתוך שבו ריכוזי מתח עשויים להתקיים (זה חשוב בעיקר עבור גיאומטריות לא מעגליות). הימנע מכל מגע עם חתך כפי שהוא יפגע במדגם.
- מניחים את הרצועה בחזרה לתוך המנה עם PBS / תא בינוני, כך הרצועה צפה בצלחת. ואז לקחת את הכלים (es) למיקרוסקופ סטנדרטי של תרבות התא כדי להעריך באופן איכותי את מצבו של כל מדגם. ג'לים חייבים להיות אחידים, רציפים לאורך כל החתך, ולא צריך להיות בועות. באמצעות איור 4 כמדריך, בחר את הדגימות הטובות ביותר לניתוח נוסף.

איור 3: הסרה נכונה של שכבת סרט האיטום מתחתית רצועת הסיליקון. תהליך ההסרה צריך להיעשות לאט כך הידרוג'ל לא לקרוע או לשבור את הדבקות שלה עם הקירות הפנימיים של לחתוך החוצה. החץ הלבן מראה את כיוון ההסרה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: תצפית מיקרוסקופית של ג'ל פיברין בגזרת הסיליקון. (A)שתי דוגמאות של ג'ל פיברין פולימרי כראוי. שימו לב להומוגניות היחסית של הג'ל ולהדבקה המלאה בשולי החיתוך (B) שתי דוגמאות לכשל בספימור מדגם. למעלה: שימו לב לב לבועות רבות ואת אגרגטים שנוצרו בצד השמאלי התחתון. למטה: שימו לב לקריעת הג'ל מהקצוות החתוכים והצטברויות באזור השמאלי התחתון של החיתוך. סרגל קנה מידה = 300 מיקרומטר אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
5. טעינה לדוגמה במכשיר SCyUS
- מלאו את האמבטיה במדיום PBS/תא (איור 5)והניחו את רצועת הסיליקון הנושאת את ג'ל הדגימה על פני החלק העליון כך שהקצוות יושבים בכל צד של האמבטיה. האמבטיה נועדה למנוע כל ייבוש של הג'ל. מניחים ומהדקים את המהדקים (סגול) יחד עם רצועות הבד (ירוק) כך שכל החלקים מחוברים ליצירת רצועה ישרה אחת עם החיתוך במרכז(איור 5).
- אחזרו את התקן SCyUS וחברו היטב את נוזל האלומיניום ואת כיסויי הזכוכית המלבנית בגודל 22 מ"מ x 40 מ"מ (מס' 1 או 1.5) (איור 6Aiii). מחברים את החלקת הכיסוי לתחתית הבאר באמצעות חומר איטום (למשל, שומן ואקום) כך שניתן למלא את הבאר בנוזל ללא דליפה.
- מלאו את הבאר ב-1.2 מ"ל של מדיום PBS/תא והניחו את הרצועה + בד + מבנה ג'ל (איור 6B)לתוך המכשיר. מהדקים את רצועת הבד (2) לתוך הסוגר ( 1 )כךשהחיתוך + ג'ל (5) נמצא במרכז כפי שמוצג, ולאחר מכן מניחים בזהירות את הכנס הפינה למטה (4) לתוך המכשיר ולנעול אותו במקום.
- לאחר מכן, הכנס את צד הבד השני לציר (מבלי לחבר את הסרומוטור) ונעל אותו לציר (איור 6C).
- הכנס את התקן SCyUS עם הדגימה המצורפת לשלב המיקרוסקופ (איור 6C). חבר את המיקרו-בקר(שולחן החומרים)למחשב באמצעות כבל USB וחבר את הסרומוטור למיקרו-בקר. פתח את מודול הבקרה של SCyUS במחשב. הדגימה מוכנה כעת להדמיה כדי לבדוק את הלימות עובי הג'ל והומוגניות הסיבים מתחת למיקרוסקופ הקונפוקלי.
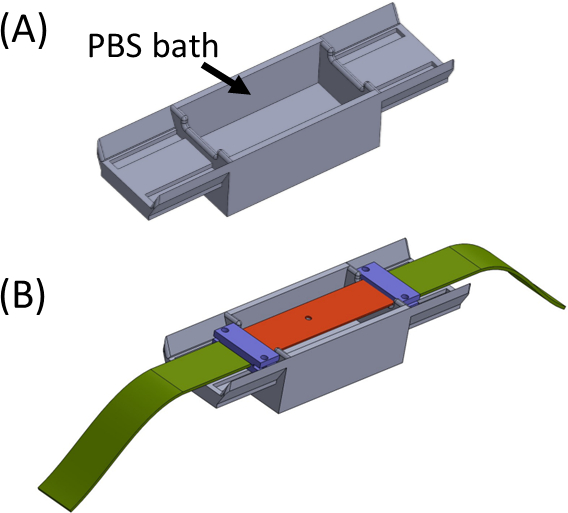
איור 5: (A) Jig המכיל אמבט PBS (מודפס בתלת-ממד) (B) מיקום רצועה על הג'יג כדי להבטיח חיבור תקין בשורה של סוגריים מרובעים (בסגול) ומניעת ייבוש הג'ל. נתון זה שונה באישור Roitblat ריבה ואח '41אנא לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
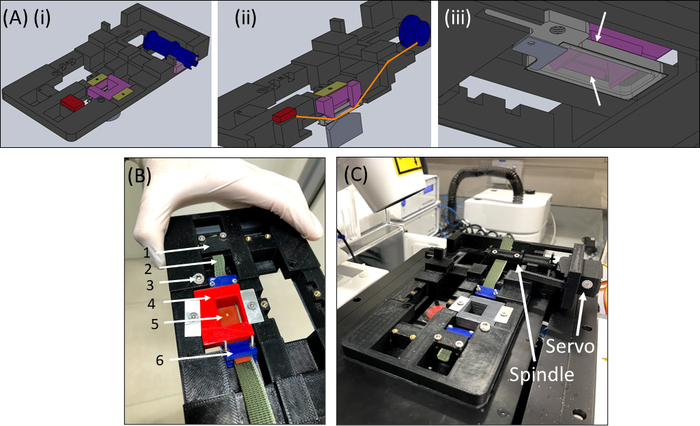
איור 6: מכשיר מתיחה של SCyUS. (A)מספר תצוגות של דגם CAD של החלקים העיקריים של ה- SCyUS: ציר המחובר לסרו (כחול), עוגן סטטי (אדום), הכנס את רצועת הסיליקון כלפי מטה (סגול) ומתקן המונע מהתוספת לעלות (צהוב-ירוק). מבט עליון של המערכת (Ai), מבט חתוך של המערכת(Aii)המציג את הנתיב של הרצועה (קו כתום), ותצוגה תחתונה(Aiii)של נוזל האלומיניום היטב עם כיסוי זכוכית. ניתן להזיז את באר הנוזלים למעלה ולמטה עם סיבוב של בורג מצויד להשחלה העיקרית. התנועה כלפי מעלה של באר האלומיניום מוגבלת על ידי כנפי הצד של הכנס הסגול, כפי שמוצג על ידי החצים הלבנים (B) המערכת בפועל: (1) עוגן סטטי (2) בד ירוק שאינו ניתן למתיחה (3) בורג לבקרת גובה היטב נוזלי אלומיניום (4) סיכה אדומה למטה הכנסה (5) רצועת סיליקון עם חיתוך עגול (6) מלחצי חיבור כחולים (C) מערכת המיקרו מתיחה ממוקמת על קונפוקל הסרוומוטור וה ציר מוצגים עם חצים. נתון זה שונה באישור Roitblat ריבה ואח '41אנא לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
6. להבטיח ג'ל הולם לדגימה
- באמצעות מיקרוסקופ confocal(טבלה של חומרים)לקחת הגדלה נמוכה (10×), ברזולוציה נמוכה (~ 1.4 מיקרומטר x 1.4 מיקרומטר פיקסל גודל) מחסנית Z confocal (≤10 פרוסות Z עם גודל צעד של מספיקה תמונת אריחים של הג'ל כולו באמצעות לייזרים של 488/543/561 כדי לבחון הומוגניות והדבקה בהיקף החיתוך הגיאומטרי לאורך עובי הסיליקון (איור 7A-B). השתמש בתמונת מחסנית Zזו כמפה עבור השלבים הבאים.
- באמצעות הדמיה חיה ברזולוציה נמוכה, לסרוק את הג'ל ולקבוע את תנוחת Zהנמוכה ביותר שבו הידבקות מלאה לקירות הפנימיים של החיתוך ניכרת ללא קרעים או בועות ולשים לב Z- מיקום של המיקרוסקופ (Zl). כדי לקבוע הידבקות מלאה של הג'ל לסיליקון לאורך כל היקפו, סרוק את הממשק של תווית הפלואורסצנט של הג'ל ורצועת הסיליקון (רקע כהה) מתחת למיקרוסקופ (איור 7C).
- עלו בכיוון Zעד שלא תהיה עוד המשכיות בג'ל ושימו לב לתנוחת Z(Zu):
- הפחת את הגבול העליון (Zu) של כיוון Zמהמגבלה התחתונה (Zl). זהו עובי ההפניה של המדגם (Zo):

אם Zo ≥ 100 מיקרומטר אז הג'ל נחשב משביע רצון לניתוח. שים לב כי העובי של חיתוך סיליקון הוא כ 500 מיקרומטר, אבל פולמור ג'ל בחיתוך בדרך כלל תוצאות עובי ג'ל קטן יותר. 100 מיקרומטר הוא העובי המינימלי המומלץ כדי להבטיח תהליך מתיחה יציב, ללא קרעים או ניתוק של הג'ל מחיתוך הסיליקון.
הערה: במקומות שונים XY, עובי הג'ל יכול להשתנות. סעיף זה של הפרוטוקול מודד את העובי המינימלי של הג'ל, ומאפשר לנו לקבוע את איכות הג'ל ולציין אם זה מספיק למתיחה. בנוסף, מציאת מרכז הג'ל מספקת נקודת התייחסות לחזרה לאחר מתיחה, בין אם סטטית או דינמית.

איור 7: הומוגניות ג'ל. תמונות אריחים נלכדו ותפרו באמצעות תוכנת המיקרוסקופ הקונפוקלית(Table of Materials)(A)תמונת אריח Zתפורה אחת של דגימת ג'ל פיברין עם צפיפות סיבים לא הומוגנית יחסית עקב טרומבין ופיברינוגן לא תקינים ערבוב טרום פילמור. ג'ל זה לא יספק ניתוח אמין (B) אריח תפור יחיד Z-פרוסת תמונה של דגימת ג'ל פיברין עם צפיפות סיבים הומוגנית יחסית. זהו ג'ל מקובל לניסויי מתיחה. סרגל קנה המידה עבור תמונות A & B הוא 200 מיקרומטר (C) הגדלה של הממשק בין הג'ל בעל התווית הפלואורסצנטית (אדום) לסיליקון (רקע שחור). סרגל קנה מידה = 100 מיקרומטר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
7. פעולת SCyUS, מתיחה והדמיה
- כעת, לאחר שהדגימה נקבעה כאיכות משביעת רצון ומוגדרת במכשיר SCyUS כראוי, קבעו את המיקום המתוח מראש של הדגימה. זה מושג באמצעות הדמיה חיה תחת מיקרוסקופ confocal (בדומה לשלב 6.2).
- ודאו שהסרבומוטור נמצא במיקום האפס שלו בלחיצה על הלחצן 'עבור לאפס סרוו פוזה' (לחצו על איור 8A וודאו שאיור 8B מציג אפס) וחברו אותו למכשיר המתיחה כפי שניתן לראות באיור 6C.
הערה: בצע צעד זה לאט ובזהירות כדי לא לשים כל מתח עודף על המדגם. - בעת הדמיית המדגם, הזז את המנוע בדרגה אחת (איור 8C)בכל פעם בכיוון השעון על-ידי לחיצה על לחצן +1 עד שנצפה הצד הימני של החיתוך זז. לאחר מכן, הפוך את התנועה (איור 8D) בחזרה למיקום השלב הלפני אחרון על-ידי לחיצה על לחצן -1. פעולה זו מאמתת כי המדגם נמצא תחת מתח מינימלי. לחצו על הלחצן 'הגדר מיקום סרוו מינימלי' (איור 8E)כדי לקבוע את מיקום ההפניה. ניתן לחזור לעמדת הייחוס בכל עת על-ידי לחיצה על לחצן עבור למיקום סרוו מינימלי (איור 8F).
הערה: מומלץ להשתמש במטרה עם הגדלה גבוהה (≥40×) עבור שלב זה כדי למזער את השגיאה. - לכוד הגדלה גבוהה (40×), ברזולוציה גבוהה (~ 0.2 מיקרומטר × גודל פיקסל 0.2 מיקרומטר), תמונת אריח פרוסת Z אחת של אזור הג'ל כולו. תמונה זו תשמש כתמונת הייחוס לניתוח שלאחר העיבוד. מומלץ ללכוד תמונה אחת של פרוסת Zבאמצע עובי הג'ל (באמצעות Zo מ Eq. 1), זה יאפשר את החזרה בערך באותה תנוחת Zלאחר מתיחה. כמו כן, קח בחשבון כי תמונות אריח ברזולוציה גבוהה של אזור הג'ל כולו לקחת זמן רב (~ 20-30 דקות).
- עכשיו הדגימה מוכנה למתיחות סטטיות. התאם את הסרוומוטור לגודל המתיחה הרצוי על-ידי קידום דרגה אחת (איור 8C)בכל פעם ב- GUI (בצע זאת לאט, בערך 1 מעלות לשנייה).
- ודאו שהסרבומוטור נמצא במיקום האפס שלו בלחיצה על הלחצן 'עבור לאפס סרוו פוזה' (לחצו על איור 8A וודאו שאיור 8B מציג אפס) וחברו אותו למכשיר המתיחה כפי שניתן לראות באיור 6C.
- בכל גודל מתיחה שבו הניתוח רצוי, ללכוד תמונה אחת של אריח ברזולוציה גבוהה פרוסת Z של אזור הג'ל כולו לניתוח שלאחר עיבוד. בדומה לשלב 6.2, ודאו שהג'ל לא התנתק מהסיליקון לאורך כל היקפו על ידי סריקת הממשק בין הג'ל (האדום) לסיליקון (רקע כהה), בחיפוש אחר שינויים בהדבקה מעוצמת המתיחה הקודמת.
הערה: במהלך הפעלת המנוע, השתמש בהדמיה חיה כדי לעקוב אחר מיקום הג'ל ב- X-Y (עם הגדרות ברזולוציה נמוכה ובהגדלה נמוכה). הג'ל חווה אפקט Z-Poissonשבו החלק התחתון של הג'ל עולה, ולכן Z-מיקום של המיקרוסקופ צריך גם להיות מותאם למרכז המשוער של עובי הג'ל עבור כל גודל מתיחה. זה יכול להיות מושגת על ידי חישוב מחדש Zo (Eq. 1) עבור כל גודל מתיחה. מכיוון שמתיחה בכיוון Zהיא הומוגנית יחסית, אין זה קריטי למצוא את עומק המרכז המדויק של הג'ל.
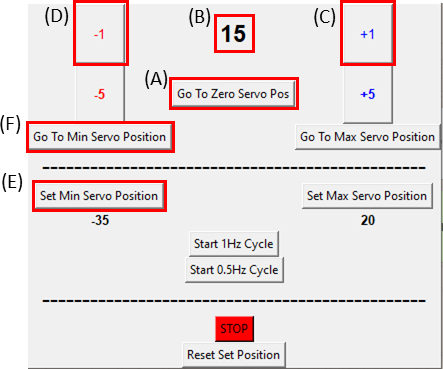
איור 8: ממשק משתמש גרפי עבור מודול הבקרה של SCyUS. (A)מיקום המנוע במעלות. הערך נע בין -90° ל- 90°(B)'הגדרת מיקום סרוו מינימלי'. לחצן זה מאפשר מיקום מינימלי מוגדר מראש, להגדרת מיקום הפניה חדש השונה מלחצן אפס סרוו (C) 'פלוס 1°' מזיז את מנוע הסרוו במעלה אחת בכיוון השעון (D) 'מינוס 1°' מזיז את מנוע הסרוו במעלה אחת נגד כיוון השעון (E) לחצן 'עבור למיקום אפס' מגדיר את מיקום הסרומוטור ל- 0° ([A] יוגדר לאפס) (F) לחצן 'עבור למיקום סרוו מינימלי' מעביר את הסרומוטור למיקום 'Min' המוגדר על-ידי המשתמש. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
8. לאחר עיבוד מדידות זן חיצוני
- למדידת הזנים האפקטיביים של הגבולות החתוכים, מדדו את אורכי מקצה לקצה בכיוון המתיחה(X-ציר)במרכז ציר Y(איור 9A).
- העלה את התמונה שלפני המתיחה לתוכנת עיבוד התמונה (ImageJ FIJI43) ומדוד את המרחק הגדול ביותר מקצה לקצה המוגדר כאורך הצירי של החור (
 ) במרכז.
) במרכז. - הגדר את המרחק הגדול ביותר מלמעלה למטה כמרחק הניצב (
 ).
). - חזור על תהליך זה עבור כל תמונות מרווחי המתיחה וחשב את
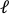 המרחקים הציריים ( ) והתובנים
המרחקים הציריים ( ) והתובנים  ( ) של הפריפריה החתוכה(איור 9A, למטה) ולאחר מכן בצע את החישובים הבאים כדי למצוא את הזנים של הקצוות החתוכים:
( ) של הפריפריה החתוכה(איור 9A, למטה) ולאחר מכן בצע את החישובים הבאים כדי למצוא את הזנים של הקצוות החתוכים:
- העלה את התמונה שלפני המתיחה לתוכנת עיבוד התמונה (ImageJ FIJI43) ומדוד את המרחק הגדול ביותר מקצה לקצה המוגדר כאורך הצירי של החור (
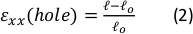

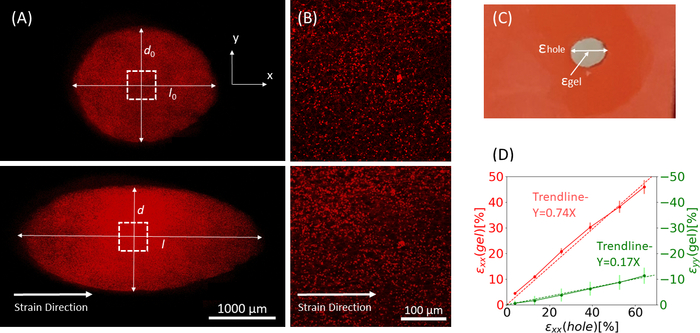
איור 9: זני ג'ל עקב מתיחה חיצונית של רצועת הסיליקון. (A) X-Y חתך רוחב של ג'ל פיברין לא מתוח (למעלה), ולאחר יישום של חור ε = 64% זן לאורך כיוון x (למטה). הג'ל משובץ חרוזים פלואורסצנטיים. האורכים הרלוונטיים של d ו- l המשמשים לחישוב חור ε מסומנים בתמונות (B) זום-אין תמונות של השטח הריבועי המקווקו המסומן ב- A (C) איור של סוגי הזנים הנחשבים במחקר זה: חור ε הוא הזן הצירי של החיתוך בקוטר המרבי שלו, וג'ל ε הוא הזן הצירי במרכז הג'ל (כפי שנמדד על ידי מיקומי צבירת החרוזים)(D)נמצא קשר ליניארי בין חור ε לג'ל ε הן בכיוון xx (קו אדום) והן בכיוון yy (קו ירוק). נתון זה הותאם באישור Roitblat ריבה ואח '41אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
9. ניתוח כיוון סיבים
- השתמש כימות של יישור סיבים כדי לאפיין את התגובה המבנית של ג'ל סיבי כדי להגדיל את סדרי הגודל של מתיחה. העלה תמונות ברזולוציה גבוהה לתוכנת ImageJ FIJI (NIH)43 ולאחר מכן נתח באמצעות מודול OrientationJ (EPFL)44 (הגדרות: הדרגתי גאוסיאני וחלון של 3 פיקסלים, איור 10).
- חישוב פרמטר הסדר הנמטי הדו-מימדי (NOP) של היסטוגרמה של הכיוון כ:45
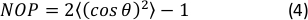
הערה: ערך של NOP = 1 מציין יישור מושלם לאורך הכיוון הצירי (זווית אפס) ו- NOP = 0 מציין איזוטרופיה. זווית הכיוון, θ, היא זווית הסיבים ביחס לציר המתח (ציר x) המתקבל באמצעות ניתוח תמונה ומוגדר במדויק בתיעוד OrientationJ. 44 (זה לא יכול לעשות את זה)
- חישוב פרמטר הסדר הנמטי הדו-מימדי (NOP) של היסטוגרמה של הכיוון כ:45

איור 10: ניתוח כיוון סיבים באמצעות תוכנת FIJI ImageJ. (A)התפריט הראשי של ImageJ עם חץ המציין את המיקום של התפריט הנפתח 'תוספים' שבו 'OrientationJ' ניתן למצוא. תחת התפריט המורחב של 'OrientationJ', לחץ על האפשרות 'התפלגות אוריינטציה' (B) מודול ההפצה של OrientationJ. הגדר את 'חלון מקומי σ' ל- 3 פיקסלים ואת 'הדרגתי' ל'גאוסיאני'. לאחר מכן לחץ על לחצן 'הפעל' (חץ אדום). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
10. ניתוח ידני של זן ג'ל פנימי
- בעת ביצוע הדמיה חיה בהגדלה גבוהה של הידרוג'ל עם חרוזים מוטבעים, אתר באופן ידני אזור מעניין (ROI) עם תכונות הניתנות לזיהוי בקלות (למשל, אגרגטים של חרוזים), על מנת לחזור לאותו מיקום לאחר כל גודל מתיחה.
הערה: דחיסה בכיוון Z (אפקט פואסון) יכולה להוביל לעלייה בצפיפות החרוזים ככל שהמתיחה עולה, ולכן אנו ממליצים לבחור אגרגטים חרוזים גדולים מספיק, כך שניתן יהיה לזיהוי בבירור. פרוטוקול זה דורש ניתוח של האזור המרכזי של ג'ל פיברין, אם כי כל אזור ניתן לבחור. - במצב טרום מתיחה (שלב 6), לכוד תמונת מחסנית Zברזולוציה גבוהה של ההחזר על ההשקעה שנבחר. לאחר כל מרווח זמן רצוי למתיחה, חזור לאותו החזר על ההשקעה וחזור על תהליך לכידת התמונה.
- קח את התמונות וייבא אותן לתוך ImageJ. בהו"ר, רשום את מיקום הפיקסל X-Y של כל צבירת חרוזים גלויה. העבר את הנתונים המוקלטים לגיליון אלקטרוני.
- למדוד את המרחקים בין כל זוג אגרגטים ולהשוות אותם למרחקים של אותם זוגות בתמונת הייחוס, המאפשר חישוב של זנים בכיוונים X ו- Y.
הערה: אם סרט רציף בזמן אמת נרשם בזמן שהג'ל נמתח (במקום לכידת תמונה סטטית), ניתן לבצע ניתוח אוטומטי של זנים בשיטות של תמונה דיגיטלית או מתאמי נפח (DIC/DVC), כפי שהוכח בעבר46,47. עם זאת, יש לציין כי ניתוח אוטומטי DIC / DVC הוא מאתגר בהגדרה זו, כמו מחסנית Zלא רק נע במישור X-Y, אלא גם בכיוון Zבשל אפקט פואסון (דחיסה), חשבונאות עבור סחף ניכר במהלך הסרט המוקלט.
Access restricted. Please log in or start a trial to view this content.
תוצאות
באיור 9 מוצג באיור 9נתונים מייצגים מרצועת גודל הולכת וגדלה של פסי סיליקון הנושאים הידרוג'ל פיברין תלת-ממדי, משובצים חרוזים פלואורסצנטיים של 1 מיקרומטר. הניתוח מדגים את ההשפעה של מתיחת סיליקון על שינויים גיאומטריים של החיתוך, כמו גם את הזנים המפותחים בתוך הג'ל. תמונות ...
Access restricted. Please log in or start a trial to view this content.
Discussion
השיטה והפרוטוקול המוצגים בזאת מבוססים במידה רבה על המחקר הקודם שלנו על ידי Roitblat Riba et al.41 אנו כוללים כאן את העיצוב המלא בעזרת מחשב (CAD), פייתון וקודי מיקרו-בקר של מכשיר SCyUS.
היתרונות העיקריים של השיטה המוצגת על פני גישות קיימות כוללים את האפשרות להתאמץ הידרוג'?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
כמה מהנתונים הכלולים כאן הותאמו באישור המרכז לסיווג זכויות יוצרים: ספרינגר טבע, תולדות ההנדסה הביו-רפואית. מאמץ הידרוג'לים תלת מימדיים עם זנים אחידים של ציר z תוך מתן אפשרות להדמיה מיקרוסקופית חיה, א. רויטבלט ריבה, ס. נתן, א. קול, ה. רושקין, א. צ'ישיאן, א. לסמן, זכויות יוצרים© (2019).
https://doi.org/10.1007/s10439-019-02426-7
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 546 carboxylic acid, succinimidyl ester | Invitrogen | A20002 | |
| Cell Medium (DMEM High Glucose) | Biological Industries | 01-052-1A | Add 10% FBS, 1% PNS, 1% L-Glutamine, 1% Sodium Pyruvate |
| Cover Slip #1.5 | Bar-Naor Ltd. | BN72204-30 | 22×40 mm |
| DIMETHYL SULPHOXIDE 99.5% GC DMSO | Sigma-Aldrich Inc. | D-5879-500 ML | |
| Dulbecco's Phosphate-Buffered Saline | Biological Industries | 02-023-1A | |
| EVICEL Fibrin Sealant (Human) | Omrix Biopharmaceuticals | 3902 | Fibrinogen: 70 mg/mL, Thrombin: 800-1200 IU/mL |
| Fibrinogen Buffer | N/A | Recipe for 1L: 7g NaCl, 2.94g trisodium citrate dihydrate, 9g glycine, 20g arginine hydrochloride & 0.15g calcium chloride dihydrate. Bring final volume to 1L with PuW (pH 7.0-7.2) | |
| Fluorescent micro-beads FluoSpheres (1 µm) | Invitrogen | F8820 | Orange (540/560) Provided as suspension (2% solids) in water plus 2 mM sodium azide |
| High-Temperature Silicone Rubber | McMaster-Carr | 3788T41 | 580 µm-thick E = 1.5 Mpa Poisson Ratio = 0.48 Tensile Strength = 4.8 MPa Upper limit of stretch = +300% engineering strain |
| HiTrap desalting column 5 mL (Sephadex G-25 packed) | GE Healthcare | 17-1408-01 | |
| HIVAC-G High Vacuum Sealing Compound | Shin-Etsu Chemical Co., Ltd. | HIVAC-G 100 | |
| ImageJ FIJI software39 | National Institute of Health, Bethesda, MD | Version 1.8.0_112 | |
| Microcontroller (Adruino Uno + Adafruit Motorshield v2.3) | Arduino/Adafruit | Arduino-DK001/Adafruit-1438 | |
| MicroVL 21R Centrifuge | Thermo Scientific | 75002470 | |
| Parafilm | Bemis | PM-996 | |
| Primovert Light Microscope | Carl Zeiss Suzhou Co., Ltd. | 491206-0011-000 | |
| SCyUS CAD (Solidworks) | Dassault Systèmes | N/A | |
| SCyUS Code37 | N/A | N/A | |
| Servomotor - TowerPro SG-5010 | Adafruit | 155 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | For 50 mL tubes |
| Sterile 10 cm non-culture plates | Corning | 430167 | |
| Thrombin buffer | N/A | Recipe for 1L: 20g mannitol, 8.77g NaCl, 2.72g sodium acetate trihydrate, 24 mL 25% Human Serum Albumin, 5.88g calcium chloride. Bring final volume to 1L with PuW (pH 7.0) | |
| Trypsin EDTA Solution B (0.25%), EDTA (0.05%) | Biological Industries | 03-052-1B | |
| USB Cable (Type B Male to Type A Male) | N/A | N/A | |
| Zeiss LSM 880 Confocal Microscope | Carl Zeiss AG | 2811000417 | |
| ZEN 2.3 SP1 FP3 (black) | Carl Zeiss AG | Release Version 14.0.0.0 |
References
- Bleuel, J., Zaucke, V., Bruggemann, G. P., Niehoff, A. Effects of cyclic tensile strain on chondrocyte metabolism: a systematic review. PLoS ONE. 10, 0119816(2015).
- Pennisi, C. P., Olesen, C. G., de Zee, M., Rasmussen, J., Zachar, V. Uniaxial cyclic strain drives assembly and differentiation of skeletal myocytes. Tissue Engineering Part A. 17, 2543-2550 (2011).
- Grodzinsky, A. J., Levenston, M. E., Jin, M., Frank, E. H. Cartilage Tissue Remodeling in Response to Mechanical Forces. Annual Review of Biomedical Engineering. 2 (1), 691-713 (2000).
- Munster, S., et al. Strain history dependence of the nonlinear stress response of fibrin and collagen networks. Proceedings of the National Academy of Sciences of the USA. 110, 12197-12202 (2013).
- Vader, D., Kabla, A., Weitz, D., Mahadevan, L. Strain-induced alignment in collagen gels. PLoS ONE. 4, 5902(2009).
- Badylak, S. F. The extracellular matrix as a scaffold for tissue reconstruction. Seminars in Cell & Developmental Biology. 13 (5), 377-383 (2002).
- Natan, S., Koren, Y., Shelah, O., Goren, S., Lesman, A. Molecular Biology of the Cell. 31 (14), 1474-1485 (2020).
- Ban, E., et al. Mechanisms of Plastic Deformation in Collagen Networks Induced by Cellular Forces. Biophysical Journal. 114 (2), 450-461 (2018).
- Kim, J., et al. Stress-induced plasticity of dynamic collagen networks. Nature Communications. 8, 842(2017).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Basu, A., Janmey, P. A., Yodh, A. G. Non-affine deformations in polymer hydrogels. Soft Matter. 8, 8039-8049 (2012).
- Muiznieks, L. D., Keeley, F. W. Molecular assembly and mechanical properties of the extracellular matrix: A fibrous protein perspective. Biochimica et Biophysica Acta. 1832, 866-875 (2012).
- Brown, A. E. X., Litvinov, R. I., Discher, D. E., Purohit, P. K., Weisel, J. W. Multiscale mechanics of fibrin polymer: gel stretching with protein unfolding and loss of water. Science. 325, 741-744 (2009).
- Carroll, S. F., Buckley, C. T., Kelly, D. J. Cyclic tensile strain can play a role in directing both intramembranous and endochondral ossification of mesenchymal stem cells. Frontiers in Bioengineering and Biotechnology. 5, 73(2017).
- Livne, A., Bouchbinder, E., Geiger, B. Cell reorientation under cyclic stretching. Nature Communications. 5, 3938(2014).
- Wang, L., et al. Patterning cellular alignment through stretching hydrogels with programmable strain gradients. ACS Applied Materials & Interfaces. 7, 15088-15097 (2015).
- Xu, G. K., Feng, X. Q., Gao, H. Orientations of Cells on Compliant Substrates under Biaxial Stretches: A Theoretical Study. Biophysical Journal. 114 (3), 701-710 (2017).
- Chagnon-Lessard, S., Jean-Ruel, H., Godin, M., Pelling, A. E. Cellular orientation is guided by strain gradients. Integrative Biology (United Kingdom). 9 (7), 607-618 (2013).
- Lu, J., et al. Cell orientation gradients on an inverse opal substrate. ACS Applied Materials & Interfaces. 7 (19), 10091-10095 (2015).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125, 3015-3024 (2012).
- Bono, N., et al. Unraveling the role of mechanical stimulation on smooth muscle cells: a comparative study between 2D and 3D models. Biotechnology and Bioengineering. 113, 2254-2263 (2016).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8, 839-845 (2007).
- Riehl, B. D., Park, J. H., Kwon, I. K., Lim, J. Y. Mechanical stretching for tissue engineering: two-dimensional and three-dimensional constructs. Tissue Engineering Part B: Reviews. 18, 288-300 (2012).
- Flexcell. Linear Tissue Train Culture Plate. Flexcell. , (2019).
- Flexcell. Tissue Train. Flexcell. , (2019).
- CellScale. MCT6 Stretcher. CellScale. , (2019).
- STREX. STB-150. STREX. , (2019).
- STREX. Stretch Chambers. STREX. , (2019).
- Kamble, H., Barton, M. J., Jun, M., Park, S., Nguyen, N. T. Cell stretching devices as research tools: engineering and biological considerations. Lab on a Chip. 16, 3193-3203 (2016).
- Weidenhamer, N. K., Tranquillo, R. T. Influence of cyclic mechanical stretch and tissue constraints on cellular and collagen alignment in fibroblast-derived cell sheets. Tissue Engineering Part C: Methods. 19, 386-395 (2013).
- Yung, Y. C., Vandenburgh, H., Mooney, D. J. Cellular strain assessment tool (CSAT): precision-controlled cyclic uniaxial tensile loading. Journal of Biomechanics. 42, 178-182 (2009).
- Chen, K., et al. Role of boundary conditions in determining cell alignment in response to stretch. Proceedings of the National Academy of Sciences of the USA. 115, 986-991 (2018).
- Heher, P., et al. A novel bioreactor for the generation of highly aligned 3D skeletal muscle-like constructs through orientation of fibrin via application of static strain. Acta Biomaterialia. 24, 251-265 (2015).
- Foolen, J., Deshpande, V. S., Kanters, F. M. W., Baaijens, F. P. T. The influence of matrix integrity on stress-fiber remodeling in 3D. Biomaterials. 33, 7508-7518 (2012).
- Walker, M., Godin, M., Pelling, A. E. A vacuum-actuated microtissue stretcher for long-term exposure to oscillatory strain within a 3D matrix. Biomedical Microdevices. 20, 43(2018).
- Zhao, R. G., Boudou, T., Wang, W. G., Chen, C. S., Reich, D. H. Decoupling cell and matrix mechanics in engineered microtissues using magnetically actuated microcantilevers. Advanced Materials. 25, 1699-1705 (2013).
- Li, Y. H., et al. Magnetically actuated cell-laden micro-scale hydrogels for probing strain-induced cell responses in three dimensions. NPG Asia Materials. 8, 238(2016).
- Li, Y. H., et al. An approach to quantifying 3D responses of cells to extreme strain. Scientific Reports. 6, 19550(2016).
- Humphrey, J. D., et al. A theoretically-motivated biaxial tissue culture system with intravital microscopy. Biomechanics and Modeling in Mechanobiology. 7, 323-334 (2008).
- Niklason, L. E., et al. Enabling tools for engineering collagenous tissues integrating bioreactors, intravital imaging, and biomechanical modeling. Proceedings of the National Academy of Sciences of the USA. 107, 3335-3339 (2010).
- Roitblat Riba, A., et al. Straining 3D hydrogels with uniform z-axis strains while enabling live microscopy imaging. Annals of Biomedical Engineering. , (2019).
- Gomez, D., Natan, S., Shokef, Y., Lesman, A. Mechanical interaction between cells facilitates molecular transport. Advanced Biosystems. 3 (12), 1900192(2019).
- Schindelin, J., et al. Fiji: an open- source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- EPFL Switzerland. OrientationJ plug in. EPFL Switzerland. , (2019).
- Goren, S., Koren, Y., Xu, X., Lesman, A. Elastic anisotropy governs the decay of cell-induced displacements. Biophysical Journal. 118 (5), 1152-1164 (2019).
- Notbohm, J., Lesman, A., Tirrell, D. A., Ravichandran, G. Quantifying cell-induced matrix deformation in three dimensions based on imaging matrix fibers. Integrative Biology. 7 (10), 1186-1195 (2015).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. Journal of Cell Biology. 205 (2), 155-162 (2014).
- Cha, C. Y., et al. Tailoring Hydrogel Adhesion to Polydimethylsiloxane Substrates Using Polysaccharide Glue. Angewandte Chemie International Edition. 52, 6949-6952 (2019).
- Wirthl, D., et al. Instant tough bonding of hydrogels for soft machines and electronics. Science Advances. 3, (2017).
- Juarez-Moreno, J. A., Avila-Ortega, A., Oliva, A. I., Aviles, F., Cauich-Rodriguez, J. V. Effect of wettability and surface roughness on the adhesion properties of collagen on PDMS films treated by capacitively coupled oxygen plasma. Applied Surface Science. 349, 763-773 (2015).
- Kim, H. T., Jeong, O. C. PDMS surface modification using atmospheric pressure plasma. Microelectronic Engineering. 88, 2281-2285 (2011).
- Prasad, B. R., et al. Controlling cellular activity by manipulating silicone surface roughness. Colloids and Surfaces. 78, 237-242 (2010).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved