Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Контролируемое напряжение 3D-гидрогелей при визуализации живой микроскопии
В этой статье
Резюме
Представленный способ включает одноосное растяжение 3D мягких гидрогелей, встроенных в силиконовую резину, при этом позволяя проводить живую конфокальную микроскопию. Показано определение характеристик внешних и внутренних деформаций гидрогеля, а также выравнивание волокон. Разработанное устройство и протокол могут оценивать реакцию клеток на различные режимы деформации.
Аннотация
Внешние силы являются важным фактором в формировании, развитии и поддержании тканей. Воздействие этих сил часто изучается с использованием специализированных методов растяжения in vitro. Различные доступные системы используют носилки на основе 2D-подложки, в то время как доступность 3D-методов для деформации мягких гидрогелей более ограничена. Здесь мы описываем метод, который позволяет внешне растягивать мягкие гидрогели от их окружности, используя упругую силиконовую полосу в качестве носителя образца. Система растяжения, используемая в этом протоколе, построена из 3D-печатных деталей и недорогой электроники, что делает ее простой и легкой для воспроизведения в других лабораториях. Экспериментальный процесс начинается с полимеризации толстых (>100 мкм) мягких гидрогелей фибрина (модуль упругости ~100 Па) в вырезе в центре силиконовой полосы. Силикон-гелевые конструкции затем прикрепляются к печатно-растягивающей устройству и помещаются на ступень конфокального микроскопа. При живой микроскопии активируется растягивающее устройство, и гели визуаизируются с различной величиной растяжения. Затем обработка изображений используется для количественной оценки результирующих деформаций геля, демонстрируя относительно однородные деформации и выравнивание волокон по всей толщине геля 3D (осьZ). Преимущества этого метода включают в себя возможность деформации чрезвычайно мягких гидрогелей в 3D при выполнении микроскопии in situ и свободу манипулировать геометрией и размером образца в соответствии с потребностями пользователя. Кроме того, при правильной адаптации этот метод может быть использован для растяжения других типов гидрогелей (например, коллагена, полиакриламида или полиэтиленгликоля) и может позволить анализировать реакцию клеток и тканей на внешние силы в более биомиметических 3D-условиях.
Введение
Реакция тканей на механические силы является неотъемлемой частью широкого спектра биологических функций, включая экспрессию генов1,дифференцировку клеток2и ремоделированиетканей 3. Кроме того, вызванные силой изменения во внеклеточном матриксе (ECM), такие как выравнивание и уплотнение волокон, могут влиять на поведение клеток и формирование тканей4,5,6. Структура волокнистой сетки ECM обладает интригующими механическими свойствами, такими как нелинейная упругость, неаффинная деформация и пластические деформации7,8,9,10,11,12. Эти свойства влияют на то, как клетки и окружающая их микросреда реагируют на внешние механические силы13,14. Понимание того, как ECM и ткани реагируют на механические силы, позволит прогрессировать в области тканевой инженерии и в разработке более точных вычислительных и теоретических моделей.
Наиболее распространенные методы механического растяжения образцов были сосредоточены на 2D-субстратах, нагруженных клетками, чтобы изучить влияние на поведение клеток. К ним относятся, например, нанесение деформации на подложки из полидиметилсилоксана (PDMS) и анализ углов переориентации клеток по отношению к направлению растяжения15,16,17,18,19. Тем не менее, методы, исследующие реакцию 3D-гидрогелей, встроенных в клетки, на внешнее растяжение, ситуацию, которая более точно имитирует микроокружение тканей, более ограничены. Достижения в области методов 3D-растяжения имеют особое значение, потому что клетки ведут себя по-разному на 2D-подложках по сравнению с 3D-матрицами20. Это поведение включает клеточную перестройку, уровни экспрессии белка и модели миграции21,22,23.
Методы и устройства, позволяющие растягивать 3D-образец, включают как коммерчески доступные24,25,26,27,28, так и разработанные для лабораторных исследований29. В этих методах используются рассываемые силиконовые трубки30,многозаборные камеры31,зажимы26,32,биореакторы11,33,консольныекамеры 34,35,36и магниты37,38. Некоторые методы генерируют растяжение, которое локально деформирует 3D-гидрогели, например, путем вытягивания игл из двух отдельных точек вгеле 5,в то время как другие допускают деформацию всей массы геля16. Более того, большинство из этих систем сосредоточены на анализе поля деформации в плоскости X-Y, с ограниченной информацией о поле деформации в Z-направлении. Кроме того, только несколько из этих устройств способны к микроскопической визуализации in situ. Основной проблемой визуализации in situ с высоким увеличением (например, конфокального микроскопа) является ограниченное рабочее расстояние в несколько сотен микрон от объектива до образца. Устройства, которые действительно позволяют визуализировать в реальном времени во время растяжения, жертвуют однородностью деформации в оси Zили относительно сложны и трудно воспроизводятся в других лабораториях39,40.
Такой подход к растяжению 3D-гидрогелей позволяет проводить статическую или циклическую одноосную деформацию во время живой конфокальной микроскопии. Растягивающее устройство (называемое «Smart Cyclic Uniaxial Stretcher — SCyUS») построено с использованием 3D-печатных деталей и недорогого оборудования, что позволяет легко воспроизводить в других лабораториях. К устройству прилагается коммерчески доступная силиконовая резина с геометрическим вырезом в центре. Компоненты гидрогеля полимеризуются для заполнения выреза. Во время полимеризации биологические гидрогели, такие как фибрин или коллаген, естественным образом прилипают к внутренним стенкам выреза. Используя SCyUS, силиконовая полоса ненатягивается, передавая контролируемые деформации во встроенный 3D-гидрогель41.
Эта система позволяет обеспечить уникальное сочетание функций и преимуществ по сравнению с другими существующими методами. Во-первых, система позволяет одноосное растяжение толстых 3D-мягких гидрогелей (толщиной >100 мкм, жесткость <1 кПа) с их периферии с Z-однороднойдеформацией по всему гидрогелю. Эти гидрогели слишком мягкие, чтобы их можно было сжимать и растягивать обычными методами растяжения. Во-вторых, растягивающее устройство может быть легко воспроизведено в других лабораториях, поскольку 3D-печать легко доступна для исследователей, а электроника, используемая в дизайне, является недорогой. В-третьих, и, возможно, самая привлекательная особенность, геометрия и размер выреза в силиконовой полосе могут быть легко обработаны, что позволяет настраивать градиенты деформации и граничные условия, а также использовать различные объемы образцов, вплоть до нескольких микролитров.
Представленный протокол состоит из формования фибринового геля в диски диаметром ~2 мм в силиконовых резиновых полосах толщиной 0,5 мм, продолженных одноосным растяжением под живой конфокальной микроскопией. Далее подробно обсуждаются экспериментальные процедуры измерения и анализа деформаций, действующих на геометрический вырез, внутренние деформации, выработанные в гидрогеле, а также результирующее выравнивание волокон после различных манипуляций с растяжением. Наконец, обсуждается возможность встраивания клеток в гидрогель и воздействия на них контролируемого внешнего растяжения.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Подготовка раствора (производится заранее)
- Маркировка фибриногена
ПРИМЕЧАНИЕ: Этап маркировки требуется только в том случае, если требуется анализ деформации фибринового геля. Для клеточных экспериментов можно использовать немеченый гель.- Добавьте 38 мкл 10 мг/мл флуоресцентного красителя сукцинимидилового эфира (растворенного в ДМСО) в 1,5 мл раствора фибриногена 15 мг/мл (молярное соотношение 5:1) в центрифужную трубку 50 мл и поместите на шейкер на 1 час при комнатной температуре. После этого поместите трубку в центрифугу на 3 минуты при 800 х г (комнатная температура).
- Фильтруйте супернатант с предыдущей ступени через обессоливую колонну, заполненную декстрановой гелевой смолой(Таблица материалов), чтобыотделить нереактированный краситель,42, выполнив следующие шаги.
- Предварительно промыть колонну 25 мл фибриногенного буфера.
- Медленно вводите меченый фибриноген с шага 1.1.1 в колонку, следя за тем, чтобы в фильтр не поступали пузырьки. Отбросьте первые ~0,3 мл элюированного раствора (4-6 капель слабой окрашенной жидкости). Затем собирают следующие 1,0-1,5 мл очищенного раствора (следуйте протоколу производителя для получения более конкретных деталей).
- Завершите процесс фильтрации стерилизацией полученного очищенного раствора с помощью шприцевого фильтра (0,22-0,45 мкм).
- Для очистки и переработки колонны промыть 20 мл фибриногенного буфера, а затем хранить в 25 мл 20% этанола.
- После элюирования разделите полученный очищенный меченый фибриноген на небольшие аликвоты ~7-50 мкл в зависимости от желаемого количества растянутых гелей. Для каждого растянутого геля круга диаметром 2 мм приготовьте около 3,5 мкл фибриногена (на гель будет использоваться 2,5 мкл + 1 мкл для ошибок пипетирования).
- Храните аликвоты в морозильной камере при -20 °C. Их можно использовать примерно до одного года (не рекомендуется размораживать и снова замораживать).
- В течение остальной части этого протокола храните приблизительно 7 мкл очищенного меченого фибриногена в холодильнике (4 °C) до этапа 4. Этот объем предназначен для создания двух растянутых гелей (на гель необходимо 2,5 мкл, а для учета ошибок в пробоподготовке используется дополнительный объем в 1 мкл).
ПРИМЕЧАНИЕ: Эта процедура фильтрации обычно разбавляет исходный раствор фибриногена 15 мг/мл до конечной концентрации около 10 мг/мл. Коэффициент разбавления зависит от исходного объема и концентрации фибриногена, как указано в протоколе производителя.
- Приготовить 7 мкл тромбиновой раствора (разбавить с помощью тромбинового буфера до 2 ед/мл, Таблица материалов)и держать в холодильнике (4 °С) до этапа 4. Этот объем предназначен для заполнения вырезов двух растянутых гелей.
ПРИМЕЧАНИЕ: Для проведения анализа внутренней деформации к флуоресцентным сферическим шарикам диаметром 1 мкм (приобретаемые в виде суспензии [2% твердых веществ] в воде плюс 2 мМ NaN3)следует добавить к раствору тромбина (для 40-кратного объектива рекомендуется соотношение 1:25 в/об% от бисера:тромбин). Бусины следует включать только тогда, когда требуется измерение внутренней деформации, либо при наличии, либо при отсутствии клеток.
2. Подготовка силиконовой полосы
- Извлеките силиконовую резину толщиной 0,5 мм и разрежьте ее на полосы размером 15 x 80 мм2 с отверстием диаметром 2 мм в центре полосы(рисунок 1). Если возможно, используйте программируемый лазерный резак для высокой точности. Если программируемое оборудование недоступно, ножниц достаточно для резки контура полосы, а для центрального выреза достаточно небольшого отверстия-перфоратора.
ПРИМЕЧАНИЕ: Коммерческая силиконовая резина обычно приобретается с пластиковой пленкой с обеих сторон. Держите оригинальное пластиковое покрытие с обеих сторон силикона, если это возможно. При повторном замыкание силиконовых полосок из предыдущего эксперимента обработайте их трипсином в течение 0,5 ч, замочите в 0,2 М NaOH на 0,5 часа, а затем замочите в 70% этаноле на 1 час. Дайте им высохнуть перед использованием. - Подготовьте слои герметизирующих (гидрофобных) слоев размерами не менее 20 ×30 мм2,чтобы они были шире силиконовой полосы и тем самым позволяли образовывать уплотнение над всем геометрическим вырезом.
- Вымойте 10-сантиметровую посуду с 70% этанолом, а затем протрите и высушите необлицовочные деликатные салфетки (как для стерильных, так и для нестерильных экспериментов). Этот шаг важен, поскольку он позволяет слоям герметизирующих пленок лучше прилипать к пластине и ограничивать движение образца в процессе подготовки.
- Поместите слои герметизируемой пленки в вымытую посуду 10 см, чтобы было достаточно места для размещения двух полосок в каждой посуде бок о бок(рисунок 2A).
- Снимите полиэтиленовую пленку с одной стороны силиконовой полосы и поместите открытую сторону на слой уплотнительной пленки, чтобы вырез был полностью окружен слоем уплотнительной пленки(рисунок 2B). Затем осторожно надавите на силикон на слой уплотнительной пленки, чтобы запечатать область, окружающую вырез, используя чистые пальцы в перчатках.
ПРИМЕЧАНИЕ: Убедитесь, что между силиконом и уплотнительной пленкой нет воздушных карманов, особенно вокруг выреза. Сделайте это, осмотрев нижнюю сторону блюда(рисунок 2C).
- Снимите полиэтиленовую пленку с одной стороны силиконовой полосы и поместите открытую сторону на слой уплотнительной пленки, чтобы вырез был полностью окружен слоем уплотнительной пленки(рисунок 2B). Затем осторожно надавите на силикон на слой уплотнительной пленки, чтобы запечатать область, окружающую вырез, используя чистые пальцы в перчатках.
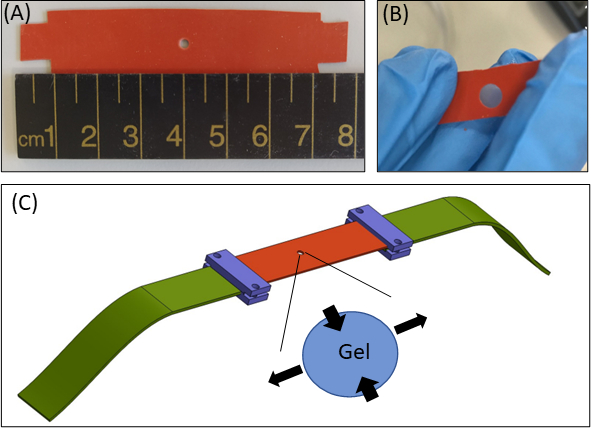
Рисунок 1: Подход к деформации гидрогеля. (A)15 × 80 мм2 силиконовая полоса с вырезом диаметром 2 мм в центре полосы(B)Силиконовая полоса с круглым вырезом со встроенным фибриновым гелем. Для иллюстративных целей вырез в силиконе больше, чем в реальных экспериментах(C)Схема растяжения с силиконовой полосой (оранжевый), круглым гелем (вырез посередине) и удлинителями ткани (зеленый), которые соединяют силикон с растягивающим устройством. Увеличенная площадь геля указывает на деформацию геля, в ответ на одноосное растяжение силикона. Для простоты сжатие по толщине геля (осиZ)на рисунке не показано. Рисунки 1B & 1C были адаптированы из Roitblat Riba et al.41Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Пример правильного размещения силиконовой полосы на уплотнительной пленке перед полимеризацией геля. (A)Размещение двух слоев герметизирующих пленок в тарелке размером 10 см (B)Размещение силиконовых полос на слоях уплотнительной пленки(C)Вид снизу тарелки, отображающий воздушное уплотнение между силиконом и слоем уплотнительной пленки. Слева:Правильное уплотнение слоя уплотнительной пленки к силиконовой полосе вокруг выреза без воздушных карманов. Справа:Неправильное уплотнение слоя уплотнительной пленки к вырезу силиконовой полосы с воздушными карманами по краю выреза. Это приведет к утечке компонентов гидрогеля под силиконом. Красная стрелка указывает на область, где образовался воздушный карман. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Приготовление тромбина с клетками
ПРИМЕЧАНИЕ: Выполняйте этот этап только в том случае, если требуется встраивание клеток в гидрогель, и в стерильных условиях в биологическую вытяжку(Таблица материалов).
- Стерилизация: за день до клеточного эксперимента поместите силиконовые полоски и слои герметизируемой пленки в 70% этанол на ночь, а затем выполните УФ-стерилизацию в течение 30 минут с каждой стороны (если посуда размером 10 см еще не стерильны, они также должны быть стерилизованы под ультрафиолетовым светом в течение 30 минут после промывки 70% этанола). УФ-система, используемая в протоколе, встроена в биологический капот.
ПРИМЕЧАНИЕ: Альтернативно, цикл автоклавной стерилизации (140 °C) может быть выполнен на силиконовых полосах, поскольку они устойчивы к 260 °C. - Выполняют подсчет клеток для определения концентрации клеток, а затем центрифугируют и повторно суспендируют клеточную гранулу с 7 мкл тромбина (2 единицы / мл) в центрифужной трубке 1,5 мл. Мы рекомендуем клеточную концентрацию 800 клеток/мкл тромбина. Держите клетки охлажденными до использования (не превышайте более получаса, чтобы избежать повреждения клеток).
4. Полимеризация фибриновых гелей
- Извлеките 2 единицы / мл тромбина и 10 мг / мл меченых растворов фибриногена из холодильника (подготовленных на этапе 1) и поместите их на лед, где они будут доступны.
ПРИМЕЧАНИЕ: Растворы хранят в холодном месте перед процессом смешивания, чтобы замедлить кинетику реакции полимеризации. Это позволяет более однородно смешивать белки. - Когда тарелка (тарелки) установлена (этап 2), извлеките 2,5 мкл меченого фибриногена и пипетку равномерно в силиконовый вырез (с прикрепив слой уплотнительной пленки к его нижней стороне) так, чтобы вся окружность выреза контактировала с фибриногеном. Будьте осторожны, чтобы не позволить каким-либо воздушным карманам или пузырькам образоваться где-либо в растворе, обращая особое внимание на нижние края выреза (интерфейс между слоем уплотнительной пленки и силиконом).
- Немедленно возьмите 2,5 мкл тромбина (с клетками/шариками или без) и пипетку непосредственно в раствор фибриногена в вырезе (достигнув конечного объема фибрина 5 мкл). Затем быстро перемешайте два раствора, тщательно пипетируя вверх и вниз ~ 10 раз. Во время процесса смешивания перемещайте наконечник по всему объему, чтобы создать как можно более однородный раствор.
- Добавьте очень небольшое количество фосфатного буферного физиологического раствора (PBS) [альтернативно клеточная среда для клеточных экспериментов, Таблица материалов]вдоль края каждой чашки, чтобы гидрогель не высох во время процесса полимеризации. Убедитесь, что нет контакта между PBS/клеточной средой и образцами, так как это повредит образец.
- Накройте посуду (блюда) и поместите их в инкубатор при 37 °C на 30 минут.
ПРИМЕЧАНИЕ: Требуемое время инкубации зависит от объема геля. Если используются большие объемы, время инкубации должно увеличиться. - Выньте тарелку (чашки) из инкубатора и добавьте PBS/клеточную среду в блюдо, погружая всю гелево-силиконовую конструкцию.
- Осторожно поднимайте образцы конструкций по одному из тарелки, следя за тем, чтобы слой герметизной пленки оставался прилип к полосе. Медленно отсоедините слой уплотнительной пленки от силикона, осторожно перекипав с одного конца силикона на другой(рисунок 3). Избегайте вытягивания из областей, близких к вырезу, где могут существовать концентрации напряжений (это в основном важно для некруглой геометрии). Избегайте любого контакта с вырезом, так как это повредит образец.
- Поместите полоску обратно в тарелку с PBS/клеточной средой так, чтобы полоска плавал в блюде. Затем отведите чашку (чашки) к стандартному микроскопу клеточной культуры, чтобы качественно оценить состояние каждого образца. Гели должны быть однородными, непрерывными на протяжении всего выреза, и никаких пузырьков не должно присутствовать. Используя рисунок 4 в качестве руководства, выберите лучшие образцы для дальнейшего анализа.

Рисунок 3: Правильное удаление слоя уплотнительной пленки со дна силиконовой полосы. Процесс удаления следует проводить медленно, чтобы гидрогель не порвал и не нарушил свою адгезию с внутренними стенками выреза. Белая стрелка показывает направление удаления. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Микроскопическое наблюдение за фибриновыми гелями в силиконовом вырезе. (A) Два примера правильно полимеризованного фибринового геля. Обратите внимание на относительную однородность геля и полную адгезию к краям выреза(B)Два примера отказа от полимеризации образца. Вверху:Обратите внимание на множество пузырьков и агрегатов, образовавшуюся с левой нижней стороны. Внизу:Обратите внимание на разрыв геля с вырезанных краев и заполнителей в нижней левой области выреза. Шкала = 300 мкм Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Загрузка образца на устройство SCyUS
- Наполните ванну средой PBS/ячейки(рисунок 5)и поместите силиконовую полоску, несущую образец геля сверху, чтобы концы сидели по обе стороны ванны. Ванна предназначена для того, чтобы избежать высыхания геля. Поместите и затяните зажимы (фиолетовый) вместе с тканевыми полосками (зеленый) так, чтобы все части соединились в одну прямую полосу с вырезом в центре(рисунок 5).
- Извлеките устройство SCyUS и прикрепите алюминиевый жидкостный колодец и прямоугольный стеклянный облицовку размером 22 мм x 40 мм (No 1 или 1,5)(рисунок 6Aiii). Прикрепите крышку к дну скважины с помощью уплотнительного материала (например, вакуумной смазки), чтобы скважину можно было заполнить жидкостью без утечки.
- Заполните колодец ~1-2 мл PBS/клеточной среды и поместите в устройство полоску + ткань +гель (рисунок 6B). Зажмите тканевую полоску(2)в кронштейн(1)так, чтобы вырез +гель (5)оказался в центре, как показано на рисунке, затем аккуратно поместите зажимную вставку(4)в устройство и зафиксируйте ее на месте.
- Затем вставьте другую сторону ткани в шпиндель (без прикрепления серводвигателя) и зафиксируйте его в шпинделье(рисунок 6C).
- Вставьте прибор SCyUS с прикрепленным образцом в ступень микроскопа(рисунок 6С). Подключите микроконтроллер(Таблица материалов)к компьютеру через USB-кабель и подключите серводвигатель к микроконтроллеру. Откройте модуль управления SCyUS на компьютере. Образец теперь готов к визуализации, чтобы проверить адекватность толщины геля и однородность волокна под конфокальным микроскопом.
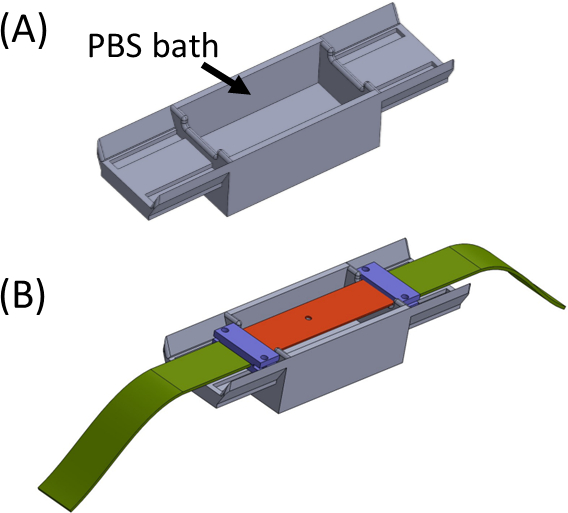
Рисунок 5: (A)Джиг, содержащий ванну PBS (напечатанную на 3D-принтере)(B)Размещение полосы на джиге для обеспечения надлежащего линейного крепления кронштейнов (фиолетового цвета) и предотвращения высыхания геля. Этот рисунок был изменен с разрешения Roitblat Riba et al.41Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
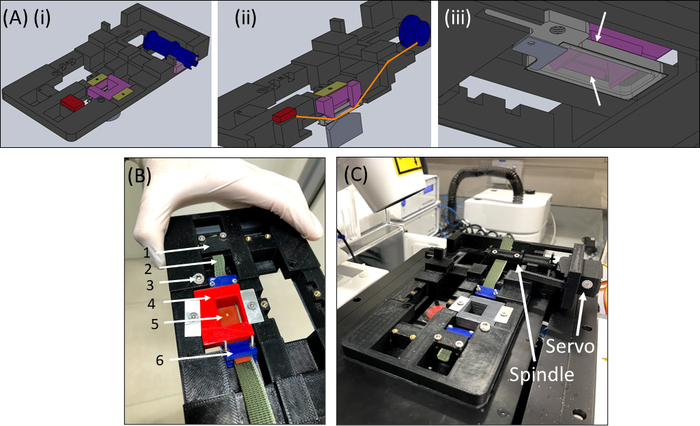
Рисунок 6: Растягивающее устройство SCyUS. (A) Несколько видов модели CAD основных частей SCyUS: шпиндель, соединенный с сервоприводом (синий), статический якорь (красный), вставка, которая прикрепляет силиконовую полосу вниз (фиолетовый) и фиксаторы, которые предотвращают подъем вставки вверх (желто-зеленый). Вид системы сверху(Ai),вид системы (Aii), вид системы(Aii),показывающий путь полосы (оранжевая линия), и вид снизу(Aiii)алюминиевой жидкостной скважины со стеклянным покровом. Жидкостный колодец можно перемещать вверх и вниз поворотом винта, установленного в основной резьбе. Движение алюминиевого колодца вверх ограничено боковыми крыльями фиолетовой вставки, как показано белыми стрелками(B)Фактическая система: ( 1 )статическийанкер (2) зеленый неэластичный тканевый (3) винт для контроля высоты алюминиевой жидкостной скважины (4) красная зажимная вставка (5) силиконовая полоса с круглым вырезом (6) синие соединительные зажимы (C) Система растяжения, размещенная на конфокальном микроскопе. Серводвигатель и шпиндель показаны стрелками. Этот рисунок был изменен с разрешения Roitblat Riba et al.41Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Обеспечьте достаточное количество геля для отбора проб
- С помощью конфокального микроскопа(Таблица материалов)берут низкоусилищное (10×) низкое разрешение (~1,4 мкм х 1,4 мкм размер пикселя) конфокальный Z-стек (≤10 Z-срезов с размером шага примерно 10 мкм достаточно) плиточное изображение всего геля с помощью лазеров 488/543/561 для проверки однородности и адгезии к окружности геометрического выреза по всей толщине силикона(рисунок 7A-B). Используйте это изображение Z-стека в качестве карты для следующих шагов.
- Используя живую визуализацию с низким разрешением, отсканируйте гель и определите самое низкое Z-положение,где полная адгезия к внутренним стенкам выреза очевидна без разрывов или пузырьков, и обратите внимание на Z-расположениемикроскопа(Zl). Чтобы определить полную адгезию геля к силикону по всей его окружности, под микроскопом сканируют интерфейс флуоресцентной этикетки геля и силиконовой полосы (темный фон)(рисунок 7С).
- Двигайтесь вверх в направлении Zдо тех пор, пока в геле больше не будет непрерывности, и обратите внимание на положение Z( Zu):
- Вычтите верхний предел(Zu) направления Zиз нижнего предела(Zl). Это эталонная толщина образца (Zo):

Если Zo ≥ 100 мкм, то гель считается удовлетворительным для анализа. Обратите внимание, что толщина силиконового выреза составляет около 500 мкм, но полимеризация геля в вырезе обычно приводит к меньшей толщине геля. 100 мкм - это минимальная рекомендуемая толщина для обеспечения стабильного процесса растяжения, без разрывов или отрыва геля от силиконового выреза.
ПРИМЕЧАНИЕ: В разных местах XY толщина геля может варьироваться. Этот раздел протокола измеряет минимальную толщину геля, позволяя определить качество геля и указать, достаточно ли его для растяжения. Кроме того, нахождение центра геля обеспечивает ориентир для возврата к пост-растяжению, будь то статическое или динамическое.

Рисунок 7: Однородность геля. Изображения плиток были захвачены и сшиты с использованием программного обеспечения конфокального микроскопа (Таблица материалов) (A) Одно сшитое изображение Z-срезаплитки образца фибринового геля с относительно неоднородной плотностью волокна из-за неправильного смешивания тромбина и фибриногена предварительно полимеризации. Этот гель не обеспечит надежного анализа (B) Одна сшитая плитка Z-срезизображения образца фибринового геля с относительно однородной плотностью волокна. Это приемлемый гель для экспериментов по растяжке. Шкала для изображений A & B составляет 200 мкм (C)Увеличение интерфейса между флуоресцентно меченым гелем (красный) и силиконом (черный фон). Шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
7. SCyUS операция, растяжение и визуализация
- Теперь, когда образец был определен как удовлетворительное качество и установлен на устройстве SCyUS должным образом, определите предварительно растянутое положение образца. Это достигается с помощью живой визуализации под конфокальным микроскопом (аналогично шагу 6.2).
- Убедитесь, что серводвигатель находится в нулевом положении, нажав кнопку Go To Zero Servo Pos (Щелкните на рисунке 8A и убедитесь, что на рисунке 8B отображается ноль) и прикрепите его к растягивательному устройству, как показано на рисунке 6C.
ПРИМЕЧАНИЕ: Делайте этот шаг медленно и осторожно, чтобы не натянуть образец. - Во время визуализации образца перемещайте двигатель на один градус(рисунок 8C)за раз по часовой стрелке, нажимая кнопку +1, пока не будет замечено движение правой стороны выреза. Затем переверните движение назад(рисунок 8D)обратно в положение предпоследнего шага, нажав на кнопку -1. Это подтверждает, что образец находится под минимальным напряжением. Нажмите на кнопку Set Min Servo Position (Рисунок 8E),чтобы установить опорное положение. Вернуться в опорное положение можно в любое время, нажав кнопку Go To Min Servo Position (рисунок 8F).
ПРИМЕЧАНИЕ: Для минимизации ошибок рекомендуется использовать объектив с высоким увеличением (≥40×). - Захват изображения плитки с высоким увеличением (40×) с высоким разрешением (~0,2 мкм × размером пикселя 0,2 мкм) с одним Z-срезом всей области геля. Он будет использоваться в качестве эталонного изображения для анализа постобработки. Рекомендуется захватывать одно Z-срезное изображение в середине толщины геля (с помощью Zo из экв. 1),это позволит вернуться примерно в то же Z-положениепосле растяжения. Кроме того, учитывайте, что изображения плитки с высоким разрешением всей области геля занимают значительное время (~ 20-30 мин).
- Теперь образец готов к статическому растяжению. Отрегулируйте серводвигатель до желаемой величины растяжения, продвигаясь на один градус(рисунок 8C)за раз в графическом интерфейсе (выполняйте это медленно, около 1 градуса в секунду).
- Убедитесь, что серводвигатель находится в нулевом положении, нажав кнопку Go To Zero Servo Pos (Щелкните на рисунке 8A и убедитесь, что на рисунке 8B отображается ноль) и прикрепите его к растягивательному устройству, как показано на рисунке 6C.
- На каждой величине растяжения, где необходим анализ, захватите одно изображение плитки с высоким разрешением Z-среза всей области геля для анализа после обработки. Подобно шагу 6.2, убедитесь, что гель не отделился от силикона по всей его окружности, путем сканирования интерфейса между гелем (красный) и силиконом (темный фон), ища изменения адгезии от предыдущей величины растяжения.
ПРИМЕЧАНИЕ: Во время активации двигателя используйте живую визуализацию, чтобы следить за расположением геля в X-Y (с низким разрешением и низким увеличением). Гель испытывает эффект Z-Пуассона, когда дно геля поднимается, поэтому Z-положениемикроскопа также должно быть скорректировано в соответствии с приблизительным центром толщины геля для каждой величины растяжения. Это может быть достигнуто путем пересчета Zo (экв. 1)для каждой величины растяжения. Поскольку растяжение в Z-направленииотносительно однородно, не критично найти точную глубину центра геля.
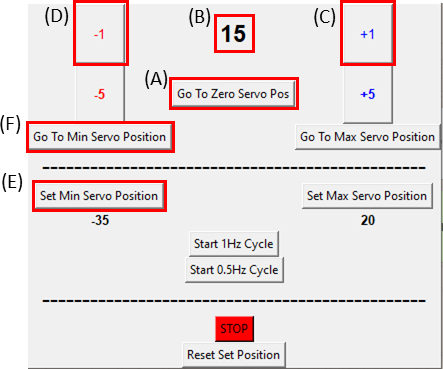
Рисунок 8: Графический интерфейс для модуля управления SCyUS. (A) Положение двигателя в градусах. Значение колеблется от -90° до 90°(B)'Установить минимальное положение сервопривода'. Эта кнопка позволяет установить заданное минимальное положение, для установки нового опорного положения, которое отличается от нулевого положения сервопривода(C)Кнопка «Плюс 1°» перемещает серводвигатель на один градус по часовой стрелке (D) Кнопка «Минус 1°» перемещает серводвигатель на один градус против часовой стрелки(E)Кнопка «Перейти в нулевую позицию» устанавливает положение серводвигателя на 0° ([A] будет установлено на ноль) (F) Кнопка «Перейти к минимальному положению сервопривода» перемещает серводвигатель в определенное пользователем положение «Min». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
8. Постобработка внешних измерений деформации
- Чтобы измерить эффективные деформации границ выреза, измерьте длины от края до края в направлении растяжения (осьX)в центре оси Y(рисунок 9A).
- Загрузите предварительно растягиваемое изображение в программное обеспечение для обработки изображений (ImageJ FIJI43)и измерьте расстояние от края до края, которое определяется как осевая длина отверстия (
 ) в центре.
) в центре. - Определите наибольшее расстояние сверху вниз как перпендикулярное расстояние (
 ).
). - Повторите этот процесс для всех изображений интервала растяжения и рассчитайте осевые (
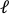 ) и перпендикулярные (
) и перпендикулярные (  ) расстояния от выреза периферии(рисунок 9A,внизу), а затем выполните следующие расчеты, чтобы найти деформации вырезанных краев:
) расстояния от выреза периферии(рисунок 9A,внизу), а затем выполните следующие расчеты, чтобы найти деформации вырезанных краев:
- Загрузите предварительно растягиваемое изображение в программное обеспечение для обработки изображений (ImageJ FIJI43)и измерьте расстояние от края до края, которое определяется как осевая длина отверстия (
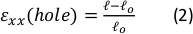

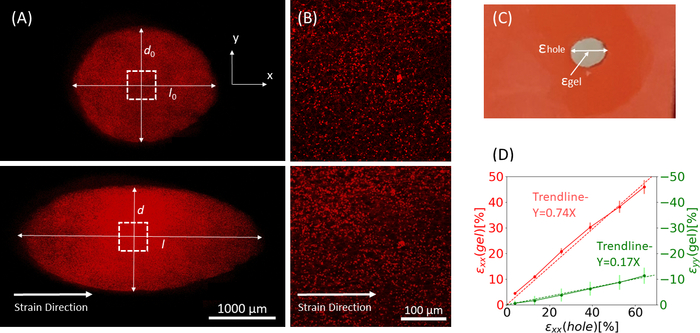
Рисунок 9: Гелевые деформации из-за внешнего растяжения силиконовой полоски. (A) X-Y поперечное сечение нерастянутого фибринового геля (сверху), и после применения εотверстия = 64% деформации вдоль направления x (внизу). Гель сложен флуоресцентными бусинами. Соответствующие длины d и l, используемые для расчета εотверстия, указаны на изображениях(B)Увеличенные изображения пунктирной квадратной области, отмеченной в A (C)Иллюстрация типов деформаций, рассмотренных в данном исследовании: εотверстие представляет собой осевую деформацию выреза на его максимальном диаметре, а εгель представляет собой осевую деформацию в центре геля (измеренную по расположениям бисерного агрегата)(D)Была обнаружена линейная зависимость между εотверстием и εгелем в обоих направлениях xx (красная линия) и yy (зеленая линия). Эта цифра была адаптирована с разрешения Roitblat Riba et al.41Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
9. Анализ ориентации волокон
- Используйте количественную оценку выравнивания волокон, чтобы охарактеризовать структурную реакцию волокнистого геля на увеличение величин растяжения. Загрузите изображения с высоким разрешением в программное обеспечение ImageJ FIJI (NIH)43, а затем проанализируйте с помощью модуля OrientationJ (EPFL)44 (Настройки: градиент Гаусса и 3-пиксельное окно, рисунок 10).
- Вычислить 2D нематический параметр порядка (NOP) гистограммы ориентации как:45
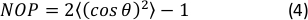
ПРИМЕЧАНИЕ: Значение NOP = 1 указывает на идеальное выравнивание по осевому направлению (нулевой угол), а NOP = 0 указывает на изотропию. Угол ориентации, θ,является углом волокна по отношению к оси деформации (оси X), полученным путем анализа изображения и точно определенным в документации OrientationJ. 44 44
- Вычислить 2D нематический параметр порядка (NOP) гистограммы ориентации как:45

Рисунок 10: Анализ ориентации волокон с использованием программного обеспечения FIJI ImageJ. (A) Главное меню ImageJ со стрелкой, указывающей местоположение выпадающего меню «Плагины», где можно найти «OrientationJ». В расширенном меню 'OrientationJ' нажмите на опцию 'OrientationJ Distribution'(B)Модуль распределения OrientationJ. Установите для «Локального окна σ» значение 3 пикселя, а для «Градиента» — значение «Гауссов». Затем нажмите кнопку «Выполнить» (красная стрелка). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
10. Ручной внутренний анализ деформации геля
- Выполняя живую визуализацию гидрогеля со встроенными шариками с высоким увеличением, вручную найдите интересующую область (ROI) с легко узнаваемыми характеристиками (например, агрегатами бусин), чтобы вернуться в то же место после каждой величины растяжения.
ПРИМЕЧАНИЕ: Сжатие в Z-направлении (эффект Пуассона) может привести к увеличению плотности бусин по мере увеличения растяжения, поэтому мы предлагаем выбирать бисенные агрегаты достаточно большие, чтобы их можно было четко идентифицировать. Этот протокол требует анализа центральной области фибринового геля, хотя может быть выбрана любая область. - В предварительном растяжении (шаг 6) запишите Z-стековое изображение выбранной окупаемости инвестиций с высоким разрешением. После каждого требуемого интервала растяжения вернитесь к той же окупаемоотвернеке инвестиций и повторите процесс захвата изображения.
- Возьмите изображения и импортируйте их в ImageJ. В ROI запишите расположение пикселя X-Y каждого видимого агрегата бусин. Перенесите записанные данные в электронную таблицу.
- Измерьте расстояния между каждой парой агрегатов и сравните их с расстояниями тех же пар на эталонном изображении, что позволит рассчитать деформации в направлениях X и Y.
ПРИМЕЧАНИЕ: Если непрерывный фильм в реальном времени записывается во время растяжения геля (вместо статического захвата изображения), автоматический анализ деформаций может быть выполнен методами цифрового изображения или объемных корреляций (DIC / DVC), как было продемонстрированоранее 46,47. Однако следует отметить, что автоматический анализ DIC/DVC является сложной задачей в этой настройке, так как Z-стекдвижется не только в плоскости X-Y, но и в направлении Zиз-за эффекта Пуассона (сжатия), что приводит к значительным дрейфам во время записанного фильма.
Access restricted. Please log in or start a trial to view this content.
Результаты
Репрезентативные данные статического растяжения возрастающих величин, нанесенного на силиконовую полосу, несущий 3D-гидрогель фибрина, встроенный флуоресцентными шариками 1 мкм, показаны на рисунке 9. Анализ демонстрирует влияние растяжения силикона на геометрич?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Способ и протокол, представленные здесь, в значительной степени основаны на нашем предыдущем исследовании Roitblat Riba et al.41 Мы включаем здесь полное автоматизированное проектирование (CAD), Python и коды микроконтроллеров устройства SCyUS.
К основным преимущества...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Некоторые фигуры, включенные здесь, были адаптированы с разрешения Центра проверки авторских прав: Springer Nature, Annals of Biomedical Engineering. Процеживание 3D-гидрогелей с однородными деформациями оси Z при одновременном создании изображений в живой микроскопии, A. Roitblat Riba, S. Natan, A. Kolel, H. Rushkin, O. Tchaicheeyan, A. Lesman, Copyright© (2019).
https://doi.org/10.1007/s10439-019-02426-7
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 546 carboxylic acid, succinimidyl ester | Invitrogen | A20002 | |
| Cell Medium (DMEM High Glucose) | Biological Industries | 01-052-1A | Add 10% FBS, 1% PNS, 1% L-Glutamine, 1% Sodium Pyruvate |
| Cover Slip #1.5 | Bar-Naor Ltd. | BN72204-30 | 22×40 mm |
| DIMETHYL SULPHOXIDE 99.5% GC DMSO | Sigma-Aldrich Inc. | D-5879-500 ML | |
| Dulbecco's Phosphate-Buffered Saline | Biological Industries | 02-023-1A | |
| EVICEL Fibrin Sealant (Human) | Omrix Biopharmaceuticals | 3902 | Fibrinogen: 70 mg/mL, Thrombin: 800-1200 IU/mL |
| Fibrinogen Buffer | N/A | Recipe for 1L: 7g NaCl, 2.94g trisodium citrate dihydrate, 9g glycine, 20g arginine hydrochloride & 0.15g calcium chloride dihydrate. Bring final volume to 1L with PuW (pH 7.0-7.2) | |
| Fluorescent micro-beads FluoSpheres (1 µm) | Invitrogen | F8820 | Orange (540/560) Provided as suspension (2% solids) in water plus 2 mM sodium azide |
| High-Temperature Silicone Rubber | McMaster-Carr | 3788T41 | 580 µm-thick E = 1.5 Mpa Poisson Ratio = 0.48 Tensile Strength = 4.8 MPa Upper limit of stretch = +300% engineering strain |
| HiTrap desalting column 5 mL (Sephadex G-25 packed) | GE Healthcare | 17-1408-01 | |
| HIVAC-G High Vacuum Sealing Compound | Shin-Etsu Chemical Co., Ltd. | HIVAC-G 100 | |
| ImageJ FIJI software39 | National Institute of Health, Bethesda, MD | Version 1.8.0_112 | |
| Microcontroller (Adruino Uno + Adafruit Motorshield v2.3) | Arduino/Adafruit | Arduino-DK001/Adafruit-1438 | |
| MicroVL 21R Centrifuge | Thermo Scientific | 75002470 | |
| Parafilm | Bemis | PM-996 | |
| Primovert Light Microscope | Carl Zeiss Suzhou Co., Ltd. | 491206-0011-000 | |
| SCyUS CAD (Solidworks) | Dassault Systèmes | N/A | |
| SCyUS Code37 | N/A | N/A | |
| Servomotor - TowerPro SG-5010 | Adafruit | 155 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | For 50 mL tubes |
| Sterile 10 cm non-culture plates | Corning | 430167 | |
| Thrombin buffer | N/A | Recipe for 1L: 20g mannitol, 8.77g NaCl, 2.72g sodium acetate trihydrate, 24 mL 25% Human Serum Albumin, 5.88g calcium chloride. Bring final volume to 1L with PuW (pH 7.0) | |
| Trypsin EDTA Solution B (0.25%), EDTA (0.05%) | Biological Industries | 03-052-1B | |
| USB Cable (Type B Male to Type A Male) | N/A | N/A | |
| Zeiss LSM 880 Confocal Microscope | Carl Zeiss AG | 2811000417 | |
| ZEN 2.3 SP1 FP3 (black) | Carl Zeiss AG | Release Version 14.0.0.0 |
Ссылки
- Bleuel, J., Zaucke, V., Bruggemann, G. P., Niehoff, A. Effects of cyclic tensile strain on chondrocyte metabolism: a systematic review. PLoS ONE. 10, 0119816(2015).
- Pennisi, C. P., Olesen, C. G., de Zee, M., Rasmussen, J., Zachar, V. Uniaxial cyclic strain drives assembly and differentiation of skeletal myocytes. Tissue Engineering Part A. 17, 2543-2550 (2011).
- Grodzinsky, A. J., Levenston, M. E., Jin, M., Frank, E. H. Cartilage Tissue Remodeling in Response to Mechanical Forces. Annual Review of Biomedical Engineering. 2 (1), 691-713 (2000).
- Munster, S., et al. Strain history dependence of the nonlinear stress response of fibrin and collagen networks. Proceedings of the National Academy of Sciences of the USA. 110, 12197-12202 (2013).
- Vader, D., Kabla, A., Weitz, D., Mahadevan, L. Strain-induced alignment in collagen gels. PLoS ONE. 4, 5902(2009).
- Badylak, S. F. The extracellular matrix as a scaffold for tissue reconstruction. Seminars in Cell & Developmental Biology. 13 (5), 377-383 (2002).
- Natan, S., Koren, Y., Shelah, O., Goren, S., Lesman, A. Molecular Biology of the Cell. 31 (14), 1474-1485 (2020).
- Ban, E., et al. Mechanisms of Plastic Deformation in Collagen Networks Induced by Cellular Forces. Biophysical Journal. 114 (2), 450-461 (2018).
- Kim, J., et al. Stress-induced plasticity of dynamic collagen networks. Nature Communications. 8, 842(2017).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Basu, A., Janmey, P. A., Yodh, A. G. Non-affine deformations in polymer hydrogels. Soft Matter. 8, 8039-8049 (2012).
- Muiznieks, L. D., Keeley, F. W. Molecular assembly and mechanical properties of the extracellular matrix: A fibrous protein perspective. Biochimica et Biophysica Acta. 1832, 866-875 (2012).
- Brown, A. E. X., Litvinov, R. I., Discher, D. E., Purohit, P. K., Weisel, J. W. Multiscale mechanics of fibrin polymer: gel stretching with protein unfolding and loss of water. Science. 325, 741-744 (2009).
- Carroll, S. F., Buckley, C. T., Kelly, D. J. Cyclic tensile strain can play a role in directing both intramembranous and endochondral ossification of mesenchymal stem cells. Frontiers in Bioengineering and Biotechnology. 5, 73(2017).
- Livne, A., Bouchbinder, E., Geiger, B. Cell reorientation under cyclic stretching. Nature Communications. 5, 3938(2014).
- Wang, L., et al. Patterning cellular alignment through stretching hydrogels with programmable strain gradients. ACS Applied Materials & Interfaces. 7, 15088-15097 (2015).
- Xu, G. K., Feng, X. Q., Gao, H. Orientations of Cells on Compliant Substrates under Biaxial Stretches: A Theoretical Study. Biophysical Journal. 114 (3), 701-710 (2017).
- Chagnon-Lessard, S., Jean-Ruel, H., Godin, M., Pelling, A. E. Cellular orientation is guided by strain gradients. Integrative Biology (United Kingdom). 9 (7), 607-618 (2013).
- Lu, J., et al. Cell orientation gradients on an inverse opal substrate. ACS Applied Materials & Interfaces. 7 (19), 10091-10095 (2015).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125, 3015-3024 (2012).
- Bono, N., et al. Unraveling the role of mechanical stimulation on smooth muscle cells: a comparative study between 2D and 3D models. Biotechnology and Bioengineering. 113, 2254-2263 (2016).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8, 839-845 (2007).
- Riehl, B. D., Park, J. H., Kwon, I. K., Lim, J. Y. Mechanical stretching for tissue engineering: two-dimensional and three-dimensional constructs. Tissue Engineering Part B: Reviews. 18, 288-300 (2012).
- Flexcell. Linear Tissue Train Culture Plate. Flexcell. , (2019).
- Flexcell. Tissue Train. Flexcell. , (2019).
- CellScale. MCT6 Stretcher. CellScale. , (2019).
- STREX. STB-150. STREX. , (2019).
- STREX. Stretch Chambers. STREX. , (2019).
- Kamble, H., Barton, M. J., Jun, M., Park, S., Nguyen, N. T. Cell stretching devices as research tools: engineering and biological considerations. Lab on a Chip. 16, 3193-3203 (2016).
- Weidenhamer, N. K., Tranquillo, R. T. Influence of cyclic mechanical stretch and tissue constraints on cellular and collagen alignment in fibroblast-derived cell sheets. Tissue Engineering Part C: Methods. 19, 386-395 (2013).
- Yung, Y. C., Vandenburgh, H., Mooney, D. J. Cellular strain assessment tool (CSAT): precision-controlled cyclic uniaxial tensile loading. Journal of Biomechanics. 42, 178-182 (2009).
- Chen, K., et al. Role of boundary conditions in determining cell alignment in response to stretch. Proceedings of the National Academy of Sciences of the USA. 115, 986-991 (2018).
- Heher, P., et al. A novel bioreactor for the generation of highly aligned 3D skeletal muscle-like constructs through orientation of fibrin via application of static strain. Acta Biomaterialia. 24, 251-265 (2015).
- Foolen, J., Deshpande, V. S., Kanters, F. M. W., Baaijens, F. P. T. The influence of matrix integrity on stress-fiber remodeling in 3D. Biomaterials. 33, 7508-7518 (2012).
- Walker, M., Godin, M., Pelling, A. E. A vacuum-actuated microtissue stretcher for long-term exposure to oscillatory strain within a 3D matrix. Biomedical Microdevices. 20, 43(2018).
- Zhao, R. G., Boudou, T., Wang, W. G., Chen, C. S., Reich, D. H. Decoupling cell and matrix mechanics in engineered microtissues using magnetically actuated microcantilevers. Advanced Materials. 25, 1699-1705 (2013).
- Li, Y. H., et al. Magnetically actuated cell-laden micro-scale hydrogels for probing strain-induced cell responses in three dimensions. NPG Asia Materials. 8, 238(2016).
- Li, Y. H., et al. An approach to quantifying 3D responses of cells to extreme strain. Scientific Reports. 6, 19550(2016).
- Humphrey, J. D., et al. A theoretically-motivated biaxial tissue culture system with intravital microscopy. Biomechanics and Modeling in Mechanobiology. 7, 323-334 (2008).
- Niklason, L. E., et al. Enabling tools for engineering collagenous tissues integrating bioreactors, intravital imaging, and biomechanical modeling. Proceedings of the National Academy of Sciences of the USA. 107, 3335-3339 (2010).
- Roitblat Riba, A., et al. Straining 3D hydrogels with uniform z-axis strains while enabling live microscopy imaging. Annals of Biomedical Engineering. , (2019).
- Gomez, D., Natan, S., Shokef, Y., Lesman, A. Mechanical interaction between cells facilitates molecular transport. Advanced Biosystems. 3 (12), 1900192(2019).
- Schindelin, J., et al. Fiji: an open- source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- EPFL Switzerland. OrientationJ plug in. EPFL Switzerland. , (2019).
- Goren, S., Koren, Y., Xu, X., Lesman, A. Elastic anisotropy governs the decay of cell-induced displacements. Biophysical Journal. 118 (5), 1152-1164 (2019).
- Notbohm, J., Lesman, A., Tirrell, D. A., Ravichandran, G. Quantifying cell-induced matrix deformation in three dimensions based on imaging matrix fibers. Integrative Biology. 7 (10), 1186-1195 (2015).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. Journal of Cell Biology. 205 (2), 155-162 (2014).
- Cha, C. Y., et al. Tailoring Hydrogel Adhesion to Polydimethylsiloxane Substrates Using Polysaccharide Glue. Angewandte Chemie International Edition. 52, 6949-6952 (2019).
- Wirthl, D., et al. Instant tough bonding of hydrogels for soft machines and electronics. Science Advances. 3, (2017).
- Juarez-Moreno, J. A., Avila-Ortega, A., Oliva, A. I., Aviles, F., Cauich-Rodriguez, J. V. Effect of wettability and surface roughness on the adhesion properties of collagen on PDMS films treated by capacitively coupled oxygen plasma. Applied Surface Science. 349, 763-773 (2015).
- Kim, H. T., Jeong, O. C. PDMS surface modification using atmospheric pressure plasma. Microelectronic Engineering. 88, 2281-2285 (2011).
- Prasad, B. R., et al. Controlling cellular activity by manipulating silicone surface roughness. Colloids and Surfaces. 78, 237-242 (2010).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены