Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Souche contrôlée d’hydrogels 3D sous imagerie par microscopie dynamique
Dans cet article
Résumé
La méthode présentée implique l’étirement uniaxial des hydrogels mous 3D incorporés dans le caoutchouc de silicone tout en permettant la microscopie confocale vivante. La caractérisation des souches externes et internes d’hydrogel ainsi que l’alignement des fibres sont démontrés. Le dispositif et le protocole développés peuvent évaluer la réponse des cellules à divers régimes de déformation.
Résumé
Les forces externes sont un facteur important dans la formation, le développement, et le maintien de tissu. Les effets de ces forces sont souvent étudiés à l’aide de méthodes d’étirement in vitro spécialisées. Divers systèmes disponibles utilisent des civières 2D à base de substrat, tandis que l’accessibilité des techniques 3D pour filtrer les hydrogels mous est plus restreinte. Ici, nous décrivons une méthode qui permet l’étirement externe des hydrogels mous de leur circonférence, en utilisant une bande élastique de silicone comme support d’échantillon. Le système d’étirement utilisé dans ce protocole est construit à partir de pièces imprimées en 3D et d’électronique à faible coût, ce qui le rend simple et facile à reproduire dans d’autres laboratoires. Le processus expérimental commence par la polymérisation d’hydrogels de fibrine molle épais (>100 μm) (module élastique d’environ 100 Pa) dans une découpe au centre d’une bande de silicone. Les constructions en gel de silicone sont ensuite fixées au dispositif d’étirement imprimé et placées sur l’étage du microscope confocal. Sous microscopie en direct, le dispositif d’étirement est activé et les gels sont entifiés à différentes magnitudes d’étirement. Le traitement d’image est ensuite utilisé pour quantifier les déformations de gel résultantes, démontrant des déformations relativement homogènes et un alignement des fibres tout au long de l’épaisseur 3D du gel (axeZ). Les avantages de cette méthode incluent la possibilité de filtrer des hydrogels extrêmement mous en 3D lors de l’exécution de la microscopie in situ, et la liberté de manipuler la géométrie et la taille de l’échantillon en fonction des besoins de l’utilisateur. De plus, avec une adaptation appropriée, cette méthode peut être utilisée pour étirer d’autres types d’hydrogels (par exemple, le collagène, le polyacrylamide ou le polyéthylène glycol) et peut permettre l’analyse de la réponse des cellules et des tissus aux forces externes dans des conditions 3D plus biomimétiques.
Introduction
La réponse tissulaire aux forces mécaniques fait partie intégrante d’un large éventail de fonctions biologiques, y compris l’expressiongénique 1,la différenciation cellulaire2et le remodelage tissulaire3. De plus, les changements induits par la force dans la matrice extracellulaire (ECM) tels que l’alignement et la densification des fibres peuvent avoir un impact sur le comportement cellulaire et la formation des tissus4,5,6. La structure de maille fibreuse de l’ECM possède des propriétés mécaniques intrigantes, telles que l’élasticité non linéaire, la déformation non affine et les déformations plastiques7,8,9,10,11,12. Ces propriétés ont un impact sur la façon dont les cellules et leur microenvironnement environnant répondent aux forces mécaniques externes13,14. Comprendre comment l’ECM et les tissus répondent aux forces mécaniques permettra de progresser dans le domaine de l’ingénierie tissulaire et dans le développement de modèles informatiques et théoriques plus précis.
Les méthodes les plus courantes pour étirer mécaniquement des échantillons se sont concentrées sur des substrats 2D chargés de cellules pour explorer les effets sur le comportement des cellules. Il s’agit, par exemple, d’appliquer une contrainte sur des substrats de polydiméthylsiloxane (PDMS) et d’analyser les angles de réorientation cellulaire par rapport à la direction d’étirement15,16,17,18,19. Pourtant, les méthodes d’étude de la réponse des hydrogels 3D intégrés aux cellules à l’étirement externe, une situation qui imite plus étroitement le microenvironnement tissulaire, sont plus limitées. Les progrès vers les méthodes d’étirement 3D sont d’une importance particulière car les cellules se comportent différemment sur les substrats 2D par rapport aux matrices 3D20. Ces comportements incluent le réalignement cellulaire, les niveaux d’expression des protéines et les modèles de migration21,22,23.
Les procédés et dispositifs qui permettent l’étirement d’échantillons 3D comprennent à la fois les24,25,26,27,28 disponibles dans le commerce et ceux développés pour la recherche en laboratoire29. Ces procédés utilisent des tubes en silicone distensibles30,des chambres multi-puits31,des pinces26,32,des bioréacteurs11,33,des cantilevers34,35,36,et des aimants37,38. Certaines techniques génèrent un étirement qui déforme localement les hydrogels 3D, par exemple en tirant des aiguilles de deux points uniques dans le gel5,tandis que d’autres permettent la déformation de l’ensemble du gel16. De plus, la plupart de ces systèmes se concentrent sur l’analyse du champ de déformation dans le plan X-Y, avec des informations limitées sur le champ de déformation dans la direction Z. De plus, seule une poignée de ces appareils sont capables d’imagerie microscopique in situ. Le principal défi de l’imagerie in situ à fort grossissement (p. ex. microscope confocal) est la distance de travail limitée de quelques centaines de microns entre la lentille de l’objectif et l’échantillon. Les dispositifs qui permettent l’imagerie en direct pendant l’étirement sacrifient l’uniformité de la déformation dans l’axe Zou sont relativement complexes et difficiles à reproduire dans d’autres laboratoires39,40.
Cette approche d’étirement des hydrogels 3D permet une contrainte uniaxiale statique ou cyclique pendant la microscopie confocale en direct. Le dispositif d’étirement (appelé « Brancard uniaxial cyclique intelligent - SCyUS ») est construit à l’aide de pièces imprimées en 3D et de matériel à faible coût, permettant une reproduction facile dans d’autres laboratoires. Attaché à l’appareil est un caoutchouc de silicone disponible dans le commerce avec une découpe géométrique en son centre. Les composants d’hydrogel sont polymérisés pour remplir la découpe. Lors de la polymérisation, les hydrogels biologiques, tels que la fibrine ou le collagène, adhèrent naturellement aux parois intérieures de la découpe. En utilisant le SCyUS, la bande de silicone est étirée de manière uniaxially, transférant des souches contrôlées à l’hydrogel 3D intégré41.
Ce système permet une combinaison unique de fonctionnalités et d’avantages par rapport à d’autres méthodes existantes. Tout d’abord, le système permet l’étirement uniaxial d’hydrogels mous 3D épais (>100 μm d’épaisseur, <1 kPa rigidité) à partir de leur périphérie, avec une déformation Zhomogène dans tout l’hydrogel. Ces hydrogels sont trop mous pour être saisis et étirés par des techniques de traction conventionnelles. Deuxièmement, le dispositif d’étirement peut être facilement reproduit dans d’autres laboratoires, car l’impression 3D est facilement disponible pour les chercheurs et l’électronique utilisée dans la conception est peu coûteuse. Troisièmement, et c’est peut-être la caractéristique la plus attrayante, la géométrie et la taille de la découpe dans la bande de silicone peuvent être facilement manipulées, ce qui permet des gradients de déformation et des conditions limites accordables ainsi que l’utilisation d’une variété de volumes d’échantillons, jusqu’à quelques microlitres.
Le protocole présenté consiste à mouler le gel de fibrine en disques de ~2 mm de diamètre dans des bandes de caoutchouc de silicone de 0,5 mm d’épaisseur procédé par étirement uniaxial sous microscopie confocale vivante. Ce qui suit traite en détail des procédures expérimentales de mesure et d’analyse des déformations agissant sur la découpe géométrique, des déformations internes développées dans l’hydrogel, ainsi que de l’alignement des fibres résultant après diverses manipulations d’étirement. En conclusion, la possibilité d’incorporer des cellules dans le hydrogel et de les exposer à l’étirement externe commandé est discutée.
Protocole
1. Préparation de la solution (à effectuer à l’avance)
- Étiquetage du fibrinogène
REMARQUE: L’étape d’étiquetage n’est requise que si l’analyse de la déformation du gel de fibrine est souhaitée. Pour les expériences cellulaires, il est possible d’utiliser un gel non étiqueté.- Ajouter 38 μL de colorant fluorescent à l’ester de succinimidyle à 10 mg/mL (dissous dans du DMSO) à 1,5 mL de solution de fibrinogène à 15 mg/mL (rapport molaire de 5:1) dans un tube de centrifugation de 50 mL et placer sur un agitateur pendant 1 heure à température ambiante. Ensuite, placez le tube dans la centrifugeuse pendant 3 minutes à 800 x g (température ambiante).
- Filtrer le surnageant de l’étape précédente à travers une colonne de dessalement emballée avec de la résine gel de dextrane (Table des matériaux) pour séparer le colorant n’ayant pas réagi,42 en suivant ces étapes.
- Prélavez la colonne avec 25 mL de tampon de fibrinogène.
- Injectez lentement le fibrinogène marqué de l’étape 1.1.1 dans la colonne, en vous assurant qu’il n’y a pas de bulles entrant dans le filtre. Jetez le premier ~ 0,3 mL de solution éluée (4-6 gouttes de liquide de couleur faible). Ensuite, collectez les 1,0 à 1,5 mL suivants de solution purifiée (suivez le protocole du fabricant pour plus de détails).
- Terminez le processus de filtration en stérilisant la solution purifiée résultante à l’aide d’un filtre à seringue (0,22-0,45 μm).
- Pour nettoyer et recycler la colonne, laver avec 20 mL de tampon de fibrinogène, puis conserver dans 25 mL d’éthanol à 20%.
- Après l’élution, divisez le fibrinogène marqué purifié résultant en petites aliquotes d’environ 7 à 50 μL, en fonction du nombre souhaité de gels étirés. Pour chaque gel circulaire étiré de 2 mm de diamètre, préparer environ 3,5 μL de fibrinogène (2,5 μL seront utilisés par gel + 1 μL pour les erreurs de pipetage).
- Entreposer les aliquotes dans un congélateur à -20 °C. Ils peuvent être utilisés jusqu’à environ un an (il n’est pas recommandé de décongeler et de congeler à nouveau).
- Pour le reste de ce protocole, conserver environ 7 μL du fibrinogène marqué purifié au réfrigérateur (4 °C) jusqu’à l’étape 4. Ce volume est destiné à la création de deux gels étirés (2,5 μL est nécessaire par gel, et un volume supplémentaire de 1 μL est utilisé pour tenir compte des erreurs dans la préparation de l’échantillon).
REMARQUE : Cette procédure de filtrage dilue généralement la solution initiale de fibrinogène de 15 mg/mL à une concentration finale d’environ 10 mg/mL. Le facteur de dilution dépend du volume initial et de la concentration de fibrinogène, comme spécifié dans le protocole du fabricant.
- Préparer 7 μL de solution de thrombine (diluer à l’aide d’un tampon de thrombine à 2 unités/mL, Table des matériaux)et conserver au réfrigérateur (4 °C) jusqu’à l’étape 4. Ce volume est destiné à remplir les découpes de deux gels étirés.
REMARQUE : Afin d’effectuer une analyse de déformation interne, des billes sphériques fluorescentes de 1 μm de diamètre (achetées en suspension [2 % de solides] dans de l’eau plus 2 mM de NaN3) doivent être ajoutées à la solution de thrombine (un rapport de 1:25 v/v % de perles:thrombine est recommandé pour un objectif de 40x). Les billes ne doivent être incluses que lorsque des mesures de déformation interne sont souhaitées, en présence ou en l’absence de cellules.
2. Préparation de bande de silicone
- Récupérez le caoutchouc de silicone de 0,5 mm d’épaisseur et coupez-le en bandes de 15 x 80 mm2 avec un trou de 2 mm de diamètre au centre de la bande(Figure 1). Si possible, utilisez une découpeuse laser programmable pour une haute précision. Si des machines programmables ne sont pas disponibles, les ciseaux sont suffisants pour couper le contour de la bande et un petit trou-poinçon est suffisant pour la découpe centrale.
REMARQUE: Le caoutchouc de silicone commercial est généralement acheté avec une pellicule de plastique des deux côtés. Conservez le revêtement en plastique d’origine des deux côtés du silicone si possible. Si vous réutilisez des bandes de silicone d’une expérience précédente, traitez-les avec de la trypsine pendant 0,5 heure, trempez-les dans du NaOH 0,2 M pendant 0,5 heure, puis faites tremper dans de l’éthanol à 70% pendant 1 heure. Laissez-les sécher avant utilisation. - Préparez des couches de film d’étanchéité (hydrophobe) de dimensions d’au moins 20 × 30 mm2,de sorte qu’elles soient plus larges que la bande de silicone et permettent ainsi à un joint de se former sur l’ensemble de la découpe géométrique.
- Lavez un plat de 10 cm avec de l’éthanol à 70 %, puis essuyez et séchez-les avec des lingettes délicates non pelucheuses (pour les expériences stériles et non stériles). Cette étape est importante car elle permet aux couches de film d’étanchéité de mieux coller à la plaque et de restreindre le mouvement de l’échantillon pendant le processus de préparation.
- Placez les couches de film d’étanchéité dans le plat de 10 cm lavé afin qu’il y ait suffisamment d’espace pour placer deux bandes dans chaque plat côte à côte(Figure 2A).
- Retirez la pellicule de plastique d’un côté de la bande de silicone et placez le côté exposé sur la couche de film d’étanchéité de sorte que la découpe soit entièrement entourée par la couche de film d’étanchéité(Figure 2B). Ensuite, appuyez doucement sur le silicone contre la couche de film d’étanchéité afin de sceller la zone entourant la découpe, en utilisant des doigts gantés propres.
REMARQUE: Assurez-vous qu’il n’y a pas de poches d’air entre le silicone et le film d’étanchéité, en particulier autour de la découpe. Pour ce faire, examinez la face inférieure de la parabole(Figure 2C).
- Retirez la pellicule de plastique d’un côté de la bande de silicone et placez le côté exposé sur la couche de film d’étanchéité de sorte que la découpe soit entièrement entourée par la couche de film d’étanchéité(Figure 2B). Ensuite, appuyez doucement sur le silicone contre la couche de film d’étanchéité afin de sceller la zone entourant la découpe, en utilisant des doigts gantés propres.
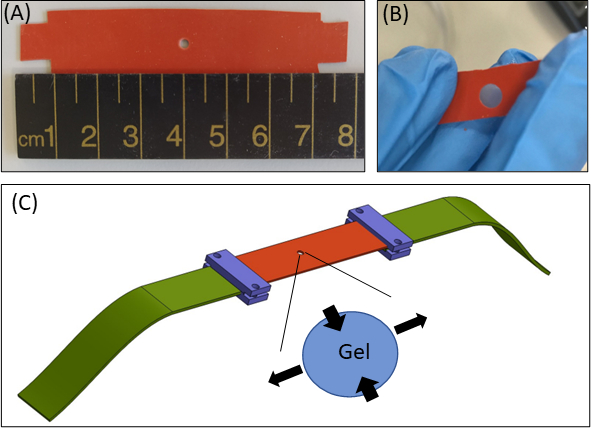
Figure 1 : Approche de déformation de l’hydrogel. (A) 15 × bande de silicone de 80 mm2 avec une découpe de 2 mm de diamètre au centre de la bande (B) Une bande de silicone avec une découpe circulaire avec gel de fibrine incorporé. À des fins d’illustration, la découpe dans le silicone est plus grande que dans les expériences réelles(C)Schéma de l’approche d’étirement avec la bande de silicone (orange), le gel circulaire (découpé au milieu) et les prolongateurs de tissu (verts) qui relient le silicone au dispositif d’étirement. La zone élargie du gel indique la déformation du gel, en réponse à l’étirement uniaxial du silicone. Par souci de simplicité, la compression le long de l’épaisseur du gel (axeZ)n’est pas indiquée dans l’illustration. Les figures 1B &1C ont été adaptées de Roitblat Riba et al.41Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 2 : Exemple de placement approprié d’une bande de silicone sur une couche de film d’étanchéité avant la polymérisation du gel. (A) Placement de deux couches de film d’étanchéité dans une parabole de 10 cm (B) Placement de bandes de silicone sur les couches de film d’étanchéité (C) Vue de dessous de la parabole, affichant l’étanchéité à l’air entre le silicone et la couche de film d’étanchéité. Gauche: Joint approprié de la couche de film d’étanchéité à la bande de silicone autour de la découpe sans poches d’air. À droite: Mauvaise étanchéité de la couche de film d’étanchéité à la bande de silicone découpée avec des poches d’air autour du bord de la découpe. Cela entraînera une fuite des composants de l’hydrogel sous le silicone. La flèche rouge pointe vers une zone où une poche d’air a été formée. Veuillez cliquer ici pour voir une version plus grande de cette figure.
3. Préparation de la thrombine avec des cellules
REMARQUE: Effectuez cette étape uniquement si l’incorporation de cellules dans l’hydrogel est souhaitée, et dans des conditions stériles dans une hotte biologique(Table des matériaux).
- Stérilisation: la veille de l’expérience cellulaire, placez les bandes de silicone et les couches de film d’étanchéité dans de l’éthanol à 70% pendant la nuit, puis effectuez une stérilisation UV pendant 30 minutes de chaque côté (si les plats de 10 cm ne sont pas déjà stériles, ils doivent également être stérilisés sous lumière UV pendant 30 minutes après un lavage à l’éthanol à 70%). Le système UV utilisé dans le protocole est celui intégré dans la hotte biologique.
REMARQUE: Alternativement, un cycle de stérilisation par autoclave (140 °C) peut être effectué sur les bandes de silicone car elles sont résistantes jusqu’à 260 °C. - Effectuer un dénombrement cellulaire pour déterminer la concentration cellulaire, puis centrifuger et suspendre à nouveau la pastille cellulaire avec 7 μL de thrombine (2 unités/mL) dans un tube à centrifuger de 1,5 mL. Nous recommandons une concentration cellulaire de 800 cellules/μL de thrombine. Gardez les cellules réfrigérées jusqu’à utilisation (ne pas dépasser plus d’une demi-heure pour éviter d’endommager les cellules).
4. Polymérisation des gels de fibrine
- Récupérez les solutions de fibrinogène marqué de 2 unités/mL de thrombine et de 10 mg/mL du réfrigérateur (préparées à l’étape 1) et placez-les sur de la glace où elles seront accessibles.
REMARQUE: Les solutions sont maintenues au froid avant le processus de mélange afin de ralentir la cinétique de la réaction de polymérisation. Cela permet un mélange plus homogène des protéines. - Avec la ou les plats mis en place (étape 2), extraire 2,5 μL de fibrinogène marqué et le pipetter uniformément dans la découpe en silicone (avec la couche de film d’étanchéité attachée à sa face inférieure) de sorte que toute la circonférence de la découpe soit en contact avec le fibrinogène. Veillez à ne pas laisser de poches d’air ou de bulles se former n’importe où dans la solution, en accordant une attention particulière aux bords inférieurs de la découpe (l’interface entre la couche de film d’étanchéité et le silicone).
- Prenez immédiatement 2,5 μL de thrombine (avec ou sans cellules/billes) et pipettez-la directement dans la solution de fibrinogène dans la découpe (atteignant le volume final de 5 μL de fibrine). Ensuite, mélangez rapidement les deux solutions en pipetant soigneusement de haut en bas ~ 10 fois. Pendant le processus de mélange, déplacez la pointe autour de l’ensemble du volume pour créer une solution aussi homogène que possible.
- Ajouter une très petite quantité de phosphate tampon salin (PBS) [alternativement milieu cellulaire pour les expériences cellulaires, table des matériaux]le long du bord de chaque plat afin que l’hydrogel ne se dessèche pas pendant le processus de polymérisation. Assurez-vous qu’il n’y a pas de contact entre le PBS/milieu cellulaire et les échantillons, car cela endommagerait l’échantillon.
- Couvrez le(s) plat(s) et placez-les dans l’incubateur à 37 °C pendant 30 minutes.
REMARQUE: Le temps d’incubation requis dépend du volume du gel. Si des volumes plus importants sont utilisés, le temps d’incubation devrait augmenter. - Retirez le(s) plat(s) de l’incubateur et ajoutez du PBS/milieu cellulaire au plat, en submergeant toute la construction gel-silicone.
- Soulevez soigneusement les constructions d’échantillon une à la fois du plat en vous assurant que la couche de film d’étanchéité reste collée à la bande. Détachez lentement la couche de film d’étanchéité du silicone en passant doucement d’une extrémité du silicone à l’autre(Figure 3). Évitez de tirer des zones proches de la découpe où des concentrations de contraintes peuvent exister (ceci est principalement important pour les géométries non circulaires). Évitez tout contact avec la découpe car cela endommagerait l’échantillon.
- Replacez la bande dans la parabole avec du PBS/milieu cellulaire de manière à ce que la bande flotte dans la parabole. Ensuite, amenez la ou les paraboles à un microscope à culture cellulaire standard pour évaluer qualitativement l’état de chaque échantillon. Les gels doivent être uniformes, continus tout au long de la découpe et aucune bulle ne doit être présente. À l’aide de la figure 4 comme guide, sélectionnez les meilleurs échantillons pour une analyse plus approfondie.

Figure 3 : Retrait approprié de la couche de film d’étanchéité du bas de la bande de silicone. Le processus d’enlèvement doit être fait lentement afin que l’hydrogel ne déchire pas ou ne casse pas son adhérence avec les parois internes de la découpe. La flèche blanche indique la direction de l’enlèvement. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Ill. 4 : Observation microscopique de gels de fibrine dans la découpe en silicone. (A) Deux exemples d’un gel de fibrine correctement polymérisé. Notez l’homogénéité relative du gel et la pleine adhérence aux bords de la découpe(B)Deux exemples de défaillance de polymérisation de l’échantillon. Haut: Remarquez les nombreuses bulles et les agrégats formés en bas à gauche. Bas: Remarquez l’arrachement du gel des bords découpés et des agrégats dans la région inférieure gauche de la découpe. Barre d’échelle = 300 μm Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Chargement de l’échantillon sur l’appareil SCyUS
- Remplissez le bain avec du PBS/milieu cellulaire (Figure 5) et placez la bande de silicone portant le gel de l’échantillon sur le dessus afin que les extrémités soient assises de chaque côté du bain. Le bain est destiné à éviter tout séchage du gel. Placez et serrez les pinces (violettes) ainsi que les bandes de tissu (vert) afin que toutes les pièces soient connectées pour former une bande droite avec la découpe au centre(Figure 5).
- Récupérez l’appareil SCyUS et fixez le puits de liquide en aluminium et la lamelle rectangulaire en verre de 22 mm x 40 mm (n° 1 ou 1.5)(Figure 6Aiii). Fixez le glissement du couvercle au fond du puits à l’aide d’un matériau d’étanchéité (p. ex. graisse sous vide) afin que le puits puisse être rempli de liquide sans fuite.
- Remplissez le puits avec environ 1-2 mL de PBS / milieu cellulaire et placez la bande + tissu + gel construction (Figure 6B) dans l’appareil. Serrez la bande de tissu(2)dans le support(1)de sorte que la découpe + gel(5)soit au centre comme indiqué, puis placez soigneusement l’insert de pincement(4)dans l’appareil et verrouillez-le en place.
- Ensuite, insérez l’autre côté du tissu sur la broche (sans attacher le servomoteur) et verrouillez-le dans la broche(Figure 6C).
- Insérez le dispositif SCyUS avec l’échantillon attaché dans l’étage du microscope(Figure 6C). Connectez le microcontrôleur(Table des matériaux)à l’ordinateur via un câble USB et connectez le servomoteur au microcontrôleur. Ouvrez le module de contrôle SCyUS sur l’ordinateur. L’échantillon est maintenant prêt pour l’imagerie afin de vérifier l’adéquation de l’épaisseur du gel et de l’homogénéité des fibres sous le microscope confocal.
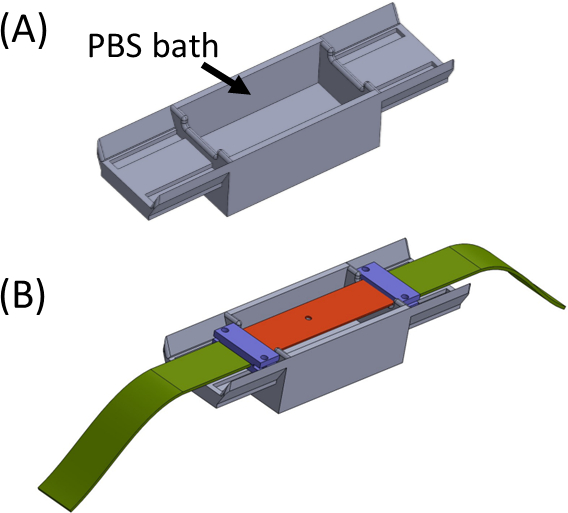
Figure 5: (A)Gabarit contenant un bain PBS (imprimé en 3D)(B)Placement de la bande sur le gabarit pour assurer une bonne fixation en ligne des supports (en violet) et empêcher le dessèchement du gel. Ce chiffre a été modifié avec la permission de Roitblat Riba et al.41Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
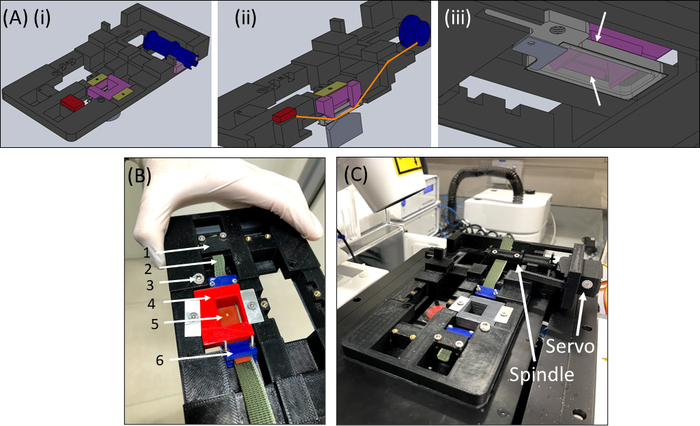
Figure 6 : dispositif d’étirement SCyUS. (A) Plusieurs vues d’un modèle CAO des pièces principales du SCyUS: broche connectée au servo (bleu), ancre statique (rouge), insert qui épingle la bande de silicone vers le bas (violet) et fixations qui empêchent l’insert de se lever (jaune-vert). Une vue de dessus du système(Ai),une vue coupée du système(Aii)montrant le chemin de la bande (ligne orange), et une vue de dessous(Aiii)du puits de liquide en aluminium avec une lame de couverture en verre. Le puits de liquide peut être déplacé de haut en bas avec la tour d’une vis montée dans le filetage principal. Le mouvement vers le haut du puits en aluminium est limité par les ailes latérales de l’insert violet, comme le montrent les flèches blanches (B) Le système réel: (1) ancre statique (2) tissu vert non extensible (3) vis pour le contrôle de la hauteur du puits liquide en aluminium (4) insert pin-down rouge (5) une bande de silicone avec une découpe circulaire (6) pinces de connexion bleues (C) Le système d’étirement placé sur un microscope confocal. Le servomoteur et la broche sont représentés avec des flèches. Ce chiffre a été modifié avec la permission de Roitblat Riba et al.41Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
6. Assurez-vous d’un gel adéquat pour l’échantillonnage
- À l’aide du microscope confocal(Table des matériaux),prenez une image confocale de Z-stack à faible grossissement (10×), basse résolution (~ 1,4 μm x 1,4 μm de taille de pixel) confocale Z-stack (≤10 Z-slices avec une taille de pas d’environ 10 μm est suffisante) de l’ensemble du gel à l’aide de lasers de 488/543/561 pour examiner l’homogénéité et l’adhérence à la circonférence de la découpe géométrique sur toute l’épaisseur du silicone(Figure 7A-B). Utilisez cette image Z-stack comme carte pour les étapes suivantes.
- À l’aide de l’imagerie en direct à basse résolution, scannez le gel et déterminez la position Zla plus basse où l’adhésion totale aux parois internes de la découpe est apparente sans déchirures ni bulles et notez l’emplacement Zdu microscope(Zl). Pour déterminer l’adhésion complète du gel au silicone sur toute sa circonférence, scannez l’interface de l’étiquette fluorescente du gel et de la bande de silicone (fond sombre) au microscope(figure 7C).
- Déplacez-vous vers le haut dans la direction Zjusqu’à ce qu’il n’y ait plus de continuité dans le gel et notez la position Z(Zu):
- Soustrayez la limite supérieure (Zu) de la direction Zde la limite inférieure (Zl). Voici l’épaisseur de référence de l’échantillon(Zo):

Si Zo ≥ 100 μm, le gel est considéré comme satisfaisant pour l’analyse. Notez que l’épaisseur de la découpe en silicone est d’environ 500 μm, mais la polymérisation en gel dans la découpe entraîne généralement une épaisseur de gel plus petite. 100 μm est l’épaisseur minimale recommandée pour assurer un processus d’étirement stable, sans déchirures ni détachement du gel de la découpe en silicone.
REMARQUE: À différents endroits XY, l’épaisseur du gel peut varier. Cette section du protocole mesure l’épaisseur minimale du gel, ce qui nous permet de déterminer la qualité du gel et d’indiquer si elle est suffisante pour l’étirement. De plus, trouver le centre du gel fournit un point de référence pour revenir au post-étirement, qu’il soit statique ou dynamique.

Figure 7 : Homogénéité du gel. Des images de tuile ont été capturées et cousues utilisant le logiciel confocal de microscope (Table des matériaux) (A) Une image simple cousue de Z-tranche de carreau d’un échantillon de gel de fibrine avec la densité relativement inhomogène de fibre due à la thrombine incorrecte et au fibrinogène mélangeant la pré-polymérisation. Ce gel ne fournira pas une analyse fiable(B)Une seule tuile cousue Z-slice image d’un échantillon de gel de fibrine avec une densité de fibres relativement homogène. C’est un gel acceptable pour les expériences d’étirement. La barre d’échelle pour les images A &B est de 200 μm (C)Zoom avant de l’interface entre le gel marqué par fluorescence (rouge) et le silicone (fond noir). Barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
7. Fonctionnement, étirement et imagerie de SCyUS
- Maintenant que l’échantillon a été jugé de qualité satisfaisante et qu’il est correctement placé sur le dispositif SCyUS, déterminez la position pré-étirée de l’échantillon. Ceci est réalisé en utilisant l’imagerie en direct sous le microscope confocal (similaire à l’étape 6.2).
- Assurez-vous que le servomoteur est à sa position zéro en cliquant sur le bouton Go To Zero Servo Pos (Cliquez sur la Figure 8A et assurez-vous que la Figure 8B affiche zéro) et fixez-le au dispositif d’étirement comme le montre la Figure 6C.
REMARQUE: Faites cette étape lentement et soigneusement afin de ne pas mettre d’excès de tension sur l’échantillon. - Lors de l’imagerie de l’échantillon, déplacez le moteur d’un degré(Figure 8C)à la fois dans le sens des aiguilles d’une montre en cliquant sur le bouton +1 jusqu’à ce que l’on observe que le côté droit de la découpe se déplace. Ensuite, inversez le mouvement(Figure 8D)à l’avant-dernière position de l’étape en cliquant sur le bouton -1. Cela permet de vérifier que l’échantillon est soumis à une tension minimale. Cliquez sur le bouton Set Min Servo Position (Définir la position de l’asservissement min) (Figure 8E)pour définir la position de référence. Il est possible de revenir à la position de référence à tout moment en cliquant sur le bouton Go To Min Servo Position (Figure 8F).
Remarque : il est recommandé d’utiliser un objectif à fort grossissement (≥40×) pour cette étape afin de minimiser l’erreur. - Capturez une image de tuile à fort grossissement (40×), haute résolution (~0,2 μm × taille de pixel de 0,2 μm), à tranche Z unique de l’ensemble de la zone de gel. Il sera utilisé comme image de référence pour l’analyse de post-traitement. Il est recommandé de capturer une seule image Z-slice au milieu de l’épaisseur du gel (en utilisant Zo de Eq. 1), cela permettra le retour à peu près à la même position Zaprès l’étirement. En outre, prenez en considération que les images de tuiles haute résolution de toute la zone de gel prennent un temps considérable (~ 20-30 min).
- Maintenant, l’exemple est prêt pour l’étirement statique. Ajustez le servomoteur à la magnitude d’étirement souhaitée en avançant d’un degré(Figure 8C)à la fois dans l’interface graphique (effectuez-le lentement, environ 1 degré/seconde).
- Assurez-vous que le servomoteur est à sa position zéro en cliquant sur le bouton Go To Zero Servo Pos (Cliquez sur la Figure 8A et assurez-vous que la Figure 8B affiche zéro) et fixez-le au dispositif d’étirement comme le montre la Figure 6C.
- À chaque amplitude d’étirement où l’analyse est souhaitée, capturez une seule image de tuile haute résolution Z-slice de la zone de gel entière pour l’analyse de post-traitement. Semblable à l’étape 6.2, vérifiez que le gel ne s’est pas détaché du silicone sur toute sa circonférence en balayant l’interface entre le gel (rouge) et le silicone (fond sombre), en recherchant des changements dans l’adhérence par rapport à l’amplitude d’étirement précédente.
REMARQUE: Lors de l’activation du moteur, utilisez l’imagerie en direct pour suivre l’emplacement du gel dans X-Y (avec des paramètres de faible résolution et de faible grossissement). Le gel subit un effet Z-Poisson où le fond du gel s’élève, donc la position Zdu microscope doit également être ajustée au centre approximatif de l’épaisseur du gel pour chaque magnitude d’étirement. Ceci peut être réalisé en recalculant Zo (Eq. 1) pour chaque magnitude d’étirement. Étant donné que l’étirement dans la direction Zest relativement homogène, il n’est pas essentiel de trouver la profondeur centrale exacte du gel.
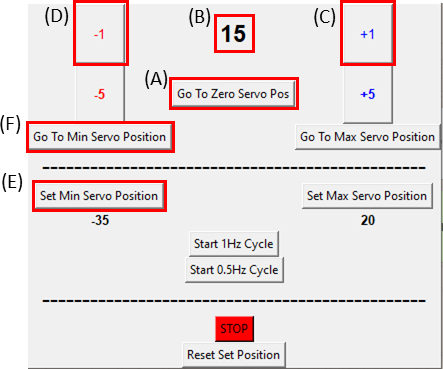
Figure 8 : Interface graphique du module de contrôle SCyUS. (A) Position du moteur en degrés. La valeur varie de -90° à 90°(B)'Set Minimum Servo Position'. Ce bouton permet une position minimale prédéfinie, pour définir une nouvelle position de référence qui est différente du bouton Zero Servo Position(C)'Plus 1 °' déplace le servomoteur d’un degré dans le sens des aiguilles d’une montre(D)Le bouton 'Moins 1 °' déplace le servomoteur d’un degré dans le sens inverse des aiguilles d’une montre(E)Le bouton 'Aller à la position zéro' définit la position du servomoteur à 0 ° ([A] sera réglé sur zéro) (F) Le bouton 'Aller à la position minimale du servomoteur' déplace le servomoteur à la position 'Min' définie par l’utilisateur. Veuillez cliquer ici pour voir une version plus grande de cette figure.
8. Post-traitement des mesures de déformation externes
- Pour mesurer les déformations effectives des limites découpées, mesurez les longueurs bord à bord dans la direction de l’étirement (axeX)au centre de l’axe Y(Figure 9A).
- Téléchargez l’image pré-étirrée sur le logiciel de traitement d’image (ImageJ FIJI43)et mesurez la plus grande distance bord à bord qui est définie comme la longueur axiale du trou (
 ) au centre.
) au centre. - Définissez la plus grande distance de haut en bas comme distance perpendiculaire (
 ).
). - Répétez ce processus pour toutes les images d’intervalle d’étirement et calculez les distances axiales
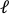 ( ) et perpendiculaires ( ) de
( ) et perpendiculaires ( ) de  la périphérie découpée(Figure 9A, en bas), puis effectuez les calculs suivants pour trouver les déformations des arêtes découpées :
la périphérie découpée(Figure 9A, en bas), puis effectuez les calculs suivants pour trouver les déformations des arêtes découpées :
- Téléchargez l’image pré-étirrée sur le logiciel de traitement d’image (ImageJ FIJI43)et mesurez la plus grande distance bord à bord qui est définie comme la longueur axiale du trou (
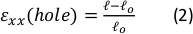

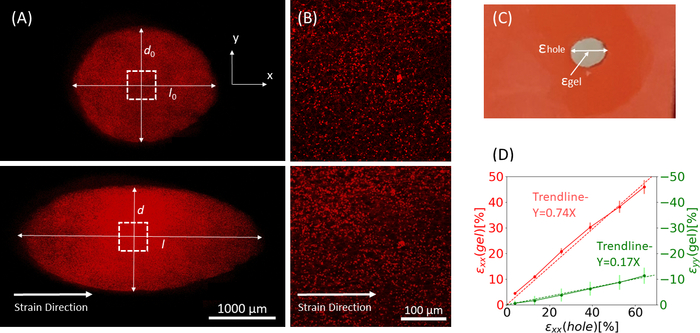
Figure 9 : Contraintes de gel dues à l’étirement externe de la bande de silicone. (A) X-Y section transversale d’un gel de fibrine non étiré (en haut), et après application de εtrou = déformation de 64% le long de la direction x (bas). Le gel est incrusté de perles fluorescentes. Les longueurs pertinentes de d et l utilisées pour le calcul de εtrou sont indiquées dans les images (B) Images zoom avant de la zone carrée pointillée marquée en A (C) Illustration des types de déformations considérés dans cette étude : εtrou est la déformation axiale de la découpe à son diamètre maximal, et εgel est la déformation axiale au centre du gel (telle que mesurée par les emplacements agrégés de perles) (D) Une relation linéaire a été trouvée entre εtrou et εgel à la fois dans la direction xx (ligne rouge) et la direction yy (ligne verte). Cette figure a été adaptée avec la permission de Roitblat Riba et al.41Veuillez cliquer ici pour voir une version plus grande de cette figure.
9. Analyse de l’orientation des fibres
- Utilisez la quantification de l’alignement des fibres pour caractériser la réponse structurelle du gel fibreux à l’augmentation des amplitudes d’étirement. Téléchargez des images haute résolution sur le logiciel ImageJ FIJI (NIH)43, puis analysez à l’aide du module OrientationJ (EPFL)44 (Paramètres: dégradé gaussien et fenêtre de 3 pixels, Figure 10).
- Calculez le paramètre d’ordre nématique 2D (NOP) de l’histogramme d’orientation comme suit :45
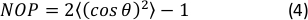
REMARQUE: Une valeur de NOP = 1 indique un alignement parfait le long de la direction axiale (angle zéro) et NOP = 0 indique l’isotropie. L’angle d’orientation, θ, est l’angle de la fibre par rapport à l’axe de déformation (axe des x) obtenu par analyse d’image et défini avec précision dans la documentation OrientationJ. 44 ans
- Calculez le paramètre d’ordre nématique 2D (NOP) de l’histogramme d’orientation comme suit :45

Figure 10 : Analyse de l’orientation des fibres à l’aide du logiciel FIJI ImageJ. (A) Menu principal d’ImageJ avec une flèche indiquant l’emplacement du menu déroulant « Plugins » où « OrientationJ » peut être trouvé. Dans le menu étendu de 'OrientationJ', cliquez sur l’option 'OrientationJ Distribution' (B) Module de distribution d’OrientationJ. Définissez 'Local window σ' sur 3 pixels et 'Gradient' sur 'Gaussian'. Appuyez ensuite sur le bouton « Exécuter » (flèche rouge). Veuillez cliquer ici pour voir une version plus grande de cette figure.
10. Analyse manuelle des souches de gel interne
- Lors de l’imagerie à fort grossissement en direct d’un hydrogel avec des perles intégrées, localisez manuellement une région d’intérêt (ROI) avec des caractéristiques facilement reconnaissables (par exemple, des agrégats de perles), afin de revenir au même endroit après chaque magnitude d’étirement.
REMARQUE: La compression dans la direction Z (effet Poisson) peut entraîner une augmentation de la densité de perles à mesure que l’étirement augmente, nous vous suggérons donc de choisir des agrégats de perles suffisamment grands, afin qu’ils soient clairement identifiables. Ce protocole appelle à l’analyse de la région centrale du gel de fibrine, bien que n’importe quelle région puisse être choisie. - Dans la position de pré-étirement (étape 6), capturez une image Z-stackhaute résolution du retour sur investissement sélectionné. Après chaque intervalle d’étirement souhaité, revenez au même retour sur investissement et répétez le processus de capture d’image.
- Prenez les images et importez-les dans ImageJ. Dans le retour sur investissement, enregistrez l’emplacement du pixel X-Y de chaque agrégat de perles visible. Transférez les données enregistrées vers une feuille de calcul.
- Mesurez les distances entre chaque paire d’agrégats et comparez-les aux distances des mêmes paires dans l’image de référence, ce qui permet de calculer les déformations dans les directions X et Y.
REMARQUE: Si un film en temps réel continu est enregistré pendant que le gel est étiré (au lieu de la capture d’image statique), une analyse automatique des déformations peut être effectuée avec des méthodes de corrélations d’image numérique ou de volume (DIC / DVC), comme démontré précédemment46,47. Cependant, il convient de noter que l’analyse automatique DIC / DVC est difficile dans ce contexte, car la pile Zne se déplace pas seulement dans le plan X-Y, mais aussi dans la direction Zen raison de l’effet Poisson (compression), ce qui explique des dérives considérables pendant le film enregistré.
Résultats
Des données représentatives d’étirement statiques de magnitudes croissantes appliquées à la bande de silicone portant un hydrogel de fibrine 3D, encastré avec des billes fluorescentes de 1 μm, sont illustrées à la figure 9. L’analyse démontre l’effet de l’étirement en silicone sur les changements géométriques de la découpe ainsi que sur les souches développées dans le gel. Des images z-stack de l’ensemble du gel sont utilisées pour évaluer la dé...
Discussion
La méthode et le protocole présentés ici sont largement basés sur notre étude précédente par Roitblat Riba et al.41 Nous incluons ici les codes complets de conception assistée par ordinateur (CAO), Python et microcontrôleur du dispositif SCyUS.
Les principaux avantages de la méthode présentée par rapport aux approches existantes incluent la possibilité de forcer des hydrogels 3D très mous (module élastique de ~ 100 Pa) de leur circonférence, et ...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Certains chiffres inclus ici ont été adaptés avec la permission du Copyright Clearance Center: Springer Nature, Annals of Biomedical Engineering. Straining 3D hydrogels with uniform z-axis strains while enabling live microscopy imaging, A. Roitblat Riba, S. Natan, A. Kolel, H. Rushkin, O. Tchaicheeyan, A. Lesman, Copyright© (2019).
https://doi.org/10.1007/s10439-019-02426-7
matériels
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 546 carboxylic acid, succinimidyl ester | Invitrogen | A20002 | |
| Cell Medium (DMEM High Glucose) | Biological Industries | 01-052-1A | Add 10% FBS, 1% PNS, 1% L-Glutamine, 1% Sodium Pyruvate |
| Cover Slip #1.5 | Bar-Naor Ltd. | BN72204-30 | 22×40 mm |
| DIMETHYL SULPHOXIDE 99.5% GC DMSO | Sigma-Aldrich Inc. | D-5879-500 ML | |
| Dulbecco's Phosphate-Buffered Saline | Biological Industries | 02-023-1A | |
| EVICEL Fibrin Sealant (Human) | Omrix Biopharmaceuticals | 3902 | Fibrinogen: 70 mg/mL, Thrombin: 800-1200 IU/mL |
| Fibrinogen Buffer | N/A | Recipe for 1L: 7g NaCl, 2.94g trisodium citrate dihydrate, 9g glycine, 20g arginine hydrochloride & 0.15g calcium chloride dihydrate. Bring final volume to 1L with PuW (pH 7.0-7.2) | |
| Fluorescent micro-beads FluoSpheres (1 µm) | Invitrogen | F8820 | Orange (540/560) Provided as suspension (2% solids) in water plus 2 mM sodium azide |
| High-Temperature Silicone Rubber | McMaster-Carr | 3788T41 | 580 µm-thick E = 1.5 Mpa Poisson Ratio = 0.48 Tensile Strength = 4.8 MPa Upper limit of stretch = +300% engineering strain |
| HiTrap desalting column 5 mL (Sephadex G-25 packed) | GE Healthcare | 17-1408-01 | |
| HIVAC-G High Vacuum Sealing Compound | Shin-Etsu Chemical Co., Ltd. | HIVAC-G 100 | |
| ImageJ FIJI software39 | National Institute of Health, Bethesda, MD | Version 1.8.0_112 | |
| Microcontroller (Adruino Uno + Adafruit Motorshield v2.3) | Arduino/Adafruit | Arduino-DK001/Adafruit-1438 | |
| MicroVL 21R Centrifuge | Thermo Scientific | 75002470 | |
| Parafilm | Bemis | PM-996 | |
| Primovert Light Microscope | Carl Zeiss Suzhou Co., Ltd. | 491206-0011-000 | |
| SCyUS CAD (Solidworks) | Dassault Systèmes | N/A | |
| SCyUS Code37 | N/A | N/A | |
| Servomotor - TowerPro SG-5010 | Adafruit | 155 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | For 50 mL tubes |
| Sterile 10 cm non-culture plates | Corning | 430167 | |
| Thrombin buffer | N/A | Recipe for 1L: 20g mannitol, 8.77g NaCl, 2.72g sodium acetate trihydrate, 24 mL 25% Human Serum Albumin, 5.88g calcium chloride. Bring final volume to 1L with PuW (pH 7.0) | |
| Trypsin EDTA Solution B (0.25%), EDTA (0.05%) | Biological Industries | 03-052-1B | |
| USB Cable (Type B Male to Type A Male) | N/A | N/A | |
| Zeiss LSM 880 Confocal Microscope | Carl Zeiss AG | 2811000417 | |
| ZEN 2.3 SP1 FP3 (black) | Carl Zeiss AG | Release Version 14.0.0.0 |
Références
- Bleuel, J., Zaucke, V., Bruggemann, G. P., Niehoff, A. Effects of cyclic tensile strain on chondrocyte metabolism: a systematic review. PLoS ONE. 10, 0119816 (2015).
- Pennisi, C. P., Olesen, C. G., de Zee, M., Rasmussen, J., Zachar, V. Uniaxial cyclic strain drives assembly and differentiation of skeletal myocytes. Tissue Engineering Part A. 17, 2543-2550 (2011).
- Grodzinsky, A. J., Levenston, M. E., Jin, M., Frank, E. H. Cartilage Tissue Remodeling in Response to Mechanical Forces. Annual Review of Biomedical Engineering. 2 (1), 691-713 (2000).
- Munster, S., et al. Strain history dependence of the nonlinear stress response of fibrin and collagen networks. Proceedings of the National Academy of Sciences of the USA. 110, 12197-12202 (2013).
- Vader, D., Kabla, A., Weitz, D., Mahadevan, L. Strain-induced alignment in collagen gels. PLoS ONE. 4, 5902 (2009).
- Badylak, S. F. The extracellular matrix as a scaffold for tissue reconstruction. Seminars in Cell & Developmental Biology. 13 (5), 377-383 (2002).
- Natan, S., Koren, Y., Shelah, O., Goren, S., Lesman, A. . Molecular Biology of the Cell. 31 (14), 1474-1485 (2020).
- Ban, E., et al. Mechanisms of Plastic Deformation in Collagen Networks Induced by Cellular Forces. Biophysical Journal. 114 (2), 450-461 (2018).
- Kim, J., et al. Stress-induced plasticity of dynamic collagen networks. Nature Communications. 8, 842 (2017).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Basu, A., Janmey, P. A., Yodh, A. G. Non-affine deformations in polymer hydrogels. Soft Matter. 8, 8039-8049 (2012).
- Muiznieks, L. D., Keeley, F. W. Molecular assembly and mechanical properties of the extracellular matrix: A fibrous protein perspective. Biochimica et Biophysica Acta. 1832, 866-875 (2012).
- Brown, A. E. X., Litvinov, R. I., Discher, D. E., Purohit, P. K., Weisel, J. W. Multiscale mechanics of fibrin polymer: gel stretching with protein unfolding and loss of water. Science. 325, 741-744 (2009).
- Carroll, S. F., Buckley, C. T., Kelly, D. J. Cyclic tensile strain can play a role in directing both intramembranous and endochondral ossification of mesenchymal stem cells. Frontiers in Bioengineering and Biotechnology. 5, 73 (2017).
- Livne, A., Bouchbinder, E., Geiger, B. Cell reorientation under cyclic stretching. Nature Communications. 5, 3938 (2014).
- Wang, L., et al. Patterning cellular alignment through stretching hydrogels with programmable strain gradients. ACS Applied Materials & Interfaces. 7, 15088-15097 (2015).
- Xu, G. K., Feng, X. Q., Gao, H. Orientations of Cells on Compliant Substrates under Biaxial Stretches: A Theoretical Study. Biophysical Journal. 114 (3), 701-710 (2017).
- Chagnon-Lessard, S., Jean-Ruel, H., Godin, M., Pelling, A. E. Cellular orientation is guided by strain gradients. Integrative Biology (United Kingdom). 9 (7), 607-618 (2013).
- Lu, J., et al. Cell orientation gradients on an inverse opal substrate. ACS Applied Materials & Interfaces. 7 (19), 10091-10095 (2015).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125, 3015-3024 (2012).
- Bono, N., et al. Unraveling the role of mechanical stimulation on smooth muscle cells: a comparative study between 2D and 3D models. Biotechnology and Bioengineering. 113, 2254-2263 (2016).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8, 839-845 (2007).
- Riehl, B. D., Park, J. H., Kwon, I. K., Lim, J. Y. Mechanical stretching for tissue engineering: two-dimensional and three-dimensional constructs. Tissue Engineering Part B: Reviews. 18, 288-300 (2012).
- Flexcell. Linear Tissue Train Culture Plate. Flexcell. , (2019).
- Flexcell. Tissue Train. Flexcell. , (2019).
- CellScale. MCT6 Stretcher. CellScale. , (2019).
- STREX. STB-150. STREX. , (2019).
- STREX. Stretch Chambers. STREX. , (2019).
- Kamble, H., Barton, M. J., Jun, M., Park, S., Nguyen, N. T. Cell stretching devices as research tools: engineering and biological considerations. Lab on a Chip. 16, 3193-3203 (2016).
- Weidenhamer, N. K., Tranquillo, R. T. Influence of cyclic mechanical stretch and tissue constraints on cellular and collagen alignment in fibroblast-derived cell sheets. Tissue Engineering Part C: Methods. 19, 386-395 (2013).
- Yung, Y. C., Vandenburgh, H., Mooney, D. J. Cellular strain assessment tool (CSAT): precision-controlled cyclic uniaxial tensile loading. Journal of Biomechanics. 42, 178-182 (2009).
- Chen, K., et al. Role of boundary conditions in determining cell alignment in response to stretch. Proceedings of the National Academy of Sciences of the USA. 115, 986-991 (2018).
- Heher, P., et al. A novel bioreactor for the generation of highly aligned 3D skeletal muscle-like constructs through orientation of fibrin via application of static strain. Acta Biomaterialia. 24, 251-265 (2015).
- Foolen, J., Deshpande, V. S., Kanters, F. M. W., Baaijens, F. P. T. The influence of matrix integrity on stress-fiber remodeling in 3D. Biomaterials. 33, 7508-7518 (2012).
- Walker, M., Godin, M., Pelling, A. E. A vacuum-actuated microtissue stretcher for long-term exposure to oscillatory strain within a 3D matrix. Biomedical Microdevices. 20, 43 (2018).
- Zhao, R. G., Boudou, T., Wang, W. G., Chen, C. S., Reich, D. H. Decoupling cell and matrix mechanics in engineered microtissues using magnetically actuated microcantilevers. Advanced Materials. 25, 1699-1705 (2013).
- Li, Y. H., et al. Magnetically actuated cell-laden micro-scale hydrogels for probing strain-induced cell responses in three dimensions. NPG Asia Materials. 8, 238 (2016).
- Li, Y. H., et al. An approach to quantifying 3D responses of cells to extreme strain. Scientific Reports. 6, 19550 (2016).
- Humphrey, J. D., et al. A theoretically-motivated biaxial tissue culture system with intravital microscopy. Biomechanics and Modeling in Mechanobiology. 7, 323-334 (2008).
- Niklason, L. E., et al. Enabling tools for engineering collagenous tissues integrating bioreactors, intravital imaging, and biomechanical modeling. Proceedings of the National Academy of Sciences of the USA. 107, 3335-3339 (2010).
- Roitblat Riba, A., et al. Straining 3D hydrogels with uniform z-axis strains while enabling live microscopy imaging. Annals of Biomedical Engineering. , (2019).
- Gomez, D., Natan, S., Shokef, Y., Lesman, A. Mechanical interaction between cells facilitates molecular transport. Advanced Biosystems. 3 (12), 1900192 (2019).
- Schindelin, J., et al. Fiji: an open- source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- EPFL Switzerland. OrientationJ plug in. EPFL Switzerland. , (2019).
- Goren, S., Koren, Y., Xu, X., Lesman, A. Elastic anisotropy governs the decay of cell-induced displacements. Biophysical Journal. 118 (5), 1152-1164 (2019).
- Notbohm, J., Lesman, A., Tirrell, D. A., Ravichandran, G. Quantifying cell-induced matrix deformation in three dimensions based on imaging matrix fibers. Integrative Biology. 7 (10), 1186-1195 (2015).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. Journal of Cell Biology. 205 (2), 155-162 (2014).
- Cha, C. Y., et al. Tailoring Hydrogel Adhesion to Polydimethylsiloxane Substrates Using Polysaccharide Glue. Angewandte Chemie International Edition. 52, 6949-6952 (2019).
- Wirthl, D., et al. Instant tough bonding of hydrogels for soft machines and electronics. Science Advances. 3, (2017).
- Juarez-Moreno, J. A., Avila-Ortega, A., Oliva, A. I., Aviles, F., Cauich-Rodriguez, J. V. Effect of wettability and surface roughness on the adhesion properties of collagen on PDMS films treated by capacitively coupled oxygen plasma. Applied Surface Science. 349, 763-773 (2015).
- Kim, H. T., Jeong, O. C. PDMS surface modification using atmospheric pressure plasma. Microelectronic Engineering. 88, 2281-2285 (2011).
- Prasad, B. R., et al. Controlling cellular activity by manipulating silicone surface roughness. Colloids and Surfaces. 78, 237-242 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon