JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
라이브 현미경 이미징 에서 3D 하이드로겔의 제어 변형
요약
제시된 방법은 실리콘 고무에 내장된 3D 소프트 하이드로겔의 단종 스트레칭을 포함하면서 살아있는 공초점 현미경 검사를 허용합니다. 섬유 정렬뿐만 아니라 외부 및 내부 하이드로겔 균주의 특성화가 입증된다. 개발된 장치 및 프로토콜은 다양한 변형 정권에 대한 세포의 반응을 평가할 수 있다.
초록
외부 힘은 조직 형성, 발달 및 유지 보수에 중요한 요소입니다. 이러한 힘의 효과 종종 시험 관 스트레칭 방법을 전문 사용 하 여 공부. 다양한 사용 가능한 시스템은 2D 기판 기반 들것을 사용하는 반면, 3D 기술의 접근성은 부드러운 하이드로겔을 변형시키는 데 더 제한적입니다. 여기서는 탄성 실리콘 스트립을 샘플 캐리어로 사용하여 둘레에서 부드러운 하이드로겔의 외부 스트레칭을 허용하는 방법을 설명합니다. 이 프로토콜에 활용되는 스트레칭 시스템은 3D 인쇄 부품과 저비용 전자 장치로 구성되므로 다른 실험실에서 간단하고 쉽게 복제할 수 있습니다. 실험 공정은 실리콘 스트립의 중앙에 컷아웃에서 두꺼운(>100 μm) 소프트 피브린 하이드로겔(탄성 계수 ~100Pa)을 중합하는 것으로 시작됩니다. 그런 다음 실리콘 겔 구조는 인쇄 된 스트레칭 장치에 부착되고 공초점 현미경 단계에 배치됩니다. 살아있는 현미경 검사에서 스트레칭 장치가 활성화되고 겔은 다양한 스트레치 크기로 이미지됩니다. 영상 처리는 젤의 3D 두께(Z-축)에 걸쳐 상대적으로 균일한 균질균및 섬유 정렬을입증하여 생성된 겔 변형을 정량화하는 데 사용됩니다. 이 방법의 장점은 시투 현미경 검사법에서 실행하는 동안 3D에서 매우 부드러운 하이드로겔을 변형시키는 능력과 사용자의 요구에 따라 샘플의 형상 및 크기를 조작 할 수있는 자유를 포함한다. 또한, 적절한 적응을 통해, 이 방법은 다른 유형의 하이드로겔(예를 들어, 콜라겐, 폴리아크릴라미드 또는 폴리에틸렌 글리콜)을 스트레칭하는 데 사용될 수 있으며, 더 많은 생체 모방 3D 조건 하에서 외부 력에 대한 세포 및 조직 반응의 분석을 허용할 수 있다.
서문
기계적 힘에 대한 조직 반응은 유전자 발현1,세포 분화2및 조직 리모델링3을포함하는 광범위한 생물학적 기능의 필수적인 부분이다. 더욱이, 섬유 정렬 및 밀도와 같은 세포외 매트릭스(ECM)의 강제 유도 된 변화는 세포 거동 및 조직형성에영향을 미칠 수 있습니다4,5,6. ECM의 섬유질 메쉬 구조는 비선형 탄성, 비미세 변형 및 플라스틱 변형7,8,9,10,11,12와같은 흥미로운 기계적 특성을 갖는다. 이러한 특성은 세포와 주변 미세 환경이 외부 기계적힘(13,14)에어떻게반응하는지에영향을 미칩니다. ECM과 조직이 기계적 힘에 어떻게 반응하는지 이해하면 조직 공학 분야와 보다 정확한 전산 및 이론적 모델 의 개발에서 진전을 이룰 수 있습니다.
기계적으로 샘플을 스트레칭하는 가장 일반적인 방법은 세포 거동에 미치는 영향을 탐구하기 위해 세포가 풍부한 2D 기판에 초점을 맞추고있다. 이들은 예를 들어, 폴리디메틸실록산(PDMS) 기판에 균주를 적용하고 스트레치방향(15,16,17,18,19)과관련하여 세포 배향 각도를 분석한다. 그러나, 외부 스트레치에 3D 세포 임베디드 하이드로겔의 반응을 조사하는 방법은 조직 미세 환경을 보다 밀접하게 모방하는 상황이더 제한적이다. 3D 스트레칭 방법을 향한 어드밴스는 세포가 3D행렬(20)과비교할 때 2D 기판에서 다르게 행동하기 때문에 특히 중요합니다. 이러한 거동은 세포 재조정, 단백질 발현 수준 및 이동패턴(21,22,23)을포함한다.
3D 샘플 스트레칭을허용하는 방법 및 장치는24, 25, 26,27,28 및 실험실 연구를 위해 개발된29개모두를 포함한다. 이들 방법은 분해성 실리콘튜브(30),다중웰 챔버31개,클램프26,32,생물반응기11,33,캔틸레버34,35,36,및 자석37,38을사용한다. 일부 기술은 젤5의두 단일 지점에서 바늘을 당겨서 3D 하이드로겔을 국소 변형시키는 스트레치를 생성하고, 다른 기술은겔(16)의전체 대량의 변형을 허용한다. 더욱이, 이러한 시스템의 대부분은 Z-방향의스트레인 필드에 대한 제한된 정보와 함께 X-Y 평면에서 스트레인 필드의 분석에 초점을 맞춥니다. 추가적으로, 이 장치의 소수만이 시투 화상 진찰에 있는 현미경을 할 수 있습니다. 시상 고배율 이미징(예: 공초점 현미경)의 주요 과제는 객관적인 렌즈에서 샘플까지 수백 미크론의 제한된 작업 거리입니다. 스트레치 중에 라이브 이미징을 허용하는 장치는 Z축에서 균주의 균일성을 희생하거나 상대적으로 복잡하고 다른 실험실에서 재현하기 어려운39,40.
스트레치 3D 하이드로겔에 대한 이 접근법은 살아있는 공초점 현미경 검사관 동안 정적 또는 주기적 원색 균주를 허용합니다. 스트레칭 장치('스마트 순환 동종 들것 - SCyUS'라고 함)는 3D 인쇄 부품과 저비용 하드웨어를 사용하여 제작되어 다른 실험실에서 쉽게 재현할 수 있습니다. 장치에 부착된 것은 중앙에 기하학적 컷아웃이 있는 시판되는 실리콘 고무입니다. 하이드로겔 성분은 컷아웃을 채우기 위해 중합된다. 중합 화 하는 동안, 생물 하이드로 겔, 피브린 또는 콜라겐 등, 자연스럽 게 컷 아웃의 내부 벽에 부착. SCyUS를 사용하여 실리콘 스트립은 단원하게 뻗어 임베디드 3D하이드로겔(41)으로제어된 균주를 이송한다.
이 시스템은 다른 기존 방법에 비해 기능과 장점의 독특한 조합을 할 수 있습니다. 첫째, 이 시스템은 하이드로겔 전체에 걸쳐 Z-균질변형과 함께 주변에서 두꺼운 3D 소프트 하이드로겔(>100 μm 두께, <1 kPa 강성)의 단방향 스트레칭을 허용합니다. 이러한 하이드로겔은 기존의 인장 기술에 의해 잡히고 뻗어 너무 부드럽습니다. 둘째, 3D 프린팅은 연구원이 쉽게 사용할 수 있고 설계에 사용되는 전자 장치가 저렴한 비용으로 사용되기 때문에 스트레치 장치는 다른 실험실에서 쉽게 복제 될 수 있습니다. 셋째, 아마도 가장 매력적인 기능, 실리콘 스트립에서 컷아웃의 형상 및 크기는 쉽게 조작할 수 있어, 튜닝 가능한 스트레인 그라데이션 및 경계 조건뿐만 아니라 다양한 샘플 볼륨을 몇 마이크로리터까지 사용할 수 있습니다.
제시된 프로토콜은 라이브 공초점 현미경 검사의 밑에 uniaxial 스트레치에 의해 진행된 0.5 mm 두께의 실리콘 고무 스트립에 있는 ~2mm 직경 디스크로 성형 피브린 젤로 이루어져 있습니다. 다음은 기하학적 컷아웃에 작용하는 균주를 측정하고 분석하기 위한 실험 절차, 하이드로겔에서 개발된 내부 균주, 다양한 스트레치 조작 후의 결과 섬유 정렬에 대해 자세히 설명합니다. 마지막으로, 하이드로겔에 세포를 포함하고 통제된 외부 스트레치에 노출시킬 가능성에 대해 논의된다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 솔루션 준비 (사전에 수행 될)
- 피브리노겐 라벨링
참고: 피브린 젤의 변형을 분석하는 경우에만 라벨링 단계가 필요합니다. 세포 실험의 경우 라벨이 없는 젤을 사용할 수 있습니다.- 10 mg/mL succinimidyl 에스테르 형광 염료 (DMSO에 용해)의 38 μL을 50 mL 원심분리기 튜브에 15 mg /mL 피브리노겐 용액 (5:1의 어금니 비율)의 1.5 mL에 추가하고 실온에서 1 시간 동안 셰이커에 놓습니다. 그 후, 800 x g (실온)에서 3 분 동안 원심분리기에 튜브를 놓습니다.
- 이 단계를 수행하여 미반응염염을 분리하기 위해 덱스텐 겔 수지(재료표)로 포장된 탈염 컬럼을 통해 이전 단계로부터 상체를 필터링한다.
- 25mL의 피브리노겐 버퍼로 컬럼을 미리 세척합니다.
- 1.1.1 단계에서 라벨이 부착된 피브리노겐을 컬럼에 천천히 주입하여 필터에 거품이 들어오지 않도록 합니다. 용액의 첫 번째 ~0.3 mL (희미한 색깔의 액체 4-6 방울)를 폐기하십시오. 그런 다음 정제 된 솔루션의 다음 1.0-1.5 mL을 수집합니다 (자세한 내용은 제조업체의 프로토콜을 따르십시오).
- 주사기 구동 필터(0.22-0.45 μm)를 사용하여 결과 정제 솔루션을 살균하여 여과 공정을 완료합니다.
- 컬럼을 청소하고 재활용하려면 20mL의 피브리노겐 버퍼로 세척한 다음 25mL의 20%에탄올에 보관하십시오.
- 용출 후, 생성된 정제 된 피브리노겐을 ~ 7-50 μL의 작은 알리쿼트로 나누어 원하는 수의 뻗어 젤에 따라. 각 뻗어 2mm 직경 원 젤에 대 한, 약 준비 3.5 fibrinogen의 μL (2.5 μL 젤 당 사용 됩니다 + 파이펫 오류에 대 한 1 μL).
- -20°C 냉동고에 알리쿼트를 보관합니다. 그들은 약 1 년까지 사용할 수 있습니다 (해동 및 다시 동결하는 것이 좋습니다).
- 이 프로토콜의 나머지 부분에 대해, 4단계까지 냉장고(4°C)에 정제된 피브리노겐의 약 7μL을 보관한다. 이 부피는 두 개의 뻗은 젤을 만들기 위한 것입니다(젤당 2.5 μL이 필요하며, 1 μL의 추가 부피는 샘플 준비의 오류를 설명하기 위해 사용됩니다).
참고: 이 필터링 절차는 일반적으로 초기 15 mg/mL 피브리노겐 용액을 약 10 mg/mL의 최종 농도로 희석시합니다. 희석 계수는 제조업체의 프로토콜에 명시된 바와 같이 초기 피브리노겐의 부피 및 농도에 따라 달라집니다.
- 7 μL의 혈소판 용액(트롬빈 버퍼를 사용하여 2단위/mL, 재료표로희석)하고 4단계까지 냉장고(4°C)에 보관하십시오. 이 볼륨은 두 개의 뻗은 젤의 컷 아웃을 채우기위한 것입니다.
참고: 내부 균주 분석을 수행하기 위해, 1 μm 직경 형광 구형 구슬 (물에서 서스펜션 [2 % 고체]와 2 mM NaN3로구입) 혈소판 용액에 추가해야합니다 (비드의 비율 1:25 v /v %의 비율 : thrombin은 40 배 목표에 권장됩니다). 비드는 내부 변형 측정이 필요한 경우에만 포함되어야 하며, 셀의 존재 또는 부재 시 포함되어야 합니다.
2. 실리콘 스트립 준비
- 0.5mm 두께의 실리콘 고무를 회수하여 스트립 중앙에 직경 2mm 구멍이 있는 15 x 80mm2 스트립으로 자른다(그림1). 가능하면 프로그래밍 가능한 레이저 커터를 사용하여 고정밀을 만드시면 됩니다. 프로그래밍 가능한 기계를 사용할 수 없는 경우 가위는 스트립 윤곽선을 절단하기에 충분하며 작은 구멍 펀치는 센터 컷아웃에 적합합니다.
참고 : 상업용 실리콘 고무는 일반적으로 양쪽에 플라스틱 랩으로 구입합니다. 가능하면 실리콘의 양쪽에 원래 플라스틱 덮개를 보관하십시오. 이전 실험에서 실리콘 스트립을 재사용하는 경우 0.5 시간 동안 트립신으로 치료하고 0.2 M NaOH에 0.5 시간 동안 담근 다음 1 시간 동안 70 %의 에탄올에 담가십시오. 사용하기 전에 건조하게 하십시오. - 최소 20 × 30mm2의치수로 밀봉 필름(소수성) 층을 준비하여 실리콘 스트립보다 넓기 때문에 전체 기하학적 컷아웃을 통해 씰이 형성되도록 합니다.
- 10cm 접시에 70% 에탄올로 씻은 다음, 비린두근 섬세한 작업 물티슈(멸균 및 비멸 실험 모두)로 닦아 말리십시오. 이 단계는 밀봉 필름 레이어가 플레이트에 더 잘 달라붙어 준비 과정에서 샘플의 움직임을 제한할 수 있기 때문에 중요합니다.
- 밀봉 필름 층을 세척 된 10cm 접시에 놓으므로 각 접시에 두 개의 스트립을 나란히 배치 할 수있는 충분한 공간이 있습니다(그림 2A).
- 실리콘 스트립의 한쪽에서 플라스틱 랩을 제거하고 밀봉 필름 층에 노출된 면을 배치하여 컷아웃이 밀봉 필름층(도 2B)에의해 완전히 둘러싸여 있도록 합니다. 그런 다음, 깨끗한 장갑을 낀 손가락을 사용하여 컷아웃 주변 영역을 밀봉하기 위해 밀봉 필름 레이어에 대한 실리콘을 부드럽게 누릅니다.
참고: 실리콘과 밀봉 필름 사이에 에어 포켓이 없는지, 특히 컷아웃 주변에 있는지 확인합니다. 접시의 하단면을 검사하여 이 작업을 수행하십시오(그림2C).
- 실리콘 스트립의 한쪽에서 플라스틱 랩을 제거하고 밀봉 필름 층에 노출된 면을 배치하여 컷아웃이 밀봉 필름층(도 2B)에의해 완전히 둘러싸여 있도록 합니다. 그런 다음, 깨끗한 장갑을 낀 손가락을 사용하여 컷아웃 주변 영역을 밀봉하기 위해 밀봉 필름 레이어에 대한 실리콘을 부드럽게 누릅니다.
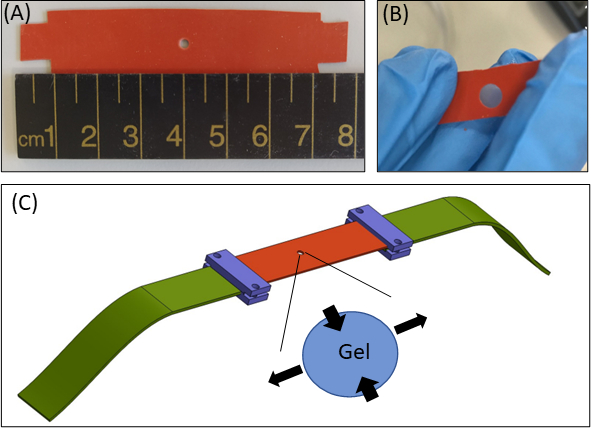
그림 1: 하이드로겔 긴장 접근법. (A)스트립(B) 임베디드 피브린 젤이 있는 원형 컷아웃이 있는 실리콘스트립(B)직경 2mm컷아웃이 있는 15× 80mm 2 실리콘 스트립. 예시적인 목적을 위해, 실리콘의 컷아웃은 실리콘 스트립(주황색), 원형 겔(가운데 컷아웃), 그리고 실리콘을 스트레칭 장치에 연결하는 패브릭 익스텐더(green)와 함께 스트레치 접근법의 실제실험(C)회로도보다 크다. 겔의 확대 된 영역은 실리콘의 단방향 스트레칭에 대한 응답으로 젤의 변형을 나타냅니다. 단순성으로, 겔(Z-축)의두께를 따라 압축하는 것은 그림에 표시되지 않는다. 그림 1B 및 1C는 Roitblat Riba 등41에서 적응되어이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 겔 중합 전에 밀봉 필름 층에 실리콘 스트립을 적절히 배치하는 예. (A) 10cm 접시(B)에실리콘 스트립을 배치하여 밀봉 필름층(C)접시의 바닥뷰, 실리콘과 밀봉 필름 층 사이의 공기 씰을 표시한다. 왼쪽: 밀봉 필름 층의 적절한 밀봉 필름 층은 에어 포켓없이 컷 아웃 주위에 실리콘 스트립에. 오른쪽: 컷 아웃의 가장자리에 공기 포켓으로 실리콘 스트립 컷 아웃에 밀봉 필름 레이어의 부적절한 씰. 이것은 실리콘 아래에 하이드로겔 성분의 누출로 이어질 것입니다. 빨간색 화살표는 에어 포켓이 형성된 영역을 가리킵니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 세포와 트롬빈 준비
참고: 하이드로겔에 세포를 포함시키는 것이 바람직한 경우에만 이 단계를 수행하고 생물학적후드(재료표)에서멸균 조건하에서 수행한다.
- 살균: 세포 실험 전날, 실리콘 스트립및 밀봉 필름 층을 하룻밤 사이에 70% 에탄올에 넣고 양쪽에 30분 동안 UV 살균을 수행합니다(10cm 접시가 이미 멸균되지 않은 경우, 70% 에탄올 세척 후 30분 동안 UV 빛 아래에서 살균해야 함). 프로토콜에 사용되는 UV 시스템은 생물학적 후드에 내장된 시스템입니다.
참고: 대안적으로, 오토클레이브 멸균 사이클(140°C)은 최대 260°C까지 저항하기 때문에 실리콘 스트립에서 수행될 수 있다. - 세포 수를 수행하여 세포 농도를 결정한 다음 원심분리기를 수행한 다음 1.5mL 원심분리기 튜브에서 7 μL(2 단위/mL)의 세포 펠릿을 다시 중단합니다. 우리는 800 세포 / 혈소판의 세포 농도를 권장합니다. 사용 될 때까지 세포를 차갑게 유지 (세포를 손상시키지 않도록 반 시간 이상 초과하지 마십시오).
4. 피브린 젤의 중합
- 냉장고에서 2 유닛/mL 혈전 및 10 mg/mL 라벨 피브리노겐 용액을 냉장고에서 검색하고(1단계에서 준비)하고 얼음 위에 놓아 접근이 가능합니다.
참고: 용액은 중합 반응 역학을 늦추기 위해 혼합 공정 전에 차갑게 유지됩니다. 이것은 단백질의 더 균일한 혼합을 허용합니다. - 접시(es)를 설정(2단계)으로, 라벨이 부착된 피브리노겐과 파이펫의 2.5 μL을 실리콘 컷아웃(아래쪽에 부착된 밀봉 필름 층)으로 균일하게 추출하여 컷아웃의 전체 둘레가 세브리노겐과 접촉하게 된다. 어떤 공기 포켓이나 거품이 솔루션의 어느 곳에서나 형성되지 않도록주의, 컷 아웃의 하단 가장자리에 특히주의를 지불 (밀봉 필름 층과 실리콘 사이의 인터페이스).
- 즉시 (세포 / 구슬유무) 트롬빈의 2.5 μL을 가지고 컷 아웃 (5 μL 피브린의 최종 볼륨에 도달)에서 피브리노겐 용액에 직접 파이펫. 그런 다음 두 솔루션을 조심스럽게 위아래로 ~ 10 번 피펫하여 빠르게 혼합합니다. 믹싱 프로세스 동안 팁을 전체 볼륨 주위로 이동하여 가능한 한 균일한 솔루션을 만듭니다.
- 매우 소량의 인산염 버퍼 식염수(PBS)를 추가 [셀 실험을 위한 대안적 세포 배지, 재료의 표]는각 접시의 가장자리를 따라, 하이드로겔은 중합 공정 중에 건조하지 않도록 한다. PBS/셀 배지와 샘플 사이에 접촉이 없는지 확인하여 시료가 손상됩니다.
- 접시(es)를 덮고 인큐베이터에 30분간 넣습니다.
참고: 필요한 잠복기 시간은 젤의 부피에 따라 달라집니다. 볼륨이 큰 경우 인큐베이션 시간이 증가합니다. - 인큐베이터에서 접시(es)를 제거하고 PBS/셀 배지를 접시에 추가하여 전체 젤 실리콘 구조를 잠급니다.
- 밀봉 필름 레이어가 스트립에 부착되어 있는지 확인하기 위해 접시에서 샘플을 한 번에 하나씩 조심스럽게 들어 올립니다. 실리콘의 한쪽 끝에서 다른 쪽 끝까지 부드럽게 피살하여 밀봉 필름 층을 실리콘에서 천천히 분리합니다(그림3). 응력 농도가 존재할 수 있는 컷아웃 에 가까운 영역에서 당기는 것을 피하십시오(이는 주로 원형이 아닌 형상에 중요합니다). 샘플이 손상되기 때문에 컷아웃과의 접촉을 피하십시오.
- 스트립이 접시에 떠 있는 PBS/셀 배지로 접시에 다시 넣습니다. 그런 다음 각 샘플의 상태를 질적으로 평가하기 위해 표준 세포 배양 현미경으로 접시 (es)를 가져 가라. 젤은 균일해야하며 컷 아웃 내내 연속적이어야하며 거품이 없어야합니다. 그림 4를 가이드로 사용하여 추가 분석을 위해 최상의 샘플을 선택합니다.

그림 3: 실리콘 스트립의 바닥에서 밀봉 필름 층을 적절히 제거합니다. 하이드로겔이 컷아웃의 내부 벽으로 접착을 찢거나 깨뜨리지 않도록 제거 과정을 천천히 수행해야 합니다. 흰색 화살표는 제거 방향을 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 실리콘 컷아웃에서 피브린 젤의 현미경 관찰. (A)제대로 중합된 피브린 젤의 두 가지 예. 겔의 상대적 균일성 및 컷아웃(B)의 가장자리에 대한 전체 접착력을주목한다(B)시료 중합 실패의 두 가지 예. 위: 왼쪽 하단에 형성된 많은 거품과 골재를 확인합니다. 아래쪽: 컷아웃 가장자리에서 젤이 찢어지는 것을 알 수 있으며 컷아웃의 왼쪽 아래 영역의 골재를 확인합니다. 스케일 바 = 300 μm이 그림을 보려면 여기를 클릭하십시오.
5. SCyUS 장치의 샘플 로딩
- PBS/셀배지(도 5)로목욕을 채우고, 끝이 목욕의 양쪽에 앉을 수 있도록 샘플 젤을 상단에 걸쳐 실리콘 스트립을 놓습니다. 목욕은 젤의 건조를 피하기위한 것입니다. 모든 조각이 중앙(그림 5)에서컷 아웃과 하나의 직선 스트립을 형성하기 위해 연결되도록 직물 스트립 (녹색)과 함께 클램프 (보라색)를 배치하고 조여.
- SCyUS 장치를 회수하고 알루미늄 액체를 잘 부착하고 22mm x 40mm 직사각형 유리 커버슬립(1번 또는 1.5번)(그림6Aiii)을부착합니다. 밀봉 재질(예: 진공 그리스)을 사용하여 커버 슬립을 우물 바닥에 부착하여 유정이 누설 없이 액체로 채워질 수 있도록 합니다.
- PBS/셀 배지의 ~1-2mL로 잘 채우고 스트립 + 패브릭 + 젤구조(도 6B)를장치에 넣습니다. 패브릭스트립(2)을브래킷(1)에 고정하여 컷아웃 + 젤(5)이 중앙에 있도록 한 다음, 핀다운 인서트(4)를 장치에 조심스럽게 배치하고 제자리에 잠급니다.
- 다음으로, 스핀들(서보모터를 부착하지 않고)에 다른 직물 측을 삽입하고 스핀들(도6C)에잠급니다.
- 현미경의 단계에 부착 된 샘플과 SCyUS 장치를 삽입(도 6C). USB 케이블을 통해 마이크로컨트롤러(재료 테이블)를컴퓨터에 연결하고 서보모터를 마이크로 컨트롤러에 연결합니다. 컴퓨터에서 SCyUS 제어 모듈을 엽니다. 샘플은 이제 공초점 현미경의 밑에 젤의 두께 및 섬유 균질성의 적정성을 확인하기 위하여 화상 진찰을 위한 준비되었습니다.
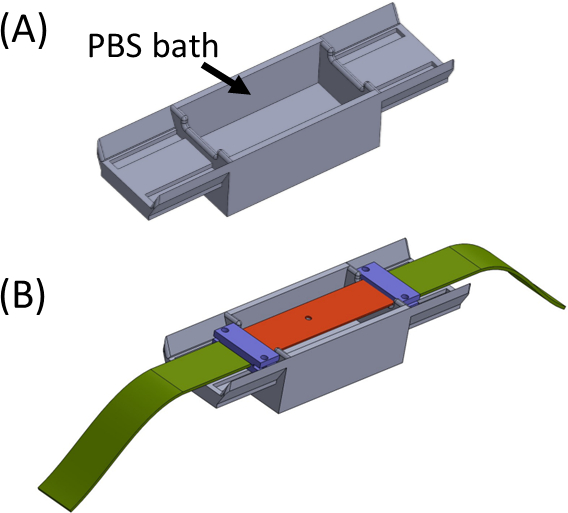
도 5: (a)PBS 목욕(3D 프린팅)(B)을 함유한 지그(B) 스트립 배치는 브래킷(보라색)의 적절한 인라인 부착을 보장하고 겔의 건조를 방지한다. 이 그림은 Roitblat Riba 등의 허가하에 수정되었습니다.41이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
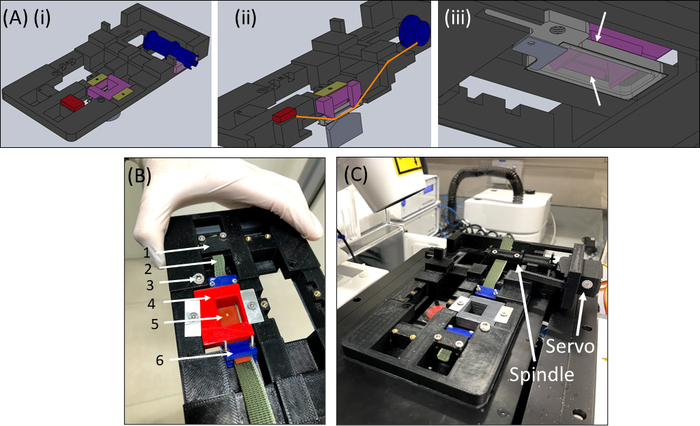
그림 6: SCyUS 스트레칭 장치. (A)SCyUS의 주요 부분의 CAD 모델의 여러 보기 : 서보 (파란색), 정적 앵커 (빨간색)에 연결된 스핀들, 실리콘 스트립을 아래로 고정 삽입 (보라색) 및 삽입이 상승 (노란색 - 녹색)을 방지 하는 해결사. 상기 시스템의 상부뷰(Ai),스트립(주황색선)의 경로를 보여주는 시스템(Aii)의 컷 뷰와 유리 커버슬립이 있는 알루미늄 액체의 바닥뷰(Aiii)가 잘 된다. 액체 우물은 주요 스레딩에 장착 된 나사의 회전과 함께 위아래로 이동할 수 있습니다. 알루미늄 우물의 상향 이동은 흰색 화살표(B)실제 시스템에 의해 표시된 바와 같이 보라색 인서트의 측면 날개에 의해 제한됩니다 :(1)정적 앵커(2)녹색 비 신축성 직물(3)알루미늄 액체 우물 높이 제어(4)빨간색 핀 다운 인서트(5)원형 컷 아웃(6)블루 연결 클램프(C)팽창 하는 실리콘 스트립에 배치 된 마이크로 초점 시스템에 배치 된 초점 시스템. 서보모터와 스핀들은 화살표로 표시됩니다. 이 그림은 Roitblat Riba 등의 허가하에 수정되었습니다.41이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 샘플링에 적합한 젤을 보장하십시오.
- 공초점현미경(재료표)을사용하여 저배율(10×), 저해상도(~1.4 μm x 1.4 μm x 1.4 μm 픽셀 크기) 공초점 Z-스택(≤ 약 10μ의 단계 크기)을 사용합니다. 488/543/561의 레이저를 사용하여 전체 젤의 타일 이미지로 실리콘의 두께 전반에 걸쳐 기하학적 컷아웃의 둘레에 균일성과 접착력을 검사한다(도7A-B). 다음 단계의 맵으로 이 Z-스택이미지를 사용합니다.
- 저해상도 라이브 이미징을 사용하여 젤을 스캔하고 컷아웃의 내부 벽에 대한 완전한 접착이 눈물이나 거품없이 명백히 보이는 가장 낮은 Z-위치를결정하고 현미경(Zl)의 Z-위치를 주목하십시오. 둘레 전체에 걸쳐 실리콘에 겔의 완전한 접착력을 결정하기 위해현미경(도 7C)에서겔및 실리콘 스트립(dark background)의 형광 라벨의 인터페이스를 스캔한다.
- 젤에 더 이상 연속성이 없을 때까지 Z방향으로 이동하고 Z-위치(Zu)를기록합니다.
- 하한(Z l)으로부터 Z-방향의상한(Zu)을 빼는다. 이것은 샘플(Zo)의기준 두께입니다.

Zo가 100 μm을 ≥ 경우 젤은 분석을 위해 만족스러운 것으로 간주됩니다. 실리콘 컷아웃의 두께는 약 500μm이지만 컷아웃에서겔 중합화는 일반적으로 더 작은 젤 두께를 초래한다. 100 μm은 실리콘 컷아웃에서 젤의 눈물이나 분리 없이 안정적인 스트레칭 과정을 보장하기 위해 최소한의 권장 두께입니다.
참고: 다른 XY 위치에서 젤의 두께가 다를 수 있습니다. 프로토콜의 이 단면도는 겔의 최소 두께를 측정하여 겔 품질을 결정하고 스트레칭에 충분한지 나타낼 수 있습니다. 또한 겔의 중심을 찾는 것은 정적 또는 동적 여부에 관계없이 포스트 스트레칭으로 돌아가는 기준점을 제공합니다.

그림 7: 겔 균질성. 타일 이미지는 공초점 현미경 소프트웨어(재료표)(A)를 사용하여포정된 화질(A)을 사용하여 부적절한 혈소암 및 피브리노겐 혼합 사전 중합으로 인해 상대적으로 불균일한 섬유 밀도를 가진 피브린 젤 샘플의 단일 스티치 타일 Z-슬라이스영상을 캡처및 스티치하였다. 이 겔은 비교적 균일한 섬유 밀도를 가진 피브린 젤 샘플의 신뢰할 수 있는분석(B)을제공하지 않습니다. 이것은 실험을 스트레칭하기위한 허용 젤입니다. 이미지 A & B의 스케일 바는 200 μm(C) 형광 표지젤(red)과 실리콘(black background) 사이의 인터페이스를 확대한다. 스케일 바 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. SCyUS 작동, 스트레칭 및 이미징
- 이제 샘플이 만족스러운 품질로 결정되고 SCyUS 장치에 올바르게 설정되었으므로 샘플의 미리 늘어난 위치를 결정합니다. 이것은 공초점 현미경의 밑에 살아있는 화상 진찰을 사용하여 달성됩니다 (단계 6.2와 유사).
- 서보모터가 제로 서보 Pos 로 이동 버튼을 클릭하여 0 위치에 있는지 확인합니다(그림 8A를 클릭하고 그림 8B가 0을 표시하는지 확인) 그림 6C에서볼 수 있듯이 스트롱 장치에 부착하십시오.
참고: 샘플에 과도한 장력을 두지 않도록 천천히 신중하게 이 단계를 수행합니다. - 시료를 이미징하는 동안, 컷아웃의 오른쪽이 움직일 때까지 +1 버튼을 클릭하여 시계 방향으로 한 번에 모터 1도(도8C)를이동한다. 그런 다음 -1 버튼을 클릭하여 두 번째 단계 위치로 다시이동(도 8D)을역행합니다. 이렇게 하면 샘플이 최소 장력 아래에 있는지 확인합니다. 참조 위치를 설정하려면 최소 서보 위치 설정 버튼(그림8E)을클릭합니다. 민서보 위치로 이동 버튼(도8F)을클릭하여 언제든지 참조 위치로 돌아갈 수 있습니다.
참고: 이 단계에 는 고배율 목표(≥40×)를 사용하여 오류를 최소화하는 것이 좋습니다. - 전체 젤 영역의 고배율(40×), 고해상도(~0.2 μm × 0.2 μm) 크기의 단일 Z 슬라이스 타일 이미지를 캡처합니다. 이는 사후 처리 분석을 위한 참조 이미지로 사용됩니다. 젤 두께의 중간에 단일 Z-슬라이스이미지를 캡처하는 것이 좋습니다 (Eq. 1에서 Zo를 사용하여), 이것은 스트레칭 후 거의 동일한 Z-위치로 반환 할 수 있습니다. 또한 전체 젤 영역의 고해상도 타일 이미지에는 상당한 시간이 소요된다는 점을 고려하십시오(~20-30분).
- 이제 샘플은 정적 스트레칭에 대한 준비가되어 있습니다. GUI에서 한 번에 1도(도8C)를진행하여 원하는 스트레치 크기로 서보모터를 조정합니다(천천히, 약 1도/초 수행).
- 서보모터가 제로 서보 Pos 로 이동 버튼을 클릭하여 0 위치에 있는지 확인합니다(그림 8A를 클릭하고 그림 8B가 0을 표시하는지 확인) 그림 6C에서볼 수 있듯이 스트롱 장치에 부착하십시오.
- 분석이 원하는 각 스트레치 크기에서 후처리 분석을 위해 전체 젤 영역의 단일 Z 슬라이스 고해상도 타일 이미지를 캡처합니다. 6.2 단계와 유사하게, 겔(red)과 실리콘(dark background) 사이의 인터페이스를 스캔하여 둘레 전체에 걸쳐 실리콘으로부터 겔이 분리되지 않았는지 확인하여 이전 스트레치 크기로부터 접착의 변화를 찾는다.
참고: 모터를 활성화하는 동안 라이브 이미징을 사용하여 X-Y의 젤 위치를 따르십시오(저해상도, 저배율 설정). 젤은 젤의 바닥이 상승하는 Z-푸아송효과를 경험하므로 현미경의 Z-위치도모든 스트레치 크기에 대한 젤 두께의 대략적인 중심으로 조정되어야 합니다. 이는 각 스트레치 크기에 대해 Z o(Eq. 1)를재계산하여 달성할 수 있습니다. Z-방향에서 스트레치가 비교적 균일하기 때문에 겔의 정확한 중심 깊이를 찾는 것은 중요하지 않습니다.
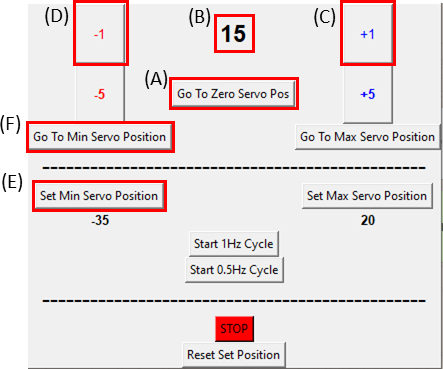
그림 8: SCyUS 제어 모듈용 GUI입니다. (A)모터의 위치도. 값범위는 -90°에서90°(B)'최소 서보 위치 설정'입니다. 이 버튼은 제로 서보 위치(C)'플러스 1 °' 버튼이 서보 모터를 1도 시계 방향으로 이동(D)'마이너스 1°' 버튼을 이동서보 모터 를 이동에 다른 새로운 참조 위치를 설정하기 위해 사전 설정 최소 위치를 할 수 있습니다 시계 반대 방향(E) '제로 위치로 이동' 버튼은 서보모터 위치를 0°로 설정([A]는 0으로 설정)(F) '최소 서보 위치로 이동' 버튼은 서보모터를 사용자정의 'Min' 위치로 이동한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 후처리 외부 균주 측정
- 컷아웃 경계의 유효 균주를 측정하려면 Y축(도9A)의중심에서 스트레치 방향(X-축)에서 에지-투-에지 길이를 측정합니다.
- 이미지 처리 소프트웨어(ImageJ FIJI43)에사전 스트레치 이미지를 업로드하고 중앙에 구멍()의 축 길이로 정의된 가장 큰 에지-투-에지 거리를
 측정한다.
측정한다. - 수직 거리()로 위에서 아래로 가장 큰 거리를
 정의합니다.
정의합니다. - 모든 스트레치 간격 이미지에 대해이 프로세스를
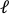 반복하고 절단 주변의 축 () 및 수직
반복하고 절단 주변의 축 () 및 수직  () 거리를 계산한 다음 컷 아웃 가장자리의 균주를 찾기 위해 다음 계산을 수행합니다.
() 거리를 계산한 다음 컷 아웃 가장자리의 균주를 찾기 위해 다음 계산을 수행합니다.
- 이미지 처리 소프트웨어(ImageJ FIJI43)에사전 스트레치 이미지를 업로드하고 중앙에 구멍()의 축 길이로 정의된 가장 큰 에지-투-에지 거리를
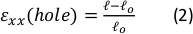

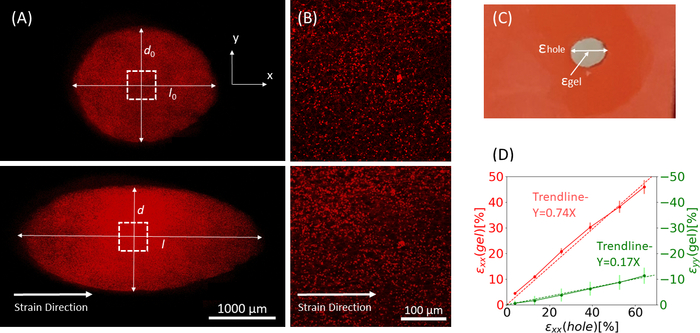
그림 9: 실리콘 스트립의 외부 스트레칭으로 인한 젤 균주. (A) x-Y 단면은 구이되지 않은 피브린 겔(상단)의 단면, 그리고 ε홀의 적용 후 = x 방향(bottom)을 따라 64% 변형한다. 젤에는 형광 구슬이 내장되어 있습니다. ε구멍의 계산에 사용되는 d 및 l의 관련 길이는 A(C)에 표시된 대시 사각형 면적의이미지(B)줌인 이미지에 표시되어 있습니다 ε. 및 ε겔은 겔의 중앙에 있는 축 균주(비드 골재 위치에 의해 측정된 대로)(D) 선형 관계는 ε 구멍과 ε겔 사이에 xx 방향(red line) 및 yy 방향(green line)에서 발견되었다. 이 그림은 Roitblat Riba 등의 허가하에 적용되었습니다.41이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
9. 섬유 배향 분석
- 섬유 정렬의 정량화를 사용하여 섬유질 겔의 구조적 반응을 특성화하여 스트레치의 크기를 증가시면 됩니다. ImageJ FIJI 소프트웨어(NIH)43에 고해상도 이미지를 업로드한 다음 오리엔테이션J(EPFL)44 모듈(설정: 가우시안 그라데이션 및 3픽셀 윈도우, 그림 10)을사용하여 분석합니다.
- 방향 히스토그램의 2D 네매틱 오더 매개변수(NOP)를 다음과 같이 계산합니다:45
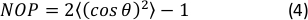
참고: NOP = 1값은 축 방향(각도 0)을 따라 완벽한 정렬을 나타내고 NOP = 0은 등위도를 나타냅니다. 방향 각도, θ는이미지 분석을 통해 얻어지고 OrientationJ 설명서에 정확하게 정의된 스트레인 축(x축)과 관련하여 섬유 각도입니다. 44
- 방향 히스토그램의 2D 네매틱 오더 매개변수(NOP)를 다음과 같이 계산합니다:45

그림 10: 피지 이미지J 소프트웨어를 이용한 섬유 배향 분석. (A)'오리엔테이션J'를 찾을 수 있는 '플러그인' 풀다운 메뉴의 위치를 나타내는 화살표가 있는 ImageJ의 메인 메뉴. '오리엔테이션J'의 확장 메뉴에서 '오리엔테이션J 배포'옵션(B)오리엔테이션J의 배포 모듈을 클릭합니다. '로컬 윈도우 σ'을 3픽셀로 설정하고 '그라데이션'을 '가우시안'으로 설정합니다. 그런 다음 '실행' 버튼(빨간색 화살표)을 누릅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
10. 수동 내부 젤 균주 분석
- 내장된 구슬이 있는 하이드로겔의 라이브 고배율 이미징을 수행하는 동안, 각 스트레치 크기 후 동일한 위치로 돌아가기 위해 쉽게 알아볼 수 있는 기능(예: 구슬의 골재)을 가진 관심 영역(ROI)을 수동으로 찾습니다.
참고: Z 방향(Poisson 효과)의 압축은 스트레치가 증가함에 따라 비드 밀도가 증가할 수 있으므로 비드 응고를 충분히 크게 선택하는 것이 좋습니다. 이 프로토콜은 피브린 젤의 중앙 영역의 분석을 요구하지만 모든 영역을 선택할 수 있습니다. - 사전 스트레치 위치(6단계에서)에서 선택한 ROI의 고해상도 Z-스택이미지를 캡처합니다. 원하는 각 스트레치 간격 후 동일한 ROI로 돌아가 이미지 캡처 프로세스를 반복합니다.
- 이미지를 가져와 ImageJ로 가져옵니다. ROI에서 표시되는 각 비드 집계의 X-Y 픽셀 위치를 기록합니다. 기록된 데이터를 스프레드시트로 전송합니다.
- 모든 응집체 쌍 사이의 거리를 측정하고 참조 이미지의 동일한 쌍의 거리와 비교하여 X 및 Y 방향으로 균주를 계산할 수 있습니다.
참고: 겔이 늘어나는 동안 연속 실시간 영화가 기록되는 경우(정적 이미지 캡처 대신), 이전에 시연된46,47과같이 디지털 이미지 또는 볼륨 상관관계(DIC/DVC) 방법으로 균주의 자동 분석을 수행할 수 있습니다. 그러나 Z-스택이 X-Y 평면에서 움직일 뿐만 아니라 푸아송 효과(압축)로 인해 Z-방향으로이동하므로 자동 DIC/DVC 분석이 이 설정에서 어려운 것으로 기록되어 기록된 영화 중 상당한 드리프트를 차지합니다.
Access restricted. Please log in or start a trial to view this content.
결과
1 μm 형광 구슬이 내장된 3D 피브린 하이드로겔을 운반하는 실리콘 스트립에 가해지는 증가 크기의 정적 스트레치로부터의 대표적인 데이터가 도 9에도시된다. 이 분석은 실리콘 스트레치가 절단의 기하학적 변화뿐만 아니라 젤 내의 개발 된 균주에 미치는 영향을 보여줍니다. 전체 젤의 Z-스택이미지는 타원형형상(도 9A)에컷아웃된 원래 ?...
Access restricted. Please log in or start a trial to view this content.
토론
본 원에 제시된 방법 및 프로토콜은 주로 Roitblat Riba 외.41에 의한 이전 연구를 기반으로 하며, 여기에 SCyUS 장치의 전체 컴퓨터 지원 설계(CAD), 파이썬 및 마이크로 컨트롤러 코드를 포함합니다.
기존 접근법에 비해 제시된 방법의 주요 장점은 매우 부드러운 3D 하이드로겔(+100 Pa의 탄성 계수)을 둘레에서, 그리고 살아있는 공초점 이미징하에서 변?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
여기에 포함 된 일부 수치는 저작권 허가 센터의 허가에 의해 적응되었습니다 : 스프링어 자연, 생물 의학 공학의 연보. 라이브 현미경 이미징을 가능하게하면서 균일 한 z 축 균주를 가진 3D 하이드로겔을 긴장, A. Roitblat 리바, S. 나탄, A. 콜렐, H. Rushkin, O. Tchaicheeyan, A. Lesman, 저작권© (2019).
https://doi.org/10.1007/s10439-019-02426-7
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 546 carboxylic acid, succinimidyl ester | Invitrogen | A20002 | |
| Cell Medium (DMEM High Glucose) | Biological Industries | 01-052-1A | Add 10% FBS, 1% PNS, 1% L-Glutamine, 1% Sodium Pyruvate |
| Cover Slip #1.5 | Bar-Naor Ltd. | BN72204-30 | 22×40 mm |
| DIMETHYL SULPHOXIDE 99.5% GC DMSO | Sigma-Aldrich Inc. | D-5879-500 ML | |
| Dulbecco's Phosphate-Buffered Saline | Biological Industries | 02-023-1A | |
| EVICEL Fibrin Sealant (Human) | Omrix Biopharmaceuticals | 3902 | Fibrinogen: 70 mg/mL, Thrombin: 800-1200 IU/mL |
| Fibrinogen Buffer | N/A | Recipe for 1L: 7g NaCl, 2.94g trisodium citrate dihydrate, 9g glycine, 20g arginine hydrochloride & 0.15g calcium chloride dihydrate. Bring final volume to 1L with PuW (pH 7.0-7.2) | |
| Fluorescent micro-beads FluoSpheres (1 µm) | Invitrogen | F8820 | Orange (540/560) Provided as suspension (2% solids) in water plus 2 mM sodium azide |
| High-Temperature Silicone Rubber | McMaster-Carr | 3788T41 | 580 µm-thick E = 1.5 Mpa Poisson Ratio = 0.48 Tensile Strength = 4.8 MPa Upper limit of stretch = +300% engineering strain |
| HiTrap desalting column 5 mL (Sephadex G-25 packed) | GE Healthcare | 17-1408-01 | |
| HIVAC-G High Vacuum Sealing Compound | Shin-Etsu Chemical Co., Ltd. | HIVAC-G 100 | |
| ImageJ FIJI software39 | National Institute of Health, Bethesda, MD | Version 1.8.0_112 | |
| Microcontroller (Adruino Uno + Adafruit Motorshield v2.3) | Arduino/Adafruit | Arduino-DK001/Adafruit-1438 | |
| MicroVL 21R Centrifuge | Thermo Scientific | 75002470 | |
| Parafilm | Bemis | PM-996 | |
| Primovert Light Microscope | Carl Zeiss Suzhou Co., Ltd. | 491206-0011-000 | |
| SCyUS CAD (Solidworks) | Dassault Systèmes | N/A | |
| SCyUS Code37 | N/A | N/A | |
| Servomotor - TowerPro SG-5010 | Adafruit | 155 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | For 50 mL tubes |
| Sterile 10 cm non-culture plates | Corning | 430167 | |
| Thrombin buffer | N/A | Recipe for 1L: 20g mannitol, 8.77g NaCl, 2.72g sodium acetate trihydrate, 24 mL 25% Human Serum Albumin, 5.88g calcium chloride. Bring final volume to 1L with PuW (pH 7.0) | |
| Trypsin EDTA Solution B (0.25%), EDTA (0.05%) | Biological Industries | 03-052-1B | |
| USB Cable (Type B Male to Type A Male) | N/A | N/A | |
| Zeiss LSM 880 Confocal Microscope | Carl Zeiss AG | 2811000417 | |
| ZEN 2.3 SP1 FP3 (black) | Carl Zeiss AG | Release Version 14.0.0.0 |
참고문헌
- Bleuel, J., Zaucke, V., Bruggemann, G. P., Niehoff, A. Effects of cyclic tensile strain on chondrocyte metabolism: a systematic review. PLoS ONE. 10, 0119816(2015).
- Pennisi, C. P., Olesen, C. G., de Zee, M., Rasmussen, J., Zachar, V. Uniaxial cyclic strain drives assembly and differentiation of skeletal myocytes. Tissue Engineering Part A. 17, 2543-2550 (2011).
- Grodzinsky, A. J., Levenston, M. E., Jin, M., Frank, E. H. Cartilage Tissue Remodeling in Response to Mechanical Forces. Annual Review of Biomedical Engineering. 2 (1), 691-713 (2000).
- Munster, S., et al. Strain history dependence of the nonlinear stress response of fibrin and collagen networks. Proceedings of the National Academy of Sciences of the USA. 110, 12197-12202 (2013).
- Vader, D., Kabla, A., Weitz, D., Mahadevan, L. Strain-induced alignment in collagen gels. PLoS ONE. 4, 5902(2009).
- Badylak, S. F. The extracellular matrix as a scaffold for tissue reconstruction. Seminars in Cell & Developmental Biology. 13 (5), 377-383 (2002).
- Natan, S., Koren, Y., Shelah, O., Goren, S., Lesman, A. Molecular Biology of the Cell. 31 (14), 1474-1485 (2020).
- Ban, E., et al. Mechanisms of Plastic Deformation in Collagen Networks Induced by Cellular Forces. Biophysical Journal. 114 (2), 450-461 (2018).
- Kim, J., et al. Stress-induced plasticity of dynamic collagen networks. Nature Communications. 8, 842(2017).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Basu, A., Janmey, P. A., Yodh, A. G. Non-affine deformations in polymer hydrogels. Soft Matter. 8, 8039-8049 (2012).
- Muiznieks, L. D., Keeley, F. W. Molecular assembly and mechanical properties of the extracellular matrix: A fibrous protein perspective. Biochimica et Biophysica Acta. 1832, 866-875 (2012).
- Brown, A. E. X., Litvinov, R. I., Discher, D. E., Purohit, P. K., Weisel, J. W. Multiscale mechanics of fibrin polymer: gel stretching with protein unfolding and loss of water. Science. 325, 741-744 (2009).
- Carroll, S. F., Buckley, C. T., Kelly, D. J. Cyclic tensile strain can play a role in directing both intramembranous and endochondral ossification of mesenchymal stem cells. Frontiers in Bioengineering and Biotechnology. 5, 73(2017).
- Livne, A., Bouchbinder, E., Geiger, B. Cell reorientation under cyclic stretching. Nature Communications. 5, 3938(2014).
- Wang, L., et al. Patterning cellular alignment through stretching hydrogels with programmable strain gradients. ACS Applied Materials & Interfaces. 7, 15088-15097 (2015).
- Xu, G. K., Feng, X. Q., Gao, H. Orientations of Cells on Compliant Substrates under Biaxial Stretches: A Theoretical Study. Biophysical Journal. 114 (3), 701-710 (2017).
- Chagnon-Lessard, S., Jean-Ruel, H., Godin, M., Pelling, A. E. Cellular orientation is guided by strain gradients. Integrative Biology (United Kingdom). 9 (7), 607-618 (2013).
- Lu, J., et al. Cell orientation gradients on an inverse opal substrate. ACS Applied Materials & Interfaces. 7 (19), 10091-10095 (2015).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125, 3015-3024 (2012).
- Bono, N., et al. Unraveling the role of mechanical stimulation on smooth muscle cells: a comparative study between 2D and 3D models. Biotechnology and Bioengineering. 113, 2254-2263 (2016).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8, 839-845 (2007).
- Riehl, B. D., Park, J. H., Kwon, I. K., Lim, J. Y. Mechanical stretching for tissue engineering: two-dimensional and three-dimensional constructs. Tissue Engineering Part B: Reviews. 18, 288-300 (2012).
- Flexcell. Linear Tissue Train Culture Plate. Flexcell. , (2019).
- Flexcell. Tissue Train. Flexcell. , (2019).
- CellScale. MCT6 Stretcher. CellScale. , (2019).
- STREX. STB-150. STREX. , (2019).
- STREX. Stretch Chambers. STREX. , (2019).
- Kamble, H., Barton, M. J., Jun, M., Park, S., Nguyen, N. T. Cell stretching devices as research tools: engineering and biological considerations. Lab on a Chip. 16, 3193-3203 (2016).
- Weidenhamer, N. K., Tranquillo, R. T. Influence of cyclic mechanical stretch and tissue constraints on cellular and collagen alignment in fibroblast-derived cell sheets. Tissue Engineering Part C: Methods. 19, 386-395 (2013).
- Yung, Y. C., Vandenburgh, H., Mooney, D. J. Cellular strain assessment tool (CSAT): precision-controlled cyclic uniaxial tensile loading. Journal of Biomechanics. 42, 178-182 (2009).
- Chen, K., et al. Role of boundary conditions in determining cell alignment in response to stretch. Proceedings of the National Academy of Sciences of the USA. 115, 986-991 (2018).
- Heher, P., et al. A novel bioreactor for the generation of highly aligned 3D skeletal muscle-like constructs through orientation of fibrin via application of static strain. Acta Biomaterialia. 24, 251-265 (2015).
- Foolen, J., Deshpande, V. S., Kanters, F. M. W., Baaijens, F. P. T. The influence of matrix integrity on stress-fiber remodeling in 3D. Biomaterials. 33, 7508-7518 (2012).
- Walker, M., Godin, M., Pelling, A. E. A vacuum-actuated microtissue stretcher for long-term exposure to oscillatory strain within a 3D matrix. Biomedical Microdevices. 20, 43(2018).
- Zhao, R. G., Boudou, T., Wang, W. G., Chen, C. S., Reich, D. H. Decoupling cell and matrix mechanics in engineered microtissues using magnetically actuated microcantilevers. Advanced Materials. 25, 1699-1705 (2013).
- Li, Y. H., et al. Magnetically actuated cell-laden micro-scale hydrogels for probing strain-induced cell responses in three dimensions. NPG Asia Materials. 8, 238(2016).
- Li, Y. H., et al. An approach to quantifying 3D responses of cells to extreme strain. Scientific Reports. 6, 19550(2016).
- Humphrey, J. D., et al. A theoretically-motivated biaxial tissue culture system with intravital microscopy. Biomechanics and Modeling in Mechanobiology. 7, 323-334 (2008).
- Niklason, L. E., et al. Enabling tools for engineering collagenous tissues integrating bioreactors, intravital imaging, and biomechanical modeling. Proceedings of the National Academy of Sciences of the USA. 107, 3335-3339 (2010).
- Roitblat Riba, A., et al. Straining 3D hydrogels with uniform z-axis strains while enabling live microscopy imaging. Annals of Biomedical Engineering. , (2019).
- Gomez, D., Natan, S., Shokef, Y., Lesman, A. Mechanical interaction between cells facilitates molecular transport. Advanced Biosystems. 3 (12), 1900192(2019).
- Schindelin, J., et al. Fiji: an open- source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- EPFL Switzerland. OrientationJ plug in. EPFL Switzerland. , (2019).
- Goren, S., Koren, Y., Xu, X., Lesman, A. Elastic anisotropy governs the decay of cell-induced displacements. Biophysical Journal. 118 (5), 1152-1164 (2019).
- Notbohm, J., Lesman, A., Tirrell, D. A., Ravichandran, G. Quantifying cell-induced matrix deformation in three dimensions based on imaging matrix fibers. Integrative Biology. 7 (10), 1186-1195 (2015).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. Journal of Cell Biology. 205 (2), 155-162 (2014).
- Cha, C. Y., et al. Tailoring Hydrogel Adhesion to Polydimethylsiloxane Substrates Using Polysaccharide Glue. Angewandte Chemie International Edition. 52, 6949-6952 (2019).
- Wirthl, D., et al. Instant tough bonding of hydrogels for soft machines and electronics. Science Advances. 3, (2017).
- Juarez-Moreno, J. A., Avila-Ortega, A., Oliva, A. I., Aviles, F., Cauich-Rodriguez, J. V. Effect of wettability and surface roughness on the adhesion properties of collagen on PDMS films treated by capacitively coupled oxygen plasma. Applied Surface Science. 349, 763-773 (2015).
- Kim, H. T., Jeong, O. C. PDMS surface modification using atmospheric pressure plasma. Microelectronic Engineering. 88, 2281-2285 (2011).
- Prasad, B. R., et al. Controlling cellular activity by manipulating silicone surface roughness. Colloids and Surfaces. 78, 237-242 (2010).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유