需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
实时显微镜成像下的 3D 水凝胶控制应变
摘要
提出的方法涉及嵌入硅橡胶的3D软水凝胶的单轴拉伸,同时允许活体共焦显微镜。演示了外部和内部水凝胶菌株的特征以及纤维对齐。开发的设备和协议可以评估细胞对各种菌株机制的反应。
摘要
外力是组织形成、发育和维护的重要因素。这些力的作用通常使用专门的体外拉伸方法进行研究。各种可用系统使用基于 2D 基板的担架,而 3D 技术对软水凝胶应变的可及性则受到更多限制。在这里,我们描述了一种方法,允许软水凝胶从其周长外部拉伸,使用弹性硅胶条作为样品载体。本协议中使用的拉伸系统由 3D 打印部件和低成本电子产品构建,使其简单易于在其他实验室中复制。实验过程从聚合厚(>100微米)软纤维素水凝胶(弹性Modulus+100 Pa)开始,切口位于硅胶条的中心。然后,硅胶构造连接到打印拉伸装置上,并放置在共焦显微镜阶段。在实时显微镜下,拉伸装置被激活,凝胶以各种拉伸量度进行成像。然后,用于图像处理来量化由此产生的凝胶变形,在整个凝胶的 3D 厚度(Z-轴) 中显示相对均匀的菌株和纤维对齐。这种方法的优点包括能够在进行原位显微镜时以3D方式应变极其柔软的水凝胶,以及根据用户的需求自由地操纵样品的几何形状和大小。此外,通过适当的适应,该方法可用于拉伸其他类型的水凝胶(如胶原蛋白、聚丙烯酰胺或聚乙二醇),并允许在更逼真3D条件下分析细胞和组织对外部力量的反应。
引言
组织对机械力的反应是多种生物功能的组成部分,包括基因表达1、细胞分化2和组织改造3。此外,细胞外基质(ECM)的力诱发变化,如纤维对齐和密度化,可以影响细胞行为和组织形成4,5,6。ECM的纤维网状结构具有耐人寻味的机械特性,如非线性弹性、非擦合变形和塑料变形7、8、9、10、11、12。这些特性影响细胞及其周围微环境对外部机械力的反应13、14。了解 ECM 和组织对机械力的反应将推动组织工程领域以及更精确的计算和理论模型的开发取得进展。
最常见的机械拉伸样本的方法都集中在细胞载2D基材上,以探索对细胞行为的影响。例如,这些包括将菌株应用于多晶硅氧烷(PDMS)基板,以及分析与拉伸方向15、16、17、18、19相关的细胞重新定向角度。然而,研究3D细胞嵌入式水凝胶对外部拉伸的反应的方法更为有限,这种情况更密切地模仿组织微环境。与3D矩阵20相比,3D拉伸方法的进步尤为重要,因为细胞在2D基材上的行为不同。这些行为包括细胞重新调整,蛋白质表达水平,和迁移模式21,22,23。
允许3D样品拉伸的方法和设备包括市售的24、25、26、27、28和为实验室研究开发的方法和设备29。这些方法使用可拆解硅胶管30,多井室31,夹子26,32,生物反应器11,33,罐34,35,36,和磁铁37,38。有些技术会产生局部变形的3D水凝胶,例如从凝胶5中的两个单点拔针,而另一些技术允许凝胶16的大部分变形。此外,这些系统大多侧重于分析X-Y平面中的应变场,而Z方向的应变场信息有限。此外,这些设备中只有少数能够进行微观原位成像。原位高放大成像(例如共聚焦显微镜)的主要挑战是,从目标透镜到样品的几百微米工作距离有限。允许在拉伸过程中进行实时成像的设备牺牲了Z轴应变的均匀性,或者相对复杂且难以在其他实验室39,40中复制。
这种伸展3D水凝胶的方法允许在活体对焦显微镜期间进行静态或周期性单轴应变。拉伸设备(称为"智能环状单轴拉伸器 - SCyUS")采用 3D 打印部件和低成本硬件构建,可在其他实验室中轻松复制。连接到设备的是一个市售的硅橡胶,其中心有几何切口。水凝胶组件聚合以填充切口。在聚合过程中,生物水凝胶,如纤维蛋白或胶原蛋白,自然粘附在切口的内壁上。使用SCyUS,硅胶条是非近似拉伸,转移控制菌株到嵌入式3D水凝胶41。
与其他现有方法相比,该系统允许将功能和优势的独特组合。首先,该系统允许从其外围单轴拉伸厚的 3D 软水凝胶(>100 微米厚,<1 kPa 刚度),在整个水凝胶中 Z- 同质变形。这些水凝胶太软,不能被传统的拉伸技术抓住和拉伸。其次,拉伸设备可以很容易地在其他实验室复制,因为 3D 打印可供研究人员使用,设计中使用的电子产品成本低廉。第三,也许也是最吸引人的特征,硅胶条中切口的几何形状和大小可以很容易地操纵,允许可调谐应变梯度和边界条件,以及使用各种样品体积,下至几微升。
所提出的协议包括将纤维蛋白凝胶成直径约2毫米的圆盘,在0.5毫米厚的硅橡胶条中,在活体共焦显微镜下进行单轴拉伸。以下详细讨论了测量和分析几何切口上的菌株、水凝胶中形成的内部菌株以及各种拉伸操作后产生的纤维对齐的实验程序。最后,讨论了将细胞嵌入水凝胶中并使其暴露在受控外部拉伸的可能性。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 解决方案准备(将提前执行)
- 纤维蛋白原标签
注意:只有当需要分析纤维蛋白凝胶的变形时,才需要标记步骤。对于细胞实验,可以使用无标签的凝胶。- 在 50 mL 离心管中加入 38 微升 10 毫克/mL 的超新星酯荧光染料(溶解在 DMSO 中)至 1.5 mL 15 毫克/mL 纤维素溶液(摩尔比为 5:1),并在室温下放置摇床 1 小时。之后,将管子放在离心机中3分钟,温度为800 x g( 室温)。
- 通过装有脱硝凝胶树脂(材料表)的脱盐柱过滤前一步的超自然物质,通过遵循这些步骤分离未反应的染料42。
- 使用 25 mL 的纤维素缓冲器预洗柱。
- 慢慢地将标记的纤维蛋白原从步骤 1.1.1 注入列中,确保没有气泡进入过滤器。丢弃第一个 ~0.3 mL 的稀释溶液(4-6 滴淡色液体)。然后收集以下 1.0-1.5 mL 的纯化解决方案(按照制造商的协议了解更多具体细节)。
- 使用注射器驱动的过滤器(0.22-0.45 μm)对由此产生的纯化溶液进行灭菌,从而完成过滤过程。
- 要清洁和回收柱,用20mL的纤维素缓冲器清洗,然后储存在25mL的20%乙醇。
- 洗净后,根据所需的拉伸凝胶数量,将由此产生的纯化标记纤维原分成 7-50μL 的小别名。对于每个拉伸的直径为 2 毫米的圆凝胶,准备约 3.5μL 的纤维蛋白原(每凝胶 2.5 μL 将用于管道错误 + 1 μL)。
- 将别名存放在-20°C的冰柜中。它们最多可使用一年左右(不建议再次解冻和冻结)。
- 在此协议的剩余部分,将大约 7 μL 的纯化标记纤维蛋白原保留在冰箱中 (4 °C) 直到第 4 步。此卷用于创建两个拉伸凝胶(每凝胶需要 2.5μL,并使用额外的 1 μL 体积来解释样品制备中的错误)。
注意:此过滤过程通常稀释初始 15 毫克/mL 纤维素溶液,最终浓度约为 10 毫克/mL。稀释因子取决于制造商协议中规定的纤维蛋白原的初始体积和浓度。
- 准备7μL的血栓溶液(使用血栓缓冲器稀释到2个单位/mL, 材料表),并保存在冰箱(4°C),直到步骤4。此卷旨在填充两个拉伸凝胶的切口。
注意:为了进行内部应变分析,应在血栓溶液中加入直径为 1μm 的荧光球形珠子(作为悬架购买 [2% 固体] 加 2 mM NaN3),应添加 1:25 v/v% 的珠子比例:建议为 40 倍目标购买血栓。只有在需要内部应变测量时,在细胞存在或不存在时,才应包括珠子。
2. 硅胶条制备
- 取回 0.5 毫米厚的硅橡胶,将其切成 15 x 80 mm2 条,在条形中心有一个直径为 2 毫米的孔(图 1)。如果可能,使用可编程激光切割机进行高精度切割。如果无法编程的机械,剪刀足以切割条形轮廓,小孔冲孔足以进行中心切口。
注:商用硅胶橡胶通常用塑料包装在两侧购买。如果可能,在硅胶两侧保留原始塑料覆盖物。如果重复使用先前实验中的硅胶条,用 trypsin 治疗 0.5 小时,浸泡在 0.2 M NaOH 中 0.5 小时,然后浸泡 70% 乙醇 1 小时。使用前让它们干燥。 - 准备密封膜(疏水)层,尺寸至少为20×30毫米2,因此它们比硅胶条更宽,从而允许密封形成整个几何切口。
- 用70%乙醇清洗10厘米的盘子,然后用不林细腻的任务湿巾擦拭和干燥(用于无菌和非无菌实验)。这一步骤很重要,因为它允许密封膜层更好地粘在板上,并在制备过程中限制样品的运动。
- 将密封膜层放在洗过的 10 厘米的盘子中,以便有足够的空间将两条条放在每个菜中并排放置 (图 2A)。
- 从硅胶条的一侧取出塑料包装,将外露的一侧放在密封膜层上,使切口完全被密封膜层(图 2B)包围。然后,用干净的戴手套手指轻轻压在硅胶上,以密封切口周围的区域。
注意:确保硅胶和密封膜之间没有气囊,尤其是在切口周围。通过检查菜的底部(图2C)来做到这一点。
- 从硅胶条的一侧取出塑料包装,将外露的一侧放在密封膜层上,使切口完全被密封膜层(图 2B)包围。然后,用干净的戴手套手指轻轻压在硅胶上,以密封切口周围的区域。
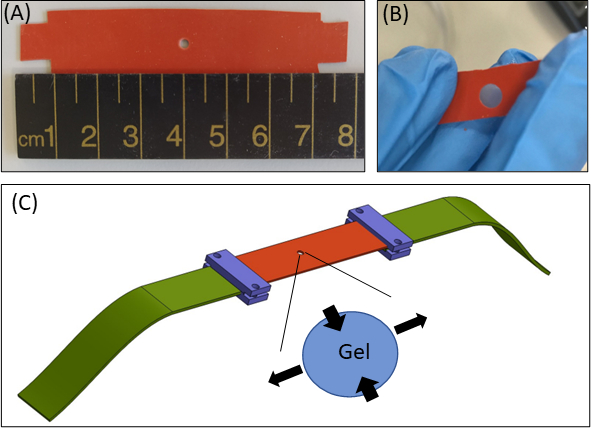
图1:水凝胶拉紧方法。(A) 15 × 80 毫米2 硅胶条,带中央直径为 2 毫米 的切口 (B) 带圆形切口的硅胶条,带有嵌入式纤维蛋白凝胶。为了说明目的,硅胶中的切口大于实际实验(C)与硅胶条(橙色)、圆形凝胶(中间切口)和将硅胶连接到拉伸装置的织物扩展器(绿色)的拉伸方法的示意图。凝胶的扩大区域表示凝胶的变形,以响应硅胶的单轴拉伸。为了简单起见,图中未显示凝胶(Z轴)厚度的压缩。 图 1B 和 1C 已改编自罗伊特布拉特里巴等人。 41请单击此处查看此图的较大版本。

图2:凝胶聚合前在密封膜层上正确放置硅胶条的例子。(A) 将两个密封膜层放置在一个10 厘米 的盘子中(B)放置在密封膜层(C)的密封膜层(C)底部视图上,显示硅胶层和密封膜层之间的密封空气。 左图:将密封膜层正确密封到切口周围的硅胶条上,无需气囊。 右图:密封膜层的密封不当,硅胶条切口,切口边缘周围有气囊。这将导致硅胶下方水凝胶组件泄漏。红色箭头指向形成气囊的区域。 请单击此处查看此图的较大版本。
3. 用细胞准备血栓
注意:只有在需要将细胞嵌入水凝胶中,并在生物罩(材料表)的无菌条件下,才能执行此步骤。
- 灭菌:在细胞实验前一天,将硅胶条和密封膜层置于70%乙醇中过夜,然后对每边进行30分钟的紫外线灭菌(如果10厘米的菜肴尚未灭菌,在洗完70%乙醇后,还应在紫外线下消毒30分钟)。协议中使用的紫外线系统是内置于生物罩中的紫外线系统。
注:或者,可以在硅胶条上执行高压灭菌周期(140 °C),因为它们对高达 260 °C 的抗药性。 - 进行细胞计数以确定细胞浓度,然后在 1.5 mL 离心管中用 7μL 的血栓(2 单位/mL)重新悬浮细胞颗粒。我们建议细胞浓度为800个细胞/μL的血栓。保持细胞冷却,直到使用(不超过半小时,以避免损坏细胞)。
4. 纤维蛋白凝胶的聚合
- 从冰箱中检索 2 个单位/mL 血栓 + 10 毫克/mL 标记纤维素溶液(在第 1 步中准备),并将它们放在冰上,以便访问。
注意:为了减缓聚合反应动力学,在混合过程之前,解决方案保持冷。这允许蛋白质更均匀的混合。 - 设置菜(第 2 步),提取 2.5μL 的标记纤维蛋白原和移液器,均匀地放入硅胶切口(密封膜层连接到底部),使切口的整个周长与纤维蛋白原接触。小心不要让任何气囊或气泡在溶液的任何地方形成,特别注意切口的底部边缘(密封膜层和硅胶之间的接口)。
- 立即将 2.5 μL 的血栓(有或没有细胞/珠子)和移液器直接放入切口中的纤维素溶液中(达到 5 μL 纤维蛋白的最终体积)。然后通过小心地上下吹管 10 次,快速混合两种解决方案。在混合过程中,在整个卷周围移动尖端,以创建尽可能均匀的解决方案。
- 沿每道菜的边缘添加少量磷酸盐缓冲盐水 (PBS) [替代细胞介质,用于细胞实验, 材料表] 以便水凝胶在聚合过程中不会干涸。确保 PBS/细胞介质与样品之间没有接触,因为这将损坏样品。
- 盖上盘子,放在37°C的孵化器中30分钟。
注:所需的孵化时间取决于凝胶的体积。如果使用更大的体积,孵化时间应增加。 - 从孵化器中取出碟子,并将 PBS/细胞介质添加到菜中,将整个凝胶硅结构浸入中。
- 小心地将样品一次从盘子中提起一个,确保密封膜层仍粘附在条带上。慢慢地将密封膜层从硅胶中分离,从硅胶的一端轻轻撒到另一端(图3)。避免从靠近切口的区域拉出,因为那里可能存在应力浓度(这对于非圆形几何学来说非常重要)。避免与切口有任何接触,因为它会损坏样品。
- 将条带放回盘子中,用 PBS/细胞介质将条状物漂浮在盘子中。然后将菜肴带到标准的细胞培养显微镜上,对每个样本的状况进行定性评估。凝胶必须是均匀的,在整个切口中是连续的,并且不应存在气泡。使用 图 4 作为指南,选择最佳样本进行进一步分析。

图3:正确去除硅胶条底部的密封膜层。去除过程应缓慢完成,以便水凝胶不会撕裂或破坏其附着力与切口的内壁。白色箭头显示移除方向。 请单击此处查看此图的较大版本。

图4:硅胶切口中纤维蛋白凝胶的微观观察。(A) 适当聚合纤维蛋白凝胶的两个例子。注意凝胶的相对均匀性以及切口边缘的完全粘附(B) 样品聚合失败的两个例子。 顶部:注意左下角形成的许多气泡和聚合物。 底部:注意从切口边缘和切口左下角区域的聚合物撕裂凝胶。比例栏 =300 μm 请单击此处查看此图的较大版本。
5. SCyUS 设备上的样品加载
- 将浴缸中填充 PBS/细胞介质(图 5),并将携带样品凝胶的硅胶条放在顶部,以便两端位于浴缸的每一侧。浴缸是为了避免凝胶干燥。将夹子(紫色)与织物条(绿色)一起放置并拧紧,以便所有部件都连接起来,形成一条直条,中间有切口(图 5)。
- 取回 SCyUS 设备并连接铝液井和 22 mm x 40 mm 矩形玻璃盖滑(第 1 号或 1.5 号)(图 6Aiii)。使用密封材料(如真空润滑脂)将盖滑附到井底,使井中可以充满液体,而不会泄漏。
- 用 +1-2 mL 的 PBS/细胞介质填充油井,并将条状面料 + 凝胶构造 (图 6B) 放入设备中。将织物条(2) 夹入支架(1),使切口 + 凝胶(5) 在中心(如图所示),然后小心地将针下插入(4)放入设备中并将其锁定到位。
- 接下来,将另一面织物插入主轴(不附加伺服器),并将其锁定在主轴(图6C)中。
- 将带有附件样本的 SCyUS 设备插入显微镜(图 6C)的阶段。通过 USB 电缆将微控制器 (材料表) 连接到计算机,并将伺服器连接到微控制器。打开计算机上的 SCyUS 控制模块。样品现已准备好成像,以检查凝胶厚度和纤维在共焦显微镜下的均质性是否足够。
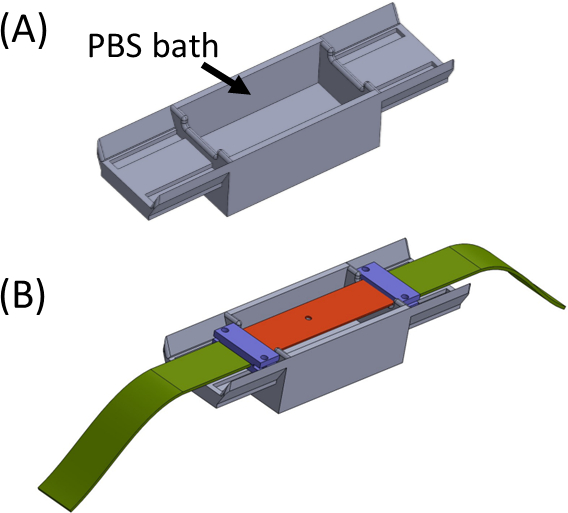
图 5:( A) 夹具包含 PBS 浴池 (3D 打印) (B) 夹具上的条形放置,以确保支架(紫色)的正确在线附件,并防止凝胶干燥。此图已在 Roitblat Riba 等人的许可下进行了修改。
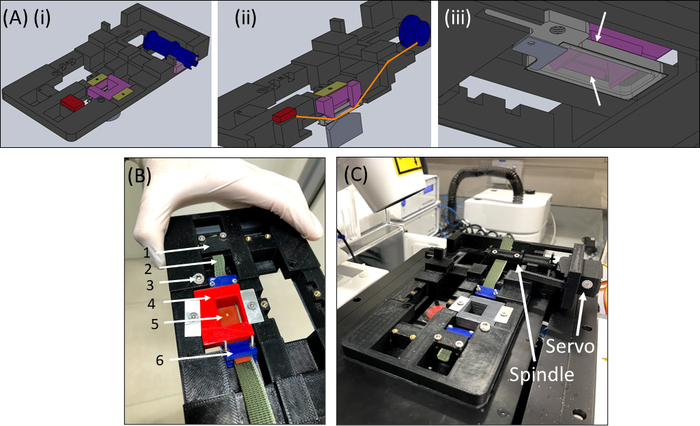
图6:SCyUS 拉伸设备。(A) SCyUS 主要部分的 CAD 模型的几种视图:连接到伺服(蓝色)、静态锚(红色)的主轴,插入将硅胶条向下(紫色)固定,以及防止插入物上升(黄绿色)的固定器。系统(Ai)的顶部视图,显示带状(橙色线)的切口视图,以及带玻璃盖唇的铝制液体井的底部视图(Aiii)。液体井可以上下移动,螺丝的转动安装到主螺纹中。铝井的向上运动受紫色插入侧翼的限制,如白色箭头(B) 实际系统所示:(1) 静态锚(2) 绿色非拉伸织物(3)螺丝铝液体井高度控制(4) 红色针下插入(5)带圆形切口的硅胶条(6) 蓝色连接夹(C)拉伸系统放置在对焦显微镜上。伺服器和主轴用箭头显示。此图已在 Roitblat Riba 等人的许可下进行了修改。
6. 确保有足够的凝胶进行采样
- 使用共焦显微镜 (材料表) 采取低放大 (10×), 低分辨率 (+1.4μm x 1.4μm 像素大小) 共焦 Z 堆栈 (≤10 Z 切片与步骤大小 大约 10μm 足够)使用 488/543/561 激光对整个凝胶的瓷砖图像进行检查,以检查硅胶厚度中几何切口周长的均匀性和粘连性(图 7A-B)。使用此 Z堆栈图像作为下列步骤的映射。
- 使用低分辨率的实时成像,扫描凝胶,确定切口内壁完全粘附在没有眼泪或气泡的 Z 位置的最低Z位置,并注意显微镜(Zl)的Z位置。要确定凝胶在整个周长内对硅胶的完全粘附,扫描凝胶的荧光标签和显微镜下的硅胶条(暗背景)的接口(图 7C)。
- 在Z方向向上移动,直到凝胶不再具有连续性,并注意Z-位置(Zu):
- 从下限减去 Z方向的上限(Zu)。这是样品的参考厚度(Zo):

如果Zo ≥ 100μm,则凝胶分析令人满意。 请注意,硅胶切口的厚度约为 500 μm,但切口中的凝胶聚合通常会导致凝胶厚度变小。100 μm 是建议的最小厚度,以确保稳定的拉伸过程,无需将凝胶从硅胶切口中分离出来。
注意:在不同的 XY 位置,凝胶的厚度可能有所不同。协议的这一部分测量凝胶的最小厚度,使我们能够确定凝胶质量并指示是否足以拉伸。此外,找到凝胶的中心为恢复拉伸后(无论是静态的还是动态的)提供了参考点。

图7:凝胶均匀性。使用共聚焦显微镜软件(材料表)(A) 捕获并缝合了薄纤维凝胶样品的单缝瓷砖Z片图像,由于血栓和纤维蛋白原混合预聚合不当,纤维密度相对不均匀。这种凝胶不会提供可靠的分析(B) 单缝瓷砖Z切片图像的纤维凝胶样品具有相对均匀的纤维密度。这是一种可接受的伸展实验凝胶。图像 A & B 的缩放条是 200μm(C) 放大荧光标记凝胶(红色)和硅胶(黑色背景)之间的界面。 比例杆 = 100 μm。请单击此处查看此图的较大版本。
7. SCyUS 操作、拉伸和成像
- 现在,样品已确定质量令人满意,并正确设置在 SCyUS 设备上,确定样品的预拉伸位置。这是通过在共焦显微镜下使用 实时 成像(类似于步骤 6.2)实现的。
- 通过单击"去零伺服姿势"按钮(单击图 8A 并确保图 8B显示为零),并确保伺服器处于零位置,并将其连接到图 6C中看到的拉伸设备上。
注意:缓慢而小心地做这一步,不要在样品上放上任何过度的张力。 - 在成像样品时,通过单击+1按钮,一次移动电机一度 (图 8C),直到观察到切口的右侧移动。然后,通过单击-1按钮将运动(图8D)倒回倒数第二步位置。这验证了样品处于最小的张力下。单击设置最小伺服位置按钮 (图 8E)以设置参考位置。点击"去最小伺服位置"按钮(图 8F),随时可以返回参考位置。
注意:建议使用高放大目标(≥40×)来减少错误。 - 捕获高放大(40×)、高分辨率(+0.2 μm × 0.2 μm 像素大小)、整个凝胶区域的单 Z 片瓷砖图像。这将用作后期处理分析的参考图像。建议在凝胶厚度中间捕获单个Z切片图像(通过使用Eq. 1中的Zo),这样在拉伸后即可返回到大致相同的Z位置。此外,考虑到整个凝胶区域的高分辨率瓷砖图像需要相当长的时间(+20-30分钟)。
- 现在样品已准备好静态拉伸。通过在GUI中一次推进一度(图8C)来将伺服运动器调整到所需的拉伸幅度(缓慢地执行此,大约1度/秒)。
- 通过单击"去零伺服姿势"按钮(单击图 8A 并确保图 8B显示为零),并确保伺服器处于零位置,并将其连接到图 6C中看到的拉伸设备上。
- 在需要分析的每个拉伸幅度中,捕获整个凝胶区域的单个 Z 片高分辨率磁贴图像,用于后期处理分析。与步骤 6.2 类似,通过扫描凝胶(红色)和硅胶(深色背景)之间的界面,验证凝胶在整个周长内没有与硅胶分离,以查找粘附度与上一个拉伸幅度的变化。
注意:在电机激活期间,使用实时成像技术跟踪X-Y中的凝胶位置(具有低分辨率、低放大度设置)。凝胶在凝胶底部上升时会产生Z-Poisson效应,因此显微镜的Z位置也应调整到凝胶厚度的近似中心,以达到每个拉伸幅度。这可以通过重新计算 Z o (Eq. 1)来实现。由于Z方向的拉伸相对均匀,因此找到凝胶的确切中心深度并不关键。
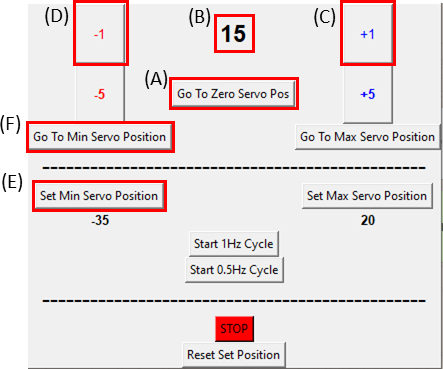
图8:SCyUS控制模块的GUI。(A) 电机在度上的位置。值范围从 -90° 到 90°(B) "设置最低伺服位置"。此按钮允许预先设置的最低位置,用于设置与零伺服位置(C)不同的新参考位置(C)"Plus 1°"按钮,使伺服电机顺时针移动一度(D) "减去 1°"按钮移动伺服电机一度 逆时针(E) "去零位置" 按钮将伺服器位置设置为 0° ([A] 将设置为零)(F)[转到最低伺服位置] 按钮将伺服器移动到用户定义的"Min"位置。请单击此处查看此图的较大版本。
8. 处理后外部应变测量
- 要测量切口边界的有效应变,测量Y轴中心拉伸方向(X轴) 的边缘到边缘长度 (图 9A)。
- 将预拉伸图像上传到图像处理软件 (ImageJ FIJI43),并测量中心最大边缘到边缘距离,该距离定义为孔 () 的轴向长度
 。
。 - 将从上到下的最大距离定义为垂直距离(
 )。
)。 - 重复此过程以查看所有拉伸间隔图像,并计算
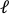
 切口外围的轴向 () 和垂直 ()距离 (图 9A,底部),然后执行以下计算以查找切口边缘的应变:
切口外围的轴向 () 和垂直 ()距离 (图 9A,底部),然后执行以下计算以查找切口边缘的应变:
- 将预拉伸图像上传到图像处理软件 (ImageJ FIJI43),并测量中心最大边缘到边缘距离,该距离定义为孔 () 的轴向长度
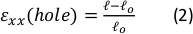

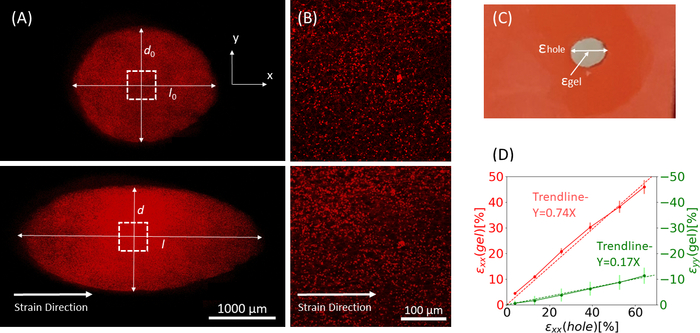
图9:由于硅胶条的外部拉伸,凝胶应变。(A) 未拉伸纤维蛋白凝胶(顶部)的X-Y横截面,在应用ε孔后 = 沿 x 方向 (底部) 应变 64%。凝胶嵌入荧光珠。用于计算ε孔的d和l的相关长度在 A(C)中标记的虚张声幅的图像中表示:ε孔是最大直径的切口的轴向应变, ε凝胶是凝胶中心的轴向应变(按珠子聚合位置测量)(D)在xx方向 (红线) 和yy方向 (绿线) 中发现ε孔和ε凝胶之间的线性关系。此图已在 Roitblat Riba 等人的许可下进行调整。
9. 纤维定向分析
- 使用纤维对齐的定量来描述纤维凝胶对拉伸量增加的结构反应。将高分辨率图像上传到 ImageJ FIJI 软件 (NIH)43, 然后使用定向J (EPFL)44 模块(设置:高斯梯度和 3 像素窗口( 图 10)进行分析。
- 计算定向直方图的 2D 内序参数 (NOP) 为:45
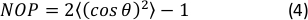
注:NOP =1值表示沿轴向(角零)的完美对齐,而NOP =0表示等位。定向角度 ,θ,是光纤角度相对于通过图像分析获得的应变轴(x轴),并在定向J文档中精确定义。44
- 计算定向直方图的 2D 内序参数 (NOP) 为:45

图10:使用FIJI图像J软件进行光纤定向分析。(A) 图像J主菜单,箭头指示"插件"下拉菜单的位置,其中可以找到"定向J"。在"定向J"的扩展菜单下,单击"定向J分布"选项(B)定向J 的分发模块。将"本地窗口σ"设置为 3 像素,将"渐变"设置为"高斯"。然后按下"运行"按钮(红色箭头)。 请单击此处查看此图的较大版本。
10. 手动内部凝胶应变分析
- 在使用嵌入珠子对水凝胶进行实时高放大成像时,手动定位具有易于识别的特征(如珠子聚合)的兴趣区域(ROI),以便在每次拉伸量级后返回到同一位置。
注意:Z方向(波松效应)的压缩会导致珠子密度随着拉伸的增加而增加,因此我们建议选择足够大的珠子聚合物,以便它们清晰可识别。该协议要求分析纤维蛋白凝胶的中心区域,尽管可以选择任何区域。 - 在拉伸前位置(第 6 步),捕获所选投资回报率的高分辨率 Z堆栈图像。在每个所需的拉伸间隔后,返回到相同的投资回报率并重复图像捕获过程。
- 将图像导入图像J。在投资回报率中,记录每个可见珠子聚合物的 X-Y 像素位置。将记录的数据传输到电子表格。
- 测量每对聚合物之间的距离,并将它们与参考图像中同一对的距离进行比较,从而计算 X 和 Y 方向中的应变。
注意:如果在凝胶拉伸(而不是静态图像捕获)时录制连续实时电影,则可以采用数字图像或体积相关性 (DIC/DVC) 方法自动分析应变,如先前所示46,47。然而,应该指出的是,自动DIC/DVC分析是具有挑战性的,在这个设置中,因为Z-堆栈不仅在X-Y平面上移动,而且在Z方向由于泊松效应(压缩),占了在录制电影期间相当大的漂移。
Access restricted. Please log in or start a trial to view this content.
结果
图9显示了用于硅胶条的静态增量拉伸数据,该条带有3D纤维蛋白水凝胶,内嵌1μm荧光珠。分析表明硅胶拉伸对切口的几何变化以及凝胶中发达菌株的影响。整个凝胶的Z 堆栈图像用于评估原始圆形切口到椭圆几何形状的变形 (图 9A)。这些图像用于计算ε xx(孔) (方程 2)。在凝胶拉伸过程中放大并手动跟踪...
Access restricted. Please log in or start a trial to view this content.
讨论
本文介绍的方法和协议主要基于我们之前由罗伊特布拉特·里巴等人进行的研究。
与现有方法相比,该方法的主要优点包括有可能从其周长中拉紧非常柔软的 3D 水凝胶(弹性 Modulus +100 Pa),并在 实时 对焦成像下进行。其他方法通常限制其在 Z轴中应用应变场的能力,并且无法在拉伸时提供原位高放大显微镜图像,这主要是由于从样品?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
此处包含的一些数字经版权许可中心许可已修改:斯普林格自然, 生物医学工程年鉴。用均匀的 z 轴菌株应变 3D 水凝胶,同时实现实时显微镜成像,A. Roitblat Riba,S. 纳坦,A. 科莱尔,H. 拉什金,O. 柴切扬,A. 莱斯曼,版权所有© (2019)。
https://doi.org/10.1007/s10439-019-02426-7
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 546 carboxylic acid, succinimidyl ester | Invitrogen | A20002 | |
| Cell Medium (DMEM High Glucose) | Biological Industries | 01-052-1A | Add 10% FBS, 1% PNS, 1% L-Glutamine, 1% Sodium Pyruvate |
| Cover Slip #1.5 | Bar-Naor Ltd. | BN72204-30 | 22×40 mm |
| DIMETHYL SULPHOXIDE 99.5% GC DMSO | Sigma-Aldrich Inc. | D-5879-500 ML | |
| Dulbecco's Phosphate-Buffered Saline | Biological Industries | 02-023-1A | |
| EVICEL Fibrin Sealant (Human) | Omrix Biopharmaceuticals | 3902 | Fibrinogen: 70 mg/mL, Thrombin: 800-1200 IU/mL |
| Fibrinogen Buffer | N/A | Recipe for 1L: 7g NaCl, 2.94g trisodium citrate dihydrate, 9g glycine, 20g arginine hydrochloride & 0.15g calcium chloride dihydrate. Bring final volume to 1L with PuW (pH 7.0-7.2) | |
| Fluorescent micro-beads FluoSpheres (1 µm) | Invitrogen | F8820 | Orange (540/560) Provided as suspension (2% solids) in water plus 2 mM sodium azide |
| High-Temperature Silicone Rubber | McMaster-Carr | 3788T41 | 580 µm-thick E = 1.5 Mpa Poisson Ratio = 0.48 Tensile Strength = 4.8 MPa Upper limit of stretch = +300% engineering strain |
| HiTrap desalting column 5 mL (Sephadex G-25 packed) | GE Healthcare | 17-1408-01 | |
| HIVAC-G High Vacuum Sealing Compound | Shin-Etsu Chemical Co., Ltd. | HIVAC-G 100 | |
| ImageJ FIJI software39 | National Institute of Health, Bethesda, MD | Version 1.8.0_112 | |
| Microcontroller (Adruino Uno + Adafruit Motorshield v2.3) | Arduino/Adafruit | Arduino-DK001/Adafruit-1438 | |
| MicroVL 21R Centrifuge | Thermo Scientific | 75002470 | |
| Parafilm | Bemis | PM-996 | |
| Primovert Light Microscope | Carl Zeiss Suzhou Co., Ltd. | 491206-0011-000 | |
| SCyUS CAD (Solidworks) | Dassault Systèmes | N/A | |
| SCyUS Code37 | N/A | N/A | |
| Servomotor - TowerPro SG-5010 | Adafruit | 155 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | For 50 mL tubes |
| Sterile 10 cm non-culture plates | Corning | 430167 | |
| Thrombin buffer | N/A | Recipe for 1L: 20g mannitol, 8.77g NaCl, 2.72g sodium acetate trihydrate, 24 mL 25% Human Serum Albumin, 5.88g calcium chloride. Bring final volume to 1L with PuW (pH 7.0) | |
| Trypsin EDTA Solution B (0.25%), EDTA (0.05%) | Biological Industries | 03-052-1B | |
| USB Cable (Type B Male to Type A Male) | N/A | N/A | |
| Zeiss LSM 880 Confocal Microscope | Carl Zeiss AG | 2811000417 | |
| ZEN 2.3 SP1 FP3 (black) | Carl Zeiss AG | Release Version 14.0.0.0 |
参考文献
- Bleuel, J., Zaucke, V., Bruggemann, G. P., Niehoff, A. Effects of cyclic tensile strain on chondrocyte metabolism: a systematic review. PLoS ONE. 10, 0119816(2015).
- Pennisi, C. P., Olesen, C. G., de Zee, M., Rasmussen, J., Zachar, V. Uniaxial cyclic strain drives assembly and differentiation of skeletal myocytes. Tissue Engineering Part A. 17, 2543-2550 (2011).
- Grodzinsky, A. J., Levenston, M. E., Jin, M., Frank, E. H. Cartilage Tissue Remodeling in Response to Mechanical Forces. Annual Review of Biomedical Engineering. 2 (1), 691-713 (2000).
- Munster, S., et al. Strain history dependence of the nonlinear stress response of fibrin and collagen networks. Proceedings of the National Academy of Sciences of the USA. 110, 12197-12202 (2013).
- Vader, D., Kabla, A., Weitz, D., Mahadevan, L. Strain-induced alignment in collagen gels. PLoS ONE. 4, 5902(2009).
- Badylak, S. F. The extracellular matrix as a scaffold for tissue reconstruction. Seminars in Cell & Developmental Biology. 13 (5), 377-383 (2002).
- Natan, S., Koren, Y., Shelah, O., Goren, S., Lesman, A. Molecular Biology of the Cell. 31 (14), 1474-1485 (2020).
- Ban, E., et al. Mechanisms of Plastic Deformation in Collagen Networks Induced by Cellular Forces. Biophysical Journal. 114 (2), 450-461 (2018).
- Kim, J., et al. Stress-induced plasticity of dynamic collagen networks. Nature Communications. 8, 842(2017).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Basu, A., Janmey, P. A., Yodh, A. G. Non-affine deformations in polymer hydrogels. Soft Matter. 8, 8039-8049 (2012).
- Muiznieks, L. D., Keeley, F. W. Molecular assembly and mechanical properties of the extracellular matrix: A fibrous protein perspective. Biochimica et Biophysica Acta. 1832, 866-875 (2012).
- Brown, A. E. X., Litvinov, R. I., Discher, D. E., Purohit, P. K., Weisel, J. W. Multiscale mechanics of fibrin polymer: gel stretching with protein unfolding and loss of water. Science. 325, 741-744 (2009).
- Carroll, S. F., Buckley, C. T., Kelly, D. J. Cyclic tensile strain can play a role in directing both intramembranous and endochondral ossification of mesenchymal stem cells. Frontiers in Bioengineering and Biotechnology. 5, 73(2017).
- Livne, A., Bouchbinder, E., Geiger, B. Cell reorientation under cyclic stretching. Nature Communications. 5, 3938(2014).
- Wang, L., et al. Patterning cellular alignment through stretching hydrogels with programmable strain gradients. ACS Applied Materials & Interfaces. 7, 15088-15097 (2015).
- Xu, G. K., Feng, X. Q., Gao, H. Orientations of Cells on Compliant Substrates under Biaxial Stretches: A Theoretical Study. Biophysical Journal. 114 (3), 701-710 (2017).
- Chagnon-Lessard, S., Jean-Ruel, H., Godin, M., Pelling, A. E. Cellular orientation is guided by strain gradients. Integrative Biology (United Kingdom). 9 (7), 607-618 (2013).
- Lu, J., et al. Cell orientation gradients on an inverse opal substrate. ACS Applied Materials & Interfaces. 7 (19), 10091-10095 (2015).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125, 3015-3024 (2012).
- Bono, N., et al. Unraveling the role of mechanical stimulation on smooth muscle cells: a comparative study between 2D and 3D models. Biotechnology and Bioengineering. 113, 2254-2263 (2016).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8, 839-845 (2007).
- Riehl, B. D., Park, J. H., Kwon, I. K., Lim, J. Y. Mechanical stretching for tissue engineering: two-dimensional and three-dimensional constructs. Tissue Engineering Part B: Reviews. 18, 288-300 (2012).
- Flexcell. Linear Tissue Train Culture Plate. Flexcell. , (2019).
- Flexcell. Tissue Train. Flexcell. , (2019).
- CellScale. MCT6 Stretcher. CellScale. , (2019).
- STREX. STB-150. STREX. , (2019).
- STREX. Stretch Chambers. STREX. , (2019).
- Kamble, H., Barton, M. J., Jun, M., Park, S., Nguyen, N. T. Cell stretching devices as research tools: engineering and biological considerations. Lab on a Chip. 16, 3193-3203 (2016).
- Weidenhamer, N. K., Tranquillo, R. T. Influence of cyclic mechanical stretch and tissue constraints on cellular and collagen alignment in fibroblast-derived cell sheets. Tissue Engineering Part C: Methods. 19, 386-395 (2013).
- Yung, Y. C., Vandenburgh, H., Mooney, D. J. Cellular strain assessment tool (CSAT): precision-controlled cyclic uniaxial tensile loading. Journal of Biomechanics. 42, 178-182 (2009).
- Chen, K., et al. Role of boundary conditions in determining cell alignment in response to stretch. Proceedings of the National Academy of Sciences of the USA. 115, 986-991 (2018).
- Heher, P., et al. A novel bioreactor for the generation of highly aligned 3D skeletal muscle-like constructs through orientation of fibrin via application of static strain. Acta Biomaterialia. 24, 251-265 (2015).
- Foolen, J., Deshpande, V. S., Kanters, F. M. W., Baaijens, F. P. T. The influence of matrix integrity on stress-fiber remodeling in 3D. Biomaterials. 33, 7508-7518 (2012).
- Walker, M., Godin, M., Pelling, A. E. A vacuum-actuated microtissue stretcher for long-term exposure to oscillatory strain within a 3D matrix. Biomedical Microdevices. 20, 43(2018).
- Zhao, R. G., Boudou, T., Wang, W. G., Chen, C. S., Reich, D. H. Decoupling cell and matrix mechanics in engineered microtissues using magnetically actuated microcantilevers. Advanced Materials. 25, 1699-1705 (2013).
- Li, Y. H., et al. Magnetically actuated cell-laden micro-scale hydrogels for probing strain-induced cell responses in three dimensions. NPG Asia Materials. 8, 238(2016).
- Li, Y. H., et al. An approach to quantifying 3D responses of cells to extreme strain. Scientific Reports. 6, 19550(2016).
- Humphrey, J. D., et al. A theoretically-motivated biaxial tissue culture system with intravital microscopy. Biomechanics and Modeling in Mechanobiology. 7, 323-334 (2008).
- Niklason, L. E., et al. Enabling tools for engineering collagenous tissues integrating bioreactors, intravital imaging, and biomechanical modeling. Proceedings of the National Academy of Sciences of the USA. 107, 3335-3339 (2010).
- Roitblat Riba, A., et al. Straining 3D hydrogels with uniform z-axis strains while enabling live microscopy imaging. Annals of Biomedical Engineering. , (2019).
- Gomez, D., Natan, S., Shokef, Y., Lesman, A. Mechanical interaction between cells facilitates molecular transport. Advanced Biosystems. 3 (12), 1900192(2019).
- Schindelin, J., et al. Fiji: an open- source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- EPFL Switzerland. OrientationJ plug in. EPFL Switzerland. , (2019).
- Goren, S., Koren, Y., Xu, X., Lesman, A. Elastic anisotropy governs the decay of cell-induced displacements. Biophysical Journal. 118 (5), 1152-1164 (2019).
- Notbohm, J., Lesman, A., Tirrell, D. A., Ravichandran, G. Quantifying cell-induced matrix deformation in three dimensions based on imaging matrix fibers. Integrative Biology. 7 (10), 1186-1195 (2015).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. Journal of Cell Biology. 205 (2), 155-162 (2014).
- Cha, C. Y., et al. Tailoring Hydrogel Adhesion to Polydimethylsiloxane Substrates Using Polysaccharide Glue. Angewandte Chemie International Edition. 52, 6949-6952 (2019).
- Wirthl, D., et al. Instant tough bonding of hydrogels for soft machines and electronics. Science Advances. 3, (2017).
- Juarez-Moreno, J. A., Avila-Ortega, A., Oliva, A. I., Aviles, F., Cauich-Rodriguez, J. V. Effect of wettability and surface roughness on the adhesion properties of collagen on PDMS films treated by capacitively coupled oxygen plasma. Applied Surface Science. 349, 763-773 (2015).
- Kim, H. T., Jeong, O. C. PDMS surface modification using atmospheric pressure plasma. Microelectronic Engineering. 88, 2281-2285 (2011).
- Prasad, B. R., et al. Controlling cellular activity by manipulating silicone surface roughness. Colloids and Surfaces. 78, 237-242 (2010).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。