É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Tensão controlada de hidrogéis 3D sob imagem de microscopia ao vivo
Neste Artigo
Resumo
O método apresentado envolve alongamento uniaxial de hidrogéis macios 3D embutidos na borracha de silicone, permitindo microscopia confocal ao vivo. Demonstra-se a caracterização das cepas de hidrogel externos e internos, bem como o alinhamento de fibras. O dispositivo e o protocolo desenvolvidos podem avaliar a resposta das células a vários regimes de tensão.
Resumo
As forças externas são um fator importante na formação, desenvolvimento e manutenção de tecidos. Os efeitos dessas forças são frequentemente estudados usando métodos especializados de alongamento in vitro. Vários sistemas disponíveis usam macas à base de substrato 2D, enquanto a acessibilidade de técnicas 3D para coar hidrogéis macios, é mais restrita. Aqui, descrevemos um método que permite alongamento externo de hidrogéis macios a partir de sua circunferência, usando uma tira de silicone elástica como portador da amostra. O sistema de alongamento utilizado neste protocolo é construído a partir de peças impressas em 3D e eletrônicos de baixo custo, tornando-o simples e fácil de replicar em outros laboratórios. O processo experimental começa com hidrogéis de fibrina macia polimerizador (>100 μm) (Elastic Modulus de ~100 Pa) em um recorte no centro de uma tira de silicone. As construções de gel de silicone são então anexadas ao dispositivo de alongamento impresso e colocadas no estágio do microscópio confocal. Sob microscopia ao vivo, o dispositivo de alongamento é ativado, e os géis são imageados em várias magnitudes de estiramento. O processamento de imagem é então usado para quantificar as deformações de gel resultantes, demonstrando cepas relativamente homogêneas e alinhamento de fibras ao longo da espessura 3D do gel (eixoZ). As vantagens deste método incluem a capacidade de coar hidrogéis extremamente macios em 3D durante a execução da microscopia in situ, e a liberdade de manipular a geometria e o tamanho da amostra de acordo com as necessidades do usuário. Além disso, com a devida adaptação, este método pode ser usado para esticar outros tipos de hidrogéis (por exemplo, colágeno, poliacrilamida ou polietileno glicol) e pode permitir a análise de células e resposta tecidual a forças externas em condições 3D mais biomiméticas.
Introdução
A resposta tecidual às forças mecânicas é parte integrante de uma ampla gama de funções biológicas, incluindo expressão genética1,diferenciação celular2e remodelação tecidual3. Além disso, alterações induzidas por força na matriz extracelular (ECM), como alinhamento de fibras e adensamento, podem impactar o comportamento celular e a formação tecidual4,5,6. A estrutura de malha fibrosa do ECM possui propriedades mecânicas intrigantes, como elasticidade não linear, deformação não afine e deformações plásticas7,8,9,10,11,12. Essas propriedades impactam como as células e seu microambiente circundante respondem às forças mecânicas externas13,14. Entender como o ECM e os tecidos respondem às forças mecânicas permitirá o progresso no campo da engenharia de tecidos e no desenvolvimento de modelos computacionais e teóricos mais precisos.
Os métodos mais comuns para esticar amostras mecanicamente se concentraram em substratos 2D carregados de células para explorar os efeitos no comportamento celular. Estes incluem, por exemplo, a aplicação de cepa a substratos de polidimetilatilaxano (PDMS) e análise de ângulos de reorientação celular em relação à direção de estiramento15,16,17,18,19. No entanto, os métodos que investigam a resposta de hidrogéis embutidos em células 3D ao trecho externo, uma situação que imita mais de perto o microambiente tecidual, são mais limitados. Os avanços em direção aos métodos de alongamento 3D são de particular importância porque as células se comportam de forma diferente em substratos 2D quando comparadas às matrizes 3D20. Esses comportamentos incluem realinhamento celular, níveis de expressão proteica e padrões de migração21,22,23.
Os métodos e dispositivos que permitem o alongamento da amostra 3D incluem ambos comercialmente disponíveis24,25,26,27,28 e aqueles desenvolvidos para pesquisa laboratorial29. Estes métodos utilizam tubos de silicone distensíveis30,câmaras multi-poço31,grampos26,32, bioreatores11,33, cantilevers34,35,36, e ímãs37,38. Algumas técnicas geram trecho que deforma localmente hidrogéis 3D, por exemplo, puxando agulhas de dois pontos únicos no gel5,enquanto outras permitem a deformação de toda a maior parte do gel16. Além disso, a maioria desses sistemas se concentra na análise do campo de tensão no plano X-Y, com informações limitadas sobre o campo de tensão na direção Z. Além disso, apenas um punhado desses dispositivos são capazes de imagens microscópicas in situ. O principal desafio com imagens de alta ampliação in situ (por exemplo, microscópio confocal) é a distância de trabalho limitada de algumas centenas de mícrons da lente objetiva para a amostra. Dispositivos que permitem imagens vivas durante o sacrifício de estiramento a uniformidade da tensão no eixo Zou são relativamente complexos e difíceis de reproduzir em outros laboratórios39,40.
Esta abordagem para esticar hidrogéis 3D permite a tensão uniaxial estática ou cíclica durante a microscopia confocal ao vivo. O dispositivo de alongamento (conhecido como 'Smart Cyclic Uniaxial Stretcher – SCyUS') é construído usando peças impressas em 3D e hardware de baixo custo, permitindo fácil reprodução em outros laboratórios. Anexado ao dispositivo está uma borracha de silicone comercialmente disponível com um recorte geométrico em seu centro. Os componentes do hidrogel são polimerizados para preencher o recorte. Durante a polimerização, hidrogéis biológicos, como fibrina ou colágeno, naturalmente aderem às paredes internas do recorte. Usando o SCyUS, a tira de silicone é esticada não axisiomente, transferindo cepas controladas para o hidrogel 3D incorporado41.
Este sistema permite uma combinação única de recursos e vantagens em comparação com outros métodos existentes. Primeiro, o sistema permite alongamento uniaxial de hidrogéis macios 3D espessos (> 100 μm de espessura, <1 kPa rigidez) de sua periferia, com deformação Z-homogênea em todo o hidrogel. Estes hidrogéis são muito macios para serem agarrados e esticados por técnicas convencionais de tração. Em segundo lugar, o dispositivo de alongamento pode ser facilmente replicado em outros laboratórios, uma vez que a impressão 3D está prontamente disponível para os pesquisadores e os eletrônicos usados no design são de baixo custo. Em terceiro lugar, e talvez a característica mais atraente, a geometria e o tamanho do recorte na tira de silicone podem ser facilmente manipulados, permitindo gradientes de tensão e condições de limite, bem como o uso de uma variedade de volumes de amostra, até alguns microliters.
O protocolo apresentado consiste em moldar gel de fibrina em discos de ~2 mm de diâmetro em tiras de borracha de silicone de 0,5 mm de espessura procedidas por estiramento uniaxial sob microscopia confocal ao vivo. O seguinte discute detalhadamente os procedimentos experimentais para medição e análise das cepas que atuam no recorte geométrico, as cepas internas desenvolvidas no hidrogel, bem como o alinhamento de fibras resultante após várias manipulações de estiramento. Por fim, discute-se a possibilidade de incorporar células no hidrogel e expô-las a trechos externos controlados.
Protocolo
1. Preparação da solução (a ser realizada com antecedência)
- Rotulagem fibrinogênio
NOTA: A etapa de rotulagem só é necessária se a análise da deformação do gel de fibrina for desejada. Para experimentos celulares, é possível usar um gel sem rótulo.- Adicione 38 μL de 10 mg/mL de corante fluorescente de éster succinimidil (dissolvido em DMSO) a 1,5 mL de solução fibrinogênio de 15 mg/mL (razão molar de 5:1) em um tubo centrífuga de 50 mL e coloque em um agitador por 1 hora à temperatura ambiente. Depois, coloque o tubo na centrífuga por 3 minutos a 800 x g (temperatura ambiente).
- Filtre o supernatante da etapa anterior através de uma coluna de desalagem embalada com resina de gel dextran(Tabela de Materiais)para separar o corante não redigido,42 seguindo estas etapas.
- Pré-lave a coluna com 25 mL de tampão fibrinogênico.
- Injete lentamente o fibrinogênio rotulado da etapa 1.1.1 na coluna, certificando-se de que não há bolhas entrando no filtro. Descarte o primeiro ~0,3 mL de solução elucidada (4-6 gotas de líquido colorido fraco). Em seguida, colete os seguintes 1,0-1,5 mL de solução purificada (siga o protocolo do fabricante para obter detalhes mais específicos).
- Finalize o processo de filtragem esterilizando a solução purificada resultante usando um filtro acionado por seringa (0,22-0,45 μm).
- Para limpar e reciclar a coluna, lave com 20 mL de tampão fibrinogênio e, em seguida, armazene em 25 mL de 20% de etanol.
- Após a elução, divida o fibrinogênio rotulado purificado resultante em pequenas alíquotas de ~7-50 μL, dependendo do número desejado de géis esticados. Para cada gel de círculo de 2 mm de diâmetro esticado, prepare cerca de 3,5 μL de fibrinogênio (2,5 μL será usado por gel + 1 μL para erros de pipetação).
- Guarde as alíquotas em um congelador de -20 °C. Eles podem ser usados até cerca de um ano (não é recomendado descongelar e congelar novamente).
- Para o restante deste protocolo, mantenha aproximadamente 7 μL do fibrinogênio rotulado purificado na geladeira (4 °C) até o passo 4. Este volume destina-se à criação de dois géis esticados (2,5 μL é necessário por gel, e um volume extra de 1 μL é usado para explicar erros na preparação da amostra).
NOTA: Este procedimento de filtragem normalmente dilui a solução fibrinogênio inicial de 15 mg/mL para uma concentração final de cerca de 10 mg/mL. O fator de diluição depende do volume inicial e concentração de fibrinogênio, conforme especificado no protocolo do fabricante.
- Prepare 7 μL de solução de trombina (diluir usando tampão de trombina para 2 unidades/mL, Tabela de Materiais) e mantenha na geladeira (4 °C) até o passo 4. Este volume destina-se a preencher os recortes de dois géis esticados.
NOTA: Para realizar a análise interna da tensão, as contas esféricas fluorescentes de 1 μm de diâmetro (compradas como suspensão [2% de sólidos] em água mais 2 mM NaN3) devem ser adicionadas à solução de trombina (uma razão de 1:25 v/v % de contas:trombbina é recomendada para um objetivo de 40x). As contas só devem ser incluídas quando forem desejadas medidas internas de tensão, seja na presença ou ausência de células.
2. Preparação de tiras de silicone
- Recupere a borracha de silicone de 0,5 mm de espessura e corte-a em tiras de 15 x 80 mm2 com um orifício de 2 mm de diâmetro no centro da tira(Figura 1). Se possível, use um cortador de laser programável para alta precisão. Se o maquinário programável não estiver disponível, a tesoura é suficiente para cortar o contorno da tira e um pequeno furo é adequado para o recorte central.
NOTA: A borracha de silicone comercial geralmente é comprada com plástico em ambos os lados. Mantenha a cobertura de plástico original em ambos os lados do silicone, se possível. Se reutilizar tiras de silicone de um experimento anterior, trate-as com trippsina por 0,5 hora, mergulhe em 0,2 M NaOH por 0,5 hora e, em seguida, mergulhe em 70% de etanol por 1 hora. Deixe-os secar antes de usar. - Prepare camadas de filme de vedação (hidrofóbica) com dimensões de pelo menos 20 × 30 mm2,para que sejam mais largas que a tira de silicone e, assim, permitindo que uma vedação se forme sobre todo o recorte geométrico.
- Lave um prato de 10 cm com 70% de etanol e, em seguida, limpe e seque com lenços de tarefa delicados não-linting (tanto para experimentos estéreis quanto não estéreis). Esta etapa é importante, pois permite que as camadas de filme de vedação se ater melhor à placa e restringir o movimento da amostra durante o processo de preparação.
- Coloque as camadas de filme de vedação no prato lavado de 10 cm para que haja espaço suficiente para colocar duas tiras em cada prato lado a lado(Figura 2A).
- Remova o plástico de um lado da tira de silicone e coloque o lado exposto na camada de filme de vedação para que o recorte seja cercado inteiramente pela camada de filme de vedação(Figura 2B). Em seguida, pressione suavemente o silicone contra a camada de filme de vedação, a fim de selar a área ao redor do recorte, usando dedos de luvas limpos.
NOTA: Certifique-se de que não há bolsas de ar entre o silicone e o filme de vedação, especialmente em torno do recorte. Faça isso examinando o lado inferior do prato(Figura 2C).
- Remova o plástico de um lado da tira de silicone e coloque o lado exposto na camada de filme de vedação para que o recorte seja cercado inteiramente pela camada de filme de vedação(Figura 2B). Em seguida, pressione suavemente o silicone contra a camada de filme de vedação, a fim de selar a área ao redor do recorte, usando dedos de luvas limpos.
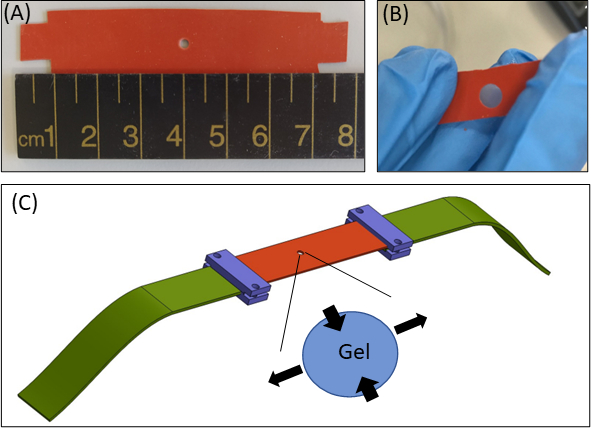
Figura 1: Abordagem de tensão de hidrogel. (A) 15 × tira de silicone de 80 mm2 com um recorte de 2 mm de diâmetro no centro da tira (B) Uma tira de silicone com um recorte circular com gel de fibrina embutido. Para fins ilustrativos, o recorte no silicone é maior do que nos experimentos reais (C) Esquema da abordagem de alongamento com a tira de silicone (laranja), gel circular (recortado no meio) e extensores de tecido (verde) que conectam o silicone ao dispositivo de alongamento. A área ampliada do gel indica a deformação do gel, em resposta ao alongamento uniaxial do silicone. Para simplificar, a compressão ao longo da espessura do gel (eixoZ)não é mostrada na ilustração. Figuras 1B & 1C foram adaptadas de Roitblat Riba et al.41Clique aqui para ver uma versão maior desta figura.

Figura 2: Exemplo de colocação adequada de uma tira de silicone em uma camada de filme de vedação antes da polimerização do gel. (A) Colocação de duas camadas de filme de vedação em um prato de 10 cm (B) Colocação de tiras de silicone nas camadas de filme de vedação(C) Vista inferior do prato, exibindo o selo de ar entre o silicone e a camada de filme de vedação. Esquerda: Vedação adequada da camada de filme de vedação para a tira de silicone ao redor do recorte sem bolsas de ar. Direito: Vedação inadequada da camada de filme de vedação para o recorte da tira de silicone com bolsas de ar ao redor da borda do recorte. Isso levará ao vazamento dos componentes do hidrogel sob o silicone. A flecha vermelha aponta para uma área onde um bolsão de ar foi formado. Clique aqui para ver uma versão maior desta figura.
3. Preparando trombina com células
NOTA: Realize esta etapa somente se desejar a incorporação de células no hidrogel, e em condições estéreis em uma capa biológica(Tabela de Materiais).
- Esterilização: um dia antes do experimento celular, coloque as tiras de silicone e selamento de camadas de filme em 70% de etanol durante a noite e, em seguida, realize a esterilização UV por 30 minutos de cada lado (se os pratos de 10 cm ainda não estiverem estéreis, eles também devem ser esterilizados sob luz UV por 30 minutos após uma lavagem de 70% de etanol). O sistema UV utilizado no protocolo é aquele embutido no capô biológico.
NOTA: Alternativamente, um ciclo de esterilização autoclave (140 °C) pode ser realizado nas tiras de silicone, uma vez que são resistentes a até 260 °C. - Realize uma contagem de células para determinar a concentração celular e, em seguida, centrífuga e suspenda novamente a pelota celular com 7 μL de trombina (2 unidades/mL) em um tubo de centrífuga de 1,5 mL. Recomendamos uma concentração celular de 800 células/μL de trombina. Mantenha as células refrigeradas até o uso (não exceda mais de meia hora para evitar danificar as células).
4. Polimerização de géis de fibrina
- Recupere as soluções de trombbina de 2 Unidades/mL e 10 mg/mL de fibrinogen rotulado da geladeira (preparada na etapa 1) e coloque-as no gelo onde serão acessíveis.
NOTA: As soluções são mantidas frias antes do processo de mistura, a fim de diminuir a cinética de reação de polimerização. Isso permite uma mistura mais homogênea das proteínas. - Com o prato(es) configurado (passo 2), extrair 2,5 μL de fibrinogen rotulado e pipeta-lo uniformemente no recorte de silicone (com a camada de filme de vedação presa ao seu lado inferior) de modo que toda a circunferência do recorte esteja em contato com fibrinogênio. Tenha cuidado para não permitir que nenhum bolsão de ar ou bolhas se formem em qualquer lugar da solução, prestando especial atenção às bordas inferiores do recorte (a interface entre a camada de filme de vedação e o silicone).
- Pegue imediatamente 2,5 μL de trombina (com ou sem células/contas) e pipeta diretamente na solução fibrinogênio no recorte (atingindo o volume final de 5 μL fibrin). Em seguida, misture rapidamente as duas soluções, pipetando cuidadosamente para cima e para baixo ~10 vezes. Durante o processo de mistura, mova a ponta em torno de todo o volume para criar uma solução o mais homogênea possível.
- Adicione uma quantidade muito pequena de Salina Tampão fosfato (PBS) [alternativamente meio celular para experimentos celulares, Tabela de Materiais] ao longo da borda de cada prato para que o hidrogel não seque durante o processo de polimerização. Certifique-se de que não há contato entre o meio PBS/célula e as amostras, pois isso danificará a amostra.
- Cubra o prato e coloque-os na incubadora a 37 °C por 30 minutos.
NOTA: O tempo de incubação necessário depende do volume do gel. Se forem utilizados volumes maiores, o tempo de incubação deve aumentar. - Retire o prato da incubadora e adicione PBS/meio de célula ao prato, submergindo toda a construção gel-silicone.
- Levante cuidadosamente as construções de amostra uma de cada vez do prato certificando-se de que a camada de filme de vedação permanece aderida à tira. Desprende lentamente a camada de filme de vedação do silicone, pealing suavemente de uma extremidade do silicone para a outra (Figura 3). Evite retirar áreas próximas ao recorte onde podem existir concentrações de estresse (isso é importante principalmente para geometrias não circulares). Evite qualquer contato com o recorte, pois danificará a amostra.
- Coloque a tira de volta no prato com pbs/meio celular de tal forma que a tira está flutuando no prato. Em seguida, leve o prato(es) para um microscópio padrão de cultura celular para avaliar qualitativamente a condição de cada amostra. Os géis devem ser uniformes, contínuos durante todo o recorte, e nenhuma bolha deve estar presente. Usando a Figura 4 como guia, selecione as melhores amostras para análise posterior.

Figura 3: Remoção adequada da camada de filme de vedação da parte inferior da tira de silicone. O processo de remoção deve ser feito lentamente para que o hidrogel não rasgue ou quebre sua adesão com as paredes internas do recorte. A seta branca mostra a direção da remoção. Clique aqui para ver uma versão maior desta figura.

Figura 4: Observação microscópica de géis de fibrina no recorte de silicone. (A) Dois exemplos de um gel de fibrina polimerizado adequadamente. Observe a homogeneidade relativa do gel e a adesão total às bordas do recorte (B) Dois exemplos de falha de polimerização amostral. Topo: Observe as muitas bolhas e os agregados formados no lado inferior esquerdo. Inferior: Observe o rasgo do gel das bordas recortados e os agregados na região inferior esquerda do recorte. Barra de escala = 300 μm Clique aqui para ver uma versão maior desta figura.
5. Carregamento de amostras no dispositivo SCyUS
- Encha o banho com pbs/meio celular(Figura 5) e coloque a tira de silicone carregando o gel de amostra através da parte superior para que as extremidades estejam sentadas em cada lado do banho. O banho é feito para evitar qualquer secagem do gel. Coloque e aperte os grampos (roxo) junto com as tiras de tecido (verde) para que todas as peças sejam conectadas para formar uma tira reta com o recorte no centro(Figura 5).
- Recupere o dispositivo SCyUS e conecte o poço líquido de alumínio e a tampa de vidro retangular de 22 mm x 40 mm (nº 1 ou 1,5)(Figura 6Aiii). Fixar o deslizamento da tampa na parte inferior do poço usando material de vedação (por exemplo, graxa a vácuo) para que o poço possa ser preenchido com líquido sem vazamento.
- Encha o poço com ~1-2 mL de PBS/cell medium e coloque a tira + construção de tecido + gel(Figura 6B) no dispositivo. Fixar a tira de tecido (2) no suporte (1) de modo que o recorte + gel (5) esteja no centro como mostrado, em seguida, coloque cuidadosamente a inserção pin-down(4) no dispositivo e bloqueie-a no lugar.
- Em seguida, insira o outro lado do tecido no eixo (sem anexar o servomotor) e tranque-o no eixo(Figura 6C).
- Insira o dispositivo SCyUS com a amostra anexada no estágio do microscópio (Figura 6C). Conecte o microcontrolador(Tabela de Materiais)ao computador através de um cabo USB e conecte o servomotor ao microcontrolador. Abra o módulo de controle SCyUS no computador. A amostra está agora pronta para imagens para verificar a adequação da espessura do gel e homogeneidade de fibras sob o microscópio confocal.
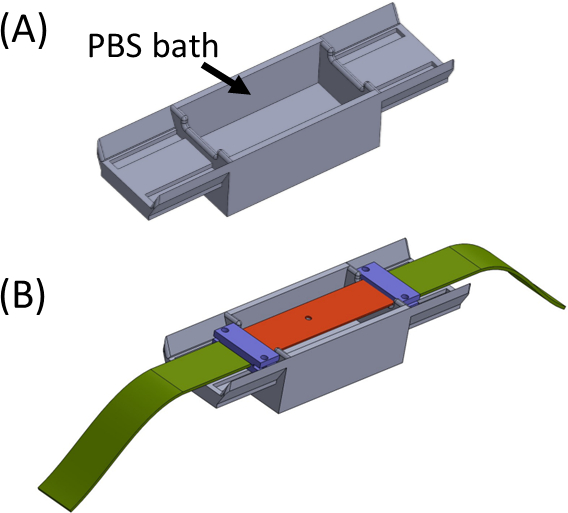
Figura 5: (A) Gabarito contendo um banho PBS (impresso em 3D) (B) Despir a colocação no gabarito para garantir a fixação adequada em linha de suportes (em roxo) e evitar a secagem do gel. Esta figura foi modificada com permissão de Roitblat Riba et al.41Clique aqui para ver uma versão maior desta figura.
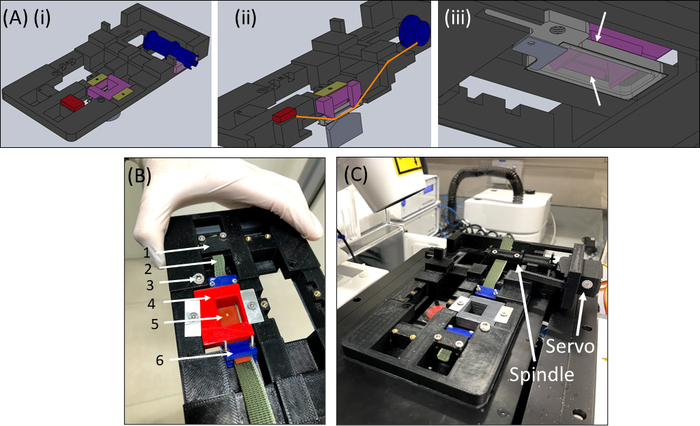
Figura 6: Dispositivo de alongamento SCyUS. (A) Várias vistas de um modelo CAD das principais partes do SCyUS: fuso conectado ao servo (azul), âncora estática (vermelho), inserção que prende a tira de silicone para baixo (roxo) e fixadores que impedem a inserção de subir (verde-amarelo). Uma visão superior do sistema (Ai),uma visão cortada do sistema (Aii) mostrando o caminho da tira (linha laranja), e uma vista inferior(Aiii)do poço líquido de alumínio com uma mancha de vidro. O poço líquido pode ser movido para cima e para baixo com a virada de um parafuso encaixado na rosca principal. O movimento ascendente do poço de alumínio é limitado pelas asas laterais da inserção roxa, como mostrado pelas setas brancas (B) O sistema real: (1) âncora estática(2) tecido verde não elástico(3) parafuso para controle de altura do poço líquidode alumínio (4)inserir pin-down vermelho(5) uma tira de silicone com um recorte circular(6)grampos de conexão azul(C)O sistema de alongamento colocado em um microscópio de confocal. O servomotor e o eixo são mostrados com setas. Esta figura foi modificada com permissão de Roitblat Riba et al.41Clique aqui para ver uma versão maior desta figura.
6. Garanta o gel adequado para a amostragem
- Usando o microscópio confocal(Tabela de Materiais) tome uma baixa ampliação (10×), baixa resolução (~1,4 μm x 1,4 μm tamanho de pixel) confocal Z-stack (≤10 Z-slices com tamanho de passo de aproximadamente 10 μm é suficiente) imagem de azulejo de todo o gel usando lasers de 488/543/561 para examinar a homogeneidade e a adesão à circunferência do recorte geométrico ao longo da espessura do silicone(Figura 7A-B). Use esta imagem Z-stackcomo um mapa para as seguintes etapas.
- Usando imagens ao vivo de baixa resolução, escaneie o gel e determine a posição Zmais baixa onde a adesão total às paredes internas do recorte é aparente sem lágrimas ou bolhas e observe a localização Zdo microscópio(Zl). Para determinar a adesão total do gel ao silicone ao longo de sua circunferência, escaneie a interface do rótulo fluorescente do gel e da tira de silicone (fundo escuro) sob o microscópio(Figura 7C).
- Mova-se na direção Zaté que não haja mais continuidade no gel e observe a posição Z(Zu):
- Subtrair o limite superior(Zu)da direção Za partir do limite inferior(Zl). Esta é a espessura de referência da amostra (Zo):

Se Zo ≥ 100 μm, então o gel é considerado satisfatório para análise. Note que a espessura do recorte de silicone é de cerca de 500 μm, mas a polimerização de gel no recorte normalmente resulta em uma espessura de gel menor. 100 μm é a espessura mínima recomendada para garantir um processo de alongamento estável, sem lágrimas ou desprendimento do gel do recorte de silicone.
NOTA: Em diferentes locais XY, a espessura do gel pode variar. Esta seção do protocolo mede a espessura mínima do gel, permitindo determinar a qualidade do gel e indicar se ele é suficiente para alongamento. Além disso, encontrar o centro do gel fornece um ponto de referência para retornar ao pós-alongamento, seja estático ou dinâmico.

Figura 7: Homogeneidade de gel. As imagens de ladrilhos foram capturadas e costuradas utilizando-se o software de microscópio confocal (Tabela de Materiais) (A) Uma única imagem de corte de azulejo z-slicede uma amostra de gel de fibrina com densidade de fibra relativamente inhomogênea devido à intercalação de trombina e fibrinogen misturando pré-polimerização. Este gel não fornecerá uma análise confiável (B) Uma única imagem de corte de azulejos Zde uma amostra de gel de fibrina com densidade de fibra relativamente homogênea. Este é um gel aceitável para experimentos de alongamento. Barra de escala para imagens A & B é de 200 μm (C) Zoom na interface entre o gel fluorescente rotulado (vermelho) e o silicone (fundo preto). Barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
7. Operação SCyUS, alongamento e imagem
- Agora que a amostra foi determinada como de qualidade satisfatória e está configurada corretamente no dispositivo SCyUS, determine a posição pré-esticada da amostra. Isso é conseguido usando imagens vivas sob o microscópio confocal (semelhante ao passo 6.2).
- Certifique-se de que o servomotor está na posição zero clicando no botão Go To Zero Servo Pos (Clique na Figura 8A e certifique-se de que a Figura 8B exibe zero) e conecte-o ao dispositivo de alongamento, como visto na Figura 6C.
NOTA: Faça este passo devagar e com cuidado para não colocar qualquer excesso de tensão na amostra. - Ao fotografar a amostra, mova o motor um grau(Figura 8C) de cada vez no sentido horário clicando no botão +1 até que o lado direito do recorte seja observado para se mover. Em seguida, reverta o movimento (Figura 8D) de volta à penúltima posição de passo clicando no botão -1. Isso verifica que a amostra está sob tensão mínima. Clique no botão Definir Min Servo Position (Figura 8E) para definir a posição de referência. É possível retornar à posição de referência a qualquer momento clicando no botão Ir Para Min Servo Position ( Figura8F).
NOTA: Recomenda-se usar um objetivo de alta ampliação (≥40×) para esta etapa para minimizar o erro. - Capture uma alta ampliação (40×), alta resolução (~0,2 μm × tamanho de pixel de 0,2 μm), imagem de azulejo de fatia Z única de toda a área de gel. Esta será usada como imagem de referência para análise pós-processamento. Recomenda-se capturar uma única imagem de fatia Zno meio da espessura do gel (usando Zo de Eq. 1), isso permitirá o retorno para aproximadamente a mesma posição Zapós o alongamento. Além disso, leve em consideração que imagens de ladrilhos de alta resolução de toda a área de gel levam um tempo considerável (~20-30 min).
- Agora a amostra está pronta para alongamento estático. Ajuste o servomotor à magnitude do trecho desejado avançando um grau(Figura 8C) de cada vez na GUI (realize lentamente, cerca de 1 grau/segundo).
- Certifique-se de que o servomotor está na posição zero clicando no botão Go To Zero Servo Pos (Clique na Figura 8A e certifique-se de que a Figura 8B exibe zero) e conecte-o ao dispositivo de alongamento, como visto na Figura 6C.
- Em cada magnitude de trecho onde a análise é desejada, capture uma única imagem de azulejo de alta resolução de fatia Z de toda a área de gel para análise pós-processamento. Semelhante ao passo 6.2, verifique se o gel não se desprendeu do silicone ao longo de sua circunferência, escaneando a interface entre o gel (vermelho) e o silicone (fundo escuro), buscando mudanças na adesão da magnitude do trecho anterior.
NOTA: Durante a ativação do motor, use imagens ao vivo para acompanhar a localização do gel em X-Y (com configurações de baixa resolução e baixa ampliação). O gel experimenta um efeito Z-Poissononde a parte inferior do gel sobe, portanto a posição Zdo microscópio também deve ser ajustada ao centro aproximado da espessura do gel para cada magnitude de estiramento. Isso pode ser conseguido recalculando Zo (Eq. 1) para cada magnitude de estiramento. Uma vez que o alongamento na direção Zé relativamente homogêneo, não é fundamental encontrar a profundidade central exata do gel.
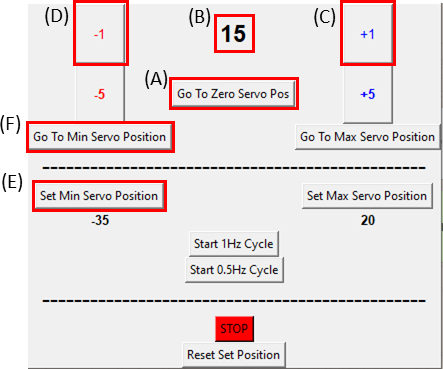
Figura 8: GUI para o módulo de controle SCyUS. (A) Posição do motor em graus. O valor varia de -90° a 90°(B)'Definir posição de servo mínimo'. Este botão permite uma posição mínima pré-definida, para definir uma nova posição de referência diferente do botão Zero Servo Position (C) 'Plus 1°' move o servo motor de um grau no sentido horário(D)'Menos 1°' move o servo motor um no sentido anti-horário (E)O botão 'Ir para a posição zero' define a posição servomotor para 0° ([A]será definido como zero) (F) Botão 'Ir para a posição de servo mínimo' move o servomotor para a posição 'Min' definida pelo usuário. Clique aqui para ver uma versão maior desta figura.
8. Medições de tensão externa pós-processamento
- Para medir as cepas eficazes dos limites de corte, meça os comprimentos de borda a borda na direção de estiramento(eixo X)no centro do eixo Y(Figura 9A).
- Carregue a imagem pré-esticada para o software de processamento de imagem (ImageJ FIJI43) e meça a maior distância de borda a borda que é definida como o comprimento axial do orifício (
 ) no centro.
) no centro. - Defina a maior distância de cima para baixo como a distância perpendicular (
 ).
). - Repita este processo para todas as imagens de intervalo de estiramento e calcule as
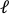 distâncias axiais ( ) e perpendiculares da
distâncias axiais ( ) e perpendiculares da  periferia recorada(Figura 9A, inferior) e, em seguida, realize os seguintes cálculos para encontrar as cepas das bordas recorte:
periferia recorada(Figura 9A, inferior) e, em seguida, realize os seguintes cálculos para encontrar as cepas das bordas recorte:
- Carregue a imagem pré-esticada para o software de processamento de imagem (ImageJ FIJI43) e meça a maior distância de borda a borda que é definida como o comprimento axial do orifício (
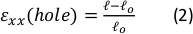

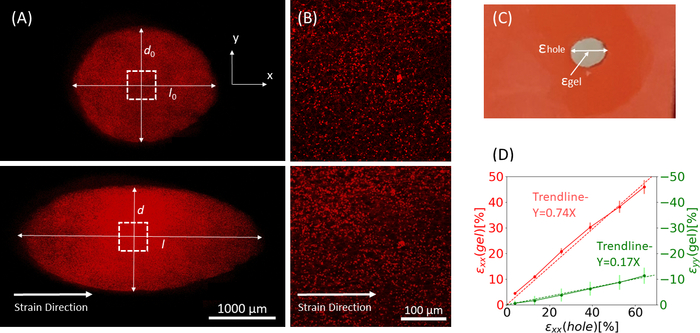
Figura 9: O gel se esforça devido ao alongamento externo da tira de silicone. (A) Seção transversal X-Y de um gel de fibrina não esticada (superior), e após a aplicação de εorifício = 64% de tensão ao longo da direção x (inferior). O gel é embutido com contas fluorescentes. Os comprimentos relevantes de d e l utilizados para cálculo de εorifício são indicados nas imagens (B) Imagens zoom-in da área quadrada tracejada marcada em A (C) Ilustração dos tipos de cepa considerados neste estudo: εorifício é a cepa axial do recorte em seu diâmetro máximo, e εgel é a cepa axial no centro do gel (medida pelos locais agregados de contas) (D) Uma relação linear foi encontrada entre εorifício e εgel na direção xx (linha vermelha) e yy direção (linha verde). Esta figura foi adaptada com permissão de Roitblat Riba et al.41Clique aqui para ver uma versão maior desta figura.
9. Análise de orientação de fibras
- Use a quantificação do alinhamento de fibras para caracterizar a resposta estrutural do gel fibroso ao aumento das magnitudes do estiramento. Carregue imagens de alta resolução para o software ImageJ FIJI (NIH)43 e, em seguida, analise usando o módulo OrientationJ (EPFL)44 (Configurações: gradiente gaussiano e janela de 3 pixels, Figura 10).
- Calcule o Parâmetro de Ordem Nemática 2D (NOP) do histograma de orientação como:45
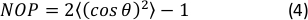
NOTA: Um valor de NOP = 1 indica alinhamento perfeito ao longo da direção axial (ângulo zero) e NOP = 0 indica isotropia. O ângulo de orientação, φ, é o ângulo de fibra em relação ao eixo de tensão (eixo x) obtido através da análise de imagem e precisamente definido na documentação do OrientationJ. 44
- Calcule o Parâmetro de Ordem Nemática 2D (NOP) do histograma de orientação como:45

Figura 10: Análise de orientação de fibra usando o software FIJI ImageJ. (A) Menu principal do ImageJ com uma seta indicando a localização do menu pulldown 'Plugins' onde o 'OrientationJ' pode ser encontrado. No menu estendido do 'OrientationJ', clique na opção 'OrientaçãoJ Distribuição'(B)Módulo de Distribuição do R. Defina 'janela local σ' para 3 pixels e 'Gradiente' para 'Gaussian'. Em seguida, pressione o botão 'Executar' (seta vermelha). Clique aqui para ver uma versão maior desta figura.
10. Análise manual da tensão do gel interno
- Ao realizar imagens vivas de alta ampliação de um hidrogel com contas incorporadas, localize manualmente uma região de interesse (ROI) com características facilmente reconhecíveis (por exemplo, agregados de contas), a fim de retornar ao mesmo local após cada magnitude de estiramento.
NOTA: A compressão na direção Z (efeito Poisson) pode levar a um aumento na densidade das contas à medida que o estiramento aumenta, por isso sugerimos a escolha de agregados de contas grandes o suficiente, por isso eles são claramente identificáveis. Este protocolo exige a análise da região central do gel de fibrina, embora qualquer região possa ser escolhida. - Na posição pré-estiramento (etapa 6), capture uma imagem de alta resolução Z-stackdo ROI selecionado. Após cada intervalo de estiramento desejado, retorne ao mesmo ROI e repita o processo de captura de imagem.
- Pegue as imagens e importe-as para o ImageJ. No ROI, registo a localização do pixel X-Y de cada agregado de contas visível. Transfira os dados gravados para uma planilha.
- Meça as distâncias entre cada par de agregados e compare-as com as distâncias dos mesmos pares na imagem de referência, permitindo o cálculo das cepas nas direções X e Y.
NOTA: Se um filme contínuo em tempo real for gravado enquanto o gel estiver esticado (em vez de captura de imagem estática), uma análise automática das cepas pode ser realizada com métodos de correlações de imagem digital ou volume (DIC/DVC), como demonstrado anteriormente46,47. No entanto, deve-se notar que a análise automática de DIC/DVC é desafiadora neste cenário, já que a pilha Znão está apenas se movendo no plano X-Y, mas também na direção Zdevido ao efeito Poisson (compressão), contabilizando derivas consideráveis durante o filme gravado.
Resultados
Dados representativos de trecho estático de magnitudes crescentes aplicadas à tira de silicone carregando um hidrogel fibrina 3D, embutido com contas fluorescentes de 1 μm, são mostrados na Figura 9. A análise demonstra o efeito do estiramento do silicone nas alterações geométricas do recorte, bem como as cepas desenvolvidas dentro do gel. Imagensde pilha de Z de todo o gel são usadas para avaliar a deformação do recorte em forma de círculo original para a geome...
Discussão
O método e o protocolo aqui apresentados são em grande parte baseados em nosso estudo anterior por Roitblat Riba et al.41 Incluímos aqui o design completo auxiliado por computador (CAD), Python e códigos microcontroladores do dispositivo SCyUS.
As principais vantagens do método apresentado sobre as abordagens existentes incluem a possibilidade de esticar hidrogéis 3D muito macios (Módulo Elástico de ~100 Pa) de sua circunferência, e sob imagens confoca...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Algumas figuras incluídas aqui foram adaptadas por permissão do Centro de Liberação de Direitos Autorais: Springer Nature, Annals of Biomedical Engineering. Esticando hidrogéis 3D com cepas uniformes de eixo Z ao permitir imagens de microscopia ao vivo, A. Roitblat Riba, S. Natan, A. Kolel, H. Rushkin, O. Tchaicheeyan, A. Lesman, Copyright© (2019).
https://doi.org/10.1007/s10439-019-02426-7
Materiais
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 546 carboxylic acid, succinimidyl ester | Invitrogen | A20002 | |
| Cell Medium (DMEM High Glucose) | Biological Industries | 01-052-1A | Add 10% FBS, 1% PNS, 1% L-Glutamine, 1% Sodium Pyruvate |
| Cover Slip #1.5 | Bar-Naor Ltd. | BN72204-30 | 22×40 mm |
| DIMETHYL SULPHOXIDE 99.5% GC DMSO | Sigma-Aldrich Inc. | D-5879-500 ML | |
| Dulbecco's Phosphate-Buffered Saline | Biological Industries | 02-023-1A | |
| EVICEL Fibrin Sealant (Human) | Omrix Biopharmaceuticals | 3902 | Fibrinogen: 70 mg/mL, Thrombin: 800-1200 IU/mL |
| Fibrinogen Buffer | N/A | Recipe for 1L: 7g NaCl, 2.94g trisodium citrate dihydrate, 9g glycine, 20g arginine hydrochloride & 0.15g calcium chloride dihydrate. Bring final volume to 1L with PuW (pH 7.0-7.2) | |
| Fluorescent micro-beads FluoSpheres (1 µm) | Invitrogen | F8820 | Orange (540/560) Provided as suspension (2% solids) in water plus 2 mM sodium azide |
| High-Temperature Silicone Rubber | McMaster-Carr | 3788T41 | 580 µm-thick E = 1.5 Mpa Poisson Ratio = 0.48 Tensile Strength = 4.8 MPa Upper limit of stretch = +300% engineering strain |
| HiTrap desalting column 5 mL (Sephadex G-25 packed) | GE Healthcare | 17-1408-01 | |
| HIVAC-G High Vacuum Sealing Compound | Shin-Etsu Chemical Co., Ltd. | HIVAC-G 100 | |
| ImageJ FIJI software39 | National Institute of Health, Bethesda, MD | Version 1.8.0_112 | |
| Microcontroller (Adruino Uno + Adafruit Motorshield v2.3) | Arduino/Adafruit | Arduino-DK001/Adafruit-1438 | |
| MicroVL 21R Centrifuge | Thermo Scientific | 75002470 | |
| Parafilm | Bemis | PM-996 | |
| Primovert Light Microscope | Carl Zeiss Suzhou Co., Ltd. | 491206-0011-000 | |
| SCyUS CAD (Solidworks) | Dassault Systèmes | N/A | |
| SCyUS Code37 | N/A | N/A | |
| Servomotor - TowerPro SG-5010 | Adafruit | 155 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | For 50 mL tubes |
| Sterile 10 cm non-culture plates | Corning | 430167 | |
| Thrombin buffer | N/A | Recipe for 1L: 20g mannitol, 8.77g NaCl, 2.72g sodium acetate trihydrate, 24 mL 25% Human Serum Albumin, 5.88g calcium chloride. Bring final volume to 1L with PuW (pH 7.0) | |
| Trypsin EDTA Solution B (0.25%), EDTA (0.05%) | Biological Industries | 03-052-1B | |
| USB Cable (Type B Male to Type A Male) | N/A | N/A | |
| Zeiss LSM 880 Confocal Microscope | Carl Zeiss AG | 2811000417 | |
| ZEN 2.3 SP1 FP3 (black) | Carl Zeiss AG | Release Version 14.0.0.0 |
Referências
- Bleuel, J., Zaucke, V., Bruggemann, G. P., Niehoff, A. Effects of cyclic tensile strain on chondrocyte metabolism: a systematic review. PLoS ONE. 10, 0119816 (2015).
- Pennisi, C. P., Olesen, C. G., de Zee, M., Rasmussen, J., Zachar, V. Uniaxial cyclic strain drives assembly and differentiation of skeletal myocytes. Tissue Engineering Part A. 17, 2543-2550 (2011).
- Grodzinsky, A. J., Levenston, M. E., Jin, M., Frank, E. H. Cartilage Tissue Remodeling in Response to Mechanical Forces. Annual Review of Biomedical Engineering. 2 (1), 691-713 (2000).
- Munster, S., et al. Strain history dependence of the nonlinear stress response of fibrin and collagen networks. Proceedings of the National Academy of Sciences of the USA. 110, 12197-12202 (2013).
- Vader, D., Kabla, A., Weitz, D., Mahadevan, L. Strain-induced alignment in collagen gels. PLoS ONE. 4, 5902 (2009).
- Badylak, S. F. The extracellular matrix as a scaffold for tissue reconstruction. Seminars in Cell & Developmental Biology. 13 (5), 377-383 (2002).
- Natan, S., Koren, Y., Shelah, O., Goren, S., Lesman, A. . Molecular Biology of the Cell. 31 (14), 1474-1485 (2020).
- Ban, E., et al. Mechanisms of Plastic Deformation in Collagen Networks Induced by Cellular Forces. Biophysical Journal. 114 (2), 450-461 (2018).
- Kim, J., et al. Stress-induced plasticity of dynamic collagen networks. Nature Communications. 8, 842 (2017).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Basu, A., Janmey, P. A., Yodh, A. G. Non-affine deformations in polymer hydrogels. Soft Matter. 8, 8039-8049 (2012).
- Muiznieks, L. D., Keeley, F. W. Molecular assembly and mechanical properties of the extracellular matrix: A fibrous protein perspective. Biochimica et Biophysica Acta. 1832, 866-875 (2012).
- Brown, A. E. X., Litvinov, R. I., Discher, D. E., Purohit, P. K., Weisel, J. W. Multiscale mechanics of fibrin polymer: gel stretching with protein unfolding and loss of water. Science. 325, 741-744 (2009).
- Carroll, S. F., Buckley, C. T., Kelly, D. J. Cyclic tensile strain can play a role in directing both intramembranous and endochondral ossification of mesenchymal stem cells. Frontiers in Bioengineering and Biotechnology. 5, 73 (2017).
- Livne, A., Bouchbinder, E., Geiger, B. Cell reorientation under cyclic stretching. Nature Communications. 5, 3938 (2014).
- Wang, L., et al. Patterning cellular alignment through stretching hydrogels with programmable strain gradients. ACS Applied Materials & Interfaces. 7, 15088-15097 (2015).
- Xu, G. K., Feng, X. Q., Gao, H. Orientations of Cells on Compliant Substrates under Biaxial Stretches: A Theoretical Study. Biophysical Journal. 114 (3), 701-710 (2017).
- Chagnon-Lessard, S., Jean-Ruel, H., Godin, M., Pelling, A. E. Cellular orientation is guided by strain gradients. Integrative Biology (United Kingdom). 9 (7), 607-618 (2013).
- Lu, J., et al. Cell orientation gradients on an inverse opal substrate. ACS Applied Materials & Interfaces. 7 (19), 10091-10095 (2015).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125, 3015-3024 (2012).
- Bono, N., et al. Unraveling the role of mechanical stimulation on smooth muscle cells: a comparative study between 2D and 3D models. Biotechnology and Bioengineering. 113, 2254-2263 (2016).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8, 839-845 (2007).
- Riehl, B. D., Park, J. H., Kwon, I. K., Lim, J. Y. Mechanical stretching for tissue engineering: two-dimensional and three-dimensional constructs. Tissue Engineering Part B: Reviews. 18, 288-300 (2012).
- Flexcell. Linear Tissue Train Culture Plate. Flexcell. , (2019).
- Flexcell. Tissue Train. Flexcell. , (2019).
- CellScale. MCT6 Stretcher. CellScale. , (2019).
- STREX. STB-150. STREX. , (2019).
- STREX. Stretch Chambers. STREX. , (2019).
- Kamble, H., Barton, M. J., Jun, M., Park, S., Nguyen, N. T. Cell stretching devices as research tools: engineering and biological considerations. Lab on a Chip. 16, 3193-3203 (2016).
- Weidenhamer, N. K., Tranquillo, R. T. Influence of cyclic mechanical stretch and tissue constraints on cellular and collagen alignment in fibroblast-derived cell sheets. Tissue Engineering Part C: Methods. 19, 386-395 (2013).
- Yung, Y. C., Vandenburgh, H., Mooney, D. J. Cellular strain assessment tool (CSAT): precision-controlled cyclic uniaxial tensile loading. Journal of Biomechanics. 42, 178-182 (2009).
- Chen, K., et al. Role of boundary conditions in determining cell alignment in response to stretch. Proceedings of the National Academy of Sciences of the USA. 115, 986-991 (2018).
- Heher, P., et al. A novel bioreactor for the generation of highly aligned 3D skeletal muscle-like constructs through orientation of fibrin via application of static strain. Acta Biomaterialia. 24, 251-265 (2015).
- Foolen, J., Deshpande, V. S., Kanters, F. M. W., Baaijens, F. P. T. The influence of matrix integrity on stress-fiber remodeling in 3D. Biomaterials. 33, 7508-7518 (2012).
- Walker, M., Godin, M., Pelling, A. E. A vacuum-actuated microtissue stretcher for long-term exposure to oscillatory strain within a 3D matrix. Biomedical Microdevices. 20, 43 (2018).
- Zhao, R. G., Boudou, T., Wang, W. G., Chen, C. S., Reich, D. H. Decoupling cell and matrix mechanics in engineered microtissues using magnetically actuated microcantilevers. Advanced Materials. 25, 1699-1705 (2013).
- Li, Y. H., et al. Magnetically actuated cell-laden micro-scale hydrogels for probing strain-induced cell responses in three dimensions. NPG Asia Materials. 8, 238 (2016).
- Li, Y. H., et al. An approach to quantifying 3D responses of cells to extreme strain. Scientific Reports. 6, 19550 (2016).
- Humphrey, J. D., et al. A theoretically-motivated biaxial tissue culture system with intravital microscopy. Biomechanics and Modeling in Mechanobiology. 7, 323-334 (2008).
- Niklason, L. E., et al. Enabling tools for engineering collagenous tissues integrating bioreactors, intravital imaging, and biomechanical modeling. Proceedings of the National Academy of Sciences of the USA. 107, 3335-3339 (2010).
- Roitblat Riba, A., et al. Straining 3D hydrogels with uniform z-axis strains while enabling live microscopy imaging. Annals of Biomedical Engineering. , (2019).
- Gomez, D., Natan, S., Shokef, Y., Lesman, A. Mechanical interaction between cells facilitates molecular transport. Advanced Biosystems. 3 (12), 1900192 (2019).
- Schindelin, J., et al. Fiji: an open- source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- EPFL Switzerland. OrientationJ plug in. EPFL Switzerland. , (2019).
- Goren, S., Koren, Y., Xu, X., Lesman, A. Elastic anisotropy governs the decay of cell-induced displacements. Biophysical Journal. 118 (5), 1152-1164 (2019).
- Notbohm, J., Lesman, A., Tirrell, D. A., Ravichandran, G. Quantifying cell-induced matrix deformation in three dimensions based on imaging matrix fibers. Integrative Biology. 7 (10), 1186-1195 (2015).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. Journal of Cell Biology. 205 (2), 155-162 (2014).
- Cha, C. Y., et al. Tailoring Hydrogel Adhesion to Polydimethylsiloxane Substrates Using Polysaccharide Glue. Angewandte Chemie International Edition. 52, 6949-6952 (2019).
- Wirthl, D., et al. Instant tough bonding of hydrogels for soft machines and electronics. Science Advances. 3, (2017).
- Juarez-Moreno, J. A., Avila-Ortega, A., Oliva, A. I., Aviles, F., Cauich-Rodriguez, J. V. Effect of wettability and surface roughness on the adhesion properties of collagen on PDMS films treated by capacitively coupled oxygen plasma. Applied Surface Science. 349, 763-773 (2015).
- Kim, H. T., Jeong, O. C. PDMS surface modification using atmospheric pressure plasma. Microelectronic Engineering. 88, 2281-2285 (2011).
- Prasad, B. R., et al. Controlling cellular activity by manipulating silicone surface roughness. Colloids and Surfaces. 78, 237-242 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados