Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cepa controlada de hidrogeles 3D bajo imágenes de microscopía en vivo
En este artículo
Resumen
El método presentado implica el estiramiento uniaxial de hidrogeles blandos 3D incrustados en caucho de silicona mientras permite la microscopía confocal viva. Se demuestra la caracterización de las cepas de hidrogel externas e internas, así como la alineación de la fibra. El dispositivo y el protocolo desarrollados pueden evaluar la respuesta de las células a diversos regímenes de deformación.
Resumen
Las fuerzas externas son un factor importante en la formación, el desarrollo y el mantenimiento de los tejidos. Los efectos de estas fuerzas se estudian a menudo utilizando métodos de estiramiento in vitro especializados. Varios sistemas disponibles utilizan camillas basadas en sustrato 2D, mientras que la accesibilidad de las técnicas 3D para tensar hidrogeles blandos, es más restringida. Aquí, describimos un método que permite el estiramiento externo de hidrogeles blandos de su circunferencia, utilizando una tira de silicona elástica como el portador de la muestra. El sistema de estiramiento utilizado en este protocolo está construido a partir de piezas impresas en 3D y electrónica de bajo costo, por lo que es simple y fácil de replicar en otros laboratorios. El proceso experimental comienza con hidrogeles de fibrina blanda polimerización (>100 μm) (módulo elástico de ~ 100 Pa) en un recorte en el centro de una tira de silicona. Las construcciones de gel de silicona se unen al dispositivo de estiramiento impreso y se colocan en la etapa de microscopio confocal. Bajo microscopía en vivo, se activa el dispositivo de estiramiento, y los geles se muestran en varias magnitudes de estiramiento. El procesamiento de imágenes se utiliza para cuantificar las deformaciones de gel resultantes, demostrando cepas relativamente homogéneas y alineación de fibras a lo largo del espesor 3D del gel (ejeZ). Las ventajas de este método incluyen la capacidad de colar hidrogeles extremadamente blandos en 3D mientras se ejecuta microscopía in situ, y la libertad de manipular la geometría y el tamaño de la muestra de acuerdo con las necesidades del usuario. Además, con la adaptación adecuada, este método se puede utilizar para estirar otros tipos de hidrogeles (por ejemplo, colágeno, poliacrilamida o polietilenglicol) y puede permitir el análisis de las células y la respuesta de los tejidos a las fuerzas externas en condiciones 3D más biomiméticas.
Introducción
La respuesta tisular a las fuerzas mecánicas es una parte integral de una amplia gama de funciones biológicas, incluyendo la expresióngénica 1,la diferenciación celular2,y la remodelación tisular3. Por otra parte, los cambios inducidos por la fuerza en la matriz extracelular (ECM) tales como alineación y densificación de la fibra pueden afectar comportamiento de la célula y la formación del tejido4,5,6. La estructura de malla fibrosa del ECM tiene propiedades mecánicas intrigantes, como elasticidad no lineal, deformación no afín y deformaciones plásticas7,8,9,10,11,12. Estas propiedades afectan la forma en que las células y su microambiente circundante responden a las fuerzas mecánicas externas13,14. Comprender cómo responden el ECM y los tejidos a las fuerzas mecánicas permitirá avanzar en el campo de la ingeniería de tejidos y en el desarrollo de modelos computacionales y teóricos más precisos.
Los métodos más comunes para estirar mecánicamente las muestras se han centrado en sustratos 2D cargados de células para explorar los efectos sobre el comportamiento celular. Estos incluyen, por ejemplo, la aplicación de deformación a sustratos de polidimetilsiloxano (PDMS) y el análisis de los ángulos de reorientación celular en relación con la dirección de estiramiento15,16,17,18,19. Sin embargo, los métodos que investigan la respuesta de los hidrogeles incrustados en células 3D al estiramiento externo, una situación que imita más de cerca el microambiente tisular, son más limitados. Los avances hacia los métodos de estiramiento 3D son de particular importancia porque las células se comportan de manera diferente en sustratos 2D en comparación con las matrices 3D20. Estos comportamientos incluyen realineamiento celular, niveles de expresión de proteínas y patrones de migración21,22,23.
Los métodos y dispositivos que permiten el estiramiento de muestras en 3D incluyen tanto los disponibles comercialmente24,25,26,27,28 como los desarrollados para la investigación de laboratorio29. Estos métodos utilizan tubos de silicona distensibles30,cámaras multi-pozo31,abrazaderas26,32,biorreactores11,33,voladizos34,35,36,eimanes 37,38. Algunas técnicas generan estiramientos que localmente deforman hidrogeles 3D, por ejemplo tirando de agujas de dos puntos individuales en el gel5,mientras que otras permiten la deformación de todo el bulto del gel16. Además, la mayoría de estos sistemas se centran en el análisis del campo de deformación en el plano X-Y, con información limitada sobre el campo de deformación en la dirección Z. Además, sólo un puñado de estos dispositivos son capaces de imágenes microscópicas in situ. El principal desafío con las imágenes de gran aumento in situ (por ejemplo, microscopio confocal) es la distancia de trabajo limitada de unos pocos cientos de micras desde la lente objetivo hasta la muestra. Los dispositivos que permiten la obtención de imágenes en vivo durante el estiramiento sacrifican la uniformidad de la tensión en el eje Zo son relativamente complejos y difíciles de reproducir en otros laboratorios39,40.
Este enfoque para estirar hidrogeles 3D permite la deformación uniaxial estática o cíclica durante la microscopía confocal viva. El dispositivo de estiramiento (conocido como 'Smart Cyclic Uniaxial Stretcher – SCyUS') está construido utilizando piezas impresas en 3D y hardware de bajo costo, lo que permite una fácil reproducción en otros laboratorios. Unido al dispositivo hay un caucho de silicona disponible comercialmente con un recorte geométrico en su centro. Los componentes de hidrogel se polimerizan para rellenar el recorte. Durante la polimerización, los hidrogeles biológicos, como la fibrina o el colágeno, se adhieren naturalmente a las paredes interiores del recorte. Usando el SCyUS, la tira de silicona se estira uniaxally, transfiriendo tensiones controladas al hidrogel 3D embebido41.
Este sistema permite una combinación única de características y ventajas en comparación con otros métodos existentes. En primer lugar, el sistema permite el estiramiento uniaxial de hidrogeles blandos 3D gruesos (>100 μm de espesor, rigidez de <1 kPa) desde su periferia, con deformación homogénea en Zen todo el hidrogel. Estos hidrogeles son demasiado blandos para ser agarrados y estirados por técnicas de tracción convencionales. En segundo lugar, el dispositivo de estiramiento se puede replicar fácilmente en otros laboratorios, ya que la impresión 3D está disponible para los investigadores y la electrónica utilizada en el diseño es de bajo costo. En tercer lugar, y quizás la característica más atractiva, la geometría y el tamaño del recorte en la tira de silicona se pueden manipular fácilmente, lo que permite gradientes de deformación ajustables y condiciones de contorno, así como el uso de una variedad de volúmenes de muestra, hasta unos pocos microlitros.
El actual protocolo consiste en moldear el gel de la fibrina en discos del diámetro de ~2 milímetros en tiras de goma gruesas del silicón de 0.5 milímetros procedidas por el estiramiento uniaxial bajo microscopia confocal viva. A continuación se analizan en detalle los procedimientos experimentales para medir y analizar las cepas que actúan sobre el recorte geométrico, las cepas internas desarrolladas en el hidrogel, así como la alineación de fibras resultante después de varias manipulaciones de estiramiento. Finalmente, la posibilidad de incrustar las células en el hidrogel y de exponerlas al estiramiento externo controlado se discute.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparación de la solución (que se realizará con antelación)
- Etiquetado de fibrinógeno
NOTA: El paso de etiquetado es necesario sólo si se desea analizar la deformación del gel de fibrina. Para experimentos celulares, es posible usar un gel sin etiquetar.- Añadir 38 μL de 10 mg/mL de colorante fluorescente de éster succinimidilo (disuelto en DMSO) a 1,5 mL de solución de fibrinógeno de 15 mg/mL (relación molar de 5:1) en un tubo de centrífuga de 50 mL y colocar en una coctelera durante 1 hora a temperatura ambiente. Después, coloque el tubo en la centrífuga durante 3 minutos a 800 x g (temperatura ambiente).
- Filtre el sobrenadante del paso anterior a través de una columna de desalación llena de resina de gel de dextrano(Tabla de materiales)para separar el tinte sin reaccionar,42 siguiendo estos pasos.
- Prelava la columna con 25 mL de tampón de fibrinógeno.
- Inyecte lentamente el fibrinógeno etiquetado del paso 1.1.1 en la columna, asegurándose de que no haya burbujas que entren en el filtro. Deseche los primeros ~ 0.3 mL de solución eluida (4-6 gotas de líquido de color débil). A continuación, recoja los siguientes 1,0-1,5 mL de solución purificada (siga el protocolo del fabricante para obtener detalles más específicos).
- Termine el proceso de filtración esterilizando la solución purificada resultante utilizando un filtro accionado por jeringa (0.22-0.45 μm).
- Para limpiar y reciclar la columna, lave con 20 mL de tampón de fibrinógeno, y luego guárdelo en 25 mL de etanol al 20%.
- Después de la elución, divida el fibrinógeno marcado purificado resultante en pequeñas alícuotas de ~ 7-50 μL, dependiendo del número deseado de geles estirados. Para cada gel de círculo estirado de 2 mm de diámetro, prepare aproximadamente 3.5 μL de fibrinógeno (se usarán 2.5 μL por gel + 1 μL para errores de pipeteo).
- Guarde las alícuotas en un congelador de -20 °C. Se pueden usar hasta aproximadamente un año (no se recomienda descongelar y congelar de nuevo).
- Durante el resto de este protocolo, mantenga aproximadamente 7 μL del fibrinógeno purificado etiquetado en el refrigerador (4 °C) hasta el paso 4. Este volumen está destinado a la creación de dos geles estirados (se necesitan 2,5 μL por gel, y se utiliza un volumen adicional de 1 μL para tener en cuenta los errores en la preparación de la muestra).
NOTA: Este procedimiento de filtrado diluye típicamente la solución inicial de fibrinógeno de 15 mg/mL a una concentración final de aproximadamente 10 mg/mL. El factor de dilución depende del volumen inicial y la concentración de fibrinógeno, como se especifica en el protocolo del fabricante.
- Preparar 7 μL de solución de trombina (diluir usando tampón de trombina a 2 unidades/mL, Tabla de Materiales)y conservar en el refrigerador (4 °C) hasta el paso 4. Este volumen está destinado a llenar los recortes de dos geles estirados.
NOTA: Para realizar el análisis de deformación interna, se deben añadir a la solución de trombina 1 μm de diámetro de perlas fluorescentes (adquiridas en suspensión [2% sólidos] en agua más 2 mM naN3)(se recomienda una relación de 1:25 v/v % de perla:trombina para un objetivo de 40x). Las perlas deben incluirse sólo cuando se deseen mediciones de deformación interna, ya sea en presencia o ausencia de células.
2. Preparación de tiras de silicona
- Recupere el caucho de silicona de 0,5 mm de espesor y córtelo en tiras de 15 x 80 mm2 con un agujero de 2 mm de diámetro en el centro de la tira (Figura 1). Si es posible, utilice un cortador láser programable para una alta precisión. Si la maquinaria programable no está disponible, las tijeras son suficientes para cortar el contorno de la tira y un pequeño punzón de agujero es adecuado para el recorte central.
NOTA: El caucho de silicona comercial generalmente se compra con una envoltura de plástico en ambos lados. Mantenga la cubierta de plástico original en ambos lados de la silicona si es posible. Si reutiliza tiras de silicona de un experimento anterior, trátelas con tripsina durante 0,5 horas, remoje 0,2 M NaOH durante 0,5 horas y luego remoje etanol al 70% durante 1 hora. Déjalos secar antes de usarlos. - Prepare capas de película de sellado (hidrofóbicas) con dimensiones de al menos 20 × 30 mm2,para que sean más anchas que la tira de silicona y, por lo tanto, permita que se forme un sello sobre todo el recorte geométrico.
- Lave un plato de 10 cm con etanol al 70%, y luego limpie y seque con toallitas de tareas delicadas sin linting (para experimentos estériles y no estériles). Este paso es importante ya que permite que las capas de película de sellado se adhieran mejor a la placa y restrinjan el movimiento de la muestra durante el proceso de preparación.
- Coloque las capas de la película de sellado en el plato lavado de 10 cm para que haya suficiente espacio para colocar dos tiras en cada plato lado a lado (Figura 2A).
- Retire la envoltura de plástico de un lado de la tira de silicona y coloque el lado expuesto en la capa de película de sellado para que el recorte esté rodeado completamente por la capa de película de sellado (Figura 2B). Luego, presione suavemente la silicona contra la capa de película de sellado para sellar el área que rodea el recorte, usando dedos enguantado limpios.
NOTA: Asegúrese de que no haya bolsas de aire entre la silicona y la película de sellado, especialmente alrededor del recorte. Haga esto examinando la parte inferior del plato (Figura 2C).
- Retire la envoltura de plástico de un lado de la tira de silicona y coloque el lado expuesto en la capa de película de sellado para que el recorte esté rodeado completamente por la capa de película de sellado (Figura 2B). Luego, presione suavemente la silicona contra la capa de película de sellado para sellar el área que rodea el recorte, usando dedos enguantado limpios.
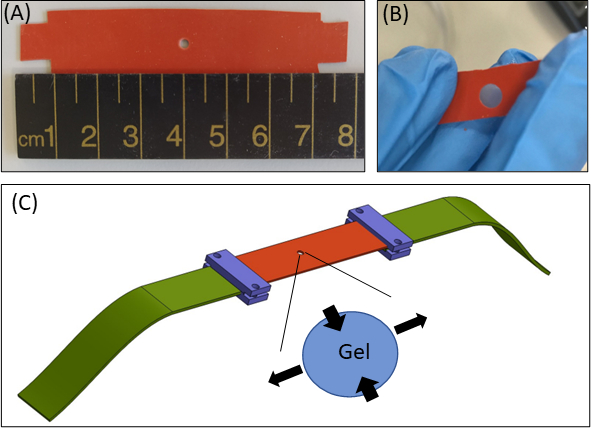
Figura 1: Enfoque de colado de hidrogel. (A) 15 × 80 mm2 tira de silicona con un corte de 2 mm de diámetro en el centro de la tira (B) Una tira de silicona con un recorte circular con gel de fibrina incrustado. Para fines ilustrativos, el recorte en la silicona es más grande que en los experimentos reales(C)Esquema del enfoque de estiramiento con la tira de silicona (naranja), gel circular (recorte en el medio) y extensores de tela (verde) que conectan la silicona al dispositivo de estiramiento. El área ampliada del gel indica la deformación del gel, en respuesta al estiramiento uniaxial de la silicona. Para simplificar, la compresión a lo largo del espesor del gel (ejeZ)no se muestra en la ilustración. Las figuras 1B y 1C han sido adaptadas de Roitblat Riba et al.41Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Ejemplo de colocación adecuada de una tira de silicona en una capa de película de sellado antes de la polimerización en gel. (A) Colocación de dos capas de película de sellado en un plato de 10 cm (B) Colocación de tiras de silicona en las capas de película de sellado (C) Vista inferior del plato, mostrando el sello de aire entre la silicona y la capa de película de sellado. Izquierda: Sellado adecuado de la capa de película de sellado a la tira de silicona alrededor del recorte sin bolsas de aire. Derecha: Sello incorrecto de la capa de película de sellado a la tira de silicona recortada con bolsas de aire alrededor del borde del recorte. Esto dará lugar a fugas de los componentes de hidrogel debajo de la silicona. La flecha roja apunta a un área donde se formó una bolsa de aire. Haga clic aquí para ver una versión más amplia de esta figura.
3. Preparación de la trombina con células
NOTA: Realice este paso sólo si se desea incrustar células en el hidrogel, y en condiciones estériles en una campana biológica(Tabla de Materiales).
- Esterilización: el día anterior al experimento celular, coloque las tiras de silicona y las capas de película de sellado en etanol al 70% durante la noche y luego realice la esterilización UV durante 30 minutos en cada lado (si los platos de 10 cm no son ya estériles, también deben esterilizarse bajo luz UV durante 30 minutos después de un lavado de etanol al 70%). El sistema UV utilizado en el protocolo es el integrado en la campana biológica.
NOTA: Alternativamente, se puede realizar un ciclo de esterilización en autoclave (140 °C) en las tiras de silicona, ya que son resistentes hasta 260 °C. - Realice un recuento celular para determinar la concentración celular, y luego centrífuga y vuelva a suspender el pellet celular con 7 μL de trombina (2 unidades/mL) en un tubo centrífuga de 1,5 mL. Recomendamos una concentración celular de 800 células/μL de trombina. Mantenga las células enfriadas hasta su uso (no exceda más de media hora para evitar dañar las células).
4. Polimerización de geles de fibrina
- Recupere las soluciones de fibrinógeno con etiqueta de 2 unidades/mL y 10 mg/mL del refrigerador (preparadas en el paso 1) y colóquelas en el hielo donde serán accesibles.
NOTA: Las soluciones se mantienen frías antes del proceso de mezcla para ralentizar la cinética de la reacción de polimerización. Esto permite una mezcla más homogénea de las proteínas. - Con el plato (es) configurado (paso 2), extraiga 2,5 μL de fibrinógeno marcado y pipetee uniformemente en el corte de silicona (con la capa de película de sellado unida a su lado inferior) para que toda la circunferencia del corte esté en contacto con el fibrinógeno. Tenga cuidado de no permitir que se formen bolsas de aire o burbujas en ninguna parte de la solución, prestando especial atención a los bordes inferiores del recorte (la interfaz entre la capa de película de sellado y la silicona).
- Tomar inmediatamente 2,5 μL de trombina (con o sin células/perlas) y pipetearlo directamente en la solución de fibrinógeno en el corte (alcanzando el volumen final de 5 μL de fibrina). Luego mezcle rápidamente las dos soluciones pipeteando cuidadosamente hacia arriba y hacia abajo ~ 10 veces. Durante el proceso de mezcla, mueva la punta alrededor de todo el volumen para crear una solución lo más homogénea posible.
- Agregue una cantidad muy pequeña de solución salina tampón de fosfato (PBS) [alternativamente medio celular para experimentos celulares, Tabla de materiales]a lo largo del borde de cada plato para que el hidrogel no se seque durante el proceso de polimerización. Asegúrese de que no haya contacto entre el pbs/medio celular y las muestras, ya que esto dañará la muestra.
- Cubrir el plato o platos y colocarlos en la incubadora a 37 °C durante 30 minutos.
NOTA: El tiempo de incubación requerido depende del volumen del gel. Si se utilizan volúmenes más grandes, el tiempo de incubación debería aumentar. - Retire el plato (es) de la incubadora y agregue PBS / medio celular al plato, sumergiendo toda la construcción de gel-silicona.
- Levante cuidadosamente las construcciones de la muestra de una en una del plato asegurándose de que la capa de la película de sellado permanezca adherida a la tira. Suelte lentamente la capa de película de sellado de la silicona guisando suavemente de un extremo de la silicona al otro (Figura 3). Evite tirar de áreas cercanas al recorte donde pueden existir concentraciones de tensión (esto es principalmente importante para geometrías no circulares). Evite cualquier contacto con el recorte, ya que dañará la muestra.
- Coloque la tira de nuevo en el plato con PBS / medio celular de tal manera que la tira esté flotando en el plato. Luego lleve el(los) plato(s) a un microscopio estándar de cultivo celular para evaluar cualitativamente la condición de cada muestra. Los geles deben ser uniformes, continuos durante todo el corte, y no deben estar presentes burbujas. Utilizando la Figura 4 como guía, seleccione las mejores muestras para un análisis más profundo.

Figura 3: Eliminación adecuada de la capa de película de sellado de la parte inferior de la tira de silicona. El proceso de eliminación debe hacerse lentamente para que el hidrogel no se rasgue o rompa su adhesión con las paredes internas del recorte. La flecha blanca muestra la dirección de eliminación. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 4: Observación microscópica de geles de fibrina en el corte de silicona. (A) Dos ejemplos de un gel de fibrina correctamente polimerizado. Observe la homogeneidad relativa del gel y la adhesión completa a los bordes del recorte (B) Dos ejemplos de falla de polimerización de la muestra. Arriba: Observe las muchas burbujas y los agregados formados en la parte inferior izquierda. Inferior: Observe el desgarro del gel de los bordes recortados y los agregados en la región inferior izquierda del recorte. Barra de escala = 300 μm Haga clic aquí para ver una versión más grande de esta figura.
5. Carga de muestra en el dispositivo SCyUS
- Llene el baño con PBS / medio celular(Figura 5)y coloque la tira de silicona que lleva el gel de muestra en la parte superior para que los extremos estén sentados a cada lado del baño. El baño está destinado a evitar cualquier secado del gel. Colocar y apretar las abrazaderas (morado) junto con las tiras de tela (verde) para que todas las piezas estén conectadas para formar una tira recta con el recorte en el centro (Figura 5).
- Recupere el dispositivo SCyUS y coloque el pozo líquido de aluminio y la cubierta de vidrio rectangular de 22 mm x 40 mm (No. 1 o 1.5) (Figura 6Aiii). Coloque el resbalón de la cubierta en la parte inferior del pozo utilizando material de sellado (por ejemplo, grasa de vacío) para que el pozo se pueda llenar con líquido sin fugas.
- Llene el pozo con ~ 1-2 mL de PBS / medio celular y coloque la tira + tela + construcción de gel (Figura 6B) en el dispositivo. Sujete la tira de tela(2)en el soporte (1) para que el recorte + gel (5) esté en el centro como se muestra, luego coloque cuidadosamente el inserto pin-down (4) en el dispositivo y bloquee en su lugar.
- A continuación, inserte el otro lado de la tela en el husillo (sin conectar el servomotor) y bloquee el husillo (Figura 6C).
- Inserte el dispositivo SCyUS con la muestra adjunta en la etapa del microscopio (Figura 6C). Conecte el microcontrolador(Tabla de Materiales)a la computadora a través de un cable USB y conecte el servomotor al microcontrolador. Abra el módulo de control SCyUS en el ordenador. La muestra ya está lista para la toma de imágenes para comprobar la adecuación del espesor del gel y la homogeneidad de la fibra bajo el microscopio confocal.
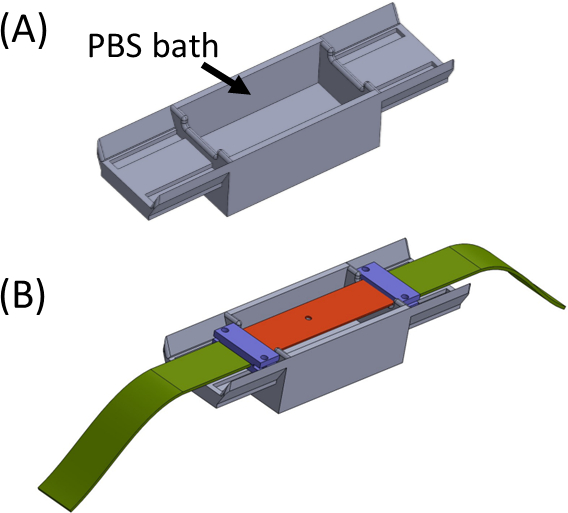
Figura 5: (A) Plantilla que contiene un baño de PBS (impreso en 3D) (B) Colocación de tiras en la plantilla para asegurar la fijación adecuada en línea de los soportes (en púrpura) y evitar el secado del gel. Esta cifra ha sido modificada con permiso de Roitblat Riba et al.41Por favor, haga clic aquí para ver una versión más grande de esta figura.
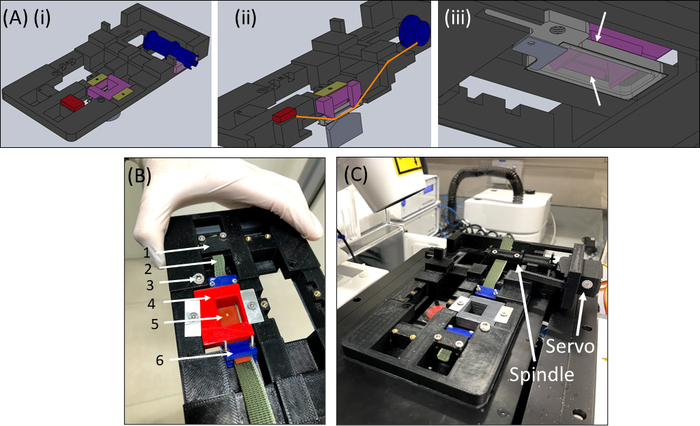
Figura 6: Dispositivo de estiramiento SCyUS. (A)Varias vistas de un modelo CAD de las partes principales del SCyUS: husillo conectado al servo (azul), anclaje estático (rojo), inserto que fija la tira de silicona hacia abajo (púrpura) y fijadores que impiden que el inserto se eleve (amarillo-verde). Una vista superior del sistema (Ai), una vista cortada del sistema (Aii) que muestra la trayectoria de la tira (línea naranja), y una vista inferior (Aiii) del pozo líquido de aluminio con una cubierta de vidrio. El pozo líquido se puede mover hacia arriba y hacia abajo con el giro de un tornillo instalado en el roscado principal. El movimiento hacia arriba del pozo de aluminio está limitado por las alaslateralesdel inserto púrpura, como lo muestran las flechas blancas(B)El sistema real: (1) anclaje estático (2) tela verde no estirable ( 3 ) tornillo para el control de altura del pozo líquido de aluminio (4) inserto pin-down rojo (5) una tira de silicona con un recorte circular (6) abrazaderas de conexión azules(C) El sistema de estiramiento colocado en un microscopio confocal. El servomotor y el husillo se muestran con flechas. Esta cifra ha sido modificada con permiso de Roitblat Riba et al.41Por favor, haga clic aquí para ver una versión más grande de esta figura.
6. Asegúrese de gel adecuado para el muestreo
- Usando el microscopio confocal(Tabla de Materiales)tome una imagen de baldosas confocales de pila Z (≤10 ×), de baja resolución (~ 1.4 μm x 1.4 μm de tamaño de píxel) de pila Z con ≤10 rebanadas Z con un tamaño de paso de aproximadamente 10 μm es suficiente) de todo el gel utilizando láseres de 488/543/561 para examinar la homogeneidad y la adhesión a la circunferencia del recorte geométrico a lo largo del espesor de la silicona(Figura 7A-B). Utilice esta imagen Z-stack como mapa para los siguientes pasos.
- Usando imágenes vivas de baja resolución, escanee el gel y determine la posición Zmás baja donde la adhesión completa a las paredes internas del recorte es evidente sin desgarros ni burbujas y observe la ubicación Zdel microscopio(Zl). Para determinar la adhesión completa del gel a la silicona a lo largo de su circunferencia, escanee la interfaz de la etiqueta fluorescente del gel y la tira de silicona (fondo oscuro) bajo el microscopio (Figura 7C).
- Muévase hacia arriba en la dirección Zhasta que ya no haya continuidad en el gel y observe la posición Z(Zu):
- Restar el límite superior (Zu) de la dirección Zdel límite inferior (Zl). Este es el espesor de referencia de la muestra (Zo):

Si Zo ≥ 100 μm entonces el gel se considera satisfactorio para el análisis. Tenga en cuenta que el espesor del recorte de silicona es de aproximadamente 500 μm, pero la polimerización de gel en el recorte generalmente resulta en un espesor de gel más pequeño. 100 μm es el espesor mínimo recomendado para asegurar un proceso de estiramiento estable, sin desgarros ni desprendimiento del gel del corte de silicona.
NOTA: En diferentes ubicaciones XY, el grosor del gel puede variar. Esta sección del protocolo mide el espesor mínimo del gel, lo que nos permite determinar la calidad del gel e indicar si es suficiente para estirar. Además, encontrar el centro del gel proporciona un punto de referencia para volver al post-estiramiento, ya sea estático o dinámico.

Figura 7: Homogeneidad del gel. Las imágenes del azulejo fueron capturadas y cosidas usando el software confocal del microscopio(tabla de materiales)(A)una sola imagen cosida de lateja Z - de la rebanada de una muestra del gel de la fibrina con la densidad relativamente no homogénea de la fibra debido a la prepolimerización inadecuada de la mezcla de la trombina y del fibrinógeno. Este gel no proporcionará un análisis confiable(B)Una sola imagen de la rebanada Zde una muestra de gel de fibrina con densidad de fibra relativamente homogénea. Este es un gel aceptable para experimentos de estiramiento. La barra de escala para las imágenes A &B es de 200 μm (C)Zoom de la interfaz entre el gel marcado fluorescentemente (rojo) y la silicona (fondo negro). Barra de escala = 100 μm. Haga clic aquí para ver una versión más amplia de esta figura.
7. Operación SCyUS, estiramiento e imágenes
- Ahora que se ha determinado que la muestra es de calidad satisfactoria y está configurada en el dispositivo SCyUS correctamente, determine la posición pre-estirada de la muestra. Esto se logra mediante el uso de imágenes en vivo bajo el microscopio confocal (similar al paso 6.2).
- Asegúrese de que el servomotor esté en su posición cero haciendo clic en el botón Ir a cero servo pos (haga clic en la Figura 8A y asegúrese de que la Figura 8B muestre cero) y conéctelo al dispositivo de estiramiento como se ve en la Figura 6C.
NOTA: Haga este paso lenta y cuidadosamente para no poner ningún exceso de tensión en la muestra. - Mientras toma imágenes de la muestra, mueva el motor un grado (Figura 8C) a la vez en el sentido de las agujas del reloj haciendo clic en el botón +1 hasta que se observe que el lado derecho del recorte se mueve. Luego, invierta el movimiento(Figura 8D)de nuevo a la penúltima posición del paso haciendo clic en el botón -1. Esto verifica que la muestra está bajo una tensión mínima. Haga clic en el botón Establecer posición mínima de servo ( Figura8E) para establecer la posición de referencia. Es posible volver a la posición de referencia en cualquier momento haciendo clic en el botón Ir a la posición mínima de servo ( Figura8F).
Nota : se recomienda utilizar un objetivo de ampliación alta (≥40×) para este paso para minimizar el error. - Capture una imagen de mosaico de alta magnificación (40×), alta resolución (~ 0.2 μm × tamaño de píxel de 0.2 μm), de una sola rebanada Z de toda el área de gel. Esto se utilizará como la imagen de referencia para el análisis posterior al procesamiento. Se recomienda capturar una sola imagen Z-sliceen el centro del espesor del gel (mediante el uso de Zo de Eq. 1),esto permitirá el retorno a aproximadamente la misma posición Zdespués del estiramiento. Además, tenga en cuenta que las imágenes de baldosas de alta resolución de toda el área de gel toman un tiempo considerable (~ 20-30 min).
- Ahora el ejemplo está listo para el estiramiento estático. Ajuste el servomotor a la magnitud de estiramiento deseada avanzando un grado (Figura 8C) a la vez en la GUI (realice esto lentamente, aproximadamente 1 grado / segundo).
- Asegúrese de que el servomotor esté en su posición cero haciendo clic en el botón Ir a cero servo pos (haga clic en la Figura 8A y asegúrese de que la Figura 8B muestre cero) y conéctelo al dispositivo de estiramiento como se ve en la Figura 6C.
- En cada magnitud de estiramiento donde se desee el análisis, capture una sola imagen de mosaico de alta resolución de Z-slice de toda el área de gel para el análisis posterior al procesamiento. Similar al paso 6.2, verifique que el gel no se haya desprendido de la silicona a lo largo de su circunferencia escaneando la interfaz entre el gel (rojo) y la silicona (fondo oscuro), buscando cambios en la adherencia de la magnitud de estiramiento anterior.
NOTA: Durante la activación del motor, utilice imágenes en vivo para seguir la ubicación del gel en X-Y (con ajustes de baja resolución y bajo aumento). El gel experimenta un efecto Z-Poissondonde la parte inferior del gel se eleva, por lo tanto, la posición Zdel microscopio también debe ajustarse al centro aproximado del espesor del gel para cada magnitud de estiramiento. Esto se puede lograr recalculando Zo (Eq. 1) para cada magnitud de estiramiento. Dado que el estiramiento en la dirección Zes relativamente homogéneo, no es crítico encontrar la profundidad central exacta del gel.
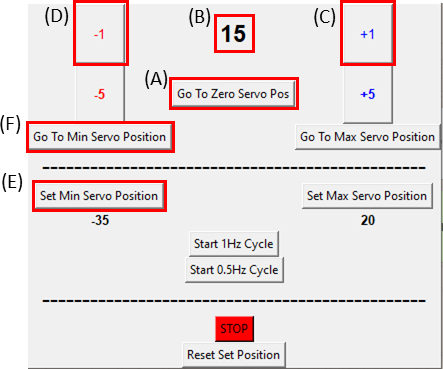
Figura 8: GUI para el módulo de control SCyUS. (A) Posición del motor en grados. El valor oscila entre -90° y 90°(B)'Set Minimum Servo Position'. Este botón permite una posición mínima preestrada, para establecer una nueva posición de referencia que es diferente de la posición servo cero (C) 'Más 1 °' botón mueve el servomotor de un grado en el sentido de las agujas del reloj (D) 'Menos 1 °' botón mueve el servomotor de un grado en sentido contrario a las agujas del reloj (E) 'Ir a la posición cero' botón establece la posición del servomotor a 0 ° ([A] se establecerá en cero) (F) 'Ir a la posición mínima servo' mueve el servomotor a la posición 'Min' definida por el usuario. Haga clic aquí para ver una versión más amplia de esta figura.
8. Mediciones de deformación externa posteriores al procesamiento
- Para medir las deformaciones efectivas de los límites de corte, mida las longitudes de borde a borde en la dirección de estiramiento ( ejeX)en el centro del eje Y(Figura 9A).
- Cargue la imagen pre-estirada en el software de procesamiento de imágenes (ImageJ FIJI43) y mida la distancia de borde a borde más grande que se define como la longitud axial del agujero (
 ) en el centro.
) en el centro. - Defina la distancia más grande de arriba a abajo como la distancia perpendicular (
 ).
). - Repita este proceso para todas las imágenes de intervalo de estiramiento y calcule las distancias axiales
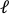 ( ) y perpendiculares ( ) de la
( ) y perpendiculares ( ) de la  periferia recortada ( Figura9A, inferior) y luego realice los siguientes cálculos para encontrar las deformaciones de los bordes recortados:
periferia recortada ( Figura9A, inferior) y luego realice los siguientes cálculos para encontrar las deformaciones de los bordes recortados:
- Cargue la imagen pre-estirada en el software de procesamiento de imágenes (ImageJ FIJI43) y mida la distancia de borde a borde más grande que se define como la longitud axial del agujero (
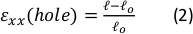

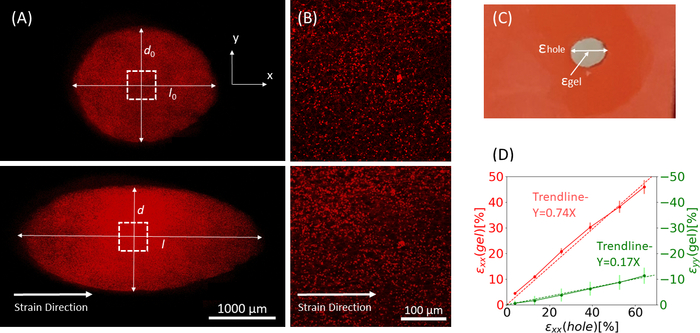
Figura 9: Cepas de gel debido al estiramiento externo de la tira de silicona. (A)Sección transversal X-Y de un gel de fibrina sin estirar (arriba), y después de la aplicación de εagujero = 64% de tensión a lo largo de la dirección x (inferior). El gel está incrustado con perlas fluorescentes. Las longitudes relevantes de d y l utilizadas para el cálculo delagujero ε se indican en las imágenes (B) Imágenes zoom-in de la zona cuadrada discontinua marcada en A (C) Ilustración de los tipos de deformación considerados en este estudio: εagujero es la deformación axial del recorte en su diámetro máximo, y εgel es la tensión axial en el centro del gel (medida por las ubicaciones de agregado de perlas) (D) Se encontró una relación lineal entre εagujero y εgel en dirección xx (línea roja) y dirección yy (línea verde). Esta cifra ha sido adaptada con permiso de Roitblat Riba et al.41Por favor, haga clic aquí para ver una versión más grande de esta figura.
9. Análisis de orientación de fibra
- Utilice la cuantificación de la alineación de la fibra para caracterizar la respuesta estructural del gel fibroso al aumento de las magnitudes de estiramiento. Cargue imágenes de alta resolución en el software ImageJ FIJI (NIH)43 y luego analice utilizando el módulo OrientationJ (EPFL)44 (Configuración: degradado gaussiano y ventana de 3 píxeles, Figura 10).
- Calcular el parámetro de orden nemático (NOP) 2D del histograma de orientación como:45
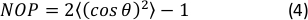
NOTA: Un valor de NOP = 1 indica una alineación perfecta a lo largo de la dirección axial (ángulo cero) y NOP = 0 indica isotropía. El ángulo de orientación, θ, es el ángulo de fibra en relación con el eje de deformación (eje x) obtenido a través del análisis de imágenes y definido con precisión en la documentación de OrientationJ. 44
- Calcular el parámetro de orden nemático (NOP) 2D del histograma de orientación como:45

Figura 10: Análisis de orientación de fibra utilizando el software FIJI ImageJ. (A) Menú principal de ImageJ con una flecha que indica la ubicación del menú desplegable 'Plugins' donde se puede encontrar 'OrientationJ'. En el menú extendido de 'OrientationJ', haga clic en la opción 'OrientationJ Distribution'(B)Módulo de distribución de OrientationJ. Establezca 'Ventana local σ' en 3 píxeles y 'Degradado' en 'Gaussian'. A continuación, pulse el botón 'Ejecutar' (flecha roja). Haga clic aquí para ver una versión más amplia de esta figura.
10. Análisis de deformación de gel interno manual
- Mientras se realizan imágenes en vivo de alto aumento de un hidrogel con perlas incrustadas, localice manualmente una región de interés (ROI) con características fácilmente reconocibles (por ejemplo, agregados de cuentas), para volver a la misma ubicación después de cada magnitud de estiramiento.
NOTA: La compresión en la dirección Z (efecto Poisson) puede conducir a un aumento en la densidad de perlas a medida que aumenta el estiramiento, por lo tanto, sugerimos elegir agregados de cuentas lo suficientemente grandes, por lo que son claramente identificables. Este protocolo requiere el análisis de la región central del gel de fibrina, aunque se puede elegir cualquier región. - En la posición previa al estiramiento (paso 6), capture una imagen Z-stackde alta resolución del ROI seleccionado. Después de cada intervalo de estiramiento deseado, vuelva al mismo ROI y repita el proceso de captura de imágenes.
- Tome las imágenes e impórtelos en ImageJ. En el ROI, registre la ubicación de píxeles X-Y de cada agregado de cuentas visibles. Transferir los datos registrados a una hoja de cálculo.
- Mida las distancias entre cada par de agregados y compárelos con las distancias de los mismos pares en la imagen de referencia, lo que permite el cálculo de deformaciones en las direcciones X e Y.
NOTA: Si se graba una película continua en tiempo real mientras se estira el gel (en lugar de la captura de imagen estática), se puede realizar un análisis automático de las cepas con métodos de correlaciones de imagen digital o de volumen (DIC/DVC), como se ha demostrado anteriormente46,47. Sin embargo, cabe señalar que el análisis automático DIC/DVC es un desafío en este ajuste, ya que la pila Zno solo se mueve en el plano X-Y, sino también en la dirección Zdebido al efecto Poisson (compresión), lo que representa derivas considerables durante la película grabada.
Access restricted. Please log in or start a trial to view this content.
Resultados
Los datos representativos del estiramiento estático de magnitudes crecientes aplicado a la tira de silicona portadora de un hidrogel de fibrina 3D, embebido con perlas fluorescentes de 1 μm, se muestran en la Figura 9. El análisis demuestra el efecto del estiramiento de silicona en los cambios geométricos del recorte, así como las cepas desarrolladas dentro del gel. Lasimágenes de pila Z de todo el gel se utilizan para evaluar la deformación del recorte original en f...
Access restricted. Please log in or start a trial to view this content.
Discusión
El método y el protocolo presentados aquí se basan en gran medida en nuestro estudio anterior de Roitblat Riba et al.41 Incluimos aquí el diseño completo asistido por computadora (CAD), Python y los códigos de microcontrolador del dispositivo SCyUS.
Las principales ventajas del método presentado sobre los enfoques existentes incluyen la posibilidad de colar hidrogeles 3D muy suaves (módulo elástico de ~ 100 Pa) desde su circunferencia, y bajo imágenes ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Algunas figuras incluidas aquí han sido adaptadas con permiso del Copyright Clearance Center: Springer Nature, Annals of Biomedical Engineering. Straining 3D hydrogels with uniform z-axis strains while enabling live microscopy imaging, A. Roitblat Riba, S. Natan, A. Kolel, H. Rushkin, O. Tchaicheeyan, A. Lesman, Copyright© (2019).
https://doi.org/10.1007/s10439-019-02426-7
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 546 carboxylic acid, succinimidyl ester | Invitrogen | A20002 | |
| Cell Medium (DMEM High Glucose) | Biological Industries | 01-052-1A | Add 10% FBS, 1% PNS, 1% L-Glutamine, 1% Sodium Pyruvate |
| Cover Slip #1.5 | Bar-Naor Ltd. | BN72204-30 | 22×40 mm |
| DIMETHYL SULPHOXIDE 99.5% GC DMSO | Sigma-Aldrich Inc. | D-5879-500 ML | |
| Dulbecco's Phosphate-Buffered Saline | Biological Industries | 02-023-1A | |
| EVICEL Fibrin Sealant (Human) | Omrix Biopharmaceuticals | 3902 | Fibrinogen: 70 mg/mL, Thrombin: 800-1200 IU/mL |
| Fibrinogen Buffer | N/A | Recipe for 1L: 7g NaCl, 2.94g trisodium citrate dihydrate, 9g glycine, 20g arginine hydrochloride & 0.15g calcium chloride dihydrate. Bring final volume to 1L with PuW (pH 7.0-7.2) | |
| Fluorescent micro-beads FluoSpheres (1 µm) | Invitrogen | F8820 | Orange (540/560) Provided as suspension (2% solids) in water plus 2 mM sodium azide |
| High-Temperature Silicone Rubber | McMaster-Carr | 3788T41 | 580 µm-thick E = 1.5 Mpa Poisson Ratio = 0.48 Tensile Strength = 4.8 MPa Upper limit of stretch = +300% engineering strain |
| HiTrap desalting column 5 mL (Sephadex G-25 packed) | GE Healthcare | 17-1408-01 | |
| HIVAC-G High Vacuum Sealing Compound | Shin-Etsu Chemical Co., Ltd. | HIVAC-G 100 | |
| ImageJ FIJI software39 | National Institute of Health, Bethesda, MD | Version 1.8.0_112 | |
| Microcontroller (Adruino Uno + Adafruit Motorshield v2.3) | Arduino/Adafruit | Arduino-DK001/Adafruit-1438 | |
| MicroVL 21R Centrifuge | Thermo Scientific | 75002470 | |
| Parafilm | Bemis | PM-996 | |
| Primovert Light Microscope | Carl Zeiss Suzhou Co., Ltd. | 491206-0011-000 | |
| SCyUS CAD (Solidworks) | Dassault Systèmes | N/A | |
| SCyUS Code37 | N/A | N/A | |
| Servomotor - TowerPro SG-5010 | Adafruit | 155 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | For 50 mL tubes |
| Sterile 10 cm non-culture plates | Corning | 430167 | |
| Thrombin buffer | N/A | Recipe for 1L: 20g mannitol, 8.77g NaCl, 2.72g sodium acetate trihydrate, 24 mL 25% Human Serum Albumin, 5.88g calcium chloride. Bring final volume to 1L with PuW (pH 7.0) | |
| Trypsin EDTA Solution B (0.25%), EDTA (0.05%) | Biological Industries | 03-052-1B | |
| USB Cable (Type B Male to Type A Male) | N/A | N/A | |
| Zeiss LSM 880 Confocal Microscope | Carl Zeiss AG | 2811000417 | |
| ZEN 2.3 SP1 FP3 (black) | Carl Zeiss AG | Release Version 14.0.0.0 |
Referencias
- Bleuel, J., Zaucke, V., Bruggemann, G. P., Niehoff, A. Effects of cyclic tensile strain on chondrocyte metabolism: a systematic review. PLoS ONE. 10, 0119816(2015).
- Pennisi, C. P., Olesen, C. G., de Zee, M., Rasmussen, J., Zachar, V. Uniaxial cyclic strain drives assembly and differentiation of skeletal myocytes. Tissue Engineering Part A. 17, 2543-2550 (2011).
- Grodzinsky, A. J., Levenston, M. E., Jin, M., Frank, E. H. Cartilage Tissue Remodeling in Response to Mechanical Forces. Annual Review of Biomedical Engineering. 2 (1), 691-713 (2000).
- Munster, S., et al. Strain history dependence of the nonlinear stress response of fibrin and collagen networks. Proceedings of the National Academy of Sciences of the USA. 110, 12197-12202 (2013).
- Vader, D., Kabla, A., Weitz, D., Mahadevan, L. Strain-induced alignment in collagen gels. PLoS ONE. 4, 5902(2009).
- Badylak, S. F. The extracellular matrix as a scaffold for tissue reconstruction. Seminars in Cell & Developmental Biology. 13 (5), 377-383 (2002).
- Natan, S., Koren, Y., Shelah, O., Goren, S., Lesman, A. Molecular Biology of the Cell. 31 (14), 1474-1485 (2020).
- Ban, E., et al. Mechanisms of Plastic Deformation in Collagen Networks Induced by Cellular Forces. Biophysical Journal. 114 (2), 450-461 (2018).
- Kim, J., et al. Stress-induced plasticity of dynamic collagen networks. Nature Communications. 8, 842(2017).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Basu, A., Janmey, P. A., Yodh, A. G. Non-affine deformations in polymer hydrogels. Soft Matter. 8, 8039-8049 (2012).
- Muiznieks, L. D., Keeley, F. W. Molecular assembly and mechanical properties of the extracellular matrix: A fibrous protein perspective. Biochimica et Biophysica Acta. 1832, 866-875 (2012).
- Brown, A. E. X., Litvinov, R. I., Discher, D. E., Purohit, P. K., Weisel, J. W. Multiscale mechanics of fibrin polymer: gel stretching with protein unfolding and loss of water. Science. 325, 741-744 (2009).
- Carroll, S. F., Buckley, C. T., Kelly, D. J. Cyclic tensile strain can play a role in directing both intramembranous and endochondral ossification of mesenchymal stem cells. Frontiers in Bioengineering and Biotechnology. 5, 73(2017).
- Livne, A., Bouchbinder, E., Geiger, B. Cell reorientation under cyclic stretching. Nature Communications. 5, 3938(2014).
- Wang, L., et al. Patterning cellular alignment through stretching hydrogels with programmable strain gradients. ACS Applied Materials & Interfaces. 7, 15088-15097 (2015).
- Xu, G. K., Feng, X. Q., Gao, H. Orientations of Cells on Compliant Substrates under Biaxial Stretches: A Theoretical Study. Biophysical Journal. 114 (3), 701-710 (2017).
- Chagnon-Lessard, S., Jean-Ruel, H., Godin, M., Pelling, A. E. Cellular orientation is guided by strain gradients. Integrative Biology (United Kingdom). 9 (7), 607-618 (2013).
- Lu, J., et al. Cell orientation gradients on an inverse opal substrate. ACS Applied Materials & Interfaces. 7 (19), 10091-10095 (2015).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125, 3015-3024 (2012).
- Bono, N., et al. Unraveling the role of mechanical stimulation on smooth muscle cells: a comparative study between 2D and 3D models. Biotechnology and Bioengineering. 113, 2254-2263 (2016).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8, 839-845 (2007).
- Riehl, B. D., Park, J. H., Kwon, I. K., Lim, J. Y. Mechanical stretching for tissue engineering: two-dimensional and three-dimensional constructs. Tissue Engineering Part B: Reviews. 18, 288-300 (2012).
- Flexcell. Linear Tissue Train Culture Plate. Flexcell. , (2019).
- Flexcell. Tissue Train. Flexcell. , (2019).
- CellScale. MCT6 Stretcher. CellScale. , (2019).
- STREX. STB-150. STREX. , (2019).
- STREX. Stretch Chambers. STREX. , (2019).
- Kamble, H., Barton, M. J., Jun, M., Park, S., Nguyen, N. T. Cell stretching devices as research tools: engineering and biological considerations. Lab on a Chip. 16, 3193-3203 (2016).
- Weidenhamer, N. K., Tranquillo, R. T. Influence of cyclic mechanical stretch and tissue constraints on cellular and collagen alignment in fibroblast-derived cell sheets. Tissue Engineering Part C: Methods. 19, 386-395 (2013).
- Yung, Y. C., Vandenburgh, H., Mooney, D. J. Cellular strain assessment tool (CSAT): precision-controlled cyclic uniaxial tensile loading. Journal of Biomechanics. 42, 178-182 (2009).
- Chen, K., et al. Role of boundary conditions in determining cell alignment in response to stretch. Proceedings of the National Academy of Sciences of the USA. 115, 986-991 (2018).
- Heher, P., et al. A novel bioreactor for the generation of highly aligned 3D skeletal muscle-like constructs through orientation of fibrin via application of static strain. Acta Biomaterialia. 24, 251-265 (2015).
- Foolen, J., Deshpande, V. S., Kanters, F. M. W., Baaijens, F. P. T. The influence of matrix integrity on stress-fiber remodeling in 3D. Biomaterials. 33, 7508-7518 (2012).
- Walker, M., Godin, M., Pelling, A. E. A vacuum-actuated microtissue stretcher for long-term exposure to oscillatory strain within a 3D matrix. Biomedical Microdevices. 20, 43(2018).
- Zhao, R. G., Boudou, T., Wang, W. G., Chen, C. S., Reich, D. H. Decoupling cell and matrix mechanics in engineered microtissues using magnetically actuated microcantilevers. Advanced Materials. 25, 1699-1705 (2013).
- Li, Y. H., et al. Magnetically actuated cell-laden micro-scale hydrogels for probing strain-induced cell responses in three dimensions. NPG Asia Materials. 8, 238(2016).
- Li, Y. H., et al. An approach to quantifying 3D responses of cells to extreme strain. Scientific Reports. 6, 19550(2016).
- Humphrey, J. D., et al. A theoretically-motivated biaxial tissue culture system with intravital microscopy. Biomechanics and Modeling in Mechanobiology. 7, 323-334 (2008).
- Niklason, L. E., et al. Enabling tools for engineering collagenous tissues integrating bioreactors, intravital imaging, and biomechanical modeling. Proceedings of the National Academy of Sciences of the USA. 107, 3335-3339 (2010).
- Roitblat Riba, A., et al. Straining 3D hydrogels with uniform z-axis strains while enabling live microscopy imaging. Annals of Biomedical Engineering. , (2019).
- Gomez, D., Natan, S., Shokef, Y., Lesman, A. Mechanical interaction between cells facilitates molecular transport. Advanced Biosystems. 3 (12), 1900192(2019).
- Schindelin, J., et al. Fiji: an open- source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- EPFL Switzerland. OrientationJ plug in. EPFL Switzerland. , (2019).
- Goren, S., Koren, Y., Xu, X., Lesman, A. Elastic anisotropy governs the decay of cell-induced displacements. Biophysical Journal. 118 (5), 1152-1164 (2019).
- Notbohm, J., Lesman, A., Tirrell, D. A., Ravichandran, G. Quantifying cell-induced matrix deformation in three dimensions based on imaging matrix fibers. Integrative Biology. 7 (10), 1186-1195 (2015).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. Journal of Cell Biology. 205 (2), 155-162 (2014).
- Cha, C. Y., et al. Tailoring Hydrogel Adhesion to Polydimethylsiloxane Substrates Using Polysaccharide Glue. Angewandte Chemie International Edition. 52, 6949-6952 (2019).
- Wirthl, D., et al. Instant tough bonding of hydrogels for soft machines and electronics. Science Advances. 3, (2017).
- Juarez-Moreno, J. A., Avila-Ortega, A., Oliva, A. I., Aviles, F., Cauich-Rodriguez, J. V. Effect of wettability and surface roughness on the adhesion properties of collagen on PDMS films treated by capacitively coupled oxygen plasma. Applied Surface Science. 349, 763-773 (2015).
- Kim, H. T., Jeong, O. C. PDMS surface modification using atmospheric pressure plasma. Microelectronic Engineering. 88, 2281-2285 (2011).
- Prasad, B. R., et al. Controlling cellular activity by manipulating silicone surface roughness. Colloids and Surfaces. 78, 237-242 (2010).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados