È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Ceppo controllato di idrogel 3D in imaging a microscopia dal vivo
In questo articolo
Riepilogo
Il metodo presentato prevede lo stiramento uniassiale di idrogel morbidi 3D incorporati nella gomma siliconica, consentendo al contempo la microscopia confocale viva. Vengono dimostrate la caratterizzazione dei ceppi idrogel esterni e interni e l'allineamento delle fibre. Il dispositivo e il protocollo sviluppati possono valutare la risposta delle cellule a vari regimi di deformazione.
Abstract
Le forze esterne sono un fattore importante nella formazione, nello sviluppo e nella manutenzione dei tessuti. Gli effetti di queste forze sono spesso studiati utilizzando metodi specializzati di stretching in vitro. Vari sistemi disponibili utilizzano barelle basate su substrato 2D, mentre l'accessibilità delle tecniche 3D per filtrare gli idrogel morbidi è più limitata. Qui descriviamo un metodo che consente lo stiramento esterno di idrogel morbidi dalla loro circonferenza, utilizzando una striscia elastica in silicone come portacampcampo. Il sistema di stretching utilizzato in questo protocollo è costruito con parti stampate in 3D ed elettronica a basso costo, rendendolo semplice e facile da replicare in altri laboratori. Il processo sperimentale inizia con idrogel di fibrina morbida spessi (>100 μm) (modulo elastico di ~ 100 Pa) in un ritaglio al centro di una striscia di silicone. I costrutti in silicone-gel vengono quindi attaccati al dispositivo di stiramento stampato e posizionati sullo stadio del microscopio confocale. Sotto microscopia dal vivo viene attivato il dispositivo di allungamento e i gel vengono immagini a varie grandezze di allungamento. L'elaborazione delle immagini viene quindi utilizzata per quantificare le deformazioni del gel risultanti, dimostrando ceppi relativamente omogenei e allineamento delle fibre attraverso lo spessore 3D del gel (asseZ). I vantaggi di questo metodo includono la capacità di filtrare idrogel estremamente morbidi in 3D durante l'esecuzione della microscopia in situ e la libertà di manipolare la geometria e le dimensioni del campione in base alle esigenze dell'utente. Inoltre, con un adeguato adattamento, questo metodo può essere utilizzato per allungare altri tipi di idrogel (ad esempio collagene, poliacrilammide o polietilene glicole) e può consentire l'analisi delle cellule e la risposta dei tessuti alle forze esterne in condizioni 3D più biomimetiche.
Introduzione
La risposta dei tessuti alle forze meccaniche è parte integrante di una vasta gamma di funzioni biologiche, tra cui l'espressione genica1,ladifferenziazione cellulare 2e il rimodellamento deitessuti 3. Inoltre, i cambiamenti indotti dalla forza nella matrice extracellulare (ECM) come l'allineamento e la densificazione delle fibre possono influire sul comportamento cellulare e sullaformazione dei tessuti 4,5,6. La struttura in rete fibrosa dell'ECM ha intriganti proprietà meccaniche, come elasticità non lineare, deformazione non affini e deformazioni plastiche7,8,9,10,11,12. Queste proprietà hanno un impatto sul modo in cui le cellule e il microambiente circostante rispondono alleforze meccaniche esterne 13,14. Comprendere come l'ECM e i tessuti rispondono alle forze meccaniche consentirà di progredire nel campo dell'ingegneria tissutale e nello sviluppo di modelli computazionali e teorici più accurati.
I metodi più comuni per allungare meccanicamente i campioni si sono concentrati su substrati 2D carichi di cellule per esplorare gli effetti sul comportamento cellulare. Questi includono, ad esempio, l'applicazione di deformazione ai substrati di polidimetilsilossano (PDMS) e l'analisi degli angoli di riorientamento cellulare in relazione alla direzione diallungamento 15,16,17,18,19. Tuttavia, i metodi che studiano la risposta degli idrogel incorporati in cellule 3D all'allungamento esterno, una situazione che imita più da vicino il microambiente tissutale, sono più limitati. I progressi verso i metodi di stretching 3D sono di particolare importanza perché le cellule si comportano in modo diverso sui substrati 2D rispetto alle matrici 3D20. Questi comportamenti includono riallineamento cellulare, livelli di espressione proteica e modellidi migrazione 21,22,23.
I metodi e i dispositivi che consentono lo stretching del campione 3D includono sia quelli disponibili in commercio24,25,26,27,28 e quelli sviluppati per la ricerca di laboratorio29. Questi metodi utilizzano tubi in silicone distensibili30,camere multi-pozzo31,morsetti26,32,bioreattori11,33,slittenti34,35,36e magneti37,38. Alcune tecniche generano allungamento che deforma localmente gli idrogel 3D, ad esempio tirando aghi da due singoli punti nel gel5, mentrealtre consentono la deformazione dell'intera massa del gel16. Inoltre, la maggior parte di questi sistemi si concentra sull'analisi del campo di deformazione nel piano X-Y, con informazioni limitate sul campo di deformazione nella direzione Z. Inoltre, solo una manciata di questi dispositivi è in grado di imaging microscopico in situ. La sfida principale con l'imaging ad alto ingrandimento in situ (ad esempio, microscopio confocale) è la limitata distanza di lavoro di poche centinaia di micron dalla lente oggettiva al campione. I dispositivi che consentono l'imaging dal vivo durante l'allungamento sacrificano l'uniformità dello sforzo nell'asse Zo sono relativamente complessi e difficili da riprodurre in altri laboratori39,40.
Questo approccio all'allungamento degli idrogel 3D consente un ceppo uniassiale statico o ciclico durante la microscopia confocale viva. Il dispositivo di stretching (indicato come "Smart Cyclic Uniaxial Stretcher – SCyUS") è costruito utilizzando parti stampate in 3D e hardware a basso costo, consentendo una facile riproduzione in altri laboratori. Attaccato al dispositivo è una gomma siliconica disponibile in commercio con un ritaglio geometrico al centro. I componenti dell'idrogel sono polimerizzati per riempire il ritaglio. Durante la polimerizzazione, gli idrogel biologici, come la fibrina o il collagene, aderiscono naturalmente alle pareti interne del cut-out. Utilizzando lo SCyUS, la striscia di silicone viene allungata in modo iniessiale, trasferendo ceppi controllati all'idrogel 3Dincorporato 41.
Questo sistema consente una combinazione unica di funzionalità e vantaggi rispetto ad altri metodi esistenti. In primo luogo, il sistema consente lo stiramento uniassiale di idrogel morbidi 3D spessi (>100 μm di spessore, rigidità <1 kPa) dalla loro periferia, con deformazione omogenea Zin tutto l'idrogel. Questi idrogel sono troppo morbidi per essere afferrati e allungati dalle tecniche di trazione convenzionali. In secondo luogo, il dispositivo di stretching può essere facilmente replicato in altri laboratori poiché la stampa 3D è prontamente disponibile per i ricercatori e l'elettronica utilizzata nel design è a basso costo. In terzo luogo, e forse la caratteristica più attraente, la geometria e le dimensioni del ritaglio nella striscia di silicone possono essere facilmente manipolate, consentendo gradienti di deformazione tonnibili e condizioni limite, nonché l'uso di una varietà di volumi di campioni, fino a pochi microlitri.
Il protocollo presentato consiste nello stampaggio del gel di fibrina in dischi di circa 2 mm di diametro in strisce di gomma siliconica spesse 0,5 mm procedenti per tratto uniassiale sotto microscopia confocale viva. Di seguito vengono discusse in dettaglio le procedure sperimentali per misurare e analizzare i ceppi che agiscono sul ritaglio geometrico, i ceppi interni sviluppati nell'idrogel, nonché il conseguente allineamento delle fibre dopo varie manipolazioni elastiche. Infine, viene discussa la possibilità di incorporare cellule nell'idrogel ed esporle a un tratto esterno controllato.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Preparazione della soluzione (da eseguire in anticipo)
- Etichettatura fibrinogena
NOTA: La fase di etichettatura è necessaria solo se si desidera analizzare la deformazione del gel di fibrina. Per gli esperimenti cellulari, è possibile utilizzare un gel senza etichetta.- Aggiungere 38 μL di colorante fluorescente succinimidil estere da 10 mg/ml (sciolto in DMSO) a 1,5 ml di soluzione di fibrinogeno da 15 mg/ml (rapporto molare di 5:1) in un tubo di centrifuga da 50 ml e posizionare su uno shaker per 1 ora a temperatura ambiente. Successivamente, posizionare il tubo nella centrifuga per 3 minuti a 800 x g (temperatura ambiente).
- Filtrare il supernatante dal passaggio precedente attraverso una colonna di dissalezione imballata con resina gel dextran(Table of Materials)per separare il colorante non reatto,42 seguendo questi passaggi.
- Prelavare la colonna con 25 mL di tampone di fibrinogeno.
- Iniettare lentamente il fibrinogeno etichettato dal passaggio 1.1.1 nella colonna, assicurandosi che non vi siano bolle che entrano nel filtro. Scartare i primi ~0,3 mL di soluzione eluita (4-6 gocce di liquido di colore debole). Quindi raccogliere i seguenti 1,0-1,5 mL di soluzione purificata (seguire il protocollo del produttore per dettagli più specifici).
- Completare il processo di filtrazione sterilizzando la soluzione purificata risultante utilizzando un filtro a siringa (0,22-0,45 μm).
- Per pulire e riciclare la colonna, lavare con 20 mL di tampone di fibrinogeno, quindi conservare in 25 mL di 20% di etanolo.
- Dopo l'eluizione, dividere il risultante purificato etichettato-fibrinogeno in piccole aliquote di ~7-50 μL, a seconda del numero desiderato di gel allungati. Per ogni gel circolare di 2 mm di diametro allungato, preparare circa 3,5 μL di fibrinogeno (2,5 μL saranno utilizzati per gel + 1 μL per errori di pipettazione).
- Conservare le aliquote in un congelatore a -20 °C. Possono essere utilizzati fino a circa un anno (non è consigliabile scongelarsi e congelare di nuovo).
- Per il resto di questo protocollo, conservare circa 7 μL del fibrinogeno purificato etichettato in frigorifero (4 °C) fino al passaggio 4. Questo volume è destinato alla creazione di due gel allungati (sono necessari 2,5 μL per gel e un volume aggiuntivo di 1 μL viene utilizzato per tenere conto degli errori nella preparazione del campione).
NOTA: Questa procedura di filtraggio in genere diluisce la soluzione iniziale di fibrinogeno da 15 mg/mL ad una concentrazione finale di circa 10 mg/mL. Il fattore di diluizione dipende dal volume iniziale e dalla concentrazione di fibrinogeno, come specificato nel protocollo del produttore.
- Preparare 7 μL di soluzione di trombina (diluire utilizzando tampone di trombina a 2 unità/mL, tabella dei materiali)e conservare in frigorifero (4 °C) fino al passaggio 4. Questo volume ha lo scopo di riempire i ritagli di due gel allungati.
NOTA: Per eseguire l'analisi interna della deformazione, alla soluzione di trombina devono essere aggiunte perline sferiche fluorescenti di 1 μm di diametro (acquistate come sospensione [2% solidi] in acqua più 2 mM NaN3) (si raccomanda un rapporto di 1:25 v/v % di perline:trombina per un obiettivo 40x). Le perline devono essere incluse solo quando si desidera misurazioni interne dello sforzo, in presenza o assenza di cellule.
2. Preparazione striscia di silicone
- Recuperare la gomma siliconica spessa 0,5 mm e tagliarla in strisce da 15 x 80 mm2 con un foro di 2 mm di diametro al centro del nastro(Figura 1). Se possibile, utilizzare una fresa laser programmabile per un'alta precisione. Se non sono disponibili macchinari programmabili, le forbici sono sufficienti per tagliare il contorno della striscia e un piccolo foro è adeguato per il taglio centrale.
NOTA: La gomma siliconica commerciale viene solitamente acquistata con involucro di plastica su entrambi i lati. Mantenere il rivestimento in plastica originale su entrambi i lati del silicone, se possibile. Se riutilizzi le strisce di silicone di un esperimento precedente, trattarle con tripside per 0,5 ore, immergere in NaOH da 0,2 M per 0,5 ore e quindi immergere il 70% di etanolo per 1 ora. Lasciarli asciugare prima dell'uso. - Preparare strati di pellicola di tenuta (idrofobica) con dimensioni di almeno 20 × 30 mm2,in modo che siano più larghi della striscia di silicone e quindi consentano la forma di una guarnizione su tutto il ritaglio geometrico.
- Lavare un piatto da 10 cm con etanolo al 70%, quindi pulire e asciugare con salviette delicate non linting (per esperimenti sterili e non sterili). Questo passaggio è importante poiché consente agli strati del film di tenuta di attenersi meglio alla piastra e limitare il movimento del campione durante il processo di preparazione.
- Posizionare gli strati del film di tenuta nel piatto lavato di 10 cm in modo che ci sia abbastanza spazio per posizionare due strisce in ogni piatto fianco a fianco(Figura 2A).
- Rimuovere l'involucro di plastica da un lato della striscia di silicone e posizionare il lato esposto sullo strato del film di tenuta in modo che il ritaglio sia circondato interamente dallo strato della pellicola di tenuta(Figura 2B). Quindi, premere delicatamente sul silicone contro lo strato del film di tenuta per sigillare l'area che circonda il ritaglio, utilizzando dita guantate pulite.
NOTA: Assicurarsi che non ci siano sacche d'aria tra il silicone e il film di tenuta, specialmente intorno al ritaglio. A tale fine, esaminare il lato inferiore del piatto (Figura 2C).
- Rimuovere l'involucro di plastica da un lato della striscia di silicone e posizionare il lato esposto sullo strato del film di tenuta in modo che il ritaglio sia circondato interamente dallo strato della pellicola di tenuta(Figura 2B). Quindi, premere delicatamente sul silicone contro lo strato del film di tenuta per sigillare l'area che circonda il ritaglio, utilizzando dita guantate pulite.
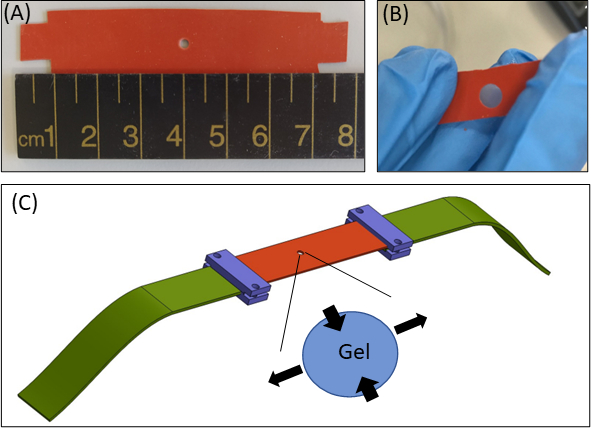
Figura 1: Approccio di deformazione dell'idrogel. (A) 15 × nastro silicone da 80 mm2 con un ritaglio di 2 mm di diametro al centro delnastro (B)Una striscia di silicone con ritaglio circolare con gel di fibrina incorporato. A scopo illustrativo, il ritaglio nel silicone è più grande rispetto agli esperimenti reali (C) Schematico dell'approccio di stiramento con la striscia di silicone (arancione), gel circolare (ritaglio al centro) ed estensori in tessuto (verde) che collegano il silicone al dispositivo di stretching. L'area allargata del gel indica la deformazione del gel, in risposta allo stiramento uniassiale del silicone. Per semplicità, la compressione lungo lo spessore del gel(asse Z)non viene visualizzata nell'illustrazione. Le figure 1B & 1C sono state adattateda Roitblat Riba et al.

Figura 2: Esempio di corretto posizionamento di una striscia di silicone su uno strato di pellicola di tenuta prima della polimerizzazione del gel. (A) Posizionamento di due strati di pellicola sigillante in una piastra di 10 cm (B) Posizionamento di strisce di silicone sugli strati di pellicola di tenuta (C) Vista inferiore della piastra, con la tenuta d'aria tra il silicone e lo strato del film di tenuta. Asinistra: Corretta tenuta dello strato del film di tenuta alla striscia di silicone intorno al ritaglio senza sacche d'aria. Destra:Tenuta impropria dello strato del film di tenuta alla striscia di silicone ritaglia con sacche d'aria intorno al bordo del ritaglio. Ciò porterà alla perdita dei componenti dell'idrogel sotto il silicone. Freccia rossa indica un'area in cui si è formata una tasca d'aria. Clicca qui per visualizzare una versione più grande di questa figura.
3. Preparazione della trombina con le cellule
NOTA: Eseguire questo passaggio solo se si desidera incorporare cellule nell'idrogel e in condizioni sterili in una cappa biologica (Table of Materials).
- Sterilizzazione: il giorno prima dell'esperimento cellulare, posizionare le strisce di silicone e sigillare gli strati del film in etanolo al 70% durante la notte e quindi eseguire la sterilizzazione UV per 30 minuti su ciascun lato (se i piatti da 10 cm non sono già sterili, dovrebbero anche essere sterilizzati sotto la luce UV per 30 minuti dopo un lavaggio a etanolo al 70%). Il sistema UV utilizzato nel protocollo è quello integrato nel cofano biologico.
NOTA: In alternativa, un ciclo di sterilizzazione in autoclave (140 °C) può essere eseguito sulle strisce di silicone poiché sono resistenti fino a 260 °C. - Eseguire un conteggio delle cellule per determinare la concentrazione cellulare, quindi centrifugare e sospendere di nuovo il pellet di cella con 7 μL di trombina (2 unità/ml) in un tubo di centrifuga da 1,5 ml. Si consiglia una concentrazione cellulare di 800 cellule/μL di trombina. Mantenere le cellule refrigerate fino all'uso (non superare più di mezz'ora per evitare di danneggiare le cellule).
4. Polimerizzazione dei gel di fibrina
- Recuperare le soluzioni di trombina e 10 mg/mL di trombina 2 Unità/mL etichettate-fibrinogeno dal frigorifero (preparate al passaggio 1) e posizionarle sul ghiaccio dove saranno accessibili.
NOTA: Le soluzioni vengono mantenute fredde prima del processo di miscelazione al fine di rallentare la cinetica di reazione di polimerizzazione. Ciò consente una miscelazione più omogenea delle proteine. - Con il piatto o i piatti impostati (fase 2), estrarre 2,5 μL di fibrinogeno etichettato e pipettarlo uniformemente nel ritaglio di silicone (con lo strato di pellicola di tenuta attaccato al lato inferiore) in modo che l'intera circonferenza del ritaglio sia a contatto con il fibrinogeno. Fare attenzione a non permettere che eventuali sacche d'aria o bolle si formeranno in qualsiasi punto della soluzione, prestando particolare attenzione ai bordi inferiori del ritaglio (l'interfaccia tra lo strato del film di tenuta e il silicone).
- Prendere immediatamente 2,5 μL di trombina (con o senza cellule/perline) e pipettarla direttamente nella soluzione di fibrinogeno nel ritaglio (raggiungendo il volume finale di 5 μL di fibrina). Quindi mescolare rapidamente le due soluzioni con pipettando con cura su e giù ~ 10 volte. Durante il processo di miscelazione, spostare la punta intorno all'intero volume per creare una soluzione il più omogenea possibile.
- Aggiungere una quantità molto piccola di phosphate buffer saline (PBS) [in alternativa mezzo cellulare per esperimenti cellulari, Tabella dei materiali] lungo il bordo di ogni piatto in modo che l'idrogel non si asciughi durante il processo di polimerizzazione. Assicurarsi che non vi sia alcun contatto tra il PBS/supporto cellulare e i campioni in quanto ciò danneggerà il campione.
- Coprire il piatto o gli es e metterli nell'incubatrice a 37 °C per 30 minuti.
NOTA: Il tempo di incubazione richiesto dipende dal volume del gel. Se vengono utilizzati volumi maggiori, il tempo di incubazione dovrebbe aumentare. - Rimuovere il piatto o gli es dall'incubatore e aggiungere PBS / supporto cellulare al piatto, immergendo l'intero costrutto gel-silicone.
- Sollevare con cura il campione costruisce uno alla volta dal piatto assicurandosi che lo strato del film di tenuta rimanga aderendo alla striscia. Staccare lentamente lo strato del film di tenuta dal silicone facendo delicatamente pipì da un'estremità all'altra del silicone (Figura 3). Evitare di estrarre da aree vicine al ritaglio in cui possono esistere concentrazioni di sollecitazione (questo è importante principalmente per le geometrie non circolari). Evitare qualsiasi contatto con il ritaglio in quanto danneggerà il campione.
- Riposizionare la striscia nel piatto con PBS / mezzo cellulare in modo che la striscia galleggia nel piatto. Quindi portare il piatto o i piatti al microscopio standard per la coltura cellulare per valutare qualitativamente le condizioni di ciascun campione. I gel devono essere uniformi, continui per tutto il ritaglio e non devono essere presenti bolle. Utilizzando la figura 4 come guida, selezionate i campioni migliori per ulteriori analisi.

Figura 3: Corretta rimozione dello strato di pellicola di tenuta dal fondo della striscia di silicone. Il processo di rimozione deve essere fatto lentamente in modo che l'idrogel non strappi o rompa la sua adesione con le pareti interne del ritaglio. La freccia bianca mostra la direzione di rimozione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Osservazione microscopica dei gel di fibrina nel ritaglio di silicone. (A) Due esempi di gel di fibrina adeguatamente polimerizzato. Si noti la relativa omogeneità del gel e la piena adesione ai bordi del cut-out (B) Due esempi di guasto della polimerizzazione del campione. Inalto: notare le numerose bolle e gli aggregati formati sul lato in basso a sinistra. Inbasso: notare lo strappo del gel dai bordi ritagliati e gli aggregati nella regione in basso a sinistra del ritaglio. Barra di scala = 300 μm Fare clic qui per visualizzare una versione più grande di questa figura.
5. Caricamento del campione sul dispositivo SCyUS
- Riempire il bagno con PBS/supporto cellulare (Figura 5) e posizionare la striscia di silicone che trasporta il gel campione sulla parte superiore in modo che le estremità siano sedute su ciascun lato del bagno. Il bagno ha lo scopo di evitare qualsiasi essiccazione del gel. Posizionare e stringere i morsetti (viola) insieme alle strisce di tessuto (verde) in modo che tutti i pezzi siano collegati per formare una striscia dritta con il ritaglio al centro(Figura 5).
- Recuperare il dispositivo SCyUS e fissare il pozzo liquido in alluminio e il coperchio rettangolare in vetro da 22 mm x 40 mm (n. 1 o 1.5)(Figura 6Aiii). Attaccare lo slittamento del coperchio sul fondo del pozzo utilizzando materiale di tenuta (ad esempio, grasso sottovuoto) in modo che il pozzo possa essere riempito con liquido senza perdite.
- Riempire il pozzo con ~1-2 mL di PBS/supporto cellulare e posizionare il costrutto strip + fabric + gel (Figura 6B) nel dispositivo. Fissare la striscia di tessuto (2) nella staffa (1) in modo che il cut-out + gel (5) sia al centro come mostrato, quindi posizionare con cura l'inserto pin-down (4) nel dispositivo e bloccarlo in posizione.
- Inserire quindi l'altro lato del tessuto nel mandrino (senza attaccare il servomotore) e bloccarlo nel mandrino (Figura 6C).
- Inserire il dispositivo SCyUS con il campione collegato nella fase del microscopio (Figura 6C). Collegare il microcontrollore( Table of Materials) al computer tramite un cavo USB e collegare il servomotore al microcontrollore. Aprire il modulo di controllo SCyUS nel computer. Il campione è ora pronto per l'imaging per verificare l'adeguatezza dello spessore del gel e dell'omogeneità delle fibre al microscopio confocale.
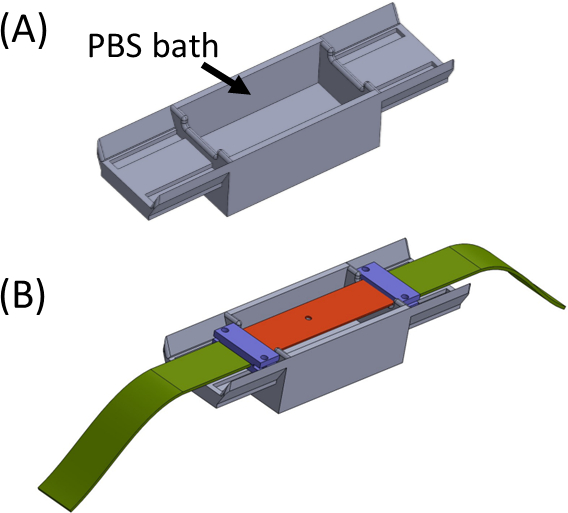
Figura 5: (A) Giga contenente un bagno PBS (stampato in 3D) (B) Posizionamento della striscia sulla giga per garantire un corretto attacco in linea delle staffe (in viola) ed evitare l'essiccazione del gel. Questa cifra è stata modificata con il permesso di Roitblat Riba etal.
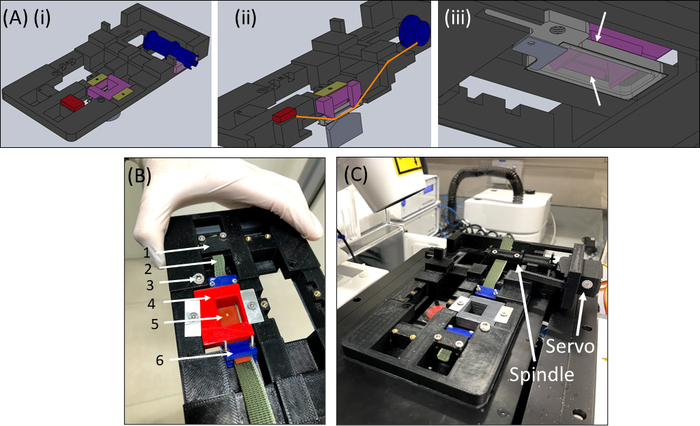
Figura 6: Dispositivo di stretching SCyUS. (A) Diverse viste di un modello CAD delle parti principali dello SCyUS: mandrino collegato al servo (blu), ancora statica (rosso), inserto che fissa la striscia di silicone verso il basso (viola) e fissatori che impediscono l'aumento dell'inserto (giallo-verde). Una vista dall'alto del sistema (Ai), una vista tagliata del sistema ( Aii ) che mostra il percorso della striscia (lineaarancione),e una vista inferiore(Aiii)del pozzo liquido in alluminio con una coverlip di vetro. Il pozzo liquido può essere spostato su e giù con il giro di una vite inserita nella filettatura principale. Il movimento verso l'alto del pozzo in alluminio è limitato dalle ali laterali dell'inserto viola, come dimostrano le freccebianche( B ) Il sistema attuale: (1) ancora statica (2) tessuto verde non allungabile (3) vite per il controllo dell'altezza del pozzo liquidoin alluminio( 4 ) inserto rosso pin-down (5) una striscia di silicone con un taglio circolare (6) morsetti di collegamento blu (C) Il sistema di allungamento posto su un microscopio confocale. Il servomotore e il mandrino sono mostrati con le frecce. Questa cifra è stata modificata con il permesso di Roitblat Riba etal.
6. Garantire un gel adeguato per il campionamento
- Utilizzando il microscopio confocale (Table of Materials) prendi uno Z-stack confocale a basso ingrandimento (10×), a bassa risoluzione (~ 1,4 μm x 1,4 μm di dimensioni in pixel) (≤10 Z-slice con una dimensione del passo di circa 10 μm è sufficiente) immagine di piastrelle dell'intero gel utilizzando laser di 488/543/561 per esaminare l'omogeneità e l'adesione alla circonferenza del ritaglio geometrico su tutto lo spessore del silicone(Figura 7A-B). Utilizzare questa immagine Z-stack come mappa per i passaggi seguenti.
- Utilizzando l'imaging dal vivo a bassa risoluzione, scansionare il gel e determinare la posizione Zpiù bassa in cui è evidente la piena adesione alle pareti interne del ritaglio senza strappi o bolle e notare la posizione Zdel microscopio (Zl). Per determinare la piena adesione del gel al silicone durante la sua circonferenza, scansionare l'interfaccia dell'etichetta fluorescente del gel e della striscia di silicone (sfondo scuro) al microscopio (Figura 7C).
- Spostarsi verso l'alto nella direzione Zfino a quando non c'è più continuità nel gel e notare laposizione Z (Zu):
- Sottrarre il limite superiore (Zu) della direzione Zdal limite inferiore (Zl). Questo è lo spessore di riferimento del campione (Zo):

Se Zo ≥ 100 μm, il gel è considerato soddisfacente per l'analisi. Si noti che lo spessore del ritaglio di silicone è di circa 500 μm, ma la polimerizzazione del gel nel ritaglio in genere si traduce in uno spessore del gel più piccolo. 100 μm è lo spessore minimo raccomandato per garantire un processo di stiramento stabile, senza strappi o distacco del gel dal ritaglio di silicone.
NOTA: In diverse posizioni XY, lo spessore del gel può variare. Questa sezione del protocollo misura lo spessore minimo del gel, permettendoci di determinare la qualità del gel e indicare se è sufficiente per lo stretching. Inoltre, trovare il centro del gel fornisce un punto di riferimento per tornare al post-stretching, sia statico che dinamico.

Figura 7: Omogeneità del gel. Le immagini delle piastrelle sono state catturate e cucite utilizzando il software al microscopio confocale (Table of Materials) (A) Un'immagine a sezione Zdi una piastrella cucita di un campione di gel di fibrina con densità di fibre relativamente disomogenea a causa di una trombina impropria e di una pre-polimerizzazione di miscelazione del fibrinogeno. Questo gel non fornirà un'analisi affidabile (B) Una singola piastrella cucita Z-slice immagine di un campione di gel di fibrina con densità di fibre relativamente omogenea. Questo è un gel accettabile per gli esperimenti di stretching. La barra di scala per le immagini A & B è di 200 μm (C) Zoom nell'interfaccia tra il gel etichettato fluorescentmente (rosso) e il silicone (sfondo nero). Barra di scala = 100 μm. Clicca qui per visualizzare una versione più grande di questa figura.
7. Funzionamento SCyUS, stretching e imaging
- Ora che il campione è stato determinato come di qualità soddisfacente ed è impostato correttamente sul dispositivo SCyUS, determinare la posizione pre-allungata del campione. Ciò si ottiene utilizzando l'imaging dal vivo al microscopio confocale (simile al passaggio 6.2).
- Assicurarsi che il servomotore si trova nella posizione zero facendo clic sul pulsante Vai a zero servo pos (fare clic sulla figura 8A e assicurarsi che la figura 8B non sia visualizzata) e collegarlo al dispositivo di allungamento come si vede nella figura 6C.
NOTA: Fare questo passaggio lentamente e con attenzione per non mettere alcuna tensione in eccesso sul campione. - Durante l'imaging del campione, spostare il motore di un grado (Figura 8C) alla volta in senso orario facendo clic sul pulsante +1 fino a quando non si osserva che il lato destro del ritaglio si sposta. Quindi, invertire il movimento (Figura 8D) nella penultima posizione del passo facendo clic sul pulsante -1. Ciò verifica che il campione sia sotto tensione minima. Fate clic sul pulsante Imposta posizione servo min (Set Min Servo Position) (Figura 8E) per impostare la posizione di riferimento. È possibile tornare alla posizione di riferimento in qualsiasi momento facendo clic sul pulsante Vai a posizione servo min(Figura 8F).
NOTA: si consiglia di utilizzare un obiettivo ad alto ingrandimento (≥40×) per questo passaggio per ridurre al minimo gli errori. - Cattura un'immagine di riquadro a sezione Z singola ad alto ingrandimento (40×), ad alta risoluzione (~0,2 μm × 0,2 μm di pixel). Questo verrà utilizzato come immagine di riferimento per l'analisi post-elaborazione. Si consiglia di acquisire una singola immagine z-sliceal centro dello spessore del gel (usando Z oda Eq. 1), questo consentirà il ritorno all'incirca nella stessa posizione Zdopo lo stiramento. Inoltre, prendi in considerazione che le immagini di piastrelle ad alta risoluzione dell'intera area del gel richiedere molto tempo (~ 20-30 minuti).
- Ora il campione è pronto per lo stretching statico. Regolare il servomotore alla magnitudine di allungamento desiderata avanzando di un grado(Figura 8C) alla volta nella GUI (eseguire questa funzione lentamente, circa 1 grado/secondo).
- Assicurarsi che il servomotore si trova nella posizione zero facendo clic sul pulsante Vai a zero servo pos (fare clic sulla figura 8A e assicurarsi che la figura 8B non sia visualizzata) e collegarlo al dispositivo di allungamento come si vede nella figura 6C.
- Ad ogni magnitudine di estensione in cui si desidera l'analisi, acquisire una singola immagine di riquadro ad alta risoluzione Z-slice dell'intera area gel per l'analisi di post-elaborazione. Analogamente al passaggio 6.2, verificare che il gel non si sia staccato dal silicone per tutta la sua circonferenza scansionando l'interfaccia tra il gel (rosso) e il silicone (sfondo scuro), alla ricerca di cambiamenti nell'adesione rispetto alla magnitudine del tratto precedente.
NOTA: Durante l'attivazione del motore, utilizzare l'imaging dal vivo per seguire la posizione del gel in X-Y (con impostazioni a bassa risoluzione e a basso ingrandimento). Il gel sperimenta un effetto Z-Poisson dove sale il fondo del gel, quindi la posizione Zdel microscopio dovrebbe anche essere regolata al centro approssimativo dello spessore del gel per ogni magnitudine di stiramento. Questo può essere ottenuto ricalcolando Zo (Eq. 1) per ogni magnitudine di tratto. Poiché l'allungamento nella direzione Zè relativamente omogeneo, non è fondamentale trovare l'esatta profondità centrale del gel.
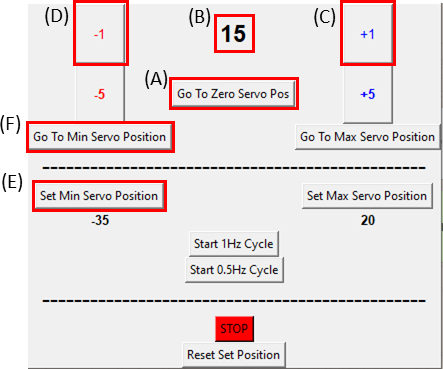
Figura 8: GUI per il modulo di controllo SCyUS. (A) Posizione del motore in gradi. Il valore varia da -90° a 90° (B) 'Imposta posizione minima servo'. Questo pulsante consente una posizione minima pre-impostata, per impostare una nuova posizione di riferimento diversa dal pulsante Zero Servo Position (C) 'Plus 1°' sposta il servomotore in senso orario ( D )'Meno1°' sposta il servomotore di un grado in senso antiorario (E) Il pulsante 'Vai a posizione zero' imposta la posizione servomotore su 0° ([A] sarà impostato su zero) (F) Il pulsante 'Vai alla posizione minima del servo' sposta il servomotore sulla posizione 'Min' definita dall'utente. Clicca qui per visualizzare una versione più grande di questa figura.
8. Misure di deformazione esterna post-elaborazione
- Per misurare i ceppi efficaci dei limiti di ritaglio, misurare le lunghezze da bordo a bordo nella direzione di allungamento(asse X)al centro dell'asse Y(Figura 9A).
- Caricare l'immagine pre-allungamento nel software di elaborazione delle immagini (ImageJ FIJI43) e misurare la distanza più grande da bordo a bordo definita come lunghezza assiale del foro (
 ) al centro.
) al centro. - Definire la distanza maggiore dall'alto verso il basso come distanza perpendicolare (
 ).
). - Ripetere questo processo per tutte le immagini dell'intervallo di allungamento
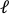 e calcolare le distanze assiali ( ) e perpendicolari ( ) della periferia
e calcolare le distanze assiali ( ) e perpendicolari ( ) della periferia  ritagliate ( Figura9A, in basso) e quindi eseguire i seguenti calcoli per trovare i ceppi dei bordi ritagliati:
ritagliate ( Figura9A, in basso) e quindi eseguire i seguenti calcoli per trovare i ceppi dei bordi ritagliati:
- Caricare l'immagine pre-allungamento nel software di elaborazione delle immagini (ImageJ FIJI43) e misurare la distanza più grande da bordo a bordo definita come lunghezza assiale del foro (
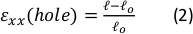

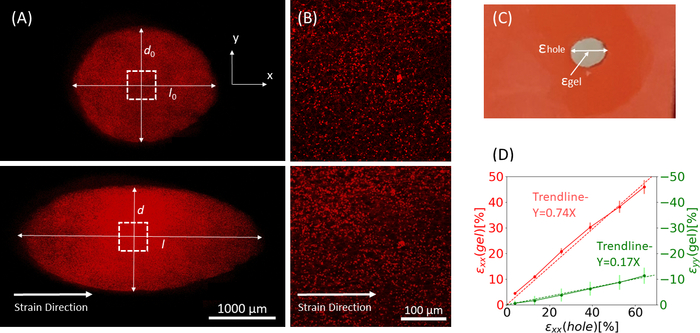
Figura 9: Ceppi di gel dovuti allo stiramento esterno della striscia di silicone. (A) Sezione trasversale X-Y di un gel di fibrina non allungato (in alto) e dopo l'applicazione di unforo di ε = deformazione del 64% lungo la direzione x (in basso). Il gel è incorporato con perline fluorescenti. Le lunghezze pertinenti di d e l utilizzate per il calcolo di ε un foro sono indicate nelle immagini (B) Immagini zoom-in dell'area quadrata tratteggiata contrassegnata in A (C) Illustrazione dei tipi di deformazione considerati nel presente studio: ε unforo è la deformazione assiale del ritaglio al suo diametro massimo, e ε gel è la tensione assiale al centro del gel (misurata dalle posizioni ε aggregate delle perline) (D) È stata trovata una relazione lineare tra unforo e ε un gel sia in direzione xx (linea rossa) che in direzione yy (linea verde). Questa cifra è stata adattata con il permesso di Roitblat Riba etal.
9. Analisi dell'orientamento della fibra
- Utilizzare la quantificazione dell'allineamento delle fibre per caratterizzare la risposta strutturale del gel fibroso all'aumento delle grandezze di elasticità. Caricare immagini ad alta risoluzione sul software ImageJ FIJI (NIH)43 e quindi analizzare utilizzando il modulo OrientationJ (EPFL)44 (Impostazioni: sfumatura gaussiana e finestra a 3 pixel, Figura 10).
- Calcolare il parametro 2D Nematic Order (NOP) dell'istogramma di orientamento come:45
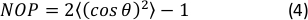
NOTA: Un valore di NOP = 1 indica un allineamento perfetto lungo la direzione assiale (angolo zero) e NOP = 0 indica isotropia. L'angolo di orientamento, θ, è l'angolo della fibra in relazione all'asse di deformazione (asse x) ottenuto attraverso l'analisi dell'immagine e definito con precisione nella documentazione orientationJ. 44 di cui: La commissione per la
- Calcolare il parametro 2D Nematic Order (NOP) dell'istogramma di orientamento come:45

Figura 10: Analisi dell'orientamento delle fibre utilizzando il software FIJI ImageJ. (A) Menu principale di ImageJ con una freccia che indica la posizione del menu a discesa 'Plugins' in cui è possibile trovare 'OrientationJ'. Nel menu esteso 'OrientamentoJ', fate clic sul modulo distribuzione dell'opzione 'Orientamento(OrientationJDistribution) ( B ) Orientamento (OrientationJ). Impostare 'Finestra locale σ' su 3 pixel e 'Sfumatura' su 'Gaussiano'. Quindi premere il pulsante 'Esegui' (freccia rossa). Clicca qui per visualizzare una versione più grande di questa figura.
10. Analisi manuale interna dello sforzo gel
- Durante l'esecuzione di immagini ad alto ingrandimento dal vivo di un idrogel con perline incorporate, individuare manualmente una regione di interesse (ROI) con caratteristiche facilmente riconoscibili (ad esempio, aggregati di perline), al fine di tornare nella stessa posizione dopo ogni magnitudine di allungamento.
NOTA: La compressione nella direzione Z (effetto Poisson) può portare ad un aumento della densità dei perline all'aumentare del tratto, quindi suggeriamo di scegliere aggregati di perline abbastanza grandi, quindi sono chiaramente identificabili. Questo protocollo richiede l'analisi della regione centrale del gel di fibrina, anche se qualsiasi regione può essere scelta. - Nella posizione di pre-allungamento (passaggio 6), acquisire un'immagine Z-stackad alta risoluzione del ROI selezionato. Dopo ogni intervallo di allungamento desiderato, torna allo stesso ROI e ripeti il processo di acquisizione dell'immagine.
- Prendi le immagini e importale in ImageJ. Nel ROI, registra la posizione dei pixel X-Y di ogni aggregato di perline visibile. Trasferire i dati registrati in un foglio di calcolo.
- Misurare le distanze tra ogni coppia di aggregati e confrontarle con le distanze delle stesse coppie nell'immagine di riferimento, permettendo il calcolo dei ceppi nelle direzioni X e Y.
NOTA: Se viene registrato un filmato continuo in tempo reale mentre il gel è allungato (invece dell'acquisizione statica dell'immagine), è possibile eseguire un'analisi automatica dei ceppi con metodi di correlazione digitale dell'immagine o del volume (DIC/DVC), comeprecedentemente dimostrato 46,47. Tuttavia, va notato che l'analisi automatica DIC/DVC è impegnativa in questa impostazione, poiché loZ -stack non si muove solo nel piano X-Y ma anche nella direzione Za causa dell'effetto Poisson (compressione), che rappresenta notevoli derive durante il film registrato.
Access restricted. Please log in or start a trial to view this content.
Risultati
I dati rappresentativi provenienti da un tratto statico di magnitudini crescenti applicato alla striscia di silicone che trasporta un idrogel di fibrina 3D, incorporato con perline fluorescenti da 1 μm, sono mostrati nella figura 9. L'analisi dimostra l'effetto dell'allungamento del silicone sui cambiamenti geometrici del cut-out e sui ceppi sviluppati all'interno del gel. Le immagini z-stackdell'intero gel vengono utilizzate per valutare la deformazione del ritaglio origi...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il metodo e il protocollo qui presentati si basano in gran parte sul nostro precedente studio di Roitblat Riba etal.
I principali vantaggi del metodo presentato rispetto agli approcci esistenti includono la possibilità di sforzare idrogel 3D molto morbidi (modulo elastico di ~ 100 Pa) dalla loro circonferenza e sotto imaging confocale dal vivo. Altri metodi sono solitamente limitati nella loro capacità di applicare campi di deformazione nell'ass...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Alcune figure incluse qui sono state adattate su autorizzazione del Copyright Clearance Center: Springer Nature, Annals of Biomedical Engineering. Sforzo idrogel 3D con ceppi uniformi dell'asse Z, consentendo al contempo l'imaging di microscopia dal vivo, A. Roitblat Riba, S. Natan, A. Kolel, H. Rushkin, O. Tchaicheeyan, A. Lesman, Copyright© (2019).
https://doi.org/10.1007/s10439-019-02426-7
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 546 carboxylic acid, succinimidyl ester | Invitrogen | A20002 | |
| Cell Medium (DMEM High Glucose) | Biological Industries | 01-052-1A | Add 10% FBS, 1% PNS, 1% L-Glutamine, 1% Sodium Pyruvate |
| Cover Slip #1.5 | Bar-Naor Ltd. | BN72204-30 | 22×40 mm |
| DIMETHYL SULPHOXIDE 99.5% GC DMSO | Sigma-Aldrich Inc. | D-5879-500 ML | |
| Dulbecco's Phosphate-Buffered Saline | Biological Industries | 02-023-1A | |
| EVICEL Fibrin Sealant (Human) | Omrix Biopharmaceuticals | 3902 | Fibrinogen: 70 mg/mL, Thrombin: 800-1200 IU/mL |
| Fibrinogen Buffer | N/A | Recipe for 1L: 7g NaCl, 2.94g trisodium citrate dihydrate, 9g glycine, 20g arginine hydrochloride & 0.15g calcium chloride dihydrate. Bring final volume to 1L with PuW (pH 7.0-7.2) | |
| Fluorescent micro-beads FluoSpheres (1 µm) | Invitrogen | F8820 | Orange (540/560) Provided as suspension (2% solids) in water plus 2 mM sodium azide |
| High-Temperature Silicone Rubber | McMaster-Carr | 3788T41 | 580 µm-thick E = 1.5 Mpa Poisson Ratio = 0.48 Tensile Strength = 4.8 MPa Upper limit of stretch = +300% engineering strain |
| HiTrap desalting column 5 mL (Sephadex G-25 packed) | GE Healthcare | 17-1408-01 | |
| HIVAC-G High Vacuum Sealing Compound | Shin-Etsu Chemical Co., Ltd. | HIVAC-G 100 | |
| ImageJ FIJI software39 | National Institute of Health, Bethesda, MD | Version 1.8.0_112 | |
| Microcontroller (Adruino Uno + Adafruit Motorshield v2.3) | Arduino/Adafruit | Arduino-DK001/Adafruit-1438 | |
| MicroVL 21R Centrifuge | Thermo Scientific | 75002470 | |
| Parafilm | Bemis | PM-996 | |
| Primovert Light Microscope | Carl Zeiss Suzhou Co., Ltd. | 491206-0011-000 | |
| SCyUS CAD (Solidworks) | Dassault Systèmes | N/A | |
| SCyUS Code37 | N/A | N/A | |
| Servomotor - TowerPro SG-5010 | Adafruit | 155 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | For 50 mL tubes |
| Sterile 10 cm non-culture plates | Corning | 430167 | |
| Thrombin buffer | N/A | Recipe for 1L: 20g mannitol, 8.77g NaCl, 2.72g sodium acetate trihydrate, 24 mL 25% Human Serum Albumin, 5.88g calcium chloride. Bring final volume to 1L with PuW (pH 7.0) | |
| Trypsin EDTA Solution B (0.25%), EDTA (0.05%) | Biological Industries | 03-052-1B | |
| USB Cable (Type B Male to Type A Male) | N/A | N/A | |
| Zeiss LSM 880 Confocal Microscope | Carl Zeiss AG | 2811000417 | |
| ZEN 2.3 SP1 FP3 (black) | Carl Zeiss AG | Release Version 14.0.0.0 |
Riferimenti
- Bleuel, J., Zaucke, V., Bruggemann, G. P., Niehoff, A. Effects of cyclic tensile strain on chondrocyte metabolism: a systematic review. PLoS ONE. 10, 0119816(2015).
- Pennisi, C. P., Olesen, C. G., de Zee, M., Rasmussen, J., Zachar, V. Uniaxial cyclic strain drives assembly and differentiation of skeletal myocytes. Tissue Engineering Part A. 17, 2543-2550 (2011).
- Grodzinsky, A. J., Levenston, M. E., Jin, M., Frank, E. H. Cartilage Tissue Remodeling in Response to Mechanical Forces. Annual Review of Biomedical Engineering. 2 (1), 691-713 (2000).
- Munster, S., et al. Strain history dependence of the nonlinear stress response of fibrin and collagen networks. Proceedings of the National Academy of Sciences of the USA. 110, 12197-12202 (2013).
- Vader, D., Kabla, A., Weitz, D., Mahadevan, L. Strain-induced alignment in collagen gels. PLoS ONE. 4, 5902(2009).
- Badylak, S. F. The extracellular matrix as a scaffold for tissue reconstruction. Seminars in Cell & Developmental Biology. 13 (5), 377-383 (2002).
- Natan, S., Koren, Y., Shelah, O., Goren, S., Lesman, A. Molecular Biology of the Cell. 31 (14), 1474-1485 (2020).
- Ban, E., et al. Mechanisms of Plastic Deformation in Collagen Networks Induced by Cellular Forces. Biophysical Journal. 114 (2), 450-461 (2018).
- Kim, J., et al. Stress-induced plasticity of dynamic collagen networks. Nature Communications. 8, 842(2017).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Basu, A., Janmey, P. A., Yodh, A. G. Non-affine deformations in polymer hydrogels. Soft Matter. 8, 8039-8049 (2012).
- Muiznieks, L. D., Keeley, F. W. Molecular assembly and mechanical properties of the extracellular matrix: A fibrous protein perspective. Biochimica et Biophysica Acta. 1832, 866-875 (2012).
- Brown, A. E. X., Litvinov, R. I., Discher, D. E., Purohit, P. K., Weisel, J. W. Multiscale mechanics of fibrin polymer: gel stretching with protein unfolding and loss of water. Science. 325, 741-744 (2009).
- Carroll, S. F., Buckley, C. T., Kelly, D. J. Cyclic tensile strain can play a role in directing both intramembranous and endochondral ossification of mesenchymal stem cells. Frontiers in Bioengineering and Biotechnology. 5, 73(2017).
- Livne, A., Bouchbinder, E., Geiger, B. Cell reorientation under cyclic stretching. Nature Communications. 5, 3938(2014).
- Wang, L., et al. Patterning cellular alignment through stretching hydrogels with programmable strain gradients. ACS Applied Materials & Interfaces. 7, 15088-15097 (2015).
- Xu, G. K., Feng, X. Q., Gao, H. Orientations of Cells on Compliant Substrates under Biaxial Stretches: A Theoretical Study. Biophysical Journal. 114 (3), 701-710 (2017).
- Chagnon-Lessard, S., Jean-Ruel, H., Godin, M., Pelling, A. E. Cellular orientation is guided by strain gradients. Integrative Biology (United Kingdom). 9 (7), 607-618 (2013).
- Lu, J., et al. Cell orientation gradients on an inverse opal substrate. ACS Applied Materials & Interfaces. 7 (19), 10091-10095 (2015).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125, 3015-3024 (2012).
- Bono, N., et al. Unraveling the role of mechanical stimulation on smooth muscle cells: a comparative study between 2D and 3D models. Biotechnology and Bioengineering. 113, 2254-2263 (2016).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8, 839-845 (2007).
- Riehl, B. D., Park, J. H., Kwon, I. K., Lim, J. Y. Mechanical stretching for tissue engineering: two-dimensional and three-dimensional constructs. Tissue Engineering Part B: Reviews. 18, 288-300 (2012).
- Flexcell. Linear Tissue Train Culture Plate. Flexcell. , (2019).
- Flexcell. Tissue Train. Flexcell. , (2019).
- CellScale. MCT6 Stretcher. CellScale. , (2019).
- STREX. STB-150. STREX. , (2019).
- STREX. Stretch Chambers. STREX. , (2019).
- Kamble, H., Barton, M. J., Jun, M., Park, S., Nguyen, N. T. Cell stretching devices as research tools: engineering and biological considerations. Lab on a Chip. 16, 3193-3203 (2016).
- Weidenhamer, N. K., Tranquillo, R. T. Influence of cyclic mechanical stretch and tissue constraints on cellular and collagen alignment in fibroblast-derived cell sheets. Tissue Engineering Part C: Methods. 19, 386-395 (2013).
- Yung, Y. C., Vandenburgh, H., Mooney, D. J. Cellular strain assessment tool (CSAT): precision-controlled cyclic uniaxial tensile loading. Journal of Biomechanics. 42, 178-182 (2009).
- Chen, K., et al. Role of boundary conditions in determining cell alignment in response to stretch. Proceedings of the National Academy of Sciences of the USA. 115, 986-991 (2018).
- Heher, P., et al. A novel bioreactor for the generation of highly aligned 3D skeletal muscle-like constructs through orientation of fibrin via application of static strain. Acta Biomaterialia. 24, 251-265 (2015).
- Foolen, J., Deshpande, V. S., Kanters, F. M. W., Baaijens, F. P. T. The influence of matrix integrity on stress-fiber remodeling in 3D. Biomaterials. 33, 7508-7518 (2012).
- Walker, M., Godin, M., Pelling, A. E. A vacuum-actuated microtissue stretcher for long-term exposure to oscillatory strain within a 3D matrix. Biomedical Microdevices. 20, 43(2018).
- Zhao, R. G., Boudou, T., Wang, W. G., Chen, C. S., Reich, D. H. Decoupling cell and matrix mechanics in engineered microtissues using magnetically actuated microcantilevers. Advanced Materials. 25, 1699-1705 (2013).
- Li, Y. H., et al. Magnetically actuated cell-laden micro-scale hydrogels for probing strain-induced cell responses in three dimensions. NPG Asia Materials. 8, 238(2016).
- Li, Y. H., et al. An approach to quantifying 3D responses of cells to extreme strain. Scientific Reports. 6, 19550(2016).
- Humphrey, J. D., et al. A theoretically-motivated biaxial tissue culture system with intravital microscopy. Biomechanics and Modeling in Mechanobiology. 7, 323-334 (2008).
- Niklason, L. E., et al. Enabling tools for engineering collagenous tissues integrating bioreactors, intravital imaging, and biomechanical modeling. Proceedings of the National Academy of Sciences of the USA. 107, 3335-3339 (2010).
- Roitblat Riba, A., et al. Straining 3D hydrogels with uniform z-axis strains while enabling live microscopy imaging. Annals of Biomedical Engineering. , (2019).
- Gomez, D., Natan, S., Shokef, Y., Lesman, A. Mechanical interaction between cells facilitates molecular transport. Advanced Biosystems. 3 (12), 1900192(2019).
- Schindelin, J., et al. Fiji: an open- source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- EPFL Switzerland. OrientationJ plug in. EPFL Switzerland. , (2019).
- Goren, S., Koren, Y., Xu, X., Lesman, A. Elastic anisotropy governs the decay of cell-induced displacements. Biophysical Journal. 118 (5), 1152-1164 (2019).
- Notbohm, J., Lesman, A., Tirrell, D. A., Ravichandran, G. Quantifying cell-induced matrix deformation in three dimensions based on imaging matrix fibers. Integrative Biology. 7 (10), 1186-1195 (2015).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. Journal of Cell Biology. 205 (2), 155-162 (2014).
- Cha, C. Y., et al. Tailoring Hydrogel Adhesion to Polydimethylsiloxane Substrates Using Polysaccharide Glue. Angewandte Chemie International Edition. 52, 6949-6952 (2019).
- Wirthl, D., et al. Instant tough bonding of hydrogels for soft machines and electronics. Science Advances. 3, (2017).
- Juarez-Moreno, J. A., Avila-Ortega, A., Oliva, A. I., Aviles, F., Cauich-Rodriguez, J. V. Effect of wettability and surface roughness on the adhesion properties of collagen on PDMS films treated by capacitively coupled oxygen plasma. Applied Surface Science. 349, 763-773 (2015).
- Kim, H. T., Jeong, O. C. PDMS surface modification using atmospheric pressure plasma. Microelectronic Engineering. 88, 2281-2285 (2011).
- Prasad, B. R., et al. Controlling cellular activity by manipulating silicone surface roughness. Colloids and Surfaces. 78, 237-242 (2010).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon