A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مجسات توتر الحمض النووي لرسم خريطة لقوى مستقبلات بيكونيوتن العابرة بواسطة الخلايا المناعية
In This Article
Summary
تصف هذه الورقة بروتوكولا مفصلا لاستخدام مجسات التوتر القائمة على الحمض النووي لتصوير قوى المستقبلات التي تطبقها الخلايا المناعية. يمكن لهذا النهج تعيين قوى المستقبلات >4.7pN في الوقت الفعلي ويمكنه دمج القوى بمرور الوقت.
Abstract
تعتبر القوى الميكانيكية التي تنتقل عند التقاطع بين خليتين متجاورتين وعند التقاطع بين الخلايا والمصفوفة خارج الخلية ضرورية لتنظيم العديد من العمليات التي تتراوح من التطور إلى علم المناعة. لذلك ، فإن تطوير الأدوات اللازمة لدراسة هذه القوى على المستوى الجزيئي أمر بالغ الأهمية. طورت مجموعتنا مجموعة من مستشعرات التوتر الجزيئي لتحديد وتصور القوى التي تولدها الخلايا وتنتقل إلى روابط محددة. تتكون الفئة الأكثر حساسية من مستشعرات التوتر الجزيئي من دبابيس شعر حلقة جذعية للحمض النووي. تستخدم هذه المستشعرات أزواج الفلوروفور والتبريد للإبلاغ عن الامتداد الميكانيكي وتكشف دبابيس شعر الحمض النووي تحت القوة. يتمثل أحد التحديات التي تواجه مستشعرات شد دبوس الشعر في الحمض النووي في أنها قابلة للانعكاس مع إعادة طي دبوس الشعر السريع عند انتهاء التوتر وبالتالي يصعب تسجيل القوى العابرة. في هذه المقالة ، نصف بروتوكولات إعداد مستشعرات شد الحمض النووي التي يمكن "قفلها" ومنعها من إعادة الطي لتمكين "تخزين" المعلومات الميكانيكية. وهذا يسمح بتسجيل قوى piconewton العابرة للغاية ، والتي يمكن "محوها" لاحقا عن طريق إضافة الأحماض النووية التكميلية التي تزيل القفل. تكشف هذه القدرة على التبديل بين رسم خرائط التوتر في الوقت الفعلي وتخزين المعلومات الميكانيكية عن قوى ضعيفة وقصيرة العمر وأقل وفرة ، والتي تستخدمها الخلايا التائية بشكل شائع كجزء من وظائفها المناعية.
Introduction
تدافع الخلايا المناعية ضد مسببات الأمراض والخلايا السرطانية عن طريق الزحف المستمر ومسح أسطح الخلايا المستهدفة بحثا عن المستضدات ، وترصيع سطحها 1,2. يبدأ التعرف على المستضد عند الارتباط بين مستقبل الخلايا التائية (TCR) ومركب التوافق النسيجي الببتدي الرئيسي MHC (pMHC) المعبر عنه على سطح الخلايا المستهدفة. نظرا لأن التعرف على TCR-pMHC يحدث عند التقاطع بين خليتين متحركتين ، فقد اشتبه منذ فترة طويلة في أنه يعاني من قوى ميكانيكية. علاوة على ذلك ، أدى ذلك إلى نموذج المستشعر الميكانيكي لتنشيط TCR ، مما يشير إلى أن قوى TCR تساهم في وظيفتها 3,4. لفهم متى وأين وكيف تساهم القوى الميكانيكية في وظيفة الخلايا التائية ، من الضروري تطوير أدوات لتصور القوى الجزيئية التي تنتقل بواسطة الخلايا التائية. تقليديا ، يتم استخدام طرق مثل مجهر قوة الجر (TFM) ومصفوفات micropillar للتحقيق في القوى الخلوية 5,6. ومع ذلك ، فإن حساسية القوة لمصفوفات TFM و micropillar تكون على مقياس nanonewton (nN) ، وبالتالي فهي غالبا ما تكون غير كافية لدراسة قوى piconewton الجزيئية (pN) التي تنتقل بواسطة مستقبلات الخلايا7. لتحسين القوة والدقة المكانية للكشف ، كان مختبرنا رائدا في تطوير مجسات التوتر الجزيئي ، والتي تم تصنيعها في البداية باستخدام بوليمرات البولي إيثيلين جلايكول (PEG)7. تتكون مجسات التوتر الجزيئي من "زنبرك" جزيئي قابل للتمديد (PEG ، بروتين ، حمض نووي) محاط بفلوروفور ومروي ومثبت على سطح. تؤدي القوى المطبقة على نهاية المسبار إلى امتداده ، وفصل الفلوروفور والتبريد ، وبالتالي توليد إشارة مضان قوية (الشكل 1 أ)8،9،10.
على مدار العقد الماضي ، قمنا بتطوير مكتبة من فئات مختلفة من مجسات التوتر الجزيئي مع عناصر زنبركية مصنوعة من الأحماض النووية11 والبروتينات10 والبوليمرات8. من بين هذه ، توفر مجسات التوتر القائمة على الحمض النووي أعلى نسبة إشارة إلى الضوضاء وأكبر حساسية للقوة ، والتي يمكن ضبطها بسهولة من بضعة pN إلى ~ 20 pN11. لقد استخدمنا مجسات توتر الحمض النووي في الوقت الفعلي لدراسة القوى الجزيئية الناتجة عن العديد من أنواع الخلايا المتنوعة ، بما في ذلك الخلايا الليفية والخلايا السرطانية والصفائح الدموية والخلايا المناعية11،12،13. ستصف هذه المخطوطة بروتوكولات لتجميع وتجميع مجسات توتر الحمض النووي على سطح لرسم خريطة لقوى المستقبلات الجزيئية بدقة قوة pN باستخدام مجهر مضان تقليدي. في حين أن الإجراء الحالي يتضمن تعديلات كيميائية على الحمض النووي لإدخال مراسل الفلورسنت (الشكل 1 ب) ، من المهم ملاحظة أن العديد من خطوات التعديل والتنقية يمكن الاستعانة بمصادر خارجية لشركات تخليق الحمض النووي المخصصة. لذلك ، فإن تقنية مجسات توتر الحمض النووي سهلة ، ويمكن الوصول إليها من قبل مجتمعات بيولوجيا الخلية والبيولوجيا الميكانيكية الأوسع.
باختصار ، لتجميع مستشعرات توتر الحمض النووي ، يتم تهجين دبوس شعر الحمض النووي إلى حبلا يجند فلوري على ذراع واحدة وشريط مرساة مروي على الذراع الأخرى ثم يجمد على ركيزة زجاجية (الشكل 1 ج ، التوتر في الوقت الفعلي). في حالة عدم وجود قوة ميكانيكية ، يتم إغلاق دبوس الشعر ، وبالتالي يتم إخماد التألق. ومع ذلك ، عندما تكون القوة الميكانيكية المطبقة أكبر من F1/2 (القوة عند التوازن التي تؤدي إلى احتمال 50٪ للتكشف) ، يذوب دبوس الشعر ميكانيكيا ، ويتم إنشاء إشارة فلورسنت.
بناء على مستشعر توتر الحمض النووي في الوقت الفعلي، نصف أيضا بروتوكولات لرسم خريطة للقوى المتراكمة، وهو أمر مفيد بشكل خاص لدراسة التفاعلات بين المستقبلات على الخلايا المناعية ورباطها الطبيعي. وذلك لأن المستقبلات المناعية غالبا ما تعرض روابط قصيرة العمر 3,14. يتم تصوير القوى المتراكمة باستخدام حبلا "قفل" يرتبط بشكل تفضيلي بفتح دبابيس شعر الحمض النووي ويسمح بتخزين إشارات التألق المرتبطة بأحداث السحب الميكانيكية (الشكل 1C ، التوتر المقفل). تم تصميم حبلا القفل لربط موقع ربط خفي يتعرض عند ذوبان دبوس الشعر المستحث ميكانيكيا وقفل دبوس الشعر في الحالة المفتوحة عن طريق منع إعادة طي دبوس الشعر ، وبالتالي تخزين إشارة التوتر ، وتوليد خريطة توتر متراكمة. علاوة على ذلك ، تم تصميم حبلا القفل بإصبع قدم مكون من ثمانية نيوكليوتيدات ، مما يتيح تفاعل إزاحة حبلا بوساطة إصبع القدم مع مكمله الكامل ، حبلا "فتح". مع إضافة حبلا الفتح ، يتم تجريد حبلا القفل المربوط من بنية دبوس الشعر ، مما يؤدي إلى محو إشارة التوتر المخزنة وإعادة ضبط دبوس الشعر إلى حالة الوقت الفعلي.
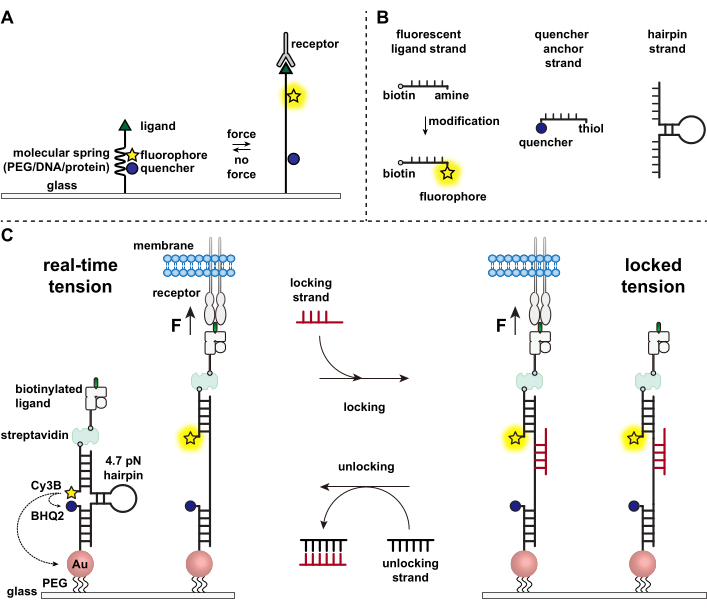
الشكل 1: مخطط أحدث مجسات التوتر الجزيئي. (أ) التصميم العام لمسبار التوتر الجزيئي في الوقت الفعلي، (ب) خيوط بناء مسبار التوتر القائم على الحمض النووي، (ج) مجسات التوتر القائمة على الحمض النووي (DNA) وتبديلها بين الحالة في الوقت الفعلي والحالة المقفلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يتكون البروتوكول الرئيسي من أربعة أقسام رئيسية - إعداد قليل النوكليوتيد ، وإعداد السطح ، والتصوير ، وتحليل البيانات. تم إثبات هذا البروتوكول بنجاح من قبل مختبرنا وغيره في خلايا OT-1 CD8 + T الساذجة والمنشطة ، وخلايا OT-II CD4 + ، وكذلك الأورام الهجينة ، ويمكن تطبيقه لاستجواب مستقبلات الخلايا المناعية المختلفة بما في ذلك مستقبلات الخلايا التائية ، ومستقبلات موت الخلايا المبرمجة (PD1) ، وقوى المستضد 1 المرتبطة بوظيفة الخلايا الليمفاوية (LFA-1). تستخدم الخلايا التائية الساذجة OT-1 CD8 + كمثال على خط الخلية في هذه الورقة.
Protocol
توجد الفئران المعدلة وراثيا OT-1 في قسم مرفق الموارد الحيوانية في جامعة إيموري. تمت الموافقة على جميع التجارب وتنفيذها بموجب بروتوكول اللجنة المؤسسية لرعاية واستخدام الحيوان (IACUC).
1. إعداد قليل النوكليوتيد
- قم بإذابة الحمض النووي لشريط الليجند في الماء (مقاومة 18.2 MΩ ، المستخدمة في جميع أنحاء البروتوكول بأكمله). دوامة وتدور الحل مع جهاز طرد مركزي منضدية. ضبط حجم الماء بحيث يكون التركيز النهائي 1 mM. تحقق من صحة التركيز باستخدام مقياس الطيف الضوئي النانوي لقياس الامتصاص عند 260 نانومتر وتحديد التركيز النهائي بناء على معامل انقراض قليل النيوكليوتيد.
ملاحظة: يحتوي شريط الليجند على تعديل في كل محطة ، 5 'أمين و 3' بيوتين ، للاقتران مع الفلوروفور ولتقديم الرباط البيوتينيل. يجب أن تكون مجموعة الأمين في شريط الليجند مترافقة مع فلوروفور. تستخدم صبغة Cy3B لهذا الاقتران نظرا لسطوعها العالي وثباتها الضوئي ، ولكنها لا تقدم بشكل عام تجاريا وتتطلب اقترانا داخليا. وفقا لذلك ، يصف القسم التالي الاقتران بين الأمينات وأصباغ إستر NHS. بالنسبة للمستخدمين النهائيين الذين ليس لديهم إمكانية الوصول إلى المرافق أو الموارد لتعديل الحمض النووي ، يمكن بدلا من ذلك شراء الأحماض النووية المعدلة من بائعي تخليق الحمض النووي المخصصين الذين يقدمون أصباغا ساطعة وقابلة للضوء ، مثل عائلة الأصباغ Alexa و Atto. - قم بإعداد حلول 10x PBS و 1 M NaHCO3 . امزج 10 ميكرولتر من محلول حبلا أمين ليجند 1 مللي متر (10 نانومول) مع 10 ميكرولتر من 10x PBS ، و 10 ميكرولتر من 1 M NaHCO3 ، و 60 ميكرولتر من H2O. قم بإذابة 50 ميكروغرام من إستر Cy3B NHS في 10 ميكرولتر من DMSO مباشرة قبل الاستخدام وأضفه إلى الخليط لحجم تفاعل إجمالي يبلغ 100 ميكرولتر. أضف إستر Cy3B NHS أخيرا. اتركه يتفاعل في درجة حرارة الغرفة لمدة 1 ساعة أو 4 درجات مئوية طوال الليل.
- قم بإعداد حبلا قفل Atto647N عن طريق اقتران حبلا قفل الأمين مع استر Atto647N NHS. قم بإعداد 10x PBS و 1 M محلول NaHCO3 . امزج 10 ميكرولتر من محلول حبلا قفل أمين 1 مللي متر (10 نانومول) مع 10 ميكرولتر من 10x PBS ، و 10 ميكرولتر من 1 M NaHCO3 ، و 60 ميكرولتر من H2O. قم بإذابة 50 ميكروغرام من Atto647N NHS ester في 10 ميكرولتر من DMSO مباشرة قبل الاستخدام وأضفه إلى الخليط لحجم تفاعل إجمالي يبلغ 100 ميكرولتر. أضف Atto647N NHS استر الماضي. اتركه يتفاعل في درجة حرارة الغرفة لمدة 1 ساعة أو 4 درجات مئوية طوال الليل.
- بعد التفاعلات ، قم بإزالة المنتجات الثانوية والصبغة الزائدة والأملاح عن طريق ترشيح الجل المحلى P2. قم بتخفيف خليط التفاعل باستخدام H2O إلى حجم إجمالي قدره 300 ميكرولتر ، وهو مناسب لخطوة تنقية HPLC اللاحقة. أضف 650 ميكرولتر من جل P2 المائي إلى جهاز طرد مركزي وقم بتدويره لأسفل عند 18000 × جم لمدة 1 دقيقة. قم بإزالة السائل الموجود في الجزء السفلي من الجهاز ، وأضف خليط التفاعل إلى العمود الذي يحتوي على هلام P2 ، وقم بتدويره لأسفل عند 18000 × جم لمدة 1 دقيقة وجمع خليط التفاعل في الجزء السفلي من الجهاز.
ملاحظة: يجب ترطيب جل P2 لمدة 4 ساعات على الأقل قبل الاستخدام مع H2O. - تنقية خليط التفاعل المحلى باستخدام HPLC باستخدام عمود C18 مخصص لتنقية قليل النوكليوتيد ، مع المذيب A: 0.1 M TEAA في H2O و B: ACN كمرحلة متحركة لشطف التدرج الخطي 10-100٪ B على مدى 50 دقيقة بمعدل تدفق 0.5 مل / دقيقة. حقن خليط التفاعل المنزوع التحلية في HPLC ذو الطور العكسي بحلقة حقن 500 ميكرولتر للتنقية. اجمع المنتج الذي يحتوي على ذروة امتصاص للحمض النووي (260 نانومتر) وذروة امتصاص للفلوروفور (560 نانومتر ل Cy3B و 647 نانومتر ل Atto647N) وجففها في مكثف طرد مركزي فراغي طوال الليل (انظر الشكل 2 أ).
- أعد تكوين منتج صبغة الأوليغو المجففة في 100 ميكرولتر من الماء. حدد تركيز حبلا ليجند Cy3B وشريط قفل Atto647N باستخدام مقياس الطيف الضوئي النانوي. تأكد من أن نسبة وضع العلامات على الصبغة قريبة من 1: 1. صحيح لامتصاص 260 نانومتر للصبغة إذا لزم الأمر عند تحديد تركيز قليل النوكليوتيد.
- تحقق من صحة المنتج المنقى باستخدام MALDI-TOF-MS باستخدام 3-HPA كركيزة في 50٪ ACN / H2O مع 0.1٪ TFA و 5 مجم / مل سترات الأمونيوم باستخدام 0.5 ميكرولتر من المنتج عند 1-5 ميكرومتر لإعداد عينة MALDI-TOF-MS. يمكن العثور على مثال على الطيف الكتلي في الشكل 2B.
- قم بإذابة خصلة دبوس الشعر وخصلة مرساة المروي في الماء وتأكد من أن تركيز محاليل المخزون يتراوح بين 50 و 100 ميكرومتر.
ملاحظة: خصلة دبوس الشعر غير معدلة ويمكن تصنيعها بشكل مخصص مباشرة من البائع. يحتوي حبلا المرساة على مجموعة تثبيت ثيول ومبرد BHQ2 ويمكن تصنيعه مباشرة من البائع. - قسمة جميع قليل النيوكليوتيدات. للاستخدام والتخزين على المدى القصير ، قم بتخزين هذه oligonucleotides في 4 درجات مئوية. للتخزين طويل الأجل ، قم بتجميدها والاحتفاظ بها عند -20 درجة مئوية. عند هذه النقطة، تكون جميع قليل النيوكليوتيدات جاهزة لتجميع مسبار شد الحمض النووي.
ملاحظة: دورات التجميد والذوبان المتكررة ليست مشكلة بالنسبة لقليل النيوكليوتيدات.
2. تحضير السطح
ملاحظة: يستغرق تحضير ركائز مسبار شد دبوس الشعر DNA يومين. سيتم تشغيل مسبار شد دبوس الشعر DNA على أغطية زجاجية.
- اليوم 1
- ضع أغطية 25 مم على رف بولي تترافلورو إيثيلين في دورق سعة 50 مل. يمكن لكل رف استيعاب ما يصل إلى 8 أغطية غطاء. شطف أغطية عن طريق غمرها في الماء ثلاث مرات.
- أضف 40 مل من محلول الإيثانول بنسبة 1: 1 (v: v) الممزوج بالماء إلى الدورق الذي يحتوي على الرف وأغطية الغطاء ، وأغلق الدورق باستخدام فيلم بارافين.
- قم بتركيب الدورق لمدة 15 دقيقة في منظف بالموجات فوق الصوتية (تردد التشغيل 35 كيلو هرتز) لتنظيف أغطية الغطاء. بعد صوتنة ، تخلص من السائل وشطف الدورق مع الرف وأغطية الأغطية فيه بالماء 6 مرات على الأقل لإزالة أي مذيب عضوي متبقي.
- تحضير محلول سمكة البيرانا الطازج عن طريق خلط حمض الكبريتيك وبيروكسيد الهيدروجين بنسبة 3: 1. لصنع 40 mL من محلول سمكة البيرانا، أضف 30 mL من حمض الكبريتيك إلى كأس زجاجية نظيفة سعة 50 mL أولا، ثم أضف ببطء 10 mL من H 2 O2. سوف يسخن محلول سمكة البيرانا بسرعة وفقاعة عند إضافة H 2O2. اخلطي سمكة البيرانا برفق باستخدام نهاية ماصة زجاجية.
- بعد ذلك ، انقل الرف الذي يحمل أغطية الغطاء إلى الدورق الذي يحتوي على محلول سمكة البيرانا المختلطة بلطف للحفر (الشكل 3 أ). اترك محلول سمكة البيرانا يصنع الهيدروكسيلات ونظف أغطية الغطاء لمدة 30 دقيقة في درجة حرارة الغرفة. بعد حفر سمكة البيرانا ، انقل الرف باستخدام ملاقط فولاذية أو بولي تترافلورو إيثيلين إلى دورق نظيف سعة 50 مل بالماء واشطفه مرة أخرى بالماء 6 مرات على الأقل.
تنبيه: يمكن أن تتفاعل كميات كبيرة من المواد العضوية بقوة مع محلول سمكة البيرانا وقد تسبب انفجارا. كن حذرا واعمل دائما مع محلول سمكة البيرانا في غطاء الدخان. تأكد من ارتداء معطف وقفازات ونظارات واقية. لا تقم أبدا بتخزين محلول سمكة البيرانا الطازج في حاوية مغلقة.
ملاحظة: يجب أن تبقى نسبة بيروكسيد الهيدروجين إلى حمض الكبريتيك أقل من 1: 2 (v: v) ويجب ألا تتجاوز 1: 1. عند غمر الحامل بأغطية في محلول سمكة البيرانا ، ضعها في المحلول ببطء وبعناية. لا تتخلص من المحلول مباشرة بعد الحفر ، لأنه لا يزال نشطا وساخنا. اتركه في الدورق طوال الليل قبل سكبه في حاوية النفايات الحمضية. - اغمر الرف الذي يحمل أغطية الغطاء في دورق سعة 50 مل مع 40 مل من الإيثانول لإزالة الماء. تخلص من الإيثانول وكرر 3 مرات للتأكد من إزالة الماء.
- ثم اغمر الرف في 3٪ أمينوبروبيل ثلاثي إيثوكسي سيلان (APTES) (v / v) في 40 مل من الإيثانول للتفاعل مع -OH على أغطية الغطاء لمدة 1 ساعة في درجة حرارة الغرفة (الشكل 3 ب).
ملاحظة: يمكن استبدال الإيثانول بالأسيتون. - اشطف الأسطح 6 مرات عن طريق غمرها في 40 مل من الإيثانول ، ثم جففها في الفرن على حرارة 80 درجة مئوية لمدة 20 دقيقة. بعد التبريد ، قم بتخزين أغطية الغطاء المجففة المعدلة بالأمين عند -20 درجة مئوية للاستخدام في المستقبل (حتى 6 أشهر).
- قم بتغطية الجانب الداخلي السفلي من أطباق بتري البلاستيكية بقطر 10 سم بغشاء البارافين. يمنع فيلم البارافين انزلاق الغطاء من الانزلاق داخل طبق بتري ويساعد في الحفاظ على الحل للخطوات التالية من العمل على زلات الغطاء. ضع أغطية الغطاء المبردة المعدلة بالأمين في أطباق بتري. يجب أن يكون الجانب المراد تشغيله متجها لأعلى.
- لتعديل مجموعات الأمين على أغطية الغطاء ، أضف 300 ميكرولتر من 0.5٪ وزن / فولت حمض ليبويك PEG NHS (LA-PEG-SC) و 2.5٪ وزن / v mPEG NHS (mPEG-SC) في 0.1 M NaHCO3 على كل غطاء واحتضانها لمدة 1 ساعة في درجة حرارة الغرفة (الشكل 3C). لكل غطاء 25 مم ، تزن 1.5 مجم من LA-PEG-SC و 7.5 مجم من mPEG-SC. قم بإذابة كواشف NHS مباشرة قبل إضافتها إلى الأسطح ، حيث أن لها عمر نصف قصير (~ 10 دقائق) في محلول مائي في درجة حرارة الغرفة. بعد التفاعل ، شطف الأسطح 3 مرات بالماء.
ملاحظة: يمكن إجراء تفاعل NHS عند 4 درجات مئوية طوال الليل. تتمتع كواشف NHS بعمر نصف أطول قبل التحلل المائي عند 4 درجات مئوية ، أي حوالي 4-6 ساعات. سيؤدي ذلك إلى إجراء تحضير السطح لمدة ثلاثة أيام. - أضف 100 ميكرولتر من 0.1 M NaHCO3 تحتوي على 1 مجم / مل من أسيتات السلفو-NHS إلى مجموعة من أغطية "الساندويتش" (خطان للغطاء يواجهان بعضهما البعض مع وجود مخزن مؤقت للتفاعل بينهما). اسمح بحدوث التخميل لمدة 30 دقيقة على الأقل. لحفظ الكاشف ، يمكن القيام بهذه الخطوة باستخدام 50 ميكرولتر من أسيتات السلفو-NHS 1 مجم / مل. شطف بالماء ثلاث مرات بعد التخميل.
- أضف 0.5 مل من جسيمات الذهب النانوية (AuNP ، 8.8 نانومتر ، حمض التانيك ، 0.05 مجم / مل) إلى كل غطاء واحتضانها لمدة 30 دقيقة في درجة حرارة الغرفة (الشكل 3 د). لحفظ الكاشف ، يمكن القيام بهذه الخطوة عن طريق وضع اثنين من أغطية الغطاء أيضا. تأكد من عدم وجود أملاح في النظام من الخطوات السابقة لتجنب تجميع جسيمات الذهب النانوية. لا تترك أغطية الملابس حتى تجف بعد هذه الخطوة.
- وفي الوقت نفسه ، قم بالتهجين المسبق 4.7 pN hairpin، حبلا Cy3B ligand ، وشريط مرساة BHQ2 الذي يشكل مجسات توتر الحمض النووي بنسبة 1.1: 1: 1 في 1 M NaCl عند 300 نانومتر في أنبوب PCR. قم بتلدين الخيوط عن طريق تسخين المحلول حتى 95 درجة مئوية لمدة 5 دقائق ، ثم تبرد تدريجيا عن طريق خفض درجة الحرارة إلى 20 درجة مئوية خلال 30 دقيقة في جهاز تدوير حراري.
- شطف أغطية بالماء ثلاث مرات بعد 30 دقيقة من الحضانة مع الجسيمات النانوية الذهبية. أضف حبلا مرساة BHQ2 إضافيا (من مخزون 100 ميكرومتر) إلى محلول الحمض النووي الملدن لجعل النسبة بين حبلا مرساة BHQ2 وخيط ليجند Cy3B 10: 1. في هذه المرحلة ، يجب أن يحتوي محلول الحمض النووي على 300 نانومتر من بناء مسبار التوتر و 2.7 ميكرومتر BHQ2 حبلا. أضف 100 ميكرولتر لكل غطاءين لعمل "شطيرة" (الشكل 3E).
- ضع كرة مناديل معملية مبللة بعناية في طبق بتري (بعيدا عن أغطية الغطاء) وأغلق الطبق بغشاء البارافين لمنع المحلول من الجفاف. يغطى الطبق بورق القصدير ويحتضنه على حرارة 4 درجات مئوية طوال الليل.
- اليوم 2
- اغسل المجسات الزائدة من أغطية الغطاء باستخدام 1x PBS. تحقق من جودة سطح مسبار توتر الحمض النووي تحت مجهر الفلورسنت.
- تحضير 40 ميكروغرام / مل من الستربتافيدين في 1x PBS واحتضانها على أغطية لمدة 30 دقيقة في درجة حرارة الغرفة (الشكل 3F). عادة ، 100 ميكرولتر كافية لغطاء 25 مم. شطف مع برنامج تلفزيوني 3 مرات بعد الحضانة لغسل الكمية الزائدة من الستربتافيدين.
- تحضير 40 ميكروغرام / مل من الأجسام المضادة / الربيطة البيوتينيلية في 1x PBS. أضف 50-100 ميكرولتر لكل شطيرة واحتضانها لمدة 30 دقيقة في درجة حرارة الغرفة (الشكل 3G). شطف مع برنامج تلفزيوني ثلاث مرات بعد الحضانة لغسل الكمية الزائدة من الأجسام المضادة بيوتينيل / يجند.
- قم بتجميع غرف التصوير النظيفة مع الأسطح بعناية. يمكن تكسير الأسطح بسهولة عند شد الغرف. أضف 0.5-1 مل من محلول الملح المتوازن (HBSS) من هانك إلى غرف التصوير واحتفظ بها جاهزة للتصوير بالخلايا (الشكل 3H).
3. تصوير قوى مستقبلات الخلايا
- تحضير الخلايا المناعية ذات الأهمية في HBSS عند 1-2 × 106 خلايا / مل.
ملاحظة: تستخدم الخلايا الساذجة OT-1 CD8 + كمثال في هذه الورقة. تنقية الخلايا التائية الساذجة OT-1 CD8 + A من طحال الفئران التي تم التضحية بها باستخدام مجموعة عزل الخلايا التائية CD8 + T للماوس MACS مع فاصل MACS وفقا لتعليمات الشركة المصنعة. عزل وإثراء الخلايا التائية CD8 + عن طريق إزالة أي خلايا غير CD8 + T يرتبط بها كوكتيل الأجسام المضادة المستنفدة المغناطيسية. أعد تعليق الخلايا التائية الساذجة OT-1 CD8 + المنقى في HBSS عند 2 × 106 خلايا / مل واحتفظ بها على الثلج قبل الاستخدام. - تحقق من جودة سطح مسبار شد دبوس الشعر DNA تحت مجهر مضان (هدف 100x) لمراقبة الجودة قبل إضافة الروابط أو خلايا الطلاء. قم بتصوير وتحديد متوسط كثافة الخلفية في قناة Cy3B لسطح مسبار شد دبوس الشعر DNA من 5 مواضع مختلفة على الأقل و 3 مكررات. حافظ على اتساق ظروف الحصول على التصوير بحيث يمكن استخدام هذه القيمة كعلامة موثوقة لجودة السطح وكثافة المسبار (الشكل 4C).
ملاحظة: حدد عدد خيوط الحمض النووي لكل جسيم نانوي ذهبي وعدد جسيمات الذهب النانوية لكل ميكرومتر2 في المرات القليلة الأولى من تحضير السطح وفقا للأدبيات12 ، والتي يمكن استخدامها كعلامة موثوقة أخرى لجودة السطح. - لوحة ~ 4 × 10 4 - 10 × 104 خلايا على كل مسبار توتر الحمض النووي غطاء وظيفي والسماح لهم بالتعلق والانتشار لمدة ~ 15 دقيقة في درجة حرارة الغرفة.
- عندما يتم طلاء الخلايا على مجسات توتر دبوس الشعر للحمض النووي وتبدأ في الانتشار ، قم بتصوير إشارات التألق التي يتم إنشاؤها في قناة Cy3B بهدف 100x (الشكل 3I).
- بعد أن تبدأ الخلايا في إنتاج إشارة شد في الوقت الفعلي على سطح مسبار شد دبوس الشعر DNA في قناة Cy3B ، احصل على صور في كل من قنوات Cy3B و Atto647N (يعطي الفحص المجهري TIRF نسبة إشارة إلى ضوضاء أفضل من التألق). بعد ذلك ، أضف حبلا Atto647N إلى غرف التصوير بتركيز نهائي يبلغ 200 نانومتر للتهجين الانتقائي ميكانيكيا.
- بعد 10 دقائق من الحضانة ، قم بإزالة المخزن المؤقت الذي يحتوي على حبلا قفل Atto647N الفلوري بسرعة ورفق واستبدله بأملاح هانك المتوازنة الطازجة. الصورة في كل من قنوات Cy3B و Atto647N مرة أخرى وتحديد معامل ارتباط بيرسون مع برنامجفيجي 15.
- في الوقت الذي يثير الاهتمام بالتحقيق ، أدخل حبلا قفل غير فلوري إلى الخلايا الموجودة في غرفة التصوير لتخزين إشارة الشد. تحضير مخزون حبلا القفل (100 ميكرومتر) وإضافته إلى الخلايا بتركيز نهائي يبلغ 1 ميكرومتر. ماصة بلطف لخلط. يمكن أن تختلف مدة القفل ولكن 10 دقائق هي الوقت الموصى به.
- احصل على أفلام الفاصل الزمني أو صور نقطة النهاية في التألق لكل من رسم خرائط التوتر النوعي والتحليل الكمي حسب الحاجة (الشكل 3J والشكل 5).
ملاحظة: إذا كان قياس التوتر في نقاط زمنية متعددة مطلوبا ، فابدأ في مسح إشارات التوتر المخزنة عن طريق إضافة حبلا لإلغاء القفل. لتجنب الشطف الزائد ، يتم استخدام تركيز نهائي أعلى لفتح حبلا عند 2 ميكرومتر لبدء تفاعل إزاحة حبلا بوساطة إصبع القدم مع حبلا القفل لمدة 3 دقائق ، مما يمحو الإشارات المخزنة (الشكل 3J). اشطف قليل النوكليوتيدات الزائدة برفق باستخدام HBSS. سطح مسبار شد دبوس الشعر DNA والخلايا جاهزة لجولة أخرى من تخزين التوتر ورسم الخرائط. فتح إشارات التوتر ليس ضروريا إذا كانت نقطة زمنية واحدة فقط ذات أهمية في الدراسة.
4. تحليل البيانات
ملاحظة: يتم إجراء تحليل الصور باستخدام برنامج فيجي ، ويتم إجراء التحليل الكمي باستخدام برنامج التحليل.
- قم بتصحيح أي انحراف أثناء الحصول على الصورة باستخدام أمر تصحيح الانجراف 3D في التسجيل ضمن قائمة المكونات الإضافية .
- قم بإزالة خلفية الكاميرا للصورة باستخدام أمر الطرح ضمن قائمة العملية .
- حدد معامل ارتباط بيرسون مع دالة التوطين المشترك ضمن قائمة تحليل .
- متوسط وطرح الخلفية الفلورية التي تنتجها المجسات غير المفتوحة من ثلاث مناطق خلفية محلية مختلفة. ارسم عائد استثمار للخلايا على الصور المطروحة في الخلفية أو صور RICM (مجهر تباين تداخل الانعكاس) باستخدام أداة التحديد اليدوي للصورة J. قم بقياس أي مقياس لأهمية عائد الاستثمار ، على سبيل المثال ، كثافة التألق المتكاملة وإشغال التوتر باستخدام أداة القياس ضمن قائمة التحليل (الشكل 6).
- تصدير القياسات للتحليل الكمي باستخدام برنامج التحليل.
- ارسم البيانات باستخدام أي برنامج تحليل.
النتائج
نعرض هنا صورا تمثيلية لمراقبة جودة السطح (الشكل 4). يجب أن يكون للسطح عالي الجودة خلفية نظيفة في قناة RICM (الشكل 4B) ، وشدة مضان موحدة في قناة Cy3B (الشكل 4C). مع نفس معدات التصوير وظروف اكتساب التصوير الفلوري المتطابقة ، يجب أن تكون شدة مضان الخلفية ...
Discussion
من خلال الإجراءات التفصيلية المقدمة هنا ، يمكن للمرء إعداد ركائز مسبار شد دبوس الشعر للحمض النووي لرسم خريطة وقياس توتر المستقبلات التي تنتجها الخلايا المناعية. عندما يتم طلاء الخلايا على ركيزة مسبار شد دبوس الشعر DNA ، فإنها تهبط وتلتصق وتنتشر عندما تستشعر المستقبلات الروابط كيميائيا وم?...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل منح المعاهد الوطنية للصحة R01GM131099 و NIH R01GM124472 و NSF CAREER 1350829. نشكر مرفق المعاهد الوطنية للصحة Tetramer على روابط pMHC. تم دعم هذه الدراسة ، جزئيا ، من قبل Emory Comprehensive Glycomics Core.
Materials
| Name | Company | Catalog Number | Comments |
| 3-hydroxypicolinic acid (3-HPA) | Sigma | 56197 | maldi-TOF-MS matrix |
| mPEG-SC | Biochempeg | MF001023-2K | surface prep |
| (3-Aminopropyl)triethoxysilane | Acros | AC430941000 | surface prep |
| 10x Red blood cell lysis buffer | Biolegend | 00-4333-57 | buffer |
| 8.8 nm gold nanoparticles, tannic acid | Nanocomposix | customized order | surface prep |
| Atto647N NHS ester | Sigma | 18373-1MG-F | fluorophore, oligo prep |
| Attofluor Cell Chamber, for microscopy | Thermo Fisher Scientific | A7816 | imaging |
| BD Syringes only with Luer-Lok | BD bioscience | 309657 | cells |
| biotinylated anti-mouse CD3e | ebioscience | 13-0031-82 | antibody/ligand |
| Biotinylated pMHC ovalbumin (SIINFEKL) | NIH Tetramer Core Facility at Emory University | NA | antibody/ligand |
| bovine serum albumin | Sigma | 735078001 | block non-specific interactions |
| Cell strainers | Biologix | 15-1100 | cells |
| Coverslip Mini-Rack, teflon | Thermo Fisher Scientific | C14784 | surface prep |
| Cy3B NHS ester | GE Healthcare | PA63101 | fluorophore, oligo prep |
| Dulbecco's phosphate-buffered saline (DPBS) | Corning | 21-031-CM | buffer |
| ethanol | Sigma | 459836 | surface prep |
| Hank’s balanced salts (HBSS) | Sigma | H8264 | buffer |
| hydrogen peroxide | Sigma | H1009 | surface prep |
| LA-PEG-SC | Biochempeg | HE039023-3.4K | surface prep |
| Midi MACS (LS) startup kit | Miltenyi Biotec | 130-042-301 | cells |
| mouse CD8+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | cells |
| Nanosep MF centrifugal devices | Pall laboratory | ODM02C35 | oligo prep |
| No. 2 round glass coverslips | VWR | 48382-085 | surface prep |
| NTA-SAM | Dojindo Molecular Technologies | N475-10 | surface prep |
| P2 gel | Bio-rad | 1504118 | oligo prep |
| sufuric acid | EMD Millipore Corporation | SX1244-6 | surface prep |
| Sulfo-NHS acetate | Thermo Fisher Scientific | 26777 | surface prep |
| Equipment | |||
| Agilent AdvanceBio Oligonucleotide C18 column, 4.6 x 150 mm, 2.7 μm | 653950-702 | oligonucleotide preparation | |
| Barnstead Nanopure water purifying system | Thermo Fisher | water | |
| CFI Apo 100× NA 1.49 objective | Nikon | Microscopy | |
| Cy5 cube | CHROMA | Microscopy | |
| evolve electron multiplying charge coupled device (EMCCD) | Photometrics | Microscopy | |
| High-performance liquid chromatography | Agilent 1100 | oligonucleotide preparation | |
| Intensilight epifluorescence source | Nikon | Microscopy | |
| Matrix-assisted laser desorption/ionization time-of-flight mass spectrometer (MALDI-TOF-MS) | Voyager STR | oligonucleotide preparation | |
| Nanodrop 2000 UV-Vis Spectrophotometer | Thermo Fisher | oligonucleotide preparation | |
| Nikon Eclipse Ti inverted microscope | Nikon | Microscopy | |
| Nikon Perfect Focus System | Nikon | Microscopy | |
| NIS Elements software | Nikon | Microscopy | |
| quad band TIRF 405/488/561/647 cube | CHROMA | Microscopy | |
| RICM cube | CHROMA | Microscopy | |
| TIRF launcher with 488 nm (50 mW), 561 nm (50 mW), and 640 nm | Coherent | Microscopy | |
| TRITC cube | CHROMA | Microscopy | |
| oligo name | 5' modification / 3' modification | sequence (5' to 3') | Use |
| 15mer amine locking strand | 5' modification: no modification 3' modification: /3AmMO/ | AAA AAA CAT TTA TAC CCT ACC TA | locking real-time tension signal |
| 15mer Atto647N locking strand | 5' modification: Atto647N 3' modification: /3AmMO/ | AAA AAA CAT TTA TAC CCT ACC TA | locking real-time tension signal |
| 15mer non-fluoresccent locking strand | 5' modification: no modification 3' modification: no modification | A AAA AAC ATT TAT AC | locking real-time tension signal for quantitative analysis |
| 4.7 pN hairpin strand | 5' modification: no modification 3' modification: no modification | GTGAAATACCGCACAGATGCGT TTGTATAAATGTTTTTTTCATTTAT ACTTTAAGAGCGCCACGTAGCC CAGC | hairpin probe |
| amine ligand strand | 5' modification: /5AmMC6/ 3' modification: /3Bio/ | CGCATCTGTGCG GTA TTT CAC TTT | hairpin probe |
| BHQ2 anchor strand | 5' modification: /5ThiolMC6-D/ 3' modification: /3BHQ_2/ | TTTGCTGGGCTACGTGGCGCTCTT | hairpin probe |
| Cy3B ligand strand | 5' modification: Cy3B 3' modification: /3Bio/ | CGCATCTGTGCG GTA TTT CAC TTT | hairpin probe |
| unlocking strand | 5' modification: no modification 3' modification: no modification | TAG GTA GGG TAT AAA TGT TTT TTT C | unlocking accumulated tension signal |
References
- Dustin, M. L. T-cell activation through immunological synapses and kinapses. Immunological Reviews. 221 (1), 77-89 (2008).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. Journal of Cell Biology. 216 (1), 217-230 (2017).
- Feng, Y., et al. Mechanosensing drives acuity of αβ T-cell recognition. Proceedings of the National Academy of Sciences. 114 (39), 8204-8213 (2017).
- Hong, J., et al. A TCR mechanotransduction signaling loop induces negative selection in the thymus. Nature Immunology. 19 (12), 1379-1390 (2018).
- Basu, R., et al. Cytotoxic T cells use mechanical force to potentiate target cell killing. Cell. 165 (1), 100-110 (2016).
- Bashour, K. T., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences. 111 (6), 2241-2246 (2014).
- Ma, V. P. Y., Salaita, K. DNA nanotechnology as an emerging tool to study mechanotransduction in living systems. Small. 15 (26), 1900961 (2019).
- Liu, Y., Yehl, K., Narui, Y., Salaita, K. Tension sensing nanoparticles for mechano-imaging at the living/nonliving interface. Journal of the American Chemical Society. 135 (14), 5320-5323 (2013).
- Glazier, R., et al. DNA mechanotechnology reveals that integrin receptors apply pN forces in podosomes on fluid substrates. Nature Communications. 10 (1), 1-13 (2019).
- Galior, K., Liu, Y., Yehl, K., Vivek, S., Salaita, K. Titin-based nanoparticle tension sensors map high-magnitude integrin forces within focal adhesions. Nano Letters. 16 (1), 341-348 (2016).
- Zhang, Y., Ge, C., Zhu, C., Salaita, K. DNA-based digital tension probes reveal integrin forces during early cell adhesion. Nature Communications. 5, 5167 (2014).
- Liu, Y., et al. DNA-based nanoparticle tension sensors reveal that T-cell receptors transmit defined pN forces to their antigens for enhanced fidelity. Proceedings of the National Academy of Sciences. 113 (20), 5610-5615 (2016).
- Zhang, Y., et al. Platelet integrins exhibit anisotropic mechanosensing and harness piconewton forces to mediate platelet aggregation. Proceedings of the National Academy of Sciences. 115 (2), 325-330 (2018).
- Huang, J., et al. The kinetics of two-dimensional TCR and pMHC interactions determine T-cell responsiveness. Nature. 464 (7290), 932-936 (2010).
- Ma, R., et al. DNA probes that store mechanical information reveal transient piconewton forces applied by T cells. Proceedings of the National Academy of Sciences. 116 (34), 16949-16954 (2019).
- Hui, E., et al. T cell costimulatory receptor CD28 is a primary target for PD-1-mediated inhibition. Science. 355 (6332), 1428-1433 (2017).
- Whitley, K. D., Comstock, M. J., Chemla, Y. R. Elasticity of the transition state for oligonucleotide hybridization. Nucleic Acids Research. 45 (2), 547-555 (2016).
- Brockman, J. M., et al. Live-cell super-resolved PAINT imaging of piconewton cellular traction forces. Nature Methods. 17 (10), 1018-1024 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved