JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
면역 세포에 의한 일시적인 피코네톤 수용체 힘을 매핑하는 DNA 장력 프로브
요약
이 논문은 DNA 기반 장력 프로브를 사용하여 면역 세포에 의해 가해지는 수용체 힘을 이미지화하기 위한 자세한 프로토콜을 설명합니다. 이 접근법은 수용체 힘>4.7pN을 실시간으로 매핑할 수 있으며 시간이 지남에 따라 힘을 통합할 수 있습니다.
초록
인접한 두 세포 사이의 접합부와 세포와 세포외 기질 사이의 접합부에서 전달되는 기계적 힘은 발달에서 면역학에 이르는 많은 과정을 조절하는 데 중요합니다. 따라서 분자 규모에서 이러한 힘을 연구하는 도구를 개발하는 것이 중요합니다. 우리 그룹은 세포에서 생성되어 특정 리간드로 전달되는 힘을 정량화하고 시각화하기 위해 분자 장력 센서 제품군을 개발했습니다. 가장 민감한 종류의 분자 장력 센서는 핵산 줄기 루프 헤어핀으로 구성됩니다. 이 센서는 형광단-소광제 쌍을 사용하여 힘을 받고 있는 DNA 헤어핀의 기계적 확장 및 풀림을 보고합니다. DNA 헤어핀 장력 센서의 한 가지 문제는 장력이 종료될 때 빠르게 헤어핀을 다시 접을 수 있어 일시적인 힘을 기록하기 어렵다는 것입니다. 이 기사에서는 기계적 정보를 "저장"할 수 있도록 "잠길" 수 있고 다시 접히는 것을 방지할 수 있는 DNA 장력 센서를 준비하기 위한 프로토콜에 대해 설명합니다. 이를 통해 매우 일시적인 피코네톤 힘을 기록할 수 있으며, 이는 잠금 장치를 제거하는 상보적 핵산을 추가하여 이후에 "삭제"할 수 있습니다. 실시간 장력 매핑과 기계적 정보 저장 사이를 전환하는 이 기능은 T 세포가 면역 기능의 일부로 일반적으로 사용하는 약하고 수명이 짧으며 덜 풍부한 힘을 보여줍니다.
서문
면역 세포는 항원에 대해 표적 세포의 표면을 지속적으로 크롤링하고 스캔하여 표면을 박음으로써 병원체와 암세포를 방어합니다 1,2. 항원 인식은 T 세포 수용체(TCR)와 표적 세포 표면에서 발현되는 펩타이드-주요 조직적합성 복합체 MHC(pMHC) 복합체 사이의 결합에 따라 시작됩니다. TCR-pMHC 인식은 두 이동 셀 사이의 접합부에서 발생하기 때문에 오랫동안 기계적 힘이 발생하는 것으로 의심되어 왔습니다. 또한, 이것은 TCR 활성화의 기계 센서 모델로 이어졌으며, 이는 TCR 힘이 기능 3,4에 기여한다는 것을 시사합니다. 언제, 어디서, 어떻게 기계적 힘이 T 세포 기능에 기여하는지 이해하려면 T 세포에 의해 전달되는 분자력을 시각화하는 도구를 개발하는 것이 필수적입니다. 전통적으로, 견인력 현미경 (TFM) 및 마이크로 필러 어레이와 같은 방법은 세포력 5,6을 조사하는 데 사용됩니다. 그러나 TFM과 마이크로필러 어레이의 힘 감도는 나노뉴턴(nN) 규모이므로 세포 수용체에 의해 전달되는 분자 피코네톤(pN) 힘을 연구하기에는 불충분한 경우가 많다7. 검출을 위한 힘과 공간 분해능을 개선하기 위해 우리 연구실은 분자 장력 프로브의 개발을 개척했으며, 이 프로브는 초기에 폴리에틸렌 글리콜(PEG) 폴리머를 사용하여 합성되었습니다7. 분자 장력 프로브는 형광단과 소광제 옆에 있는 확장 가능한 분자 "스프링"(PEG, 단백질, DNA)으로 구성되며 표면에 고정되어 있습니다. 프로브의 말단에 가해지는 힘은 프로브의 확장으로 이어져 형광단과 소광제를 분리하여 강력한 형광 신호를 생성합니다(그림 1A)8,9,10.
지난 10년 동안 우리는 핵산(nucleic acids)11, 단백질(proteins) 10 및 폴리머(polymers) 8로 만들어진 스프링 요소(spring elements)를 가진 다양한 종류의 분자 장력 프로브(molecular tension probe) 라이브러리를 개발해 왔습니다. 이 중 DNA 기반 장력 프로브는 가장 높은 신호 대 잡음비와 가장 큰 힘 감도를 제공하며, 이는 몇 pN에서 최대 ~20pN까지 쉽게 조정할 수 있습니다11. 우리는 이러한 실시간 DNA 장력 프로브를 사용하여 섬유아세포, 암세포, 혈소판 및 면역 세포를 포함한 다양한 세포 유형에서 생성되는 분자력을 연구했습니다11,12,13. 이 원고는 기존의 형광 현미경을 사용하여 pN 힘 분해능으로 분자 수용체 힘을 매핑하기 위해 표면에 DNA 장력 프로브를 합성하고 조립하는 프로토콜을 설명합니다. 현재 절차에는 형광 리포터를 도입하기 위한 핵산에 대한 화학적 변형이 포함되지만(그림 1B), 많은 수정 및 정제 단계를 맞춤형 DNA 합성 회사에 아웃소싱할 수 있다는 점에 유의해야 합니다. 따라서 DNA 장력 프로브 기술은 용이하고 광범위한 세포 생물학 및 기계 생물학 커뮤니티에서 접근할 수 있습니다.
간단히 말해서, DNA 장력 센서를 조립하기 위해 DNA 헤어핀을 한쪽 팔의 형광 리간드 가닥과 다른 쪽 팔의 소광제 앵커 가닥에 혼성화한 다음 유리 기판에 고정합니다(그림 1C, 실시간 장력). 기계적 힘이 없으면 머리핀이 닫히고 형광이 소멸됩니다. 그러나 적용된 기계적 힘이 F1/2 (풀림 확률 50%로 이어지는 평형 상태의 힘)보다 크면 헤어핀이 기계적으로 녹고 형광 신호가 생성됩니다.
실시간 DNA 장력 센서를 기반으로 축적된 힘을 매핑하는 프로토콜도 설명하는데, 이는 면역 세포의 수용체와 천연 리간드 간의 상호 작용을 연구하는 데 특히 유용합니다. 이것은 면역 수용체가 종종 수명이 짧은 결합을 나타내기 때문입니다 3,14. 축적된 힘은 열린 DNA 헤어핀에 우선적으로 결합하고 기계적 당김 이벤트와 관련된 형광 신호를 저장할 수 있는 "잠금" 가닥을 사용하여 이미지화됩니다(그림 1C, 고정 장력). 상기 잠금 스트랜드는 기계적으로 유도된 헤어핀의 용융 시 노출되는 비밀 결합 부위를 묶고, 헤어핀 재접힘을 차단하여 헤어핀을 개방 상태로 고정시켜 장력 신호를 저장하고, 축적된 장력 맵을 생성하도록 설계된다. 또한, 잠금 가닥은 8개의 뉴클레오티드 토홀드로 설계되어 완전한 보완인 "잠금 해제" 가닥으로 발가락 매개 가닥 변위 반응을 가능하게 합니다. 잠금 해제 스트랜드가 추가되면 바운드 잠금 스트랜드가 헤어핀 구조에서 벗겨져 저장된 장력 신호가 지워지고 헤어핀이 실시간 상태로 재설정됩니다.
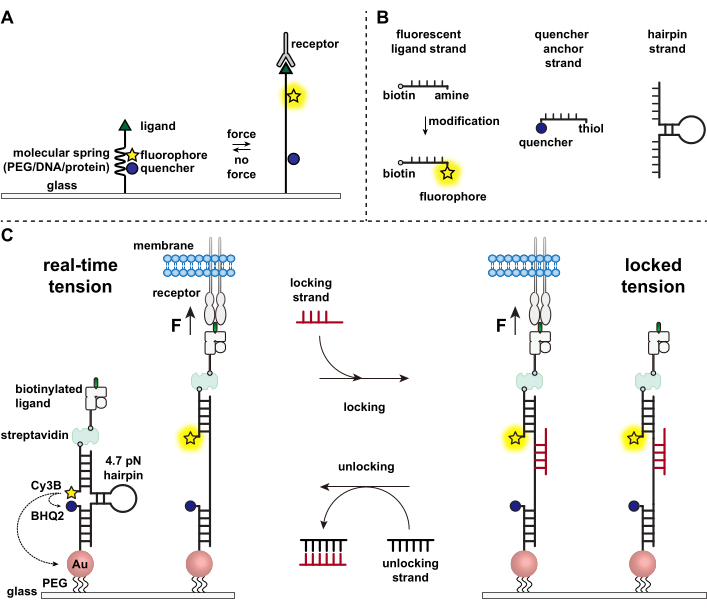
그림 1: 최첨단 분자 장력 프로브의 구성표. (A) 실시간 분자 장력 프로브의 일반 설계, (B) DNA 기반 장력 프로브 구성을 위한 가닥, (C) 설계된 DNA 기반 장력 프로브 및 실시간 상태와 잠금 상태 간의 전환. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
주요 프로토콜은 올리고뉴클레오티드 준비, 표면 처리, 이미징 및 데이터 분석의 네 가지 주요 섹션으로 구성됩니다. 이 프로토콜은 순진하고 활성화된 OT-1 CD8+ T 세포, OT-II CD4+ 세포 및 하이브리도마에서 우리 연구실과 다른 사람들에 의해 성공적으로 입증되었으며 T 세포 수용체, 프로그래밍된 세포 사멸 수용체(PD1) 및 림프구 기능 관련 항원 1(LFA-1) 힘을 포함한 다양한 면역 세포 수용체를 조사하는 데 적용할 수 있습니다. OT-1 CD8+ 나이브 T 세포는 본 논문에서 세포주의 예로 사용됩니다.
프로토콜
OT-1 형질전환 마우스는 에모리 대학교의 동물 자원 시설부에 보관되어 있습니다. 모든 실험은 IACUC(Institutional Animal Care and Use Committee) 프로토콜에 따라 승인 및 수행되었습니다.
1. 올리고뉴클레오티드 제조
- 리간드 가닥 DNA를 물에 용해시킵니다(18.2MΩ 저항률, 전체 프로토콜에 걸쳐 사용됨). Vortex 및 탁상용 원심분리기로 용액을 회전시킵니다. 최종 농도가 1mM이 되도록 물의 부피를 조정합니다. 나노드롭 분광광도계를 이용하여 농도를 검증하여 260 nm에서 흡광도를 측정하고 올리고뉴클레오티드의 흡광계수를 기준으로 최종 농도를 결정한다.
참고: 리간드 가닥은 각 말단, 5' 아민 및 3' 비오틴에 변형이 있어 형광단과 접합하고 비오티닐화 리간드를 제시합니다. 리간드 가닥의 아민기는 형광단과 접합되어야 합니다. Cy3B 염료는 높은 밝기와 광안정성으로 인해 이러한 접합에 사용되지만 일반적으로 상업적으로 제공되지 않으며 자체 접합이 필요합니다. 따라서, 다음 섹션에서는 아민과 NHS 에스테르 염료 사이의 접합에 대해 설명합니다. 핵산 변형을 위한 시설이나 자원에 접근할 수 없는 최종 사용자의 경우, 대신 Alexa 및 Atto 염료 제품군과 같이 밝고 광안정성이 있는 염료를 제공하는 맞춤형 DNA 합성 공급업체에서 변형된 핵산을 구입할 수 있습니다. - 10x PBS 및 1M NaHCO3 용액을 준비합니다. 10 μL의 1 mM 아민 리간드 가닥 용액 (10 nmol)을 10 μL의 10x PBS, 10 μL의 1 MNaHCO3 및 60 μL의H2O와 혼합한다. 50 μg의 Cy3B NHS 에스테르를 사용 직전에 10 μL의 DMSO에 용해시키고, 100 μL의 총 반응 부피를 위해 혼합물에 첨가한다. 마지막으로 Cy3B NHS 에스테르를 추가합니다. 실온에서 1시간 또는 4°C에서 하룻밤 동안 반응시킵니다.
- 아민 잠금 가닥을 Atto647N NHS 에스테르와 접합하여 Atto647N 잠금 가닥을 준비합니다. 10x PBS 및 1 M NaHCO3 용액을 준비한다. 10 μL의 1 mM 아민 잠금 스트랜드 용액 (10 nmol)을 10 μL의 10x PBS, 10 μL의 1 MNaHCO3 및 60 μL의H2O와 혼합한다. 사용 직전에 10 μL의 DMSO에 50 μg의 Atto647N NHS 에스테르를 용해시키고, 100 μL의 총 반응 부피를 위해 혼합물에 첨가한다. Atto647N NHS 에스테르를 마지막에 첨가하십시오. 실온에서 1시간 또는 4°C에서 하룻밤 동안 반응시킵니다.
- 반응 후 P2 탈염 겔 여과로 부산물, 과잉 염료 및 염을 제거합니다. 반응 혼합물을H2O로 총 부피 300 μL로 희석하고, 이는 후속 HPLC 정제 단계에 적합하다. 650μL의 수화된 P2 겔을 원심 분리 장치에 넣고 18,000 x g 에서 1분 동안 회전시킵니다. 장치 하단에서 액체를 제거하고, 반응 혼합물을 P2 겔이 함유된 컬럼에 첨가하고, 18,000 x g 에서 1분 동안 스핀다운하고, 장치 하단에서 반응 혼합물을 수집합니다.
참고: P2 젤은 H2O와 함께 사용하기 최소 4시간 전에 수화되어야 합니다. - 올리고뉴클레오티드 정제를 위해 지정된 C18 컬럼을 사용하여 HPLC로 탈염된 반응 혼합물을 정제하고, 용매 A:H2O중 0.1M TEAA 및 B: ACN을 이동상으로 하여 0.5mL/분의 유속으로 50분에 걸쳐 10-100% B. 정제를 위해 500μL 주입 루프를 사용하여 역상 HPLC에 탈염 반응 혼합물을 주입합니다. DNA에 대한 흡광도 피크(260nm)와 형광단에 대한 흡광도 피크(Cy3B의 경우 560nm, Atto647N의 경우 647nm)를 갖는 생성물을 수집하고 진공 원심 농축기에서 밤새 건조시킵니다( 그림 2A 참조).
- 건조된 올리고염료 생성물을 물 100 μL로 재구성한다. 나노드롭 분광 광도계로 Cy3B 리간드 가닥과 Atto647N 잠금 가닥의 농도를 측정합니다. 염료 라벨링 비율이 1:1에 가까운지 확인하십시오. 올리고뉴클레오타이드 농도를 결정할 때 필요한 경우 염료의 260nm 흡광도를 수정합니다.
- MALDI-TOF-MS 샘플 준비를 위해 1-5μM에서 0.5μL의 제품을 사용하여 0.1% TFA와 5mg/mL 구연산암모늄이 포함된 50% ACN/H2O에서 3-HPA를 기질로 사용하는 MALDI-TOF-MS로 정제된 제품을 검증합니다. 질량 스펙트럼의 예는 그림 2B에서 찾을 수 있습니다.
- 머리핀 가닥과 소광제 앵커 가닥을 물에 녹이고 원액의 농도가 50에서 100 μM 사이인지 확인하십시오.
알림: 헤어핀 가닥은 수정되지 않았으며 공급업체에서 직접 맞춤 합성할 수 있습니다. 앵커 가닥에는 티올 앵커링 그룹과 퀀서 BHQ2가 있으며 공급업체로부터 직접 맞춤 합성할 수 있습니다. - 모든 올리고뉴클레오티드를 분취한다. 단기 사용 및 보관을 위해 이러한 올리고뉴클레오티드를 4°C에서 보관하십시오. 장기 보관을 위해 냉동하여 -20 °C에서 보관하십시오. 이 시점에서, 모든 올리고뉴클레오티드는 DNA 장력 프로브 조립을 위한 준비가 된다.
참고: 반복되는 동결-해동 주기는 올리고뉴클레오티드에 문제가 되지 않습니다.
2. 표면 준비
참고: DNA 헤어핀 장력 프로브 기질의 준비에는 이틀이 걸립니다. DNA 머리핀 장력 프로브는 유리 커버슬립에 기능화됩니다.
- 1일차
- 25mm 커버슬립을 50mL 비커의 폴리테트라플루오로에틸렌 랙에 놓습니다. 각 랙은 최대 8개의 커버슬립을 수용할 수 있습니다. 커버슬립을 물에 세 번 담가 헹굽니다.
- 물과 혼합된 에탄올의 1:1 비율(v:v) 용액 40mL를 랙과 커버슬립이 들어 있는 비커에 넣고 파라핀 필름을 사용하여 비커를 밀봉합니다.
- 초음파 청소기 (작동 주파수 35KHz)에서 15 분 동안 비커를 초음파 처리하여 커버 슬립을 청소하십시오. 초음파 처리 후 액체를 버리고 랙과 커버 슬립으로 비커를 물로 6 번 이상 헹구어 남아있는 유기 용매를 제거하십시오.
- 황산과 과산화수소를 3 : 1의 비율로 혼합하여 신선한 피라냐 용액을 준비하십시오. 피라냐 용액 40mL를 만들려면 먼저 깨끗한 50mL 비이커에 황산 30mL를 넣은 다음 H 2 O210mL를 천천히 넣으십시오. 피라냐 용액은H2O2의 첨가시 빠르게 가열되고 기포가 발생합니다. 유리 피펫의 끝을 사용하여 피라냐를 부드럽게 섞습니다.
- 다음으로, 커버슬립을 고정하는 랙을 에칭을 위해 부드럽게 혼합된 피라냐 용액이 들어 있는 비커로 옮깁니다(그림 3A). 피라냐 용액이 하이드록실화되도록 하고 실온에서 30분 동안 커버슬립을 청소합니다. 피라냐 에칭 후 강철 또는 폴리테트라플루오로에틸렌 핀셋을 사용하여 랙을 깨끗한 50mL 비커에 물로 옮기고 물로 다시 6회 이상 헹굽니다.
주의 : 다량의 유기 물질은 피라냐 용액과 격렬하게 반응하여 폭발을 일으킬 수 있습니다. 조심하고 항상 흄 후드에서 피라냐 용액으로 작업하십시오. 실험복, 장갑, 보안경을 반드시 착용하십시오. 밀봉 된 용기에 신선한 피라냐 용액을 보관하지 마십시오.
알림: 과산화수소 대 황산 비율은 1:2(v:v) 미만으로 유지해야 하며 1:1을 초과해서는 안 됩니다. 커버 슬립이있는 랙을 Piranha 용액에 담그면 천천히 조심스럽게 용액에 넣으십시오. 용액은 여전히 활성 상태이고 뜨겁기 때문에 에칭 직후에 버리지 마십시오. 산성 폐기물 용기에 붓기 전에 밤새 비커에 두십시오. - 커버슬립이 들어 있는 랙을 에탄올 40mL가 든 50mL 비커에 담그고 물을 제거합니다. 에탄올을 버리고 물이 제거되었는지 확인하기 위해 3 번 반복하십시오.
- 그런 다음 랙을 에탄올 40mL의 3% 아미노프로필 트리에톡시 실란(APTES)(v/v)에 담그고 실온에서 1시간 동안 커버슬립의 -OH와 반응시킵니다(그림 3B).
알림: 에탄올은 아세톤으로 대체할 수 있습니다. - 에탄올 40mL에 담가 표면을 6번 헹군 다음 80°C의 오븐에서 20분 동안 건조시킵니다. 냉각 후 건조된 아민 변성 커버슬립을 향후 사용을 위해 -20°C에서 보관합니다(최대 6개월).
- 직경 10cm 플라스틱 페트리 접시의 바닥 안쪽을 파라핀 필름으로 덮습니다. 파라핀 필름은 커버슬립이 페트리 접시 내부로 미끄러지는 것을 방지하고 기능화의 다음 단계를 위한 용액이 커버슬립에 유지되도록 도와줍니다. 냉각된 아민 변형 커버슬립을 페트리 접시에 넣습니다. 기능화할 면이 위를 향해야 합니다.
- 커버슬립의 아민기를 수정하려면 0.1M NaHCO3 에 300μL의 0.5% w/v 리포산 PEG NHS(LA-PEG-SC) 및 2.5% w/v mPEG NHS(mPEG-SC)를 각 커버슬립에 추가하고 실온에서 1시간 동안 배양합니다(그림 3C). 각 25mm 커버슬립에 대해 1.5mg의 LA-PEG-SC 및 7.5mg의 mPEG-SC의 무게를 잰다. NHS 시약은 실온의 수용액에서 짧은 반감기 (~ 10 분)를 가지므로 표면에 첨가하기 직전에 용해시킵니다. 반응 후 표면을 물로 3 번 헹굽니다.
참고: NHS 반응은 4°C에서 하룻밤 동안 수행할 수 있습니다. NHS 시약은 4 °C에서 가수 분해되기 전에 반감기가 더 길며, 이는 약 4-6 시간입니다. 이로 인해 3일간의 표면 준비 절차가 필요합니다. - 100mg/mL의 sulfo-NHS 아세테이트를 포함하는 3M NaHCO1μL 을 "샌드위치" 커버슬립 세트(두 개의 커버슬립이 서로 마주보고 그 사이에 반응 완충액이 있음)에 추가합니다. 최소 30분 동안 패시베이션이 발생하도록 합니다. 시약을 절약하기 위해 이 단계는 50μL의 1mg/mL sulfo-NHS 아세테이트로 수행할 수 있습니다. 패시베이션 후 물로 세 번 헹굽니다.
- 0.5mL의 금 나노입자(AuNP, 8.8nm, 탄닌산, 0.05mg/mL)를 각 커버슬립에 넣고 실온에서 30분 동안 배양합니다(그림 3D). 시약을 절약하기 위해 이 단계는 두 개의 커버슬립을 끼워서 수행할 수도 있습니다. 금 나노 입자의 응집을 피하기 위해 이전 단계의 시스템에 염이 없는지 확인하십시오. 이 단계 후에 커버슬립을 건조된 상태로 두지 마십시오.
- 한편, DNA 장력 프로브 구축물을 형성하는 4.7 pN 헤어핀, Cy3B 리간드 가닥 및 BHQ2 앵커 가닥을 PCR 튜브에서 300 nM에서 1 M NaCl 중 1.1:1의 비율로 사전 혼성화한다. 용액을 5분 동안 95°C까지 가열하여 가닥을 어닐링한 다음, 열 순환기에서 30분에 걸쳐 온도를 20°C로 감소시켜 점진적으로 냉각시킨다.
- 금 나노 입자로 30 분 배양 한 후 커버 슬립을 물로 세 번 헹굽니다. 어닐링된 DNA 용액에 BHQ2 앵커 가닥(100μM 스톡에서)을 추가하여 BHQ2 앵커 가닥과 Cy3B 리간드 가닥 사이의 비율을 10:1로 만듭니다. 이 시점에서 DNA 용액은 300nM의 장력 프로브 구성물과 2.7μM BHQ2 가닥을 포함해야 합니다. 커버슬립 2개당 100μL를 추가하여 "샌드위치"를 만듭니다(그림 3E).
- 젖은 실험실 티슈 볼을 페트리 접시(커버슬립에서 멀리 떨어진 곳)에 조심스럽게 놓고 용액이 마르지 않도록 파라핀 필름으로 접시를 밀봉합니다. 접시를 호일로 덮고 4°C에서 밤새 배양합니다.
- 2일차
- 1x PBS로 커버슬립에서 초과 프로브를 씻어냅니다. 에피형광 현미경으로 DNA 장력 프로브 표면 품질을 확인합니다.
- 1x PBS에 40μg/mL의 스트렙타비딘을 준비하고 실온에서 30분 동안 커버슬립에서 배양합니다(그림 3F). 일반적으로 100μL이면 25mm 커버슬립에 충분합니다. 배양 후 PBS로 3회 헹구어 과량의 스트렙타비딘을 씻어냅니다.
- 1x PBS에 40μg/mL 비오틴화 항체/리간드를 준비합니다. 샌드위치 당 50-100 μL를 추가하고 실온에서 30 분 동안 배양합니다 (그림 3G). 배양 후 PBS로 세 번 헹구어 과량의 비오티닐화 항체/리간드를 씻어냅니다.
- 표면이 있는 깨끗한 이미징 챔버를 조심스럽게 조립합니다. 챔버를 조일 때 표면에 쉽게 금이 갈 수 있습니다. 0.5-1mL의 Hank's balanced salt solution(HBSS)을 이미징 챔버에 추가하고 세포로 이미징할 수 있도록 준비합니다(그림 3H).
3. 이미징 세포 수용체 힘
- HBSS에서 관심 있는 면역 세포를 1-2 x 106 cells/mL로 준비합니다.
참고: OT-1 CD8+ 나이브 세포는 이 논문의 예로 사용됩니다. 제조업체의 지침에 따라 MACS 분리기가 있는 MACS 마우스 CD8+ T 세포 분리 키트를 사용하여 희생된 마우스의 비장에서 OT-1 CD8+ 나이브 T 세포를 정제합니다. 자기 고갈 항체 칵테일이 결합된 비 CD8+ T 세포를 제거하여 CD8+ T 세포를 분리하고 농축합니다. 정제된 OT-1 CD8+ 나이브 T 세포를 HBSS에 2 x 106 cells/mL로 재현탁하고 사용하기 전에 얼음 위에 보관하십시오. - 리간드 또는 도금 셀을 추가하기 전에 품질 관리를 위해 형광 현미경(100x 대물렌즈)으로 DNA 헤어핀 인장 프로브 표면의 품질을 확인하십시오. 최소 5개의 서로 다른 위치와 3번의 복제에서 DNA 헤어핀 장력 프로브 표면의 Cy3B 채널의 평균 배경 강도를 이미지화하고 정량화합니다. 이 값이 표면 품질 및 프로브 밀도의 신뢰할 수 있는 마커로 사용될 수 있도록 이미징 획득 조건을 일관되게 유지합니다(그림 4C).
참고: 문헌12에 따라 표면 처리의 처음 몇 번 금 나노입자당 DNA 가닥 수와μm2당 금 나노입자 수를 정량화하여 표면 품질의 또 다른 신뢰할 수 있는 마커로 사용할 수 있습니다. - 플레이트 ~4 x 10 4 - 10 x 104 세포를 각 DNA 장력 프로브 기능화 커버슬립에 부착하고 실온에서 ~15분 동안 퍼지도록 합니다.
- 세포가 DNA 헤어핀 장력 프로브에 도팅되고 확산되기 시작하면 Cy3B 채널에서 생성된 형광 신호를 100x 대물렌즈로 이미지화합니다(그림 3I).
- 세포가 Cy3B 채널의 DNA 헤어핀 장력 프로브 표면에서 실시간 장력 신호를 생성하기 시작한 후 Cy3B 및 Atto647N 채널 모두에서 이미지를 획득합니다(TIRF 현미경은 에피형광보다 더 나은 신호 대 잡음비를 제공함). 이어서, 기계적 선택적 혼성화를 위해 Atto647N 가닥을 200nM의 최종 농도로 이미징 챔버에 추가합니다.
- 10분 배양 후, 형광 Atto647N 잠금 가닥이 포함된 완충액을 빠르고 부드럽게 제거하고 신선한 Hank's balanced salts로 교체합니다. Cy3B 및 Atto647N 채널 모두에서 다시 이미지화하고, 피지 소프트웨어(15)와 피어슨의 상관 계수를 결정한다.
- 조사에 관심이 있는 시점에서 장력 신호를 저장하기 위해 이미징 챔버의 세포에 비형광 잠금 가닥을 삽입합니다. 잠금 스트랜드 스톡(100 μM)을 준비하고 1 μM의 최종 농도로 세포에 첨가합니다. 잠금 시간은 다를 수 있지만 권장 시간은 10분입니다.
- 필요에 따라 정성적 장력 매핑 및 정량 분석을 위해 epifluorescence에서 타임랩스 동영상 또는 끝점 이미지를 획득합니다(그림 3J 및 그림 5).
알림: 여러 시점에서 장력 측정이 필요한 경우 잠금 해제 가닥을 추가하여 저장된 장력 신호 지우기를 시작합니다. 과도한 헹굼을 방지하기 위해 2μM에서 더 높은 최종 농도의 잠금 해제 가닥을 사용하여 3분 동안 잠금 가닥과 발가락 매개 가닥 변위 반응을 시작하여 저장된 신호를 지웁니다(그림 3J). HBSS로 과잉 올리고뉴클레오티드를 부드럽게 헹굽니다. DNA 헤어핀 장력 프로브 표면과 세포는 또 다른 장력 저장 및 매핑을 위한 준비가 되어 있습니다. 연구에 관심이 있는 시점이 하나뿐인 경우 장력 신호의 잠금 해제가 필요하지 않습니다.
4. 데이터 분석
참고: 이미지 분석은 피지 소프트웨어를 사용하여 수행되며 정량 분석은 분석 소프트웨어를 사용하여 수행됩니다.
- Plugins 메뉴의 Registration에서 Correct 3D drift 명령을 사용하여 이미지 획득 중 드리프트를 수정합니다.
- 프로세스 메뉴에서 빼기 명령을 사용하여 이미지의 카메라 배경을 제거합니다.
- Pearson의 상관 계수를 분석 메뉴의 Colocalization 함수와 함께 확인합니다.
- 3개의 서로 다른 국소 배경 영역에서 미개봉 프로브에 의해 생성된 형광 배경을 평균화하고 뺍니다. Image J Freehand Selections 도구를 사용하여 배경 빼기 이미지 또는 RICM(반사 간섭 대비 현미경) 이미지에 셀의 ROI를 그립니다. ROI의 관심 메트릭(예: Analyze(분석) 메뉴의 Measure(측정) 도구를 사용하여 통합 형광 강도 및 장력 점유)을 측정합니다(그림 6).
- 분석 소프트웨어를 사용하여 정량 분석을 위한 측정값을 내보냅니다.
- 분석 소프트웨어를 사용하여 데이터를 플로팅합니다.
결과
여기서는 대표적인 표면 품질 관리 이미지를 보여줍니다(그림 4). 고품질 표면은 RICM 채널(그림 4B)에서 깨끗한 배경을 가져야 하고 Cy3B 채널(그림 4C)에서 균일한 형광 강도를 가져야 합니다. 동일한 이미징 장비와 동일한 형광 이미징 획득 조건으로, 배경 형광 강도는 DNA 프로브로 실험을 수행할 때마다 일관되고 재현 가능해야 합?...
토론
여기에 제공된 자세한 절차를 통해 DNA 헤어핀 장력 프로브 기질을 준비하여 면역 세포에 의해 생성된 수용체 장력을 매핑하고 정량화할 수 있습니다. 세포가 DNA 헤어핀 장력 프로브 기판에 도금되면 수용체가 화학적으로나 기계적으로 리간드를 감지함에 따라 착지, 부착 및 확산되며, 후자는 프로브에 의해 감지됩니다. 그러나 어떤 경우에는 세포가 퍼지지 않을 수 있습니다 (그림...
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
이 작업은 NIH 보조금 R01GM131099, NIH R01GM124472 및 NSF CAREER 1350829의 지원을 받았습니다. pMHC 리간드에 대해 NIH Tetramer Facility에 감사드립니다. 이 연구는 Emory Comprehensive Glycomics Core에 의해 부분적으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 3-hydroxypicolinic acid (3-HPA) | Sigma | 56197 | maldi-TOF-MS matrix |
| mPEG-SC | Biochempeg | MF001023-2K | surface prep |
| (3-Aminopropyl)triethoxysilane | Acros | AC430941000 | surface prep |
| 10x Red blood cell lysis buffer | Biolegend | 00-4333-57 | buffer |
| 8.8 nm gold nanoparticles, tannic acid | Nanocomposix | customized order | surface prep |
| Atto647N NHS ester | Sigma | 18373-1MG-F | fluorophore, oligo prep |
| Attofluor Cell Chamber, for microscopy | Thermo Fisher Scientific | A7816 | imaging |
| BD Syringes only with Luer-Lok | BD bioscience | 309657 | cells |
| biotinylated anti-mouse CD3e | ebioscience | 13-0031-82 | antibody/ligand |
| Biotinylated pMHC ovalbumin (SIINFEKL) | NIH Tetramer Core Facility at Emory University | NA | antibody/ligand |
| bovine serum albumin | Sigma | 735078001 | block non-specific interactions |
| Cell strainers | Biologix | 15-1100 | cells |
| Coverslip Mini-Rack, teflon | Thermo Fisher Scientific | C14784 | surface prep |
| Cy3B NHS ester | GE Healthcare | PA63101 | fluorophore, oligo prep |
| Dulbecco's phosphate-buffered saline (DPBS) | Corning | 21-031-CM | buffer |
| ethanol | Sigma | 459836 | surface prep |
| Hank’s balanced salts (HBSS) | Sigma | H8264 | buffer |
| hydrogen peroxide | Sigma | H1009 | surface prep |
| LA-PEG-SC | Biochempeg | HE039023-3.4K | surface prep |
| Midi MACS (LS) startup kit | Miltenyi Biotec | 130-042-301 | cells |
| mouse CD8+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | cells |
| Nanosep MF centrifugal devices | Pall laboratory | ODM02C35 | oligo prep |
| No. 2 round glass coverslips | VWR | 48382-085 | surface prep |
| NTA-SAM | Dojindo Molecular Technologies | N475-10 | surface prep |
| P2 gel | Bio-rad | 1504118 | oligo prep |
| sufuric acid | EMD Millipore Corporation | SX1244-6 | surface prep |
| Sulfo-NHS acetate | Thermo Fisher Scientific | 26777 | surface prep |
| Equipment | |||
| Agilent AdvanceBio Oligonucleotide C18 column, 4.6 x 150 mm, 2.7 μm | 653950-702 | oligonucleotide preparation | |
| Barnstead Nanopure water purifying system | Thermo Fisher | water | |
| CFI Apo 100× NA 1.49 objective | Nikon | Microscopy | |
| Cy5 cube | CHROMA | Microscopy | |
| evolve electron multiplying charge coupled device (EMCCD) | Photometrics | Microscopy | |
| High-performance liquid chromatography | Agilent 1100 | oligonucleotide preparation | |
| Intensilight epifluorescence source | Nikon | Microscopy | |
| Matrix-assisted laser desorption/ionization time-of-flight mass spectrometer (MALDI-TOF-MS) | Voyager STR | oligonucleotide preparation | |
| Nanodrop 2000 UV-Vis Spectrophotometer | Thermo Fisher | oligonucleotide preparation | |
| Nikon Eclipse Ti inverted microscope | Nikon | Microscopy | |
| Nikon Perfect Focus System | Nikon | Microscopy | |
| NIS Elements software | Nikon | Microscopy | |
| quad band TIRF 405/488/561/647 cube | CHROMA | Microscopy | |
| RICM cube | CHROMA | Microscopy | |
| TIRF launcher with 488 nm (50 mW), 561 nm (50 mW), and 640 nm | Coherent | Microscopy | |
| TRITC cube | CHROMA | Microscopy | |
| oligo name | 5' modification / 3' modification | sequence (5' to 3') | Use |
| 15mer amine locking strand | 5' modification: no modification 3' modification: /3AmMO/ | AAA AAA CAT TTA TAC CCT ACC TA | locking real-time tension signal |
| 15mer Atto647N locking strand | 5' modification: Atto647N 3' modification: /3AmMO/ | AAA AAA CAT TTA TAC CCT ACC TA | locking real-time tension signal |
| 15mer non-fluoresccent locking strand | 5' modification: no modification 3' modification: no modification | A AAA AAC ATT TAT AC | locking real-time tension signal for quantitative analysis |
| 4.7 pN hairpin strand | 5' modification: no modification 3' modification: no modification | GTGAAATACCGCACAGATGCGT TTGTATAAATGTTTTTTTCATTTAT ACTTTAAGAGCGCCACGTAGCC CAGC | hairpin probe |
| amine ligand strand | 5' modification: /5AmMC6/ 3' modification: /3Bio/ | CGCATCTGTGCG GTA TTT CAC TTT | hairpin probe |
| BHQ2 anchor strand | 5' modification: /5ThiolMC6-D/ 3' modification: /3BHQ_2/ | TTTGCTGGGCTACGTGGCGCTCTT | hairpin probe |
| Cy3B ligand strand | 5' modification: Cy3B 3' modification: /3Bio/ | CGCATCTGTGCG GTA TTT CAC TTT | hairpin probe |
| unlocking strand | 5' modification: no modification 3' modification: no modification | TAG GTA GGG TAT AAA TGT TTT TTT C | unlocking accumulated tension signal |
참고문헌
- Dustin, M. L. T-cell activation through immunological synapses and kinapses. Immunological Reviews. 221 (1), 77-89 (2008).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. Journal of Cell Biology. 216 (1), 217-230 (2017).
- Feng, Y., et al. Mechanosensing drives acuity of αβ T-cell recognition. Proceedings of the National Academy of Sciences. 114 (39), 8204-8213 (2017).
- Hong, J., et al. A TCR mechanotransduction signaling loop induces negative selection in the thymus. Nature Immunology. 19 (12), 1379-1390 (2018).
- Basu, R., et al. Cytotoxic T cells use mechanical force to potentiate target cell killing. Cell. 165 (1), 100-110 (2016).
- Bashour, K. T., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences. 111 (6), 2241-2246 (2014).
- Ma, V. P. Y., Salaita, K. DNA nanotechnology as an emerging tool to study mechanotransduction in living systems. Small. 15 (26), 1900961 (2019).
- Liu, Y., Yehl, K., Narui, Y., Salaita, K. Tension sensing nanoparticles for mechano-imaging at the living/nonliving interface. Journal of the American Chemical Society. 135 (14), 5320-5323 (2013).
- Glazier, R., et al. DNA mechanotechnology reveals that integrin receptors apply pN forces in podosomes on fluid substrates. Nature Communications. 10 (1), 1-13 (2019).
- Galior, K., Liu, Y., Yehl, K., Vivek, S., Salaita, K. Titin-based nanoparticle tension sensors map high-magnitude integrin forces within focal adhesions. Nano Letters. 16 (1), 341-348 (2016).
- Zhang, Y., Ge, C., Zhu, C., Salaita, K. DNA-based digital tension probes reveal integrin forces during early cell adhesion. Nature Communications. 5, 5167 (2014).
- Liu, Y., et al. DNA-based nanoparticle tension sensors reveal that T-cell receptors transmit defined pN forces to their antigens for enhanced fidelity. Proceedings of the National Academy of Sciences. 113 (20), 5610-5615 (2016).
- Zhang, Y., et al. Platelet integrins exhibit anisotropic mechanosensing and harness piconewton forces to mediate platelet aggregation. Proceedings of the National Academy of Sciences. 115 (2), 325-330 (2018).
- Huang, J., et al. The kinetics of two-dimensional TCR and pMHC interactions determine T-cell responsiveness. Nature. 464 (7290), 932-936 (2010).
- Ma, R., et al. DNA probes that store mechanical information reveal transient piconewton forces applied by T cells. Proceedings of the National Academy of Sciences. 116 (34), 16949-16954 (2019).
- Hui, E., et al. T cell costimulatory receptor CD28 is a primary target for PD-1-mediated inhibition. Science. 355 (6332), 1428-1433 (2017).
- Whitley, K. D., Comstock, M. J., Chemla, Y. R. Elasticity of the transition state for oligonucleotide hybridization. Nucleic Acids Research. 45 (2), 547-555 (2016).
- Brockman, J. M., et al. Live-cell super-resolved PAINT imaging of piconewton cellular traction forces. Nature Methods. 17 (10), 1018-1024 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유