A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בדיקות מתח DNA כדי למפות את כוחות קולטן פיקוניוטון חולפים על ידי תאים חיסוניים
In This Article
Summary
מאמר זה מתאר פרוטוקול מפורט לשימוש בבדיקות מתח מבוססות דנ"א כדי לדמות את כוחות הקולטן המופעלים על ידי תאי מערכת החיסון. גישה זו יכולה למפות כוחות קולטן >4.7pN בזמן אמת ויכולה לשלב כוחות לאורך זמן.
Abstract
כוחות מכניים המועברים בצומת שבין שני תאים שכנים ובצומת שבין התאים לבין המטריצה החוץ תאית הם קריטיים לוויסות תהליכים רבים, החל מהתפתחות ועד אימונולוגיה. לכן, פיתוח הכלים לחקר כוחות אלה בקנה מידה מולקולרי הוא קריטי. הקבוצה שלנו פיתחה חבילה של חיישני מתח מולקולרי כדי לכמת ולדמיין את הכוחות הנוצרים על ידי תאים ומועברים לליגנדות ספציפיות. הקבוצה הרגישה ביותר של חיישני מתח מולקולרי מורכבת מסיכות שיער של חומצת גרעין. חיישנים אלה משתמשים בזוגות פלואורופור-מרווה כדי לדווח על הארכה מכנית ופתיחה של סיכות שיער DNA תחת כוח. אחד האתגרים עם חיישני מתח של סיכות שיער DNA הוא שהם הפיכים עם קיפול מהיר של סיכת שיער עם סיום המתח ולכן קשה לתעד כוחות חולפים. במאמר זה נתאר את הפרוטוקולים להכנת חיישני מתח דנ"א שניתן "לנעול" ולמנוע קיפול מחדש כדי לאפשר "אחסון" של מידע מכני. זה מאפשר הקלטה של כוחות פיקוניוטון חולפים מאוד, אשר ניתן לאחר מכן "למחוק" על ידי תוספת של חומצות גרעין משלימות להסיר את המנעול. יכולת זו לעבור בין מיפוי מתח בזמן אמת לבין אחסון מידע מכני חושפת כוחות חלשים, קצרי מועד ופחות שופעים, המשמשים בדרך כלל תאי T כחלק מתפקודי מערכת החיסון שלהם.
Introduction
תאי מערכת החיסון מתגוננים מפני פתוגנים ותאים סרטניים על ידי זחילה וסריקה מתמדת של פני השטח של תאי המטרה לאיתור אנטיגנים, תוך שהם חוצבים את פני השטח שלהם 1,2. זיהוי אנטיגן מתחיל עם קשירה בין קולטן תאי T (TCR) לבין קומפלקס היסטותאימות פפטידי-מרכזי MHC (pMHC) המתבטא על פני השטח של תאי המטרה. מכיוון שזיהוי TCR-pMHC מתרחש בצומת בין שני תאים ניידים, הוא נחשד זה מכבר כבעל כוחות מכניים. יתר על כן, זה הוביל למודל mechanosensor של הפעלת TCR, אשר מציע כי כוחות TCR לתרום לתפקוד שלה 3,4. כדי להבין מתי, היכן וכיצד כוחות מכניים תורמים לתפקוד תאי T, הכרחי לפתח כלים להמחשת הכוחות המולקולריים המועברים על ידי תאי T. באופן מסורתי, שיטות כגון מיקרוסקופ כוח משיכה (TFM) ומערכי מיקרו-עמודים משמשים לחקר כוחות תאיים 5,6. עם זאת, רגישות הכוח של TFM ומערכי מיקרו-עמודים היא בקנה מידה של ננוניוטון (nN) ולכן לעתים קרובות אינה מספיקה כדי לחקור את כוחות הפיקוניוטון המולקולרי (pN) המועברים על ידי קולטני התא7. כדי לשפר את הכוח ואת הרזולוציה המרחבית לגילוי, המעבדה שלנו הייתה חלוצה בפיתוח של בדיקות מתח מולקולרי, אשר סונתזו בתחילה באמצעות פולימרים פוליאתילן גליקול (PEG)7. גשושיות מתח מולקולרי מורכבות מ"קפיץ" מולקולרי ניתן להארכה (PEG, חלבון, DNA) שמשני צדדיו פלואורופור ומרווה ומעוגנות על משטח. כוחות המופעלים על קצה הגשושית מובילים להתרחבותה, מפרידים בין הפלואורופור למרווה, וכך יוצרים אות פלואורסצנטי חזק (איור 1A)8,9,10.
במהלך העשור האחרון פיתחנו ספרייה של סוגים שונים של גשושיות מתח מולקולרי עם יסודות קפיציים העשויים מחומצות גרעין11, חלבונים10 ופולימרים8. מבין אלה, בדיקות המתח מבוססות ה- DNA מספקות את יחס האות לרעש הגבוה ביותר ואת רגישות הכוח הגדולה ביותר, אשר מכווננת בקלות מכמה pN עד ~ 20 pN11. השתמשנו בבדיקות מתח דנ"א בזמן אמת כדי לחקור את הכוחות המולקולריים הנוצרים על-ידי סוגי תאים רבים ומגוונים, כולל פיברובלסטים, תאים סרטניים, טסיות דם ותאי מערכת החיסון11,12,13. כתב יד זה יתאר פרוטוקולים לסנתז ולהרכיב גשושיות מתח DNA על משטח כדי למפות כוחות קולטן מולקולרי ברזולוציית כוח pN באמצעות מיקרוסקופ פלואורסצנטי קונבנציונלי. בעוד שההליך הנוכחי כולל שינויים כימיים בחומצת הגרעין כדי להציג את כתב הפלואורסצנט (איור 1B), חשוב לציין שרבים משלבי השינוי והטיהור יכולים להיות במיקור חוץ לחברות סינתזת דנ"א מותאמות אישית. לכן, טכנולוגיית בדיקות מתח הדנ"א היא קלה, ונגישה לקהילות רחבות יותר של ביולוגיה של התא ומכנוביולוגיה.
בקצרה, כדי להרכיב חיישני מתח דנ"א, סיכת ראש של דנ"א עוברת הכלאה לגדיל ליגנד פלואורסצנטי על זרוע אחת וגדיל עוגן מרווה על הזרוע השנייה, ואז משותקת על מצע זכוכית (איור 1C, מתח בזמן אמת). בהיעדר כוח מכני, סיכת הראש סגורה, וכך הפלואורסצנטיות מרווה. עם זאת, כאשר הכוח המכני המופעל גדול מה-F1/2 (הכוח בשיווי משקל שמוביל להסתברות של 50% להתגלות), סיכת הראש נמסה מכנית, ונוצר אות פלואורסצנטי.
בהתבסס על חיישן מתח דנ"א בזמן אמת, אנו גם מתארים פרוטוקולים למיפוי כוחות מצטברים, דבר שימושי במיוחד לחקר אינטראקציות בין קולטנים על תאי מערכת החיסון לבין הליגנד הטבעי שלהם. הסיבה לכך היא שקולטנים חיסוניים מציגים לעתים קרובות קשרים קצרי מועד 3,14. הכוחות המצטברים מצולמים באמצעות גדיל "נעילה" שנקשר באופן מועדף לסיכות ראש פתוחות של דנ"א ומאפשר אחסון של אותות פלואורסצנטיים הקשורים לאירועי משיכה מכניים (איור 1C, מתח נעול). גדיל הנעילה נועד לקשור אתר קשירה מסתורי שנחשף עם התכה מכנית של סיכת הראש ולנעול את סיכת השיער במצב פתוח על ידי חסימת קיפול מחדש של סיכת השיער, ובכך לאחסן את אות המתח, וליצור מפת מתח מצטברת. יתר על כן, גדיל הנעילה מתוכנן עם אחיזת אצבע בעלת שמונה נוקלאוטידים, המאפשרת תגובת תזוזה של גדיל בתיווך הבוהן עם המשלים המלא שלו, גדיל ה"נעילה". עם הוספת גדיל הנעילה, גדיל הנעילה הכבול מוסר ממבנה סיכת השיער, מוחק את אות המתח המאוחסן ומאפס את סיכת הראש בחזרה למצב בזמן אמת.
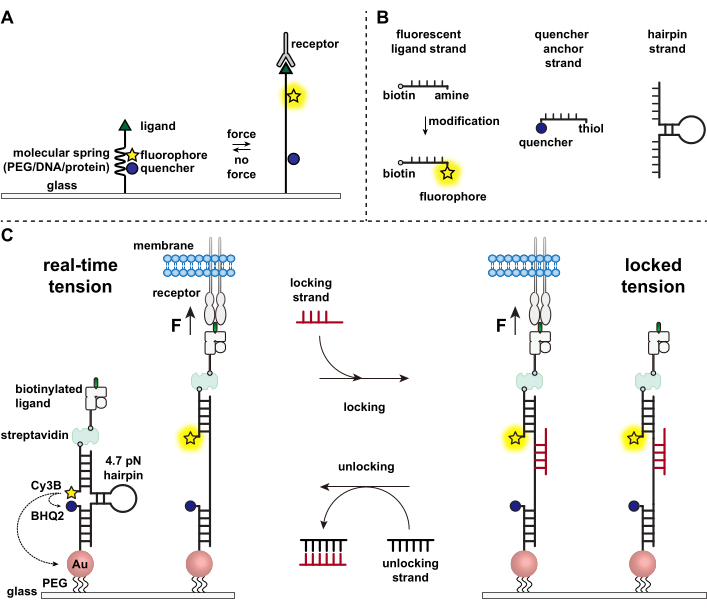
איור 1: סכמה של גשושיות המתח המולקולרי החדישות. (A) תכנון כללי של גשושית מתח מולקולרית בזמן אמת, (B) גדילים למבנה גשושית מתח מבוססת DNA, ו-(C) גשושיות מתח מהונדסות-מבוססות DNA והמעבר שלהן בין מצב בזמן אמת למצב נעול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הפרוטוקול העיקרי מורכב מארבעה חלקים עיקריים - הכנת אוליגונוקלאוטידים, הכנת פני שטח, הדמיה וניתוח נתונים. פרוטוקול זה הודגם בהצלחה על ידי המעבדה שלנו ואחרים בתאי T נאיביים ומופעלים OT-1 CD8+, תאי OT-II CD4+, כמו גם היברידיות, וניתן ליישם אותו כדי לחקור קולטנים שונים של תאי מערכת החיסון, כולל קולטן תאי T, קולטן מוות תאי מתוכנת (PD1) וכוחות אנטיגן 1 הקשורים לתפקוד לימפוציטים (LFA-1). תאי T נאיביים OT-1 CD8+ משמשים כקו תאים לדוגמה במאמר זה.
Protocol
העכברים הטרנסגניים OT-1 שוכנים במתקן המחלקה למשאבי בעלי חיים באוניברסיטת אמורי. כל הניסויים אושרו ובוצעו תחת פרוטוקול הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC).
1. הכנת אוליגונוקלאוטיד
- להמיס את הדנ"א של גדיל הליגנד במים (התנגדות של 18.2 MΩ, בשימוש לאורך כל הפרוטוקול). מערבלים ומסובבים את התמיסה עם צנטריפוגה שולחנית. כוונן את נפח המים כך שהריכוז הסופי הוא 1 mM. לאמת את הריכוז באמצעות ספקטרופוטומטר ננו-טיפות כדי למדוד את הבליעה ב 260 ננומטר ולקבוע את הריכוז הסופי בהתבסס על מקדם ההכחדה של האוליגונוקלאוטידים.
הערה: לגדיל הליגנד יש שינוי בכל טרמינוס, 5' אמין ו-3' ביוטין, כדי להצמיד את הפלואורופור ולהציג את הליגנד הביוטינילציה. קבוצת האמין בגדיל הליגנד צריכה להיות מצומדת עם פלואורופור. צבע Cy3B משמש לצמידות זו בשל בהירותו הגבוהה ויציבות האור, אך הוא אינו מוצע בדרך כלל באופן מסחרי ודורש צימוד פנימי. בהתאם לכך, החלק הבא מתאר את הצמידות בין אמינים לצבעי אסטר של NHS. עבור משתמשי קצה שאין להם גישה למתקנים או משאבים לשינוי חומצות גרעין, ניתן לרכוש במקום זאת חומצות גרעין שעברו שינוי מספקי סינתזת DNA מותאמים אישית המציעים צבעים בהירים וניתנים לצילום, כגון משפחת הצבעים Alexa ו-Atto. - הכן פתרונות 10x PBS ו- 1 M NaHCO3 . יש לערבב 10 μL של תמיסת גדיל ליגנד אמין 1 mM (10 nmol) עם 10 μL של 10x PBS, 10 μL של 1 M NaHCO3 ו-60 μL של H2O. יש להמיס 50 מיקרוגרם של אסטר Cy3B NHS ב-10 μL של DMSO מיד לפני השימוש ולהוסיף לתערובת לקבלת נפח תגובה כולל של 100 μL. הוסף את Cy3B NHS ester אחרון. יש לאפשר להגיב בטמפרטורת החדר למשך שעה או 4 מעלות צלזיוס למשך הלילה.
- הכינו את גדיל הנעילה Atto647N על ידי הצמדת גדיל נעילת האמין עם אסטר Atto647N NHS. הכן פתרון 10x PBS ו- 1 M NaHCO3 . יש לערבב 10 μL של תמיסת גדיל נעילת אמין 1 mM (10 nmol) עם 10 μL של 10x PBS, 10 μL של 1 M NaHCO3 ו-60 μL של H2O. יש להמיס 50 מיקרוגרם של Atto647N NHS ester ב-10 μL של DMSO מיד לפני השימוש ולהוסיף לתערובת לקבלת נפח תגובה כולל של 100 μL. הוסף Atto647N NHS ester אחרון. יש לאפשר להגיב בטמפרטורת החדר למשך שעה או 4 מעלות צלזיוס למשך הלילה.
- לאחר התגובות, הסירו תוצרי לוואי, עודפי צבע ומלחים על ידי סינון ג'ל התפלה P2. לדלל את תערובת התגובה עם H2O לנפח כולל של 300 μL, אשר מתאים לשלב הטיהור HPLC הבא. הוסף 650 μL של ג'ל P2 לח להתקן צנטריפוגלי וסחרור כלפי מטה ב 18,000 x גרם במשך דקה אחת. הסר את הנוזל בתחתית המכשיר, הוסף את תערובת התגובה לעמודה המכילה ג'ל P2, סובב כלפי מטה ב- 18,000 x גרם למשך דקה אחת ואסוף את תערובת התגובה בתחתית המכשיר.
הערה: ג'ל P2 צריך להיות hydrated לפחות 4 שעות לפני השימוש עם H2O. - לטהר את תערובת התגובה המותפלת עם HPLC באמצעות עמודת C18 המיועדת לטיהור אוליגונוקלאוטידים, עם ממס A: 0.1 M TEAA ב- H2O ו- B: ACN כשלב הנייד לפליטת שיפוע ליניארי 10-100% B במשך 50 דקות בקצב זרימה של 0.5 מ"ל/דקה. הזריקו את תערובת התגובה המותפלת ב-HPLC בפאזה הפוכה עם לולאת הזרקה של 500 μL לטיהור. אספו את המוצר שיש לו שיא ספיגה עבור הדנ"א (260 ננומטר) ושיא ספיגה עבור הפלואורופור (560 ננומטר עבור Cy3B ו-647 ננומטר עבור Atto647N) וייבשו אותם ברכז ואקום צנטריפוגלי למשך הלילה (ראו איור 2A).
- הרכיבו מחדש את מוצר צבע האוליגו המיובש ב-100 מיקרוליטר מים. קבע את הריכוז של גדיל ליגנד Cy3B וגדיל נעילה Atto647N באמצעות ספקטרופוטומטר ננו-טיפות. ודא שיחס סימון הצבע קרוב ל-1:1. נכון לספיגה של 260 ננומטר של הצבע במידת הצורך בעת קביעת ריכוז האוליגונוקלאוטידים.
- יש לאמת את המוצר המטוהר עם MALDI-TOF-MS באמצעות 3-HPA כמצע ב-50% ACN/H2O עם 0.1% TFA ו-5 מ"ג/מ"ל אמוניום ציטראט באמצעות 0.5 μL של המוצר ב-1-5 מיקרומטר להכנת דגימת MALDI-TOF-MS. דוגמה לספקטרום מסות ניתן למצוא באיור 2B.
- ממיסים את גדיל סיכת הראש ואת גדיל העוגן המרווה במים ומוודאים שריכוז תמיסות הציר הוא בין 50 ל-100 מיקרומטר.
הערה: גדיל סיכת השיער אינו שונה וניתן לסנתז אותו ישירות מספק. גדיל העוגן כולל קבוצת עיגון תיול ומרווה BHQ2 וניתן לסנתז אותו ישירות מספק. - Aliquot כל האוליגונוקלאוטידים. לשימוש ואחסון לטווח קצר, אחסנו אוליגונוקלאוטידים אלה בטמפרטורה של 4°C. לאחסון לטווח ארוך, יש להקפיא ולשמור אותם בטמפרטורה של -20°C. בשלב זה, כל האוליגונוקלאוטידים מוכנים להרכבת בדיקת מתח הדנ"א.
הערה: מחזורי הקפאה-הפשרה חוזרים ונשנים אינם בעייתיים עבור אוליגונוקלאוטידים.
2. הכנת פני השטח
הערה: הכנת מצעי בדיקת מתח סיכת שיער DNA אורכת יומיים. בדיקת המתח של סיכת השיער DNA תתפקד על כיסויי זכוכית.
- יום 1
- הניחו את הכיסויים בקוטר 25 מ"מ על מדף פוליטטרה-פלואוראתילן בכד של 50 מ"ל. כל מדף יכול להכיל עד 8 כיסויים. שטפו את הכיסויים על ידי טבילה במים שלוש פעמים.
- הוסיפו 40 מ"ל של תמיסת אתנול מעורבבת עם מים ביחס של 1:1 (v:v) לכד המכיל את המתלה והכיסויים, ואטמו את הכד באמצעות סרט פרפין.
- סוניק את הכד למשך 15 דקות בשואב אולטרסאונד (תדר הפעלה 35 קילוהרץ) כדי לנקות את הכיסויים. לאחר הסוניקציה, יש להשליך את הנוזל ולשטוף את הכד עם המתלה ולכסות בו במים לפחות 6 פעמים כדי להסיר את שאריות הממס האורגני.
- הכינו תמיסת פיראנה טרייה על ידי ערבוב חומצה גופרתית ומי חמצן ביחס של 3:1. כדי להפוך 40 מ"ל של פתרון פיראנה, להוסיף 30 מ"ל של חומצה גופרתית נקי 50 מ"ל הראשון ולאחר מכן לאט להוסיף 10 מ"ל של H 2 O2. תמיסת פיראנה תתחמם ותבעבע במהירות עם הוספת H 2O2. מערבבים בעדינות את הפיראנה בעזרת קצה פיפטה מזכוכית.
- לאחר מכן, העבירו את המתלה שמחזיק את הכיסויים לכוס המכילה תמיסת פיראנה מעורבת בעדינות לחריטה (איור 3A). תנו לתמיסת פיראנה לעבור הידרוקסילאט ונקו את הכיסויים למשך 30 דקות בטמפרטורת החדר. לאחר חריטת פיראנה, מעבירים את המדף באמצעות פינצטה מפלדה או פוליטטרה-פלואוראתילן לכוס נקייה של 50 מ"ל במים ושוטפים שוב במים לפחות 6 פעמים.
זהירות: כמויות גדולות של חומרים אורגניים עלולות להגיב במרץ עם תמיסת פיראנה ועלולות לגרום לפיצוץ. היזהר ותמיד עבוד עם פתרון פיראנה במכסה אדים. הקפידו ללבוש מעיל מעבדה, כפפות ומשקפי מגן. לעולם אל תאחסנו תמיסת פיראנה טרייה בכלי אטום.
הערה: יחס מי חמצן לחומצה גופרתית צריך להישמר מתחת ל-1:2 (v:v) ולעולם לא יעלה על 1:1. כאשר שוקעים את המדף עם כיסויים בתמיסת פיראנה, מניחים אותם בתמיסה לאט ובזהירות. אין להשליך את התמיסה מיד לאחר התחריט, מכיוון שהיא עדיין פעילה וחמה. השאירו אותו בכוס למשך הלילה לפני ששפכו אותו למיכל פסולת החומצה. - טבלו את המתלה המחזיק את הכיסויים בכוס 50 מ"ל עם אתנול 40 מ"ל כדי להסיר מים. השליכו את האתנול וחזרו על הפעולה 3 פעמים כדי לוודא שהמים הוסרו.
- לאחר מכן טבלו את המדף ב-3% אמינופרופיל טריאתוקסי סילאן (APTES) (v/v) ב-40 מ"ל אתנול כדי להגיב עם ה-OH על החלקות במשך שעה אחת בטמפרטורת החדר (איור 3B).
הערה: אתנול יכול להיות מוחלף על ידי אצטון. - יש לשטוף את המשטחים 6 פעמים על ידי טבילתם באתנול במינון 40 מ"ל, ולאחר מכן לייבש בתנור בטמפרטורה של 80°C למשך 20 דקות. לאחר הקירור, אחסנו את הכיסויים המיובשים שעברו שינוי אמין בטמפרטורה של -20°C לשימוש עתידי (עד 6 חודשים).
- מכסים את הצד הפנימי התחתון של צלחות פטרי פלסטיק בקוטר 10 ס"מ בסרט פרפין. סרט הפרפין מונע מהכיסויים להחליק בתוך צלחת הפטרי ומסייע לשמור על התמיסה לשלבים הבאים של התפקוד להישאר על הכיסויים. הניחו את כיסויי האמין המקוררים בצלחות הפטרי. הצד שצריך להיות פונקציונלי צריך להיות עם הפנים כלפי מעלה.
- כדי לשנות את קבוצות האמינים על תלושי הכיסוי, הוסיפו 300 μL של 0.5% w/v חומצה ליפואית PEG NHS (LA-PEG-SC) ו-2.5% w/v mPEG NHS (mPEG-SC) ב-0.1 M NaHCO3 על כל כיסוי, ודגרו במשך שעה אחת בטמפרטורת החדר (איור 3C). עבור כל כיסוי בקוטר 25 מ"מ, יש לשקול 1.5 מ"ג LA-PEG-SC ו-7.5 מ"ג mPEG-SC. להמיס את ריאגנטים NHS מיד לפני הוספת המשטחים, כפי שיש להם מחצית חיים קצרה (~ 10 דקות) בתמיסה מימית בטמפרטורת החדר. לאחר התגובה, יש לשטוף את המשטחים 3 פעמים במים.
הערה: תגובת NHS יכולה להתבצע ב 4 °C בן לילה. ריאגנטים NHS יש מחצית חיים ארוכה יותר לפני הידרוליזה ב 4 ° C, אשר סביב 4-6 שעות. התוצאה תהיה הליך הכנת משטח של שלושה ימים. - הוסף 100 μL של 0.1 M NaHCO3 המכיל 1 מ"ג / מ"ל של אצטט sulfo-NHS לקבוצה של כיסויי "סנדוויץ'" (שני כיסויים הפונים זה כלפי זה עם חיץ תגובה ביניהם). אפשר לפסיבציה להתרחש במשך 30 דקות לפחות. כדי לשמור מגיב, שלב זה יכול להיעשות עם 50 μL של 1 מ"ג / מ"ל sulfo-NHS אצטט. יש לשטוף במים שלוש פעמים לאחר פסיבציה.
- הוסיפו 0.5 מ"ל של ננו-חלקיקי זהב (AuNP, 8.8 ננומטר, חומצה טאנית, 0.05 מ"ג/מ"ל) לכל כיסוי ודגרו במשך 30 דקות בטמפרטורת החדר (איור 3D). כדי להציל את המגיב, שלב זה יכול להיעשות על ידי סנדוויץ' שני כיסויים גם כן. ודא שאין מלחים במערכת מהשלבים הקודמים כדי למנוע הצטברות של ננו-חלקיקי זהב. אין להשאיר את הכיסויים להתייבש לאחר שלב זה.
- בינתיים, טרום הכלאה של סיכת ראש 4.7 pN, גדיל ליגנד Cy3B וגדיל עוגן BHQ2 היוצרים את גשושיות מתח הדנ"א בונות ביחס של 1.1:1:1 ב-1 M NaCl ב-300 ננומטר בצינור PCR. אנאל את הגדילים על ידי חימום התמיסה עד 95 ° C במשך 5 דקות, ולאחר מכן בהדרגה לקרר על ידי הפחתת הטמפרטורה ל 20 ° C במשך 30 דקות במחזור תרמי.
- שטפו את הכיסויים במים שלוש פעמים לאחר 30 דקות דגירה עם ננו-חלקיקי זהב. הוסף גדיל עוגן BHQ2 נוסף (ממלאי של 100 מיקרומטר) לתמיסת ה- DNA המחושלת כדי להפוך את היחס בין גדיל העוגן BHQ2 לגדיל ליגנד Cy3B ל- 10:1. בשלב זה, תמיסת הדנ"א צריכה להכיל 300 ננומטר של מבנה בדיקת מתח וגדיל BHQ2 של 2.7 מיקרומטר. הוסיפו 100 מיקרוליטר לכל שני כיסויים כדי ליצור את ה"כריך" (איור 3E).
- מניחים בזהירות כדור רקמת מעבדה רטוב בצלחת הפטרי (הרחק מכיסויים) ואוטמים את הכלי בסרט פרפין כדי למנוע מהתמיסה להתייבש. מכסים את התבשיל בנייר כסף ודגרים ב-4 מעלות צלזיוס למשך הלילה.
- יום 2
- שטפו את הבדיקות העודפות מהכיסויים עם 1x PBS. בדוק את איכות פני השטח של בדיקת מתח DNA תחת מיקרוסקופ אפיפלואורסצנטי.
- הכינו 40 מק"ג/מ"ל של סטרפטאווידין ב-PBS 1x ודגרו על כיסויים במשך 30 דקות בטמפרטורת החדר (איור 3F). בדרך כלל, 100 μL מספיק עבור כיסוי 25 מ"מ. יש לשטוף עם PBS 3 פעמים לאחר הדגירה כדי לשטוף את הכמות העודפת של סטרפטווידין.
- הכינו 40 מיקרוגרם/מ"ל נוגדן/ליגנד ביוטינילציה ב-1x PBS. הוסיפו 50-100 מיקרוליטר לכריך ודגרו במשך 30 דקות בטמפרטורת החדר (איור 3G). יש לשטוף עם PBS שלוש פעמים לאחר הדגירה כדי לשטוף את הכמות העודפת של נוגדן/ליגנד ביוטינילציה.
- הרכיבו בזהירות את תאי ההדמיה הנקיים עם המשטחים. משטחים יכולים להיסדק בקלות בעת הידוק החדרים. הוסיפו 0.5-1 מ"ל של תמיסת מלח מאוזנת של האנק (HBSS) לתאי ההדמיה ושמרו אותם מוכנים להדמיה עם תאים (איור 3H).
3. הדמיה של כוחות קולטן התא
- הכינו תאי חיסון בעלי עניין בHBSS ב 1-2 x 106 תאים / מ"ל.
הערה: תאים נאיביים OT-1 CD8+ משמשים כדוגמה במאמר זה. לטהר תאי T נאיביים OT-1 CD8+ A מטחול של עכברים שהוקרבו באמצעות ערכת בידוד תאי CD8+ T של עכבר MACS עם מפריד MACS בהתאם להוראות היצרן. בודד והעשיר את תאי CD8+ T על ידי הסרת כל תאי T שאינם CD8+ כי קוקטייל נוגדנים מדלדל מגנטית קשור. יש להשהות מחדש תאי T נאיביים OT-1 CD8+ מטוהרים ב-HBSS ב-2 x 106 תאים/מ"ל ולשמור על קרח לפני השימוש. - בדוק את האיכות של משטח בדיקת מתח סיכת שיער DNA תחת מיקרוסקופ פלואורסצנטי (100x מטרה) לבקרת איכות לפני הוספת ליגנדות או תאי ציפוי. צלם וכמת את עוצמת הרקע הממוצעת בערוץ Cy3B של משטח בדיקת מתח של סיכת שיער DNA מלפחות 5 מיקומים שונים ו-3 עותקים משוכפלים. שמרו על עקביות בתנאי רכישת ההדמיה כך שניתן יהיה להשתמש בערך זה כסמן אמין של איכות פני השטח וצפיפות הגשושית (איור 4C).
הערה: כמת את מספר גדילי הדנ"א לכל ננו-חלקיק זהב ואת מספר חלקיקי הזהב למיקרומטר2 בפעמים הראשונות של הכנת פני השטח על פי ספרות12, אשר יכול לשמש סמן אמין נוסף של איכות פני השטח. - צלחת ~ 4 x 10 4 - 10 x 104 תאים על כל בדיקת מתח DNA מתפקדת כיסוי ולאפשר להם להתחבר ולהפיץ במשך ~ 15 דקות בטמפרטורת החדר.
- כאשר תאים מצופים על גשושיות המתח של סיכת השיער של הדנ"א ומתחילים להתפשט, דמיינו את אותות הפלואורסצנטיות שנוצרים בערוץ Cy3B עם המטרה של פי 100 (איור 3I).
- לאחר שתאים מתחילים לייצר אות מתח בזמן אמת על משטח בדיקת המתח של סיכת השיער של הדנ"א בערוץ Cy3B, רכשו תמונות הן בערוצי Cy3B והן בערוצי Atto647N (מיקרוסקופ TIRF נותן יחס אות לרעש טוב יותר מאשר אפיפלואורסצנציה). לאחר מכן, הוסף גדיל Atto647N לתאי ההדמיה בריכוז סופי של 200 ננומטר לצורך הכלאה סלקטיבית מכנית.
- לאחר 10 דקות של דגירה, הסירו במהירות ובעדינות את החיץ המכיל את גדיל הנעילה הפלואורסצנטי Atto647N והוחלפו במלחים מאוזנים טריים של האנק. תמונה בשני ערוצי Cy3B ו- Atto647N שוב ולקבוע את מקדם המתאם של פירסון עם תוכנת פיג'י15.
- בנקודת העניין של החקירה, הציגו גדיל נעילה שאינו פלואורסצנטי לתאים בתא ההדמיה כדי לאחסן את אות המתח. מכינים מלאי גדילי נעילה (100 מיקרומטר) ומוסיפים לתאים בריכוז סופי של 1 מיקרומטר. פיפטה עדינה לערבוב. משך הנעילה יכול להשתנות אך 10 דקות הוא הזמן המומלץ.
- רכשו סרטים בהילוך מהיר או תמונות של נקודות קצה באפיפלואורסנציה הן למיפוי מתח איכותי והן לניתוח כמותי לפי הצורך (איור 3J ואיור 5).
הערה: אם יש צורך במדידת מתח במספר נקודות זמן, התחל למחוק אותות מתח מאוחסנים על-ידי הוספת גדיל פתיחת נעילה. כדי להימנע משטיפה עודפת, משתמשים בריכוז סופי גבוה יותר של גדיל פותח ב-2 מיקרומטר כדי להתחיל תגובת תזוזה בתיווך גדיל הבוהן עם גדיל הנעילה למשך 3 דקות, אשר מוחקת את האותות המאוחסנים (איור 3J). שטפו בעדינות את עודפי האוליגונוקלאוטידים עם HBSS. בדיקת המתח של סיכת השיער של הדנ"א עולה על פני השטח והתאים מוכנים לסבב נוסף של אחסון ומיפוי מתח. פתיחת אותות מתח אינה הכרחית אם רק נקודת זמן אחת מעניינת במחקר.
4. ניתוח נתונים
הערה: ניתוח התמונה מתבצע באמצעות תוכנת פיג'י, והניתוח הכמותי מתבצע באמצעות תוכנת ניתוח.
- תקן כל סטייה במהלך רכישת תמונה באמצעות הפקודה ' תקן סטייה תלת-ממדית ' ב'רישום ' בתפריט ' תוספים' .
- הסירו את רקע המצלמה של התמונה באמצעות הפקודה ' הפחת ' בתפריט 'תהליך '.
- קבע את מקדם המתאם של פירסון עם הפונקציה Colocalization תחת תפריט ניתוח .
- ממוצע וחסר את הרקע הפלואורסצנטי שנוצר על ידי הגשושיות שלא נפתחו משלושה אזורי רקע מקומיים שונים. ציירו ROI של תאים על תמונות שהוחסרו ברקע או על תמונות RICM (מיקרוסקופ ניגודיות של הפרעות השתקפות) בעזרת הכלי בחירות חופשיות של Image J. מדוד כל מדד מעניין של החזר ההשקעה, לדוגמה, עוצמת פלואורסצנטיות משולבת ותפוסת מתח באמצעות כלי מדידה תחת תפריט ניתוח (איור 6).
- ייצא את המדידות לניתוח כמותי באמצעות תוכנת ניתוח.
- התווה את הנתונים עם כל תוכנת ניתוח.
תוצאות
כאן אנו מציגים תמונות מייצגות של בקרת איכות פני השטח (איור 4). משטח באיכות גבוהה צריך להיות בעל רקע נקי בערוץ RICM (איור 4B), ועוצמת פלואורסצנטיות אחידה בערוץ Cy3B (איור 4C). עם אותו ציוד הדמיה ותנאי רכישת דימות פלואורסצנטיים זהים, עוצמת פלואורסצנטיו...
Discussion
בעזרת ההליכים המפורטים המובאים כאן, ניתן להכין מצעי בדיקת מתח של DNA כדי למפות ולכמת את מתח הקולטן המיוצר על ידי תאי מערכת החיסון. כאשר תאים מצופים על מצע בדיקת המתח של סיכת השיער של הדנ"א, הם נוחתים, מתחברים ומתפשטים כאשר הקולטנים חשים את הליגנדות הן מבחינה כימית והן מבחינה מכנית, האחרונה שב?...
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
עבודה זו נתמכה על ידי מענקי NIH R01GM131099, NIH R01GM124472 ו- NSF CAREER 1350829. אנו מודים למתקן טטרמר NIH עבור ליגנדות pMHC. מחקר זה נתמך, בחלקו, על ידי Emory Comprehensive Glycomics Core.
Materials
| Name | Company | Catalog Number | Comments |
| 3-hydroxypicolinic acid (3-HPA) | Sigma | 56197 | maldi-TOF-MS matrix |
| mPEG-SC | Biochempeg | MF001023-2K | surface prep |
| (3-Aminopropyl)triethoxysilane | Acros | AC430941000 | surface prep |
| 10x Red blood cell lysis buffer | Biolegend | 00-4333-57 | buffer |
| 8.8 nm gold nanoparticles, tannic acid | Nanocomposix | customized order | surface prep |
| Atto647N NHS ester | Sigma | 18373-1MG-F | fluorophore, oligo prep |
| Attofluor Cell Chamber, for microscopy | Thermo Fisher Scientific | A7816 | imaging |
| BD Syringes only with Luer-Lok | BD bioscience | 309657 | cells |
| biotinylated anti-mouse CD3e | ebioscience | 13-0031-82 | antibody/ligand |
| Biotinylated pMHC ovalbumin (SIINFEKL) | NIH Tetramer Core Facility at Emory University | NA | antibody/ligand |
| bovine serum albumin | Sigma | 735078001 | block non-specific interactions |
| Cell strainers | Biologix | 15-1100 | cells |
| Coverslip Mini-Rack, teflon | Thermo Fisher Scientific | C14784 | surface prep |
| Cy3B NHS ester | GE Healthcare | PA63101 | fluorophore, oligo prep |
| Dulbecco's phosphate-buffered saline (DPBS) | Corning | 21-031-CM | buffer |
| ethanol | Sigma | 459836 | surface prep |
| Hank’s balanced salts (HBSS) | Sigma | H8264 | buffer |
| hydrogen peroxide | Sigma | H1009 | surface prep |
| LA-PEG-SC | Biochempeg | HE039023-3.4K | surface prep |
| Midi MACS (LS) startup kit | Miltenyi Biotec | 130-042-301 | cells |
| mouse CD8+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | cells |
| Nanosep MF centrifugal devices | Pall laboratory | ODM02C35 | oligo prep |
| No. 2 round glass coverslips | VWR | 48382-085 | surface prep |
| NTA-SAM | Dojindo Molecular Technologies | N475-10 | surface prep |
| P2 gel | Bio-rad | 1504118 | oligo prep |
| sufuric acid | EMD Millipore Corporation | SX1244-6 | surface prep |
| Sulfo-NHS acetate | Thermo Fisher Scientific | 26777 | surface prep |
| Equipment | |||
| Agilent AdvanceBio Oligonucleotide C18 column, 4.6 x 150 mm, 2.7 μm | 653950-702 | oligonucleotide preparation | |
| Barnstead Nanopure water purifying system | Thermo Fisher | water | |
| CFI Apo 100× NA 1.49 objective | Nikon | Microscopy | |
| Cy5 cube | CHROMA | Microscopy | |
| evolve electron multiplying charge coupled device (EMCCD) | Photometrics | Microscopy | |
| High-performance liquid chromatography | Agilent 1100 | oligonucleotide preparation | |
| Intensilight epifluorescence source | Nikon | Microscopy | |
| Matrix-assisted laser desorption/ionization time-of-flight mass spectrometer (MALDI-TOF-MS) | Voyager STR | oligonucleotide preparation | |
| Nanodrop 2000 UV-Vis Spectrophotometer | Thermo Fisher | oligonucleotide preparation | |
| Nikon Eclipse Ti inverted microscope | Nikon | Microscopy | |
| Nikon Perfect Focus System | Nikon | Microscopy | |
| NIS Elements software | Nikon | Microscopy | |
| quad band TIRF 405/488/561/647 cube | CHROMA | Microscopy | |
| RICM cube | CHROMA | Microscopy | |
| TIRF launcher with 488 nm (50 mW), 561 nm (50 mW), and 640 nm | Coherent | Microscopy | |
| TRITC cube | CHROMA | Microscopy | |
| oligo name | 5' modification / 3' modification | sequence (5' to 3') | Use |
| 15mer amine locking strand | 5' modification: no modification 3' modification: /3AmMO/ | AAA AAA CAT TTA TAC CCT ACC TA | locking real-time tension signal |
| 15mer Atto647N locking strand | 5' modification: Atto647N 3' modification: /3AmMO/ | AAA AAA CAT TTA TAC CCT ACC TA | locking real-time tension signal |
| 15mer non-fluoresccent locking strand | 5' modification: no modification 3' modification: no modification | A AAA AAC ATT TAT AC | locking real-time tension signal for quantitative analysis |
| 4.7 pN hairpin strand | 5' modification: no modification 3' modification: no modification | GTGAAATACCGCACAGATGCGT TTGTATAAATGTTTTTTTCATTTAT ACTTTAAGAGCGCCACGTAGCC CAGC | hairpin probe |
| amine ligand strand | 5' modification: /5AmMC6/ 3' modification: /3Bio/ | CGCATCTGTGCG GTA TTT CAC TTT | hairpin probe |
| BHQ2 anchor strand | 5' modification: /5ThiolMC6-D/ 3' modification: /3BHQ_2/ | TTTGCTGGGCTACGTGGCGCTCTT | hairpin probe |
| Cy3B ligand strand | 5' modification: Cy3B 3' modification: /3Bio/ | CGCATCTGTGCG GTA TTT CAC TTT | hairpin probe |
| unlocking strand | 5' modification: no modification 3' modification: no modification | TAG GTA GGG TAT AAA TGT TTT TTT C | unlocking accumulated tension signal |
References
- Dustin, M. L. T-cell activation through immunological synapses and kinapses. Immunological Reviews. 221 (1), 77-89 (2008).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. Journal of Cell Biology. 216 (1), 217-230 (2017).
- Feng, Y., et al. Mechanosensing drives acuity of αβ T-cell recognition. Proceedings of the National Academy of Sciences. 114 (39), 8204-8213 (2017).
- Hong, J., et al. A TCR mechanotransduction signaling loop induces negative selection in the thymus. Nature Immunology. 19 (12), 1379-1390 (2018).
- Basu, R., et al. Cytotoxic T cells use mechanical force to potentiate target cell killing. Cell. 165 (1), 100-110 (2016).
- Bashour, K. T., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences. 111 (6), 2241-2246 (2014).
- Ma, V. P. Y., Salaita, K. DNA nanotechnology as an emerging tool to study mechanotransduction in living systems. Small. 15 (26), 1900961 (2019).
- Liu, Y., Yehl, K., Narui, Y., Salaita, K. Tension sensing nanoparticles for mechano-imaging at the living/nonliving interface. Journal of the American Chemical Society. 135 (14), 5320-5323 (2013).
- Glazier, R., et al. DNA mechanotechnology reveals that integrin receptors apply pN forces in podosomes on fluid substrates. Nature Communications. 10 (1), 1-13 (2019).
- Galior, K., Liu, Y., Yehl, K., Vivek, S., Salaita, K. Titin-based nanoparticle tension sensors map high-magnitude integrin forces within focal adhesions. Nano Letters. 16 (1), 341-348 (2016).
- Zhang, Y., Ge, C., Zhu, C., Salaita, K. DNA-based digital tension probes reveal integrin forces during early cell adhesion. Nature Communications. 5, 5167 (2014).
- Liu, Y., et al. DNA-based nanoparticle tension sensors reveal that T-cell receptors transmit defined pN forces to their antigens for enhanced fidelity. Proceedings of the National Academy of Sciences. 113 (20), 5610-5615 (2016).
- Zhang, Y., et al. Platelet integrins exhibit anisotropic mechanosensing and harness piconewton forces to mediate platelet aggregation. Proceedings of the National Academy of Sciences. 115 (2), 325-330 (2018).
- Huang, J., et al. The kinetics of two-dimensional TCR and pMHC interactions determine T-cell responsiveness. Nature. 464 (7290), 932-936 (2010).
- Ma, R., et al. DNA probes that store mechanical information reveal transient piconewton forces applied by T cells. Proceedings of the National Academy of Sciences. 116 (34), 16949-16954 (2019).
- Hui, E., et al. T cell costimulatory receptor CD28 is a primary target for PD-1-mediated inhibition. Science. 355 (6332), 1428-1433 (2017).
- Whitley, K. D., Comstock, M. J., Chemla, Y. R. Elasticity of the transition state for oligonucleotide hybridization. Nucleic Acids Research. 45 (2), 547-555 (2016).
- Brockman, J. M., et al. Live-cell super-resolved PAINT imaging of piconewton cellular traction forces. Nature Methods. 17 (10), 1018-1024 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved