A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
انسداد الجراحة المجهرية لاندماج الخصيتين في Spodoptera litura
In This Article
Summary
تم إدخال رقائق الألومنيوم جراحيا بين خصيتي Spodoptera litura لعرقلة اندماج الخصية. يتضمن الإجراء التجميد والتثبيت والتطهير والشق ووضع الحاجز والخياطة والتغذية بعد العملية الجراحية والتفتيش. يوفر هذا النهج طريقة للتداخل مع تكوين الأنسجة.
Abstract
بدلا من استخدام الطرق الجينية مثل تداخل الحمض النووي الريبي (RNAi) وتكرار الباليندروميك القصير المتجمع بانتظام (CRISPR) / endonuclease Cas9 المرتبط بكريسبر ، تم إدخال حاجز مادي جراحيا مجهريا بين خصيتي Spodoptera litura لدراسة تأثير هذه الجراحة المجهرية على نموها وتكاثرها. بعد إدخال رقائق الألومنيوم بين الخصيتين ، استمر طرح الحشرات أثناء التحول بشكل طبيعي. لم يتغير نمو الحشرات وتطورها بشكل ملحوظ. ومع ذلك ، تغير عدد حزم الحيوانات المنوية إذا تم إيقاف اندماج الخصيتين عن طريق الجراحة المجهرية. تشير هذه النتائج إلى أن منع اندماج الخصية يمكن أن يؤثر على قدرة الذكور على الإنجاب. يمكن تطبيق هذه الطريقة بشكل أكبر لمقاطعة الاتصال بين الأعضاء لدراسة وظيفة مسارات إشارات محددة. بالمقارنة مع الجراحة التقليدية ، تتطلب الجراحة المجهرية فقط تخديرا مجمدا ، وهو أفضل من تخدير ثاني أكسيد الكربون. تقلل الجراحة المجهرية أيضا من منطقة موقع الجراحة وتسهل التئام الجروح. ومع ذلك ، فإن اختيار المواد ذات الوظائف المحددة يحتاج إلى مزيد من التحقيق. تجنب إصابة الأنسجة أمر بالغ الأهمية عند إجراء شقوق أثناء العملية.
Introduction
الانصهار هو ظاهرة شائعة في تطور الأنسجة أو الأعضاء. ومن الأمثلة على ذلك الإغلاق الظهري وإغلاق الصدر في ذبابة الفاكهة 1 ومورفوجينيا الحنك ، ومورفوجينيا الأنبوب العصبي ، ومورفوجينيا القلب في الفئران والدجاج 2. تم تطبيق كريسبر والحمض النووي الريبي للتحقيق في أدوار الجينات في عملية الانصهار2،3،4.
Spodoptera litura (S. litura, Lepidoptera: Noctuidae) هي آفة متعددة البلعوم ضارة تنتشر على نطاق واسع في المناطق الاستوائية وشبه الاستوائية في آسيا ، بما في ذلك China4,5,6. ويعزى التوزيع الواسع النطاق للبكتيريا S. litura جزئيا إلى قدرتها الإنجابية القوية ، والتي لها صلة بتطور الغدد التناسلية. العقم عند الذكور هو أحد الأساليب للسيطرة على هذه الآفة. كما هو موضح في الشكل التخطيطي لبنية الخصية ، يتم إحاطة الخصيتين بغمد الخصية ، بما في ذلك الغمد الخارجي (الغمد البريتوني) والصفيحة القاعدية الداخلية. تمتد الصفيحة القاعدية داخليا لتشكيل الظهارة الجريبية وتفصل المنطقة الداخلية من الخصية إلى أربع غرف تسمى البصيلات (الشكل 1).
في البصيلات، تتطور الحيوانات المنوية إلى منوية بعد الانقسام والانقسام الاختزالي، ثم تصطف الحيوانات المنوية في أكياس الحيوانات المنوية في نفس الاتجاه لتشكيل حزم الحيوانات المنوية7. أثناء تكوين الحيوانات المنوية ، تتمايز الخلايا المنوية الأولية إلى منوية من اليوبيرين أو الحيوانات المنوية من الأبيرين. تتطور الخلايا المنوية في مرحلة اليرقات إلى منوية من اليوبيرين مع ذيل طويل متصل برأس نواة ممدودة ؛ هذه يمكن أن تخصب البيض. على العكس من ذلك ، تتطور الخلايا المنوية في مرحلة منتصف العذراء إلى منوية من الأبيرين مع نواة مهملة. تساعد هذه الحيوانات المنوية على بقاء الحيوانات المنوية وحركتها وإخصابها 9,10. اليوم 6 من الخادرة هو الفترة التي تحتوي خلالها الخصيتان على حزم وفيرة من الحيوانات المنوية من اليوبيرين والأبيرين.
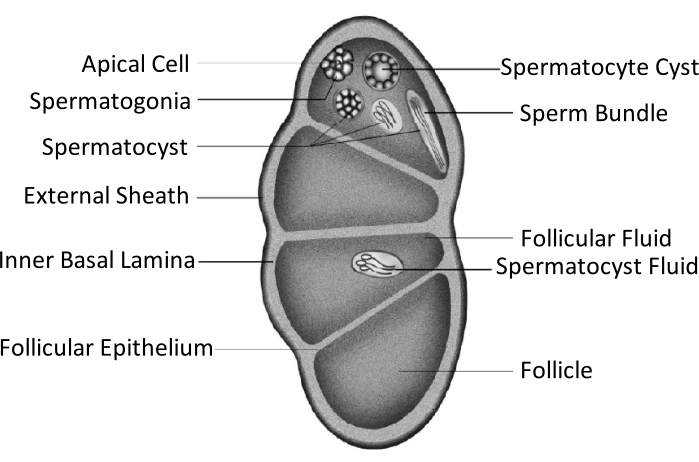
الشكل 1: مخطط تخطيطي لبنية الخصية لحشرات Lepidoptera11. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
يحدث اندماج الخصية في معظم الحشرات من ترتيب Lepidoptera11,12 ، وخاصة في تلك الأنواع التي هي الآفات الزراعية. يشير اندماج الخصية إلى زوج من الخصيتين ينمو بشكل ثنائي في مرحلة اليرقات ، ويقترب ويلتصق ببعضهما البعض ، ويندمج في النهاية في غدد غدد غصني واحد11. في Spodoptera litura، يحدث ذلك أثناء التحول من اليرقات إلى مرحلة العذراء. من اليوم 1 من النجم الخامس (L5D1) إلى اليوم 4 من النجم السادس (L6D4) ، ينمو زوج الخصيتين تدريجيا في الحجم ، ويتحول اللون إلى اللون الأصفر الفاتح من الأبيض العاجي. يصبح أحمر باهت عندما يصل إلى المرحلة القبلية (L6D5 إلى L6D6). تقترب خصيتان متماثلتان ثنائيتان من بعضهما البعض خلال مرحلة ما قبل العذراء، وتندمجان في واحدة، وتلتوي عكس اتجاه عقارب الساعة (الرؤية الدوارة) لإنتاج خصية واحدة في مرحلتي العذراء والبالغين11. لا تحدث هذه الظاهرة في ديدان القز ، التي لها أهمية اقتصادية كبيرة وتم تدجينها لمدة 5000 عام13. وبالتالي ، من المفترض أن اندماج الخصيتين يحسن القدرة الإنجابية.
لتحديد أهمية اندماج الخصية Spodoptera litura ، من المهم التحقيق في آثار منع العملية. في هذا البروتوكول ، تم إدخال رقائق الألومنيوم بشكل مجهري بين الخصيتين لإبقائهما منفصلين ، وتمت دراسة التغيرات الناتجة في تطور الحشرات والخصيتين.
Protocol
1. تربية الحشرات وصيانتها
- استزرع يرقات Spodoptera litura في غرف المحاكاة البيئية مع اتباع نظام غذائي اصطناعي حتى تصل إلى اليوم 4 من النجم السادس (L6D4). حدد يرقات الذكور عندما تدخل الديدان اليوم الأول من النجم السادس (L6D0) بناء على بنية المثلث العكسي على البطن الثامن14.
ملاحظة: تم نشر تقنيات تربية اليرقات وصيانتها سابقا4,14.
2. التحضير قبل الجراحة
- قم بتقليم رقائق الألومنيوم إلى قطع مستطيلة ذات زوايا مستديرة (1 مم × 2 مم ، الشكل 2).
- قم بتعقيم منصة الجراحة والعناصر ذات الصلة (سطح الطاولة ، المجهر ، صندوق الثلج ، صندوق الحشرات ، صينية الشمع ، الدبابيس ، والخيط) عن طريق رش 75٪ من الكحول على سطحها ومسحها.
- قم بتعقيم الأدوات الجراحية (بما في ذلك رقائق الألومنيوم) باستخدام معقم بخار عالي الضغط لمدة 30 دقيقة ، وضعها في فرن التدفئة والتجفيف عند 120 درجة مئوية.
- تأكد من أن المشغلين يرتدون ملابس مختبرية نظيفة وأقنعة جراحية وقفازات معقمة.
3. وضع الجراحة المجهرية لحاجز بين الخصيتين
ملاحظة: تدفق العمل العام هو كما يلي: تجميد → تثبيت → تطهير → شق → وضع حاجز → خياطة → التغذية بعد العملية الجراحية والتفتيش
- ضع يرقات الذكور (L6D4) على الجليد لمدة 10-30 دقيقة لإبقائها مخدرة أثناء العملية.
- ضع يرقة على صينية الشمع مع الجانب الظهري لأعلى ، ثم قم بإصلاح رأس وذيل اليرقة بدبابيس وخيوط ، مع إظهار المنطقة الجراحية التي هي السطح الظهري على الجزء التاسع من الجسم (الشكل 3A).
- تطهير المنطقة الجراحية عن طريق تطبيق صبغة اليود بنسبة 3٪ مع مسحة قطن على البشرة (الجزء التاسع من الجسم) ، تليها 70٪ من الكحول لإزالة اليود (الشكل 3B).
ملاحظة: ركز على اليرقة من خلال التعديل الخشن والدقيق للمجهر الجراحي (الشكل 3C). ضع صينية الشمع على طبق استزراع أكبر مملوء بالثلج للحفاظ على التخدير. - قم بعمل شق بطول 2 مم على البشرة الظهرية لجزء الجسم التاسع . بعد ذلك ، استخدم قطعة قطن معقمة لإزالة أي تسرب من الجسم الدموي والدهني والحصول على رؤية واضحة للمنطقة الجراحية.
ملاحظة: من المهم تجنب القلب أثناء العملية. يمكن القيام بذلك عن طريق جعل الشق قليلا بجوار خط الوسط في الجزء 9 من الجسم أو في المفصل بين أجزاء الجسم 9 و 10 لمنع الخصيتين من الظهور بسبب الضغط الداخلي لليرقات. أثناء استخدام المشرط ، قم بعمل شق رأسي باستخدام الشفرة أولا (الشكل 4A) ، ثم قم بتحويله 45 درجة نحو البشرة قبل قطع البشرة بالتساوي وباستمرار (الشكل 4B). - استخدم ملاقط جراحية لإدخال قطعة من رقائق الألومنيوم بين الخصيتين (الشكل 5).
- في نهاية الجراحة ، أغلق الشق لتجنب العدوى ، واسمح لليرقات بالتعافي من الجراحة.
- أغلق البشرة بخياطة جارية (الشكل 6).
- استخدم حامل إبرة وملاقط جراحية لربط عقدة مربعة جراحية ، مما يتطلب عقدتين بسيطتين متعارضتين لصورة المرآة (الشكل 6D ، E).
- استخدم المقص لقطع الخيط الزائد من ذيول الحلقة ، تاركا وراءه خيطا 2 مم.
- بعد الخياطة ، ضع اليرقة بلطف في صندوق التربية واحتفظ بها في غرفة محاكاة بيئية نظيفة. استمر في مراقبة اليرقات.
ملاحظة: يتوقف الجرح عن تسرب الهيموليمف ، وتتعافى اليرقات تدريجيا بعد الجراحة. تستمر الديدان في إكمال تحولها.

الشكل 2: الحاجز المادي المحضر باستخدام رقائق الألومنيوم (1 مم × 2 مم). يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
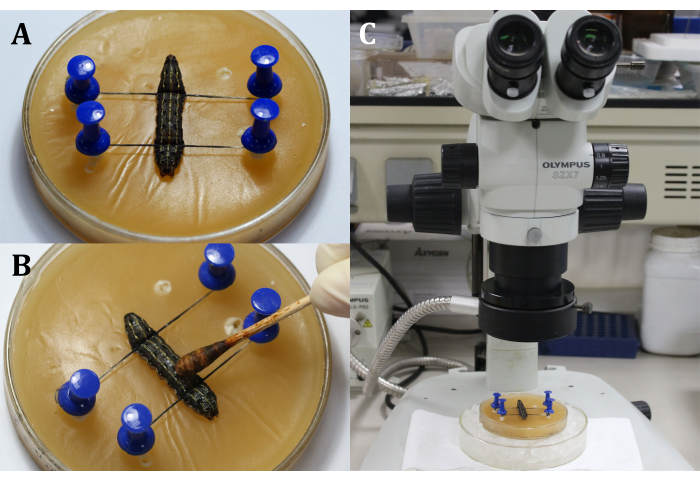
الشكل 3: قبل الشق. (أ) إصلاح اليرقات. (ب) تطهير بشرة المنطقة الجراحية. (ج) إجراء عملية جراحية تحت المجهر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
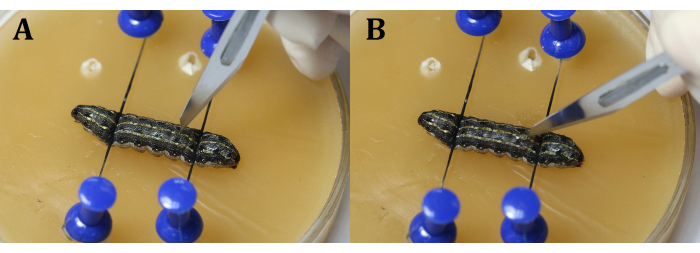
الشكل 4: شق (أ) شق اليرقات عموديا بالشفرة. (ب) أدر الشفرة 45 درجة نحو البشرة قبل القطع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: إدخال الحاجز المادي (رقائق الألومنيوم) بين الخصيتين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: الخياطة . (أ) أدخل الإبرة. (ب) سحب الإبرة. (ج) سحب الإبرة وتثبيتها. (د) ربط أول عقدة بسيطة. (ه) اربط العقدة البسيطة المتطابقة المصورة بالمرآة. (و) قطع خيط خياطة زائدة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
آثار الجراحة المجهرية على نمو وتطور Spodoptera litura
تركت الجراحة المجهرية جرحا طوله 2 مم على بشرة اليرقات الظهرية التي توقفت في النهاية عن تسرب الهيموليمف والتئمت. مرت اليرقات بمراحل ما قبل العذراء والعذراء وأغلقت ، مما يشير إلى أن الجراحة المجهرية لم يكن لها ?...
Discussion
بعد إعاقة اندماج الخصيتين جراحيا في Spodoptera litura، انخفض عدد حزم الحيوانات المنوية، مما دعم الفرضية القائلة بأن هذا الاندماج مفيد للقدرة الإنجابية. وقد استخدم التلاعب الجراحي لدراسة التطور الفسيولوجي للحشرات منذ أوائل القرن 20th. لتحديد ما إذا كان العصب القحفي ينظمه تحول الحشرات ، ?...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (Nos.:31772519, 31720103916; ) ومنحة مفتوحة من مختبر مفتاح الدولة لبيولوجيا جينوم دودة القز، جامعة ساوث ويست (رقم: sklsgb2013003).
Materials
| Name | Company | Catalog Number | Comments |
| 75% Rubbing alcohol | Qingdao Hainuo Nuowei Disinfection Technology Co., Ltd | Q/370285HNW 001-2019 | |
| Colored Push Pins | Deli Group Co.,LTD | 0042 | |
| Corneal Scissors | Suzhou Xiehe Medical Device Co., Ltd | MR-S221A | Curved and blunt tip |
| Glad Aluminum Foil | Clorox China(Guangzhou) Limited | 831457 | 10 cm*2.5 cm*0.6 |
| Medical Cotton Swabs (Sterile) | Winner Medical Co., Ltd. | 601-022921-01 | |
| Medical Iodine Cotton Swab | Winner Medical Co., Ltd. | 608-000247 | |
| Needle holder | Shanghai Medical Instruments (Group) Ltd., Corp. | J32030 | 14 cm fine needle |
| Sterile surgical blade | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | #11 | |
| Suigical Blade Holder | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | K6-10 | Straight 3# |
| Suture thread with needle | Ningbo Medical Stitch Needle Co., Ltd | needle: 3/8 Circle, 2.5*8 ; Thread: Nylon, 6/0, 25 cm | |
| Tying Forceps | Suzhou Xiehe Medical Device Co., Ltd | MR-F201T-3 | Straight-pointed; long handle; 0.12 mm-wide-head |
References
- Zeitlinger, J., Bohmann, D. Thorax closure in Drosophila: involvement of Fos and the JNK pathway. Development. 126 (17), 3947-3956 (1999).
- Ray, H. J., Niswander, L. Mechanisms of tissue fusion during development. Development. 139 (10), 1701-1711 (2012).
- Ducuing, A., Keeley, C., Mollereau, B., Vincent, S. A. DPP-mediated feed-forward loop canalizes morphogenesis during Drosophila dorsal closure. The Journal of Cell Biology. 208 (2), 239-248 (2015).
- Du, Q., et al. Identification and functional characterization of doublesex gene in the testis of Spodoptera litura. Insect Science. 26 (6), 1000-1010 (2019).
- Qin, H. G., Ding, J., Ye, Z. X., Huang, S. J., Luo, R. H. Dynamic analysis of experimental population of Spodoptera litura. Journal of Biosafety. 13 (2), 45-48 (2004).
- Guan, B. B., et al. The research in biology and ecology of Spodoptera litura. Journal of Biosafety. 8 (1), 57-61 (1999).
- Wen, L., et al. The testis development and spermatogenesis in Spodopture litura (lepidoptera: noctuidae). Journal of South China Normal University (Natural Science Edition. 51 (4), 47-56 (2019).
- Friedländer, M., Seth, R. K., Reynolds, S. E. Eupyrene and apyrene sperm: dichotomous spermatogenesis in Lepidoptera. Advances in Insect Physiology. 32, 206 (2010).
- Cook, P. A., Wedell, N. Non-fertile sperm delay female remating. Nature. 397 (6719), 486 (1999).
- Iriki, S. On the function of apyrene spermatozoa in the silk worm. Zoological Magazine. 53, 123-124 (1941).
- Liu, L., Feng, Q. L. The study of fusion of testis in Lepidoptera insects. Journal of South China Normal University (Natural Science Edition). 46 (5), 1-7 (2014).
- Klowden, M. J. . Physiological systems in insects. , (2007).
- Xu, J., et al. Transgenic characterization of two testis-specific promoters in the silkworm, Bombyx mori. Insect Molecular Biology. 24 (2), 183-190 (2015).
- Guo, X. R., Zheng, S. C., Liu, L., Feng, Q. L. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses. BioMed Central Molecular Biology. 10, 102 (2009).
- Kopeć, S. Studies on the necessity of the brain for the inception of insect metamorphosis. Biological Bulletin. 42 (6), 323-342 (1922).
- Wigglesworth, V. B. Factors controlling moulting and 'metamorphosis' in an insect. Nature. 133 (5), 725-726 (1934).
- Williams, C. N. Physiology of insect diapause; the role of the brain in the production and termination of pupal dormancy in the giant silkworm, Platysamia cecropia. Biological Bulletin. 90 (3), 234-243 (1946).
- Fukuda, S. Hormonal control of molting and pupation in the silkworm. Proceedings of the Imperial Academy Tokyo. 16 (8), 417-420 (1940).
- Tian, H. J., Liu, Z. P., Bai, Y. Y. Common methods to detect Sperm quality of mammalian. Journal of Economic Zoology. 8 (4), 198-201 (2004).
- Ji, X. S., Chen, S. L., Zhao, Y., Tian, Y. S. Progress in the quality evaluation of fish sperm. Chinese Fishery Science. 14 (6), 1048-1054 (2007).
- Baulny, B. O. D., Vern, Y. L., Kerboeuf, D., Maisse, G. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology. 34 (2), 141-149 (1997).
- Krasznai, Z., Márián, T., Balkay, I., Emri, M., Trón, L. Permeabilization and structural changes in the membrane of common carp (Cyprinus carpio L.) sperm induced by hypo-osmotic shock. Aquaculture. 129 (1), 134 (1995).
- Kime, D. E., et al. Computer-assisted sperm analysis (CASA) as a tool for monitoring sperm quality in fish. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp. 130 (4), 425-433 (2001).
- Rurangwa, E., Volckaert, F. A., Huyskens, G., Kime, D. E., Ollevier, F. Quality control of refrigerated and cryopreserved semen using computer-assisted sperm analysis (CASA), viable staining and standardized fertilization in African catfish (Clarias gariepinus). Theriogenology. 55 (3), 751-769 (2001).
- Seth, R. K., Kaur, J. J., Rao, D. K., Reynolds, S. E. Effects of larval exposure to sublethal concentrations of the ecdysteroid agonists RH-5849 and tebufenozide (RH-5992) on male reproductive physiology in Spodoptera litura. Journal of Insect Physiology. 50 (6), 505-517 (2004).
- Sweeney, R. M., Watterson, R. L. Rib development in chick embryos analyzed by means of tantalum foil blocks. American Journal of Anatomy. 126 (2), 127-149 (1969).
- Wilde, S., Logan, M. P. Application of impermeable barriers combined with candidate factor soaked beads to study inductive signals in the chick. Journal of Visualized Experiments. (117), e54618 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved