このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
鞘翅目典礼における精巣融合の顕微外科的閉塞
要約
アルミニウム箔は、精巣の融合を妨げるために 、Spodoptera litura の精巣の間に微小外科的に挿入された。この手順には、凍結、固定、消毒、切開、バリアの配置、縫合、術後の摂食、および検査が含まれる。このアプローチは、組織形成を妨害する方法を提供する。
要約
RNA干渉(RNAi)のような遺伝的方法や、規則正しく間隔をあけた短い回文反復(CRISPR)/CRISPR関連エンドヌクレアーゼCas9などの遺伝的方法を使用する代わりに、物理的な障壁を Spodoptera litura の精巣間に微小外科的に挿入し、この微小手術がその成長と生殖に及ぼす影響を研究した。精巣間にアルミ箔を挿入した後、変態中の昆虫の脱皮は正常に進行した。昆虫の成長と発達は著しく変化しなかった。しかし、精巣融合が顕微手術によって停止された場合、精子束の数は変化した。この新知見は、精巣融合を遮断することが男性の生殖能力に影響を与える可能性があることを示唆している。この方法は、特定のシグナル伝達経路の機能を研究するために、器官間の通信を遮断するためにさらに適用することができる。従来の手術と比較して、マイクロサージャリーは凍結麻酔のみを必要とし、二酸化炭素麻酔よりも好ましい。マイクロサージャリーはまた、手術部位面積を最小限に抑え、創傷治癒を促進する。しかし、特定の機能を持つ材料の選択は、さらなる調査が必要です。組織損傷を避けることは、手術中に切開を行う際に重要です。
概要
融合は、組織または器官の発達における一般的な現象である。例としては、ショウジョウバエ1および口蓋形態形成における背部閉鎖および胸郭閉鎖、マウスおよびニワトリにおける神経管形態形成、ならびに心臓形態形成2が含まれる。CRISPRとRNAiは、融合の過程における遺伝子の役割を調べるために応用されています2,3,4。
スポドプテラ・リチュラ(S. litura, 鱗翅目: Noctuidae)は、中国を含むアジアの熱帯および亜熱帯地域に広く分布している有害な多食性害虫である4,5,6。S. lituraの広い分布は、生殖腺の発達に関連するその強力な生殖能力に部分的に起因しています。男性不妊症は、この害虫を防除するための1つのアプローチです。精巣構造の模式図に示すように、精巣は精巣鞘によって囲まれ、外鞘(腹膜鞘)および内側基底薄板を含む。基底薄層は内部に伸びて濾胞上皮を形成し、精巣の内側領域を卵胞という名前の4つのチャンバーに分離する(図1)。
卵胞では、精子は有糸分裂と減数分裂の後に精子に発達し、精子嚢内の精子は同じ方向に整列して精子束を形成します7。精子形成の間、初代精子細胞はユーピレン精子またはアピレン精子に分化する。幼虫期の精子細胞は、細長い核の頭部に接続された長い尾を有するユーピレン精子に発達する。これらは卵を受精させることができます。逆に、蛹期半ばの精子細胞は、廃棄された核を有するアピレン精子に発達する。これらの精子は、ユーピレン精子の生存、運動、受精を助ける9,10。蛹の6日目は、精巣が豊富なユーピレンとアピレンの精子束を有する期間である。
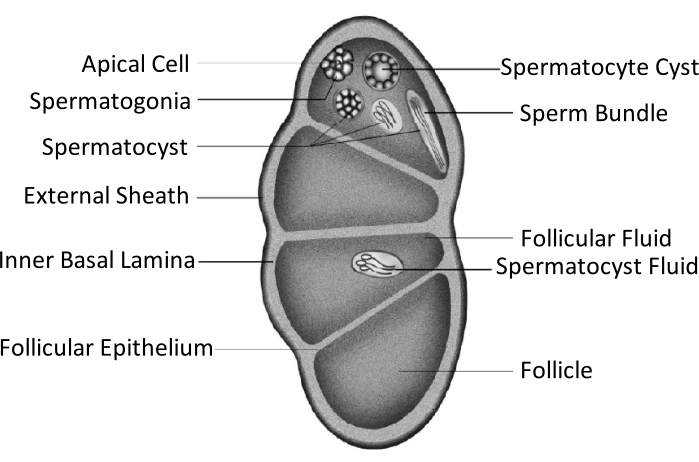
図1:鱗翅目昆虫の精巣構造の模式図11。この図の拡大版を見るにはここをクリックしてください。
精巣融合は、鱗翅目秩序のほとんどの昆虫11,12、特に農業害虫である種において起こる。精巣融合は、幼虫期に両側に成長し、互いに接近して接着し、最終的に単一の生殖腺11に統合する一対の精巣を指す。スポドプテラ・リチュラでは、幼虫から蛹期への変態中に起こる。5齢(L5D1)の1日目から6齢(L6D4)の4日目まで、精巣のペアは徐々にサイズが大きくなり、色は象牙白色から淡黄色に変わります。蛹期(L6D5~L6D6)に達するとかすかな赤色になります。2つの両側対称精巣は、蛹準備段階で互いに接近し、1つに融合し、反時計回り(肩面図)にねじれて、蛹期と成虫期に単一の精巣を生成する11。この現象は、経済的にかなり重要であり、5000年間家畜化されてきたカイコでは発生しません13。したがって、精巣の融合は生殖能力を改善すると仮定される。
Spodoptera litura testicular fusionの重要性を決定するには、このプロセスをブロックする効果を調べることが重要です。このプロトコルでは、精巣の間にアルミニウム箔を微小外科的に挿入して分離させ、その結果として昆虫および精巣の発生の変化を研究した。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. 昆虫の飼育と維持管理
- スポドプテラ典礼幼虫を人工食を用いた環境シミュレーションチャンバーで、6齢(L6D4)の4日目に達するまで培養する。ワームが第6齢(L6D0)の初日に入ったときに、第8腹部の逆三角形の構造に基づいて雄幼虫を選択します14。
注:幼虫の飼育と維持技術は以前に公開されました4,14。
2. 手術前準備
- アルミ箔を角が丸みを帯びた長方形にトリミングします(1 mm x 2 mm、 図2)。
- 手術台および関連アイテム(テーブル表面、顕微鏡、アイスボックス、昆虫ボックス、ワックストレイ、ピン、糸)を、その表面に75%アルコールを噴霧し、拭き取って滅菌する。
- 手術器具(アルミ箔を含む)を高圧蒸気滅菌器で30分間滅菌し、120°Cの加熱乾燥オーブンに入れます。
- オペレータは、清潔な実験服、手術用マスク、滅菌手袋を着用してください。
3.精巣間の障壁の顕微手術的配置
注:一般的なワークフローは次のとおりです:凍結→固定→消毒→切開→バリア配置→縫合→術後の給餌および検査
- 雄の幼虫(L6D4)を氷の上に10〜30分間置き、手術中に麻酔をかけたままにします。
- 背側を上にしてワックストレイに幼虫を置き、幼虫の頭部と尾部をピンと糸で固定し、9番目の 体セグメントの背側表面である手術領域を示す(図3A)。
- 表皮に綿棒で3%ヨウ素チンキを塗布して手術領域を消毒し(9番目の 体セグメント)、続いて70%アルコールを適用してヨウ素を除去します(図3B)。
注:手術用顕微鏡の粗い微調整を通して幼虫に焦点を合わせます(図3C)。ワックストレイを氷で満たされた大きな培養皿の上に置き、麻酔を保つ。 - 第9体節の背側表皮に長さ2mmの切開を行う。次に、滅菌綿棒を使用して、漏れている血リンパ液および脂肪体を除去し、手術領域の明確な視界を得る。
注:手順中に心臓を避けることが重要です。これは、幼虫の内圧のために精巣が飛び出すのを防ぐために、第9の身体セグメントの中間線のわずかに隣り、または第9および第10の身体セグメントの間の関節で切開を行うことによって行うことができる。メスを使用しながら、まず刃で縦スリットを作り(図4A)、次に表皮に向かって45°回してから、表皮を均等かつ連続的に切断します(図4B)。 - 手術用ピンセットを使用して、精巣の間にアルミホイルを挿入します(図5)。
- 手術の終わりに、感染を避けるために切開部を閉じ、幼虫が手術から回復するのを許す。
- ランニング縫合糸で表皮を閉じます(図6)。
- ニードルホルダーと外科用ピンセットを使用して外科用正方形の結び目を結び、2つの対向する鏡像の単純な結び目が必要です(図6D、E)。
- はさみを使用してループテールから余分な縫合糸を切断し、2mmの糸を残します。
- 縫合後、幼虫を飼育箱に静かに敷き詰め、清潔な環境シミュレーションチャンバーに保管してください。幼虫を観察し続ける。
注:創傷は血リンパ液の漏れを止め、幼虫は手術後に徐々に回復する。ワームは変態を完了し続けます。

図 2: アルミ箔 (1 mm x 2 mm) を使用して作成した物理的な障壁。 この図の拡大版を表示するには、ここをクリックしてください。
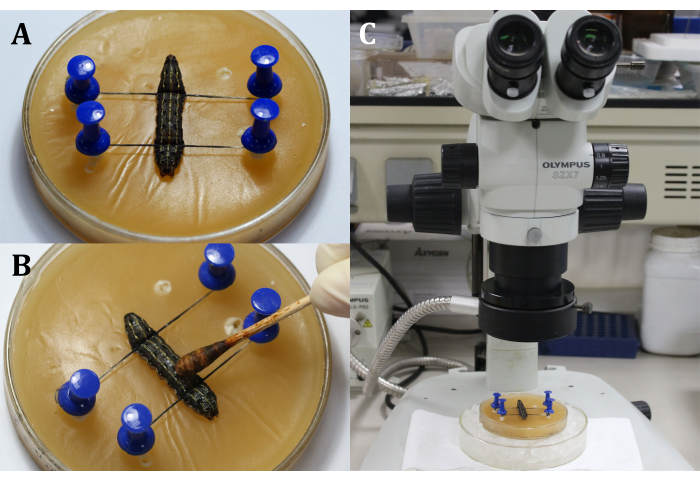
図3:切開前 (A)幼虫を固定する。(B)手術領域の表皮の消毒。(ハ)顕微鏡下で手術を行う。 この図の拡大版を表示するには、ここをクリックしてください。
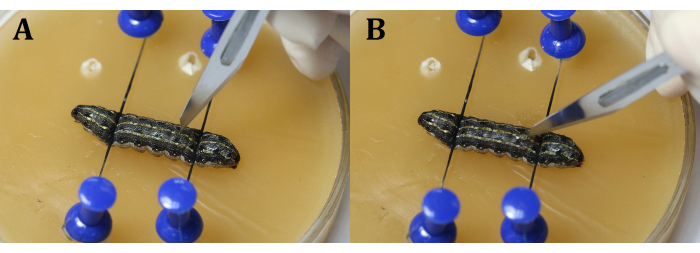
図4:切開 (A)幼虫を刃で垂直にスリットする。(B)切り裂く前に刃を表皮に向かって45°回します。 この図の拡大版を表示するには、ここをクリックしてください。

図5:精巣間に物理的な障壁(アルミニウム箔)を挿入する。 この図の拡大版を表示するには、ここをクリックしてください。

図6:縫合。 (A)針を挿入します。(B)針を抜く。(C)針を引っ込めて締め付けます。(D)最初の単純な結び目を結びます。(E)対向する鏡像の単純な結び目を結びます。(F)余分な縫合糸を切る。 この図の拡大版を表示するには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
鞘翅目典礼の成長と発達に対するマイクロサージャリーの影響
マイクロサージャリーは背側幼虫表皮に長さ2mmの傷を残し、最終的に血リンパ液の漏出を止めて治癒した。幼虫は蛹前期と蛹期を経て閉鎖され、マイクロサージャリーが成長と発達に大きな影響を及ぼさなかったことを示している。幼虫が蛹に脱皮したとき、縫合糸は表皮とともに...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
Spodoptera lituraの精巣融合を微小外科的に妨害した後、精子束の数は減少し、この融合が生殖能力に有益であるという仮説を支持した。外科的操作は、20世紀初頭以来、昆虫の生理学的発達を研究するために使用されてきた。脳神経が昆虫の変態によって調節されているかどうかを判断するために、一部の研究者は、異なる昆虫(半翅目のロドニウス・プロリクサス、鱗翅目...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは開示するものは何もありません。
謝辞
この研究は、中国国家自然科学財団(Nos.:31772519、31720103916;)と、南西大学カイコゲノム生物学国家キーラボラトリー(No.:sklsgb2013003)からの公開助成金によって支援されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 75% Rubbing alcohol | Qingdao Hainuo Nuowei Disinfection Technology Co., Ltd | Q/370285HNW 001-2019 | |
| Colored Push Pins | Deli Group Co.,LTD | 0042 | |
| Corneal Scissors | Suzhou Xiehe Medical Device Co., Ltd | MR-S221A | Curved and blunt tip |
| Glad Aluminum Foil | Clorox China(Guangzhou) Limited | 831457 | 10 cm*2.5 cm*0.6 |
| Medical Cotton Swabs (Sterile) | Winner Medical Co., Ltd. | 601-022921-01 | |
| Medical Iodine Cotton Swab | Winner Medical Co., Ltd. | 608-000247 | |
| Needle holder | Shanghai Medical Instruments (Group) Ltd., Corp. | J32030 | 14 cm fine needle |
| Sterile surgical blade | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | #11 | |
| Suigical Blade Holder | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | K6-10 | Straight 3# |
| Suture thread with needle | Ningbo Medical Stitch Needle Co., Ltd | needle: 3/8 Circle, 2.5*8 ; Thread: Nylon, 6/0, 25 cm | |
| Tying Forceps | Suzhou Xiehe Medical Device Co., Ltd | MR-F201T-3 | Straight-pointed; long handle; 0.12 mm-wide-head |
参考文献
- Zeitlinger, J., Bohmann, D. Thorax closure in Drosophila: involvement of Fos and the JNK pathway. Development. 126 (17), 3947-3956 (1999).
- Ray, H. J., Niswander, L. Mechanisms of tissue fusion during development. Development. 139 (10), 1701-1711 (2012).
- Ducuing, A., Keeley, C., Mollereau, B., Vincent, S. A. DPP-mediated feed-forward loop canalizes morphogenesis during Drosophila dorsal closure. The Journal of Cell Biology. 208 (2), 239-248 (2015).
- Du, Q., et al. Identification and functional characterization of doublesex gene in the testis of Spodoptera litura. Insect Science. 26 (6), 1000-1010 (2019).
- Qin, H. G., Ding, J., Ye, Z. X., Huang, S. J., Luo, R. H. Dynamic analysis of experimental population of Spodoptera litura. Journal of Biosafety. 13 (2), 45-48 (2004).
- Guan, B. B., et al. The research in biology and ecology of Spodoptera litura. Journal of Biosafety. 8 (1), 57-61 (1999).
- Wen, L., et al. The testis development and spermatogenesis in Spodopture litura (lepidoptera: noctuidae). Journal of South China Normal University (Natural Science Edition. 51 (4), 47-56 (2019).
- Friedländer, M., Seth, R. K., Reynolds, S. E. Eupyrene and apyrene sperm: dichotomous spermatogenesis in Lepidoptera. Advances in Insect Physiology. 32, 206(2010).
- Cook, P. A., Wedell, N. Non-fertile sperm delay female remating. Nature. 397 (6719), 486(1999).
- Iriki, S. On the function of apyrene spermatozoa in the silk worm. Zoological Magazine. 53, 123-124 (1941).
- Liu, L., Feng, Q. L. The study of fusion of testis in Lepidoptera insects. Journal of South China Normal University (Natural Science Edition). 46 (5), 1-7 (2014).
- Klowden, M. J. Physiological systems in insects. , Elsevier/Academic Press. Amsterdam, NL; Boston, MA. (2007).
- Xu, J., et al. Transgenic characterization of two testis-specific promoters in the silkworm, Bombyx mori. Insect Molecular Biology. 24 (2), 183-190 (2015).
- Guo, X. R., Zheng, S. C., Liu, L., Feng, Q. L. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses. BioMed Central Molecular Biology. 10, 102(2009).
- Kopeć, S. Studies on the necessity of the brain for the inception of insect metamorphosis. Biological Bulletin. 42 (6), 323-342 (1922).
- Wigglesworth, V. B. Factors controlling moulting and 'metamorphosis' in an insect. Nature. 133 (5), 725-726 (1934).
- Williams, C. N. Physiology of insect diapause; the role of the brain in the production and termination of pupal dormancy in the giant silkworm, Platysamia cecropia. Biological Bulletin. 90 (3), 234-243 (1946).
- Fukuda, S. Hormonal control of molting and pupation in the silkworm. Proceedings of the Imperial Academy Tokyo. 16 (8), 417-420 (1940).
- Tian, H. J., Liu, Z. P., Bai, Y. Y. Common methods to detect Sperm quality of mammalian. Journal of Economic Zoology. 8 (4), 198-201 (2004).
- Ji, X. S., Chen, S. L., Zhao, Y., Tian, Y. S. Progress in the quality evaluation of fish sperm. Chinese Fishery Science. 14 (6), 1048-1054 (2007).
- Baulny, B. O. D., Vern, Y. L., Kerboeuf, D., Maisse, G. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology. 34 (2), 141-149 (1997).
- Krasznai, Z., Márián, T., Balkay, I., Emri, M., Trón, L. Permeabilization and structural changes in the membrane of common carp (Cyprinus carpio L.) sperm induced by hypo-osmotic shock. Aquaculture. 129 (1), 134(1995).
- Kime, D. E., et al. Computer-assisted sperm analysis (CASA) as a tool for monitoring sperm quality in fish. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp. 130 (4), 425-433 (2001).
- Rurangwa, E., Volckaert, F. A., Huyskens, G., Kime, D. E., Ollevier, F. Quality control of refrigerated and cryopreserved semen using computer-assisted sperm analysis (CASA), viable staining and standardized fertilization in African catfish (Clarias gariepinus). Theriogenology. 55 (3), 751-769 (2001).
- Seth, R. K., Kaur, J. J., Rao, D. K., Reynolds, S. E. Effects of larval exposure to sublethal concentrations of the ecdysteroid agonists RH-5849 and tebufenozide (RH-5992) on male reproductive physiology in Spodoptera litura. Journal of Insect Physiology. 50 (6), 505-517 (2004).
- Sweeney, R. M., Watterson, R. L. Rib development in chick embryos analyzed by means of tantalum foil blocks. American Journal of Anatomy. 126 (2), 127-149 (1969).
- Wilde, S., Logan, M. P. Application of impermeable barriers combined with candidate factor soaked beads to study inductive signals in the chick. Journal of Visualized Experiments. (117), e54618(2016).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved