JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Spodoptera litura에서 Testes Fusion의 미세 외과 적 폐색
요약
알루미늄 호일은 고환의 융합을 방해하기 위해 Spodoptera litura 의 고환 사이에 미세 외과 적으로 삽입되었습니다. 절차에는 동결, 고정, 소독, 절개, 장벽 배치, 봉합, 수술 후 수유 및 검사가 포함됩니다. 이러한 접근법은 조직 형성을 방해하는 방법을 제공한다.
초록
RNA 간섭 (RNAi)과 같은 유전 적 방법을 사용하고 정기적으로 간격이 짧은 구두체 반복 (CRISPR) / CRISPR 관련 엔도뉴클레아제 Cas9와 같은 유전 적 방법을 사용하는 대신, 물리적 장벽이 Spodoptera litura 의 고환 사이에 미세 외과 적으로 삽입되어이 미세 수술이 성장과 번식에 미치는 영향을 연구했습니다. 고환 사이에 알루미늄 호일을 삽입 한 후, 변태 중 곤충 털갈이가 정상적으로 진행되었습니다. 곤충의 성장과 발달은 현저하게 변화되지 않았다. 그러나 고환 융합이 미세 수술에 의해 중단되면 정자 다발의 수가 변경되었습니다. 이러한 발견은 고환 융합을 차단하는 것이 남성 생식 능력에 영향을 줄 수 있음을 의미합니다. 이 방법은 특정 신호 전달 경로의 기능을 연구하기 위해 기관 간의 통신을 중단하는 데 더 적용될 수 있습니다. 기존의 수술에 비해, 미세수술은 동결마취만을 필요로 하며, 이는 이산화탄소 마취보다 바람직하다. 미세 수술은 또한 수술 부위 영역을 최소화하고 상처 치유를 용이하게합니다. 그러나 특정 기능을 가진 재료를 선택하려면 추가 조사가 필요합니다. 수술 중 절개를 할 때 조직 손상을 피하는 것이 중요합니다.
서문
융합은 조직 또는 장기 발달에서 흔히 발생하는 현상입니다. 그 예로는 Drosophila1에서의 등쪽 폐쇄 및 흉부 폐쇄 및 구개골 형태형성, 신경관 형태형성, 및 마우스 및 닭에서의 심장 형태형성2이 포함된다. CRISPR 및 RNAi는 융합 과정에서 유전자의 역할을 조사하기 위해 적용되었습니다2,3,4.
Spodoptera litura (S. litura, Lepidoptera : Noctuidae)는 중국을 포함한 아시아의 열대 및 아열대 지역에 널리 분포하는 해로운 다식성 해충입니다4,5,6. S. litura의 광범위한 분포는 부분적으로 생식선 발달과 관련된 강력한 생식 능력에 기인합니다. 남성 불임은이 해충을 방제하는 한 가지 접근법입니다. 고환 구조의 개략적인 그림에서 볼 수 있듯이, 고환은 외부 외피 (복막 외피) 및 내부 기저 라미나를 포함한 고환 외피에 의해 둘러싸여 있습니다. 기저 라미나는 내부적으로 확장되어 여포 상피를 형성하고 고환의 내부 영역을 여포라는 네 개의 챔버로 분리합니다 (그림 1).
여포에서 정자는 유사분열과 meiosis 후에 정자로 발전하고, 정자 주머니의 정자는 같은 방향으로 정렬되어 정자 다발을 형성합니다7. 정자 생성 동안, 일차 정자 세포는 유피렌 정자 또는 아피렌 정자로 분화됩니다. 유충 단계의 정자 세포는 길쭉한 핵의 머리에 연결된 긴 꼬리를 가진 유피렌 정자로 발전합니다. 이들은 알을 비옥하게 할 수 있습니다. 반대로, 번데기 중반 단계의 정자 세포는 버려진 핵을 가진 아피렌 정자로 발전합니다. 이 정자는 유피렌 정자의 생존, 운동 및 수정을 돕습니다9,10. 번데기의 6 일째 날은 고환이 풍부한 유피렌과 아피렌 정자 번들을 가지고있는 기간입니다.
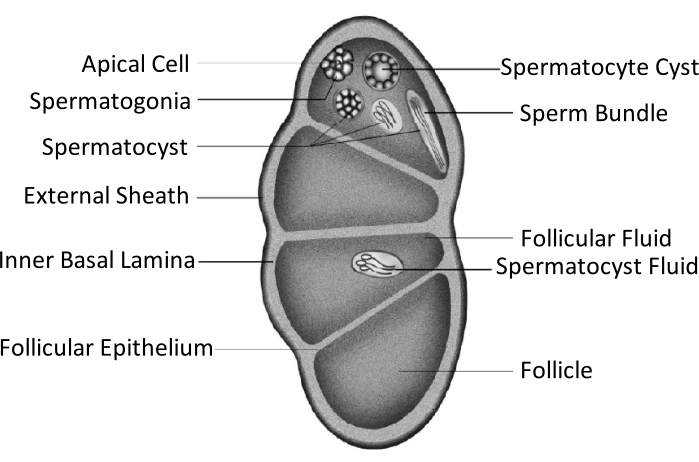
그림 1 : Lepidoptera 곤충의 고환 구조의 개략도11. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
고환 융합은 Lepidoptera 순서의 대부분의 곤충에서11,12, 특히 농업 해충 인 종에서 발생합니다. 고환 융합은 애벌레 단계에서 양측으로 자라는 한 쌍의 고환을 말하며, 서로 접근하고 고수하여 결국 단일 생식선으로 통합됩니다 11. Spodoptera litura에서는 애벌레에서 번데기 단계로 변태하는 동안 발생합니다. 5번째 인스타(L5D1)의 1일째부터 6번째 인스타(L6D4)의 4일째까지, 한 쌍의 고환은 점차 크기가 커지고, 색은 아이보리 화이트에서 연한 노란색으로 변합니다. 그것은 준비 단계 (L6D5 내지 L6D6)에 도달함에 따라 희미한 적색이된다. 두 개의 양측 대칭 고환이 준비 단계에서 서로 접근하고, 하나로 융합되고, 시계 반대 방향 (doral view)을 비틀어 번데기와 성인 단계에서 단일 고환을 생성합니다11. 이 현상은 상당한 경제적 중요성을 가지고 있으며 5000 년 동안 길들여진 누에에서는 발생하지 않습니다.13. 따라서 고환의 융합이 생식 능력을 향상시킨다고 가정합니다.
Spodoptera litura 고환 융합의 중요성을 결정하기 위해서는 과정을 막는 효과를 조사하는 것이 중요합니다. 이 프로토콜에서 알루미늄 호일은 고환 사이에 미세 외과 적으로 삽입되어 분리되도록 유지했으며 곤충과 고환의 발달에 따른 변화가 연구되었습니다.
프로토콜
1. 곤충 사육 및 유지 보수
- Spodoptera litura 유충을 6th instar (L6D4)의 4 일째에 도달 할 때까지 인공 식단으로 환경 시뮬레이션 챔버에서 배양하십시오. 벌레가 여덟 번째 복부의 역 삼각형 모양의 구조를 기반으로 6 번째 instar (L6D0)의 첫날에 들어갈 때 수컷 유충을 선택하십시오14.
참고 : 유충 사육 및 유지 보수 기술은 이전에 출판되었습니다4,14.
2. 수술 전 준비
- 알루미늄 호일을 둥근 모서리가 있는 직사각형 조각으로 다듬습니다(1mm x 2mm, 그림 2).
- 수술 플랫폼 및 관련 항목 (테이블 표면, 현미경, 아이스 박스, 곤충 상자, 왁스 트레이, 핀 및 실)을 표면에 75 % 알코올을 뿌리고 닦아서 멸균하십시오.
- 수술 도구 (알루미늄 호일 포함)를 고압 증기 멸균기로 30 분 동안 멸균하고 120 °C의 가열 및 건조 오븐에 놓습니다.
- 작업자가 깨끗한 실험실 옷, 외과 용 마스크 및 멸균 장갑을 착용했는지 확인하십시오.
3. 고환 사이의 장벽의 미세 외과 적 배치
참고 : 일반적인 작업 흐름은 다음과 같습니다 : 냉동 → 고정 → 소독 → 절개 → 장벽 배치 → 봉합→ 수술 후 먹이 및 검사
- 수컷 유충 (L6D4)을 얼음 위에 10-30 분 동안 두어 수술 중에 마취 상태로 유지하십시오.
- 등쪽이 위로 위로 향하도록 왁스 트레이에 유충을 놓은 다음 유충의 머리와 꼬리를 핀과 실로 고정하여 9 번째 신체 세그먼트의 등쪽 표면 인 수술 영역을 보여줍니다 (그림 3A).
- 표피(9번째 신체 부위)에 면봉으로 3% 요오드 팅크를 도포하여 수술 부위를 소독한 다음, 70% 알코올을 사용하여 요오드를 제거하였다(도 3B).
참고 : 수술 현미경의 거칠고 미세한 조정을 통해 유충에 집중하십시오 (그림 3C). 마취를 유지하기 위해 얼음으로 채워진 더 큰 문화 접시에 왁스 트레이를 놓습니다. - 9 번째 신체 세그먼트의 등쪽 표피에 2mm 길이의 절개를하십시오. 다음으로, 멸균 면봉을 사용하여 누출 된 용혈림프와 지방체를 제거하고 수술 부위를 명확하게 볼 수 있습니다.
참고 : 절차 중에 심장을 피하는 것이 중요합니다. 이것은 애벌레 내부 압력으로 인해 고환이 튀어 나오지 않도록 9 번째 신체 세그먼트의 중간 선 옆이나 9 번째와 10 번째 신체 세그먼트 사이의 관절에서 절개를 약간 옆에두면 수행 할 수 있습니다. 메스를 사용하는 동안 먼저 블레이드로 수직 슬릿을 만든 다음(그림 4A), 표피를 고르게 그리고 연속적으로 절단하기 전에 표피 쪽으로 45° 돌립니다(그림 4B). - 수술용 핀셋을 사용하여 고환 사이에 알루미늄 호일 조각을 삽입합니다(그림 5).
- 수술이 끝나면 감염을 피하기 위해 절개를 닫고 애벌레가 수술에서 회복 할 수 있도록하십시오.
- 달리는 봉합사로 표피를 닫습니다(그림 6).
- 바늘 홀더와 수술용 핀셋을 사용하여 수술용 사각형 매듭을 묶으려면 두 개의 반대되는 거울 이미지 단순 매듭이 필요합니다(그림 6D,E).
- 가위를 사용하여 루프 꼬리에서 과도한 봉합사를 자르고 2mm 실을 남겨 둡니다.
- 봉합 후, 유충을 사육 상자에 부드럽게 놓고 깨끗한 환경 시뮬레이션 챔버에 보관하십시오. 애벌레를 계속 관찰하십시오.
참고 : 상처는 용혈림프가 새는 것을 멈추고 유충은 수술 후 점차적으로 회복됩니다. 웜은 계속해서 변태를 완료합니다.

그림 2: 알루미늄 호일(1mm x 2mm)을 사용하여 준비된 물리적 장벽. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
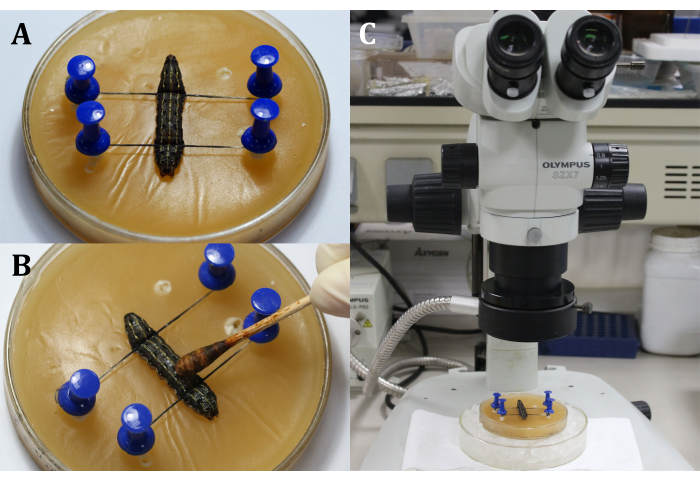
그림 3: 절개 전. (A) 애벌레 고정. (B) 수술 부위의 표피의 소독. (C) 현미경으로 수술 수행. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
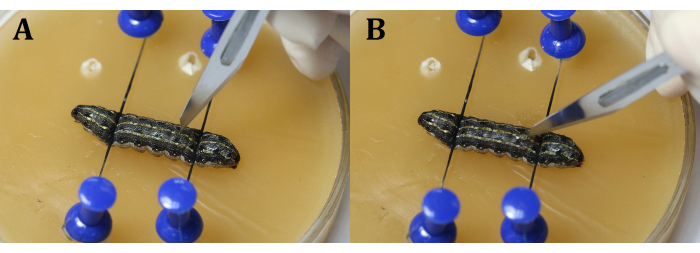
그림 4 : 절개. (A) 유충을 칼날로 수직으로 썰다. (B) 절단하기 전에 블레이드를 표피 쪽으로 45° 돌립니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 고환 사이에 물리적 장벽(알루미늄 호일)을 삽입합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 봉합 . (A) 바늘을 삽입합니다. (B) 바늘을 뽑는다. (C) 바늘을 뽑아 고정시킨다. (D) 첫 번째 간단한 매듭을 묶는다. (E) 반대편 거울 이미지 단순 매듭을 묶는다. (F) 과도한 봉합사 실을 자른다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
Spodoptera litura 성장 및 발달에 대한 미세 수술의 효과
미세 수술은 등쪽 유충 표피에 2mm 길이의 상처를 남겼고 결국 용혈림프가 새는 것을 멈추고 치유되었습니다. 유충은 준비 및 번데기 단계를 거쳐 폐쇄 된 것으로, 미세 수술이 성장과 발달에 큰 영향을 미치지 않았 음을 나타냅니다. 유충이 번데기로 털갈이했을 때, 봉합사 실은 표피와 함께 버려?...
토론
Spodoptera litura에서 미세 외과 적으로 고환 융합을 방해 한 후, 정자 다발의 수가 감소하여이 융합이 생식 능력에 도움이된다는 가설을지지했습니다. 외과 적 조작은 20 세기 초부터 곤충의 생리 학적 발달을 연구하는 데 사용되어 왔습니다. 두개골 신경이 곤충 변형에 의해 조절되는지 여부를 결정하기 위해 일부 연구자들은 다른 곤충 (Hemiptera의 Rhodnius prolixus, Lepidoptera의 Lym...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 중국 국립 자연 과학 재단 (Nos.:31772519, 31720103916; )과 사우스 웨스트 대학 실크웜 게놈 생물학의 국가 핵심 연구소 (No.: sklsgb2013003)의 공개 보조금에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 75% Rubbing alcohol | Qingdao Hainuo Nuowei Disinfection Technology Co., Ltd | Q/370285HNW 001-2019 | |
| Colored Push Pins | Deli Group Co.,LTD | 0042 | |
| Corneal Scissors | Suzhou Xiehe Medical Device Co., Ltd | MR-S221A | Curved and blunt tip |
| Glad Aluminum Foil | Clorox China(Guangzhou) Limited | 831457 | 10 cm*2.5 cm*0.6 |
| Medical Cotton Swabs (Sterile) | Winner Medical Co., Ltd. | 601-022921-01 | |
| Medical Iodine Cotton Swab | Winner Medical Co., Ltd. | 608-000247 | |
| Needle holder | Shanghai Medical Instruments (Group) Ltd., Corp. | J32030 | 14 cm fine needle |
| Sterile surgical blade | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | #11 | |
| Suigical Blade Holder | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | K6-10 | Straight 3# |
| Suture thread with needle | Ningbo Medical Stitch Needle Co., Ltd | needle: 3/8 Circle, 2.5*8 ; Thread: Nylon, 6/0, 25 cm | |
| Tying Forceps | Suzhou Xiehe Medical Device Co., Ltd | MR-F201T-3 | Straight-pointed; long handle; 0.12 mm-wide-head |
참고문헌
- Zeitlinger, J., Bohmann, D. Thorax closure in Drosophila: involvement of Fos and the JNK pathway. Development. 126 (17), 3947-3956 (1999).
- Ray, H. J., Niswander, L. Mechanisms of tissue fusion during development. Development. 139 (10), 1701-1711 (2012).
- Ducuing, A., Keeley, C., Mollereau, B., Vincent, S. A. DPP-mediated feed-forward loop canalizes morphogenesis during Drosophila dorsal closure. The Journal of Cell Biology. 208 (2), 239-248 (2015).
- Du, Q., et al. Identification and functional characterization of doublesex gene in the testis of Spodoptera litura. Insect Science. 26 (6), 1000-1010 (2019).
- Qin, H. G., Ding, J., Ye, Z. X., Huang, S. J., Luo, R. H. Dynamic analysis of experimental population of Spodoptera litura. Journal of Biosafety. 13 (2), 45-48 (2004).
- Guan, B. B., et al. The research in biology and ecology of Spodoptera litura. Journal of Biosafety. 8 (1), 57-61 (1999).
- Wen, L., et al. The testis development and spermatogenesis in Spodopture litura (lepidoptera: noctuidae). Journal of South China Normal University (Natural Science Edition. 51 (4), 47-56 (2019).
- Friedländer, M., Seth, R. K., Reynolds, S. E. Eupyrene and apyrene sperm: dichotomous spermatogenesis in Lepidoptera. Advances in Insect Physiology. 32, 206 (2010).
- Cook, P. A., Wedell, N. Non-fertile sperm delay female remating. Nature. 397 (6719), 486 (1999).
- Iriki, S. On the function of apyrene spermatozoa in the silk worm. Zoological Magazine. 53, 123-124 (1941).
- Liu, L., Feng, Q. L. The study of fusion of testis in Lepidoptera insects. Journal of South China Normal University (Natural Science Edition). 46 (5), 1-7 (2014).
- Klowden, M. J. . Physiological systems in insects. , (2007).
- Xu, J., et al. Transgenic characterization of two testis-specific promoters in the silkworm, Bombyx mori. Insect Molecular Biology. 24 (2), 183-190 (2015).
- Guo, X. R., Zheng, S. C., Liu, L., Feng, Q. L. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses. BioMed Central Molecular Biology. 10, 102 (2009).
- Kopeć, S. Studies on the necessity of the brain for the inception of insect metamorphosis. Biological Bulletin. 42 (6), 323-342 (1922).
- Wigglesworth, V. B. Factors controlling moulting and 'metamorphosis' in an insect. Nature. 133 (5), 725-726 (1934).
- Williams, C. N. Physiology of insect diapause; the role of the brain in the production and termination of pupal dormancy in the giant silkworm, Platysamia cecropia. Biological Bulletin. 90 (3), 234-243 (1946).
- Fukuda, S. Hormonal control of molting and pupation in the silkworm. Proceedings of the Imperial Academy Tokyo. 16 (8), 417-420 (1940).
- Tian, H. J., Liu, Z. P., Bai, Y. Y. Common methods to detect Sperm quality of mammalian. Journal of Economic Zoology. 8 (4), 198-201 (2004).
- Ji, X. S., Chen, S. L., Zhao, Y., Tian, Y. S. Progress in the quality evaluation of fish sperm. Chinese Fishery Science. 14 (6), 1048-1054 (2007).
- Baulny, B. O. D., Vern, Y. L., Kerboeuf, D., Maisse, G. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology. 34 (2), 141-149 (1997).
- Krasznai, Z., Márián, T., Balkay, I., Emri, M., Trón, L. Permeabilization and structural changes in the membrane of common carp (Cyprinus carpio L.) sperm induced by hypo-osmotic shock. Aquaculture. 129 (1), 134 (1995).
- Kime, D. E., et al. Computer-assisted sperm analysis (CASA) as a tool for monitoring sperm quality in fish. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp. 130 (4), 425-433 (2001).
- Rurangwa, E., Volckaert, F. A., Huyskens, G., Kime, D. E., Ollevier, F. Quality control of refrigerated and cryopreserved semen using computer-assisted sperm analysis (CASA), viable staining and standardized fertilization in African catfish (Clarias gariepinus). Theriogenology. 55 (3), 751-769 (2001).
- Seth, R. K., Kaur, J. J., Rao, D. K., Reynolds, S. E. Effects of larval exposure to sublethal concentrations of the ecdysteroid agonists RH-5849 and tebufenozide (RH-5992) on male reproductive physiology in Spodoptera litura. Journal of Insect Physiology. 50 (6), 505-517 (2004).
- Sweeney, R. M., Watterson, R. L. Rib development in chick embryos analyzed by means of tantalum foil blocks. American Journal of Anatomy. 126 (2), 127-149 (1969).
- Wilde, S., Logan, M. P. Application of impermeable barriers combined with candidate factor soaked beads to study inductive signals in the chick. Journal of Visualized Experiments. (117), e54618 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유