A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חסימה מיקרוכירורגית של היתוך האשכים בספודופטרה ליטורה
In This Article
Summary
רדיד אלומיניום הוכנס מיקרוכירורגי בין האשכים של Spodoptera litura כדי לחסום את ההיתוך של האשכים. ההליך כולל הקפאה, תיקון, חיטוי, חתך, הצבת המכשול, תפירה, האכלה לאחר הניתוח ובדיקה. גישה זו מספקת שיטה להפריע להיווצרות רקמות.
Abstract
במקום להשתמש בשיטות גנטיות כמו הפרעות RNA (RNAi) ומקובצים באופן קבוע בין-מרחבי של חזרות פלינדרומיות קצרות (CRISPR)/CRISPR הקשורים לאנדונוקלאז Cas9, מחסום פיזי הוכנס מיקרו-כירורגית בין האשכים של Spodoptera litura כדי לחקור את ההשפעה של מיקרו-כירורגיה זו על צמיחתה ורבייתה. לאחר החדרת רדיד אלומיניום בין האשכים, חרקים מותכים במהלך מטמורפוזה המשיך כרגיל. צמיחת חרקים והתפתחותם לא שונו להפליא; עם זאת, מספר חבילות הזרע השתנה אם היתוך האשכים נעצר על ידי המיקרוכירורגיה. ממצאים אלה מרמזים כי חסימת היתוך האשכים יכולה להשפיע על יכולת הרבייה הגברית. השיטה יכולה להיות מיושמת עוד יותר כדי להפריע תקשורת בין איברים כדי ללמוד את הפונקציה של מסלולי איתות ספציפיים. בהשוואה לניתוח קונבנציונלי, מיקרוכירורגיה דורשת רק הרדמה הקפאה, אשר עדיף על פחמן דו חמצני מרדים. מיקרוכירורגיה גם ממזערת את אזור אתר הניתוח ומאפשרת ריפוי פצעים. עם זאת, בחירת חומרים עם פונקציות ספציפיות דורשת חקירה נוספת. הימנעות פגיעה ברקמות היא קריטית בעת ביצוע חתכים במהלך הניתוח.
Introduction
היתוך הוא תופעה נפוצה בהתפתחות רקמות או איברים. דוגמאות כוללות סגירת גב וסגירת בית החזה ב Drosophila1 ומורפוגנזה חיך, מורפוגנזה צינור עצבי, מורפוגנזה לב, מורפוגנזה לב בעכברים ועוף2. CRISPR ו- RNAi יושמו לחקור את תפקידי הגנים בתהליך ההיתוך2,3,4.
ספודופטרה ליטורה (באנגלית: Spodoptera litura; S. litura, Lepidoptera: Noctuidae) הוא מזיק פוליפגוס מזיק המופץ באופן נרחב באזורים טרופיים וסובטרופיים באסיה, כולל סין4,5,6. ההפצה הרחבה של S. litura מיוחסת בחלקה ליכולת הרבייה החזקה שלה, שרלוונטית להתפתחות גונדו. אי פוריות הגבר היא גישה אחת לשלוט במזיק זה. כפי שניתן לראות בדמות הסכמטית של מבנה האשכים, האשכים מוקפים במעטפת האשכים, כולל הנדן החיצוני (נדן הצפק) ולאמינה הבסיסית הפנימית. הלמינה הבסיסית משתרעת באופן פנימי ויוצרת את האפיתל הזקיקי ומפרידה את האזור הפנימי של האשכים לארבעה תאים הנקראים זקיקים (איור 1).
בזקיקים, זרעונים מתפתחים לזרעונים לאחר מיטוזה ומיוזה, ואז הזרעון בשקי הזרע מתיישר באותו כיוון כדי ליצור חבילות זרע7. במהלך spermatogenesis, הזרעונים העיקריים להבדיל לתוך זרעים eupyrene או זרע apyrene. זרעונים בשלב הזחל מתפתחים לזרע אופירין עם זנב ארוך המחובר לראש של גרעין מוארך; אלה יכולים להפרות ביצים. לעומת זאת, זרעונים בשלב אמצע הגולם מתפתחים לזרע apyrene עם גרעין שהושלך; זרעים אלה מסייעים להישרדות, תנועה והפריה של זרע אופירין9,10. היום השישי של הגולם הוא התקופה שבמהלכה האשכים יש חבילות זרע אופירין ו apyrene בשפע.
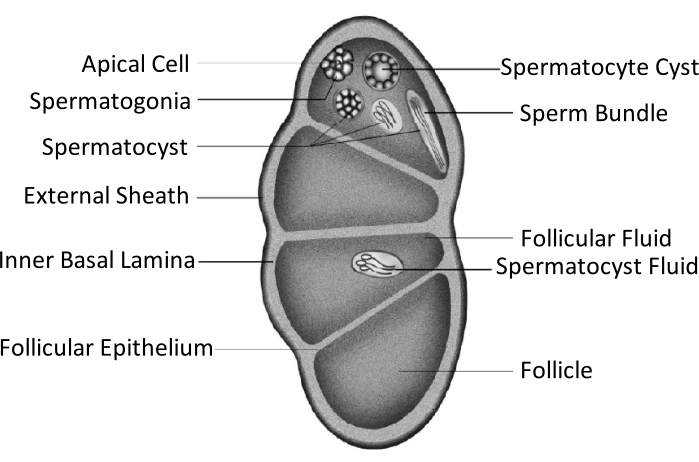
איור 1: דיאגרמה סכמטית של מבנה האשכים של חרקי לפידופטרה11. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
היתוך האשכים מתרחש ברוב החרקים של סדר לפידופטרה 11,12, במיוחד באותם מינים שהם מזיקים חקלאיים. היתוך האשכים מתייחס זוג האשכים גדל דו צדדי בשלב הזחל, מתקרב ודבק זה בזה, בסופו של דבר משתלב לתוך gonad11 יחיד. ב Spodoptera litura, זה קורה במהלך מטמורפוזה מן הזחל לשלב pupal. מהיום הראשון של האינסטאר החמישי (L5D1) ועד היום הרביעי של האינסטאר השישי (L6D4), זוג האשכים גדל בהדרגה בגודלו, והצבע הופך לצהוב בהיר מלבן שנהב. זה הופך להיות אדום קלוש כפי שהוא מגיע לשלב prepupal (L6D5 כדי L6D6). שני אשכים סימטריים דו-צדדיים מתקרבים זה לזה בשלב שלפני ההשמדה, מתמזגים לאחד, ומעוותים את כיוון השעון (תצוגת דוראל) כדי לייצר אשכים בודדים בשלבי הגולם והמבוגרים11. תופעה זו אינה מתרחשת בתולעי משי, אשר יש חשיבות כלכלית ניכרת כבר מבויתים במשך 5000 שנים13. לכן, ההנחה היא כי ההיתוך של האשכים משפר את יכולת הרבייה.
כדי לקבוע את המשמעות של היתוך האשכים Spodoptera litura , חשוב לחקור את ההשפעות של חסימת התהליך. בפרוטוקול זה, רדיד אלומיניום הוכנס מיקרוכירורגי בין האשכים כדי להפריד ביניהם, ואת השינויים הנובעים מכך בהתפתחות החרקים ואת האשכים שלהם נחקרו.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. גידול ותחזוקה של חרקים
- תרבות זחלי Spodoptera litura בתאי סימולציה סביבתיים עם דיאטה מלאכותית עד שהם מגיעים ליום 4 של כוכב 6 ( L6D4). בחר זחלים זכריים כאשר התולעים נכנסות ליום הראשון של האינסטאר השישי (L6D0) בהתבסס על המבנה ההפוך בצורת משולש על הבטן השמינית14.
הערה: טכניקות גידול ותחזוקה של זחלים פורסמו בעבר 4,14.
2. הכנה טרום-כירורגית
- חותכים את רדיד האלומיניום לחתיכות מלבניות עם פינות מעוגלות (1 מ"מ x 2 מ"מ, איור 2).
- לעקר את פלטפורמת הניתוח ואת הפריטים הקשורים (משטח השולחן, מיקרוסקופ, מקרר, קופסת חרקים, מגש שעווה, סיכות, חוט) על ידי ריסוס 75% אלכוהול על פני השטח שלהם וניגוב אותם.
- לחטא כלים כירורגיים (כולל רדיד אלומיניום) עם עיקור קיטור בלחץ גבוה במשך 30 דקות, ולהניח אותם בתנור חימום וייבוש ב 120 °C (50 °F).
- ודא שהמפעילים לובשים בגדי מעבדה נקיים, מסכות כירורגיות וכפפות סטריליות.
3. מיקום מיקרו-כירורגי של מחסום בין האשכים
הערה: זרימת העבודה הכללית היא כדלקמן: הקפאת → תיקון → חיטוי → חתך → מיקום מחסום → תפירה→ האכלה ובדיקה לאחר הניתוח
- מניחים זחלים זכריים (L6D4) על קרח במשך 10-30 דקות כדי לשמור אותם מורדמים במהלך הניתוח.
- מניחים זחל על מגש השעווה עם הצד הגבי למעלה, ולאחר מכן מתקנים את הראש והזנב של הזחל עם סיכות וחוטים, ומציגים את האזור הניתוחי שהוא משטח הגב בקטע הגוף התשיעי (איור 3A).
- לחטא את האזור הניתוחי על ידי החלת תמיסת יוד 3% עם צמר גפן על האפידרמיס (קטע הגוף התשיעי ), ואחריו 70% אלכוהול כדי להסיר את היוד (איור 3B).
הערה: התמקדו בזחל באמצעות התאמה גסה ועדינה של המיקרוסקופ הכירורגי (איור 3C). מניחים את מגש השעווה על צלחת תרבות גדולה יותר מלאה בקרח כדי לשמור על ההרדמה. - בצע חתך באורך 2 מ"מ על האפידרמיס הגבי של קטע הגוף התשיעי . לאחר מכן, השתמש ספוגית כותנה סטרילית כדי להסיר כל המולימפה דולפת וגופי שומן ולקבל תצוגה ברורה של האזור הניתוחי.
הערה: חשוב להימנע מהלב במהלך ההליך. זה יכול להיעשות על ידי ביצוע החתך מעט ליד קו האמצע בקטע הגוף ה - 9 או במפרק בין מקטעי הגוף ה - 9 וה - 10 כדי למנוע מהאשכים לצאת בגלל הלחץ הפנימי הזחלי. בעת השימוש באזמל, בצעו תחילה חריץ אנכי עם הלהב (איור 4A), ולאחר מכן סובבו אותו ב-45° לכיוון האפידרמיס לפני חיתוך אחיד ורציף של האפידרמיס (איור 4B). - השתמשו בפינצטה כירורגית כדי להכניס פיסת רדיד אלומיניום בין האשכים (איור 5).
- בסוף הניתוח, לסגור את החתך כדי למנוע זיהום, ולאפשר לזחלים להתאושש מהניתוח.
- סגרו את האפידרמיס עם תפר פועל (איור 6).
- השתמשו במחזיק מחטים ובפינצטה כירורגית כדי לקשור קשר מרובע כירורגי, הדורש שני קשרים פשוטים מנוגדים של תמונת מראה (איור 6D, E).
- השתמש במספריים כדי לחתוך את התפר העודף מזנבות הלולאה, משאיר חוט 2 מ"מ מאחור.
- לאחר התפירה, מניחים בעדינות את הזחל בקופסת הגידול ושומרים עליהם בתא סימולציה סביבתי נקי. המשך להתבונן בזחלים.
הערה: הפצע מפסיק לדלוף המולימפה, והזחלים מתאוששים בהדרגה לאחר הניתוח. התולעים ממשיכות להשלים את המטמורפוזה שלהן.

איור 2: מחסום פיזי שהוכן באמצעות רדיד אלומיניום (1 מ"מ x 2 מ"מ). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
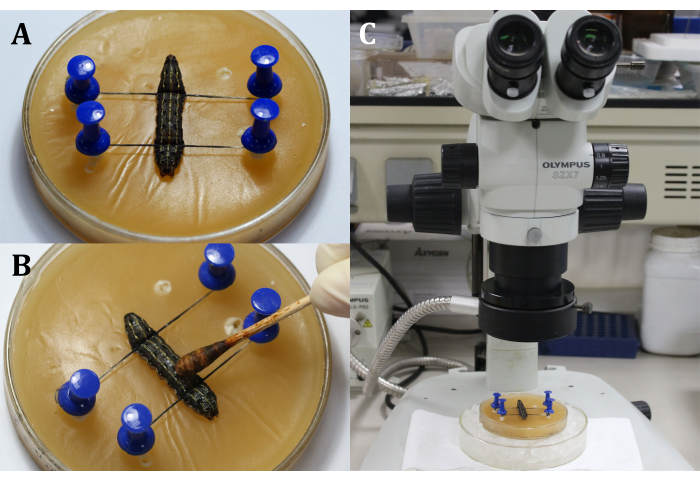
איור 3: לפני החתך. (א) תיקון הזחל. (ב) חיטוי האפידרמיס של האזור הכירורגי. (ג) ביצוע ניתוח תחת המיקרוסקופ. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
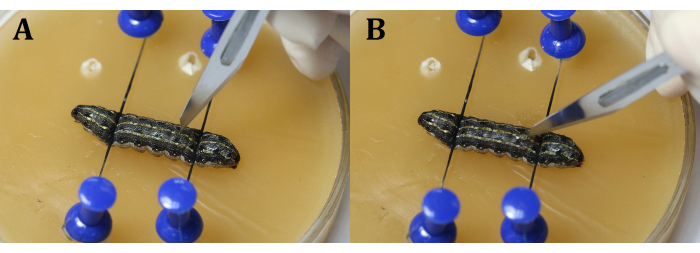
איור 4: חתך. (א) חתך את הזחלים אנכית עם הלהב. (B) סובב את הלהב 45° לכיוון האפידרמיס לפני חיתוך דרך. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: החדרת המחסום הפיזי (רדיד אלומיניום) בין האשכים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 6: תפירה. (א) הכנס את המחט. (ב) למשוך את המחט. (ג) לסגת ולהדק את המחט. (ד) לקשור את הקשר הפשוט הראשון. (ה) קשרו את הקשר הפשוט הנגדי בתמונה במראה. (F) לחתוך חוט תפר עודף. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
ההשפעות של מיקרוכירורגיה על Spodoptera ליטורה צמיחה ופיתוח
המיקרוכירורגיה הותירה פצע באורך 2 מ"מ על אפידרמיס זחל הגב שבסופו של דבר הפסיק לדלוף המולימפה ונרפא. הזחלים עברו שלבים מוקדמים וגולם ועיקלו, מה שמצביע על כך שלמיקרוכירורגיה לא הייתה השפעה משמעותית על ה...
Access restricted. Please log in or start a trial to view this content.
Discussion
לאחר הפרעה מיקרוכירורגית היתוך האשכים Spodoptera litura, מספר חבילות הזרע ירד, אשר תמך בהשערה כי היתוך זה מועיל ליכולת הרבייה. מניפולציה כירורגית שימשה לחקר ההתפתחות הפיזיולוגית של חרקים מאז תחילת המאה ה -20. כדי לקבוע אם עצב הגולגולת מוסדר על ידי מטמורפוזה חרקים, כמה חוקרים ביצעו הליכים...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדעי הטבע של סין (Nos.:31772519, 31720103916; ) ומענק פתוח ממעבדת המפתח הממלכתית לביולוגיה של גנום תולעי משי, אוניברסיטת דרום מערב (מס ': sklsgb2013003).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 75% Rubbing alcohol | Qingdao Hainuo Nuowei Disinfection Technology Co., Ltd | Q/370285HNW 001-2019 | |
| Colored Push Pins | Deli Group Co.,LTD | 0042 | |
| Corneal Scissors | Suzhou Xiehe Medical Device Co., Ltd | MR-S221A | Curved and blunt tip |
| Glad Aluminum Foil | Clorox China(Guangzhou) Limited | 831457 | 10 cm*2.5 cm*0.6 |
| Medical Cotton Swabs (Sterile) | Winner Medical Co., Ltd. | 601-022921-01 | |
| Medical Iodine Cotton Swab | Winner Medical Co., Ltd. | 608-000247 | |
| Needle holder | Shanghai Medical Instruments (Group) Ltd., Corp. | J32030 | 14 cm fine needle |
| Sterile surgical blade | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | #11 | |
| Suigical Blade Holder | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | K6-10 | Straight 3# |
| Suture thread with needle | Ningbo Medical Stitch Needle Co., Ltd | needle: 3/8 Circle, 2.5*8 ; Thread: Nylon, 6/0, 25 cm | |
| Tying Forceps | Suzhou Xiehe Medical Device Co., Ltd | MR-F201T-3 | Straight-pointed; long handle; 0.12 mm-wide-head |
References
- Zeitlinger, J., Bohmann, D. Thorax closure in Drosophila: involvement of Fos and the JNK pathway. Development. 126 (17), 3947-3956 (1999).
- Ray, H. J., Niswander, L. Mechanisms of tissue fusion during development. Development. 139 (10), 1701-1711 (2012).
- Ducuing, A., Keeley, C., Mollereau, B., Vincent, S. A. DPP-mediated feed-forward loop canalizes morphogenesis during Drosophila dorsal closure. The Journal of Cell Biology. 208 (2), 239-248 (2015).
- Du, Q., et al. Identification and functional characterization of doublesex gene in the testis of Spodoptera litura. Insect Science. 26 (6), 1000-1010 (2019).
- Qin, H. G., Ding, J., Ye, Z. X., Huang, S. J., Luo, R. H. Dynamic analysis of experimental population of Spodoptera litura. Journal of Biosafety. 13 (2), 45-48 (2004).
- Guan, B. B., et al. The research in biology and ecology of Spodoptera litura. Journal of Biosafety. 8 (1), 57-61 (1999).
- Wen, L., et al. The testis development and spermatogenesis in Spodopture litura (lepidoptera: noctuidae). Journal of South China Normal University (Natural Science Edition. 51 (4), 47-56 (2019).
- Friedländer, M., Seth, R. K., Reynolds, S. E. Eupyrene and apyrene sperm: dichotomous spermatogenesis in Lepidoptera. Advances in Insect Physiology. 32, 206(2010).
- Cook, P. A., Wedell, N. Non-fertile sperm delay female remating. Nature. 397 (6719), 486(1999).
- Iriki, S. On the function of apyrene spermatozoa in the silk worm. Zoological Magazine. 53, 123-124 (1941).
- Liu, L., Feng, Q. L. The study of fusion of testis in Lepidoptera insects. Journal of South China Normal University (Natural Science Edition). 46 (5), 1-7 (2014).
- Klowden, M. J. Physiological systems in insects. , Elsevier/Academic Press. Amsterdam, NL; Boston, MA. (2007).
- Xu, J., et al. Transgenic characterization of two testis-specific promoters in the silkworm, Bombyx mori. Insect Molecular Biology. 24 (2), 183-190 (2015).
- Guo, X. R., Zheng, S. C., Liu, L., Feng, Q. L. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses. BioMed Central Molecular Biology. 10, 102(2009).
- Kopeć, S. Studies on the necessity of the brain for the inception of insect metamorphosis. Biological Bulletin. 42 (6), 323-342 (1922).
- Wigglesworth, V. B. Factors controlling moulting and 'metamorphosis' in an insect. Nature. 133 (5), 725-726 (1934).
- Williams, C. N. Physiology of insect diapause; the role of the brain in the production and termination of pupal dormancy in the giant silkworm, Platysamia cecropia. Biological Bulletin. 90 (3), 234-243 (1946).
- Fukuda, S. Hormonal control of molting and pupation in the silkworm. Proceedings of the Imperial Academy Tokyo. 16 (8), 417-420 (1940).
- Tian, H. J., Liu, Z. P., Bai, Y. Y. Common methods to detect Sperm quality of mammalian. Journal of Economic Zoology. 8 (4), 198-201 (2004).
- Ji, X. S., Chen, S. L., Zhao, Y., Tian, Y. S. Progress in the quality evaluation of fish sperm. Chinese Fishery Science. 14 (6), 1048-1054 (2007).
- Baulny, B. O. D., Vern, Y. L., Kerboeuf, D., Maisse, G. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology. 34 (2), 141-149 (1997).
- Krasznai, Z., Márián, T., Balkay, I., Emri, M., Trón, L. Permeabilization and structural changes in the membrane of common carp (Cyprinus carpio L.) sperm induced by hypo-osmotic shock. Aquaculture. 129 (1), 134(1995).
- Kime, D. E., et al. Computer-assisted sperm analysis (CASA) as a tool for monitoring sperm quality in fish. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp. 130 (4), 425-433 (2001).
- Rurangwa, E., Volckaert, F. A., Huyskens, G., Kime, D. E., Ollevier, F. Quality control of refrigerated and cryopreserved semen using computer-assisted sperm analysis (CASA), viable staining and standardized fertilization in African catfish (Clarias gariepinus). Theriogenology. 55 (3), 751-769 (2001).
- Seth, R. K., Kaur, J. J., Rao, D. K., Reynolds, S. E. Effects of larval exposure to sublethal concentrations of the ecdysteroid agonists RH-5849 and tebufenozide (RH-5992) on male reproductive physiology in Spodoptera litura. Journal of Insect Physiology. 50 (6), 505-517 (2004).
- Sweeney, R. M., Watterson, R. L. Rib development in chick embryos analyzed by means of tantalum foil blocks. American Journal of Anatomy. 126 (2), 127-149 (1969).
- Wilde, S., Logan, M. P. Application of impermeable barriers combined with candidate factor soaked beads to study inductive signals in the chick. Journal of Visualized Experiments. (117), e54618(2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved