Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Obstruction microchirurgicale de la fusion des testicules chez Spodoptera litura
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Du papier d’aluminium a été inséré microchirurgicalement entre les testicules de Spodoptera litura pour obstruer la fusion des testicules. La procédure comprend la congélation, la fixation, la désinfection, l’incision, la mise en place de la barrière, la suture, l’alimentation postopératoire et l’inspection. Cette approche fournit une méthode pour interférer avec la formation des tissus.
Résumé
Au lieu d’utiliser des méthodes génétiques telles que l’interférence ARN (ARNi) et les courtes répétitions palindromiques régulièrement espacées (CRISPR) / l’endonucléase Cas9 associée à CRISPR, une barrière physique a été insérée microchirurgicalement entre les testicules de Spodoptera litura pour étudier l’impact de cette microchirurgie sur sa croissance et sa reproduction. Après avoir inséré du papier d’aluminium entre les testicules, la mue des insectes pendant la métamorphose s’est déroulée normalement. La croissance et le développement des insectes n’ont pas été remarquablement modifiés; cependant, le nombre de faisceaux de spermatozoïdes changeait si la fusion des testicules était arrêtée par la microchirurgie. Ces résultats impliquent que le blocage de la fusion testiculaire peut influencer la capacité de reproduction masculine. La méthode peut être appliquée pour interrompre la communication entre les organes afin d’étudier la fonction de voies de signalisation spécifiques. Par rapport à la chirurgie conventionnelle, la microchirurgie ne nécessite qu’une anesthésie par congélation, ce qui est préférable à l’anesthésie au dioxyde de carbone. La microchirurgie minimise également la zone du site chirurgical et facilite la cicatrisation des plaies. Cependant, la sélection de matériaux ayant des fonctions spécifiques nécessite une enquête plus approfondie. Éviter les lésions tissulaires est crucial lors de la réalisation d’incisions pendant l’opération.
Introduction
La fusion est un phénomène courant dans le développement des tissus ou des organes. Les exemples incluent la fermeture dorsale et la fermeture du thorax chez la drosophile1 et la morphogenèse du palais, la morphogenèse du tube neural et la morphogenèse cardiaque chez la souris et le poulet2. CRISPR et l’ARNi ont été appliqués pour étudier les rôles des gènes dans le processus de fusion2,3,4.
Spodoptera litura (S. litura, Lepidoptera: Noctuidae) est un ravageur polyphage nuisible qui est largement distribué dans les régions tropicales et subtropicales d’Asie, y compris la Chine4,5,6. La large distribution de S. litura est en partie attribuée à sa puissante capacité de reproduction, ce qui est pertinent pour le développement des gonades. L’infertilité masculine est une approche pour contrôler ce ravageur. Comme le montre la figure schématique de la structure testiculaire, les testicules sont entourés par la gaine testiculaire, y compris la gaine externe (gaine péritonéale) et la lame basale interne. La lame basale s’étend à l’intérieur pour former l’épithélium folliculaire et sépare la zone interne du testicule en quatre chambres appelées follicules (Figure 1).
Dans les follicules, la spermatogonie se développe en spermatozoïdes après la mitose et la méiose, puis les spermatozoïdes dans les sacs de spermatozoïdes s’alignent dans la même direction pour former des faisceaux de spermatozoïdes7. Au cours de la spermatogenèse, les spermatocytes primaires se différencient en spermatozoïdes d’eupyrène ou en spermatozoïdes d’apyrène. Les spermatocytes en phase larvaire se développent en spermatozoïdes d’eupyrène avec une longue queue reliée à une tête d’un noyau allongé; ceux-ci peuvent féconder les œufs. Inversement, les spermatocytes dans la phase mi-nymphale se développent en spermatozoïdes d’apyrène avec un noyau rejeté; ces spermatozoïdes aident à la survie, au mouvement et à la fécondation des spermatozoïdes d’eupyrène9,10. Le 6ème jour de la nymphe est la période pendant laquelle les testicules ont des faisceaux abondants de spermatozoïdes d’eupyrène et d’apyrène.
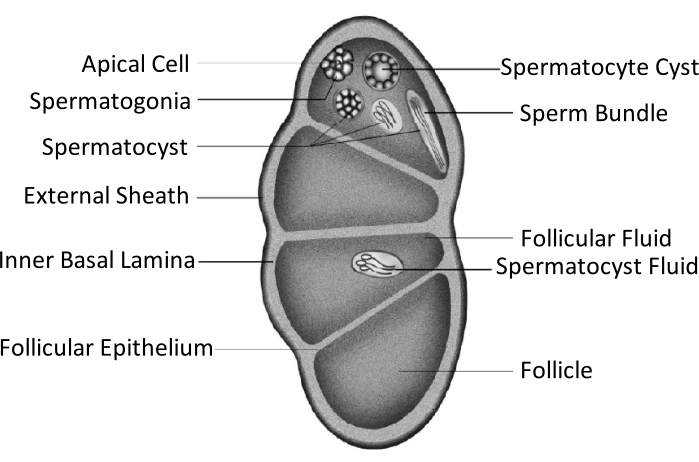
Figure 1: Schéma de la structure testiculaire des insectes lépidoptères11. Veuillez cliquer ici pour voir une version plus grande de cette figure.
La fusion testiculaire se produit chez la plupart des insectes de l’ordre des lépidoptères11,12, en particulier chez les espèces qui sont des ravageurs agricoles. La fusion testiculaire fait référence à une paire de testicules se développant bilatéralement dans la phase larvaire, s’approchant et adhérant les uns aux autres, s’intégrant finalement en une seule gonade11. Chez Spodoptera litura, cela se produit lors de la métamorphose du stade larvaire au stade nymphal. Du jour 1 de la 5ème instar (L5D1) au jour 4 de la 6ème instar (L6D4), la paire de testicules grandit progressivement en taille, et la couleur devient jaune clair à partir de blanc ivoire. Il devient légèrement rouge lorsqu’il atteint la phase prépaptique (L6D5 à L6D6). Deux testicules symétriques bilatéraux s’approchent l’un de l’autre au cours de la phase prépupale, fusionnent en un seul et se tordent dans le sens inverse des aiguilles d’une montre (vue dorale) pour produire un seul testicule dans les phases nymphale et adulte11. Ce phénomène ne se produit pas chez les vers à soie, qui ont une importance économique considérable et ont été domestiqués depuis 5000 ans13. Ainsi, on suppose que la fusion des testicules améliore la capacité de reproduction.
Pour déterminer l’importance de la fusion testiculaire de Spodoptera litura , il est important d’étudier les effets du blocage du processus. Dans ce protocole, du papier d’aluminium a été inséré microchirurgicalement entre les testicules pour les garder séparés, et les changements qui en ont résulté dans le développement des insectes et de leurs testicules ont été étudiés.
Protocole
1. Élevage et entretien des insectes
- Cultivez les larves de Spodoptera litura dans des chambres de simulation environnementale avec un régime artificiel jusqu’à ce qu’elles atteignent le jour 4 du 6ème stade (L6D4). Sélectionnez les larves mâles lorsque les vers entrent dans le premier jour de la 6e instar (L6D0) en fonction de la structure en forme de triangle inverse sur le huitième abdomen14.
NOTE: Les techniques d’élevage et d’entretien des larves ont été publiées précédemment4,14.
2. Préparation préchirurgicale
- Coupez la feuille d’aluminium en morceaux rectangulaires aux coins arrondis (1 mm x 2 mm, Figure 2).
- Stérilisez la plate-forme chirurgicale et les articles connexes (surface de table, microscope, glacière, boîte à insectes, plateau de cire, épingles et fil) en pulvérisant 75% d’alcool sur leur surface et en les essuyant.
- Stérilisez les outils chirurgicaux (y compris le papier d’aluminium) avec un stérilisateur à vapeur haute pression pendant 30 min et placez-les dans un four de chauffage et de séchage à 120 °C.
- Assurez-vous que les opérateurs portent des vêtements de laboratoire propres, des masques chirurgicaux et des gants stériles.
3. Mise en place microchirurgicale d’une barrière entre les testicules
REMARQUE: Le flux de travail général est le suivant: Congélation → fixation → désinfection → incision → barrière Placement → suture→ alimentation et inspection postopératoires
- Placer les larves mâles (L6D4) sur la glace pendant 10 à 30 minutes pour les garder anesthésiées pendant l’opération.
- Placez une larve sur le plateau de cire avec la face dorsale vers le haut, puis fixez la tête et la queue de la larve avec des épingles et des fils, en montrant la zone chirurgicale qui est la surface dorsale sur le 9ème segment du corps (Figure 3A).
- Désinfectez la zone chirurgicale en appliquant de la teinture d’iode à 3 % avec un coton-tige sur l’épiderme (9e segment du corps), suivie de 70 % d’alcool pour éliminer l’iode (figure 3B).
REMARQUE: Concentrez-vous sur la larve grâce à un ajustement grossier et fin du microscope chirurgical (Figure 3C). Placez le plateau de cire sur un plus grand plat de culture rempli de glace pour garder l’anesthésie. - Faites une incision de 2 mm de long sur l’épiderme dorsal du 9ème segment du corps. Ensuite, utilisez un coton-tige stérile pour enlever toute fuite d’hémolymphe et de corps gras et obtenir une vue claire de la zone chirurgicale.
REMARQUE: Il est important d’éviter le cœur pendant la procédure. Cela peut être fait en faisant l’incision légèrement à côté de la ligne médiane dans le 9ème segment du corps ou à l’articulation entre les 9ème et 10ème segments du corps pour empêcher les testicules de sortir en raison de la pression interne larvaire. Lors de l’utilisation du scalpel, faites d’abord une fente verticale avec la lame (Figure 4A), puis tournez-la de 45° vers l’épiderme avant de couper uniformément et continuellement à travers l’épiderme (Figure 4B). - Utilisez une pince à épiler chirurgicale pour insérer un morceau de papier d’aluminium entre les testicules (Figure 5).
- À la fin de la chirurgie, fermez l’incision pour éviter l’infection et permettre aux larves de se remettre de la chirurgie.
- Fermez l’épiderme avec une suture courante (Figure 6).
- Utilisez un porte-aiguille et une pince à épiler chirurgicale pour nouer un nœud carré chirurgical, nécessitant deux nœuds simples opposés en image miroir (Figure 6D, E).
- Utilisez des ciseaux pour couper l’excès de suture des queues de boucle, en laissant un fil de 2 mm derrière.
- Après la suture, déposez doucement la larve dans la boîte d’élevage et maintenez-la dans une chambre de simulation environnementale propre. Continuez à observer les larves.
REMARQUE: La plaie cesse de fuir l’hémolymphe et les larves se rétablissent progressivement après la chirurgie. Les vers continuent de compléter leur métamorphose.

Figure 2: Barrière physique préparée à l’aide d’une feuille d’aluminium (1 mm x 2 mm). Veuillez cliquer ici pour voir une version plus grande de cette figure.
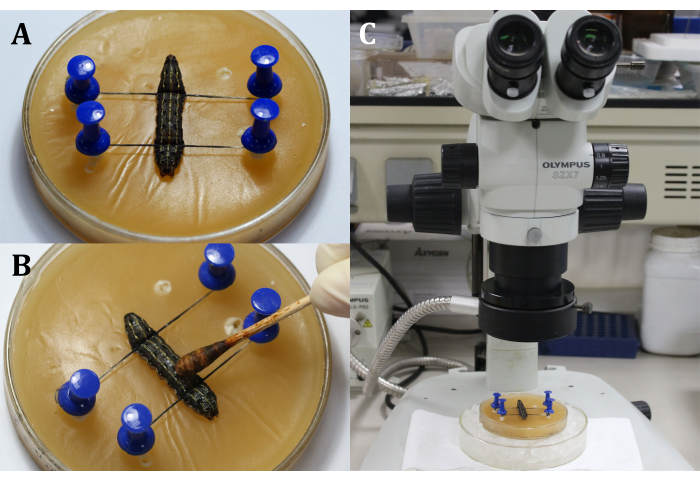
Figure 3 : Avant l’incision. (A) Fixation de la larve. (B) Désinfection de l’épiderme de la zone chirurgicale. (C) Effectuer une intervention chirurgicale au microscope. Veuillez cliquer ici pour voir une version agrandie de cette figure.
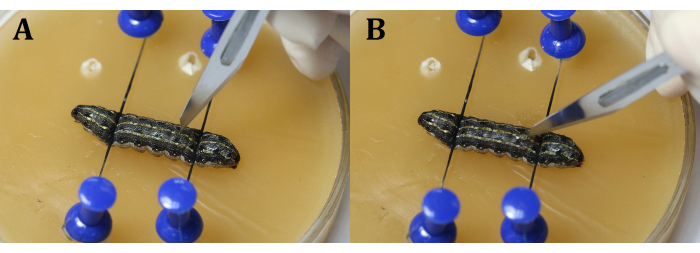
Figure 4 : Incision. (A) Fendez les larves verticalement avec la lame. (B) Tournez la lame de 45° vers l’épiderme avant de la couper. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Insertion de la barrière physique (feuille d’aluminium) entre les testicules. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6: Suture. (A) Insérer l’aiguille. (B) Retirez l’aiguille. (C) Retirer et serrer l’aiguille. (D) Nouez le premier nœud simple. (E) Attachez le nœud simple opposé à l’image miroir. (F) Couper l’excès de fil de suture. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Les effets de la microchirurgie sur la croissance et le développement de Spodoptera litura
La microchirurgie a laissé une plaie de 2 mm de long sur l’épiderme larvaire dorsal qui a finalement cessé de fuir l’hémolymphe et a guéri. Les larves sont passées par des stades prépoupaux et nymphaux et se sont écloses, ce qui indique que la microchirurgie n’a pas eu d’impact majeur sur la croissance et le développement. Lorsque les larves ont mué...
Discussion
Après l’obstruction microchirurgicale de la fusion des testicules chez Spodoptera litura, le nombre de faisceaux de spermatozoïdes a diminué, ce qui a soutenu l’hypothèse selon laquelle cette fusion est bénéfique pour la capacité de reproduction. La manipulation chirurgicale a été utilisée pour étudier le développement physiologique des insectes depuis le début du 20ème siècle. Pour déterminer si le nerf crânien est régulé par la métamorphose des insectes, certains chercheurs o...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la National Natural Science Foundation of China (Nos.:31772519, 31720103916; ) et une subvention ouverte du State Key Laboratory of Silkworm Genome Biology, South West University (No.: sklsgb2013003).
matériels
| Name | Company | Catalog Number | Comments |
| 75% Rubbing alcohol | Qingdao Hainuo Nuowei Disinfection Technology Co., Ltd | Q/370285HNW 001-2019 | |
| Colored Push Pins | Deli Group Co.,LTD | 0042 | |
| Corneal Scissors | Suzhou Xiehe Medical Device Co., Ltd | MR-S221A | Curved and blunt tip |
| Glad Aluminum Foil | Clorox China(Guangzhou) Limited | 831457 | 10 cm*2.5 cm*0.6 |
| Medical Cotton Swabs (Sterile) | Winner Medical Co., Ltd. | 601-022921-01 | |
| Medical Iodine Cotton Swab | Winner Medical Co., Ltd. | 608-000247 | |
| Needle holder | Shanghai Medical Instruments (Group) Ltd., Corp. | J32030 | 14 cm fine needle |
| Sterile surgical blade | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | #11 | |
| Suigical Blade Holder | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | K6-10 | Straight 3# |
| Suture thread with needle | Ningbo Medical Stitch Needle Co., Ltd | needle: 3/8 Circle, 2.5*8 ; Thread: Nylon, 6/0, 25 cm | |
| Tying Forceps | Suzhou Xiehe Medical Device Co., Ltd | MR-F201T-3 | Straight-pointed; long handle; 0.12 mm-wide-head |
Références
- Zeitlinger, J., Bohmann, D. Thorax closure in Drosophila: involvement of Fos and the JNK pathway. Development. 126 (17), 3947-3956 (1999).
- Ray, H. J., Niswander, L. Mechanisms of tissue fusion during development. Development. 139 (10), 1701-1711 (2012).
- Ducuing, A., Keeley, C., Mollereau, B., Vincent, S. A. DPP-mediated feed-forward loop canalizes morphogenesis during Drosophila dorsal closure. The Journal of Cell Biology. 208 (2), 239-248 (2015).
- Du, Q., et al. Identification and functional characterization of doublesex gene in the testis of Spodoptera litura. Insect Science. 26 (6), 1000-1010 (2019).
- Qin, H. G., Ding, J., Ye, Z. X., Huang, S. J., Luo, R. H. Dynamic analysis of experimental population of Spodoptera litura. Journal of Biosafety. 13 (2), 45-48 (2004).
- Guan, B. B., et al. The research in biology and ecology of Spodoptera litura. Journal of Biosafety. 8 (1), 57-61 (1999).
- Wen, L., et al. The testis development and spermatogenesis in Spodopture litura (lepidoptera: noctuidae). Journal of South China Normal University (Natural Science Edition. 51 (4), 47-56 (2019).
- Friedländer, M., Seth, R. K., Reynolds, S. E. Eupyrene and apyrene sperm: dichotomous spermatogenesis in Lepidoptera. Advances in Insect Physiology. 32, 206 (2010).
- Cook, P. A., Wedell, N. Non-fertile sperm delay female remating. Nature. 397 (6719), 486 (1999).
- Iriki, S. On the function of apyrene spermatozoa in the silk worm. Zoological Magazine. 53, 123-124 (1941).
- Liu, L., Feng, Q. L. The study of fusion of testis in Lepidoptera insects. Journal of South China Normal University (Natural Science Edition). 46 (5), 1-7 (2014).
- Klowden, M. J. . Physiological systems in insects. , (2007).
- Xu, J., et al. Transgenic characterization of two testis-specific promoters in the silkworm, Bombyx mori. Insect Molecular Biology. 24 (2), 183-190 (2015).
- Guo, X. R., Zheng, S. C., Liu, L., Feng, Q. L. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses. BioMed Central Molecular Biology. 10, 102 (2009).
- Kopeć, S. Studies on the necessity of the brain for the inception of insect metamorphosis. Biological Bulletin. 42 (6), 323-342 (1922).
- Wigglesworth, V. B. Factors controlling moulting and 'metamorphosis' in an insect. Nature. 133 (5), 725-726 (1934).
- Williams, C. N. Physiology of insect diapause; the role of the brain in the production and termination of pupal dormancy in the giant silkworm, Platysamia cecropia. Biological Bulletin. 90 (3), 234-243 (1946).
- Fukuda, S. Hormonal control of molting and pupation in the silkworm. Proceedings of the Imperial Academy Tokyo. 16 (8), 417-420 (1940).
- Tian, H. J., Liu, Z. P., Bai, Y. Y. Common methods to detect Sperm quality of mammalian. Journal of Economic Zoology. 8 (4), 198-201 (2004).
- Ji, X. S., Chen, S. L., Zhao, Y., Tian, Y. S. Progress in the quality evaluation of fish sperm. Chinese Fishery Science. 14 (6), 1048-1054 (2007).
- Baulny, B. O. D., Vern, Y. L., Kerboeuf, D., Maisse, G. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology. 34 (2), 141-149 (1997).
- Krasznai, Z., Márián, T., Balkay, I., Emri, M., Trón, L. Permeabilization and structural changes in the membrane of common carp (Cyprinus carpio L.) sperm induced by hypo-osmotic shock. Aquaculture. 129 (1), 134 (1995).
- Kime, D. E., et al. Computer-assisted sperm analysis (CASA) as a tool for monitoring sperm quality in fish. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp. 130 (4), 425-433 (2001).
- Rurangwa, E., Volckaert, F. A., Huyskens, G., Kime, D. E., Ollevier, F. Quality control of refrigerated and cryopreserved semen using computer-assisted sperm analysis (CASA), viable staining and standardized fertilization in African catfish (Clarias gariepinus). Theriogenology. 55 (3), 751-769 (2001).
- Seth, R. K., Kaur, J. J., Rao, D. K., Reynolds, S. E. Effects of larval exposure to sublethal concentrations of the ecdysteroid agonists RH-5849 and tebufenozide (RH-5992) on male reproductive physiology in Spodoptera litura. Journal of Insect Physiology. 50 (6), 505-517 (2004).
- Sweeney, R. M., Watterson, R. L. Rib development in chick embryos analyzed by means of tantalum foil blocks. American Journal of Anatomy. 126 (2), 127-149 (1969).
- Wilde, S., Logan, M. P. Application of impermeable barriers combined with candidate factor soaked beads to study inductive signals in the chick. Journal of Visualized Experiments. (117), e54618 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon