È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Ostruzione microchirurgica della fusione dei testicoli in Spodoptera litura
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il foglio di alluminio è stato inserito microchirurgicamente tra i testicoli di Spodoptera litura per ostruire la fusione del testicolo. La procedura include congelamento, fissaggio, disinfezione, incisione, posizionamento della barriera, sutura, alimentazione postoperatoria e ispezione. Questo approccio fornisce un metodo per interferire con la formazione dei tessuti.
Abstract
Invece di utilizzare metodi genetici come l'interferenza dell'RNA (RNAi) e le brevi ripetizioni palindrome raggruppate regolarmente intervallate (CRISPR) / endonucleasi associate a CRISPR Cas9, una barriera fisica è stata inserita microchirurgicamente tra i testicoli di Spodoptera litura per studiare l'impatto di questa microchirurgia sulla sua crescita e riproduzione. Dopo aver inserito un foglio di alluminio tra i testicoli, la muta degli insetti durante la metamorfosi procedeva normalmente. La crescita e lo sviluppo degli insetti non sono stati notevolmente alterati; tuttavia, il numero di fasci di spermatozoi è cambiato se la fusione dei testicoli è stata interrotta dalla microchirurgia. Questi risultati implicano che il blocco della fusione testicolare può influenzare la capacità di riproduzione maschile. Il metodo può essere ulteriormente applicato per interrompere la comunicazione tra gli organi per studiare la funzione di specifiche vie di segnalazione. Rispetto alla chirurgia convenzionale, la microchirurgia richiede solo l'anestesia congelante, che è preferibile all'anestesia con anidride carbonica. La microchirurgia riduce anche al minimo l'area del sito chirurgico e facilita la guarigione delle ferite. Tuttavia, la selezione di materiali con funzioni specifiche richiede ulteriori indagini. Evitare lesioni tissutali è fondamentale quando si praticano incisioni durante l'operazione.
Introduzione
La fusione è un fenomeno comune nello sviluppo di tessuti o organi. Gli esempi includono la chiusura dorsale e la chiusura del torace in Drosophila1 e morfogenesi del palato, morfogenesi del tubo neurale e morfogenesi cardiaca in topi e polli2. CRISPR e RNAi sono stati applicati per studiare i ruoli dei geni nel processo di fusione2,3,4.
Spodoptera litura (S. litura, Lepidoptera: Noctuidae) è un parassita polifago dannoso che è ampiamente distribuito nelle aree tropicali e subtropicali dell'Asia, tra cui la Cina4,5,6. L'ampia distribuzione di S. litura è in parte attribuita alla sua potente capacità riproduttiva, che è rilevante per lo sviluppo delle gonadi. L'infertilità maschile è un approccio per controllare questo parassita. Come mostrato nella figura schematica della struttura testicolare, i testicoli sono racchiusi dalla guaina testicolare, compresa la guaina esterna (guaina peritoneale) e la lamina basale interna. La lamina basale si estende internamente per formare l'epitelio follicolare e separa l'area interna del testicolo in quattro camere chiamate follicoli (Figura 1).
Nei follicoli, gli spermatogoni si sviluppano in spermatozoi dopo mitosi e meiosi, e quindi gli spermatozoi nelle sacche spermatiche si allineano nella stessa direzione per formare fasci di spermatozoi7. Durante la spermatogenesi, gli spermatociti primari si differenziano in spermatozoi eupireni o spermatozoi apireni. Gli spermatociti nella fase larvale si sviluppano in spermatozoi eupireni con una lunga coda collegata a una testa di un nucleo allungato; questi possono fecondare le uova. Al contrario, gli spermatociti nella fase mid-pupal si sviluppano in spermatozoi apireni con un nucleo scartato; questi spermatozoi aiutano la sopravvivenza, il movimento e la fecondazione degli spermatozoi eupireni9,10. Il 6 ° giorno della pupa è il periodo durante il quale i testicoli hanno abbondanti fasci di spermatozoi eupirene e apirene.
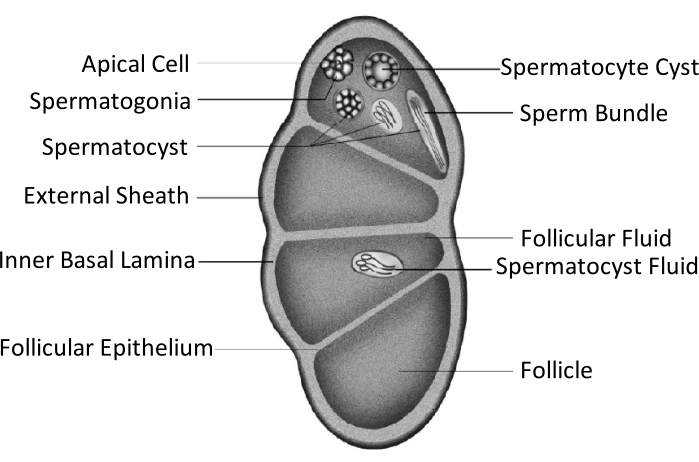
Figura 1: Diagramma schematico della struttura testicolare degli insetti lepidotteri11. Fare clic qui per visualizzare una versione più grande di questa figura.
La fusione testicolare si verifica nella maggior parte degli insetti dell'ordine dei lepidotteri11,12, specialmente in quelle specie che sono parassiti agricoli. La fusione testicolare si riferisce a una coppia di testicoli che crescono bilateralmente nella fase larvale, avvicinandosi e aderendo l'uno all'altro, integrandosi infine in una singola gonade11. In Spodoptera litura, accade durante la metamorfosi dallo stadio larvale a quello pupale. Dal giorno 1 del 5 ° instar (L5D1) al giorno 4 del 6 ° instar (L6D4), la coppia di testicoli cresce gradualmente di dimensioni e il colore diventa giallo chiaro da bianco avorio. Diventa rosso tenue quando raggiunge la fase prepupale (da L6D5 a L6D6). Due testicoli simmetrici bilaterali si avvicinano l'un l'altro durante lo stadio prepupale, si fondono in uno e ruotano in senso antiorario (vista dorale) per produrre un singolo testicolo nelle fasi pupale e adulta11. Questo fenomeno non si verifica nei bachi da seta, che hanno una notevole importanza economica e sono stati addomesticati per 5000 anni13. Pertanto, si presume che la fusione dei testicoli migliori la capacità riproduttiva.
Per determinare il significato della fusione testicolare di Spodoptera litura , è importante indagare gli effetti del blocco del processo. In questo protocollo, il foglio di alluminio è stato inserito microchirurgicamente tra i testicoli per tenerli separati e sono stati studiati i conseguenti cambiamenti nello sviluppo degli insetti e dei loro testicoli.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Allevamento e manutenzione degli insetti
- Coltivare le larve di Spodoptera litura in camere di simulazione ambientale con una dieta artificiale fino al raggiungimento del giorno 4 del 6° instar (L6D4). Seleziona le larve maschili quando i vermi entrano nel primo giorno del 6 ° instar (L6D0) in base alla struttura a forma di triangolo inverso sull'ottavo addome14.
NOTA: Le tecniche di allevamento e manutenzione delle larve sono state pubblicate in precedenza4,14.
2. Preparazione prechirurgica
- Tagliare il foglio di alluminio in pezzi rettangolari con angoli arrotondati (1 mm x 2 mm, Figura 2).
- Sterilizzare la piattaforma chirurgica e gli elementi correlati (superficie del tavolo, microscopio, ghiacciaia, scatola degli insetti, vassoio di cera, spilli e filo) spruzzando il 75% di alcol sulla loro superficie e pulendoli.
- Sterilizzare gli strumenti chirurgici (incluso il foglio di alluminio) con uno sterilizzatore a vapore ad alta pressione per 30 minuti e metterli in un forno di riscaldamento e asciugatura a 120 °C.
- Assicurarsi che gli operatori indossino abiti da laboratorio puliti, maschere chirurgiche e guanti sterili.
3. Posizionamento microchirurgico di una barriera tra i testicoli
NOTA: Il flusso di lavoro generale è il seguente: congelamento → fissaggio → disinfezione → incisione → posizionamento della barriera → sutura→ alimentazione e ispezione postoperatoria
- Posizionare le larve maschili (L6D4) sul ghiaccio per 10-30 minuti per tenerle anestetizzate durante l'operazione.
- Posizionare una larva sul vassoio di cera con il lato dorsale verso l'alto, quindi fissare la testa e la coda della larva con spilli e fili, mostrando l'area chirurgica che è la superficie dorsale sul 9 ° segmento del corpo (Figura 3A).
- Disinfettare l'area chirurgica applicando la tintura di iodio al 3% con un batuffolo di cotone sull'epidermide (9 ° segmento del corpo), seguito da alcol al 70% per rimuovere lo iodio (Figura 3B).
NOTA: Concentrarsi sulla larva attraverso la regolazione grossolana e fine del microscopio chirurgico (Figura 3C). Posizionare il vassoio di cera su un piatto di coltura più grande pieno di ghiaccio per mantenere l'anestesia. - Fai un'incisione lunga 2 mm sull'epidermide dorsale del 9 ° segmento del corpo. Successivamente, utilizzare un batuffolo di cotone sterile per rimuovere eventuali perdite di emolinfa e corpi grassi e ottenere una visione chiara dell'area chirurgica.
NOTA: È importante evitare il cuore durante la procedura. Questo può essere fatto facendo l'incisione leggermente vicino alla linea mediana nel 9 ° segmento del corpo o all'articolazione tra il 9 ° e il 10 ° segmento del corpo per evitare che i testicoli fuoriescano a causa della pressione interna larvale. Durante l'utilizzo del bisturi, fare prima una fessura verticale con la lama (Figura 4A), quindi ruotarla di 45 ° verso l'epidermide prima di tagliare uniformemente e continuamente l'epidermide (Figura 4B). - Utilizzare una pinzetta chirurgica per inserire un foglio di alluminio tra i testicoli (Figura 5).
- Alla fine dell'intervento chirurgico, chiudere l'incisione per evitare l'infezione e consentire alle larve di riprendersi dall'intervento chirurgico.
- Chiudere l'epidermide con una sutura in esecuzione (Figura 6).
- Utilizzare un portaago e una pinzetta chirurgica per legare un nodo quadrato chirurgico, richiedendo due nodi semplici a immagine speculare opposti (Figura 6D, E).
- Usa le forbici per tagliare la sutura in eccesso dalle code del cappio, lasciando dietro di sé un filo di 2 mm.
- Dopo la sutura, posare delicatamente la larva nella scatola di allevamento e mantenerla in una camera di simulazione ambientale pulita. Continua a osservare le larve.
NOTA: La ferita smette di perdere emolinfa e le larve si riprendono gradualmente dopo l'intervento chirurgico. I vermi continuano a completare la loro metamorfosi.

Figura 2: Barriera fisica preparata utilizzando un foglio di alluminio (1 mm x 2 mm). Fare clic qui per visualizzare una versione più grande di questa figura.
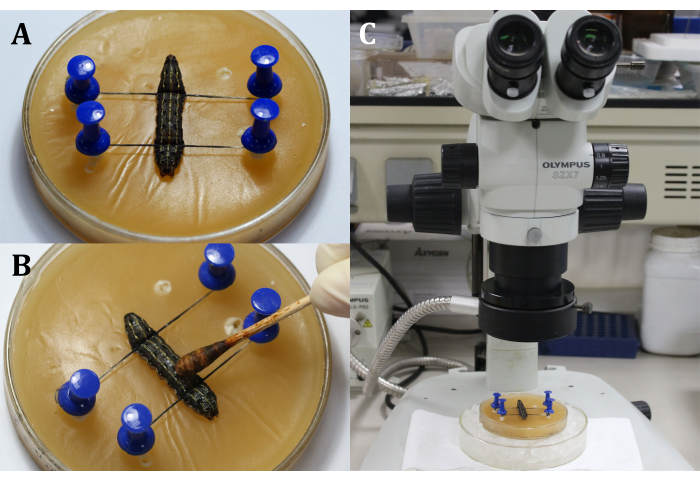
Figura 3: Prima dell'incisione. (A) Fissare la larva. (B) Disinfezione dell'epidermide dell'area chirurgica. C) Esecuzione di interventi chirurgici al microscopio. Fare clic qui per visualizzare una versione più grande di questa figura.
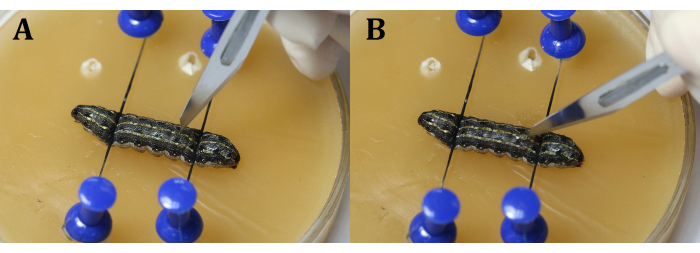
Figura 4: Incisione. (A) Tagliare le larve verticalmente con la lama. (B) Ruotare la lama di 45° verso l'epidermide prima di tagliarla. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Inserimento della barriera fisica (foglio di alluminio) tra i testicoli. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Sutura. (A) Inserire l'ago. (B) Ritirare l'ago. (C) Prelevare e bloccare l'ago. (D) Legare il primo nodo semplice. (E) Legare il nodo semplice opposto con immagini speculari. (F) Tagliare il filo di sutura in eccesso. Fare clic qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
Gli effetti della microchirurgia sulla crescita e lo sviluppo di Spodoptera litura
La microchirurgia ha lasciato una ferita lunga 2 mm sull'epidermide larvale dorsale che alla fine ha smesso di perdere emolinfa ed è guarita. Le larve hanno attraversato fasi prepupali e pupali e si sono chiuse, indicando che la microchirurgia non ha avuto un impatto importante sulla crescita e sullo sviluppo. Quando le larve si sono fuse in pupe, i fili di sutura sono stati ...
Access restricted. Please log in or start a trial to view this content.
Discussione
Dopo aver ostruito microchirurgicamente la fusione dei testicoli in Spodoptera litura, il numero di fasci di spermatozoi è diminuito, il che ha supportato l'ipotesi che questa fusione sia benefica per la capacità riproduttiva. La manipolazione chirurgica è stata utilizzata per studiare lo sviluppo fisiologico degli insetti sin dall'inizio del 20 ° secolo. Per determinare se il nervo cranico è regolato dalla metamorfosi degli insetti, alcuni ricercatori hanno eseguito procedure come la legatura e ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (Nos.:31772519, 31720103916; ) e da una sovvenzione aperta dello State Key Laboratory of Silkworm Genome Biology, South West University (No.: sklsgb2013003).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 75% Rubbing alcohol | Qingdao Hainuo Nuowei Disinfection Technology Co., Ltd | Q/370285HNW 001-2019 | |
| Colored Push Pins | Deli Group Co.,LTD | 0042 | |
| Corneal Scissors | Suzhou Xiehe Medical Device Co., Ltd | MR-S221A | Curved and blunt tip |
| Glad Aluminum Foil | Clorox China(Guangzhou) Limited | 831457 | 10 cm*2.5 cm*0.6 |
| Medical Cotton Swabs (Sterile) | Winner Medical Co., Ltd. | 601-022921-01 | |
| Medical Iodine Cotton Swab | Winner Medical Co., Ltd. | 608-000247 | |
| Needle holder | Shanghai Medical Instruments (Group) Ltd., Corp. | J32030 | 14 cm fine needle |
| Sterile surgical blade | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | #11 | |
| Suigical Blade Holder | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | K6-10 | Straight 3# |
| Suture thread with needle | Ningbo Medical Stitch Needle Co., Ltd | needle: 3/8 Circle, 2.5*8 ; Thread: Nylon, 6/0, 25 cm | |
| Tying Forceps | Suzhou Xiehe Medical Device Co., Ltd | MR-F201T-3 | Straight-pointed; long handle; 0.12 mm-wide-head |
Riferimenti
- Zeitlinger, J., Bohmann, D. Thorax closure in Drosophila: involvement of Fos and the JNK pathway. Development. 126 (17), 3947-3956 (1999).
- Ray, H. J., Niswander, L. Mechanisms of tissue fusion during development. Development. 139 (10), 1701-1711 (2012).
- Ducuing, A., Keeley, C., Mollereau, B., Vincent, S. A. DPP-mediated feed-forward loop canalizes morphogenesis during Drosophila dorsal closure. The Journal of Cell Biology. 208 (2), 239-248 (2015).
- Du, Q., et al. Identification and functional characterization of doublesex gene in the testis of Spodoptera litura. Insect Science. 26 (6), 1000-1010 (2019).
- Qin, H. G., Ding, J., Ye, Z. X., Huang, S. J., Luo, R. H. Dynamic analysis of experimental population of Spodoptera litura. Journal of Biosafety. 13 (2), 45-48 (2004).
- Guan, B. B., et al. The research in biology and ecology of Spodoptera litura. Journal of Biosafety. 8 (1), 57-61 (1999).
- Wen, L., et al. The testis development and spermatogenesis in Spodopture litura (lepidoptera: noctuidae). Journal of South China Normal University (Natural Science Edition. 51 (4), 47-56 (2019).
- Friedländer, M., Seth, R. K., Reynolds, S. E. Eupyrene and apyrene sperm: dichotomous spermatogenesis in Lepidoptera. Advances in Insect Physiology. 32, 206(2010).
- Cook, P. A., Wedell, N. Non-fertile sperm delay female remating. Nature. 397 (6719), 486(1999).
- Iriki, S. On the function of apyrene spermatozoa in the silk worm. Zoological Magazine. 53, 123-124 (1941).
- Liu, L., Feng, Q. L. The study of fusion of testis in Lepidoptera insects. Journal of South China Normal University (Natural Science Edition). 46 (5), 1-7 (2014).
- Klowden, M. J. Physiological systems in insects. , Elsevier/Academic Press. Amsterdam, NL; Boston, MA. (2007).
- Xu, J., et al. Transgenic characterization of two testis-specific promoters in the silkworm, Bombyx mori. Insect Molecular Biology. 24 (2), 183-190 (2015).
- Guo, X. R., Zheng, S. C., Liu, L., Feng, Q. L. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses. BioMed Central Molecular Biology. 10, 102(2009).
- Kopeć, S. Studies on the necessity of the brain for the inception of insect metamorphosis. Biological Bulletin. 42 (6), 323-342 (1922).
- Wigglesworth, V. B. Factors controlling moulting and 'metamorphosis' in an insect. Nature. 133 (5), 725-726 (1934).
- Williams, C. N. Physiology of insect diapause; the role of the brain in the production and termination of pupal dormancy in the giant silkworm, Platysamia cecropia. Biological Bulletin. 90 (3), 234-243 (1946).
- Fukuda, S. Hormonal control of molting and pupation in the silkworm. Proceedings of the Imperial Academy Tokyo. 16 (8), 417-420 (1940).
- Tian, H. J., Liu, Z. P., Bai, Y. Y. Common methods to detect Sperm quality of mammalian. Journal of Economic Zoology. 8 (4), 198-201 (2004).
- Ji, X. S., Chen, S. L., Zhao, Y., Tian, Y. S. Progress in the quality evaluation of fish sperm. Chinese Fishery Science. 14 (6), 1048-1054 (2007).
- Baulny, B. O. D., Vern, Y. L., Kerboeuf, D., Maisse, G. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology. 34 (2), 141-149 (1997).
- Krasznai, Z., Márián, T., Balkay, I., Emri, M., Trón, L. Permeabilization and structural changes in the membrane of common carp (Cyprinus carpio L.) sperm induced by hypo-osmotic shock. Aquaculture. 129 (1), 134(1995).
- Kime, D. E., et al. Computer-assisted sperm analysis (CASA) as a tool for monitoring sperm quality in fish. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp. 130 (4), 425-433 (2001).
- Rurangwa, E., Volckaert, F. A., Huyskens, G., Kime, D. E., Ollevier, F. Quality control of refrigerated and cryopreserved semen using computer-assisted sperm analysis (CASA), viable staining and standardized fertilization in African catfish (Clarias gariepinus). Theriogenology. 55 (3), 751-769 (2001).
- Seth, R. K., Kaur, J. J., Rao, D. K., Reynolds, S. E. Effects of larval exposure to sublethal concentrations of the ecdysteroid agonists RH-5849 and tebufenozide (RH-5992) on male reproductive physiology in Spodoptera litura. Journal of Insect Physiology. 50 (6), 505-517 (2004).
- Sweeney, R. M., Watterson, R. L. Rib development in chick embryos analyzed by means of tantalum foil blocks. American Journal of Anatomy. 126 (2), 127-149 (1969).
- Wilde, S., Logan, M. P. Application of impermeable barriers combined with candidate factor soaked beads to study inductive signals in the chick. Journal of Visualized Experiments. (117), e54618(2016).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon