Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Spodoptera litura'da Testislerin Füzyonunun Mikrocerrahi Obstrüksiyonu
Bu Makalede
Özet
Alüminyum folyo, testisin füzyonunu engellemek için Spodoptera litura'nın testisleri arasına mikrocerrahi olarak yerleştirildi. Prosedür dondurma, sabitleme, dezenfeksiyon, insizyon, bariyerin yerleştirilmesi, dikiş, ameliyat sonrası beslenme ve muayeneyi içerir. Bu yaklaşım, doku oluşumuna müdahale etmek için bir yöntem sağlar.
Özet
RNA girişimi (RNAi) gibi genetik yöntemler kullanmak ve düzenli olarak kümelenmiş kısa palindromik tekrarlar (CRISPR) / CRISPR ile ilişkili endonükleaz Cas9 yerine, bu mikrocerrahinin büyümesi ve üremesi üzerindeki etkisini incelemek için Spodoptera litura'nın testisleri arasına mikrocerrahi olarak fiziksel bir bariyer yerleştirildi. Testisler arasına alüminyum folyo yerleştirildikten sonra, metamorfoz sırasında böcek erimesi normal şekilde ilerledi. Böceklerin büyümesi ve gelişmesi dikkat çekici bir şekilde değişmedi; Bununla birlikte, testislerin füzyonu mikrocerrahi ile durdurulursa sperm demetlerinin sayısı değişti. Bu bulgular, testis füzyonunun bloke edilmesinin erkek üreme yeteneğini etkileyebileceğini düşündürmektedir. Yöntem, belirli sinyal yollarının işlevini incelemek için organlar arasındaki iletişimi kesmek için daha fazla uygulanabilir. Geleneksel cerrahiye kıyasla, mikrocerrahi sadece karbondioksit anestezisine tercih edilen dondurucu anestezi gerektirir. Mikrocerrahi ayrıca ameliyat bölgesini en aza indirir ve yara iyileşmesini kolaylaştırır. Bununla birlikte, belirli işlevlere sahip malzemelerin seçimi daha fazla araştırmaya ihtiyaç duymaktadır. Ameliyat sırasında kesi yaparken doku hasarından kaçınmak çok önemlidir.
Giriş
Füzyon, doku veya organ gelişiminde yaygın bir olgudur. Örnekler arasında Drosophila1'da dorsal kapanma ve toraks kapanması ve damak morfogenezi, nöral tüp morfogenezi ve farelerde ve tavukta kalp morfogenezi2 sayılabilir. CRISPR ve RNAi, genlerin füzyon sürecindeki rollerini araştırmak için uygulanmıştır2,3,4.
Spodoptera litura (S. litura, Lepidoptera: Noctuidae), Çin de dahil olmak üzere Asya'nın tropikal ve subtropikal bölgelerinde yaygın olarak dağılmış zararlı bir polifagot zararlıdır4,5,6. S. litura'nın geniş dağılımı kısmen gonad gelişimi ile ilgili olan güçlü üreme kabiliyetine atfedilir. Erkek kısırlığı, bu zararlıyı kontrol etmek için bir yaklaşımdır. Testis yapısının şematik şeklinde gösterildiği gibi, testisler dış kılıf (periton kılıfı) ve iç bazal lamina dahil olmak üzere testis kılıfı ile kapatılır. Bazal lamina, foliküler epiteli oluşturmak için dahili olarak uzanır ve testisin iç alanını folikül adı verilen dört odaya ayırır (Şekil 1).
Foliküllerde, spermatogonia, mitoz ve mayozdan sonra spermatozoaya dönüşür ve daha sonra sperm keselerindeki spermatozoa, sperm demetleri oluşturmak için aynı yönde hizalanır7. Spermatogenez sırasında, birincil spermatositler öpiren spermlerine veya apiren spermlerine farklılaşır. Larva fazındaki spermatositler, uzun bir çekirdeğin başına bağlı uzun bir kuyrukla öpiren spermine dönüşür; bunlar yumurtaları dölleyebilir. Tersine, orta pupa fazındaki spermatositler, atılmış bir çekirdeğe sahip apyrene spermine dönüşür; bu spermler öpiren sperminin hayatta kalmasına, hareketine ve döllenmesine yardımcı olur9,10. Pupa'nın 6. günü, testislerin bol miktarda öpiren ve apiren sperm demetlerine sahip olduğu dönemdir.
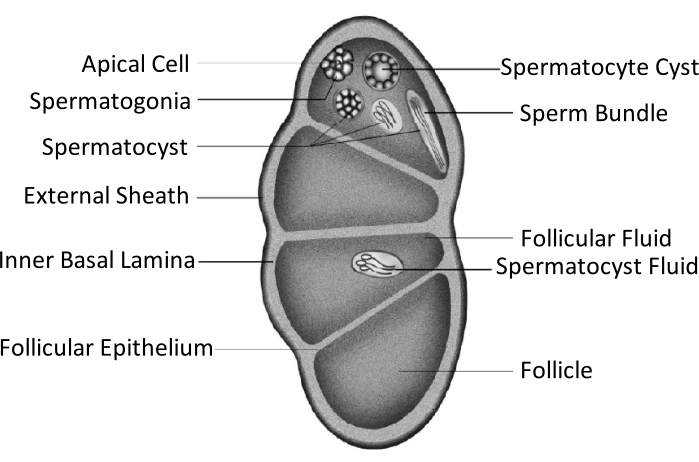
Şekil 1: Lepidoptera böceklerinin testis yapısının şematik diyagramı11. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Testis füzyonu, Lepidoptera düzeninin çoğu böceğinde11,12, özellikle tarımsal zararlılar olan türlerde görülür. Testis füzyonu, larva fazında iki taraflı olarak büyüyen, birbirine yaklaşan ve yapışan, sonunda tek bir gonad11 içine entegre olan bir çift testisi ifade eder. Spodoptera litura'da, larvadan pupa aşamasına metamorfoz sırasında meydana gelir. 5. instarın (L5D1) 1. gününden 6. instarın (L6D4) 4. gününe kadar, testis çifti yavaş yavaş büyür ve renk fildişi beyazından açık sarıya döner. Prepupa faza ulaştıkça soluk kırmızı olur (L6D5 ila L6D6). İki bilateral simetrik testis, prepupa aşamasında birbirine yaklaşır, bir araya gelir ve pupa ve yetişkin fazlarında tek bir testis üretmek için saat yönünün tersine (doral görünüm) bükülür11. Bu fenomen, önemli ekonomik öneme sahip olan ve 5000 yıldır evcilleştirilen ipekböceklerinde meydana gelmez13. Bu nedenle, testislerin füzyonunun üreme yeteneğini arttırdığı varsayılmaktadır.
Spodoptera litura testis füzyonunun önemini belirlemek için, süreci bloke etmenin etkilerini araştırmak önemlidir. Bu protokolde, alüminyum folyo, testislerin arasına mikrocerrahi olarak yerleştirilerek ayrı tutuldu ve bunun sonucunda böceklerin ve testislerinin gelişimindeki değişiklikler incelendi.
Protokol
1. Böcek yetiştiriciliği ve bakımı
- Spodoptera litura larvalarını çevresel simülasyon odalarında 6. instarın (L6D4) 4. gününe ulaşana kadar yapay bir diyetle kültürleyin. Solucanlar 6. instarın (L6D0) ilk gününe sekizinci karın bölgesindeki ters üçgen şeklindeki yapıya dayanarak girdiğinde erkek larvaları seçin14.
NOT: Larva yetiştirme ve bakım teknikleri daha önce yayınlanmıştı4,14.
2. Ameliyat öncesi hazırlık
- Alüminyum folyoyu köşeleri yuvarlatılmış dikdörtgen parçalar halinde kesin (1 mm x 2 mm, Şekil 2).
- Ameliyat platformunu ve ilgili öğeleri (masa yüzeyi, mikroskop, buz kutusu, böcek kutusu, balmumu tepsisi, pimler ve iplik) yüzeylerine %75 alkol püskürterek ve silerek sterilize edin.
- Cerrahi aletleri (alüminyum folyo dahil) 30 dakika boyunca yüksek basınçlı buharlı sterilizatör ile sterilize edin ve 120 ° C'de bir ısıtma ve kurutma fırınına yerleştirin.
- Operatörlerin temiz laboratuvar kıyafetleri, cerrahi maskeler ve steril eldivenler giydiğinden emin olun.
3. Testisler arasına bir bariyerin mikrocerrahi olarak yerleştirilmesi
NOT: Genel iş akışı aşağıdaki gibidir: Donma → Sabitleme → Dezenfeksiyon → Kesi → Bariyer Yerleştirme → Dikiş→ Ameliyat Sonrası Beslenme ve Muayene
- Erkek larvaları (L6D4) operasyon sırasında anestezi altında tutmak için 10-30 dakika boyunca buz üzerine yerleştirin.
- Balmumu tepsisine sırt tarafı yukarı bakacak şekilde bir larva yerleştirin ve ardından larvaların başını ve kuyruğunu iğneler ve ipliklerle sabitleyerek 9. vücut segmentindeki dorsal yüzey olan cerrahi alanı gösterin (Şekil 3A).
- Epidermise (9. vücut segmenti) pamuklu çubukla %3 iyot tentürü uygulayarak cerrahi bölgeyi dezenfekte edin, ardından iyotu çıkarmak için %70 alkol uygulayın (Şekil 3B).
NOT: Cerrahi mikroskobun kaba ve ince ayarlanmasıyla larvaya odaklanın (Şekil 3C). Balmumu tepsisini anesteziyi korumak için buzla dolu daha büyük bir kültür kabına yerleştirin. - 9. vücut segmentinin dorsal epidermisi üzerinde 2 mm uzunluğunda bir kesi yapın. Daha sonra, sızan hemolenf ve yağ cisimciklerini çıkarmak ve cerrahi alanın net bir görünümünü elde etmek için steril bir pamuklu çubuk kullanın.
NOT: İşlem sırasında kalpten kaçınmak önemlidir. Bu, testislerin larva iç basıncı nedeniyle dışarı çıkmasını önlemek için 9. vücut segmentindeki orta çizginin biraz yanında veya 9. ve 10. vücut segmentleri arasındaki eklemde kesi yaparak yapılabilir. Neşteri kullanırken, önce bıçakla dikey bir yarık yapın (Şekil 4A) ve daha sonra epidermisi eşit ve sürekli olarak kesmeden önce epidermise doğru 45 ° çevirin (Şekil 4B). - Testislerin arasına bir parça alüminyum folyo yerleştirmek için cerrahi cımbız kullanın (Şekil 5).
- Ameliyatın sonunda, enfeksiyondan kaçınmak için kesiyi kapatın ve larvaların ameliyattan iyileşmesine izin verin.
- Epidermisi akan bir dikişle kapatın (Şekil 6).
- İki karşıt ayna görüntüsü basit düğüm gerektiren cerrahi kare düğümü bağlamak için bir iğne tutucu ve cerrahi cımbız kullanın (Şekil 6D, E).
- Fazla dikişi ilmek kuyruklarından kesmek için makas kullanın ve geride 2 mm'lik bir iplik bırakın.
- Dikişten sonra, larvaları yetiştirme kutusuna yavaşça yerleştirin ve temiz bir çevresel simülasyon odasında tutun. Larvaları gözlemlemeye devam edin.
NOT: Yara hemolenf sızıntısını durdurur ve larvalar ameliyattan sonra yavaş yavaş iyileşir. Solucanlar metamorfozlarını tamamlamaya devam ediyor.

Resim 2: Alüminyum folyo kullanılarak hazırlanan fiziksel bariyer (1 mm x 2 mm). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
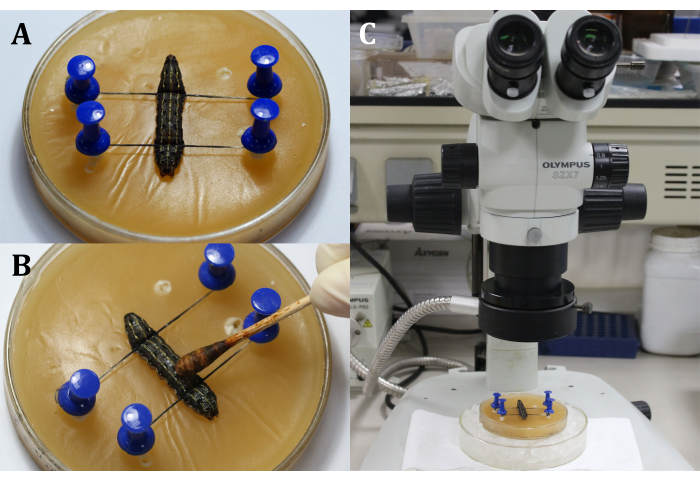
Şekil 3: Kesiden önce. (A) Larvaların sabitlenmesi. (B) Cerrahi bölgenin epidermisinin dezenfeksiyonu. (C) Mikroskop altında ameliyat yapmak. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
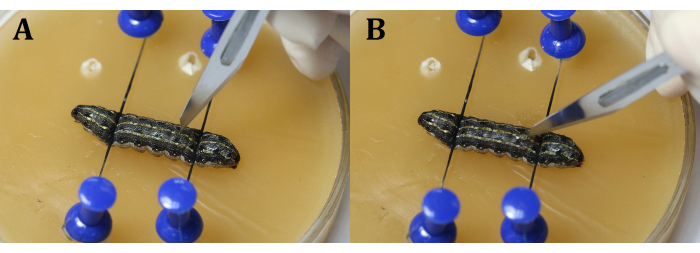
Şekil 4: Kesiyon . (A) Larvaları bıçakla dikey olarak yarıklayın. (B) Kesmeden önce bıçağı 45° epidermise doğru çevirin. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5: Testislerin arasına fiziksel bariyerin (alüminyum folyo) yerleştirilmesi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 6: Dikiş . (A) İğneyi takın. (B) İğneyi geri çekin. (C) İğneyi geri çekin ve kelepçeleyin. (D) İlk basit düğümü bağlayın. (E) Karşıt ayna görüntüsündeki basit düğümü bağlayın. (F) Fazla dikiş ipliğini kesin. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Mikrocerrahinin Spodoptera litura büyümesi ve gelişimi üzerindeki etkileri
Mikrocerrahi, dorsal larva epidermisinde 2 mm uzunluğunda bir yara bıraktı ve sonunda hemolenf sızıntısını durdurdu ve iyileşti. Larvalar prepupal ve pupa aşamalarından geçti ve mikrocerrahinin büyüme ve gelişme üzerinde büyük bir etkisi olmadığını gösteren kapalı kaldı. Larvalar pupaya eridiğinde, dikiş iplikleri epidermis ile birlikte atıldı. Ameliyat...
Tartışmalar
Spodoptera litura'da testislerin füzyonunu mikrocerrahi olarak engelledikten sonra, sperm demetlerinin sayısı azaldı ve bu da bu füzyonun üreme yeteneğine faydalı olduğu hipotezini destekledi. Cerrahi manipülasyon, 20. yüzyılın başlarından beri böceklerin fizyolojik gelişimini incelemek için kullanılmıştır. Kraniyal sinirin böcek metamorfozu tarafından düzenlenip düzenlenmediğini belirlemek için, bazı araştırmacılar farklı böcekler üzerinde ligasyon ve dekapitasyon g...
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (No.:31772519, 31720103916; ) ve Güney Batı Üniversitesi İpekböceği Genom Biyolojisi Devlet Anahtar Laboratuvarı'ndan (No.: sklsgb2013003) açık bir hibe ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 75% Rubbing alcohol | Qingdao Hainuo Nuowei Disinfection Technology Co., Ltd | Q/370285HNW 001-2019 | |
| Colored Push Pins | Deli Group Co.,LTD | 0042 | |
| Corneal Scissors | Suzhou Xiehe Medical Device Co., Ltd | MR-S221A | Curved and blunt tip |
| Glad Aluminum Foil | Clorox China(Guangzhou) Limited | 831457 | 10 cm*2.5 cm*0.6 |
| Medical Cotton Swabs (Sterile) | Winner Medical Co., Ltd. | 601-022921-01 | |
| Medical Iodine Cotton Swab | Winner Medical Co., Ltd. | 608-000247 | |
| Needle holder | Shanghai Medical Instruments (Group) Ltd., Corp. | J32030 | 14 cm fine needle |
| Sterile surgical blade | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | #11 | |
| Suigical Blade Holder | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | K6-10 | Straight 3# |
| Suture thread with needle | Ningbo Medical Stitch Needle Co., Ltd | needle: 3/8 Circle, 2.5*8 ; Thread: Nylon, 6/0, 25 cm | |
| Tying Forceps | Suzhou Xiehe Medical Device Co., Ltd | MR-F201T-3 | Straight-pointed; long handle; 0.12 mm-wide-head |
Referanslar
- Zeitlinger, J., Bohmann, D. Thorax closure in Drosophila: involvement of Fos and the JNK pathway. Development. 126 (17), 3947-3956 (1999).
- Ray, H. J., Niswander, L. Mechanisms of tissue fusion during development. Development. 139 (10), 1701-1711 (2012).
- Ducuing, A., Keeley, C., Mollereau, B., Vincent, S. A. DPP-mediated feed-forward loop canalizes morphogenesis during Drosophila dorsal closure. The Journal of Cell Biology. 208 (2), 239-248 (2015).
- Du, Q., et al. Identification and functional characterization of doublesex gene in the testis of Spodoptera litura. Insect Science. 26 (6), 1000-1010 (2019).
- Qin, H. G., Ding, J., Ye, Z. X., Huang, S. J., Luo, R. H. Dynamic analysis of experimental population of Spodoptera litura. Journal of Biosafety. 13 (2), 45-48 (2004).
- Guan, B. B., et al. The research in biology and ecology of Spodoptera litura. Journal of Biosafety. 8 (1), 57-61 (1999).
- Wen, L., et al. The testis development and spermatogenesis in Spodopture litura (lepidoptera: noctuidae). Journal of South China Normal University (Natural Science Edition. 51 (4), 47-56 (2019).
- Friedländer, M., Seth, R. K., Reynolds, S. E. Eupyrene and apyrene sperm: dichotomous spermatogenesis in Lepidoptera. Advances in Insect Physiology. 32, 206 (2010).
- Cook, P. A., Wedell, N. Non-fertile sperm delay female remating. Nature. 397 (6719), 486 (1999).
- Iriki, S. On the function of apyrene spermatozoa in the silk worm. Zoological Magazine. 53, 123-124 (1941).
- Liu, L., Feng, Q. L. The study of fusion of testis in Lepidoptera insects. Journal of South China Normal University (Natural Science Edition). 46 (5), 1-7 (2014).
- Klowden, M. J. . Physiological systems in insects. , (2007).
- Xu, J., et al. Transgenic characterization of two testis-specific promoters in the silkworm, Bombyx mori. Insect Molecular Biology. 24 (2), 183-190 (2015).
- Guo, X. R., Zheng, S. C., Liu, L., Feng, Q. L. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses. BioMed Central Molecular Biology. 10, 102 (2009).
- Kopeć, S. Studies on the necessity of the brain for the inception of insect metamorphosis. Biological Bulletin. 42 (6), 323-342 (1922).
- Wigglesworth, V. B. Factors controlling moulting and 'metamorphosis' in an insect. Nature. 133 (5), 725-726 (1934).
- Williams, C. N. Physiology of insect diapause; the role of the brain in the production and termination of pupal dormancy in the giant silkworm, Platysamia cecropia. Biological Bulletin. 90 (3), 234-243 (1946).
- Fukuda, S. Hormonal control of molting and pupation in the silkworm. Proceedings of the Imperial Academy Tokyo. 16 (8), 417-420 (1940).
- Tian, H. J., Liu, Z. P., Bai, Y. Y. Common methods to detect Sperm quality of mammalian. Journal of Economic Zoology. 8 (4), 198-201 (2004).
- Ji, X. S., Chen, S. L., Zhao, Y., Tian, Y. S. Progress in the quality evaluation of fish sperm. Chinese Fishery Science. 14 (6), 1048-1054 (2007).
- Baulny, B. O. D., Vern, Y. L., Kerboeuf, D., Maisse, G. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology. 34 (2), 141-149 (1997).
- Krasznai, Z., Márián, T., Balkay, I., Emri, M., Trón, L. Permeabilization and structural changes in the membrane of common carp (Cyprinus carpio L.) sperm induced by hypo-osmotic shock. Aquaculture. 129 (1), 134 (1995).
- Kime, D. E., et al. Computer-assisted sperm analysis (CASA) as a tool for monitoring sperm quality in fish. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp. 130 (4), 425-433 (2001).
- Rurangwa, E., Volckaert, F. A., Huyskens, G., Kime, D. E., Ollevier, F. Quality control of refrigerated and cryopreserved semen using computer-assisted sperm analysis (CASA), viable staining and standardized fertilization in African catfish (Clarias gariepinus). Theriogenology. 55 (3), 751-769 (2001).
- Seth, R. K., Kaur, J. J., Rao, D. K., Reynolds, S. E. Effects of larval exposure to sublethal concentrations of the ecdysteroid agonists RH-5849 and tebufenozide (RH-5992) on male reproductive physiology in Spodoptera litura. Journal of Insect Physiology. 50 (6), 505-517 (2004).
- Sweeney, R. M., Watterson, R. L. Rib development in chick embryos analyzed by means of tantalum foil blocks. American Journal of Anatomy. 126 (2), 127-149 (1969).
- Wilde, S., Logan, M. P. Application of impermeable barriers combined with candidate factor soaked beads to study inductive signals in the chick. Journal of Visualized Experiments. (117), e54618 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır