Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микрохирургическая обструкция слияния яичек в Spodoptera litura
В этой статье
Резюме
Алюминиевая фольга была микрохирургически вставлена между яичками Spodoptera litura , чтобы препятствовать слиянию яичек. Процедура включает в себя замораживание, фиксацию, дезинфекцию, разрез, установку барьера, наложение швов, послеоперационное кормление, осмотр. Такой подход предусматривает метод вмешательства в образование тканей.
Аннотация
Вместо использования генетических методов, таких как РНК-интерференция (РНКи) и кластеризованные регулярно интерраспространенные короткие палиндромные повторы (CRISPR)/CRISPR-ассоциированная эндонуклеаза Cas9, между яичками Spodoptera litura был микрохирургически вставлен физический барьер для изучения влияния этой микрохирургии на ее рост и размножение. После введения алюминиевой фольги между яичками линька насекомых во время метаморфоз протекала нормально. Рост и развитие насекомых не претерпели значительных изменений; однако количество пучков сперматозоидов изменялось, если слияние яичек было остановлено микрохирургией. Эти результаты подразумевают, что блокирование слияния яичек может влиять на способность мужчин к размножению. Метод может быть дополнительно применен для прерывания связи между органами для изучения функции конкретных сигнальных путей. По сравнению с обычной хирургией, микрохирургия требует только замораживания анестезии, которая предпочтительнее обезболивания углекислым газом. Микрохирургия также минимизирует область места операции и способствует заживлению ран. Однако подбор материалов с конкретными функциями требует дальнейшего изучения. Предотвращение повреждения тканей имеет решающее значение при создании разрезов во время операции.
Введение
Слияние является распространенным явлением в развитии тканей или органов. Примеры включают закрытие спины и закрытие грудной клетки у Drosophila1 и морфогенез неба, морфогенез нервной трубки и морфогенез сердца у мышей и кур2. CRISPR и RNAi были применены для исследования роли генов в процессе слияния2,3,4.
Spodoptera litura (S. litura, Lepidoptera: Noctuidae) — вредный полифаговой вредитель, широко распространённый в тропических и субтропических районах Азии, включая Китай4,5,6. Широкое распространение S. litura отчасти объясняется его мощной репродуктивной способностью, которая имеет отношение к развитию половых желез. Мужское бесплодие является одним из подходов к борьбе с этим вредителем. Как показано на схематичном рисунке строения яичек, яички заключены оболочкой яичка, включая наружную оболочку (перитонеальную оболочку) и внутреннюю базальную пластинку. Базальная пластинка простирается внутрь, образуя фолликулярный эпителий и разделяет внутреннюю область яичка на четыре камеры, называемые фолликулами (рисунок 1).
В фолликулах сперматогония развивается в сперматозоиды после митоза и мейоза, а затем сперматозоиды в сперматозоидных мешочках выравниваются в том же направлении, образуя пучки сперматозоидов7. Во время сперматогенеза первичные сперматоциты дифференцируются в эвпиреновые сперматозоиды или апиреновые сперматозоиды. Сперматоциты в личиночной фазе развиваются в эвпиреновые сперматозоиды с длинным хвостом, соединенным с головкой вытянутого ядра; они могут оплодотворить яйцеклетки. И наоборот, сперматоциты в середине куколочной фазы развиваются в апиреновые сперматозоиды с выброшенным ядром; эти сперматозоиды способствуют выживанию, движению и оплодотворению сперматозоидов эвпирена9,10. 6-й день куколки – это период, в течение которого яички имеют обильные пучки сперматозоидов эвпирена и апирена.
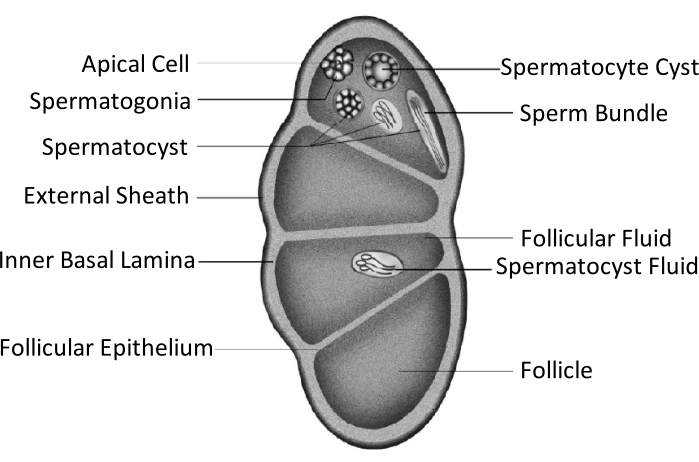
Рисунок 1: Принципиальная схема яичковой структуры чешуекрылых насекомых11. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Слияние яичек происходит у большинства насекомых отряда чешуекрылых11,12, особенно у тех видов, которые являются сельскохозяйственными вредителями. Слияние яичек относится к паре яичек, растущих двусторонне в личиночной фазе, приближающихся и прилипающих друг к другу, в конечном итоге интегрирующихся в единую гонаду11. У Spodoptera litura это происходит во время метаморфозы из личиночной в куколочную стадию. С 1-го дня 5-й звезды (L5D1) по 4-й день 6-й звезды (L6D4) пара яичек постепенно увеличивается в размерах, и цвет становится светло-желтым из слоновой кости-белого. Он становится слабым красным, когда достигает препупальной фазы (от L6D5 до L6D6). Два двусторонних симметричных яичка приближаются друг к другу во время стадии препупальности, сливаются в одну и скручиваются против часовой стрелки (доральный вид), чтобы получить одно яичко в фазе куколки и взрослой особи11. Это явление не встречается у шелкопрядов, которые имеют немалое экономическое значение и были одомашнены в течение 5000 лет13. Таким образом, предполагается, что сращение яичек улучшает репродуктивную способность.
Чтобы определить значимость слияния яичек Spodoptera litura , важно исследовать эффекты блокирования процесса. В этом протоколе алюминиевая фольга была микрохирургически вставлена между яичками, чтобы держать их разделенными, и были изучены последующие изменения в развитии насекомых и их яичек.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Выращивание и уход за насекомыми
- Культивируйте личинок Spodoptera litura в камерах моделирования окружающей среды с искусственной диетой, пока они не достигнут 4-го дня 6-й звезды (L6D4). Выбирайте личинок самцов, когда черви входят в первый день 6-й звезды (L6D0) на основе обратной треугольной структуры на восьмом брюшке14.
ПРИМЕЧАНИЕ: Методы выращивания и содержания личинок были опубликованы ранее4,14.
2. Предоперационная подготовка
- Обрежьте алюминиевую фольгу прямоугольными частями с закругленными углами (1 мм х 2 мм, рисунок 2).
- Стерилизуйте хирургическую платформу и связанные с ней предметы (поверхность стола, микроскоп, ледяной ящик, ящик для насекомых, восковой лоток, булавки и нити), распыляя 75% спирта на их поверхность и протирая их.
- Стерилизуйте хирургические инструменты (в том числе алюминиевую фольгу) паровым стерилизатором высокого давления в течение 30 минут и поместите их в нагревательную и сушильную печь при 120 °C.
- Убедитесь, что операторы носят чистую лабораторную одежду, хирургические маски и стерильные перчатки.
3. Микрохирургическое размещение барьера между яичками
ПРИМЕЧАНИЕ: Общий рабочий процесс выглядит следующим образом: замораживание → фиксация → дезинфекция → разрез → установка барьера → наложение швов→ послеоперационное кормление и инспекция
- Поместите личинок самцов (L6D4) на лед на 10-30 минут, чтобы они были обезболены во время операции.
- Поместите личинку на восковой лоток спинной стороной вверх, а затем зафиксируйте голову и хвост личинки булавками и нитями, показывая хирургическую область, которая является дорсальной поверхностью на 9-м сегменте тела (рисунок 3А).
- Продезинфицируйте хирургическую область, нанеся 3% настойку йода ватным тампоном на эпидермис (9-й сегмент тела), а затем 70% спирт для удаления йода (рисунок 3B).
ПРИМЕЧАНИЕ: Сосредоточьтесь на личинке с помощью грубой и тонкой регулировки хирургического микроскопа (рисунок 3C). Поместите восковой лоток на большую культурную посуду, наполненную льдом, чтобы сохранить анестезию. - Сделайте разрез длиной 2 мм на спинном эпидермисе 9-го сегмента тела. Затем используйте стерильный ватный тампон, чтобы удалить любые протекающие гемолимфы и жировые тела и получить четкое представление о хирургической области.
ПРИМЕЧАНИЕ: Важно избегать сердца во время процедуры. Это можно сделать, сделав разрез немного рядом со средней линией в 9-м сегменте тела или в суставе между 9-м и 10-м сегментами тела, чтобы предотвратить выскакивание яичек из-за внутреннего давления личинок. Используя скальпель, сначала сделайте вертикальную щель лезвием (рисунок 4A), а затем поверните его на 45° к эпидермису, прежде чем равномерно и непрерывно разрезать эпидермис (рисунок 4B). - Используйте хирургический пинцет, чтобы вставить кусок алюминиевой фольги между яичками (рисунок 5).
- В конце операции закройте разрез, чтобы избежать инфекции, и позвольте личинкам восстановиться после операции.
- Закройте эпидермис бегущим швом (рисунок 6).
- Используйте держатель иглы и хирургический пинцет, чтобы связать хирургический квадратный узел, требующий двух противоположных зеркальных простых узлов (рисунок 6D, E).
- Используйте ножницы, чтобы отрезать лишний шов от хвостов петли, оставив позади нить 2 мм.
- После наложения швов аккуратно укладывайте личинки в ящик для выращивания и храните их в чистой камере моделирования окружающей среды. Продолжайте наблюдать за личинками.
ПРИМЕЧАНИЕ: В рану перестает протекать гемолимфа, и личинки постепенно восстанавливаются после операции. Черви продолжают завершать свои метаморфозы.

Рисунок 2: Физический барьер, подготовленный с использованием алюминиевой фольги (1 мм x 2 мм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
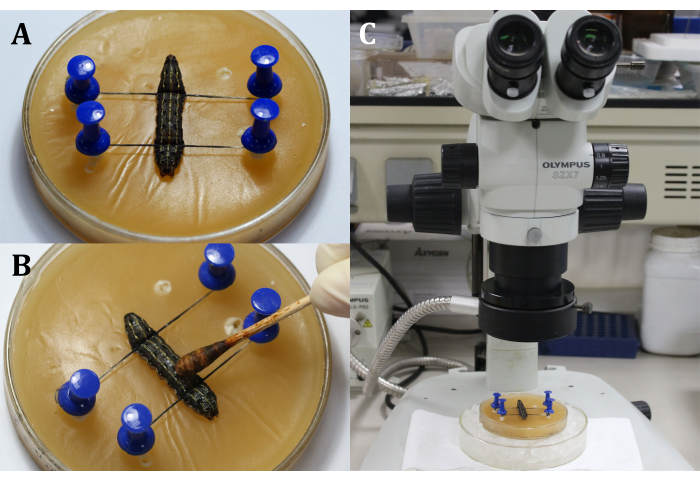
Рисунок 3: Перед разрезом. (A) Фиксация личинки. (B) Дезинфекция эпидермиса хирургической области. (С) Выполнение операции под микроскопом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
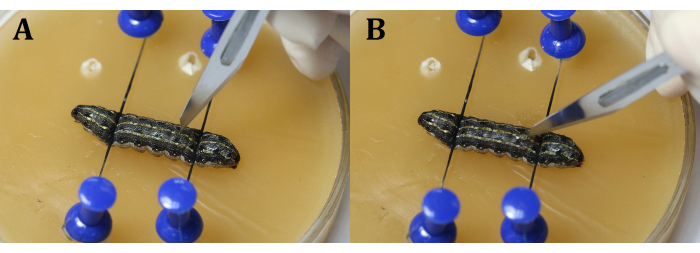
Рисунок 4: Разрез. (А) Разрезайте личинок вертикально лезвием. (B) Поверните лезвие на 45° в сторону эпидермиса перед разрезанием. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Установка физического барьера (алюминиевой фольги) между яичками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Наложение швов. (А) Вставьте иглу. (B) Извлеките иглу. (C) Отнимите и зажмите иглу. (D) Завяжите первый простой узел. (E) Завяжите противоположный зеркальный простой узел. (F) Отрежьте лишнюю шовную нить. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
Результаты
Влияние микрохирургии на рост и развитие Spodoptera litura
Микрохирургия оставила рану длиной 2 мм на дорсальном личиночном эпидермисе, которая в конечном итоге перестала протекать гемолимфой и зажила. Личинки прошли препупальную и куколочную стадии и эклоз?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
После микрохирургического препятствования слиянию яичек в Spodoptera litura количество пучков сперматозоидов уменьшилось, что подтвердило гипотезу о том, что это слияние полезно для репродуктивной способности. Хирургические манипуляции используются для изучения физиологического разв...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (Nos.:31772519, 31720103916; ) и открытым грантом от Государственной ключевой лаборатории биологии генома шелкопряда Юго-Западного университета (No: sklsgb2013003).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 75% Rubbing alcohol | Qingdao Hainuo Nuowei Disinfection Technology Co., Ltd | Q/370285HNW 001-2019 | |
| Colored Push Pins | Deli Group Co.,LTD | 0042 | |
| Corneal Scissors | Suzhou Xiehe Medical Device Co., Ltd | MR-S221A | Curved and blunt tip |
| Glad Aluminum Foil | Clorox China(Guangzhou) Limited | 831457 | 10 cm*2.5 cm*0.6 |
| Medical Cotton Swabs (Sterile) | Winner Medical Co., Ltd. | 601-022921-01 | |
| Medical Iodine Cotton Swab | Winner Medical Co., Ltd. | 608-000247 | |
| Needle holder | Shanghai Medical Instruments (Group) Ltd., Corp. | J32030 | 14 cm fine needle |
| Sterile surgical blade | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | #11 | |
| Suigical Blade Holder | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | K6-10 | Straight 3# |
| Suture thread with needle | Ningbo Medical Stitch Needle Co., Ltd | needle: 3/8 Circle, 2.5*8 ; Thread: Nylon, 6/0, 25 cm | |
| Tying Forceps | Suzhou Xiehe Medical Device Co., Ltd | MR-F201T-3 | Straight-pointed; long handle; 0.12 mm-wide-head |
Ссылки
- Zeitlinger, J., Bohmann, D. Thorax closure in Drosophila: involvement of Fos and the JNK pathway. Development. 126 (17), 3947-3956 (1999).
- Ray, H. J., Niswander, L. Mechanisms of tissue fusion during development. Development. 139 (10), 1701-1711 (2012).
- Ducuing, A., Keeley, C., Mollereau, B., Vincent, S. A. DPP-mediated feed-forward loop canalizes morphogenesis during Drosophila dorsal closure. The Journal of Cell Biology. 208 (2), 239-248 (2015).
- Du, Q., et al. Identification and functional characterization of doublesex gene in the testis of Spodoptera litura. Insect Science. 26 (6), 1000-1010 (2019).
- Qin, H. G., Ding, J., Ye, Z. X., Huang, S. J., Luo, R. H. Dynamic analysis of experimental population of Spodoptera litura. Journal of Biosafety. 13 (2), 45-48 (2004).
- Guan, B. B., et al. The research in biology and ecology of Spodoptera litura. Journal of Biosafety. 8 (1), 57-61 (1999).
- Wen, L., et al. The testis development and spermatogenesis in Spodopture litura (lepidoptera: noctuidae). Journal of South China Normal University (Natural Science Edition. 51 (4), 47-56 (2019).
- Friedländer, M., Seth, R. K., Reynolds, S. E. Eupyrene and apyrene sperm: dichotomous spermatogenesis in Lepidoptera. Advances in Insect Physiology. 32, 206(2010).
- Cook, P. A., Wedell, N. Non-fertile sperm delay female remating. Nature. 397 (6719), 486(1999).
- Iriki, S. On the function of apyrene spermatozoa in the silk worm. Zoological Magazine. 53, 123-124 (1941).
- Liu, L., Feng, Q. L. The study of fusion of testis in Lepidoptera insects. Journal of South China Normal University (Natural Science Edition). 46 (5), 1-7 (2014).
- Klowden, M. J. Physiological systems in insects. , Elsevier/Academic Press. Amsterdam, NL; Boston, MA. (2007).
- Xu, J., et al. Transgenic characterization of two testis-specific promoters in the silkworm, Bombyx mori. Insect Molecular Biology. 24 (2), 183-190 (2015).
- Guo, X. R., Zheng, S. C., Liu, L., Feng, Q. L. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses. BioMed Central Molecular Biology. 10, 102(2009).
- Kopeć, S. Studies on the necessity of the brain for the inception of insect metamorphosis. Biological Bulletin. 42 (6), 323-342 (1922).
- Wigglesworth, V. B. Factors controlling moulting and 'metamorphosis' in an insect. Nature. 133 (5), 725-726 (1934).
- Williams, C. N. Physiology of insect diapause; the role of the brain in the production and termination of pupal dormancy in the giant silkworm, Platysamia cecropia. Biological Bulletin. 90 (3), 234-243 (1946).
- Fukuda, S. Hormonal control of molting and pupation in the silkworm. Proceedings of the Imperial Academy Tokyo. 16 (8), 417-420 (1940).
- Tian, H. J., Liu, Z. P., Bai, Y. Y. Common methods to detect Sperm quality of mammalian. Journal of Economic Zoology. 8 (4), 198-201 (2004).
- Ji, X. S., Chen, S. L., Zhao, Y., Tian, Y. S. Progress in the quality evaluation of fish sperm. Chinese Fishery Science. 14 (6), 1048-1054 (2007).
- Baulny, B. O. D., Vern, Y. L., Kerboeuf, D., Maisse, G. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology. 34 (2), 141-149 (1997).
- Krasznai, Z., Márián, T., Balkay, I., Emri, M., Trón, L. Permeabilization and structural changes in the membrane of common carp (Cyprinus carpio L.) sperm induced by hypo-osmotic shock. Aquaculture. 129 (1), 134(1995).
- Kime, D. E., et al. Computer-assisted sperm analysis (CASA) as a tool for monitoring sperm quality in fish. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp. 130 (4), 425-433 (2001).
- Rurangwa, E., Volckaert, F. A., Huyskens, G., Kime, D. E., Ollevier, F. Quality control of refrigerated and cryopreserved semen using computer-assisted sperm analysis (CASA), viable staining and standardized fertilization in African catfish (Clarias gariepinus). Theriogenology. 55 (3), 751-769 (2001).
- Seth, R. K., Kaur, J. J., Rao, D. K., Reynolds, S. E. Effects of larval exposure to sublethal concentrations of the ecdysteroid agonists RH-5849 and tebufenozide (RH-5992) on male reproductive physiology in Spodoptera litura. Journal of Insect Physiology. 50 (6), 505-517 (2004).
- Sweeney, R. M., Watterson, R. L. Rib development in chick embryos analyzed by means of tantalum foil blocks. American Journal of Anatomy. 126 (2), 127-149 (1969).
- Wilde, S., Logan, M. P. Application of impermeable barriers combined with candidate factor soaked beads to study inductive signals in the chick. Journal of Visualized Experiments. (117), e54618(2016).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены