Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Obstrucción microquirúrgica de la fusión de testículos en Spodoptera litura
En este artículo
Resumen
El papel de aluminio se insertó microquirúrgicamente entre los testículos de Spodoptera litura para obstruir la fusión de los testículos. El procedimiento incluye congelación, fijación, desinfección, incisión, colocación de la barrera, sutura, alimentación postoperatoria e inspección. Este enfoque proporciona un método para interferir con la formación de tejidos.
Resumen
En lugar de utilizar métodos genéticos como la interferencia de ARN (RNAi) y las repeticiones palindrómicas cortas agrupadas regularmente interespaciadas (CRISPR) / endonucleasa asociadas a CRISPR Cas9, se insertó microquirúrgicamente una barrera física entre los testículos de Spodoptera litura para estudiar el impacto de esta microcirugía en su crecimiento y reproducción. Después de insertar papel de aluminio entre los testículos, la muda de insectos durante la metamorfosis procedió normalmente. El crecimiento y desarrollo de los insectos no se alteraron notablemente; sin embargo, el número de haces de espermatozoides cambió si la microcirugía detuvo la fusión de los testículos. Estos hallazgos implican que el bloqueo de la fusión testicular puede influir en la capacidad de reproducción masculina. El método se puede aplicar además para interrumpir la comunicación entre órganos para estudiar la función de vías de señalización específicas. En comparación con la cirugía convencional, la microcirugía solo requiere anestesia por congelación, que es preferible a la anestesia con dióxido de carbono. La microcirugía también minimiza el área del sitio de la cirugía y facilita la cicatrización de heridas. Sin embargo, la selección de materiales con funciones específicas necesita más investigación. Evitar lesiones tisulares es crucial al hacer incisiones durante la operación.
Introducción
La fusión es un fenómeno común en el desarrollo de tejidos u órganos. Los ejemplos incluyen el cierre dorsal y el cierre del tórax en Drosophila1 y la morfogénesis del paladar, la morfogénesis del tubo neural y la morfogénesis del corazón en ratones y pollo2. CrispR y RNAi se han aplicado para investigar el papel de los genes en el proceso de fusión2,3,4.
Spodoptera litura (S. litura, Lepidoptera: Noctuidae) es una plaga polífaga perjudicial que se distribuye ampliamente en áreas tropicales y subtropicales de Asia, incluyendo China4,5,6. La amplia distribución de S. litura se atribuye en parte a su poderosa capacidad reproductiva, que es relevante para el desarrollo de las gónadas. La infertilidad masculina es un enfoque para controlar esta plaga. Como se muestra en la figura esquemática de la estructura testicular, los testículos están encerrados por la vaina testicular, incluida la vaina externa (vaina peritoneal) y la lámina basal interna. La lámina basal se extiende internamente para formar el epitelio folicular y separa el área interna del testículo en cuatro cámaras llamadas folículos (Figura 1).
En los folículos, los espermatozoides se convierten en espermatozoides después de la mitosis y la meiosis, y luego los espermatozoides en los sacos de esperma se alinean en la misma dirección para formar haces de espermatozoides7. Durante la espermatogénesis, los espermatocitos primarios se diferencian en espermatozoides de eupireno o espermatozoides de apireno. Los espermatocitos en la fase larvaria se convierten en espermatozoides de eupireno con una cola larga conectada a una cabeza de un núcleo alargado; estos pueden fertilizar los huevos. Por el contrario, los espermatocitos en la fase media de pupa se convierten en espermatozoides de apireno con un núcleo descartado; estos espermatozoides ayudan a la supervivencia, el movimiento y la fertilización de los espermatozoides de eupireno9,10. El día 6 de la pupa es el período durante el cual los testículos tienen abundantes haces de espermatozoides de eupireno y apireno.
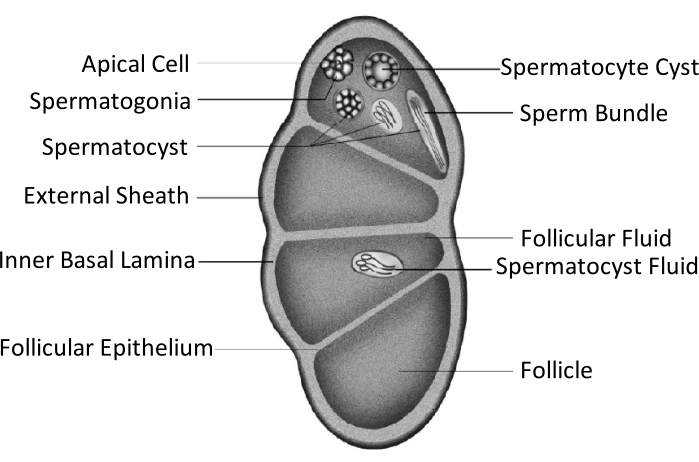
Figura 1: Diagrama esquemático de la estructura testicular de los insectos lepidópteros11. Haga clic aquí para ver una versión más grande de esta figura.
La fusión testicular ocurre en la mayoría de los insectos del orden de los lepidópteros11,12, especialmente en aquellas especies que son plagas agrícolas. La fusión testicular se refiere a un par de testículos que crecen bilateralmente en la fase larvaria, acercándose y adhiriéndose entre sí, integrándose finalmente en una sola gónada11. En Spodoptera litura, ocurre durante la metamorfosis de la etapa larval a la pupal. Desde el día 1 de la 5ª instar (L5D1) hasta el día 4 de la 6ª instar (L6D4), el par de testículos crece gradualmente en tamaño, y el color se vuelve amarillo claro de blanco marfil. Se vuelve de color rojo tenue a medida que alcanza la fase prepupal (L6D5 a L6D6). Dos testículos simétricos bilaterales se acercan entre sí durante la etapa prepupal, se fusionan en uno y giran en sentido contrario a las agujas del reloj (vista doral) para producir un solo testículo en las fases pupal y adulta11. Este fenómeno no ocurre en los gusanos de seda, que tienen una importancia económica considerable y han sido domesticados durante 5000 años13. Por lo tanto, se supone que la fusión de los testículos mejora la capacidad reproductiva.
Para determinar la importancia de la fusión testicular de Spodoptera litura , es importante investigar los efectos del bloqueo del proceso. En este protocolo, se insertó microquirúrgicamente papel de aluminio entre los testículos para mantenerlos separados, y se estudiaron los consiguientes cambios en el desarrollo de los insectos y sus testículos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Cría y mantenimiento de insectos
- Cultiva las larvas de Spodoptera litura en cámaras de simulación ambiental con una dieta artificial hasta llegar al día 4 del 6º instar (L6D4). Seleccionar larvas macho cuando los gusanos entren el primer día del 6º instar (L6D0) en base a la estructura en forma de triángulo inverso en el octavo abdomen14.
NOTA: Las técnicas de cría y mantenimiento de larvas se publicaron anteriormente4,14.
2. Preparación prequirúrgica
- Recorte el papel de aluminio en piezas rectangulares con esquinas redondeadas (1 mm x 2 mm, Figura 2).
- Esterilizar la plataforma de cirugía y los artículos relacionados (superficie de la mesa, microscopio, nevera, caja de insectos, bandeja de cera, alfileres e hilo) rociando alcohol al 75% en su superficie y limpiándolos.
- Esterilice las herramientas quirúrgicas (incluido el papel de aluminio) con un esterilizador de vapor de alta presión durante 30 minutos y colóquelas en un horno de calentamiento y secado a 120 °C.
- Asegúrese de que los operadores usen ropa de laboratorio limpia, máscaras quirúrgicas y guantes estériles.
3. Colocación microquirúrgica de una barrera entre los testículos
NOTA: El flujo de trabajo general es el siguiente: Congelación → fijación → desinfección → incisión → colocación de barrera → sutura→ alimentación e inspección postoperatoria
- Coloque las larvas macho (L6D4) en hielo durante 10-30 minutos para mantenerlas anestesiadas durante la operación.
- Coloque una larva en la bandeja de cera con el lado dorsal hacia arriba, y luego fije la cabeza y la cola de la larva con alfileres e hilos, mostrando el área quirúrgica que es la superficie dorsal en el 9º segmento corporal (Figura 3A).
- Desinfecte el área quirúrgica aplicando tintura de yodo al 3% con un hisopo de algodón en la epidermis (9º segmento del cuerpo), seguido de alcohol al 70% para eliminar el yodo (Figura 3B).
NOTA: Enfoque en la larva a través del ajuste grueso y fino del microscopio quirúrgico (Figura 3C). Coloque la bandeja de cera en un plato de cultivo más grande lleno de hielo para mantener la anestesia. - Haga una incisión de 2 mm de largo en la epidermis dorsal del 9º segmento del cuerpo. A continuación, use un hisopo de algodón estéril para eliminar cualquier fuga de hemolinfa y cuerpos grasos y obtener una visión clara del área quirúrgica.
NOTA: Es importante evitar el corazón durante el procedimiento. Esto se puede hacer haciendo la incisión ligeramente al lado de la línea media en el segmento 9 del cuerpo o en la articulación entre los segmentos del cuerpo 9 y 10 para evitar que los testículos salgan debido a la presión interna larvaria. Mientras usa el bisturí, haga una hendidura vertical con la cuchilla primero (Figura 4A), y luego gírela 45 ° hacia la epidermis antes de cortar uniforme y continuamente a través de la epidermis (Figura 4B). - Use pinzas quirúrgicas para insertar un trozo de papel de aluminio entre los testículos (Figura 5).
- Al final de la cirugía, cierre la incisión para evitar la infección y permita que las larvas se recuperen de la cirugía.
- Cierre la epidermis con una sutura en funcionamiento (Figura 6).
- Use un soporte de aguja y pinzas quirúrgicas para atar un nudo cuadrado quirúrgico, que requiere dos nudos simples de imagen especular opuestos (Figura 6D, E).
- Use tijeras para cortar el exceso de sutura de las colas de bucle, dejando un hilo de 2 mm detrás.
- Después de suturar, coloque suavemente la larva en la caja de cría y manténgala en una cámara de simulación ambiental limpia. Continúe observando las larvas.
NOTA: La herida deja de gotear hemolinfa y las larvas se recuperan gradualmente después de la cirugía. Los gusanos continúan completando su metamorfosis.

Figura 2: Barrera física preparada con papel de aluminio (1 mm x 2 mm). Haga clic aquí para ver una versión más grande de esta figura.
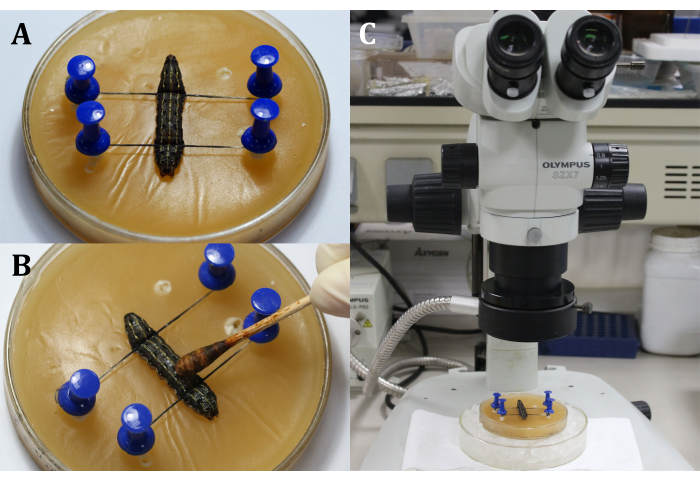
Figura 3: Antes de la incisión. (A) Fijación de la larva. (B) Desinfección de la epidermis del área quirúrgica. (C) Realizar cirugía bajo el microscopio. Haga clic aquí para ver una versión más grande de esta figura.
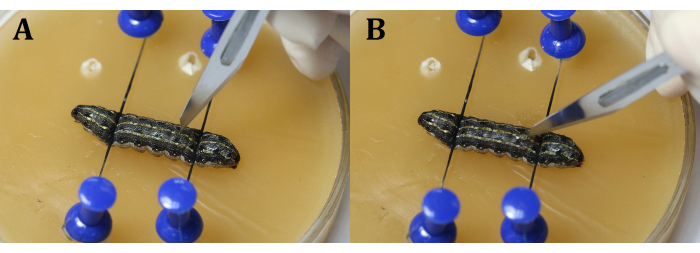
Figura 4: Incisión. (A) Cortar las larvas verticalmente con la cuchilla. (B) Gire la cuchilla 45° hacia la epidermis antes de cortarla. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Inserción de la barrera física (papel de aluminio) entre los testículos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Sutura. (A) Inserte la aguja. (B) Retire la aguja. (C) Retire y sujete la aguja. (D) Atar el primer nudo simple. (E) Ata el nudo simple opuesto con imagen especular. (F) Cortar el exceso de hilo de sutura. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Los efectos de la microcirugía en el crecimiento y desarrollo de Spodoptera litura
La microcirugía dejó una herida de 2 mm de largo en la epidermis larvaria dorsal que finalmente dejó de gotear hemolinfa y sanó. Las larvas pasaron por etapas prepupales y pupales y eclosionaron, lo que indica que la microcirugía no tuvo un impacto importante en el crecimiento y el desarrollo. Cuando las larvas mudaban en pupas, los hilos de sutura se descartaban junto c...
Access restricted. Please log in or start a trial to view this content.
Discusión
Después de obstruir microquirúrgicamente la fusión de los testículos en Spodoptera litura, el número de haces de espermatozoides disminuyó, lo que apoyó la hipótesis de que esta fusión es beneficiosa para la capacidad reproductiva. La manipulación quirúrgica se ha utilizado para estudiar el desarrollo fisiológico de los insectos desde principios del siglo 20. Para determinar si el nervio craneal está regulado por la metamorfosis de los insectos, algunos investigadores realizaron procedimi...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional de Ciencias Naturales de China (Nos.: 31772519, 31720103916; ) y una subvención abierta del Laboratorio Estatal Clave de Biología del Genoma del Gusano de Seda, Universidad del Sudoeste (No.: sklsgb2013003).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 75% Rubbing alcohol | Qingdao Hainuo Nuowei Disinfection Technology Co., Ltd | Q/370285HNW 001-2019 | |
| Colored Push Pins | Deli Group Co.,LTD | 0042 | |
| Corneal Scissors | Suzhou Xiehe Medical Device Co., Ltd | MR-S221A | Curved and blunt tip |
| Glad Aluminum Foil | Clorox China(Guangzhou) Limited | 831457 | 10 cm*2.5 cm*0.6 |
| Medical Cotton Swabs (Sterile) | Winner Medical Co., Ltd. | 601-022921-01 | |
| Medical Iodine Cotton Swab | Winner Medical Co., Ltd. | 608-000247 | |
| Needle holder | Shanghai Medical Instruments (Group) Ltd., Corp. | J32030 | 14 cm fine needle |
| Sterile surgical blade | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | #11 | |
| Suigical Blade Holder | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | K6-10 | Straight 3# |
| Suture thread with needle | Ningbo Medical Stitch Needle Co., Ltd | needle: 3/8 Circle, 2.5*8 ; Thread: Nylon, 6/0, 25 cm | |
| Tying Forceps | Suzhou Xiehe Medical Device Co., Ltd | MR-F201T-3 | Straight-pointed; long handle; 0.12 mm-wide-head |
Referencias
- Zeitlinger, J., Bohmann, D. Thorax closure in Drosophila: involvement of Fos and the JNK pathway. Development. 126 (17), 3947-3956 (1999).
- Ray, H. J., Niswander, L. Mechanisms of tissue fusion during development. Development. 139 (10), 1701-1711 (2012).
- Ducuing, A., Keeley, C., Mollereau, B., Vincent, S. A. DPP-mediated feed-forward loop canalizes morphogenesis during Drosophila dorsal closure. The Journal of Cell Biology. 208 (2), 239-248 (2015).
- Du, Q., et al. Identification and functional characterization of doublesex gene in the testis of Spodoptera litura. Insect Science. 26 (6), 1000-1010 (2019).
- Qin, H. G., Ding, J., Ye, Z. X., Huang, S. J., Luo, R. H. Dynamic analysis of experimental population of Spodoptera litura. Journal of Biosafety. 13 (2), 45-48 (2004).
- Guan, B. B., et al. The research in biology and ecology of Spodoptera litura. Journal of Biosafety. 8 (1), 57-61 (1999).
- Wen, L., et al. The testis development and spermatogenesis in Spodopture litura (lepidoptera: noctuidae). Journal of South China Normal University (Natural Science Edition. 51 (4), 47-56 (2019).
- Friedländer, M., Seth, R. K., Reynolds, S. E. Eupyrene and apyrene sperm: dichotomous spermatogenesis in Lepidoptera. Advances in Insect Physiology. 32, 206(2010).
- Cook, P. A., Wedell, N. Non-fertile sperm delay female remating. Nature. 397 (6719), 486(1999).
- Iriki, S. On the function of apyrene spermatozoa in the silk worm. Zoological Magazine. 53, 123-124 (1941).
- Liu, L., Feng, Q. L. The study of fusion of testis in Lepidoptera insects. Journal of South China Normal University (Natural Science Edition). 46 (5), 1-7 (2014).
- Klowden, M. J. Physiological systems in insects. , Elsevier/Academic Press. Amsterdam, NL; Boston, MA. (2007).
- Xu, J., et al. Transgenic characterization of two testis-specific promoters in the silkworm, Bombyx mori. Insect Molecular Biology. 24 (2), 183-190 (2015).
- Guo, X. R., Zheng, S. C., Liu, L., Feng, Q. L. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses. BioMed Central Molecular Biology. 10, 102(2009).
- Kopeć, S. Studies on the necessity of the brain for the inception of insect metamorphosis. Biological Bulletin. 42 (6), 323-342 (1922).
- Wigglesworth, V. B. Factors controlling moulting and 'metamorphosis' in an insect. Nature. 133 (5), 725-726 (1934).
- Williams, C. N. Physiology of insect diapause; the role of the brain in the production and termination of pupal dormancy in the giant silkworm, Platysamia cecropia. Biological Bulletin. 90 (3), 234-243 (1946).
- Fukuda, S. Hormonal control of molting and pupation in the silkworm. Proceedings of the Imperial Academy Tokyo. 16 (8), 417-420 (1940).
- Tian, H. J., Liu, Z. P., Bai, Y. Y. Common methods to detect Sperm quality of mammalian. Journal of Economic Zoology. 8 (4), 198-201 (2004).
- Ji, X. S., Chen, S. L., Zhao, Y., Tian, Y. S. Progress in the quality evaluation of fish sperm. Chinese Fishery Science. 14 (6), 1048-1054 (2007).
- Baulny, B. O. D., Vern, Y. L., Kerboeuf, D., Maisse, G. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology. 34 (2), 141-149 (1997).
- Krasznai, Z., Márián, T., Balkay, I., Emri, M., Trón, L. Permeabilization and structural changes in the membrane of common carp (Cyprinus carpio L.) sperm induced by hypo-osmotic shock. Aquaculture. 129 (1), 134(1995).
- Kime, D. E., et al. Computer-assisted sperm analysis (CASA) as a tool for monitoring sperm quality in fish. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp. 130 (4), 425-433 (2001).
- Rurangwa, E., Volckaert, F. A., Huyskens, G., Kime, D. E., Ollevier, F. Quality control of refrigerated and cryopreserved semen using computer-assisted sperm analysis (CASA), viable staining and standardized fertilization in African catfish (Clarias gariepinus). Theriogenology. 55 (3), 751-769 (2001).
- Seth, R. K., Kaur, J. J., Rao, D. K., Reynolds, S. E. Effects of larval exposure to sublethal concentrations of the ecdysteroid agonists RH-5849 and tebufenozide (RH-5992) on male reproductive physiology in Spodoptera litura. Journal of Insect Physiology. 50 (6), 505-517 (2004).
- Sweeney, R. M., Watterson, R. L. Rib development in chick embryos analyzed by means of tantalum foil blocks. American Journal of Anatomy. 126 (2), 127-149 (1969).
- Wilde, S., Logan, M. P. Application of impermeable barriers combined with candidate factor soaked beads to study inductive signals in the chick. Journal of Visualized Experiments. (117), e54618(2016).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados