É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Obstrução microcirúrgica de Testes Fusion em Spodoptera litura
Neste Artigo
Resumo
A folha de alumínio foi microsurgicamente inserida entre os testículos de Spodoptera litura para obstruir a fusão de testis. O procedimento inclui congelamento, fixação, desinfecção, incisão, colocação da barreira, sutura, alimentação pós-operatória e inspeção. Essa abordagem fornece um método para interferir na formação de tecidos.
Resumo
Em vez de usar métodos genéticos como a interferência de RNA (RNAi) e agrupar regularmente repetições palindrômicas curtas interespaçadas (CRISPR)/CRISPR-associated Cas9, uma barreira física foi microsurgicamente inserida entre os testículos de Spodoptera litura para estudar o impacto desta microcirurgia em seu crescimento e reprodução. Após inserir papel alumínio entre os testículos, a fusão de insetos durante a metamorfose prosseguiu normalmente. O crescimento e o desenvolvimento de insetos não foram notavelmente alterados; no entanto, o número de pacotes de esperma mudou se a fusão de testículos fosse interrompida pela microcirurgia. Esses achados implicam que o bloqueio da fusão testicular pode influenciar a capacidade de reprodução masculina. O método pode ser aplicado ainda mais para interromper a comunicação entre órgãos para estudar a função de vias de sinalização específicas. Em comparação com a cirurgia convencional, a microcirurgia requer apenas uma anestesia congelante, que é preferível à anestesia de dióxido de carbono. A microcirurgia também minimiza a área do local da cirurgia e facilita a cicatrização da ferida. No entanto, a seleção de materiais com funções específicas precisa ser aprofundada. Evitar lesões teciduais é crucial ao fazer incisões durante a operação.
Introdução
A fusão é um fenômeno comum no desenvolvimento de tecidos ou órgãos. Exemplos incluem fechamento dorsal e fechamento do tórax em Drosophila1 e morfogênese do paladar, morfogênese do tubo neural e morfogênese cardíaca em camundongos e frango2. CRISPR e RNAi têm sido aplicados para investigar os papéis dos genes no processo de fusão2,3,4.
Spodoptera litura (S. litura, Lepidoptera: Noctuidae) é uma praga polifagosa prejudicial que é amplamente distribuída em áreas tropicais e subtropicais da Ásia, incluindo China4,5,6. A ampla distribuição da S. litura é parcialmente atribuída à sua poderosa capacidade reprodutiva, que é relevante para o desenvolvimento da gônada. A infertilidade masculina é uma abordagem para controlar esta praga. Como mostrado na figura esquemática da estrutura testicular, os testículos são incluídos pela baia testicular, incluindo a baáta externa (baia peritoneal) e a lamina basal interna. A lamina basal se estende internamente para formar o epitélio folicular e separa a área interna dos testículos em quatro câmaras chamadas folículos (Figura 1).
Nos folículos, a espermatogonia se desenvolve em espermatozoides após mitose e meiose, e então os espermatozoides nos sacos de esperma se alinham na mesma direção para formar espermatozoides7. Durante a espermatogênese, os espermatotozóides primários se diferenciam em espermatozoides eupyrenos ou espermatozoides apirenos. Os espermatotozóides na fase larval desenvolvem-se em esperma de eupirrena com uma cauda longa conectada a uma cabeça de um núcleo alongado; estes podem fertilizar ovos. Por outro lado, os espermatocitotas na fase de pupal médio desenvolvem-se em espermatozoides apirene com um núcleo descartado; esses espermatozoides auxiliam na sobrevivência, movimento e fertilização do esperma eupyreno9,10. O sexto dia da pupa é o período durante o qual os testículos têm abundantes pacotes de esperma de eupirrena e apirena.
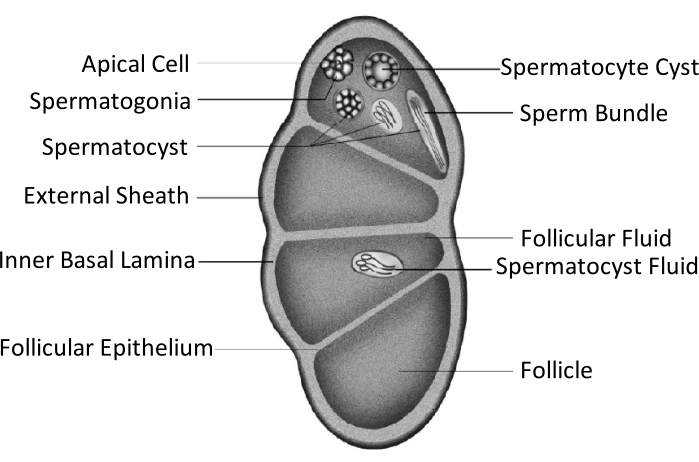
Figura 1: Diagrama esquemático da estrutura testicular dos insetos Lepidoptera11. Clique aqui para ver uma versão maior desta figura.
A fusão testicular ocorre na maioria dos insetos da ordem Lepidoptera11,12, especialmente nas espécies que são pragas agrícolas. A fusão testicular refere-se a um par de testículos crescendo bilateralmente na fase larval, aproximando-se e aderindo uns aos outros, eventualmente integrando-se em uma única gônada11. Em Spodoptera litura, acontece durante a metamorfose da larval ao estágio pupal. Do primeiro dia do 5º instar (L5D1) ao 4º dia da 6ª instar (L6D4), o par de testículos cresce gradualmente em tamanho, e a cor fica amarelo claro do branco-marfim. Torna-se vermelho fraco à medida que atinge a fase prepupal (L6D5 a L6D6). Dois testículos simétricos bilaterais se aproximam durante o estágio prepupal, fundem-se em um, e torcem no sentido anti-horário (visão doral) para produzir um único testículo nas fases pupal e adulta11. Esse fenômeno não ocorre em bichos-da-seda, que têm considerável importância econômica e foram domesticados por 5000 anos13. Assim, supõe-se que a fusão dos testículos melhora a capacidade reprodutiva.
Para determinar a significância da fusão testicular Spodoptera litura , é importante investigar os efeitos do bloqueio do processo. Neste protocolo, a folha de alumínio foi microsurgicamente inserida entre os testículos para mantê-los separados, e foram estudadas as consequentes mudanças no desenvolvimento dos insetos e seus testículos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Criação e manutenção de insetos
- Cultura as larvas Spodoptera litura em câmaras de simulação ambiental com uma dieta artificial até chegarem ao 4º dia da 6ª instar (L6D4). Selecione larvas masculinas quando os vermes entrarem no primeiro dia do 6º instar (L6D0) com base na estrutura em forma de triângulo inverso no oitavo abdômen14.
NOTA: As técnicas de criação e manutenção de larvas foram publicadas anteriormente4,14.
2. Preparação pré-úrgica
- Corte a folha de alumínio em pedaços retangulares com cantos arredondados (1 mm x 2 mm, Figura 2).
- Esterilize a plataforma de cirurgia e itens relacionados (superfície de mesa, microscópio, geladeira, caixa de insetos, bandeja de cera, pinos e rosca) pulverizando 75% de álcool em sua superfície e limpando-os.
- Esterilize ferramentas cirúrgicas (incluindo a folha de alumínio) com um esterilizador a vapor de alta pressão por 30 minutos, e coloque-as em um forno de aquecimento e secagem a 120 °C.
- Certifique-se de que os operadores usem roupas de laboratório limpas, máscaras cirúrgicas e luvas estéreis.
3. Colocação microcirúrgica de uma barreira entre os testículos
NOTA: O fluxo geral de trabalho é o seguinte: Congelamento → Fixação → Desinfecção → Incisão → Colocação da Barreira → Suturing→ Alimentação e Inspeção Pós-Operatória
- Coloque larvas masculinas (L6D4) no gelo por 10-30 minutos para mantê-las anestesiadas durante a operação.
- Coloque uma larva na bandeja de cera com o lado dorsal para cima e, em seguida, fixe a cabeça e a cauda da larva com pinos e fios, mostrando a área cirúrgica que é a superfície dorsal no segmento 9º corpo (Figura 3A).
- Desinfete a área cirúrgica aplicando 3% de tintura de iodo com cotonete na epiderme (9º segmento corporal), seguido de 70% de álcool para remover o iodo (Figura 3B).
NOTA: Concentre-se na larva através de ajuste grosseiro e fino do microscópio cirúrgico (Figura 3C). Coloque a bandeja de cera em um prato de cultura maior cheio de gelo para manter a anestesia. - Faça uma incisão de 2 mm de comprimento na epiderme dorsal do 9º segmento corporal. Em seguida, use um cotonete estéril para remover qualquer hemoglifo e corpos de gordura que vazem e obtenha uma visão clara da área cirúrgica.
NOTA: É importante evitar o coração durante o procedimento. Isso pode ser feito fazendo com que a incisão seja ligeiramente próxima à linha média do segmento do 9º corpo ou na articulação entre os segmentos do 9º e 10º corpo para evitar que os testículos apaguem devido à pressão interna larval. Ao usar o bisturi, faça uma fenda vertical com a lâmina primeiro (Figura 4A), e depois gire-a 45° em direção à epiderme antes de cortar uniforme e continuamente através da epiderme (Figura 4B). - Use pinças cirúrgicas para inserir um pedaço de papel alumínio entre os testículos (Figura 5).
- No final da cirurgia, feche a incisão para evitar infecções, e permita que as larvas se recuperem da cirurgia.
- Feche a epiderme com uma sutura em execução (Figura 6).
- Use um suporte de agulha e pinças cirúrgicas para amarrar um nó quadrado cirúrgico, exigindo dois nós simples de imagem espelhada (Figura 6D,E).
- Use uma tesoura para cortar o excesso de sutura das caudas do laço, deixando um fio de 2 mm para trás.
- Após a sutura, coloque delicadamente a larva na caixa de criação e mantenha-as em uma câmara de simulação ambiental limpa. Continue observando as larvas.
NOTA: A ferida pára de vazar hemoglifo, e as larvas se recuperam gradualmente após a cirurgia. Os vermes continuam a completar sua metamorfose.

Figura 2: Barreira física preparada usando papel alumínio (1 mm x 2 mm). Clique aqui para ver uma versão maior desta figura.
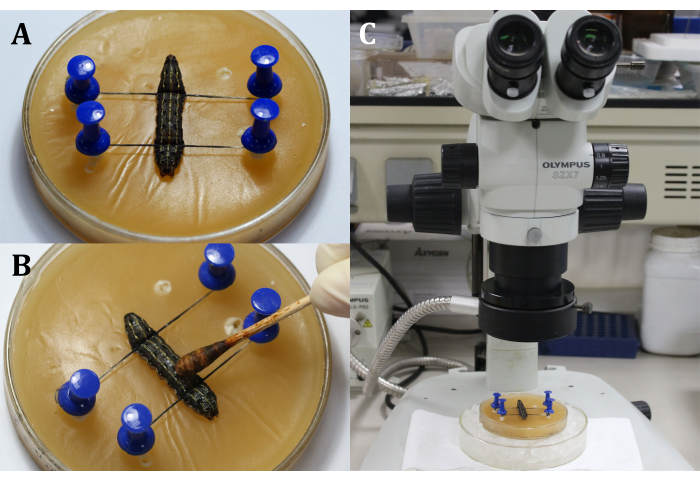
Figura 3: Antes da incisão. (A) Fixação da larva. b Desinfecção da epiderme da área cirúrgica. (C) Fazendo cirurgia sob o microscópio. Clique aqui para ver uma versão maior desta figura.
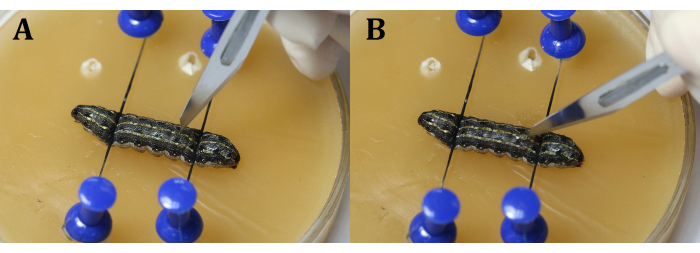
Figura 4: Incisão. (A) Corte as larvas verticalmente com a lâmina. (B) Gire a lâmina 45° em direção à epiderme antes de cortar. Clique aqui para ver uma versão maior desta figura.

Figura 5: Inserção da barreira física (folha de alumínio) entre os testículos. Clique aqui para ver uma versão maior desta figura.

Figura 6: Sutura. (A) Insira a agulha. (B) Retire a agulha. (C) Retire e aperte a agulha. (D) Amarre o primeiro nó simples. (E) Amarre o nó simples com imagens espelhadas opostas. (F) Corte o excesso de sutura. Clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Os efeitos da microcirurgia no crescimento e desenvolvimento da Spodoptera litura
A microcirurgia deixou uma ferida de 2 mm de comprimento na epiderme larval dorsal que eventualmente parou de vazar hemoglifo e se curou. As larvas passaram por estágios prepupal e pupal e foram fechadas, indicando que a microcirurgia não teve grande impacto no crescimento e desenvolvimento. Quando as larvas se fundiram em pupas, os fios de sutura foram descartados junto com ...
Access restricted. Please log in or start a trial to view this content.
Discussão
Depois de obstruir microsurgicamente a fusão de testículos em Spodoptera litura, o número de espermatozoides diminuiu, o que apoiou a hipótese de que essa fusão é benéfica para a capacidade reprodutiva. A manipulação cirúrgica tem sido usada para estudar o desenvolvimento fisiológico de insetos desde o início do século XX. Para determinar se o nervo craniano é regulado pela metamorfose de insetos, alguns pesquisadores realizaram procedimentos como ligadura e decapitação em diferentes i...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela National Natural Science Foundation of China (Nos.:31772519, 31720103916; ) e uma bolsa aberta do Laboratório Estadual de Biologia do Genoma da Bicho-Da-Seda da Universidade do Sudoeste (No.: sklsgb2013003).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 75% Rubbing alcohol | Qingdao Hainuo Nuowei Disinfection Technology Co., Ltd | Q/370285HNW 001-2019 | |
| Colored Push Pins | Deli Group Co.,LTD | 0042 | |
| Corneal Scissors | Suzhou Xiehe Medical Device Co., Ltd | MR-S221A | Curved and blunt tip |
| Glad Aluminum Foil | Clorox China(Guangzhou) Limited | 831457 | 10 cm*2.5 cm*0.6 |
| Medical Cotton Swabs (Sterile) | Winner Medical Co., Ltd. | 601-022921-01 | |
| Medical Iodine Cotton Swab | Winner Medical Co., Ltd. | 608-000247 | |
| Needle holder | Shanghai Medical Instruments (Group) Ltd., Corp. | J32030 | 14 cm fine needle |
| Sterile surgical blade | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | #11 | |
| Suigical Blade Holder | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | K6-10 | Straight 3# |
| Suture thread with needle | Ningbo Medical Stitch Needle Co., Ltd | needle: 3/8 Circle, 2.5*8 ; Thread: Nylon, 6/0, 25 cm | |
| Tying Forceps | Suzhou Xiehe Medical Device Co., Ltd | MR-F201T-3 | Straight-pointed; long handle; 0.12 mm-wide-head |
Referências
- Zeitlinger, J., Bohmann, D. Thorax closure in Drosophila: involvement of Fos and the JNK pathway. Development. 126 (17), 3947-3956 (1999).
- Ray, H. J., Niswander, L. Mechanisms of tissue fusion during development. Development. 139 (10), 1701-1711 (2012).
- Ducuing, A., Keeley, C., Mollereau, B., Vincent, S. A. DPP-mediated feed-forward loop canalizes morphogenesis during Drosophila dorsal closure. The Journal of Cell Biology. 208 (2), 239-248 (2015).
- Du, Q., et al. Identification and functional characterization of doublesex gene in the testis of Spodoptera litura. Insect Science. 26 (6), 1000-1010 (2019).
- Qin, H. G., Ding, J., Ye, Z. X., Huang, S. J., Luo, R. H. Dynamic analysis of experimental population of Spodoptera litura. Journal of Biosafety. 13 (2), 45-48 (2004).
- Guan, B. B., et al. The research in biology and ecology of Spodoptera litura. Journal of Biosafety. 8 (1), 57-61 (1999).
- Wen, L., et al. The testis development and spermatogenesis in Spodopture litura (lepidoptera: noctuidae). Journal of South China Normal University (Natural Science Edition. 51 (4), 47-56 (2019).
- Friedländer, M., Seth, R. K., Reynolds, S. E. Eupyrene and apyrene sperm: dichotomous spermatogenesis in Lepidoptera. Advances in Insect Physiology. 32, 206(2010).
- Cook, P. A., Wedell, N. Non-fertile sperm delay female remating. Nature. 397 (6719), 486(1999).
- Iriki, S. On the function of apyrene spermatozoa in the silk worm. Zoological Magazine. 53, 123-124 (1941).
- Liu, L., Feng, Q. L. The study of fusion of testis in Lepidoptera insects. Journal of South China Normal University (Natural Science Edition). 46 (5), 1-7 (2014).
- Klowden, M. J. Physiological systems in insects. , Elsevier/Academic Press. Amsterdam, NL; Boston, MA. (2007).
- Xu, J., et al. Transgenic characterization of two testis-specific promoters in the silkworm, Bombyx mori. Insect Molecular Biology. 24 (2), 183-190 (2015).
- Guo, X. R., Zheng, S. C., Liu, L., Feng, Q. L. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses. BioMed Central Molecular Biology. 10, 102(2009).
- Kopeć, S. Studies on the necessity of the brain for the inception of insect metamorphosis. Biological Bulletin. 42 (6), 323-342 (1922).
- Wigglesworth, V. B. Factors controlling moulting and 'metamorphosis' in an insect. Nature. 133 (5), 725-726 (1934).
- Williams, C. N. Physiology of insect diapause; the role of the brain in the production and termination of pupal dormancy in the giant silkworm, Platysamia cecropia. Biological Bulletin. 90 (3), 234-243 (1946).
- Fukuda, S. Hormonal control of molting and pupation in the silkworm. Proceedings of the Imperial Academy Tokyo. 16 (8), 417-420 (1940).
- Tian, H. J., Liu, Z. P., Bai, Y. Y. Common methods to detect Sperm quality of mammalian. Journal of Economic Zoology. 8 (4), 198-201 (2004).
- Ji, X. S., Chen, S. L., Zhao, Y., Tian, Y. S. Progress in the quality evaluation of fish sperm. Chinese Fishery Science. 14 (6), 1048-1054 (2007).
- Baulny, B. O. D., Vern, Y. L., Kerboeuf, D., Maisse, G. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology. 34 (2), 141-149 (1997).
- Krasznai, Z., Márián, T., Balkay, I., Emri, M., Trón, L. Permeabilization and structural changes in the membrane of common carp (Cyprinus carpio L.) sperm induced by hypo-osmotic shock. Aquaculture. 129 (1), 134(1995).
- Kime, D. E., et al. Computer-assisted sperm analysis (CASA) as a tool for monitoring sperm quality in fish. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp. 130 (4), 425-433 (2001).
- Rurangwa, E., Volckaert, F. A., Huyskens, G., Kime, D. E., Ollevier, F. Quality control of refrigerated and cryopreserved semen using computer-assisted sperm analysis (CASA), viable staining and standardized fertilization in African catfish (Clarias gariepinus). Theriogenology. 55 (3), 751-769 (2001).
- Seth, R. K., Kaur, J. J., Rao, D. K., Reynolds, S. E. Effects of larval exposure to sublethal concentrations of the ecdysteroid agonists RH-5849 and tebufenozide (RH-5992) on male reproductive physiology in Spodoptera litura. Journal of Insect Physiology. 50 (6), 505-517 (2004).
- Sweeney, R. M., Watterson, R. L. Rib development in chick embryos analyzed by means of tantalum foil blocks. American Journal of Anatomy. 126 (2), 127-149 (1969).
- Wilde, S., Logan, M. P. Application of impermeable barriers combined with candidate factor soaked beads to study inductive signals in the chick. Journal of Visualized Experiments. (117), e54618(2016).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados