A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تسجيل نشاط الشبكة في الدوائر الحساسة للألم في العمود الفقري باستخدام صفائف الأقطاب الدقيقة
In This Article
Summary
يتم تحديد الاستخدام المشترك لتكنولوجيا مصفوفة microelectrode والتحفيز الكيميائي الناجم عن 4-aminopyridine للتحقيق في نشاط مسبب للألم على مستوى الشبكة في القرن الظهري للحبل الشوكي.
Abstract
يتم تحديد أدوار واتصال أنواع محددة من الخلايا العصبية داخل القرن الظهري للحبل الشوكي (DH) بمعدل سريع لتوفير رؤية مفصلة بشكل متزايد للدوائر التي تقوم عليها معالجة آلام العمود الفقري. ومع ذلك ، فإن آثار هذه الاتصالات على نشاط الشبكة الأوسع في DH لا تزال أقل فهما لأن معظم الدراسات تركز على نشاط الخلايا العصبية المفردة والدوائر الدقيقة الصغيرة. بدلا من ذلك ، فإن استخدام صفائف الأقطاب الكهربائية الدقيقة (MEAs) ، والتي يمكنها مراقبة النشاط الكهربائي عبر العديد من الخلايا ، يوفر دقة مكانية وزمنية عالية للنشاط العصبي. هنا ، يتم وصف استخدام MEAs مع شرائح الحبل الشوكي للفئران لدراسة نشاط DH الناجم عن دوائر DH المحفزة كيميائيا باستخدام 4-aminopyridine (4-AP). يقتصر النشاط الإيقاعي الناتج على DH السطحي ، المستقر بمرور الوقت ، المحظور بواسطة tetrodotoxin ، ويمكن التحقيق فيه في اتجاهات شريحة مختلفة. معا ، يوفر هذا المستحضر منصة للتحقيق في نشاط دائرة DH في الأنسجة من الحيوانات الساذجة ، والنماذج الحيوانية للألم المزمن ، والفئران ذات وظيفة مسببة للألم معدلة وراثيا. وعلاوة على ذلك، يمكن استخدام تسجيلات MEA في شرائح الحبل الشوكي المحفزة بتقنية 4-AP كأداة فحص سريع لتقييم قدرة المركبات الجديدة المضادة للحساسية على تعطيل النشاط في DH الحبل الشوكي.
Introduction
يتم الكشف عن أدوار أنواع محددة من الخلايا العصبية المثبطة والمثيرة داخل الحبل الشوكي DH بمعدل سريع1،2،3،4. معا ، تشكل الخلايا العصبية الداخلية أكثر من 95٪ من الخلايا العصبية في DH وتشارك في المعالجة الحسية ، بما في ذلك nociception. علاوة على ذلك ، فإن هذه الدوائر بين الخلايا العصبية مهمة لتحديد ما إذا كانت الإشارات الطرفية تصعد إلى المحور العصبي للوصول إلى الدماغ والمساهمة في إدراك الألم5،6،7. حتى الآن ، حققت معظم الدراسات في دور الخلايا العصبية DH على مستوى التحليل إما على مستوى الخلية الواحدة أو الكائن الحي بأكمله باستخدام مجموعات من الفيزيولوجيا الكهربية داخل الخلايا في المختبر ، ووضع العلامات التشريحية العصبية ، والتحليل السلوكي في الجسم الحي 1،3،8،9،10،11،12،13،14 . وقد عززت هذه الأساليب بشكل كبير في فهم دور مجموعات محددة من الخلايا العصبية في معالجة الألم. ومع ذلك ، لا تزال هناك فجوة في فهم كيفية تأثير أنواع معينة من الخلايا والدوائر الكلية الصغيرة على مجموعات كبيرة من الخلايا العصبية على مستوى الدائرة الدقيقة لتشكيل مخرجات DH والاستجابات السلوكية وتجربة الألم.
إحدى التقنيات التي يمكنها التحقيق في الدائرة الكلية أو وظيفة المستوى متعدد الخلايا هي مصفوفة القطب الدقيق (MEA) 15,16. تم استخدام MEAs للتحقيق في وظيفة الجهاز العصبي لعدة عقود17,18. في الدماغ ، قاموا بتسهيل دراسة تطور الخلايا العصبية ، واللدونة المشبكية ، والفحص الدوائي ، واختبار السمية17،18. يمكن استخدامها لكل من التطبيقات في المختبر وفي الجسم الحي ، اعتمادا على نوع MEA. وعلاوة على ذلك، تطور تطوير الاتفاقات البيئية المتعددة الأطراف بسرعة، حيث أصبحت أعداد الأقطاب الكهربائية المختلفة وتكويناتها متاحة الآن19. تتمثل إحدى المزايا الرئيسية ل MEAs في قدرتها على تقييم النشاط الكهربائي في العديد من الخلايا العصبية في وقت واحد بدقة مكانية وزمنية عالية عبر أقطاب كهربائية متعددة15,16. وهذا يوفر قراءة أوسع لكيفية تفاعل الخلايا العصبية في الدوائر والشبكات، في ظل ظروف التحكم وفي وجود المركبات المطبقة محليا.
أحد التحديات التي تواجه الاستعدادات في المختبر DH هو أن مستويات النشاط المستمرة عادة ما تكون منخفضة. هنا ، يتم التعامل مع هذا التحدي في دوائر DH للحبل الشوكي باستخدام مانع قناة K + ذو بوابات الجهد ، 4-aminopryidine (4-AP) ، لتحفيز دوائر DH كيميائيا. وقد استخدم هذا الدواء سابقا لإنشاء نشاط كهربائي متزامن إيقاعي في DH من شرائح الحبل الشوكي الحادة وتحت الظروف الحادة في الجسم الحي 20،21،22،23،24. استخدمت هذه التجارب رقعة أحادية الخلية وتسجيلا خارج الخلية أو تصويرا بالكالسيوم لتوصيف النشاط الناجم عن 4-AP 20,21,22,23,24,25. معا ، أظهر هذا العمل متطلبات النقل المشبكي المثير والمثبط والمشابك الكهربائية للنشاط الإيقاعي الناجم عن 4-AP. وبالتالي ، فقد تم النظر إلى استجابة 4-AP على أنها نهج يكشف النقاب عن دوائر DH متعددة التشابك الأصلية ذات الصلة البيولوجية بدلا من كونها ظاهرة عرضية ناجمة عن المخدرات. علاوة على ذلك ، يظهر النشاط الناجم عن 4-AP ملف استجابة مشابها للأدوية المسكنة والمضادة للصرع كحالات ألم الأعصاب وقد تم استخدامه لاقتراح أهداف جديدة للعقاقير المسكنة القائمة على العمود الفقري مثل connexins20,21,22.
هنا ، يتم وصف إعداد يجمع بين MEAs والتنشيط الكيميائي ل DH الشوكي مع 4-AP لدراسة هذه الدوائر المسببة للألم على مستوى الدائرة الكلية ، أو مستوى الشبكة من التحليل. يوفر هذا النهج منصة مستقرة وقابلة للتكرار للتحقيق في الدوائر المسببة للألم في ظل ظروف "تشبه الألم" الساذجة والاعتلال العصبي. هذا التحضير قابل للتطبيق بسهولة لاختبار عمل المسكنات المعروفة على مستوى الدائرة وفحص المسكنات الجديدة في الحبل الشوكي مفرط النشاط.
Protocol
أجريت دراسات على ذكور وإناث فئران c57Bl/6 تتراوح أعمارهم بين 3-12 شهرا. تم تنفيذ جميع الإجراءات التجريبية وفقا للجنة رعاية الحيوان والأخلاقيات بجامعة نيوكاسل (البروتوكولان A-2013-312 و A-2020-002).
1. الفيزيولوجيا الكهربية في المختبر
- إعداد حلول لإعداد وتسجيل شرائح الحبل الشوكي
- السائل الدماغي الشوكي الاصطناعي
ملاحظة: يستخدم السائل الدماغي الشوكي الاصطناعي (aCSF) في غرفة حضانة الوصلة البينية، حيث يتم تخزين الشرائح حتى يبدأ التسجيل وأثناء التجارب كمواد معطرة ومخففة للأدوية. انظر الجدول 1 للاطلاع على التكوين التفصيلي.
- السائل الدماغي الشوكي الاصطناعي
| كيميائي | aCSF (ملليمتر) | aCSF (ز/100 مل) | aCSF بديل للسكروز (mM) | السائل الرباعي السائل المزمن ببدائل السكروز (g/100 mL) | aCSF عالي البوتاسيوم (mM) | ACSF عالي البوتاسيوم (جم / 100 مل) |
| كلوريد الصوديوم (كلوريد الصوديوم) | 118 | 0.690 | - | - | 118 | 0.690 |
| كربونات هيدروجين الصوديوم (NaHCO3) | 25 | 0.210 | 25 | 0.210 | 25 | 0.210 |
| الجلوكوز | 10 | 0.180 | 10 | 0.180 | 10 | 0.180 |
| كلوريد البوتاسيوم (KCl) | 2.5 | 0.019 | 2.5 | 0.019 | 4.5 | 0.034 |
| فوسفات الصوديوم ثنائي الهيدروجين (NaH2PO4) | 1 | 0.012 | 1 | 0.012 | 1 | 0.012 |
| كلوريد المغنيسيوم (MgCl2) | 1 | 0.01 | 1 | 0.01 | 1 | 0.01 |
| كلوريد الكالسيوم (CaCl2) | 2.5 | 0.028 | 2.5 | 0.028 | 2.5 | 0.028 |
| سكروز | - | - | 250 | 8.558 | - | - |
الجدول 1: تركيبات السائل الدماغي الشوكي الاصطناعي. اختصار: aCSF = السائل الدماغي الشوكي الاصطناعي.
- تحضير aCSF يحتوي على (في mM) 118 كلوريد الصوديوم ، 25 NaHCO3 ، 10 الجلوكوز ، 2.5 KCl ، 1 NaH 2 PO4 ، 1 MgCl 2 ، و2.5 CaCl 2 عن طريق إضافة الكميات المطلوبة مما سبق ، باستثناء CaCl 2 ، إلى 2 لتر من الماء المقطر.
- فقاعة الحل أعلاه مع carbogen (95٪ O 2 ، 5٪ CO 2) لمدة 5 دقائق وإضافة CaCl2.
ملاحظة: تمنع هذه الخطوة هطول الأمطار CaCl2 ، أي يجب ألا يتحول الحل إلى غائم. لتطبيق الدواء أثناء التجارب ، قم بتخفيف محاليل مخزون الدواء في aCSF إلى التركيزات النهائية المطلوبة.
- السائل الدماغي الشوكي الاصطناعي البديل للسكروز
ملاحظة: يستخدم aCSF البديل بالسكروز أثناء التشريح وتقطيع الحبل الشوكي. كما هو موضح بالاسم ، يتم استبدال السكروز بكلوريد الصوديوم لتقليل الإثارة العصبية أثناء هذه الإجراءات مع الحفاظ على الأسمولية. انظر الجدول 1 للاطلاع على التكوين التفصيلي.- تحضير aCSF بديل للسكروز يحتوي على (في mM) 250 السكروز ، 25 NaHCO3 ، 10 الجلوكوز ، 2.5 KCl ، 1 NaH 2 PO4 ، 1 MgCl 2 ، و 2.5 CaCl 2 عن طريق إضافة الكميات المطلوبة من كل ما سبق ، باستثناء CaCl 2 ، إلى 300 مل من الماء المقطر.
- فقاعة الحل مع كاربوجين لمدة 5 دقائق ثم إضافة CaCl2.
- قم بتخزين المحلول في ثلاجة -80 درجة مئوية لمدة 40 دقيقة تقريبا أو حتى يشكل المحلول ملطنا. تجنب تجميد المواد الصلبة واستخدامها أثناء اتساق الطين.
- إعداد مصفوفة القطب الدقيق
ملاحظة: يتطلب سطح التلامس في منطقة الشرق الأوسط وأفريقيا معالجة مسبقة لجعله محب للماء.- قبل التجربة، املأ MEA جيدا إما بمصل البقر الجنيني (FBS) أو مصل الحصان (HS) لمدة 30 دقيقة.
- قم بإزالة FBS أو HS وشطف MEA جيدا بحوالي خمس غسلات من الماء المقطر حتى لا يصبح الماء المقطر رغويا. املأ البئر ب aCSF ، جاهز للاستخدام.
- إعداد شريحة الحبل الشوكي الحادة
ملاحظة: إعداد شريحة الحبل الشوكي للفأر هو كما وصفه سابقا سميث وآخرون 2. من الناحية المثالية ، يجب ألا تستغرق إزالة التوسيع القطني العجزي أكثر من 8-10 دقائق (الخطوات 1.3.2-1.3.11 أدناه).- قم بتخدير الفأر بعمق باستخدام 100 مجم / كجم من الكيتامين (i.p) ثم قطع رأسه باستخدام مقص جراحي كبير.
- قم بإزالة الجلد فوق منطقة البطن عن طريق إجراء قطع صغير في الجلد على مستوى الوركين. اسحب الجلد على جانبي الجرح بشكل مستقيم حتى تتم إزالة الجلد بالكامل ، أي من أعلى القفص الصدري إلى أعلى الحوض (بطنيا وظهريا).
- ضع الجسم على الجليد واستخدم نهجا بطنيا لفضح العمود الفقري عن طريق إزالة جميع الأحشاء وقطع الأضلاع الجانبية إلى القص.
- قم بإزالة القفص الصدري البطني ، كل من الكتف (مقطوع عند T2 تقريبا) ، والأطراف السفلية والحوض (مقطوعة في الجزء العلوي من العجز تقريبا).
- انقل العمود الفقري وإعداد الأضلاع إلى حمام تشريح يحتوي على السكروز البارد المثلج aCSF. قم بتثبيت جميع الزوايا الأربع للتحضير (السطح البطني لأعلى) عن طريق وضع دبابيس عبر عضلات أسفل الظهر والأضلاع العلوية المرفقة.
- قم بإزالة جميع العضلات والأنسجة الضامة التي تغطي السطح البطني للفقرات باستخدام rongeurs وتحديد المنطقة الفقرية فوق التوسيع القطني العجزي ، والذي يقع تقريبا تحت الأجسام الفقرية T12 إلى L2.
- قم بإزالة جسم فقري ذيلي إلى منطقة التوسيع القطني العجزي لتوفير الوصول إلى الحبل الشوكي أثناء جلوسه في القناة الفقرية.
- باستخدام مقص زنبركي منحني ، قم بقطع عنيقات العمود الفقري بشكل ثنائي أثناء رفع وسحب الجسم الفقري بشكل كبير لفصل الجوانب البطنية والظهرية للفقرات وفضح الحبل الشوكي.
- بمجرد إزالة الأجسام الفقرية للكشف عن التوسيع القطني العجزي ، قم بمسح الجذور المتبقية بعناية التي تثبت الحبل الشوكي بمقص زنبركي حتى يطفو الحبل بحرية.
- اعزل الحبل الشوكي بجروح في السطح والذيلية أعلى وأسفل التوسيع القطني العجزي، مما يسمح للمنطقة المستهدفة من الحبل "بالطفو بحرية".
ملاحظة: سيحدد اتجاه الشريحة المفضل كيفية تركيب السلك لاحقا للتقسيم (الشكل 1). - بالنسبة للشرائح المستعرضة، ارفع الجزء القطني العجزي بواسطة جذر متصل وضعه على كتلة من البوليسترين (الستايروفوم) المقطوعة مسبقا (1 سم × 1 سم × 1 سم) مع قناة ضحلة مقطوعة في المنتصف. استخدم لاصق سيانو أكريليت (انظر جدول المواد) لتوصيل الكتلة والحبل بمنصة التقسيم ووضعها في حمام القطع الذي يحتوي على السكروز البارد المثلج aCSF (الطين).
ملاحظة: تساعد القناة الضحلة على تأمين الحبل الشوكي وتوجيهه، مع تعرض الجانب الظهري والطرف الصدري للحبل في أسفل الكتلة. - بالنسبة للشرائح السهمية ، ضع خطا رفيعا من لاصق cyanoacrylate على منصة التقسيم ، وارفع التوسيع القطني العجزي بواسطة جذر متصل ، وضع الحبل على طول خط الغراء ، مما يضمن وجود سطح جانبي واحد في المادة اللاصقة والوجوه الأخرى لأعلى. ضعه في حمام القطع الذي يحتوي على السكروز البارد المثلج aCSF (الطين).
- بالنسبة للشرائح الأفقية ، ضع خطا رفيعا من لاصق سيانو أكريليت على منصة التقسيم. ارفع التوسيع القطني العجزي بواسطة جذر متصل ، وضع التوسيع القطني العجزي على طول خط المادة اللاصقة ، مما يضمن وجود السطح البطني في المادة اللاصقة والسطح الظهري متجها لأعلى. استخدم الجذور المرفقة لوضع السلك. ضعه في حمام القطع الذي يحتوي على السكروز البارد المثلج aCSF (الطين).
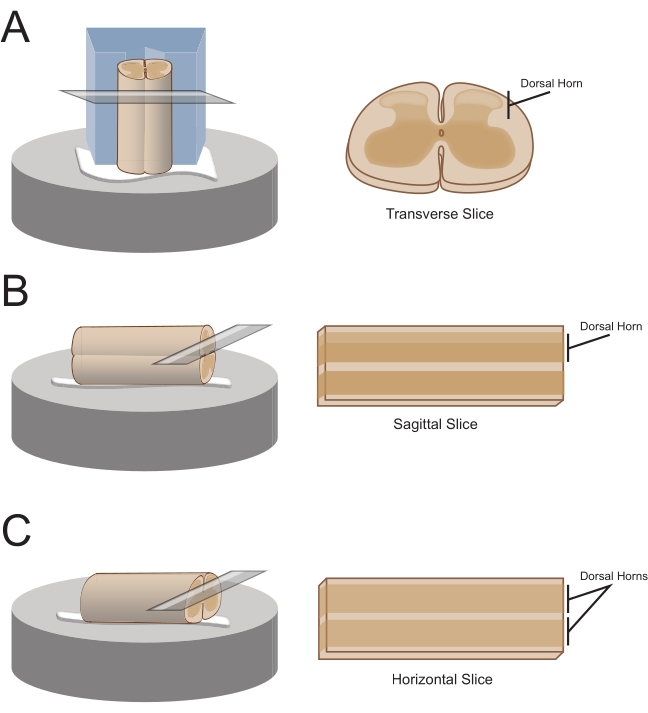
الشكل 1: اتجاهات شرائح الحبل الشوكي وطرق التركيب والقطع. (أ) تتطلب الشرائح المستعرضة كتلة قطع من الستايروفوم مع أخدود داعم مقطوع فيها. يستريح الحبل الشوكي ضد الكتلة الموجودة في أخدود الدعم ، والجانب الظهري من الحبل يواجه بعيدا عن الكتلة. يتم لصق الكتلة والحبل على مرحلة القطع باستخدام مادة لاصقة cyanoacrylate. (ب) يتم تحضير شرائح القوس عن طريق وضع خط رفيع من لاصق سيانواكريليت على مرحلة القطع ثم وضع الحبل الشوكي على جانبه على الغراء. (ج) يتم تحضير الشرائح الأفقية عن طريق وضع خط رفيع من لاصق سيانواكريليت على مرحلة القطع ثم وضع الجانب البطني للحبل الشوكي لأسفل على الغراء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- احصل على شرائح بسماكة 300 ميكرومتر (L1-L5، بنفس السماكة بغض النظر عن الاتجاه) باستخدام ميكروتوم يهتز مع الإعدادات التالية: السرعة 0.06 مم/ثانية، والسعة 2.50 مم، ومعايرتها إلى ضمن انحراف سعة الارتفاع ±0.02.
- انقل الشرائح إلى غرفة حضانة واجهة الهواء التي تحتوي على aCSF المؤكسج.
- قبل التسجيل ، اسمح للشرائح بالتوازن لمدة 1 ساعة في درجة حرارة الغرفة (20-24 درجة مئوية).
- تسجيلات مصفوفة ميكروكترود
ملاحظة: توضح الخطوات التالية بالتفصيل كيفية استخدام بيانات السجل من التجارب القائمة على الاتفاقات البيئية المتعددة الأطراف على شرائح الحبل الشوكي. يمكن استخدام العديد من تصاميم MEA اعتمادا على التجربة. وترد تفاصيل تصميم الاتفاقات البيئية المتعددة الأطراف المستخدمة في هذه التجارب في الجدول 2 و الشكل 2. تم نشر معلومات التصميم التفصيلية من قبل Egert et al.26 وثيبو وآخرون.27 للاتفاقات البيئية المتعددة الأطراف المستوية وثلاثية الأبعاد (3D)، على التوالي. يتكون كلا النوعين من MEA من 60 قطبا كهربائيا من نيتريد التيتانيوم ، مع طبقة عازلة من نيتريد السيليكون ومسارات نيتريد التيتانيوم ومنصات الاتصال.- الإعداد التجريبي
- قم بتشغيل الكمبيوتر ولوحة الواجهة ، وابدأ تشغيل برنامج التسجيل.
- قم بتحميل قالب التسجيل الذي تم تجميعه مسبقا (الشكل 3A). قم بتسمية الملفات الخاصة باليوم في علامة التبويب المسجل.
- فقاعة aCSF باستمرار مع carbogen (5٪ CO 2 ، 95٪ O2) طوال مدة التجربة.
- قم بتشغيل نظام التروية ، الذي يتم التحكم فيه بواسطة مضخة تمعجية. ضع خط المدخل في aCSF ونهاية المدخل في كوب نفايات. قم بتعبئة خطوط التروية باستخدام aCSF.
- تحضير 4-AP وأي حلول دوائية أخرى عن طريق تخفيف المخزونات في 50 مل من aCSF إلى التركيز النهائي المطلوب (على سبيل المثال ، 200 ميكرومتر ل 4-AP).
- ضع المحاليل الدوائية في أواني الأدوية وقم بفقاعتها بمادة مكربوجينة.
- 4-نشاط AP
- بعد الحضانة ، انقل شريحة واحدة من الحاضنة باستخدام ماصة باستور كبيرة الطرف مليئة ب aCSF.
- ضع الشريحة في MEA جيدا وأضف aCSF إضافيا.
- ضع الشريحة فوق صفيف التسجيل المكون من 60 قطبا كهربائيا باستخدام فرشاة طلاء شعر قصيرة ناعمة. تجنب ملامسة الأقطاب الكهربائية بفرشاة الطلاء أو سحب الأنسجة عبر الأقطاب الكهربائية ، خاصة إذا كنت تستخدم صفائف 3D.
ملاحظة: اعتمادا على تخطيط MEA ، يمكن القيام بذلك بمساعدة أو بدون مساعدة من المجهر لتحديد المواقع بدقة. - بعد وضع الشريحة، ضع شبكة مرجحة فوق الأنسجة لتثبيتها في مكانها وتعزيز الاتصال الجيد مع أقطاب MEA.
ملاحظة: قد تحتاج الشريحة إلى تغيير موضعها بعد الموضع الصافي. - ضع MEA في منصة التسجيل (الشكل 2A و B).
- تحقق من موضع الأنسجة فوق الأقطاب الكهربائية باستخدام مجهر مقلوب (تكبير 2x) للتأكد من أن أكبر عدد ممكن من الأقطاب الكهربائية تحت DH السطحي (SDH). تأكد من أن 2-6 أقطاب كهربائية على الأقل لا تتصل بالشريحة لأن هذه الأقطاب الكهربائية مهمة لطرح الضوضاء وتسجيل القطع الأثرية أثناء التحليل (الشكل 2E).
- قم بتشغيل الكاميرا، وتوصيلها بالجهاز، والتقاط صورة مرجعية للشريحة المتعلقة ب MEA لاستخدامها أثناء التحليل.
- اضغط على Start DAQ في برنامج التسجيل، وتأكد من أن جميع الأقطاب الكهربائية تتلقى إشارة واضحة.
ملاحظة: إذا كانت الإشارة صاخبة، فقم بفك الغطاء الرأسي وتنظيف كل من وسادات التلامس MEA وجهات اتصال زنبرك الذهب بنسبة 70٪ من الإيثانول (استخدم مسحة مخبرية للتأكد من جفاف الفوط وجهات الاتصال بعد التنظيف). إذا كانت الإشارة لا تزال صاخبة، فقم بإيقاف تشغيل الأقطاب الكهربائية المعطوبة في برنامج التسجيل أو قم بتدوين الملاحظات لاستبعادها لاحقا أثناء التحليل. - قم بتوصيل خطوط مدخل ومخرج التروية ببئر MEA (المملوء سابقا ب aCSF) وقم بتشغيل نظام التروية. تحقق من معدل التدفق ، من الناحية المثالية 4-6 أحجام حمام في الدقيقة ، وتأكد من أن التدفق الخارجي كاف لمنع تجاوز الفوسات.
- اسمح للنسيج بالتوازن لمدة 5 دقائق ثم سجل 5 دقائق من بيانات خط الأساس الخام غير المصفاة.
- حرك خط مدخل التروية من aCSF إلى محلول 4-AP وانتظر لمدة 12 دقيقة حتى يصل النشاط الإيقاعي الناجم عن 4-AP إلى حالة ثابتة (دقيقتان للأدوية للوصول إلى الحمام و 10 دقائق حتى يصل النشاط إلى ذروته ثم الهضبة).
- سجل 5 دقائق من النشاط الناجم عن 4-AP. كن مستعدا للتسجيلات اللاحقة لاختبار الأدوية أو للتحقق من استقرار 4-AP.
- الإعداد التجريبي
| تخطيطات مصفوفة القطب الصغير | ||||
| نموذج مصفوفة القطب الصغير | 60MEA 200/30iR-Ti | 60-3DMEA 100/12/40iR-Ti | 60-3DMEA 200/12/50iR-Ti | 60MEA 500/30iR-Ti |
| مستوية أو ثلاثية الأبعاد (3D) | مستو | 3D | 3D | مستو |
| شبكة القطب الكهربائي | 8 × 8 | 8 × 8 | 8 × 8 | 6 × 10 |
| تباعد القطب الكهربائي | 200 ميكرومتر | 100 ميكرومتر | 200 ميكرومتر | 500 ميكرومتر |
| قطر القطب الكهربائي | 30 ميكرومتر | 12 ميكرومتر | 12 ميكرومتر | 30 ميكرومتر |
| ارتفاع القطب الكهربائي (3D) | غير متوفر | 40 ميكرومتر | 50 ميكرومتر | غير متوفر |
| التجارب | شريحة عرضية | شريحة عرضية | القوس + أفقي | القوس + أفقي |
الجدول 2: تخطيطات صفيف القطب الدقيق.
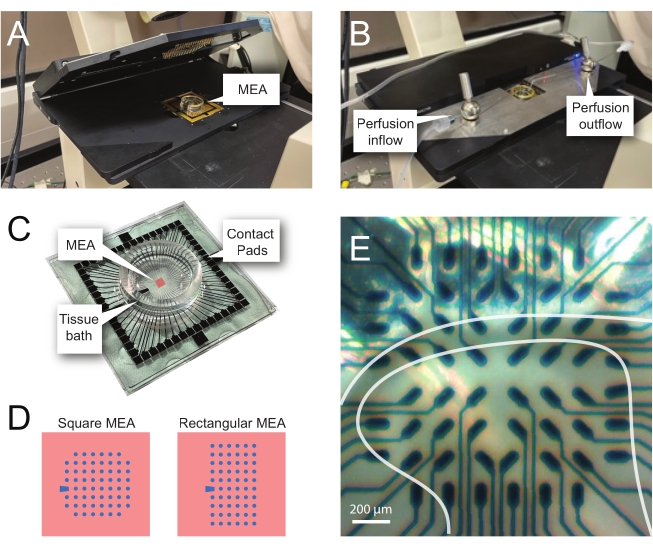
الشكل 2: وضع الأنسجة على مصفوفة القطب الدقيق . (أ) تظهر الصورة منصة أمامية مفتوحة في الشرق الأوسط وأفريقيا مع وضع MEA في موضعها. (ب) نفس المستوى ألف مع إغلاق منصة MEA الرئيسية للتسجيلات ونظام تروية الأنسجة المعمول به. (ج) تظهر الصورة شركة طيران الشرق الأوسط كما قدمتها الشركة المصنعة. يتم عرض منصات الاتصال ، التي تتفاعل مع الينابيع الذهبية للرأس ، وحمام الأنسجة MEA الذي يحمل محلول استحمام الأنسجة وشريحة الأنسجة. المنطقة التي أبرزها المربع الأحمر في الوسط هي موقع صفيف القطب الكهربائي. (د) تبين المخططات تكوينين قطبي MEA المستخدمين في هذه الدراسة، مع مزيد من التفاصيل في الجدول 2. يشار إلى القطب المرجعي بواسطة شبه المنحرف الأزرق. يظهر تخطيط القطب الكهربائي الأيسر MEA تكوينا مربعا من 60 قطبا كهربائيا ، يستخدم أكثر في نماذج العمل المقدمة 60MEA200/30iR-Ti مع أقطاب قطرها 30 ميكرومتر متباعدة 200 ميكرومتر ، أو 200 ميكرومتر متباعدة و 100 ميكرومتر متباعدة 3 أبعاد MEAs (60MEA200/12/50iR-Ti و 60MEA100/12/40iR-Ti) مع أقطاب كهربائية قطرها 12 ميكرومتر وإما 50 ميكرومتر أو 40 ميكرومتر ، على التوالي. يظهر تخطيط القطب الأيسر MEA تخطيطا مستطيلا للأقطاب الكهربائية 6 × 10-60MEA500/30iR-Ti. (ه) صورة عالية التكبير لمربع MEA 60MEA100/12/40iR-Ti مع شريحة مستعرضة للحبل الشوكي موضوعة للتسجيل. تقع الشريحة على صفوف القطب الكهربائي 3-8. الصف العلوي من الأقطاب الكهربائية ، التي لا تتصل بأي نسيج ، بمثابة أقطاب كهربائية. تظهر منطقة SDH كنطاق شبه شفاف. في هذه الحالة ، يعلو SDH الأقطاب الكهربائية في الصفوف 4 و 5 و 6 والأعمدة 2 و 3 و 4 و 5 و 7 من MEA. شريط المقياس = 200 ميكرومتر. الاختصارات: MEA = مصفوفة الأقطاب الكهربائية الدقيقة; SDH = القرن الظهري السطحي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تغيير الشرائح
- بعد كل جلسة تسجيل، اشطف الخطوط باستخدام aCSF.
- أزل MEA من المنصة.
- قم بإزالة الشبكة والأنسجة من MEA جيدا ، وشطفها جيدا باستخدام aCSF ، وكرر الخطوات المذكورة أعلاه بشريحة جديدة.
2. معالجة البيانات وتحليلها
ملاحظة: توضح الخطوات التالية بالتفصيل كيفية استخدام برنامج التحليل لتجارب الشرق الأوسط وأفريقيا على شرائح الحبل الشوكي. يعمل أحد الأقطاب الكهربائية ال 60 كمرجع داخلي (يتميز بشبه منحرف في الشكل 2 C ، D) ، في حين يتم وضع ما بين أربعة وخمسة وعشرين من ال 59 المتبقية تحت SDH في شريحة الحبل الشوكي للفأر البالغ. يكتشف التحليل اللاحق إمكانات العمل خارج الخلية (EAP) والأشكال الموجية لإمكانات المجال المحلي (LFP) (انظر الشكل 3B للحصول على أمثلة) من الإشارة الخام في هذه المنطقة.
- معالجة البيانات الخام
- افتح برنامج التحليل وقم بتحميل تخطيط التحليل المصنوع مسبقا (الشكل 3B).
- افتح الملف محل الاهتمام وقم بإلغاء تحديد القطب المرجعي (القطب الكهربائي 15 في 8 × 8 MEA- أو القطب E1 في تكوين 6 × 10 MEA) وأي أقطاب كهربائية تعتبر صاخبة بشكل مفرط.
- اضبط الإطار الزمني للتحليل (0:00 → 5:00 دقيقة).
- الانتقال إلى علامة التبويب عامل تصفية عبر القنوات . حدد مرجعا معقدا وحدد الأقطاب الكهربائية المرجعية بناء على الصورة التي تم التقاطها والملاحظات التي تم إجراؤها أثناء التجربة (أي تلك الأقطاب الكهربائية التي ليست تحت الأنسجة). للتطبيق والتحقق من ذلك، اضغط على استكشاف قبل المتابعة.
- انتقل إلى علامة تبويب مرشح EAP وقم بتطبيق مرشح Butterworth عالي التمرير بالترتيبالثاني (200 هرتز مقطوع) لإزالة نشاط LFP.
- انتقل إلى علامة تبويب مرشح LFP وقم بتطبيق مرشح Butterworth لتمرير النطاق2 من أجل الثاني (ترددات دلتا من 0.5-4 هرتز) لإزالة نشاط EAP.
- انتقل إلى علامة التبويب كاشف EAP وحدد عتبة تلقائية. حدد مربعات الحافة الصاعدة والمنخفضة واضبط الوقت الميت على 0.5 مللي ثانية.
- تعيين عتبات إيجابية وسلبية استنادا إلى البيانات. افحص البيانات عن طريق العودة إلى شاشة محلل بيانات Raw، وتحريك علامة الوقت، ثم العودة إلى علامة التبويب كاشف EAP والضغط على استكشاف. كرر ذلك حتى تقتنع بأن عتبة الكشف المحددة تلتقط EAPs دون التقاط الضوضاء / النشاط غير الفسيولوجي. استخدم الأقطاب الكهربائية المرجعية لتحديد الضوضاء / النشاط غير الفسيولوجي.
ملاحظة: من الضروري التأكد من اكتشاف الحد الأدنى من EAPs في الأقطاب الكهربائية المرجعية حيث لن يحدث نشاط فسيولوجي. ومع ذلك ، قد يتم اكتشاف انحرافات طفيفة إلى حد ما في خط الأساس بشكل خاطئ على أنها EAPs. هذا في حين لا يزال يهدف إلى زيادة عدد الأحداث الحقيقية المكتشفة في الأقطاب الكهربائية النشطة. - انتقل إلى علامة التبويب كاشف LFP ، وحدد العتبة اليدوية ، وحدد مربعات الحافة الصاعدة والهابطة ، واضبط الوقت الميت على 3 مللي ثانية.
- كرر الخطوة 2.1.8 لقطب واحد عن طريق تحديد قطب كهربائي مع نشاط LFP. بمجرد الرضا، حدد تطبيق على الجميع حيث سيتم تطبيق العتبات فقط على قطب كهربائي واحد عند إجراء العتبة اليدوية.
- أثناء فحص بيانات LFP في علامة التبويب Detector ، لاحظ الحد الأقصى لعدد معابر العتبة للشكل الموجي LFP الواحد والحد الأقصى للفصل الزمني لمعابر العتبة للشكل الموجي LFP الواحد للاستخدام في التحليل اللاحق.
- اضغط على بدء التحليل.
- عند اكتمال التحليل، انتقل إلى علامة التبويب محلل EAP وقم بتصدير البيانات. افعل الشيء نفسه في علامة التبويب محلل LFP .
- كرر هذه العملية لكافة الملفات الأخرى من نفس الشريحة.
- بعد تصدير البيانات ، قم بتحويل الملفات إلى تنسيق xlsx بحيث يمكن قراءتها بواسطة البرنامج النصي للبرمجة المستخدم. قم بتسمية الملفات وفقا للاصطلاح التالي للبرنامج النصي المقدم لقراءتها: اسم التجربة (على سبيل المثال ، بيانات العينة) - رقم الشريحة (على سبيل المثال ، S1) - رقم التسجيل (على سبيل المثال ، R1) - نوع النشاط (على سبيل المثال ، المسامير أو SPs ، المقابلة ل EAPs أو LFPs ، على التوالي).
ملاحظة: يعامل تحليل EAP الموصوف هنا الارتفاع من القنوات الفردية كمجموعة سكانية واحدة ، على الرغم من أن هذا النشاط ينشأ عادة من خلايا عصبية متعددة على مقربة من قطب التسجيل. إذا كان عدد الخلايا العصبية التي تساهم في EAPs في قناة ما مرغوبا فيه ، فيمكن تطبيق تقنيات الفرز متعددة السنبلة الموصوفة في مكان آخر للتمييز بين مجموعات متميزة من المسامير بناء على خصائص الشكل الموجي28.
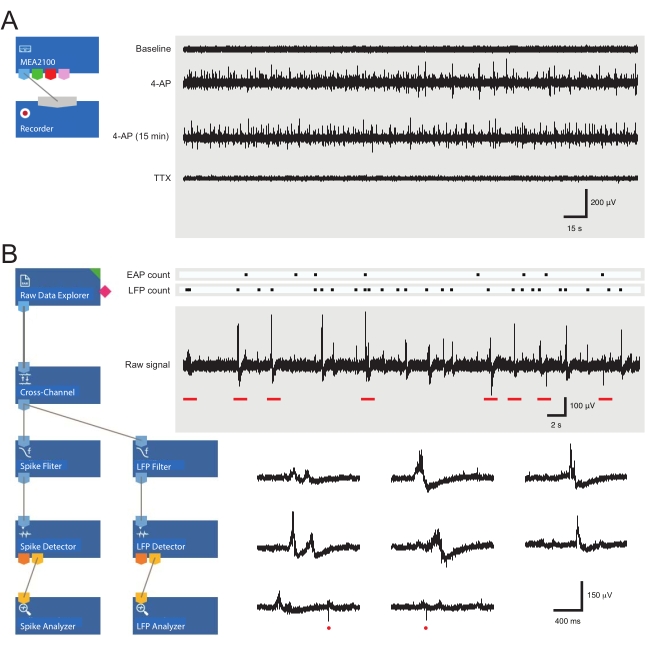
الشكل 3: تخطيطات أدوات تسجيل البيانات وتحليلها وتسجيلات مصفوفة الأقطاب الدقيقة على سبيل المثال التي تظهر إمكانات العمل خارج الخلية والأشكال الموجية المحتملة للمجال المحلي . (أ) يوضح المخطط قالب التسجيل المكون مسبقا المستخدم للحصول على بيانات MEA. يتيح ربط MEA2100 وأداة التسجيل (الرأس / مكبر الصوت) تسمية البيانات وحفظها. تم جمع أربعة أمثلة على آثار البيانات الخام (يمين، عصور مدتها 5 دقائق) بواسطة قناة MEA واحدة تظهر النشاط عند خط الأساس، و 12 دقيقة بعد تطبيق 4-AP، و 15 دقيقة أخرى بعد نشاط 4-AP المحدد، وبعد تطبيق حمام TTX (1 ميكرومتر). لاحظ أن إضافة 4-AP (التتبع الثاني) تنتج زيادة واضحة في ضوضاء الخلفية ونشاط EAP / LFP. الأهم من ذلك ، أن النشاط يظل مستقرا نسبيا لمدة 15 دقيقة على الأقل بعد إنشاء النشاط الناجم عن 4-AP (التتبع الثالث). إضافة TTX (1 ميكرومتر) يلغي كل نشاط (تتبع القاع). (ب) يعرض المخطط (يسار) تكوين برنامج المحلل لتحليل البيانات. يتم استخدام أداة مستكشف البيانات الخام لاستيراد التسجيلات التي تم جمعها بواسطة برنامج التسجيل. ثم يتم تشغيل هذه البيانات من خلال أداة تصفية عبر القنوات تطرح إشارة (إشارات) القطب (الأقطاب الكهربائية) المرجعية المحددة من الأقطاب الكهربائية الأخرى لإزالة ضوضاء الخلفية. تمر البيانات عبر مرشح EAP وأدوات مرشح LFP لتحسين علاقات الإشارة إلى الضوضاء لكل شكل موجي. باتباع هذه الخطوة، تدخل بيانات مسار EAP أداة كاشف EAP، حيث يتم تعيين العتبات. يتم الكشف عن EAPs ثم إرسالها إلى أداة محلل EAP حيث يتم تسجيل زمن الانتقال لكل حدث وتصديره ك txt. ملف. يحدث سير عمل متطابق لبيانات LFP باستخدام مجموعة أدوات LFP مقابلة. تظهر الآثار الصحيحة بيانات من قناة MEA واحدة تحتوي على أشكال موجية مختلفة خارج الخلية. يتم تمييز موقع إشارات EAP و LFP في "حساب البيانات النقطية" أعلاه. الآثار السفلية هي عصور من التسجيل العلوي (يشار إليها بأشرطة حمراء) تظهر الأشكال الموجية على مقياس زمني موسع ، بما في ذلك إشارات LFP المختلفة (لاحظ تنوع المظاهر) و EAPs الفردية خارج الخلية (الدوائر الحمراء). لاحظ أن الشكل الموجي والقطبية LFP / EAP يختلفان بالنسبة لعدد الخلايا العصبية التي تنتج هذه الإشارات ، وقربها من قطب التسجيل ، وموقعها فيما يتعلق بالقطب (الأقطاب القريبة). الاختصارات: MEA = مصفوفة الأقطاب الكهربائية الدقيقة; EAP = إمكانات العمل خارج الخلية. LFP = إمكانات المجال المحلي; 4-AP = 4-أمينوبيريدين ؛ TTX = تيترودوتوكسين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تحليل التزامن
ملاحظة: تم تحديد التزامن ، أو عدد الأحداث "المصادفة" بين قطبين كهربائيين ، باستخدام معيار الصدفة ضمن طريقة A-SPIKE-synchronization التي حددها Satuvuori et al. 29. يقارن البرنامج النصي المستخدم هنا فقط الأقطاب الكهربائية المتجاورة مع بعضها البعض من أجل الكفاءة (أي الجيران الأفقيين والرأسيين والقطريين) ؛ ومع ذلك ، يمكن إعادة كتابة البرنامج النصي لمقارنة جميع الأقطاب الكهربائية إذا لزم الأمر.- قم بإجراء تحليل البيانات باستخدام برنامج نصي مخصص للبرمجة ، والذي يستخرج الطوابع الزمنية لزمن الوصول لكل قطب كهربائي من ملفات .xlsx.
ملاحظة: يمكن القيام بذلك يدويا. - في الخطوة 2.1.11 ، سجل الحد الأقصى لعدد معابر العتبة والحد الأقصى للفصل الزمني لمعابر العتبة للشكل الموجي LFP الواحد. قم بتعديل البرنامج النصي لإدخال معلمات تعريف LFP هذه لكل شريحة قبل تشغيل البرنامج النصي.
ملاحظة: العتبة التي تم إجراؤها سابقا في برنامج التحليل تلتقط بوضوح EAPs كحدث واحد. ومع ذلك ، تتكون LFPs من عدد متغير من القمم اعتمادا على شكل الشكل الموجي والعدد اللاحق من عبور العتبة بواسطة حدث واحد. - قم بتعديل البرنامج النصي لإدخال الأقطاب الكهربائية ذات الأهمية قبل التحليل.
- لتحديد التزامن (المعرف في البرنامج النصي بواسطة أطر زمنية قابلة للتعديل للنشاط المتزامن الذي سيحدث داخلها) ، قم بفصل وتحليل زمن الاستجابة المستخرجة للكشف عن الأحداث المتزامنة.
ملاحظة: يسمح البرنامج النصي بتعيين الحد الأقصى للوقت بين الأحداث المتزامنة. يتم تعيين هذه في 20 مللي ثانية ل EAPs و 200 مللي ثانية ل LFPs. - قم بتشغيل البرنامج النصي لاستخراج الطوابع الزمنية الكمون.
ملاحظة: يحتوي ملف الإخراج .xlsx على تفسيرات بيانات الكمون، وهي أعداد EAP وLFP والترددات وعدد الأحداث المتزامنة للأقطاب الكهربائية الفردية والشرائح الكاملة. تستخدم هذه البيانات لتقييم التردد ، وعدد EAP / LFP ، وعدد الأقطاب الكهربائية النشطة ، وعدد الأحداث المتزامنة ، وعدد الأقطاب الكهربائية المرتبطة ، ومتوسط قوة هذه الروابط.
- قم بإجراء تحليل البيانات باستخدام برنامج نصي مخصص للبرمجة ، والذي يستخرج الطوابع الزمنية لزمن الوصول لكل قطب كهربائي من ملفات .xlsx.
النتائج
نموذج نشاط الشبكة في القرن الظهري للحبل الشوكي
تطبيق 4-AP يحفز بشكل موثوق النشاط الإيقاعي المتزامن في الحبل الشوكي DH. ويمثل هذا النشاط زيادة في EAPs و LFPs. الإشارة اللاحقة هي شكل موجي منخفض التردد ، والذي تم وصفه سابقا في تسجيلات MEA30. تعكس التغيرات في نشاط EAP و / أو LFP بعد تط...
Discussion
على الرغم من أهمية DH الشوكي في الإشارات المسببة للألم والمعالجة والاستجابات السلوكية والعاطفية الناتجة التي تميز الألم ، إلا أن الدوائر داخل هذه المنطقة لا تزال غير مفهومة بشكل جيد. كان التحدي الرئيسي في التحقيق في هذه المشكلة هو تنوع مجموعات الخلايا العصبية التي تشكل هذه الدوائر
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان.
Acknowledgements
تم تمويل هذا العمل من قبل المجلس الوطني للصحة والبحوث الطبية (NHMRC) في أستراليا (منح 631000 ، 1043933 ، 1144638 ، 1184974 إلى B.A.G. و R.J.C.) ومعهد هنتر للبحوث الطبية (منحة إلى B.A.G. و R.J.C.).
Materials
| Name | Company | Catalog Number | Comments |
| 4-aminopyridine | Sigma-Aldrich | 275875-5G | |
| 100% ethanol | Thermo Fisher | AJA214-2.5LPL | |
| CaCl2 1M | Banksia Scientific | 0430/1L | |
| Carbonox (Carbogen - 95% O2, 5% CO2) | Coregas | 219122 | |
| Curved long handle spring scissors | Fine Science Tools | 15015-11 | |
| Custom made air interface incubation chamber | |||
| Foetal bovine serum | Thermo Fisher | 10091130 | |
| Forceps Dumont #5 | Fine Science Tools | 11251-30 | |
| Glucose | Thermo Fisher | AJA783-500G | |
| Horse serum | Thermo Fisher | 16050130 | |
| Inverted microscope | Zeiss | Axiovert10 | |
| KCl | Thermo Fisher | AJA383-500G | |
| Ketamine | Ceva | KETALAB04 | |
| Large surgical scissors | Fine Science Tools | 14007-14 | |
| Loctite 454 Instant Adhesive | Bolts and Industrial Supplies | L4543G | |
| MATLAB | MathWorks | R2018b | |
| MEAs, 3-Dimensional | Multichannel Systems | 60-3DMEA100/12/40iR-Ti, 60-3DMEA200/12/50iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in an 8x8 square grid. Electrodes are 12 µm in diameter, 40 µm (100/12/40) or 50 µm (200/12/50) high and equidistantly spaced 100 µm (100/12/40) or 200 µm (200/12/50) apart. |
| MEA headstage | Multichannel Systems | MEA2100-HS60 | |
| MEA interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot | |
| MEA net | Multichannel Systems | ALA HSG-MEA-5BD | |
| MEA perfusion system | Multichannel Systems | PPS2 | |
| MEAs, Planar | Multichannel Systems | 60MEA200/30iR-Ti, 60MEA500/30iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in either a 8x8 square grid (200/30) or a 6x10 rectangular grid (500/30). Electrodes are 30 µm in diameter and equidistantly spaced 200 µm (200/30) or 500 µm (500/30) apart. |
| MgCl2 | Thermo Fisher | AJA296-500G | |
| Microscope camera | Motic | Moticam X Wi-Fi | |
| Multi Channel Analyser software | Multichannel Systems | V 2.17.4 | |
| Multi Channel Experimenter software | Multichannel Systems | V 2.17.4 | |
| NaCl | Thermo Fisher | AJA465-500G | |
| NaHCO3 | Thermo Fisher | AJA475-500G | |
| NaH2PO4 | Thermo Fisher | ACR207805000 | |
| Rongeurs | Fine Science Tools | 16021-14 | |
| Small spring scissors | Fine Science Tools | 91500-09 | |
| Small surgical scissors | Fine Science Tools | 14060-09 | |
| Sucrose | Thermo Fisher | AJA530-500G | |
| Superglue | cyanoacrylate adhesive | ||
| Tetrodotoxin | Abcam | AB120055 | |
| Vibration isolation table | Newport | VH3048W-OPT | |
| Vibrating microtome | Leica | VT1200 S |
References
- Smith, K. M., et al. Calretinin positive neurons form an excitatory amplifier network in the spinal cord dorsal horn. eLife. 8, 49190 (2019).
- Smith, K. M., et al. Functional heterogeneity of calretinin-expressing neurons in the mouse superficial dorsal horn: implications for spinal pain processing. The Journal of physiology. 593 (19), 4319-4339 (2015).
- Boyle, K. A., et al. Defining a spinal microcircuit that gates myelinated afferent input: Implications for tactile allodynia. Cell Reports. 28 (2), 526-540 (2019).
- Browne, T. J., et al. Transgenic cross-referencing of inhibitory and excitatory interneuron populations to dissect neuronal heterogeneity in the dorsal horn. Frontiers in Molecular Neuroscience. 13, 32 (2020).
- Graham, B. A., Hughes, D. I. Rewards, perils and pitfalls of untangling spinal pain circuits. Current Opinion in Physiology. 11, 35-41 (2019).
- Todd, A. J. Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience. 11 (12), 823-836 (2010).
- Hughes, D. I., Todd, A. J. Central nervous system targets: inhibitory interneurons in the spinal cord. Neurotherapeutics. 17 (3), 874-885 (2020).
- Duan, B., et al. Identification of spinal circuits transmitting and gating mechanical pain. Cell. 159 (6), 1417-1432 (2014).
- Hachisuka, J., Chiang, M. C., Ross, S. E. Itch and neuropathis itch. Pain. 159 (3), 603 (2018).
- Foster, E., et al. Targeted ablation, silencing, and activation establish glycinergic dorsal horn neurons as key components of a spinal gate for pain and itch. Neuron. 85 (6), 1289-1304 (2015).
- Bourane, S., et al. Identification of a spinal circuit for light touch and fine motor control. Cell. 160 (3), 503-515 (2015).
- Cheng, L., et al. Identification of spinal circuits involved in touch-evoked dynamic mechanical pain. Nature neuroscience. 20 (6), 804-814 (2017).
- Peirs, C., et al. Mechanical allodynia circuitry in the dorsal horn is defined by the nature of the injury. Neuron. 109 (1), 73-90 (2021).
- Huang, J., et al. Circuit dissection of the role of somatostatin in itch and pain. Nature Neuroscience. 21 (5), 707-716 (2018).
- Obien, M. E. J., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 8, 423 (2015).
- Nam, Y., Wheeler, B. C. In vitro microelectrode array technology and neural recordings. Critical Reviews in Biomedical Engineering. 39 (1), 45-61 (2011).
- Johnstone, A. F., et al. Microelectrode arrays: a physiologically based neurotoxicity testing platform for the 21st century. Neurotoxicology. 31 (4), 331-350 (2010).
- Stett, A., et al. Biological application of microelectrode arrays in drug discovery and basic research. Analytical and Bioanalytical Chemistry. 377 (3), 486-495 (2003).
- Xu, L., et al. Trends and recent development of the microelectrode arrays (MEAs). Biosensors and Bioelectronics. 175 (1), 112854 (2020).
- Chapman, R. J., Cilia La Corte, P. F., Asghar, A. U. R., King, A. E. Network-based activity induced by 4-aminopyridine in rat dorsal horn in vitro is mediated by both chemical and electrical synapses. The Journal of Physiology. 587, 2499-2510 (2009).
- Ruscheweyh, R., Sandkühler, J. Epileptiform activity in rat spinal dorsal horn in vitro has common features with neuropathic pain. Pain. 105 (1-2), 327-338 (2003).
- Kay, C. W., Ursu, D., Sher, E., King, A. E. The role of Cx36 and Cx43 in 4-aminopyridine-induced rhythmic activity in the spinal nociceptive dorsal horn: an electrophysiological study in vitro. Physiological Reports. 4 (14), 12852 (2016).
- Jankowska, E., Lundberg, A., Rudomin, P., Sykova, E. Effects of 4-aminopyridine on synaptic transmission in the cat spinal cord. Brain Research. 240 (1), 117-129 (1982).
- Semba, K., Geller, H. M., Egger, M. D. 4-Aminopyridine induces expansion of cutaneous receptive fields of dorsal horn cells. Brain Research. 343 (2), 398-402 (1985).
- Ruscheweyh, R., Sandkühler, J. Long-range oscillatory Ca2+ waves in rat spinal dorsal horn. European Journal of Neuroscience. 22 (8), 1967-1976 (2005).
- Egert, U., et al. A novel organotypic long-term culture of the rat hippocampus on substrate-integrated multielectrode arrays. Brain Research Protocols. 2 (4), 229-242 (1998).
- Thiebaud, P., De Rooij, N., Koudelka-Hep, M., Stoppini, L. Microelectrode arrays for electrophysiological monitoring of hippocampal organotypic slice cultures. IEEE Transactions on Biomedical Engineering. 44 (11), 1159-1163 (1997).
- Rey, H. G., Pedreira, C., Quiroga, R. Q. Past, present and future of spike sorting techniques. Brain Research Bulletin. 119, 106-117 (2015).
- Satuvuori, E., et al. Measures of spike train synchrony for data with multiple time scales. Journal of Neuroscience Methods. 287, 25-38 (2017).
- Mendis, G. D. C., Morrisroe, E., Reid, C. A., Halgamuge, S. K., Petrou, S. Use of local field potentials of dissociated cultures grown on multi-electrode arrays for pharmacological assays. 38th Annual International Conference of the IEEE Engineering in Medicine and Biology Society. , 952-956 (2016).
- Hughes, D. I., et al. Morphological, neurochemical and electrophysiological features of parvalbumin-expressing cells: a likely source of axo-axonic inputs in the mouse spinal dorsal horn. The Journal of Physiology. 590 (16), 3927-3951 (2012).
- Peirs, C., Seal, R. P. Neural circuits for pain: recent advances and current views. Science. 354 (6312), 578-584 (2016).
- Li, J., Baccei, M. L. Developmental regulation of membrane excitability in rat spinal lamina I projection neurons. Journal of Neurophysiology. 107 (10), 2604-2614 (2012).
- Li, J., Baccei, M. L. Pacemaker neurons within newborn spinal pain circuits. Journal of Neuroscience. 31 (24), 9010-9022 (2011).
- Sandkühler, J., Eblen-Zajjur, A. Identification and characterization of rhythmic nociceptive and non-nociceptive spinal dorsal horn neurons in the rat. Neuroscience. 61 (4), 991-1006 (1994).
- Lucas-Romero, J., Rivera-Arconada, I., Roza, C., Lopez-Garcia, J. A. Origin and classification of spontaneous discharges in mouse superficial dorsal horn neurons. Scientific Reports. 8 (1), 9735-9735 (2018).
- Antonio, L., et al. L. al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. 260, 33-44 (2016).
- Avoli, M., Jefferys, J. G. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. 260, 26-32 (2016).
- Taccola, G., Nistri, A. Low micromolar concentrations of 4-aminopyridine facilitate fictive locomotion expressed by the rat spinal cord in vitro. Neuroscience. 126 (2), 511-520 (2004).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. Journal of Neurophysiology. 107 (2), 728-741 (2012).
- Egert, U., Heck, D., Aertsen, A. Two-dimensional monitoring of spiking networks in acute brain slices. Experimental Brain Research. 142 (2), 268-274 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved