このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
微小電極アレイを用いた脊髄侵害受容回路におけるネットワーク活動の記録
要約
脊髄後角におけるネットワークレベルの侵害受容活性を調査するための微小電極アレイ技術と4-アミノピリジン誘発化学刺激の併用が概説される。
要約
脊髄後角(DH)内の特定のタイプのニューロンの役割と接続性は、脊髄疼痛処理を支える回路のますます詳細なビューを提供するために、急速に描写されています。しかし、DHにおけるより広範なネットワーク活動に対するこれらの接続の効果は、ほとんどの研究が単一のニューロンおよび小さな微小回路の活動に焦点を当てているため、あまりよく理解されていないままである。あるいは、多くの細胞にわたる電気的活動を監視できる微小電極アレイ(MEA)の使用は、神経活動の高い空間的および時間的分解能を提供する。ここでは、4-アミノピリジン(4-AP)でDH回路を化学的に刺激することによって誘導されるDH活性を研究するために、マウス脊髄スライスを有するMEAの使用が記載されている。結果として生じるリズミカル活性は、表在DHに制限され、経時的に安定し、テトロドトキシンによって遮断され、異なるスライス配向で調査することができる。一緒に、この調製物は、ナイーブ動物、慢性疼痛の動物モデル、および遺伝的に変更された侵害受容機能を有するマウスからの組織におけるDH回路活性を調査するためのプラットフォームを提供する。さらに、4-AP刺激脊髄スライスにおけるMEA記録は、脊髄DHにおける活性を破壊する新規抗侵害受容性化合物の能力を評価するための迅速なスクリーニングツールとして使用することができる。
概要
脊髄DH内の特定のタイプの抑制性および興奮性介在ニューロンの役割は、急速な速度で明らかにされている1,2,3,4。一緒に、介在ニューロンはDHのニューロンの95%以上を占め、侵害受容を含む感覚処理に関与しています。さらに、これらのニューロン間回路は、末梢信号が神経軸を上昇して脳に到達し、痛みの知覚に寄与するかどうかを決定するために重要である5、6、7。今日まで、ほとんどの研究は、in vitro細胞内電気生理学、神経解剖学的標識、およびin vivo行動分析の組み合わせを用いて、単一細胞または生物全体の分析のいずれかでDHニューロンの役割を調査してきた1,3,8,9,10,11,12,13,14 .これらのアプローチは、疼痛処理における特定のニューロン集団の役割の理解を著しく進歩させた。しかし、特定の細胞型と小さなマクロ回路が、マイクロ回路レベルでニューロンの大規模な集団にどのように影響し、その後DHの出力、行動応答、および疼痛経験を形成するかを理解するには、ギャップが残っています。
マクロ回路または多細胞レベルの機能を調査できる技術の1つは、微小電極アレイ(MEA)15,16である。MEAは、数十年にわたって神経系の機能を調査するために使用されてきました17,18。脳内では、ニューロン発生、シナプス可塑性、薬理学的スクリーニング、毒性試験の研究が容易になりました17,18。これらは、MEAの種類に応じて、インビトロおよびインビボの両方の用途に使用できます。さらに、MEAの開発は急速に進化しており、さまざまな電極番号と構成が利用可能になりました19。MEAの主な利点は、複数の電極を介して高い空間的および時間的精度で多くのニューロンにおける電気的活動を同時に評価する能力である15,16。これは、ニューロンが回路およびネットワーク内で、制御条件下で、局所的に適用された化合物の存在下でどのように相互作用するかのより広範な読み出しを提供する。
in vitroDH製剤の1つの課題は、進行中の活性レベルが典型的には低いことである。ここでは、この課題は、DH回路を化学的に刺激するために電位依存性K+チャネル遮断薬である4-アミノプリイジン(4-AP)を使用する脊髄DH回路で対処されています。この薬剤は、以前は急性脊髄スライスのDHにおいて、および急性in vivo条件下でのリズミカルな同期電気的活性を確立するために使用されてきた20、21、22、23、24。これらの実験は、4−AP誘導活性20、21、22、23、24、25を特徴付けるために、単一細胞パッチおよび細胞外記録またはカルシウムイメージングを用いてきた。一緒に、この研究は、リズミカルな4-AP誘導活性のための興奮性および抑制性のシナプス伝達および電気シナプスの要件を実証した。したがって、4-AP応答は、薬物誘発性エピ現象としてではなく、生物学的関連性を有する天然の多シナプスDH回路を覆い隠すアプローチとして見なされてきた。さらに、4-AP誘導活性は、神経因性疼痛状態として鎮痛薬および抗てんかん薬に対して同様の応答プロファイルを示し、コネキシンなどの新規な脊髄ベースの鎮痛薬標的を提案するために使用されている20、21、22。
ここでは、MEAsと脊髄DHの化学的活性化を4-APと組み合わせて、この侵害受容回路をマクロ回路またはネットワークレベルの分析で研究する調製物が記載されている。このアプローチは、素朴で神経因性の「痛みのような」条件下で侵害受容回路を調査するための安定した再現可能なプラットフォームを提供する。この調製物はまた、既知の鎮痛薬の回路レベルの作用を試験し、亢進性脊髄における新規鎮痛薬をスクリーニングするためにも容易に適用可能である。
プロトコル
生後3~12ヶ月の雄および雌のc57Bl/6マウスについて研究を行った。すべての実験手順は、ニューカッスル大学の動物ケアおよび倫理委員会(プロトコルA-2013-312、およびA-2020-002)に従って実施した。
1. 体外 電気生理学
- 脊髄スライス調製および記録のための溶液の調製
- 人工脳脊髄液
注:人工脳脊髄液(aCSF)は、インターフェースインキュベーションチャンバ内で使用され、スライスは記録が開始されるまで、および実験中に薬物の灌流液および希釈液の両方として保存される。詳細な組成については、 表1 を参照してください。
- 人工脳脊髄液
| ケミカル | aCSF (mM) | aCSF (g/100 mL) | スクロース置換 aCSF (mM) | スクロース置換 aCSF (g/100 mL) | 高カリウム aCSF (mM) | 高カリウム aCSF (g/100 mL) |
| 塩化ナトリウム(NaCl) | 118 | 0.690 | - | - | 118 | 0.690 |
| 炭酸水素ナトリウム(NaHCO3) | 25 | 0.210 | 25 | 0.210 | 25 | 0.210 |
| グルコース | 10 | 0.180 | 10 | 0.180 | 10 | 0.180 |
| 塩化カリウム(KCl) | 2.5 | 0.019 | 2.5 | 0.019 | 4.5 | 0.034 |
| リン酸二水素ナトリウム(NaH2PO4) | 1 | 0.012 | 1 | 0.012 | 1 | 0.012 |
| マグネシウム甲状体(MgCl2) | 1 | 0.01 | 1 | 0.01 | 1 | 0.01 |
| 塩化カルシウム(CaCl2) | 2.5 | 0.028 | 2.5 | 0.028 | 2.5 | 0.028 |
| 蔗糖 | - | - | 250 | 8.558 | - | - |
表1:人工脳脊髄液組成物。 略語: aCSF = 人工脳脊髄液.
- 2 Lの蒸留水に、118NaCl、25 NaHCO3、10 グルコース、2.5 KCl、1 NaH2PO4、1 MgCl2、および 2.5CaCl2 を含む aCSF (mM 単位) を調製します。
- 上記の溶液をカルボゲン(95%O2、5%CO2)で5分間泡立て、CaCl2を加える。
注:このステップはCaCl2 の降水を防ぎます、すなわち、溶液は曇ってはなりません。実験中の薬物適用のために、薬物ストック溶液を所望の最終濃度にaCSFで希釈する。
- スクロース置換人工脳脊髄液
注:スクロース置換aCSFは、解剖および脊髄スライス中に使用される。名前が示すように、スクロースは、浸透圧を維持しながら、これらの手順中のニューロン興奮を減少させるためにNaClに置換される。詳細な組成については、 表1 を参照してください。- 250個のスクロース、25個のNaHCO3、10個のグルコース、2.5個のKCl、1NaH2PO4、1MgCl2、および2.5個のCaCl2を含むスクロース置換aCSFを、CaCl2を除く上記の全ての必要量を300mLの蒸留水に添加して調製する。
- 溶液をカルボゲンで5分間泡立ててから、CaCl2を加える。
- 溶液を-80°Cの冷凍庫に約40分間、または溶液がスラリーを形成するまで保管する。固体の凍結を避け、スラリー状の一貫性の中で使用してください。
- 微小電極アレイ作製
注:MEAの接触面は、親水性にするために前処理が必要です。- 実験の前に、MEAをウシ胎児血清(FBS)または馬血清(HS)のいずれかで30分間よく満たします。
- FBSまたはHSを取り出し、蒸留水が泡立たなくなるまで、約5回の蒸留水でMEAを十分にすすいでください。井戸をaCSFで満たし、すぐに使用できます。
- 急性脊髄スライス調製
注:マウス脊髄スライス調製は、Smithらによって以前に記述されたとおりである2。理想的には、腰仙骨拡大の除去は8〜10分以内で完了する必要があります(以下のステップ1.3.2〜1.3.11)。- マウスを100mg/kgのケタミン(i.p.)で深く麻酔し、大きな外科用はさみを使って断頭します。
- 腰の高さで皮膚に小さな切り込みを入れて、腹部の上の皮膚を取り除きます。すべての皮膚が取り除かれるまで、すなわち胸郭の上部から骨盤の上部(腹側および背側の両方)まで、切り込みの両側の皮膚を吻側に引っ張る。
- 体を氷の上に置き、腹側アプローチを使用して、すべての内臓を除去し、胸骨の横方向の肋骨を切断することによって、椎骨柱を露出させる。
- 腹側胸郭、肩甲骨(約T2で切断)、および下肢および骨盤(仙骨のほぼ上部で切断)の両方を除去する。
- 椎骨柱および肋骨調製物を氷冷スクロースaCSFを含む解剖浴に移す。下背筋と取り付けられた上肋骨を通してピンを配置して、準備の4つの角(腹面を上向き)すべて固定します。
- 椎骨の腹側表面を覆っているすべての筋肉および結合組織をロンガーで取り除き、T12〜L2椎体体のほぼ下にある腰仙骨拡大上の椎体領域を特定する。
- 腰仙骨拡大領域の尾側にある椎体を取り除き、脊髄が椎体管にあるときに脊髄へのアクセスを提供します。
- 湾曲したスプリングはさみを使用して、椎骨の腹側と背側の側面を分離し、脊髄を露出させるために、椎体を吻側に持ち上げて引っ張りながら、椎体椎弓根を両側に切断する。
- 脊椎体が取り除かれて腰仙骨の拡大が現れたら、脊髄を固定している残りの根をスプリングハサミで慎重に取り除き、コードが自由に浮かぶまで取り除きます。
- 腰仙骨の拡大の上下に吻側と尾側の切り込みで脊髄を隔離し、コードの標的領域を「自由に浮かせる」ようにします。
メモ:スライスの向きによって、その後のセクショニングのためにコードをどのように取り付けるかが決まります(図1)。 - 横方向のスライスの場合は、腰仙骨セグメントを取り付けた根で持ち上げ、中央に浅いチャネルがカットされたあらかじめカットされたポリスチレン(発泡スチロール)ブロック(1 cm x 1 cm x 1 cm)の上に置きます。シアノアクリレート接着剤( 材料表を参照)を使用して、ブロックとコードをセクショニングプラットフォームに取り付け、氷冷スクロースaCSF(スラリー)を含む切断浴に入れます。
メモ:浅いチャネルは、背側が露出し、コードの胸端がブロックの下部にある状態で、脊髄を固定して方向付けするのに役立ちます。 - 矢状スライスの場合は、セクショニングプラットフォーム上にシアノアクリレート接着剤の細い線を置き、取り付けられた根で腰仙骨の拡大を持ち上げ、接着剤の線に沿ってコードを置き、一方の側面が接着剤にあり、他方が上を向いていることを確認します。それを氷冷スクロースaCSF(スラリー)を含む切断浴に入れる。
- 水平スライスの場合は、シアノアクリレート接着剤の細い線をセクショニングプラットフォームに置きます。取り付けられた根で腰仙骨拡大を持ち上げ、腹側表面が接着剤にあり、背側表面が上を向いていることを確認しながら、腰仙骨拡大を接着剤の線に沿って配置します。取り付けられた根を使用してコードを配置します。それを氷冷スクロースaCSF(スラリー)を含む切断浴に入れる。
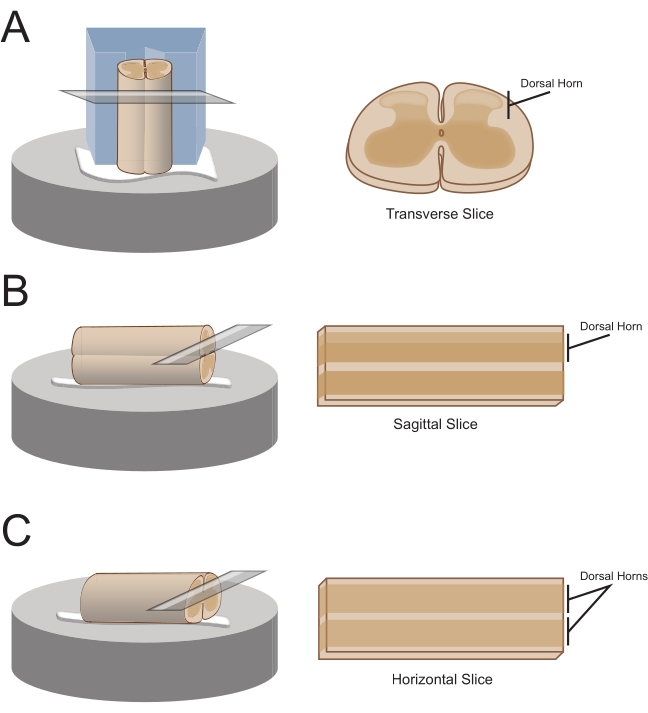
図1:脊髄スライスの向き、取り付け方法、切断方法 (A)横方向スライスには、支持溝がカットされた発泡スチロール切断ブロックが必要です。脊髄は支持溝内のブロックに対して置かれ、コードの背側はブロックから離れて向いている。ブロックとコードは、シアノアクリレート接着剤で切断ステージに接着されています。(B)矢状スライスは、切断ステージ上にシアノアクリレート接着剤の細い線を置き、次いで脊髄を接着剤上のその側面に置くことによって調製される。(C)水平スライスは、切断ステージ上にシアノアクリレート接着剤の細い線を置き、次いで脊髄腹側を接着剤の上に下方に置くことによって調製される。 この図の拡大版を表示するには、ここをクリックしてください。
- 振動ミクロトームを使用して、厚さ300 μmのスライス(L1-L5、向きに関係なく同じ厚さ)を、速度0.06 mm/s、振幅2.50 mm、高さ±0.02以内に較正した振幅偏差で取得します。
- スライスを酸素化aCSFを含む空気界面インキュベーションチャンバに移す。
- 記録する前に、スライスを室温(20-24°C)で1時間平衡化させます。
- 微小電極アレイ記録
注: 次の手順では、脊髄スライスで MEA ベースの実験からのレコード データを使用する方法を詳しく説明します。実験に応じていくつかのMEA計画を使用できます。これらの実験で使用したMEAの設計の詳細は、 表 2 そして 図2.詳細な設計情報は、Egertらによって公開されている。26 とティーボーら27 平面 MEA と 3 次元 (3D) MEA にそれぞれ使用します。どちらのMEAタイプも、窒化シリコン絶縁層と窒化チタントラックとコンタクトパッドを備えた60個の窒化チタン電極で構成されています。- 実験セットアップ
- コンピュータとインタフェースボードの電源を入れ、録音ソフトウェアを起動します。
- 組み立て済みの記録テンプレートをロードします(図3A)。[レコーダー] タブでその日のファイルに名前を付けます。
- 実験の期間中、カルボゲン(5%CO2、95%O2)でaCSFを連続的にバブル化した。
- 蠕動ポンプによって制御される灌流システムをオンにします。入口ラインをaCSFに置き、入口端を廃棄物ビーカーに入れます。aCSFで灌流ラインをプライムします。
- ストックを50mLのaCSFで必要な最終濃度(例えば、4-APの場合は200μM)に希釈することによって、4-APおよび他の薬物溶液を調製する。
- 薬液を薬のポットに入れ、カルボゲンで泡立てます。
- 4 AP アクティビティ
- インキュベーションに続いて、aCSFで満たされた大きな先端パスツールピペットを用いてインキュベーターから単一のスライスを移す。
- スライスをMEAウェルに配置し、aCSFを追加します。
- スライスを60電極の記録アレイの上に、細い短いヘアペイントブラシを使用して配置します。特に3Dアレイを使用する場合は、電極をペイントブラシに接触させたり、電極を横切って組織をドラッグしたりしないでください。
メモ:MEAレイアウトに応じて、これは正確な位置決めのために顕微鏡の助けを借りるかどうかにかかわらず行うことができます。 - スライスを位置決めした後、組織の上に加重ネットを置き、所定の位置に保持し、MEA電極との良好な接触を促進します。
メモ: スライスは、ネット配置後に再配置が必要な場合があります。 - MEAを記録ヘッドステージに置きます(図2A、B)。
- 倒立顕微鏡(倍率2倍)を使用して電極上の組織の位置を確認し、できるだけ多くの電極が表層DH(SDH)の下にあることを確認します。これらの電極は、ノイズを減算し、解析中のアーティファクトを記録するために重要であるため、少なくとも2〜6個の電極がスライスに接触 していない ことを確認してください(図2E)。
- カメラの電源を入れ、デバイスに接続し、解析中に使用するためにMEAを基準にしたスライスの参照画像を撮影します。
- 録音ソフトウェアの スタートDAQ を押し、すべての電極がクリア信号を受信していることを確認します。
メモ:信号にノイズがうるさい場合は、ヘッドステージのクリップを外し、MEAコンタクトパッドとゴールドスプリングコンタクトの両方を70%エタノールでクリーニングします(クリーニング後にパッドとコンタクトが乾いていることを確認するために、実験室用ワイプを使用してください)。信号がまだノイズが多い場合は、記録ソフトウェアの誤動作している電極をオフにするか、後で分析中に除外できるようにメモしておきます。 - 灌流入口と出口のラインをMEAウェル(以前はaCSFで満たされていた)に取り付け、灌流システムをオンにします。流量、理想的には毎分4〜6個の浴容積を確認し、流出が超溶融物のオーバーフローを防ぐのに十分であることを確認してください。
- 組織を 5 分間平衡化してから、フィルター処理されていない生のベースライン データを 5 分間記録します。
- 灌流入口ラインをaCSFから4-AP溶液に移動し、4-AP誘発リズミカル活性が定常状態に達するまで12分間待ちます(薬物が浴槽に到達するには2分間、活性がピークに達してからプラトーに達するには10分間)。
- 4-AP誘導活性の5分間を記録する。薬物をテストしたり、4-APの安定性を確認したりするために、その後の録音に備えてください。
- 実験セットアップ
| 微小電極アレイのレイアウト | ||||
| 微小電極アレイモデル | 60MEA 200/30iR-Ti | 60-3DMEA 100/12/40iR-Ti | 60-3DMEA 200/12/50iR-Ti | 60MEA 500/30iR-Ti |
| 平面または 3 次元 (3D) | 平面 | 3D | 3D | 平面 |
| 電極グリッド | 8 × 8 | 8 × 8 | 8 × 8 | 6 × 10 |
| 電極間隔 | 200 μm | 100 μm | 200 μm | 500 μm |
| 電極直径 | 30 μm | 12 μm | 12 μm | 30 μm |
| 電極高さ(3D) | 該当なし | 40 μm | 50 μm | 該当なし |
| 実験 | 横スライス | 横スライス | 射手座+水平 | 射手座+水平 |
表2:微小電極アレイのレイアウト
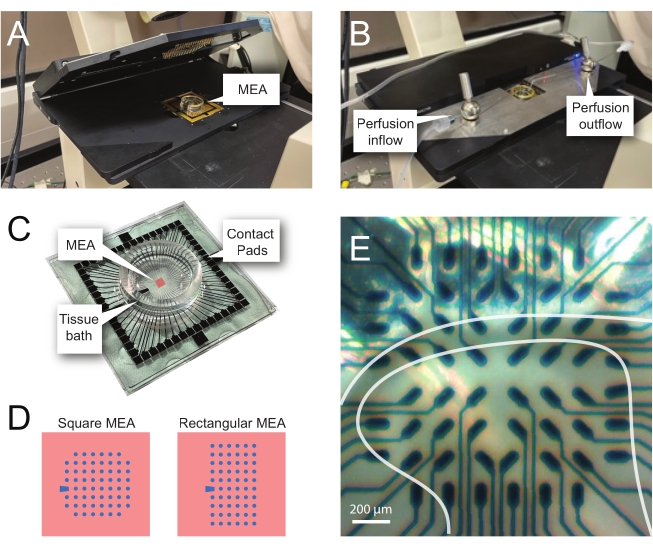
図2:微小電極アレイ上の組織位置決め(A)画像は、MEAを所定の位置に配置した開いたMEAヘッドステージを示しています。(B)MEAヘッドステージを閉じて記録し、組織灌流システムを配置したAと同じ。(C)画像は、製造元から提供されたMEAを示しています。ヘッドステージの金バネとインターフェースするコンタクトパッド、および組織入浴液および組織スライスを保持するMEA組織浴が示されている。中央の赤い四角で強調表示されている領域が電極アレイの位置です。(D)回路図は、この研究で使用された2つのMEA電極構成を示し、さらに詳細を表2に示す。参照電極は青色台形によって示される。左側のMEA電極レイアウトは、直径12μm、高さ50μmまたは40μmの電極を備えた直径30μmの電極、または200μm間隔および100μmの間隔をあけた3次元MEA(60MEA200/12/50iR-Tiおよび60MEA100/12/40iR-Ti)を備えた、提示されたワークモデル60MEA200/30iR-Tiで最も使用される60電極の正方形構成を示し、 それぞれ。左側のMEA電極レイアウトは、6 x 10電極長方形レイアウト-60MEA500/30iR-Tiを示しています。(E)60MEA100/12/40iR-Ti正方形MEAの高倍率画像で、横方向の脊髄スライスが記録用に配置されている。スライスは電極列3〜8の上に座る。どの組織にも接触しない電極の一番上の列は、参照電極として機能します。SDH 領域は半透明のバンドとして表示されます。この場合、SDH は MEA の行 4、5、および 6 および列 2、3、4、5、および 7 の電極を覆います。スケールバー = 200 μm。略語:MEA=微小電極アレイ;SDH = 表在性背角。この図の拡大版を表示するには、ここをクリックしてください。
- スライスの変更
- 各記録セッションの後、aCSFでラインをすすぎます。
- ヘッドステージからMEAを取り外します。
- MEAウェルからネットと組織を取り出し、aCSFでよくすすぎ、新しいスライスで上記の手順を繰り返します。
2. データの処理と分析
注:次の手順では、脊髄スライスのMEA実験に分析ソフトウェアを使用する方法を詳しく説明します。60個の電極のうちの1個は内部基準( 図2の C、Dでは台形によってマークされる)として機能し、残りの59個のうち4個から25個は成体マウスの脊髄スライスのSDHの下に位置する。その後の解析では、この領域の生信号から細胞外活動電位(EAP)および局所電界電位(LFP)波形(例については 図3B を参照)を検出します。
- 生データ処理
- 解析ソフトウェアを開き、あらかじめ作成された解析レイアウトをロードします(図3B)。
- 目的のファイルを開き、参照電極 (8 x 8 MEA の電極 15 または 6 x 10 MEA 構成の電極 E1) と、ノイズが多すぎると見なされる電極の選択を解除します。
- 分析のタイム ウィンドウを設定します (0:00 → 5:00 分)。
- 「クロスチャンネルフィルター」タブに移動します。[複雑な参照]を選択し、実験中に撮影した画像とメモ(つまり、組織の下にない電極)に基づいて参照電極を選択します。これを適用して確認するには、続行する前に [探索] を押します。
- EAP フィルター タブに移動し、2次ハイパス バターワース フィルター (200 Hz カットオフ) を適用して LFP アクティビティを削除します。
- LFP フィルタタブに移動し、2次バンドパスバターワースフィルタ(デルタ周波数 0.5 ~ 4 Hz)を適用して EAP アクティビティを削除します。
- [EAP 検出器] タブに移動し、[自動しきい値] を選択します。「立ち上がり」と「立ち下がり」のエッジボックスにチェックマークを付け、「デッドタイム」を 0.5 ミリ秒に設定します。
- データに基づいて 正 と 負のしきい値 を設定します。データを検査するには、[ 生データ アナライザー ] 画面に戻り、タイム マーカーを移動してから、[ EAP 検出器 ] タブに戻り、[ 探索] を押します。設定された検出しきい値が、ノイズ/非生理学的活性をキャプチャせずにEAPをキャプチャしていることが満たされるまで繰り返します。参照電極を使用して、ノイズ/非生理学的活動を特定します。
注:生理活性が発生しない参照電極で検出されるEAPの数は最小限に抑える必要があります。ただし、ベースラインのわずかな偏差が EAP として誤って検出される可能性があります。これは、活性電極で検出される実事象の数を最大化することを依然として目指している。 - LFP検出器タブに移動し、手動しきい値を選択し、立ち上がりエッジボックスと立ち下がりエッジボックスにチェックマークを付け、デッドタイムを3ミリ秒に設定します。
- LFP 活性のある電極を選択して、1 つの電極に対して手順 2.1.8 を繰り返します。満足したら、[ すべてに適用] を選択すると、しきい値は手動しきい値を設定するときに単一の電極にのみ適用されます。
- [検出器]タブでLFPデータを調べる際に、1つのLFP波形のスレッショルド交差の最大数と、後の解析で使用するために1つのLFP波形のスレッショルド交差の最大時間分離に注意してください。
- [分析の開始] を押します。
- 分析が完了したら、[ EAP アナライザー ] タブに移動し、データをエクスポートします。 LFPアナライザ タブで同じ操作を行います。
- 同じスライスの他のすべてのファイルに対して、このプロセスを繰り返します。
- データのエクスポート後に、ファイルを xlsx 形式に変換して、使用するプログラミング スクリプトで読み取れるようにします。提供されたスクリプトがファイルを読み取るための次の規則に従ってファイルに名前を付けます:実験名(例:サンプルデータ) - スライス番号(例:S1) - 記録番号(例:R1) - アクティビティタイプ(例:スパイクまたはSP、それぞれEAPまたはLFPに対応します)。
注:ここで説明するEAP分析は、この活動が記録電極に近接した複数のニューロンから一般的に生じるにもかかわらず、個々のチャネルからのスパイクを単一の集団として扱います。チャネル内のEAPに寄与するニューロンの数が望まれる場合、他の箇所で説明したマルチスパイクソーティング技術を適用して、波形特性28に基づいてスパイクの別個の集団を区別することができる。
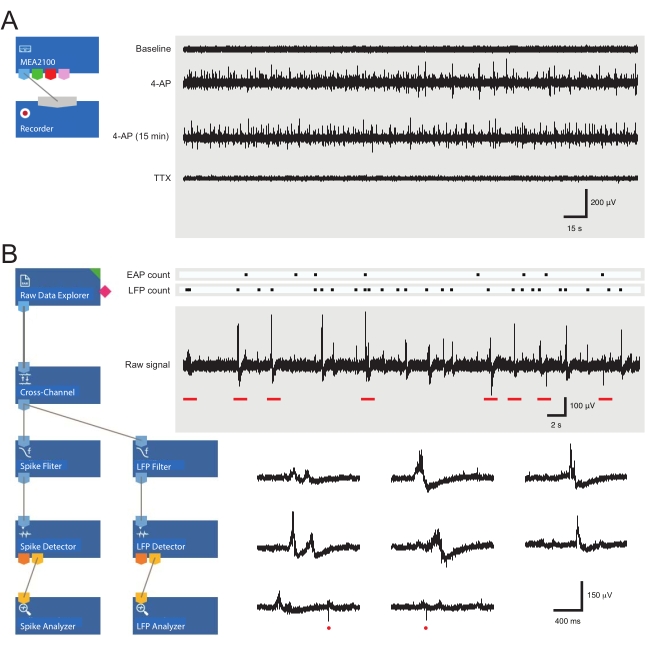
図3:データ記録および解析ツールのレイアウト、および細胞外活動電位および局所電界電位波形を示すマイクロ電極アレイ記録の例。 (A)回路図は、MEAデータの取得に使用される事前設定された記録テンプレートを示しています。MEA2100と記録(ヘッドステージ/アンプ)ツールをリンクすることで、データに名前を付けて保存することができます。生データの4つのサンプルトレース(右、5分エポック)を、ベースラインでの活性、4-AP適用後12分、確立された4-AP活性の15分後、およびTTX(1μM)の浴適用後を示す1つのMEAチャネルによって収集された。4-AP(2 番目のトレース)を追加すると、バックグラウンド ノイズと EAP/LFP アクティビティが明らかに増加します。重要なことに、活性は、4−AP誘導活性が確立されてから少なくとも15分間、比較的安定なままである(第3の痕跡)。TTX(1 μM)を添加すると、すべての活性が消失する(ボトムトレース)。(B)回路図(左)は、データ解析用の分析ソフトウェア構成を示しています。生データエクスプローラツールは、記録ソフトウェアによって収集された記録をインポートするために使用されます。これらのデータは、選択した参照電極の信号を他の電極から減算してバックグラウンドノイズを除去するクロスチャネルフィルタツールを介して実行されます。データはEAPフィルタとLFPフィルタツールを通過し、各波形の信号対ノイズ関係を最適化します。この手順の後、EAP パス データは、しきい値が設定されている EAP 検出器ツールに入ります。EAP が検出され、EAP アナライザー ツールに送信され、各イベントの待機時間が記録され、txt としてエクスポートされます。ファイル。LFP データに対して、対応する LFP ツールキットを使用して同一のワークフローが発生します。右のトレースは、さまざまな細胞外波形を含む単一のMEAチャネルからのデータを示しています。EAP信号とLFP信号の位置は、上記の「カウントラスター」で強調表示されています。下のトレースは、さまざまなLFP信号(さまざまな外観に注意してください)や個々の細胞外EAP(赤い円)を含む、拡張されたタイムスケールの波形を示す上部記録(赤いバーで示されます)からのエポックです。LFP/EAPの波形と極性は、これらの信号を生成するニューロンの数、記録電極への近接度、および近くの電極に対するニューロンの位置に応じて変化することに注意してください。略語:MEA=微小電極アレイ;EAP = 細胞外活動電位;LFP = 局所場電位;4-AP=4-アミノピリジン;TTX = テトロドトキシン。 この図の拡大版を表示するには、ここをクリックしてください。
- シンクロニシティ分析
注:同期性、または2つの電極間の「一致」事象の数は、Satuvuoriらによって概説されたA-PIKE同期法内の一致基準を使用して決定された 。29. ここで使用されるスクリプトは、効率のために互いに隣接する電極(すなわち、水平、垂直、および対角線の隣人)を比較するだけです。ただし、必要に応じてスクリプトを書き換えて、すべての電極を比較することができます。- カスタムプログラミングスクリプトを使用してデータ分析を実行し、.xlsxファイルから各電極のレイテンシタイムスタンプを抽出します。
メモ: これは手動で行うことができます。 - ステップ2.1.11で、1つのLFP波形のスレッショルド交差の最大数とスレッショルド交差の最大時間分離を記録します。スクリプトを実行する前に、スライスごとにこれらの LFP 定義パラメータを入力するスクリプトを変更します。
注: 以前に分析ソフトウェアで実行されていたしきい値設定では、EAP が 1 つのイベントとして明確にキャプチャされます。しかし、LFPは、波形の形状と、1つの事象によるその後の閾値交差の数に応じて可変数のピークで構成される。 - 解析前に目的の電極を入力するようにスクリプトを変更します。
- 同期性 (同期アクティビティが発生するための変更可能な時間枠によってスクリプトで定義される) を判断するには、抽出された待機時間を分離して分析し、一致するイベントを検出します。
メモ: このスクリプトでは、一致イベント間の最大時間を設定できます。これらは、EAP の場合は 20 ミリ秒、LFP の場合は 200 ミリ秒に設定されます。 - スクリプトを実行して、待機タイムスタンプを抽出します。
メモ: .xlsx出力ファイルには、個々の電極とスライス全体の EAP および LFP カウント、頻度、および一致イベントカウントなどのレイテンシデータの解釈が含まれています。これらのデータは、周波数、EAP/LFP数、アクティブ電極数、一致イベント数、リンクされた電極の数、およびこれらのリンケージの平均強度を評価するために使用されます。
- カスタムプログラミングスクリプトを使用してデータ分析を実行し、.xlsxファイルから各電極のレイテンシタイムスタンプを抽出します。
結果
脊髄後角におけるネットワーク活動モデル
4-APの適用は、脊髄DHにおける同期リズミカルな活動を確実に誘導する。このようなアクティビティは、EAP および LFP の増加として表示されます。後述の信号は、MEA記録30において既に説明した低周波波形である。薬物適用後のEAPおよび/またはLFP活性の変化は、神経活動の変化を反映する。EAP および LFP の例を
ディスカッション
侵害受容性シグナル伝達、処理、および痛みを特徴付ける結果として生じる行動的および感情的応答における脊髄DHの重要性にもかかわらず、この領域内の回路はほとんど理解されていないままである。この問題を調査する上での重要な課題は、これらの回路6,31,32を構成するニューロン集団の多様性であった。光遺伝学と...
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
この研究は、オーストラリアの国立保健医療研究評議会(NHMRC)(B.A.G.およびR.J.C.への助成金631000、1043933、1144638、および1184974)とハンター医学研究所(B.A.G.およびR.J.C.への助成金)から資金提供を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 4-aminopyridine | Sigma-Aldrich | 275875-5G | |
| 100% ethanol | Thermo Fisher | AJA214-2.5LPL | |
| CaCl2 1M | Banksia Scientific | 0430/1L | |
| Carbonox (Carbogen - 95% O2, 5% CO2) | Coregas | 219122 | |
| Curved long handle spring scissors | Fine Science Tools | 15015-11 | |
| Custom made air interface incubation chamber | |||
| Foetal bovine serum | Thermo Fisher | 10091130 | |
| Forceps Dumont #5 | Fine Science Tools | 11251-30 | |
| Glucose | Thermo Fisher | AJA783-500G | |
| Horse serum | Thermo Fisher | 16050130 | |
| Inverted microscope | Zeiss | Axiovert10 | |
| KCl | Thermo Fisher | AJA383-500G | |
| Ketamine | Ceva | KETALAB04 | |
| Large surgical scissors | Fine Science Tools | 14007-14 | |
| Loctite 454 Instant Adhesive | Bolts and Industrial Supplies | L4543G | |
| MATLAB | MathWorks | R2018b | |
| MEAs, 3-Dimensional | Multichannel Systems | 60-3DMEA100/12/40iR-Ti, 60-3DMEA200/12/50iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in an 8x8 square grid. Electrodes are 12 µm in diameter, 40 µm (100/12/40) or 50 µm (200/12/50) high and equidistantly spaced 100 µm (100/12/40) or 200 µm (200/12/50) apart. |
| MEA headstage | Multichannel Systems | MEA2100-HS60 | |
| MEA interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot | |
| MEA net | Multichannel Systems | ALA HSG-MEA-5BD | |
| MEA perfusion system | Multichannel Systems | PPS2 | |
| MEAs, Planar | Multichannel Systems | 60MEA200/30iR-Ti, 60MEA500/30iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in either a 8x8 square grid (200/30) or a 6x10 rectangular grid (500/30). Electrodes are 30 µm in diameter and equidistantly spaced 200 µm (200/30) or 500 µm (500/30) apart. |
| MgCl2 | Thermo Fisher | AJA296-500G | |
| Microscope camera | Motic | Moticam X Wi-Fi | |
| Multi Channel Analyser software | Multichannel Systems | V 2.17.4 | |
| Multi Channel Experimenter software | Multichannel Systems | V 2.17.4 | |
| NaCl | Thermo Fisher | AJA465-500G | |
| NaHCO3 | Thermo Fisher | AJA475-500G | |
| NaH2PO4 | Thermo Fisher | ACR207805000 | |
| Rongeurs | Fine Science Tools | 16021-14 | |
| Small spring scissors | Fine Science Tools | 91500-09 | |
| Small surgical scissors | Fine Science Tools | 14060-09 | |
| Sucrose | Thermo Fisher | AJA530-500G | |
| Superglue | cyanoacrylate adhesive | ||
| Tetrodotoxin | Abcam | AB120055 | |
| Vibration isolation table | Newport | VH3048W-OPT | |
| Vibrating microtome | Leica | VT1200 S |
参考文献
- Smith, K. M., et al. Calretinin positive neurons form an excitatory amplifier network in the spinal cord dorsal horn. eLife. 8, 49190 (2019).
- Smith, K. M., et al. Functional heterogeneity of calretinin-expressing neurons in the mouse superficial dorsal horn: implications for spinal pain processing. The Journal of physiology. 593 (19), 4319-4339 (2015).
- Boyle, K. A., et al. Defining a spinal microcircuit that gates myelinated afferent input: Implications for tactile allodynia. Cell Reports. 28 (2), 526-540 (2019).
- Browne, T. J., et al. Transgenic cross-referencing of inhibitory and excitatory interneuron populations to dissect neuronal heterogeneity in the dorsal horn. Frontiers in Molecular Neuroscience. 13, 32 (2020).
- Graham, B. A., Hughes, D. I. Rewards, perils and pitfalls of untangling spinal pain circuits. Current Opinion in Physiology. 11, 35-41 (2019).
- Todd, A. J. Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience. 11 (12), 823-836 (2010).
- Hughes, D. I., Todd, A. J. Central nervous system targets: inhibitory interneurons in the spinal cord. Neurotherapeutics. 17 (3), 874-885 (2020).
- Duan, B., et al. Identification of spinal circuits transmitting and gating mechanical pain. Cell. 159 (6), 1417-1432 (2014).
- Hachisuka, J., Chiang, M. C., Ross, S. E. Itch and neuropathis itch. Pain. 159 (3), 603 (2018).
- Foster, E., et al. Targeted ablation, silencing, and activation establish glycinergic dorsal horn neurons as key components of a spinal gate for pain and itch. Neuron. 85 (6), 1289-1304 (2015).
- Bourane, S., et al. Identification of a spinal circuit for light touch and fine motor control. Cell. 160 (3), 503-515 (2015).
- Cheng, L., et al. Identification of spinal circuits involved in touch-evoked dynamic mechanical pain. Nature neuroscience. 20 (6), 804-814 (2017).
- Peirs, C., et al. Mechanical allodynia circuitry in the dorsal horn is defined by the nature of the injury. Neuron. 109 (1), 73-90 (2021).
- Huang, J., et al. Circuit dissection of the role of somatostatin in itch and pain. Nature Neuroscience. 21 (5), 707-716 (2018).
- Obien, M. E. J., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 8, 423 (2015).
- Nam, Y., Wheeler, B. C. In vitro microelectrode array technology and neural recordings. Critical Reviews in Biomedical Engineering. 39 (1), 45-61 (2011).
- Johnstone, A. F., et al. Microelectrode arrays: a physiologically based neurotoxicity testing platform for the 21st century. Neurotoxicology. 31 (4), 331-350 (2010).
- Stett, A., et al. Biological application of microelectrode arrays in drug discovery and basic research. Analytical and Bioanalytical Chemistry. 377 (3), 486-495 (2003).
- Xu, L., et al. Trends and recent development of the microelectrode arrays (MEAs). Biosensors and Bioelectronics. 175 (1), 112854 (2020).
- Chapman, R. J., Cilia La Corte, P. F., Asghar, A. U. R., King, A. E. Network-based activity induced by 4-aminopyridine in rat dorsal horn in vitro is mediated by both chemical and electrical synapses. The Journal of Physiology. 587, 2499-2510 (2009).
- Ruscheweyh, R., Sandkühler, J. Epileptiform activity in rat spinal dorsal horn in vitro has common features with neuropathic pain. Pain. 105 (1-2), 327-338 (2003).
- Kay, C. W., Ursu, D., Sher, E., King, A. E. The role of Cx36 and Cx43 in 4-aminopyridine-induced rhythmic activity in the spinal nociceptive dorsal horn: an electrophysiological study in vitro. Physiological Reports. 4 (14), 12852 (2016).
- Jankowska, E., Lundberg, A., Rudomin, P., Sykova, E. Effects of 4-aminopyridine on synaptic transmission in the cat spinal cord. Brain Research. 240 (1), 117-129 (1982).
- Semba, K., Geller, H. M., Egger, M. D. 4-Aminopyridine induces expansion of cutaneous receptive fields of dorsal horn cells. Brain Research. 343 (2), 398-402 (1985).
- Ruscheweyh, R., Sandkühler, J. Long-range oscillatory Ca2+ waves in rat spinal dorsal horn. European Journal of Neuroscience. 22 (8), 1967-1976 (2005).
- Egert, U., et al. A novel organotypic long-term culture of the rat hippocampus on substrate-integrated multielectrode arrays. Brain Research Protocols. 2 (4), 229-242 (1998).
- Thiebaud, P., De Rooij, N., Koudelka-Hep, M., Stoppini, L. Microelectrode arrays for electrophysiological monitoring of hippocampal organotypic slice cultures. IEEE Transactions on Biomedical Engineering. 44 (11), 1159-1163 (1997).
- Rey, H. G., Pedreira, C., Quiroga, R. Q. Past, present and future of spike sorting techniques. Brain Research Bulletin. 119, 106-117 (2015).
- Satuvuori, E., et al. Measures of spike train synchrony for data with multiple time scales. Journal of Neuroscience Methods. 287, 25-38 (2017).
- Mendis, G. D. C., Morrisroe, E., Reid, C. A., Halgamuge, S. K., Petrou, S. Use of local field potentials of dissociated cultures grown on multi-electrode arrays for pharmacological assays. 38th Annual International Conference of the IEEE Engineering in Medicine and Biology Society. , 952-956 (2016).
- Hughes, D. I., et al. Morphological, neurochemical and electrophysiological features of parvalbumin-expressing cells: a likely source of axo-axonic inputs in the mouse spinal dorsal horn. The Journal of Physiology. 590 (16), 3927-3951 (2012).
- Peirs, C., Seal, R. P. Neural circuits for pain: recent advances and current views. Science. 354 (6312), 578-584 (2016).
- Li, J., Baccei, M. L. Developmental regulation of membrane excitability in rat spinal lamina I projection neurons. Journal of Neurophysiology. 107 (10), 2604-2614 (2012).
- Li, J., Baccei, M. L. Pacemaker neurons within newborn spinal pain circuits. Journal of Neuroscience. 31 (24), 9010-9022 (2011).
- Sandkühler, J., Eblen-Zajjur, A. Identification and characterization of rhythmic nociceptive and non-nociceptive spinal dorsal horn neurons in the rat. Neuroscience. 61 (4), 991-1006 (1994).
- Lucas-Romero, J., Rivera-Arconada, I., Roza, C., Lopez-Garcia, J. A. Origin and classification of spontaneous discharges in mouse superficial dorsal horn neurons. Scientific Reports. 8 (1), 9735-9735 (2018).
- Antonio, L., et al. L. al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. 260, 33-44 (2016).
- Avoli, M., Jefferys, J. G. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. 260, 26-32 (2016).
- Taccola, G., Nistri, A. Low micromolar concentrations of 4-aminopyridine facilitate fictive locomotion expressed by the rat spinal cord in vitro. Neuroscience. 126 (2), 511-520 (2004).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. Journal of Neurophysiology. 107 (2), 728-741 (2012).
- Egert, U., Heck, D., Aertsen, A. Two-dimensional monitoring of spiking networks in acute brain slices. Experimental Brain Research. 142 (2), 268-274 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved