A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הקלטת פעילות רשת במעגלים נוסיקפטיים בעמוד השדרה באמצעות מערכי מיקרו-אלקטרוניקה
In This Article
Summary
מתואר השימוש המשולב בטכנולוגיית מערך מיקרו-אלקטרודים ובגירוי כימי המושרה על-ידי 4-אמינו-פירידין לחקר פעילות נוציצפטיבית ברמת הרשת בקרן הגבית של חוט השדרה.
Abstract
התפקידים והקישוריות של סוגים ספציפיים של נוירונים בתוך הקרן הגבית של חוט השדרה (DH) מתוחמים בקצב מהיר כדי לספק תצוגה מפורטת יותר ויותר של המעגלים העומדים בבסיס עיבוד הכאב בעמוד השדרה. עם זאת, ההשפעות של קשרים אלה על פעילות רשת רחבה יותר ב-DH נותרות פחות מובנות מכיוון שרוב המחקרים מתמקדים בפעילות של נוירונים בודדים ומיקרו-מעגלים קטנים. לחלופין, השימוש במערכי מיקרו-אלקטרוניקה (MEAs), שיכולים לנטר את הפעילות החשמלית על פני תאים רבים, מספק רזולוציה מרחבית וטמפורלית גבוהה של פעילות עצבית. כאן מתואר השימוש ב-MEAs עם פרוסות חוט השדרה של העכבר כדי לחקור את פעילות ה-DH המושרה על-ידי מעגלי DH מגרים כימית עם 4-אמינופירידין (4-AP). הפעילות הקצבית המתקבלת מוגבלת ל-DH השטחי, יציב לאורך זמן, נחסם על ידי טטרודוטוקסין, וניתן לחקור אותה בכיווני פרוסות שונים. יחד, הכנה זו מספקת פלטפורמה לחקור את פעילות מעגלי ה-DH ברקמות מבעלי חיים תמימים, מודלים של בעלי חיים של כאב כרוני ועכברים עם תפקוד נוסיספטיבי שהשתנה גנטית. יתר על כן, הקלטות MEA בפרוסות חוט שדרה מגורות 4-AP יכולות לשמש ככלי סינון מהיר להערכת היכולת של תרכובות אנטי-נוציפטיביות חדשניות לשבש את הפעילות בחוט השדרה DH.
Introduction
התפקידים של סוגים ספציפיים של אינטרנורונים מעכבים ומעוררים בתוך חוט השדרה DH נחשפים בקצב מהיר 1,2,3,4. יחד, אינטרנורונים מהווים יותר מ-95% מהנוירונים ב-DH ומעורבים בעיבוד חושי, כולל nociception. יתר על כן, מעגלי אינטרנורון אלה חשובים כדי לקבוע אם אותות היקפיים עולים על הנוירואקסיס כדי להגיע למוח ולתרום לתפיסת הכאב 5,6,7. עד כה, רוב המחקרים חקרו את תפקידם של נוירוני DH ברמת הניתוח של תא יחיד או שלם באמצעות שילובים של אלקטרופיזיולוגיה תוך-תאית במבחנה, תיוג נוירואנטומי וניתוח התנהגותי in vivo 1,3,8,9,10,11,12,13,14 . גישות אלה קידמו באופן משמעותי את ההבנה של תפקידן של אוכלוסיות נוירונים ספציפיות בעיבוד כאב. עם זאת, נותר פער בהבנת האופן שבו סוגי תאים ספציפיים ומעגלי מאקרו קטנים משפיעים על אוכלוסיות גדולות של תאי עצב ברמת מיקרו-מעגל כדי לעצב לאחר מכן את התפוקה של ה-DH, את התגובות ההתנהגותיות ואת חוויית הכאב.
טכנולוגיה אחת שיכולה לחקור תפקוד מאקרו-מעגלי או רב-תאי ברמה התאית היא מערך המיקרו-אלקטרוניקה (MEA)15,16. MEAs שימשו לחקר תפקוד מערכת העצבים במשך כמה עשורים17,18. במוח, הם סייעו בחקר ההתפתחות העצבית, הפלסטיות הסינפטית, הסינון הפרמקולוגי ובדיקת הרעילות17,18. הם יכולים לשמש הן ליישומי in vitro והן ליישומי in vivo, בהתאם לסוג ה- MEA. יתר על כן, הפיתוח של MEAs התפתח במהירות, עם מספרי אלקטרודות ותצורות שונות הזמינים כעת19. יתרון מרכזי של MEAs הוא היכולת שלהם להעריך בו זמנית את הפעילות החשמלית בתאי עצב רבים עם דיוק מרחבי וטמפורלי גבוה באמצעות אלקטרודות מרובות15,16. זה מספק קריאה רחבה יותר של האופן שבו נוירונים מתקשרים במעגלים וברשתות, בתנאי בקרה ובנוכחות של תרכובות המיושמות באופן מקומי.
אחד האתגרים של ההכנות ל-DH במבחנה הוא שרמות הפעילות השוטפות בדרך כלל נמוכות. כאן, אתגר זה מטופל במעגלי DH של חוט השדרה באמצעות חוסם תעלות K+ המגודר במתח, 4-aminopryidine (4-AP), כדי לעורר כימית מעגלי DH. תרופה זו שימשה בעבר לביסוס פעילות חשמלית סינכרונית קצבית ב- DH של פרוסות חוט שדרה חריפות ובתנאים in vivo חריפים 20,21,22,23,24. ניסויים אלה השתמשו במדבקה חד-תאית ובהקלטה חוץ-תאית או בהדמיית סידן כדי לאפיין פעילות המושרה על-ידי 4-AP 20,21,22,23,24,25. יחד, עבודה זו הדגימה את הדרישה של העברה סינפטית מעוררת ומעכבת וסינפסות חשמליות לפעילות קצבית המושרה על ידי 4-AP. לפיכך, תגובת 4-AP נתפסה כגישה החושפת מעגלי DH פוליסינפטיים מקומיים בעלי רלוונטיות ביולוגית ולא כאפיפנומנון המושרה על ידי תרופה. יתר על כן, פעילות המושרה על ידי 4-AP מציגה פרופיל תגובה דומה לתרופות משככי כאבים ואנטי-אפילפטיות כמצבי כאב נוירופתיים ומשמשת להצעת מטרות חדשות של תרופות משככי כאבים המבוססות על עמוד השדרה כגון קונקסינים 20,21,22.
כאן מתוארת הכנה המשלבת MEAs והפעלה כימית של DH עמוד השדרה עם 4-AP כדי לחקור את המעגלים הנוסיקפטיים האלה במקרו-מעגל, או ברמת האנליזה של הרשת. גישה זו מספקת פלטפורמה יציבה וניתנת לשחזור לחקר מעגלים נוסיקפטיים במצבים 'דמויי כאב' נאיביים ונוירופתיים. הכנה זו ישימה בקלות גם לבדיקת הפעולה ברמת המעגל של משככי כאבים ידועים ולסינון משככי כאבים חדשניים בחוט השדרה ההיפראקטיבי.
Protocol
מחקרים נערכו על עכברי c57Bl/6 זכרים ונקבות בגילאי 3-12 חודשים. כל ההליכים הניסוייים בוצעו בהתאם לוועדת הטיפול והאתיקה בבעלי חיים של אוניברסיטת ניוקאסל (פרוטוקולים A-2013-312, ו- A-2020-002).
1. אלקטרופיזיולוגיה במבחנה
- הכנת פתרונות להכנת ורישום פרוסת חוט השדרה
- נוזל מוחי מלאכותי
הערה: נוזל מוחי מלאכותי (aCSF) משמש בתא דגירה של ממשק, שבו מאוחסנות פרוסות עד לתחילת ההקלטה ובמהלך הניסויים הן כמתפשטות והן כמדוללות לתרופות. ראו טבלה 1 להרכב המפורט.
- נוזל מוחי מלאכותי
| כימי | aCSF (mM) | aCSF (g/100 מ"ל) | ACSF בתחליף סוכרוז (mM) | ACSF בתחליף סוכרוז (g/100 מ"ל) | ACSF עתיר אשלגן (mM) | ACSF עתיר אשלגן (g/100 מ"ל) |
| נתרן כלורי (NaCl) | 118 | 0.690 | - | - | 118 | 0.690 |
| נתרן מימן פחמתי (NaHCO3) | 25 | 0.210 | 25 | 0.210 | 25 | 0.210 |
| גלוקוז | 10 | 0.180 | 10 | 0.180 | 10 | 0.180 |
| פוטסיום כלוריד (KCl) | 2.5 | 0.019 | 2.5 | 0.019 | 4.5 | 0.034 |
| נתרן דיהידרוגן פוספט (NaH2PO4) | 1 | 0.012 | 1 | 0.012 | 1 | 0.012 |
| מגנזיום קלורייד (MgCl2) | 1 | 0.01 | 1 | 0.01 | 1 | 0.01 |
| סידן כלוריד (CaCl2) | 2.5 | 0.028 | 2.5 | 0.028 | 2.5 | 0.028 |
| סוכרוז | - | - | 250 | 8.558 | - | - |
טבלה 1: הרכבי נוזל מוחי מלאכותי. קיצור: aCSF = נוזל מוחי מלאכותי.
- הכן aCSF המכיל (ב- mM) 118 NaCl, 25 NaHCO3, 10 גלוקוז, 2.5 KCl, 1 NaH2PO4, 1 MgCl2 ו- 2.5 CaCl2 על ידי הוספת הכמויות הנדרשות של האמור לעיל, למעט CaCl2, ל- 2 ליטר של מים מזוקקים.
- מקציפים את התמיסה הנ"ל עם קרבוגן (95% O2, 5% CO2) למשך 5 דקות ומוסיפים CaCl2.
הערה: שלב זה מונע משקעי CaCl2 , כלומר, הפתרון לא אמור להפוך לעכור. ליישום תרופות במהלך ניסויים, דיללו את פתרונות מלאי התרופות ב-aCSF לריכוזים הסופיים הרצויים.
- נוזל מוחי מלאכותי בתחליף סוכרוז
הערה: aCSF בתחליף סוכרוז משמש במהלך דיסקציה וחיתוך חוט השדרה. כפי שצוין על ידי השם, סוכרוז מוחלף על ידי NaCl כדי להפחית את העירור העצבי במהלך הליכים אלה תוך שמירה על osmolarity. ראו טבלה 1 להרכב המפורט.- הכינו aCSF בתחליף סוכרוז המכיל (ב-mM) 250 סוכרוז, 25 NaHCO3, 10 גלוקוז, 2.5 KCl, 1 NaH2PO4, 1 MgCl2 ו-2.5 CaCl2 על ידי הוספת הכמויות הנדרשות של כל האמור לעיל, למעט CaCl2, ל-300 מ"ל של מים מזוקקים.
- מבעבעים את התמיסה עם קרבוגן למשך 5 דקות ולאחר מכן מוסיפים CaCl2.
- אחסנו את התמיסה במקפיא של -80 מעלות צלזיוס למשך כ-40 דקות או עד שהתמיסה תיצור תמיסה. הימנעו מהקפאת מוצקים ושימוש בזמן שאתם במרקם עילג.
- הכנת מערך מיקרואלקטרודה
הערה: משטח המגע של ה- MEA דורש טיפול מקדים כדי להפוך אותו להידרופילי.- לפני הניסוי, מלאו את ה-MEA היטב בסרום בקר עוברי (FBS) או בסרום סוסים (HS) למשך 30 דקות.
- הסירו את ה-FBS או ה-HS ושטפו היטב את MEA עם כחמש שטיפות של מים מזוקקים עד שהמים המזוקקים כבר לא יהיו מוקצפים. מלא את הבאר ב- aCSF, מוכן לשימוש.
- הכנת פרוסת חוט שדרה חריפה
הערה: הכנת פרוסת חוט השדרה של העכבר היא כפי שתואר בעבר על ידי Smith et al.2. באופן אידיאלי, הסרת ההרחבה הלומבוסקרלית צריכה להימשך לא יותר מ 8-10 דקות (צעדים 1.3.2-1.3.11 להלן).- מרדימים עמוקות את העכבר עם 100 מ"ג/ק"ג קטמין (כלומר) ואז ערפים אותו באמצעות מספריים כירורגיים גדולים.
- הסר את העור מעל אזור הבטן על ידי ביצוע חתך קטן בעור ברמת הירכיים. משכו את העור משני צדי החתך באופן רוסטרלי עד להסרת כל העור, כלומר מהחלק העליון של כלוב הצלעות לחלק העליון של האגן (הן בגחון והן בגב).
- הניחו את הגוף על קרח והשתמשו בגישה גחונית כדי לחשוף את עמוד השדרה על ידי הסרת כל הקרביים וחיתוך דרך הצלעות לרוחב עצם החזה.
- הסר את כלוב הצלעות הגחוני, הן את עצם השכמה (שנחתכה בערך ב-T2), והן את הגפיים התחתונות ואת האגן (שנחתכו בערך בחלק העליון של העצה).
- העבירו את עמוד החוליות ואת הכנת הצלעות לאמבטיה מנתקת המכילה סוכרוז קר כקרח aCSF. הצמד את כל ארבע פינות ההכנה (משטח הגחון כלפי מעלה) על ידי הנחת סיכות דרך שרירי הגב התחתון והצלעות העליונות המחוברות.
- הסר את כל רקמות השרירים והחיבור שמעל פני השטח הגחוניים של החוליות בעזרת רונג'ורים וזיהה את אזור החוליות מעל ההגדלה הלומבוסקרלית, הנמצאת בערך מתחת לגופי החוליות T12 עד L2.
- הסר גוף חוליה שהוא קאודלי לאזור ההרחבה הלומבוסקרלית כדי לספק גישה לחוט השדרה כשהוא יושב בתעלת החוליות.
- באמצעות מספריים קפיציים מעוקלים, חותכים דרך פדיקלים חוליות באופן דו-צדדי תוך כדי הרמה ומשיכה של גוף החוליות באופן רוסטרלי כדי להפריד בין ההיבט הגחוני והגבי של החוליות ולחשוף את חוט השדרה.
- לאחר הסרת גופי החוליות כדי לחשוף את ההגדלה הלומבוסקרלית, יש לנקות בזהירות את השורשים הנותרים המעגנים את חוט השדרה במספריים קפיציים עד שהחוט צף חופשי.
- בודדו את חוט השדרה עם חתכים רוסטרליים וקאודלים הרבה מעל ומתחת להגדלה הלומבוסקרלית, מה שמאפשר לאזור המטרה של החוט 'לצוף חופשי'.
הערה: כיוון הפרוסה המועדף יקבע כיצד הכבל יורכב לאחר מכן לצורך חתך (איור 1). - עבור פרוסות רוחביות, הרימו את המקטע הלומבוסקרלי על ידי שורש מחובר והניחו אותו על גוש פוליסטירן (קלקר) חתוך מראש (1 ס"מ x 1 ס"מ x 1 ס"מ) עם תעלה רדודה שנחתכה במרכז. השתמשו בדבק ציאנואקרילט (ראו טבלת החומרים) כדי לחבר את הבלוק והכבל לרציף החתך ולמקם אותו באמבט החיתוך המכיל סוכרוז קר כקרח aCSF (slurry).
הערה: התעלה הרדודה מסייעת לאבטח ולכוון את חוט השדרה, כאשר הצד הגבי חשוף וקצה החזה של החוט בתחתית הבלוק. - עבור פרוסות sagittal, הניחו קו דק של דבק ציאנואקרילט על פלטפורמת החתך, הרימו את ההגדלה הלומבוסקרלית על ידי שורש מחובר, והניחו את הכבל לאורך קו הדבק, תוך הבטחה שמשטח רוחבי אחד נמצא בדבק והשני פונה כלפי מעלה. מניחים אותו באמבט החיתוך המכיל סוכרוז קר כקרח aCSF (slurry).
- עבור פרוסות אופקיות, שים קו דק של דבק ציאנואקרילט על פלטפורמת החתך. הרימו את ההגדלה הלומבוסקרלית על ידי שורש מחובר, והניחו את ההגדלה הלומבוסקרלית לאורך קו הדבק, כדי להבטיח שהמשטח הגחוני נמצא בדבק והמשטח הגבי פונה כלפי מעלה. השתמש בשורשים מחוברים כדי למקם את הכבל. מניחים אותו באמבט החיתוך המכיל סוכרוז קר כקרח aCSF (slurry).
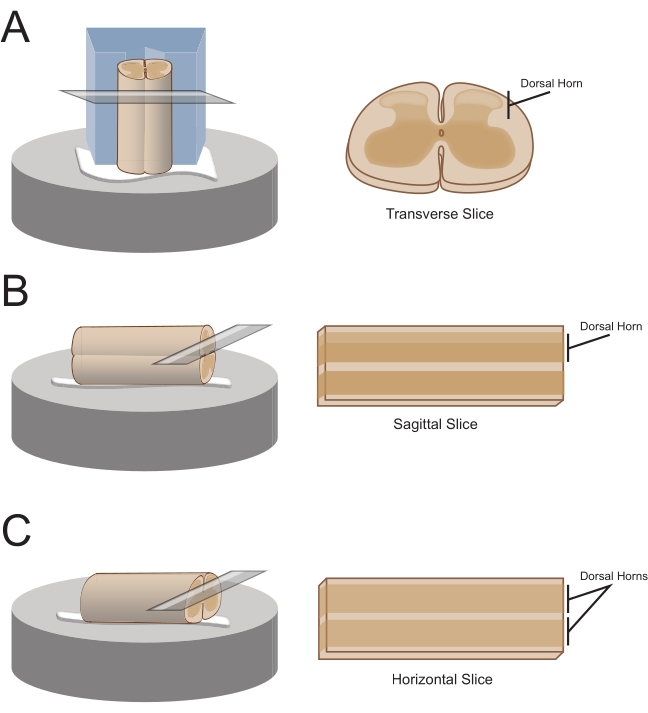
איור 1: כיווני פרוסות של חוט השדרה, שיטות הרכבה וחיתוך. (A) פרוסות רוחביות דורשות גוש חיתוך קלקר עם חריץ תומך שנחתך לתוכו. חוט השדרה מונח על הבלוק בחריץ התמיכה, הצד הגבי של החוט פונה הרחק מהגוש. הבלוק והחוט מודבקים על במת חיתוך עם דבק ציאנואקרילט. (B) פרוסות Sagittal מוכנות על ידי הנחת קו דק של דבק ציאנואקרילט על שלב החיתוך ולאחר מכן מיקום חוט השדרה על צדו על גבי הדבק. (C) פרוסות אופקיות מוכנות על ידי הנחת קו דק של דבק ציאנואקרילט על שלב החיתוך ולאחר מכן מיקום הצד הגחוני של חוט השדרה על גבי הדבק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- קבל פרוסות בעובי 300 מיקרומטר (L1-L5, עובי זהה ללא קשר לכיוון) באמצעות מיקרוטום רוטט עם ההגדרות הבאות: מהירות 0.06 מ"מ לשנייה, משרעת 2.50 מ"מ, ומכוילת לסטיית משרעת גובה של ±0.02.
- העבירו את הפרוסות לתא דגירה של ממשק אוויר המכיל aCSF מחומצן.
- לפני ההקלטה, אפשרו לפרוסות להתאזן במשך שעה אחת בטמפרטורת החדר (20-24 מעלות צלזיוס).
- הקלטות מערך מיקרואלקטרודה
הערה: השלבים הבאים מפרטים כיצד להשתמש בנתוני רשומות מניסויים מבוססי MEA על פרוסות חוט השדרה. ניתן להשתמש במספר עיצובי MEA בהתאם לניסוי. פרטי תכנון עבור MEAs ששימשו בניסויים אלה מוצגים ב טבלה 2 ו תרשים 2. מידע מפורט על העיצוב פורסם על ידי Egert et al.26 ות'יבאו ואחרים.27 עבור MEAs מישוריים ותלת-ממדיים (3D), בהתאמה. שני סוגי ה-MEA מורכבים מ-60 אלקטרודות טיטניום ניטריד, עם שכבת בידוד סיליקון ניטריד ופסי ניטריד טיטניום ומשטחי מגע.- מערך ניסיוני
- הפעל את המחשב ואת לוח הממשק, והפעל את תוכנת ההקלטה.
- טען את תבנית ההקלטה שהורכבה מראש (איור 3A). תן שם לקבצים עבור היום בכרטיסיית המקליט.
- בועה רציפה aCSF עם קרבוגן (5% CO2, 95% O2) למשך הניסוי.
- הפעל את מערכת הזלוף, הנשלטת על ידי משאבה פריסטלטית. מקם את קו הכניסה לתוך aCSF ואת קצה הכניסה בכוס פסולת. השלם את קווי הזלוף עם aCSF.
- הכן 4-AP וכל פתרון תרופה אחר על ידי דילול מלאי ב-50 מ"ל של aCSF לריכוז הסופי הנדרש (למשל, 200 μM עבור 4-AP).
- מניחים את תמיסות התרופות בסירי התרופות ומבעבעים אותן בקרבוגן.
- פעילות 4-AP
- לאחר הדגירה, מעבירים פרוסה בודדת מהאינקובטור באמצעות פיפטת פסטר בעלת קצה גדול במילוי aCSF.
- מקם את הפרוסה היטב ב- MEA והוסף aCSF נוסף.
- מקם את הפרוסה מעל מערך ההקלטה של 60 אלקטרודות באמצעות מברשת שיער קצרה ועדינה. הימנעו ממגע עם האלקטרודות עם המכחול או מגרירת הרקמה על פני האלקטרודות, במיוחד אם אתם משתמשים במערכים תלת-ממדיים.
הערה: בהתאם לפריסת MEA, ניתן לעשות זאת עם או בלי סיוע של מיקרוסקופ למיקום מדויק. - לאחר מיקום הפרוסה, הניחו רשת משוקללת מעל הרקמה כדי להחזיק אותה במקומה ולקדם מגע טוב עם אלקטרודות MEA.
הערה: ייתכן שיהיה צורך למקם מחדש את הפרוסה לאחר מיקום נטו. - מקם את ה-MEA בראש הבמה של ההקלטה (איור 2A,B).
- בדוק את מיקום הרקמה מעל האלקטרודות באמצעות מיקרוסקופ הפוך (הגדלה של פי 2) כדי לאשר שכמה שיותר אלקטרודות נמצאות תחת ה-DH השטחי (SDH). ודאו שלפחות 2-6 אלקטרודות לא ייצרו קשר עם הפרוסה, שכן האלקטרודות האלה חשובות לחיסור רעש ולהקלטת חפצים במהלך האנליזה (איור 2E).
- הפעל את המצלמה, חבר אותה למכשיר וקח תמונת ייחוס של הפרוסה ביחס ל- MEA לשימוש במהלך הניתוח.
- לחץ על התחל DAQ בתוכנת ההקלטה, ואשר שכל האלקטרודות מקבלות אות ברור.
הערה: אם האות רועש, פתחו את הבמה ונקו גם את רפידות המגע של MEA וגם את המגעים עם קפיץ הזהב עם 70% אתנול (השתמשו במגבון מעבדה כדי לוודא שהפדים והמגעים יבשים לאחר הניקוי). אם האות עדיין רועש, כבה את האלקטרודות הלא תקינות בתוכנת ההקלטה או רשום להדרה מאוחר יותר במהלך הניתוח. - חברו את קווי הכניסה והיציאה של ה-perfusion ל-MEA-well (שבעבר היה מלא ב-aCSF) והפעילו את מערכת הזלוף. בדקו את קצב הזרימה, באופן אידיאלי 4-6 נפחי אמבטיה לדקה, וודאו שהזרימה מספיקה כדי למנוע הצפה של ה-superfusate.
- אפשר לרקמה להתאזן במשך 5 דקות ולאחר מכן להקליט 5 דקות של נתוני בסיס גולמיים ולא מסוננים.
- הזז את קו הכניסה של פרפוזיה מ-aCSF לתמיסת 4-AP והמתן 12 דקות עד שהפעילות הקצבית המושרה על-ידי 4-AP תגיע למצב יציב (2 דקות עד שהתרופות יגיעו לאמבטיה ו-10 דקות עד שהפעילות תגיע לשיא ואז תיפול).
- רשמו 5 דקות של פעילות המושרה על ידי 4-AP. היו מוכנים להקלטות הבאות כדי לבדוק את התרופות או כדי לבדוק את היציבות של 4-AP.
- מערך ניסיוני
| פריסות מערך מיקרואלקטרודה | ||||
| מודל מערך מיקרואלקטרודה | 60MEA 200/30iR-Ti | 60-3DMEA 100/12/40iR-Ti | 60-3DMEA 200/12/50iR-Ti | 60MEA 500/30iR-Ti |
| מישורי או תלת-ממדי (תלת-ממדי) | מישורי | 3D | 3D | מישורי |
| רשת אלקטרודות | 8 x 8 | 8 x 8 | 8 x 8 | 6 x 10 |
| מרווח אלקטרודות | 200 מיקרומטר | 100 מיקרומטר | 200 מיקרומטר | 500 מיקרומטר |
| קוטר אלקטרודה | 30 מיקרומטר | 12 מיקרומטר | 12 מיקרומטר | 30 מיקרומטר |
| גובה אלקטרודה (3D) | N/A | 40 מיקרומטר | 50 מיקרומטר | N/A |
| ניסויים | פרוסה רוחבית | פרוסה רוחבית | סגיטל + אופקי | סגיטל + אופקי |
טבלה 2: פריסות מערך מיקרו-אלקטרוניקה.
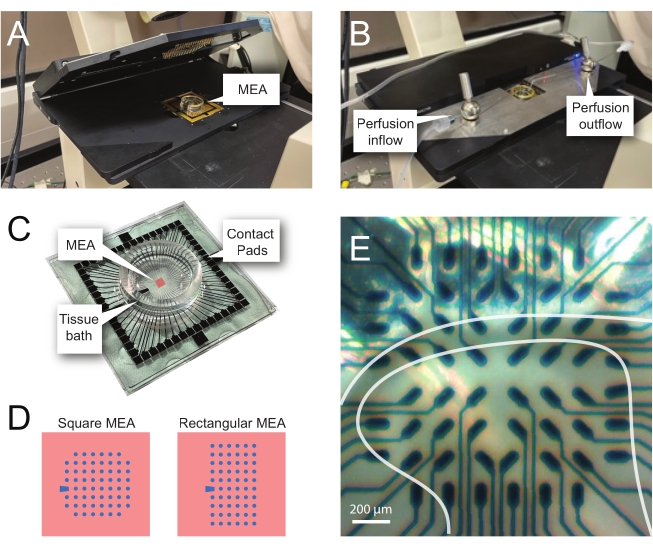
איור 2: מיקום רקמות על מערך המיקרו-אלקטרוניקה. (A) התמונה מציגה ראש MEA פתוח עם MEA הממוקם במקומו. (B) זהה ל-A עם ראש MEA סגור לצורך הקלטות ומערכת זלוף רקמות במקום. (C) התמונה מציגה MEA כפי שסופק על-ידי היצרן. מוצגות רפידות מגע, המתממשקות עם קפיצי הזהב של הבמה הראשית, ואמבט הרקמות MEA המחזיק את תמיסת הרחצה ברקמות ואת פרוסת הרקמות. השטח המודגש על ידי הריבוע האדום במרכז הוא המיקום של מערך האלקטרודות. (D) סכמות מציגות את שתי תצורות האלקטרודות של MEA ששימשו במחקר זה, עם פרטים נוספים המוצגים בטבלה 2. אלקטרודת הייחוס מסומנת על ידי הטרפז הכחול. פריסת האלקטרודות השמאלית של MEA מציגה תצורה מרובעת של 60 אלקטרודות, המשמשת בעיקר במודלי העבודה המוצגים 60MEA200/30iR-Ti עם אלקטרודות בקוטר 30 מיקרומטר במרווחים של 200 מיקרומטר זה מזה, או 200 μm מרווחים ו- 100 μm מרווחים 3-ממדיים MEAs (60MEA200/12/50iR-Ti ו- 60MEA100/12/40iR-Ti) עם אלקטרודות בקוטר 12 מיקרומטר ו-50 מיקרומטר או 40 מיקרומטר גובה, בהתאמה. פריסת אלקטרודות MEA השמאלית מציגה פריסה מלבנית של 6 x 10 אלקטרודות-60MEA500/30iR-Ti. (E) תמונה בהגדלה גבוהה של MEA מרובע 60MEA100/12/40iR-Ti עם פרוסת חוט שדרה רוחבית הממוקמת להקלטה. הפרוסה יושבת על שורות אלקטרודות 3-8. השורה העליונה של האלקטרודות, שאינן נוגעות בשום רקמה, משמשות כאלקטרודות ייחוס. אזור ה-SDH מופיע כלהקה חצי-שקופה. במקרה זה, ה-SDH מכסה את האלקטרודות בשורות 4, 5 ו-6 ואת העמודות 2, 3, 4, 5 ו-7 של ה-MEA. סרגל קנה מידה = 200 מיקרומטר. קיצורים: MEA = מערך מיקרואלקטרודה; SDH = קרן גב שטחית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- שינוי פרוסות
- לאחר כל סשן הקלטה, שטפו את השורות עם aCSF.
- הסר את ה- MEA מהבמה הראשית.
- הסר את הרשת ואת הרקמה מבאר ה- MEA, שטפו אותם היטב עם aCSF, וחזור על השלבים לעיל עם פרוסה חדשה.
2. עיבוד וניתוח נתונים
הערה: השלבים הבאים מפרטים כיצד להשתמש בתוכנת הניתוח עבור ניסויי MEA על פרוסות חוט השדרה. אחת מ-60 האלקטרודות משמשת כיחוס פנימי (מסומן על ידי טרפז באיור 2 C,D), בעוד שבין ארבע ל-25 מתוך 59 הנותרות ממוקמות מתחת ל-SDH בפרוסת חוט השדרה של עכבר בוגר. ניתוח מאוחר יותר מזהה צורות גל של פוטנציאל פעולה חוץ-תאי (EAP) ופוטנציאל שדה מקומי (LFP) (ראו איור 3B לדוגמה) מהאות הגולמי באזור זה.
- עיבוד נתונים גולמי
- פתחו את תוכנת הניתוח וטענו את פריסת הניתוח המוכנה מראש (איור 3B).
- פתח את הקובץ המעניין ובטל את הבחירה באלקטרודת הייחוס (אלקטרודה 15 ב- 8 x 8 MEA - או אלקטרודה E1 בתצורת 6 x 10 MEA) וכל אלקטרודות הנחשבות רועשות יתר על המידה.
- הגדר את חלון הזמן לניתוח (0:00 → 5:00 דקות).
- מעבר לכרטיסיה מסנן חוצה ערוצים . בחר הפניה מורכבת ובחר את אלקטרודות הייחוס על סמך התמונה שצולמה וההערות שנעשו במהלך הניסוי (כלומר, אלקטרודות שאינן מתחת לרקמה). כדי להחיל ולבדוק זאת, הקש על גלה לפני שתמשיך.
- עבור לכרטיסיית המסנן EAP והחיל מסנן Butterworth בעל מעברגבוה מסדר שני (200 הרץ מנותק) כדי להסיר פעילות LFP.
- עבור לכרטיסיית המסנן LFP והחל מסנן פס מסדרשני במסנן Butterworth (תדרי דלתא של 0.5-4 הרץ) כדי להסיר פעילות EAP.
- עבור לכרטיסיה גלאי EAP ובחר סף אוטומטי. סמן תיבות קצה עולות ויורדות והגדר את זמן המת ל- 0.5 אלפיות השנייה.
- הגדר ערכי סף חיוביים ושליליים בהתבסס על הנתונים. בדוק את הנתונים על-ידי חזרה למסך מנתח הנתונים Raw, הזזת סמן הזמן ולאחר מכן חזרה לכרטיסיית גלאי EAP והקשה על Explore. חזרו על הפעולה עד שתשביעות רצון מכך שסף הזיהוי המוגדר הוא לכידת EAPs מבלי ללכוד רעש/פעילות לא פיזיולוגית. השתמש באלקטרודות הייחוס כדי לזהות רעש/ פעילות לא פיזיולוגית.
הערה: יש צורך להבטיח מספר מינימלי של EAPs מזוהים באלקטרודות ייחוס שבהן פעילות פיזיולוגית לא תתרחש. עם זאת, סטיות קלות למדי בנקודת ההתחלה עשויות להיות מזוהות באופן שגוי כ- EAPs. זאת, תוך כדי שאיפה למקסם את מספר האירועים הממשיים שזוהו באלקטרודות הפעילות. - עבור לכרטיסיה גלאי LFP, בחר את הסף הידני, סמן את התיבות קצה עולה ויורד והגדיר את זמן המת ל- 3 אלפיות השנייה.
- חזור על שלב 2.1.8 עבור אלקטרודה אחת על ידי בחירת אלקטרודה עם פעילות LFP. לאחר ההשבעה, בחר החל על כולם , שכן ערכי סף יוחלו רק על אלקטרודה אחת בעת ביצוע סף ידני.
- בעת בחינת נתוני LFP בכרטיסייה גלאי , שים לב למספר המרבי של מעברי סף עבור צורת הגל LFP אחת ולהפרדת זמן מקסימלית של מעברי סף עבור צורת הגל LFP אחת לשימוש בניתוח מאוחר יותר.
- לחץ על התחל ניתוח.
- כאשר הניתוח הושלם, עבור לכרטיסיה מנתח EAP וייצא את הנתונים. בצע את אותו הדבר בכרטיסיית מנתח LFP .
- חזור על תהליך זה עבור כל הקבצים האחרים מאותה פרוסה.
- לאחר ייצוא נתונים, המר את הקבצים לתבנית xlsx כך שניתן יהיה לקרוא אותם על-ידי סקריפט התכנות שבו נעשה שימוש. תן שם לקבצים על פי המוסכמה הבאה עבור הסקריפט שסופק כדי לקרוא אותם: שם הניסוי (למשל, נתוני דגימה) - מספר פרוסה (למשל, S1) - מספר הקלטה (למשל, R1) - סוג פעילות (למשל, קוצים או SPs, המתאימים ל- EAPs או LFPs, בהתאמה).
הערה: ניתוח ה-EAP המתואר כאן מתייחס לעלייה חדה מהתעלות הבודדות כאל אוכלוסייה אחת, אף על פי שפעילות זו תנבע בדרך כלל ממספר תאי עצב בסמיכות לאלקטרודת ההקלטה. אם יש צורך במספר הנוירונים התורמים ל-EAPs בתעלה, ניתן ליישם טכניקות מיון מרובות-חלקיקים המתוארות במקומות אחרים כדי להבחין בין אוכלוסיות נפרדות של קוצים בהתבסס על מאפייני צורת גל28.
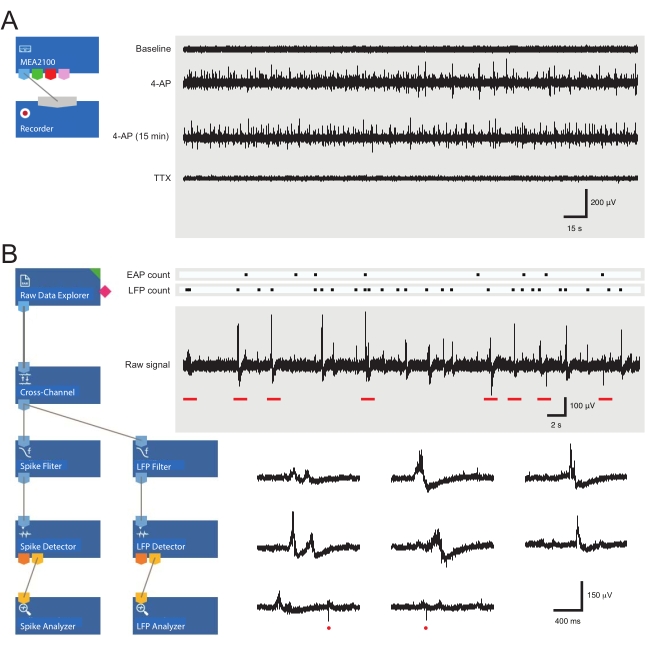
איור 3: פריסות כלי הקלטה וניתוח נתונים ורישומי מערך מיקרו-אלקטרוניקה לדוגמה המציגים פוטנציאל פעולה חוץ-תאי וצורות גל פוטנציאליות של שדה מקומי. קישור ה-MEA2100 וכלי ההקלטה (headstage/amplifier) מאפשר לתת לנתונים שם ולשמור אותם. ארבע עקבות לדוגמה של נתונים גולמיים (מימין, תקופות של 5 דקות) נאספו על ידי ערוץ MEA אחד המציג פעילות בנקודת ההתחלה, 12 דקות לאחר יישום 4-AP, 15 דקות נוספות לאחר פעילות 4-AP מבוססת, ובעקבות יישום אמבטיה של TTX (1 μM). שים לב, התוספת של 4-AP (עקבות שניים) מייצרת עלייה ברורה ברעשי הרקע ובפעילות EAP/LFP. חשוב לציין שהפעילות נשארת יציבה יחסית במשך 15 דקות לפחות לאחר שנקבעה פעילות המושרה על ידי 4-AP (עקבות שלישיים). תוספת של TTX (1 μM) מבטלת את כל הפעילות (עקבות תחתונים). (B) סכמטי (משמאל) מציג תצורת תוכנת מנתח לניתוח נתונים. כלי סייר הנתונים הגולמי משמש לייבוא הקלטות שנאספו על ידי תוכנת הקלטה. נתונים אלה מריצים לאחר מכן באמצעות כלי סינון חוצה ערוצים שמחסיר את אותות האלקטרודות הייחוס שנבחרו מאלקטרודות אחרות כדי להסיר רעשי רקע. הנתונים עוברים דרך מסנן EAP וכלי הסינון של LFP כדי למטב את יחסי האות לרעש עבור כל צורת גל. לאחר שלב זה, נתוני נתיב ה- EAP נכנסים לכלי גלאי EAP, שבו מוגדרים ערכי סף. EAPs מזוהים ולאחר מכן נשלחים לכלי ניתוח EAP שבו העיכובים של כל אירוע נרשמים ומיוצאים כ- txt. קובץ. זרימת עבודה זהה מתרחשת עבור נתוני LFP באמצעות ערכת כלים תואמת של LFP. עקבות ימניים מראים נתונים מערוץ MEA יחיד המכיל צורות גל חוץ-תאיות שונות. המיקום של אותות EAP ו-LFP מודגשים ב'ספירת רסטרים' לעיל. עקבות תחתונים הם תקופות מהקלטה עליונה (המסומנות בפסים אדומים) המציגות צורות גל על ציר זמן מורחב, כולל אותות LFP שונים (שימו לב למגוון ההופעות) ו-EAPs חוץ-תאיים בודדים (עיגולים אדומים). שימו לב, צורת הגל והקוטביות של LFP/EAP משתנות ביחס למספר הנוירונים שמייצרים את האותות האלה, לקרבתם לאלקטרודת ההקלטה ולמיקומה ביחס לאלקטרודות הסמוכות. קיצורים: MEA = מערך מיקרואלקטרודה; EAP = פוטנציאל פעולה חוץ-תאי; LFP = פוטנציאל שדה מקומי; 4-AP = 4-אמינופירידין; TTX = טטרודוטוקסין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- ניתוח סינכרוניזציה
הערה: סינכרוניות, או מספר האירועים ה'מקריים' בין שתי אלקטרודות, נקבעה באמצעות קריטריון צירוף המקרים בשיטת הסינכרון A-SPIKE המתוארת על ידי Satuvuori et al. 29. הכתב המשמש כאן משווה רק אלקטרודות הסמוכות זו לזו לצורך יעילות (כלומר, שכנים אופקיים, אנכיים ואלכסוניים); עם זאת, ניתן היה לשכתב את התסריט כדי להשוות את כל האלקטרודות במידת הצורך.- בצע ניתוח נתונים באמצעות סקריפט תכנות מותאם אישית, אשר מחלץ חותמות זמן השהיה עבור כל אלקטרודה מקבצי .xlsx.
הערה: ניתן לעשות זאת באופן ידני. - בשלב 2.1.11, רשום את המספר המרבי של מעברי סף והפרדת זמן מקסימלית של מעברי סף עבור צורת הגל LFP אחת. שנה את קובץ ה- Script להזנת פרמטרים אלה המגדירים LFP עבור כל פרוסה לפני הפעלת קובץ ה- Script.
הערה: בדיקת סף שבוצעה בעבר בתוכנת ניתוח לוכדת בבירור EAPs כאירוע יחיד. עם זאת, LFPs מורכבים ממספר משתנה של פסגות בהתאם לצורת צורת הגל ולמספר מעברי הסף הבאים על ידי האירוע האחד. - שנה את התסריט כדי להזין את האלקטרודות המעניינות לפני הניתוח.
- כדי לקבוע סינכרוניות (המוגדרת בכתב-Script על-ידי מסגרות זמן ניתנות לשינוי כדי שפעילות סינכרונית תתרחש בתוכה), הפרד ונתח את ההפסקות שחולצו כדי לזהות אירועים מקריים.
הערה: הסקריפט מאפשר להגדיר את הזמן המרבי בין אירועים מקריים. אלה מוגדרים על 20 אלפיות השנייה עבור EAPs ו-200 אלפיות השנייה עבור LFPs. - הפעל את קובץ ה- Script כדי לחלץ חותמות זמן של השהיה.
הערה: קובץ הפלט .xlsx מכיל את הפרשנויות של נתוני השהיה, שהם ספירות EAP ו- LFP, תדרים וספירת אירועים מקריים עבור אלקטרודות בודדות ופרוסות שלמות. נתונים אלה משמשים להערכת התדירות, ספירות EAP/LFP, מספר האלקטרודות הפעילות, מספר האירועים המקריים, מספר האלקטרודות המקושרות והעוצמה הממוצעת של קשרים אלה.
- בצע ניתוח נתונים באמצעות סקריפט תכנות מותאם אישית, אשר מחלץ חותמות זמן השהיה עבור כל אלקטרודה מקבצי .xlsx.
תוצאות
מודל פעילות הרשת בקרן הגב של חוט השדרה
יישום של 4-AP משרה באופן אמין פעילות קצבית סינכרונית בחוט השדרה DH. פעילות כזו מציגה כ-EAPs ו-LFPs מוגברים. האות המאוחר יותר הוא צורת גל בתדר נמוך, אשר תוארה בעבר בהקלטות MEA30. שינויים בפעילות ה-EAP ו/או ה-LFP בעקבות יישום התרופה משקפים שינוי...
Discussion
למרות החשיבות של DH עמוד השדרה באיתות, עיבוד, והתגובות ההתנהגותיות והרגשיות הנובעות מכך המאפיינות כאב, המעגלים בתוך אזור זה נותרים לא מובנים היטב. אתגר מרכזי בחקירת סוגיה זו היה מגוון אוכלוסיות הנוירונים המרכיבות את המעגלים האלה 6,31,32. ההת?...
Disclosures
למחברים אין ניגודי עניינים להצהיר עליהם.
Acknowledgements
עבודה זו מומנה על ידי המועצה הלאומית לבריאות ומחקר רפואי (NHMRC) של אוסטרליה (מענקים 631000, 1043933, 1144638 1184974 ו- B.A.G. ו- R.J.C.) ומכון המחקר הרפואי האנטר (מענק ל- B.A.G. ו- R.J.C.).
Materials
| Name | Company | Catalog Number | Comments |
| 4-aminopyridine | Sigma-Aldrich | 275875-5G | |
| 100% ethanol | Thermo Fisher | AJA214-2.5LPL | |
| CaCl2 1M | Banksia Scientific | 0430/1L | |
| Carbonox (Carbogen - 95% O2, 5% CO2) | Coregas | 219122 | |
| Curved long handle spring scissors | Fine Science Tools | 15015-11 | |
| Custom made air interface incubation chamber | |||
| Foetal bovine serum | Thermo Fisher | 10091130 | |
| Forceps Dumont #5 | Fine Science Tools | 11251-30 | |
| Glucose | Thermo Fisher | AJA783-500G | |
| Horse serum | Thermo Fisher | 16050130 | |
| Inverted microscope | Zeiss | Axiovert10 | |
| KCl | Thermo Fisher | AJA383-500G | |
| Ketamine | Ceva | KETALAB04 | |
| Large surgical scissors | Fine Science Tools | 14007-14 | |
| Loctite 454 Instant Adhesive | Bolts and Industrial Supplies | L4543G | |
| MATLAB | MathWorks | R2018b | |
| MEAs, 3-Dimensional | Multichannel Systems | 60-3DMEA100/12/40iR-Ti, 60-3DMEA200/12/50iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in an 8x8 square grid. Electrodes are 12 µm in diameter, 40 µm (100/12/40) or 50 µm (200/12/50) high and equidistantly spaced 100 µm (100/12/40) or 200 µm (200/12/50) apart. |
| MEA headstage | Multichannel Systems | MEA2100-HS60 | |
| MEA interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot | |
| MEA net | Multichannel Systems | ALA HSG-MEA-5BD | |
| MEA perfusion system | Multichannel Systems | PPS2 | |
| MEAs, Planar | Multichannel Systems | 60MEA200/30iR-Ti, 60MEA500/30iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in either a 8x8 square grid (200/30) or a 6x10 rectangular grid (500/30). Electrodes are 30 µm in diameter and equidistantly spaced 200 µm (200/30) or 500 µm (500/30) apart. |
| MgCl2 | Thermo Fisher | AJA296-500G | |
| Microscope camera | Motic | Moticam X Wi-Fi | |
| Multi Channel Analyser software | Multichannel Systems | V 2.17.4 | |
| Multi Channel Experimenter software | Multichannel Systems | V 2.17.4 | |
| NaCl | Thermo Fisher | AJA465-500G | |
| NaHCO3 | Thermo Fisher | AJA475-500G | |
| NaH2PO4 | Thermo Fisher | ACR207805000 | |
| Rongeurs | Fine Science Tools | 16021-14 | |
| Small spring scissors | Fine Science Tools | 91500-09 | |
| Small surgical scissors | Fine Science Tools | 14060-09 | |
| Sucrose | Thermo Fisher | AJA530-500G | |
| Superglue | cyanoacrylate adhesive | ||
| Tetrodotoxin | Abcam | AB120055 | |
| Vibration isolation table | Newport | VH3048W-OPT | |
| Vibrating microtome | Leica | VT1200 S |
References
- Smith, K. M., et al. Calretinin positive neurons form an excitatory amplifier network in the spinal cord dorsal horn. eLife. 8, 49190 (2019).
- Smith, K. M., et al. Functional heterogeneity of calretinin-expressing neurons in the mouse superficial dorsal horn: implications for spinal pain processing. The Journal of physiology. 593 (19), 4319-4339 (2015).
- Boyle, K. A., et al. Defining a spinal microcircuit that gates myelinated afferent input: Implications for tactile allodynia. Cell Reports. 28 (2), 526-540 (2019).
- Browne, T. J., et al. Transgenic cross-referencing of inhibitory and excitatory interneuron populations to dissect neuronal heterogeneity in the dorsal horn. Frontiers in Molecular Neuroscience. 13, 32 (2020).
- Graham, B. A., Hughes, D. I. Rewards, perils and pitfalls of untangling spinal pain circuits. Current Opinion in Physiology. 11, 35-41 (2019).
- Todd, A. J. Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience. 11 (12), 823-836 (2010).
- Hughes, D. I., Todd, A. J. Central nervous system targets: inhibitory interneurons in the spinal cord. Neurotherapeutics. 17 (3), 874-885 (2020).
- Duan, B., et al. Identification of spinal circuits transmitting and gating mechanical pain. Cell. 159 (6), 1417-1432 (2014).
- Hachisuka, J., Chiang, M. C., Ross, S. E. Itch and neuropathis itch. Pain. 159 (3), 603 (2018).
- Foster, E., et al. Targeted ablation, silencing, and activation establish glycinergic dorsal horn neurons as key components of a spinal gate for pain and itch. Neuron. 85 (6), 1289-1304 (2015).
- Bourane, S., et al. Identification of a spinal circuit for light touch and fine motor control. Cell. 160 (3), 503-515 (2015).
- Cheng, L., et al. Identification of spinal circuits involved in touch-evoked dynamic mechanical pain. Nature neuroscience. 20 (6), 804-814 (2017).
- Peirs, C., et al. Mechanical allodynia circuitry in the dorsal horn is defined by the nature of the injury. Neuron. 109 (1), 73-90 (2021).
- Huang, J., et al. Circuit dissection of the role of somatostatin in itch and pain. Nature Neuroscience. 21 (5), 707-716 (2018).
- Obien, M. E. J., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 8, 423 (2015).
- Nam, Y., Wheeler, B. C. In vitro microelectrode array technology and neural recordings. Critical Reviews in Biomedical Engineering. 39 (1), 45-61 (2011).
- Johnstone, A. F., et al. Microelectrode arrays: a physiologically based neurotoxicity testing platform for the 21st century. Neurotoxicology. 31 (4), 331-350 (2010).
- Stett, A., et al. Biological application of microelectrode arrays in drug discovery and basic research. Analytical and Bioanalytical Chemistry. 377 (3), 486-495 (2003).
- Xu, L., et al. Trends and recent development of the microelectrode arrays (MEAs). Biosensors and Bioelectronics. 175 (1), 112854 (2020).
- Chapman, R. J., Cilia La Corte, P. F., Asghar, A. U. R., King, A. E. Network-based activity induced by 4-aminopyridine in rat dorsal horn in vitro is mediated by both chemical and electrical synapses. The Journal of Physiology. 587, 2499-2510 (2009).
- Ruscheweyh, R., Sandkühler, J. Epileptiform activity in rat spinal dorsal horn in vitro has common features with neuropathic pain. Pain. 105 (1-2), 327-338 (2003).
- Kay, C. W., Ursu, D., Sher, E., King, A. E. The role of Cx36 and Cx43 in 4-aminopyridine-induced rhythmic activity in the spinal nociceptive dorsal horn: an electrophysiological study in vitro. Physiological Reports. 4 (14), 12852 (2016).
- Jankowska, E., Lundberg, A., Rudomin, P., Sykova, E. Effects of 4-aminopyridine on synaptic transmission in the cat spinal cord. Brain Research. 240 (1), 117-129 (1982).
- Semba, K., Geller, H. M., Egger, M. D. 4-Aminopyridine induces expansion of cutaneous receptive fields of dorsal horn cells. Brain Research. 343 (2), 398-402 (1985).
- Ruscheweyh, R., Sandkühler, J. Long-range oscillatory Ca2+ waves in rat spinal dorsal horn. European Journal of Neuroscience. 22 (8), 1967-1976 (2005).
- Egert, U., et al. A novel organotypic long-term culture of the rat hippocampus on substrate-integrated multielectrode arrays. Brain Research Protocols. 2 (4), 229-242 (1998).
- Thiebaud, P., De Rooij, N., Koudelka-Hep, M., Stoppini, L. Microelectrode arrays for electrophysiological monitoring of hippocampal organotypic slice cultures. IEEE Transactions on Biomedical Engineering. 44 (11), 1159-1163 (1997).
- Rey, H. G., Pedreira, C., Quiroga, R. Q. Past, present and future of spike sorting techniques. Brain Research Bulletin. 119, 106-117 (2015).
- Satuvuori, E., et al. Measures of spike train synchrony for data with multiple time scales. Journal of Neuroscience Methods. 287, 25-38 (2017).
- Mendis, G. D. C., Morrisroe, E., Reid, C. A., Halgamuge, S. K., Petrou, S. Use of local field potentials of dissociated cultures grown on multi-electrode arrays for pharmacological assays. 38th Annual International Conference of the IEEE Engineering in Medicine and Biology Society. , 952-956 (2016).
- Hughes, D. I., et al. Morphological, neurochemical and electrophysiological features of parvalbumin-expressing cells: a likely source of axo-axonic inputs in the mouse spinal dorsal horn. The Journal of Physiology. 590 (16), 3927-3951 (2012).
- Peirs, C., Seal, R. P. Neural circuits for pain: recent advances and current views. Science. 354 (6312), 578-584 (2016).
- Li, J., Baccei, M. L. Developmental regulation of membrane excitability in rat spinal lamina I projection neurons. Journal of Neurophysiology. 107 (10), 2604-2614 (2012).
- Li, J., Baccei, M. L. Pacemaker neurons within newborn spinal pain circuits. Journal of Neuroscience. 31 (24), 9010-9022 (2011).
- Sandkühler, J., Eblen-Zajjur, A. Identification and characterization of rhythmic nociceptive and non-nociceptive spinal dorsal horn neurons in the rat. Neuroscience. 61 (4), 991-1006 (1994).
- Lucas-Romero, J., Rivera-Arconada, I., Roza, C., Lopez-Garcia, J. A. Origin and classification of spontaneous discharges in mouse superficial dorsal horn neurons. Scientific Reports. 8 (1), 9735-9735 (2018).
- Antonio, L., et al. L. al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. 260, 33-44 (2016).
- Avoli, M., Jefferys, J. G. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. 260, 26-32 (2016).
- Taccola, G., Nistri, A. Low micromolar concentrations of 4-aminopyridine facilitate fictive locomotion expressed by the rat spinal cord in vitro. Neuroscience. 126 (2), 511-520 (2004).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. Journal of Neurophysiology. 107 (2), 728-741 (2012).
- Egert, U., Heck, D., Aertsen, A. Two-dimensional monitoring of spiking networks in acute brain slices. Experimental Brain Research. 142 (2), 268-274 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved