Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Запись сетевой активности в спинальных ноцицептивных цепях с помощью микроэлектродных матриц
В этой статье
Резюме
Описано совместное использование технологии микроэлектродных массивов и 4-аминопиридин-индуцированной химической стимуляции для исследования ноцицептивной активности на сетевом уровне в спинном роге спинного мозга.
Аннотация
Роли и связность определенных типов нейронов в спинном роге спинного мозга (DH) очерчиваются с быстрой скоростью, чтобы обеспечить все более подробное представление о схемах, лежащих в основе обработки боли в позвоночнике. Тем не менее, влияние этих связей на более широкую сетевую активность в DH остается менее понятным, потому что большинство исследований сосредоточены на активности отдельных нейронов и небольших микросхем. В качестве альтернативы, использование микроэлектродных массивов (MEA), которые могут контролировать электрическую активность во многих клетках, обеспечивает высокое пространственное и временное разрешение нейронной активности. Здесь описано использование MEAs с срезами спинного мозга мыши для изучения активности DH, индуцированной химически стимулирующими схемами DH с 4-аминопиридином (4-AP). Результирующая ритмическая активность ограничена поверхностным DH, стабильна с течением времени, блокируется тетродотоксином и может быть исследована в различных ориентациях срезов. Вместе этот препарат обеспечивает платформу для исследования активности контура DH в тканях наивных животных, животных моделей хронической боли и мышей с генетически измененной ноцицептивной функцией. Кроме того, записи MEA в 4-AP-стимулированных срезах спинного мозга могут быть использованы в качестве инструмента быстрого скрининга для оценки способности новых антиноцицептивных соединений нарушать активность в спинном мозге DH.
Введение
Роль специфических типов ингибирующих и возбуждающих интернейронов в ДГ спинного мозга раскрывается с быстрой скоростью 1,2,3,4. Вместе интернейроны составляют более 95% нейронов в DH и участвуют в сенсорной обработке, включая ноцицепцию. Кроме того, эти интернейронные цепи важны для определения того, поднимаются ли периферические сигналы по нейрооси, чтобы достичь мозга и способствовать восприятию боли 5,6,7. На сегодняшний день в большинстве исследований изучалась роль нейронов DH на уровне анализа одной клетки или всего организма с использованием комбинаций внутриклеточной электрофизиологии in vitro, нейроанатомической маркировки и поведенческого анализа in vivo 1,3,8,9,10,11,12,13,14 . Эти подходы значительно продвинули понимание роли конкретных популяций нейронов в обработке боли. Тем не менее, остается пробел в понимании того, как конкретные типы клеток и небольшие макроцепи влияют на большие популяции нейронов на уровне микросхем, чтобы впоследствии формировать выход DH, поведенческие реакции и болевой опыт.
Одной из технологий, которая может исследовать макросхему или функцию многоклеточного уровня, является микроэлектродная матрица (MEA)15,16. MEA использовались для исследования функции нервной системы в течение нескольких десятилетий17,18. В мозге они способствовали изучению развития нейронов, синаптической пластичности, фармакологического скрининга и тестирования токсичности17,18. Они могут использоваться как для приложений in vitro, так и in vivo, в зависимости от типа MEA. Кроме того, разработка МПС развивалась быстрыми темпами, и в настоящее время доступны различные номера и конфигурации электродов19. Ключевым преимуществом MEA является их способность одновременно оценивать электрическую активность во многих нейронах с высокой пространственной и временной точностью с помощью нескольких электродов15,16. Это обеспечивает более широкое считывание того, как нейроны взаимодействуют в цепях и сетях в условиях контроля и в присутствии локально применяемых соединений.
Одна из проблем препаратов DH in vitro заключается в том, что текущие уровни активности, как правило, низкие. Здесь эта проблема решается в цепях DH спинного мозга с использованием блокатора каналов K+ с напряжением, 4-аминопридина (4-AP), для химической стимуляции цепей DH. Этот препарат ранее применялся для установления ритмической синхронной электрической активности в ДГ острых срезов спинного мозга и при острых условиях in vivo 20,21,22,23,24. Эти эксперименты использовали одноклеточный пластырь и внеклеточную запись или кальциевую визуализацию для характеристики 4-AP-индуцированной активности 20,21,22,23,24,25. Вместе эта работа продемонстрировала потребность в возбуждающей и тормозной синаптической передаче и электрических синапсах для ритмической активности, индуцированной 4-AP. Таким образом, ответ 4-AP рассматривался как подход, который разоблачает нативные полисинаптические схемы DH с биологической значимостью, а не как эпифеномен, вызванный лекарственными средствами. Кроме того, активность, индуцированная 4-AP, демонстрирует аналогичный профиль реакции на анальгетические и противоэпилептические препараты, как невропатические болевые состояния, и была использована для предложения новых мишеней для анальгетических препаратов на основе позвоночника, таких как коннексины 20,21,22.
Здесь описан препарат, который сочетает в себе MEA и химическую активацию спинального DH с 4-AP для изучения этой ноцицептивной схемы на макроцептивном или сетевом уровне анализа. Этот подход обеспечивает стабильную и воспроизводимую платформу для исследования ноцицептивных цепей в наивных и невропатических «болевых» условиях. Этот препарат также легко применим для проверки действия известных анальгетиков на уровне схемы и для скрининга новых анальгетиков в гиперактивном спинном мозге.
протокол
Исследования проводились на самцах и самках мышей c57Bl/6 в возрасте 3-12 месяцев. Все экспериментальные процедуры были выполнены в соответствии с Комитетом по уходу за животными и этике Университета Ньюкасла (протоколы A-2013-312 и A-2020-002).
1. Электрофизиология in vitro
- Приготовление растворов для приготовления и записи срезов спинного мозга
- Искусственная спинномозговая жидкость
ПРИМЕЧАНИЕ: Искусственная спинномозговая жидкость (aCSF) используется в инкубационной камере интерфейса, где срезы хранятся до начала записи и во время экспериментов в качестве перфусата и разбавителя для лекарств. Подробный состав см. в таблице 1 .
- Искусственная спинномозговая жидкость
| Химический | aCSF (мМ) | aCSF (г/100 мл) | Сахарозамещенный aCSF (мМ) | Сахарозамещенный aCSF (г/100 мл) | Высококалийный aCSF (мМ) | Высокий уровень калия aCSF (г/100 мл) |
| Хлорид натрия (NaCl) | 118 | 0.690 | - | - | 118 | 0.690 |
| Гидрокарбонат натрия (NaHCO3) | 25 | 0.210 | 25 | 0.210 | 25 | 0.210 |
| Глюкоза | 10 | 0.180 | 10 | 0.180 | 10 | 0.180 |
| Хлорид потазия (KCl) | 2.5 | 0.019 | 2.5 | 0.019 | 4.5 | 0.034 |
| Дигидрофосфат натрия (2PO4) | 1 | 0.012 | 1 | 0.012 | 1 | 0.012 |
| Хлорид магния (MgCl2) | 1 | 0.01 | 1 | 0.01 | 1 | 0.01 |
| Хлорид кальция (CaCl2) | 2.5 | 0.028 | 2.5 | 0.028 | 2.5 | 0.028 |
| Сахароза | - | - | 250 | 8.558 | - | - |
Таблица 1: Композиции искусственной спинномозговой жидкости. Аббревиатура: aCSF = искусственная спинномозговая жидкость.
- Получают aCSF, содержащий (в мМ) 118 NaCl, 25 NaHCO3, 10 глюкозы, 2,5 KCl, 12PO4, 1 MgCl2 и 2,5 CaCl2 , добавляя необходимые количества вышеуказанного, исключая CaCl2, к 2 л дистиллированной воды.
- Взбейте вышеуказанный раствор карбогеном (95% O2, 5% CO2) в течение 5 мин и добавьте CaCl2.
ПРИМЕЧАНИЕ: Этот шаг предотвращает осаждениеCaCl2 , т.е. раствор не должен становиться мутным. Для применения препарата во время экспериментов разводят исходные растворы препарата в КСФС до желаемых конечных концентраций.
- Сахарозамещенная искусственная спинномозговая жидкость
ПРИМЕЧАНИЕ: Сахарозамещенный aCSF используется во время рассечения и нарезки спинного мозга. Как указано в названии, сахароза заменяется NaCl для уменьшения возбуждения нейронов во время этих процедур при сохранении осмолярности. Подробный состав см. в таблице 1 .- Готовят сахарозамещенный aCSF, содержащий (в мМ) 250 сахарозы, 25 NaHCO3, 10 глюкозы, 2,5 KCl, 12PO4, 1MgCl2 и 2,5 CaCl2 , добавляя необходимые количества всего вышеперечисленного, за исключением CaCl2, к 300 мл дистиллированной воды.
- Взбейте раствор карбогеном в течение 5 мин, а затем добавьте CaCl2.
- Храните раствор в морозильной камере при температуре -80 °C в течение приблизительно 40 мин или до образования раствора суспензии. Избегайте замораживания твердых веществ и используйте в консистенции навозной жижи.
- Подготовка микроэлектродного массива
ПРИМЕЧАНИЕ: Контактная поверхность МЭА требует предварительной обработки, чтобы сделать ее гидрофильной.- Перед экспериментом хорошо заполните МЭА либо фетальной бычьей сывороткой (FBS), либо конской сывороткой (HS) в течение 30 минут.
- Удалите FBS или HS и тщательно промойте MEA примерно пятью промывками дистиллированной воды, пока дистиллированная вода не перестанет пениться. Наполните колодец aCSF, готовым к использованию.
- Подготовка острого среза спинного мозга
ПРИМЕЧАНИЕ: Приготовление среза спинного мозга мыши осуществляется так, как описано ранее Smith et al.2. В идеале удаление пояснично-крестцового расширения должно занимать не более 8-10 мин (этапы 1.3.2-1.3.11 ниже).- Глубоко обезбольте мышь 100 мг/кг кетамина (т.е.), а затем обезглавливайте ее с помощью больших хирургических ножниц.
- Удалите кожу над брюшной областью, сделав небольшой разрез на коже на уровне бедер. Потяните кожу по обе стороны от разреза рострально до тех пор, пока вся кожа не будет удалена, т. е. от верхней части грудной клетки до верхней части таза (как вентрально, так и дорсально).
- Поместите тело на лед и используйте вентральный подход, чтобы обнажить позвоночный столб, удалив все внутренние органы и разрезав ребра сбоку от грудины.
- Удалите вентральную грудную клетку, обе лопатки (обрезанные примерно при Т2), а также нижние конечности и таз (обрезанные примерно в верхней части крестца).
- Переведите подготовку позвоночного столба и ребра в рассекающую ванну, содержащую ледяную сахарозу aCSF. Закрепите все четыре угла препарата (вентральная поверхность вверх), поместив штифты через мышцы нижней части спины и прикрепленные верхние ребра.
- Удалите все мышечные и соединительные ткани, покрывающие вентральную поверхность позвонков, с помощью rongeurs и определите позвоночную область над пояснично-крестцовым увеличением, которое лежит примерно под телами позвонков от T12 до L2.
- Удалите тело позвонка, которое является каудальным к пояснично-крестцовой области увеличения, чтобы обеспечить доступ к спинному мозгу, когда он находится в позвоночном канале.
- Используя изогнутые пружинные ножницы, прорежьте позвоночные ножки двусторонне, поднимая и вытягивая тело позвонка рострально, чтобы разделить вентральный и дорсальный аспекты позвонков и обнажить спинной мозг.
- После того, как тела позвонков удалены, чтобы выявить пояснично-крестцовое увеличение, тщательно очистите оставшиеся корешки, которые закрепляют спинной мозг пружинными ножницами, пока спинной мозг не выйдет на свободу.
- Изолируйте спинной мозг с ростральными и каудальными разрезами значительно выше и ниже пояснично-крестцового расширения, позволяя целевой области пуповины «свободно плавать».
ПРИМЕЧАНИЕ: Предпочтительная ориентация среза определяет, как шнур впоследствии монтируется для сечения (рисунок 1). - Для поперечных ломтиков поднимите пояснично-крестцовый сегмент прикрепленным корнем и поместите его на предварительно разрезанный блок полистирола (пенополистирола) (1 см х 1 см х 1 см) с неглубоким каналом, вырезанным в центре. Используйте цианоакрилатный клей (см. Таблицу материалов), чтобы прикрепить блок и шнур к секционной платформе и поместить его в режущую ванну, содержащую ледяную сахарозу aCSF (суспензию).
ПРИМЕЧАНИЕ: Неглубокий канал помогает закрепить и сориентировать спинной мозг, при этом дорсальная сторона открыта, а грудной конец пуповины находится в нижней части блока. - Для сагиттальных срезов уложите тонкую линию цианоакрилатного клея на секционную платформу, поднимите пояснично-крестцовое увеличение прикрепленным корнем и поместите шнур вдоль линии клея, убедившись, что одна боковая поверхность находится в клее, а другая обращена вверх. Поместите его в режущую ванну, содержащую ледяную сахарозу aCSF (суспензию).
- Для горизонтальных срезов нанесите тонкую линию цианоакрилатного клея на секционную платформу. Поднимите пояснично-крестцовое увеличение прикрепленным корнем и поместите пояснично-крестцовое увеличение вдоль линии клея, убедившись, что вентральная поверхность находится в клее, а спинная поверхность обращена вверх. Используйте прикрепленные корни для позиционирования шнура. Поместите его в режущую ванну, содержащую ледяную сахарозу aCSF (суспензию).
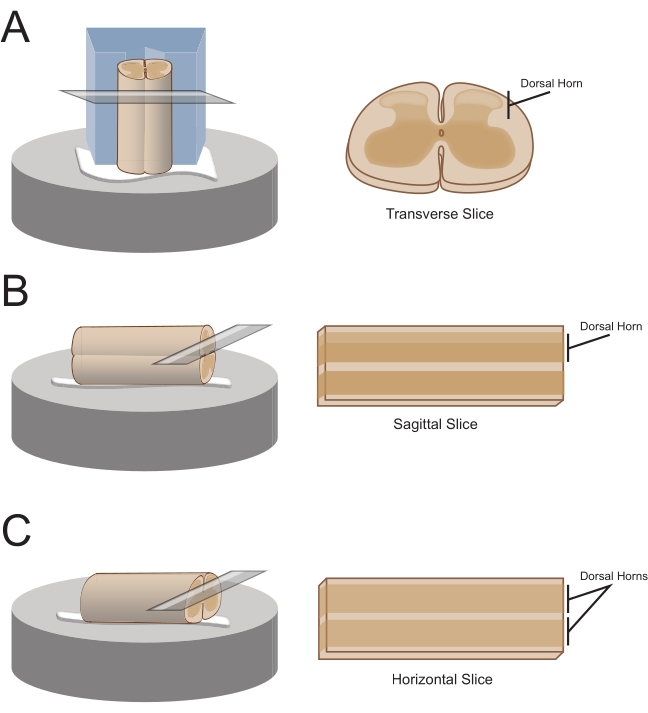
Рисунок 1: Ориентация срезов спинного мозга, методы монтажа и резки. (A) Для поперечных ломтиков требуется режущий блок из пенополистирола с вырезанной в него опорной канавкой. Спинной мозг опирается на блок в опорной бороздке, спинная сторона спинного мозга обращена в сторону от блока. Блок и шнур наклеиваются на ступень резки цианоакрилатным клеем. (B) Сагиттальные ломтики получают путем размещения тонкой линии цианоакрилатного клея на стадии резания, а затем позиционирования спинного мозга на боку на клее. (C) Горизонтальные ломтики получают путем размещения тонкой линии цианоакрилатного клея на стадии резания, а затем позиционирования вентральной стороны спинного мозга вниз на клее. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Получайте срезы толщиной 300 мкм (L1-L5, одинаковой толщины независимо от ориентации) с помощью вибрационного микротома со следующими настройками: скорость 0,06 мм/с, амплитуда 2,50 мм и калиброванной с точностью до отклонения амплитуды высоты ±0,02.
- Переложите срезы в инкубационную камеру с воздушным интерфейсом, содержащую насыщенный кислородом aCSF.
- Перед записью дайте срезам уравновеситься в течение 1 ч при комнатной температуре (20-24 °C).
- Микроэлектродные массивы записей
ПРИМЕЧАНИЕ: Следующие шаги подробно описывают, как использовать данные записи из экспериментов на основе MEA на срезах спинного мозга. В зависимости от эксперимента можно использовать несколько конструкций MEA. Сведения о конструкции МПС, используемых в этих экспериментах, приведены в разделе Таблица 2 и Рисунок 2. Подробная проектная информация была опубликована Egert et al.26 и Тибо и др.27 для планарных и 3-мерных (3D) МЭС соответственно. Оба типа MEA состоят из 60 электродов нитрида титана с изоляционным слоем нитрида кремния и дорожками нитрида титана и контактными прокладками.- Экспериментальная установка
- Включите компьютер и интерфейсную плату и запустите программное обеспечение для записи.
- Загрузите предварительно собранный шаблон записи (рисунок 3A). Присвойте файлам имя за день на вкладке рекордера.
- Непрерывно пузырьки aCSF с карбогеном (5% CO2, 95% O2) в течение всего эксперимента.
- Включите перфузионную систему, которая управляется перистальтическим насосом. Поместите впускную линию в aCSF, а входной конец в стакан для отходов. Загрунтуйте перфузионные линии с помощью aCSF.
- Готовят 4-АП и любые другие растворы лекарственных средств путем разбавления запасов в 50 мл КСФС до требуемой конечной концентрации (например, 200 мкМ для 4-АП).
- Поместите растворы препарата в кастрюли и разбейте в них карбогеном.
- Активность 4-AP
- После инкубации переложите один ломтик из инкубатора с помощью пипетки Пастера с большим наконечником, наполненной aCSF.
- Поместите ломтик в колодец MEA и добавьте дополнительный aCSF.
- Поместите срез на 60-электродную записывающую решетку с помощью тонкой короткой кисти для волос. Избегайте контакта электродов с кистью или перетаскивания ткани по электродам, особенно при использовании 3D-массивов.
ПРИМЕЧАНИЕ: В зависимости от компоновки MEA, это может быть сделано с помощью или без помощи микроскопа для точного позиционирования. - После позиционирования среза поместите утяжеленную сетку на ткань, чтобы удерживать ее на месте и способствовать хорошему контакту с электродами MEA.
ПРИМЕЧАНИЕ: Фрагмент может нуждаться в перемещении после чистого размещения. - Поместите MEA в головную часть записи (рисунок 2A,B).
- Проверьте положение ткани над электродами с помощью инвертированного микроскопа (2-кратное увеличение), чтобы подтвердить, что под поверхностным DH (SDH) находится как можно больше электродов. Убедитесь, что по крайней мере 2-6 электродов не контактируют со срезом, так как эти электроды важны для вычитания шума и записи артефактов во время анализа (рисунок 2E).
- Включите камеру, подключите ее к устройству и сделайте эталонное изображение среза относительно MEA для использования во время анализа.
- Нажмите Start DAQ в программном обеспечении записи и убедитесь, что все электроды получают четкий сигнал.
ПРИМЕЧАНИЕ: Если сигнал шумный, отстегните головную ступень и очистите контактные прокладки MEA и контакты золотой пружины с 70% этанолом (используйте лабораторную салфетку, чтобы убедиться, что прокладки и контакты сухие после очистки). Если сигнал все еще шумный, выключите неисправные электроды в записывающем программном обеспечении или запишите для исключения позже во время анализа. - Подключите впускную и выходную линии перфузии к MEA-скважине (предварительно заполненной aCSF) и включите перфузионную систему. Проверьте скорость потока, в идеале 4-6 объемов ванны в минуту, и убедитесь, что отток достаточен для предотвращения переполнения суперсыпания.
- Дайте ткани уравновеситься в течение 5 минут, а затем запишите 5 минут неочищенных, нефильтрованных исходных данных.
- Переместите впускную линию перфузии из aCSF в раствор 4-AP и подождите 12 минут, пока ритмическая активность, индуцированная 4-AP, достигнет устойчивого состояния (2 мин, чтобы препараты достигли ванны и 10 минут, чтобы активность достигла пика, а затем плато).
- Запись 5 мин 4-AP-индуцированной активности. Будьте готовы к последующим записям, чтобы протестировать препараты или проверить стабильность 4-AP.
- Экспериментальная установка
| Макеты микроэлектродных массивов | ||||
| Модель микроэлектродного массива | 60МЕА 200/30iR-Ti | 60-3ДМЭА 100/12/40iR-Ti | 60-3ДМЭА 200/12/50iR-Ti | 60МЭА 500/30iR-Ti |
| Плоский или 3-мерный (3D) | Плоскостной | 3D | 3D | Плоскостной |
| Электродная сетка | 8 х 8 | 8 х 8 | 8 х 8 | 6 х 10 |
| Расстояние между электродами | 200 мкм | 100 мкм | 200 мкм | 500 мкм |
| Диаметр электрода | 30 мкм | 12 мкм | 12 мкм | 30 мкм |
| Высота электрода (3D) | Н/Д | 40 мкм | 50 мкм | Н/Д |
| Эксперименты | Поперечный срез | Поперечный срез | Сагиттальный + Горизонтальный | Сагиттальный + Горизонтальный |
Таблица 2: Компоновка микроэлектродных массивов.
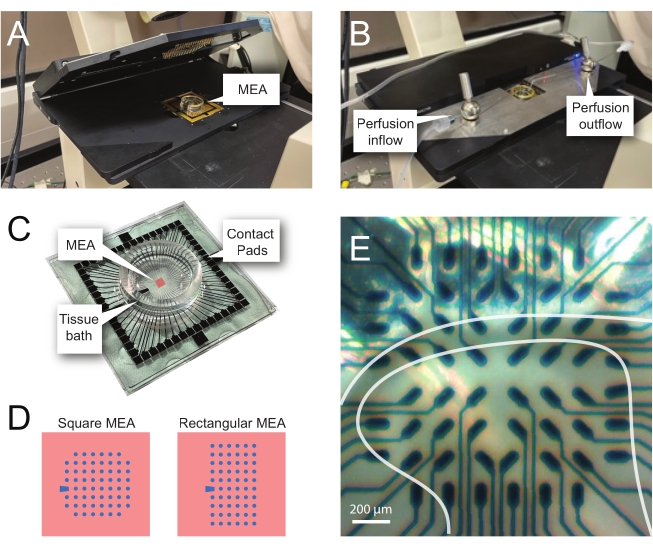
Рисунок 2: Позиционирование ткани на массиве микроэлектродов. (A) На изображении показана открытая головная ступень MEA с meA, размещенным в нужном положении. (B) То же самое, что и A с закрытой головной сценой MEA для записи и системой перфузии тканей. (C) На изображении показан МПС, поставляемый заводом-изготовителем. Показаны контактные прокладки, которые соприкасаются с золотыми пружинами головной сцены, и тканевая ванна MEA, которая удерживает раствор для купания тканей и срез ткани. Область, выделенная красным квадратом в центре, является местом расположения электродного массива. (D) Схемы показывают две конфигурации электродов MEA, используемые в этом исследовании, с более подробной информацией, представленной в таблице 2. Опорный электрод обозначается синей трапецией. Левая компоновка электродов MEA показывает квадратную конфигурацию с 60 электродами, наиболее используемую в представленных рабочих моделях 60MEA200/30iR-Ti с электродами диаметром 30 мкм, расположенными на расстоянии 200 мкм друг от друга, или 200 мкм с интервалом в 3-мерные MEA (60MEA200/12/50iR-Ti и 60MEA100/12/40iR-Ti) с электродами диаметром 12 мкм и высотой 50 мкм или 40 мкм, соответственно. Левая компоновка электродов MEA показывает прямоугольную компоновку электродов 6 x 10 - 60MEA500/30iR-Ti. (E) Изображение с высоким увеличением квадратного MEA 60MEA100/12/40iR-Ti с поперечным срезом спинного мозга, расположенным для записи. Срез сидит на электродных рядах 3-8. Верхний ряд электродов, которые не контактируют ни с одной тканью, служит опорными электродами. Область SDH выглядит как полупрозрачная полоса. В этом случае SDH перекрывает электроды в рядах 4, 5 и 6 и колонках 2, 3, 4, 5 и 7 MEA. Шкала бара = 200 мкм. Сокращения: MEA = микроэлектродный массив; SDH = поверхностный спинной рог. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Изменение фрагментов
- После каждого сеанса записи промывайте линии с помощью aCSF.
- Удалите MEA из головной сцены.
- Удалите сетку и ткань из MEA хорошо, хорошо промойте их с помощью aCSF и повторите вышеуказанные шаги с новым срезом.
2. Обработка и анализ данных
ПРИМЕЧАНИЕ: Следующие шаги подробно описывают, как использовать программное обеспечение для анализа для экспериментов MEA на срезах спинного мозга. Один из 60 электродов служит внутренним эталоном (отмеченным трапецией на рисунке 2 C,D), в то время как от четырех до двадцати пяти из оставшихся 59 расположены под SDH в срезе спинного мозга взрослой мыши. Последующий анализ обнаруживает формы сигналов внеклеточного потенциала действия (EAP) и локального потенциала поля (LFP) (см. Примеры на рисунке 3B ) из необработанного сигнала в этой области.
- Обработка необработанных данных
- Откройте программное обеспечение для анализа и загрузите готовый макет анализа (рисунок 3B).
- Откройте интересующий файл и снимите флажок электрода сравнения (электрод 15 в 8 x 8 MEA- или электрод E1 в конфигурации 6 x 10 MEA) и любые электроды, которые считаются чрезмерно шумными.
- Установите временное окно для анализа (0:00 → 5:00 мин).
- Перейдите на вкладку Межканальный фильтр . Выберите Комплексная ссылка и выберите Опорные электроды на основе сделанного изображения и заметок, сделанных во время эксперимента (т.е. тех электродов, которые не находятся под тканью). Чтобы применить и проверить это, нажмите Кнопка Проводник , прежде чем продолжить.
- Перейдите на вкладку фильтра EAP и примените фильтр Баттерворта2-го порядка высоких частот (отсечка 200 Гц), чтобы удалить активность LFP.
- Перейдите на вкладку фильтра LFP и примените фильтр Баттерворта2-го порядка диапазона (дельта-частоты 0,5-4 Гц), чтобы удалить активность EAP.
- Перейдите на вкладку Детектор EAP и выберите Автоматическое пороговое значение. Установите флажки Восходящий и Падающий края и установите время мертвой на 0,5 мс.
- Установите положительные и отрицательные пороговые значения на основе данных. Проверьте данные, вернувшись на экран анализатора необработанных данных, переместив маркер времени, а затем вернувшись на вкладку детектора EAP и нажав кнопку Проводник. Повторяйте до тех пор, пока не убедитесь, что установленный порог обнаружения захватывает EAP без захвата шума / нефизиологической активности. Используйте опорные электроды для определения шумовой/нефизиологической активности.
ПРИМЕЧАНИЕ: Необходимо обеспечить обнаружение минимального количества EAP в эталонных электродах, где физиологическая активность не будет происходить. Однако довольно незначительные отклонения в исходных условиях могут быть ложно обнаружены как EAP. Это при одновременном стремлении максимизировать количество реальных событий, обнаруженных в активных электродах. - Перейдите на вкладку детектора LFP , выберите порог Вручную, установите флажки Восходящий и Падающий края и установите для параметра Мертвое время значение 3 мс.
- Повторите шаг 2.1.8 для одного электрода, выбрав электрод с активностью LFP. После выполнения выберите Применить ко всем , так как пороговые значения будут применяться только к одному электроду при выполнении ручного порогового значения.
- При изучении данных LFP на вкладке Детектор обратите внимание на максимальное количество пороговых пересечений для одной формы сигнала LFP и максимальное временное разделение пороговых пересечений для одной формы сигнала LFP для использования в последующем анализе.
- Нажмите Начать анализ.
- После завершения анализа перейдите на вкладку Анализатор EAP и экспортируйте данные. Проделайте то же самое на вкладке анализатор LFP .
- Повторите этот процесс для всех остальных файлов из того же фрагмента.
- После экспорта данных преобразуйте файлы в формат xlsx, чтобы они могли быть прочитаны используемым сценарием программирования. Назовите файлы в соответствии со следующим соглашением для предоставленного скрипта для их чтения: название эксперимента (например, образцы данных) - номер среза (например, S1) - номер записи (например, R1) - тип деятельности (например, шипы или SP, соответствующие EAP или LFP, соответственно).
ПРИМЕЧАНИЕ: Анализ EAP, описанный здесь, рассматривает всплески из отдельных каналов как единую популяцию, хотя эта активность обычно возникает из нескольких нейронов в непосредственной близости от регистрирующего электрода. Если количество нейронов, вносящих вклад в EAP в канале, желательно, методы сортировки с несколькими щупками, описанные в другом месте, могут быть применены для различения различных популяций всплесков на основе характеристик формы сигнала28.
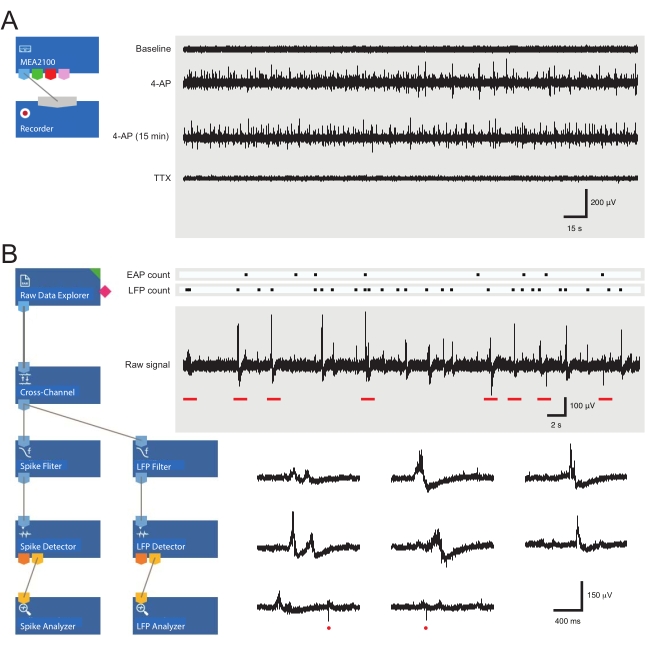
Рисунок 3: Макеты инструментов записи и анализа данных и примеры записей микроэлектродных массивов, показывающих потенциал внеклеточного действия и формы сигналов локального поля. (A) Schematic показывает предварительно настроенный шаблон записи, используемый для получения данных MEA. Связывание MEA2100 и инструмента записи (головной каскад/усилитель) позволяет именовать и сохранять данные. Четыре примера следов необработанных данных (справа, 5-минутные эпохи) были собраны одним каналом MEA, показывающим активность на исходном уровне, через 12 мин после применения 4-AP, еще через 15 мин после установленной активности 4-AP и после применения TTX (1 мкМ). Обратите внимание, что добавление 4-AP (второй след) приводит к явному увеличению фонового шума и активности EAP / LFP. Важно отметить, что активность остается относительно стабильной в течение, по крайней мере, 15 мин после установления активности, индуцированной 4-AP (третий след). Добавление TTX (1 мкМ) отменяет всю активность (нижняя трассировка). (B) Схема (слева) показывает конфигурацию программного обеспечения анализатора для анализа данных. Инструмент обозревателя необработанных данных используется для импорта записей, собранных программным обеспечением для записи. Затем эти данные проходят через инструмент кросс-канального фильтра, который вычитает выбранный сигнал (сигналы) опорного электрода (электродов) из других электродов для удаления фонового шума. Данные проходят через фильтр EAP и инструменты фильтра LFP для оптимизации отношений сигнал-шум для каждой формы сигнала. После этого шага данные пути EAP поступают в инструмент детектора EAP, где устанавливаются пороговые значения. EAP обнаруживаются, а затем отправляются в анализатор EAP, где задержки каждого события записываются и экспортируются в виде txt. файл. Идентичный рабочий процесс выполняется для данных LFP с использованием соответствующего набора инструментов LFP. Правые следы показывают данные из одного канала MEA, содержащего различные внеклеточные формы сигналов. Расположение сигналов EAP и LFP выделено в приведенном выше «подсчете растров». Нижние следы - это эпохи из верхней записи (обозначенные красными полосами), показывающие формы сигналов на расширенной временной шкале, включая различные сигналы LFP (обратите внимание на разнообразие появлений) и отдельные внеклеточные EAP (красные круги). Обратите внимание, что форма сигнала и полярность LFP / EAP варьируются относительно количества нейронов, производящих эти сигналы, их близости к записывающему электроду и их местоположения по отношению к ближайшему электроду (электродам). Сокращения: MEA = микроэлектродный массив; EAP = потенциал внеклеточного действия; LFP = локальный потенциал месторождения; 4-AP = 4-аминопиридин; TTX = тетродотоксин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Анализ синхронности
ПРИМЕЧАНИЕ: Синхронность, или число «совпадающих» событий между двумя электродами, определяли с использованием критерия совпадения в рамках метода синхронизации A-SPIKE, описанного Satuvuori et al. 29. Скрипт, используемый здесь, сравнивает только соседние друг с другом электроды по эффективности (т.е. горизонтальные, вертикальные и диагональные соседи); однако сценарий может быть переписан для сравнения всех электродов, если это необходимо.- Выполняйте анализ данных с помощью пользовательского сценария программирования, который извлекает временные метки задержки для каждого электрода из .xlsx файлов.
ПРИМЕЧАНИЕ: Это можно сделать вручную. - На этапе 2.1.11 запишите максимальное число пересечений пороговых значений и максимальное время разрыва пороговых значений для одной формы сигнала LFP. Измените сценарий для ввода этих LFP-определяющих параметров для каждого фрагмента перед запуском скрипта.
ПРИМЕЧАНИЕ: Пороговое значение, ранее выполненное в аналитическом программном обеспечении, четко фиксирует EAP как единое событие. Однако LFP состоят из переменного числа пиков в зависимости от формы сигнала и последующего числа пересечений порога одним событием. - Измените скрипт, чтобы ввести интересующие электроды перед анализом.
- Чтобы определить синхронность (определяемую в скрипте изменяемыми временными рамками для синхронной активности внутри), разделите и проанализируйте извлеченные задержки для обнаружения совпадающих событий.
ПРИМЕЧАНИЕ: Скрипт позволяет установить максимальное время между совпадающими событиями. Они установлены на уровне 20 мс для EAP и 200 мс для LFP. - Запустите сценарий для извлечения временных меток задержки.
ПРИМЕЧАНИЕ: Выходной файл .xlsx содержит интерпретации данных о задержке, которые представляют собой количество EAP и LFP, частоты и совпадения событий для отдельных электродов и целых срезов. Эти данные используются для оценки частоты, количества EAP/LFP, количества активных электродов, числа совпадающих событий, количества связанных электродов и средней прочности этих связей.
- Выполняйте анализ данных с помощью пользовательского сценария программирования, который извлекает временные метки задержки для каждого электрода из .xlsx файлов.
Результаты
Модель сетевой активности в спинном роге спинного мозга
Применение 4-АП надежно индуцирует синхронную ритмическую активность в ДГ спинного мозга. Такая деятельность проявляется в увеличении EAP и LFP. Более поздний сигнал представляет собой низкочастотную форму сигнала, котор...
Обсуждение
Несмотря на важность спинального DH в ноцицептивной передаче сигналов, обработке и результирующих поведенческих и эмоциональных реакциях, которые характеризуют боль, цепи в этой области остаются плохо изученными. Ключевой проблемой в исследовании этого вопроса было разнообразие попу...
Раскрытие информации
У авторов нет конфликта интересов, о которых можно было бы заявить.
Благодарности
Эта работа финансировалась Национальным советом по здравоохранению и медицинским исследованиям (NHMRC) Австралии (гранты 631000, 1043933, 1144638 и 1184974 B.A.G. и R.J.C.) и Институтом медицинских исследований Хантера (грант B.A.G. и R.J.C.).
Материалы
| Name | Company | Catalog Number | Comments |
| 4-aminopyridine | Sigma-Aldrich | 275875-5G | |
| 100% ethanol | Thermo Fisher | AJA214-2.5LPL | |
| CaCl2 1M | Banksia Scientific | 0430/1L | |
| Carbonox (Carbogen - 95% O2, 5% CO2) | Coregas | 219122 | |
| Curved long handle spring scissors | Fine Science Tools | 15015-11 | |
| Custom made air interface incubation chamber | |||
| Foetal bovine serum | Thermo Fisher | 10091130 | |
| Forceps Dumont #5 | Fine Science Tools | 11251-30 | |
| Glucose | Thermo Fisher | AJA783-500G | |
| Horse serum | Thermo Fisher | 16050130 | |
| Inverted microscope | Zeiss | Axiovert10 | |
| KCl | Thermo Fisher | AJA383-500G | |
| Ketamine | Ceva | KETALAB04 | |
| Large surgical scissors | Fine Science Tools | 14007-14 | |
| Loctite 454 Instant Adhesive | Bolts and Industrial Supplies | L4543G | |
| MATLAB | MathWorks | R2018b | |
| MEAs, 3-Dimensional | Multichannel Systems | 60-3DMEA100/12/40iR-Ti, 60-3DMEA200/12/50iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in an 8x8 square grid. Electrodes are 12 µm in diameter, 40 µm (100/12/40) or 50 µm (200/12/50) high and equidistantly spaced 100 µm (100/12/40) or 200 µm (200/12/50) apart. |
| MEA headstage | Multichannel Systems | MEA2100-HS60 | |
| MEA interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot | |
| MEA net | Multichannel Systems | ALA HSG-MEA-5BD | |
| MEA perfusion system | Multichannel Systems | PPS2 | |
| MEAs, Planar | Multichannel Systems | 60MEA200/30iR-Ti, 60MEA500/30iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in either a 8x8 square grid (200/30) or a 6x10 rectangular grid (500/30). Electrodes are 30 µm in diameter and equidistantly spaced 200 µm (200/30) or 500 µm (500/30) apart. |
| MgCl2 | Thermo Fisher | AJA296-500G | |
| Microscope camera | Motic | Moticam X Wi-Fi | |
| Multi Channel Analyser software | Multichannel Systems | V 2.17.4 | |
| Multi Channel Experimenter software | Multichannel Systems | V 2.17.4 | |
| NaCl | Thermo Fisher | AJA465-500G | |
| NaHCO3 | Thermo Fisher | AJA475-500G | |
| NaH2PO4 | Thermo Fisher | ACR207805000 | |
| Rongeurs | Fine Science Tools | 16021-14 | |
| Small spring scissors | Fine Science Tools | 91500-09 | |
| Small surgical scissors | Fine Science Tools | 14060-09 | |
| Sucrose | Thermo Fisher | AJA530-500G | |
| Superglue | cyanoacrylate adhesive | ||
| Tetrodotoxin | Abcam | AB120055 | |
| Vibration isolation table | Newport | VH3048W-OPT | |
| Vibrating microtome | Leica | VT1200 S |
Ссылки
- Smith, K. M., et al. Calretinin positive neurons form an excitatory amplifier network in the spinal cord dorsal horn. eLife. 8, 49190 (2019).
- Smith, K. M., et al. Functional heterogeneity of calretinin-expressing neurons in the mouse superficial dorsal horn: implications for spinal pain processing. The Journal of physiology. 593 (19), 4319-4339 (2015).
- Boyle, K. A., et al. Defining a spinal microcircuit that gates myelinated afferent input: Implications for tactile allodynia. Cell Reports. 28 (2), 526-540 (2019).
- Browne, T. J., et al. Transgenic cross-referencing of inhibitory and excitatory interneuron populations to dissect neuronal heterogeneity in the dorsal horn. Frontiers in Molecular Neuroscience. 13, 32 (2020).
- Graham, B. A., Hughes, D. I. Rewards, perils and pitfalls of untangling spinal pain circuits. Current Opinion in Physiology. 11, 35-41 (2019).
- Todd, A. J. Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience. 11 (12), 823-836 (2010).
- Hughes, D. I., Todd, A. J. Central nervous system targets: inhibitory interneurons in the spinal cord. Neurotherapeutics. 17 (3), 874-885 (2020).
- Duan, B., et al. Identification of spinal circuits transmitting and gating mechanical pain. Cell. 159 (6), 1417-1432 (2014).
- Hachisuka, J., Chiang, M. C., Ross, S. E. Itch and neuropathis itch. Pain. 159 (3), 603 (2018).
- Foster, E., et al. Targeted ablation, silencing, and activation establish glycinergic dorsal horn neurons as key components of a spinal gate for pain and itch. Neuron. 85 (6), 1289-1304 (2015).
- Bourane, S., et al. Identification of a spinal circuit for light touch and fine motor control. Cell. 160 (3), 503-515 (2015).
- Cheng, L., et al. Identification of spinal circuits involved in touch-evoked dynamic mechanical pain. Nature neuroscience. 20 (6), 804-814 (2017).
- Peirs, C., et al. Mechanical allodynia circuitry in the dorsal horn is defined by the nature of the injury. Neuron. 109 (1), 73-90 (2021).
- Huang, J., et al. Circuit dissection of the role of somatostatin in itch and pain. Nature Neuroscience. 21 (5), 707-716 (2018).
- Obien, M. E. J., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 8, 423 (2015).
- Nam, Y., Wheeler, B. C. In vitro microelectrode array technology and neural recordings. Critical Reviews in Biomedical Engineering. 39 (1), 45-61 (2011).
- Johnstone, A. F., et al. Microelectrode arrays: a physiologically based neurotoxicity testing platform for the 21st century. Neurotoxicology. 31 (4), 331-350 (2010).
- Stett, A., et al. Biological application of microelectrode arrays in drug discovery and basic research. Analytical and Bioanalytical Chemistry. 377 (3), 486-495 (2003).
- Xu, L., et al. Trends and recent development of the microelectrode arrays (MEAs). Biosensors and Bioelectronics. 175 (1), 112854 (2020).
- Chapman, R. J., Cilia La Corte, P. F., Asghar, A. U. R., King, A. E. Network-based activity induced by 4-aminopyridine in rat dorsal horn in vitro is mediated by both chemical and electrical synapses. The Journal of Physiology. 587, 2499-2510 (2009).
- Ruscheweyh, R., Sandkühler, J. Epileptiform activity in rat spinal dorsal horn in vitro has common features with neuropathic pain. Pain. 105 (1-2), 327-338 (2003).
- Kay, C. W., Ursu, D., Sher, E., King, A. E. The role of Cx36 and Cx43 in 4-aminopyridine-induced rhythmic activity in the spinal nociceptive dorsal horn: an electrophysiological study in vitro. Physiological Reports. 4 (14), 12852 (2016).
- Jankowska, E., Lundberg, A., Rudomin, P., Sykova, E. Effects of 4-aminopyridine on synaptic transmission in the cat spinal cord. Brain Research. 240 (1), 117-129 (1982).
- Semba, K., Geller, H. M., Egger, M. D. 4-Aminopyridine induces expansion of cutaneous receptive fields of dorsal horn cells. Brain Research. 343 (2), 398-402 (1985).
- Ruscheweyh, R., Sandkühler, J. Long-range oscillatory Ca2+ waves in rat spinal dorsal horn. European Journal of Neuroscience. 22 (8), 1967-1976 (2005).
- Egert, U., et al. A novel organotypic long-term culture of the rat hippocampus on substrate-integrated multielectrode arrays. Brain Research Protocols. 2 (4), 229-242 (1998).
- Thiebaud, P., De Rooij, N., Koudelka-Hep, M., Stoppini, L. Microelectrode arrays for electrophysiological monitoring of hippocampal organotypic slice cultures. IEEE Transactions on Biomedical Engineering. 44 (11), 1159-1163 (1997).
- Rey, H. G., Pedreira, C., Quiroga, R. Q. Past, present and future of spike sorting techniques. Brain Research Bulletin. 119, 106-117 (2015).
- Satuvuori, E., et al. Measures of spike train synchrony for data with multiple time scales. Journal of Neuroscience Methods. 287, 25-38 (2017).
- Mendis, G. D. C., Morrisroe, E., Reid, C. A., Halgamuge, S. K., Petrou, S. Use of local field potentials of dissociated cultures grown on multi-electrode arrays for pharmacological assays. 38th Annual International Conference of the IEEE Engineering in Medicine and Biology Society. , 952-956 (2016).
- Hughes, D. I., et al. Morphological, neurochemical and electrophysiological features of parvalbumin-expressing cells: a likely source of axo-axonic inputs in the mouse spinal dorsal horn. The Journal of Physiology. 590 (16), 3927-3951 (2012).
- Peirs, C., Seal, R. P. Neural circuits for pain: recent advances and current views. Science. 354 (6312), 578-584 (2016).
- Li, J., Baccei, M. L. Developmental regulation of membrane excitability in rat spinal lamina I projection neurons. Journal of Neurophysiology. 107 (10), 2604-2614 (2012).
- Li, J., Baccei, M. L. Pacemaker neurons within newborn spinal pain circuits. Journal of Neuroscience. 31 (24), 9010-9022 (2011).
- Sandkühler, J., Eblen-Zajjur, A. Identification and characterization of rhythmic nociceptive and non-nociceptive spinal dorsal horn neurons in the rat. Neuroscience. 61 (4), 991-1006 (1994).
- Lucas-Romero, J., Rivera-Arconada, I., Roza, C., Lopez-Garcia, J. A. Origin and classification of spontaneous discharges in mouse superficial dorsal horn neurons. Scientific Reports. 8 (1), 9735-9735 (2018).
- Antonio, L., et al. L. al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. 260, 33-44 (2016).
- Avoli, M., Jefferys, J. G. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. 260, 26-32 (2016).
- Taccola, G., Nistri, A. Low micromolar concentrations of 4-aminopyridine facilitate fictive locomotion expressed by the rat spinal cord in vitro. Neuroscience. 126 (2), 511-520 (2004).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. Journal of Neurophysiology. 107 (2), 728-741 (2012).
- Egert, U., Heck, D., Aertsen, A. Two-dimensional monitoring of spiking networks in acute brain slices. Experimental Brain Research. 142 (2), 268-274 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены