JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마이크로전극 어레이를 이용한 척추 노셉티브 회로에서의 네트워크 활동 기록
요약
척수 등쪽 경적에서 네트워크 수준의 nociceptive 활성을 조사하기 위한 마이크로전극 어레이 기술과 4-아미노피리딘-유도된 화학적 자극의 조합된 사용이 개략적으로 설명된다.
초록
척수 등쪽 뿔 (DH) 내의 특정 유형의 뉴런의 역할과 연결성은 척추 통증 처리를 뒷받침하는 회로에 대한 점점 더 상세한 시각을 제공하기 위해 빠른 속도로 묘사되고 있습니다. 그러나, DH에서의 더 넓은 네트워크 활성에 대한 이러한 연결의 효과는 대부분의 연구가 단일 뉴런 및 작은 미세 회로의 활성에 초점을 맞추기 때문에 덜 잘 이해되고 있다. 대안으로, 많은 셀에 걸친 전기적 활동을 모니터링할 수 있는 미세전극 어레이(MEA)의 사용은 신경 활동의 높은 공간적 및 시간적 분해능을 제공한다. 여기에서, 4-아미노피리딘 (4-AP)으로 DH 회로를 화학적으로 자극함으로써 유도된 DH 활성을 연구하기 위해 마우스 척수 절편과 함께 MEAs의 사용이 기술된다. 생성된 리듬 활성은 피상적 DH로 제한되고, 시간이 지남에 따라 안정하며, 테트로도톡신에 의해 차단되고, 상이한 슬라이스 배향에서 조사될 수 있다. 함께,이 제제는 순진한 동물, 만성 통증의 동물 모델 및 유 전적으로 변경된 nociceptive 기능을 가진 마우스의 조직에서 DH 회로 활성을 조사하는 플랫폼을 제공합니다. 또한, 4-AP 자극 척수 절편에서의 MEA 기록은 척수 DH에서의 활성을 방해하는 신규한 항항민성 화합물의 능력을 평가하기 위한 신속한 스크리닝 도구로서 사용될 수 있다.
서문
척수 DH 내의 특정 유형의 억제 및 흥분성 인터뉴런의 역할은 빠른 속도로 밝혀지고 있습니다 1,2,3,4. 함께, 인터뉴런은 DH에서 뉴런의 95% 이상을 차지하며 nociception을 포함한 감각 처리에 관여합니다. 또한, 이러한 인터뉴런 회로는 말초 신호가 신경축을 상승시켜 뇌에 도달하고 통증 5,6,7에 대한 인식에 기여하는지 여부를 결정하는 데 중요합니다. 현재까지 대부분의 연구는 시험관내 세포 내 전기 생리학, 신경 해부학 표지 및 생체 내 행동 분석 1,3,8,9,10,11,12,13,14의 조합을 사용하여 단일 세포 또는 전체 유기체 수준의 분석에서 DH 뉴런의 역할을 조사했습니다. . 이러한 접근법은 통증 처리에서 특정 뉴런 집단의 역할에 대한 이해를 상당히 향상 시켰습니다. 그러나 특정 세포 유형과 작은 매크로 회로가 마이크로 회로 수준에서 많은 뉴런 집단에 어떻게 영향을 미치는지 이해하여 DH의 결과, 행동 반응 및 통증 경험을 형성하는 데 차이가 남아 있습니다.
매크로 회로 또는 다셀 레벨 기능을 조사할 수 있는 기술 중 하나는 마이크로전극 어레이(MEA)15,16이다. MEA는 수십 년 동안 신경계 기능을 조사하는 데 사용되어 왔습니다17,18. 뇌에서 그들은 신경 발달, 시냅스 가소성, 약리학 적 스크리닝 및 독성 테스트17,18에 대한 연구를 촉진했습니다. 이들은 MEA의 유형에 따라 시험관내 및 생체내 적용 모두에 사용될 수 있다. 또한, MEA의 개발은 빠르게 발전해 왔으며, 현재 다양한 전극 번호와 구성을 사용할 수 있습니다19. MEA의 주요 장점은 여러 전극15,16을 통해 높은 공간 및 시간적 정확도로 많은 뉴런에서 전기 활동을 동시에 평가할 수 있다는 것입니다. 이것은 뉴런이 회로와 네트워크, 제어 조건 및 국부적으로 적용된 화합물의 존재하에 어떻게 상호 작용하는지에 대한 광범위한 판독을 제공합니다.
시험관내 DH 제제의 한 가지 과제는 진행중인 활성 수준이 전형적으로 낮다는 것이다. 여기서, 이러한 과제는 DH 회로를 화학적으로 자극하기 위해 전압 게이팅된 K+ 채널 차단제인 4-아미노프리딘(4-AP)을 사용하는 척수 DH 회로에서 해결된다. 이 약물은 이전에 급성 척수 절편의 DH와 급성 생체 내 조건20,21,22,23,24에서 리듬 동기 전기 활동을 확립하는 데 사용되었습니다. 이 실험은 4-AP 유도 활성20,21,22,23,24,25를 특성화하기 위해 단일 세포 패치 및 세포외 기록 또는 칼슘 이미징을 사용했습니다. 함께,이 연구는 리듬 4-AP 유도 활성에 대한 흥분성 및 억제 시냅스 전달 및 전기 시냅스의 요구 사항을 입증했습니다. 따라서, 4-AP 반응은 약물-유도된 에피현상이라기보다는 생물학적 관련성을 갖는 천연 폴리시냅스 DH 회로를 마스크해제하는 접근법으로 간주되어 왔다. 더욱이, 4-AP 유도 활성은 신경병증성 통증 상태로서 진통 및 항간질 약물과 유사한 반응 프로파일을 나타내며, 콘넥신20,21,22와 같은 신규한 척추 기반 진통제 표적을 제안하는데 사용되어 왔다.
여기에서, MEAs와 척추 DH의 화학적 활성화를 4-AP와 결합하여 매크로 회로 또는 네트워크 수준의 분석에서 이러한 nociceptive 회로를 연구하는 제제가 설명된다. 이 접근법은 순진하고 신경 병증적인 '통증과 같은'조건에서 nociceptive circuit을 조사하기위한 안정적이고 재현 가능한 플랫폼을 제공합니다. 이 제제는 또한 알려진 진통제의 회로 수준 작용을 테스트하고 과민성 척수에서 새로운 진통제를 스크리닝하는 데 쉽게 적용 할 수 있습니다.
프로토콜
연구는 3-12개월령의 수컷 및 암컷 c57Bl/6 마우스에 대해 수행되었다. 모든 실험 절차는 뉴캐슬 대학의 동물 관리 및 윤리위원회 (프로토콜 A-2013-312 및 A-2020-002)에 따라 수행되었습니다.
1. 시험관내 전기생리학
- 척수 슬라이스 준비 및 기록을위한 용액 준비
- 인공 뇌척수액
참고 : 인공 뇌척수액 (aCSF)은 계면 인큐베이션 챔버에서 사용되며, 기록이 시작될 때까지 그리고 실험 중에 약물에 대한 향수 및 희석제로 조각이 저장됩니다. 상세한 조성 은 표 1 을 참조한다.
- 인공 뇌척수액
| 화학 | aCSF (mM) | aCSF (g/100 mL) | 자당 치환 aCSF (mM) | 자당 치환 aCSF (g/100 mL) | 고 칼륨 aCSF (mM) | 고칼륨 aCSF (g/100 mL) |
| 염화나트륨(NaCl) | 118 | 0.690 | - | - | 118 | 0.690 |
| 탄산수소나트륨(NaHCO3) | 25 | 0.210 | 25 | 0.210 | 25 | 0.210 |
| 포도당 | 10 | 0.180 | 10 | 0.180 | 10 | 0.180 |
| 염화 칼륨 (KCl) | 2.5 | 0.019 | 2.5 | 0.019 | 4.5 | 0.034 |
| 인산이 수소 나트륨 (NaH2PO4) | 1 | 0.012 | 1 | 0.012 | 1 | 0.012 |
| 마그네슘 클로라이드 (MgCl2) | 1 | 0.01 | 1 | 0.01 | 1 | 0.01 |
| 염화칼슘(CaCl2) | 2.5 | 0.028 | 2.5 | 0.028 | 2.5 | 0.028 |
| 자당 | - | - | 250 | 8.558 | - | - |
표 1: 인공 뇌척수액 조성물. 약어 : aCSF = 인공 뇌척수액.
- 증류수 2 L에 118 NaCl, 25NaHCO3, 10 글루코스, 2.5 KCl, 1 NaH2PO4, 1 MgCl2, 및2.5 CaCl2 (mM 중)CaCl2를 제외한 상기의 필요한 양을 첨가하여 aCSF를 제조하였다.
- 상기 용액을 5분 동안 카르보겐(95% O2, 5% CO2)으로 버블링하고CaCl2를 첨가한다.
참고: 이 단계는CaCl2 강수량을 방지합니다. 즉, 용액이 흐려지지 않아야 합니다. 실험 중 약물 적용을 위해, aCSF의 약물 스톡 용액을 원하는 최종 농도로 희석하십시오.
- 자당 치환 인공 뇌척수액
참고: 자당 치환 aCSF는 해부 및 척수 슬라이싱 중에 사용됩니다. 명칭에 의해 지시된 바와 같이, 수크로스는 삼투압을 유지하면서 이들 절차 동안 뉴런 자극을 감소시키기 위해 NaCl을 대체한다. 상세한 조성 은 표 1 을 참조한다.- 250 수크로스, 25NaHCO3, 10 글루코스, 2.5 KCl, 1 NaH2PO4, 1 MgCl2, 및2.5CaCl2 (mM의) 증류수 300 mL에 CaCl2를 제외한 상기 모든 것의 필요한 양을 첨가함으로써 수크로오스 치환된 aCSF를 제조하였다.
- 용액을 5 분 동안 카르보겐으로 버블 링한 다음CaCl2를 첨가하십시오.
- 용액을 약 40분 동안 또는 용액이 슬러리를 형성할 때까지 -80°C 냉동고에 보관한다. 고체가 얼지 않도록하고 슬러리 일관성이있는 동안 사용하십시오.
- 마이크로전극 어레이 준비
참고 : MEA의 접촉면은 친수성으로 만들기 위해 전처리가 필요합니다.- 실험 전에 MEA를 30분 동안 소 태아 혈청(FBS) 또는 말 혈청(HS)으로 잘 채운다.
- FBS 또는 HS를 제거하고 증류수가 더 이상 거품이 나지 않을 때까지 약 다섯 번의 증류수로 MEA를 완전히 헹구십시오. 사용할 준비가 된 aCSF로 우물을 채 웁니다.
- 급성 척수 슬라이스 준비
참고: 마우스 척수 슬라이스 준비는 Smith et al.2에 의해 이전에 기술된 바와 같다. 이상적으로, 요추 확대증의 제거는 8-10 분 이상 걸리지 않아야합니다 (아래 단계 1.3.2-1.3.11).- 100 mg / kg 케타민 (i.p.)으로 마우스를 깊이 마취 한 다음 큰 외과 용 가위를 사용하여 마우스를 무력화하십시오.
- 엉덩이 수준에서 피부를 약간 잘라서 복부 부위의 피부를 제거하십시오. 모든 피부가 제거 될 때까지, 즉 흉곽 케이지의 상단에서 골반의 꼭대기 (심실 및 등쪽 모두)까지 절단의 양쪽에있는 피부를 로스트랄로 당깁니다.
- 시체를 얼음 위에 놓고 복부 접근법을 사용하여 모든 내장을 제거하고 갈비뼈를 통해 흉골까지 절단하여 척추 기둥을 노출시킵니다.
- 견갑골 (약 T2에서 잘림)과 하지와 골반 (천골의 대략 꼭대기에서 잘려나는)과 같은 복부 흉곽을 제거하십시오.
- 척추 기둥과 늑골 제제를 얼음처럼 차가운 자당 aCSF를 함유 한 해부 욕조로 옮깁니다. 준비의 네 모서리 (복부 표면 위쪽)를 모두 고정하여 허리 근육과 부착 된 위쪽 갈비뼈를 통해 핀을 배치하십시오.
- rongeurs로 척추의 복부 표면 위에 놓인 모든 근육 및 결합 조직을 제거하고 T12에서 L2 척추 몸체 아래에있는 요추 확대 위의 척추 영역을 확인하십시오.
- 요추 확대 부위의 인과적 인 척추 신체를 제거하여 척추관에 앉을 때 척수에 접근 할 수 있도록하십시오.
- 구부러진 스프링 가위를 사용하여 척추 페디클을 양측으로 자르고 척추 몸을 로스트랄로 들어 올리고 당겨 척추의 복부와 등쪽 측면을 분리하고 척수를 노출시킵니다.
- 요추 확대를 드러내기 위해 척추 몸체를 제거한 후에는 탯줄이 자유롭게 떠 다닐 때까지 봄 가위로 척수를 고정시키는 나머지 뿌리를 조심스럽게 치우십시오.
- 요추 확대의 위와 아래에 로스트랄과 꼬리 절단으로 척수를 분리하여 코드의 대상 영역이 '자유롭게 떠 다니게'하십시오.
주: 선호하는 슬라이스 방향은 코드가 이후에 단면화를 위해 장착되는 방식을 결정합니다(그림 1). - 횡단 슬라이스의 경우, 요추 세그먼트를 부착 된 뿌리로 들어 올려 중앙에 얕은 채널을 자른 미리 자른 폴리스티렌 (스티로폼) 블록 (1cm x 1cm x 1cm)에 놓습니다. 시아노아크릴레이트 접착제( 재료 표 참조)를 사용하여 블록과 코드를 단면화 플랫폼에 부착하고 빙냉 수크로오스 aCSF(슬러리)를 함유하는 절단조에 놓습니다.
참고: 얕은 채널은 등쪽 쪽이 노출되고 탯줄의 흉부 끝이 블록 하단에 있는 척수를 고정하고 방향을 잡는 데 도움이 됩니다. - 시상 슬라이스의 경우, 단면 플랫폼에 시아 노 아크릴레이트 접착제의 얇은 라인을 놓고, 부착 된 뿌리에 의해 요추 확대를 들어 올린 다음 접착제 라인을 따라 코드를 배치하여 한쪽 측면이 접착제에 있고 다른 쪽이 위쪽으로 향하도록하십시오. 이를 빙냉 수크로오스 aCSF(슬러리)를 함유하는 절단욕에 넣는다.
- 수평 슬라이스의 경우, 단면화 플랫폼에 시안 노 아크릴레이트 접착제의 얇은 라인을 넣어. 부착 된 뿌리로 요추 확대를 들어 올리고 접착제 라인을 따라 요추 확대를 배치하여 복부 표면이 접착제에 있고 등쪽 표면이 위쪽을 향하게하십시오. 부착된 뿌리를 사용하여 코드를 배치합니다. 이를 빙냉 수크로오스 aCSF(슬러리)를 함유하는 절단욕에 넣는다.
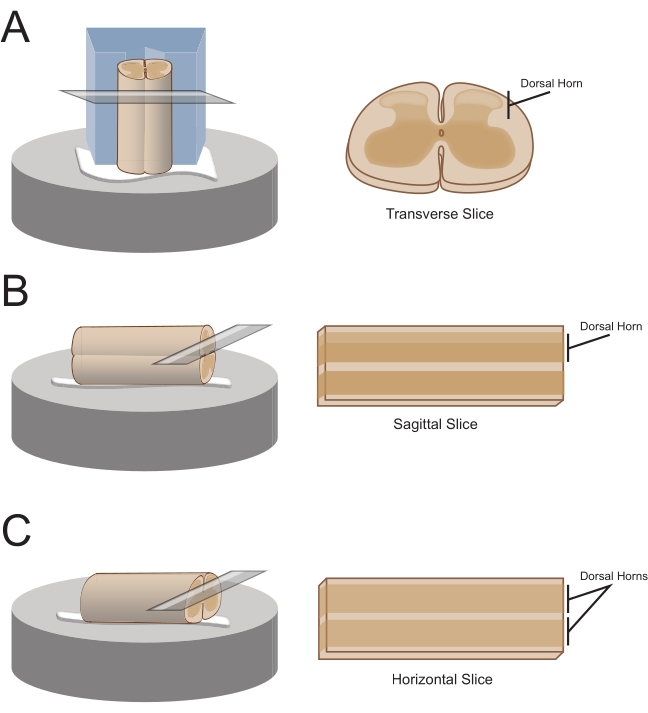
그림 1: 척수 슬라이스 방향, 장착 및 절단 방법. (A) 횡단 슬라이스에는 스티로폼 절단 블록이 필요하며 지지대가 잘립니다. 척수는 지지 홈의 블록에 대해 놓여 있으며, 코드의 등쪽 쪽은 블록에서 멀리 향합니다. 블록과 코드는 시아 노 아크릴레이트 접착제로 절단 단계에 접착됩니다. (B) 궁수 조각은 절단 단계에 시아 노 아크릴레이트 접착제의 얇은 선을 배치 한 다음 접착제 위에 척수를 그 측면에 배치하여 준비됩니다. (C) 수평 슬라이스는 절단 단계에 시아 노 아크릴레이트 접착제의 얇은 라인을 배치 한 다음 척수 복부 측면을 접착제 위에 내려 놓음으로써 준비됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 속도 0.06mm/s, 진폭 2.50mm, 높이 진폭 편차 ±0.02 이내로 보정된 진동 마이크로톰을 사용하여 300μm 두께의 슬라이스(L1-L5, 방향에 관계없이 동일한 두께)를 얻습니다.
- 슬라이스를 산소화된 aCSF를 함유하는 공기 계면 인큐베이션 챔버로 옮긴다.
- 기록하기 전에, 슬라이스가 실온 (20-24 °C)에서 1 시간 동안 평형을 이루도록 허용하십시오.
- 마이크로전극 어레이 레코딩
참고: 다음 단계에서는 척수 조각에 대한 MEA 기반 실험의 기록 데이터를 사용하는 방법을 자세히 설명합니다. 실험에 따라 여러 MEA 설계를 사용할 수 있습니다. 이러한 실험에 사용된 MEA에 대한 설계 세부사항은 다음과 같습니다. 표 2 그리고 그림 2. 상세한 설계 정보는 Egert et al.에 의해 출판되었다.26 Thiebaud et al.27 평면 및 3차원(3D) MEA의 경우, 각각. 두 MEA 유형 모두 질화 티타늄 전극 60 개로 구성되며 질화 실리콘 절연층과 질화 티타늄 트랙 및 접촉 패드가 있습니다.- 실험 설정
- 컴퓨터 및 인터페이스 보드를 켜고 녹음 소프트웨어를 시작하십시오.
- 미리 조립된 기록 템플릿을 로드합니다(그림 3A). 레코더 탭에서 해당 날짜의 파일 이름을 지정합니다.
- aCSF를 실험 기간 동안 카르보겐(5% CO2, 95%O2)으로 연속적으로 버블링한다.
- 연동 펌프에 의해 제어되는 관류 시스템을 켭니다. 입구 라인을 aCSF에 넣고 입구 끝을 폐기물 비이커에 넣으십시오. aCSF로 관류 라인을 프라임.
- 50 mL의 aCSF에서 스톡을 필요한 최종 농도로 희석하여 4-AP 및 임의의 다른 약물 용액을 준비한다(예를 들어, 4-AP의 경우 200 μM).
- 약물 용액을 약물 냄비에 넣고 탄수화물로 거품을 내십시오.
- 4-AP 활동
- 인큐베이션 후, aCSF로 채워진 대형 팁 파스퇴르 피펫을 사용하여 인큐베이터로부터 단일 슬라이스를 옮긴다.
- 슬라이스를 MEA 웰에 놓고 aCSF를 추가합니다.
- 슬라이스를 미세한 짧은 머리 페인트 브러시를 사용하여 60 전극 기록 어레이 위에 놓습니다. 특히 3D 배열을 사용하는 경우 전극을 페인트 브러시와 접촉하거나 전극을 가로 질러 티슈를 드래그하지 마십시오.
참고: MEA 레이아웃에 따라 정확한 위치 지정을 위해 현미경의 도움 유무에 관계없이 이 작업을 수행할 수 있습니다. - 슬라이스를 위치시킨 후, 조직 위에 가중 그물을 올려 제자리에 고정시키고 MEA 전극과의 양호한 접촉을 촉진하십시오.
참고: 슬라이스는 네트 배치에 따라 위치를 변경해야 할 수 있습니다. - MEA를 기록 헤드 스테이지에 배치합니다(그림 2A,B).
- 역현미경(2x 배율)을 이용하여 전극 위에 조직의 위치를 확인하여 가능한 한 많은 전극이 표면 DH(SDH) 아래에 있는지 확인합니다. 이러한 전극은 분석 중에 노이즈를 빼고 인공물을 기록하는 데 중요하므로 최소 2-6개의 전극이 슬라이스에 닿지 않도록 하십시오(그림 2E).
- 카메라를 켜고 장치에 연결한 다음 MEA를 기준으로 슬라이스의 참조 이미지를 촬영하여 분석 중에 사용합니다.
- 기록 소프트웨어에서 DAQ 시작 을 누르고 모든 전극이 명확한 신호를 수신하고 있는지 확인합니다.
참고: 신호가 시끄러운 경우 헤드스테이지의 클립을 풀고 MEA 접촉 패드와 골드 스프링 접점을 70% 에탄올로 모두 청소합니다(세척 후 패드와 접점이 건조한지 확인하려면 실험실 닦아내기를 사용하십시오). 신호가 여전히 시끄러운 경우 기록 소프트웨어에서 오작동하는 전극을 끄거나 나중에 분석 중에 제외하도록 메모해 두십시오. - 관류 입구 및 출구 라인을 MEA-우물(이전에 aCSF로 채워진)에 부착하고 관류 시스템을 켭니다. 분당 4-6 목욕 부피의 유량을 확인하고 유출이 과민 물의 오버플로를 방지하기에 충분한지 확인하십시오.
- 조직이 5분 동안 평형을 이루도록 허용한 다음, 여과되지 않은 원시 기준선 데이터의 5분을 기록한다.
- 관류 유입 라인을 aCSF에서 4-AP 용액으로 옮기고 4-AP 유도 리듬 활동이 정상 상태에 도달 할 때까지 12 분 동안 기다립니다 (약물이 욕조에 도달하는 데 2 분, 활동이 최고조에 도달하는 데 10 분, 고원).
- 5분간의 4-AP 유도 활성을 기록한다. 약물을 테스트하거나 4-AP의 안정성을 확인하기 위해 후속 기록을 준비하십시오.
- 실험 설정
| 마이크로전극 어레이 레이아웃 | ||||
| 마이크로전극 어레이 모델 | 60MEA 200/30iR-Ti | 60-3DMEA 100/12/40iR-Ti | 60-3DMEA 200/12/50iR-Ti | 60MEA 500/30iR-Ti |
| 평면 또는 3차원(3D) | 평면 | 3D | 3D | 평면 |
| 전극 그리드 | 8 x 8 | 8 x 8 | 8 x 8 | 6 x 10 |
| 전극 간격 | 200 μm | 100 μm | 200 μm | 500 μm |
| 전극 직경 | 30 μm | 12 μm | 12 μm | 30 μm |
| 전극 높이 (3D) | 해당 없음 | 40 μm | 50 μm | 해당 없음 |
| 실험 | 가로 슬라이스 | 가로 슬라이스 | 궁수 + 수평 | 궁수 + 수평 |
표 2: 마이크로전극 어레이 레이아웃.
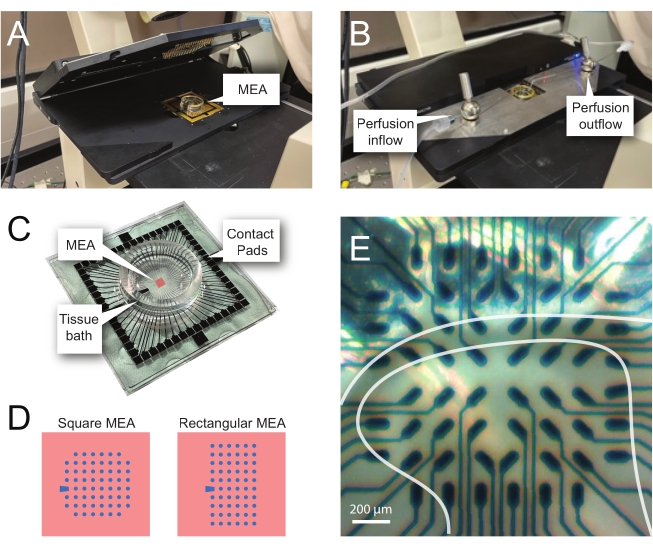
그림 2: 마이크로전극 어레이 상의 조직 위치 지정 . (A) 이미지는 MEA가 배치된 개방된 MEA 헤드스테이지를 보여준다. (B) 기록 및 조직 관류 시스템을 위해 MEA 헤드 스테이지가 닫힌 A 와 동일합니다. (C) 이미지는 제조업체가 제공한 MEA를 보여줍니다. 헤드 스테이지의 골드 스프링과 인터페이스하는 접촉 패드와 조직 입욕 용액 및 조직 슬라이스를 보유하는 MEA 조직 욕조가 표시됩니다. 중앙의 빨간색 사각형으로 강조 표시된 영역은 전극 어레이의 위치입니다. (d) 개략도는 본 연구에 사용된 2개의 MEA 전극 구성을 보여주며, 추가의 세부사항은 표 2에 제시되어 있다. 기준 전극은 청색 사다리꼴로 표시된다. 왼쪽 MEA 전극 레이아웃은 제시된 작업 모델에서 가장 많이 사용되는 60 전극 정사각형 구성을 나타내며, 직경 200 μm 간격으로 30 μm 직경 전극을 갖는 60MEA200/30iR-Ti, 또는 200 μm 간격 및 100 μm 간격의 3차원 MEA (60MEA200/12/50iR-Ti 및 60MEA100/12/40iR-Ti)와 직경 12 μm 및 높이 50 μm 또는 40 μm 높이의 전극을 갖는, 각각. 좌측 MEA 전극 레이아웃은 6 x 10 전극 직사각형 레이아웃-60MEA500/30iR-Ti를 나타낸다. (E) 횡단 척수 슬라이스가 레코딩을 위해 배치된 60MEA100/12/40iR-Ti 정사각형 MEA의 고배율 이미지. 슬라이스는 전극 행 3-8에 있습니다. 어떤 조직에도 접촉하지 않는 전극의 윗줄은 기준 전극 역할을합니다. SDH 영역은 반투명 밴드로 나타납니다. 이 경우 SDH는 MEA의 4, 5 및 6 열과 2, 3, 4, 5 및 7 열의 전극을 덮어 씁니다. 스케일 바 = 200 μm. 약어: MEA = 마이크로전극 어레이; SDH = 피상적 인 등쪽 뿔. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 슬라이스 변경
- 각 녹화 세션이 끝나면 aCSF로 선을 헹구십시오.
- 헤드 스테이지에서 MEA를 제거합니다.
- MEA 웰에서 그물과 조직을 제거하고 aCSF로 잘 헹구고 새 슬라이스로 위의 단계를 반복하십시오.
2. 데이터 처리 및 분석
참고: 다음 단계에서는 척수 조각에 대한 MEA 실험에 분석 소프트웨어를 사용하는 방법을 자세히 설명합니다. 60개의 전극 중 하나는 내부 기준( 그림 2 C,D에서 사다리꼴로 표시됨)으로 사용되는 반면, 나머지 59개 중 4개에서 이십오 개 사이는 성인 마우스 척수 슬라이스의 SDH 아래에 위치합니다. 후속 분석은 이 영역의 원시 신호로부터 세포외 작용 전위(EAP) 및 국부장 전위(LFP) 파형(예를 들어 도 3B 참조)을 검출한다.
- 원시 데이터 처리
- 분석 소프트웨어를 열고 미리 만들어진 분석 레이아웃을 로드합니다(그림 3B).
- 관심 있는 파일을 열고 기준 전극(8 x 8의 MEA- 또는 6 x 10 MEA 구성의 전극 E1의 전극 15) 및 과도하게 시끄러운 것으로 간주되는 전극을 선택 해제합니다.
- 분석할 시간 창을 설정합니다(0:00 → 5:00분).
- 교차 채널 필터 탭으로 이동합니다. 복합 참조를 선택하고 촬영한 이미지와 실험 중에 작성한 메모(즉, 조직 아래에 없는 전극)를 기반으로 참조 전극을 선택합니다. 이를 적용하고 확인하려면 계속하기 전에 탐색을 누릅니다.
- EAP 필터 탭으로 이동하고 2차 하이패스 버터워스 필터(200Hz 컷오프)를 적용하여 LFP 활동을 제거합니다.
- LFP 필터 탭으로 이동하고 2차 대역 통과 버터워스 필터(0.5-4Hz의 델타 주파수)를 적용하여 EAP 활동을 제거합니다.
- EAP 감지기 탭으로 이동하고 자동 임계값을 선택합니다. 상승 및 하강 가장자리 상자를 선택하고 데드 타임을 0.5ms로 설정합니다.
- 데이터를 기반으로 양 수 및 음수 임계값 을 설정합니다. 원시 데이터 분석기 화면으로 돌아가서 시간 마커를 이동한 다음 EAP 검출기 탭으로 돌아가서 탐색을 눌러 데이터를 검사 합니다. 설정된 감지 임계값이 잡음/비생리적 활동을 캡처하지 않고 EAP를 캡처한다는 것이 만족될 때까지 반복합니다. 기준 전극을 사용하여 소음/비생리적 활성을 식별하십시오.
참고: 생리 활성이 발생하지 않는 기준 전극에서 최소 수의 EAP가 검출되도록 할 필요가 있습니다. 그러나 기준선의 약간의 편차가 EAP로 잘못 감지될 수 있습니다. 이것은 여전히 활성 전극에서 검출되는 실제 이벤트의 수를 최대화하는 것을 목표로하고 있습니다. - LFP 검출기 탭으로 이동하고, 수동 임계값을 선택하고, 상승 및 하강 에지 상자를 체크하고, 데드 타임을 3ms로 설정합니다.
- LFP 활성을 갖는 전극을 선택하여 하나의 전극에 대해 2.1.8 단계를 반복한다. 충족되면 수동 임계값을 수행할 때 임계값이 단일 전극에만 적용되므로 모두에 적용 을 선택합니다.
- 검출기 탭에서 LFP 데이터를 검사하는 동안 하나의 LFP 파형에 대한 최대 임계값 교차 수와 이후 분석에 사용하기 위해 하나의 LFP 파형에 대한 임계값 교차의 최대 시간 분리를 기록해 둡니다.
- 분석 시작을 누릅니다.
- 분석이 완료되면 EAP 분석기 탭으로 이동하여 데이터를 내보냅니다. LFP 분석기 탭에서도 동일한 작업을 수행합니다.
- 동일한 슬라이스의 다른 모든 파일에 대해 이 프로세스를 반복합니다.
- 데이터 내보내기 후 파일을 xlsx 형식으로 변환하여 사용된 프로그래밍 스크립트에서 읽을 수 있도록 합니다. 제공된 스크립트가 이를 판독하기 위해 다음의 규칙에 따라 파일의 이름을 지정합니다: 실험 이름(예를 들어, 샘플 데이터) - 슬라이스 번호(예를 들어, S1) - 기록 번호(예를 들어, R1) - 활동 유형(예를 들어, 스파이크 또는 SP들, 각각 EAP 또는 LFP들에 대응함).
참고: 여기에 설명된 EAP 분석은 개별 채널로부터의 스파이킹을 단일 집단으로 취급하지만, 이 활동은 일반적으로 기록 전극에 근접한 여러 뉴런에서 발생한다. 채널 내의 EAP에 기여하는 뉴런의 수가 요망되는 경우, 다른 곳에서 설명된 멀티스파이크 정렬 기술은 파형 특성(28)에 기초하여 스파이크의 별개의 집단을 구별하기 위해 적용될 수 있다.
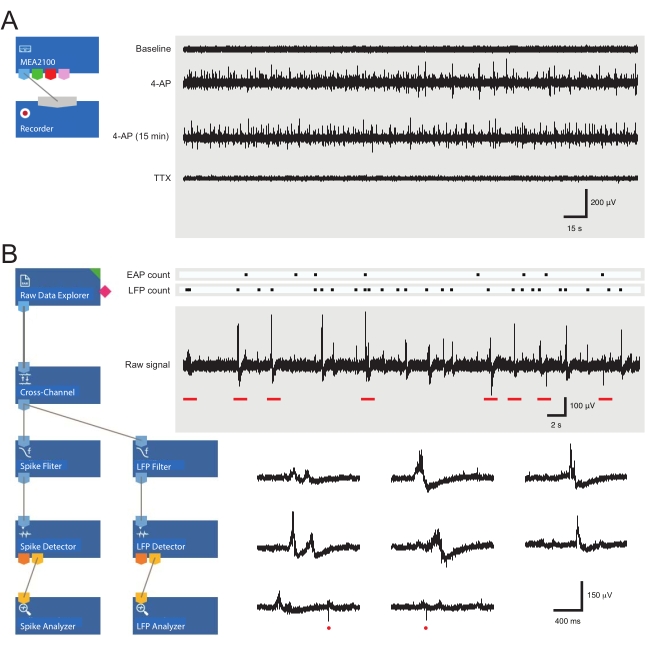
그림 3: 데이터 기록 및 분석 도구 레이아웃 및 세포외 활동 전위 및 국부장 전위 파형을 보여주는 미세전극 어레이 기록의 예. (A) 회로도는 MEA 데이터 수집에 사용되는 미리 구성된 기록 템플릿을 보여줍니다. MEA2100과 기록(헤드스테이지/증폭기) 도구를 연결하면 데이터의 이름을 지정하고 저장할 수 있습니다. 원시 데이터의 4가지 예시적인 흔적들(오른쪽, 5-분 에포크들)을 베이스라인에서의 활성을 나타내는 하나의 MEA 채널에 의해, 4-AP 적용 후 12분, 확립된 4-AP 활성 후 15분, 및 TTX(1 μM)의 목욕 적용 후 추가로 수집하였다. 4-AP(두 번째 추적)를 추가하면 배경 잡음과 EAP/LFP 활동이 명확하게 증가합니다. 중요하게도, 활성은 4-AP 유도 활성이 확립된 후 적어도 15분 동안 비교적 안정하게 유지된다(세 번째 추적). TTX (1 μM)의 첨가는 모든 활성 (하단 트레이스)을 폐지합니다. (B) 회로도(왼쪽)는 데이터 분석을 위한 분석기 소프트웨어 구성을 보여줍니다. 원시 데이터 탐색기 도구는 기록 소프트웨어에 의해 수집 된 녹음을 가져 오는 데 사용됩니다. 그런 다음 이러한 데이터는 배경 잡음을 제거하기 위해 다른 전극에서 선택한 기준 전극 신호를 뺀 교차 채널 필터 도구를 통해 실행됩니다. EAP 필터 및 LFP 필터 도구를 통해 데이터를 전달하여 각 파형에 대한 신호 대 잡음 관계를 최적화합니다. 이 단계에 따라 EAP 경로 데이터는 임계값이 설정된 EAP 검출기 도구로 들어갑니다. EAP가 감지된 후 EAP 분석기 도구로 전송되어 각 이벤트의 대기 시간이 기록되고 txt로 내보내집니다. 파일. 해당 LFP 툴킷을 사용하여 LFP 데이터에 대해 동일한 워크플로가 발생합니다. 오른쪽 트레이스는 다양한 세포외 파형을 포함하는 단일 MEA 채널의 데이터를 보여줍니다. EAP 및 LFP 신호의 위치는 위의 '카운트 래스터'에서 강조 표시됩니다. 아래쪽 트레이스는 다양한 LFP 신호(다양한 외관 참고) 및 개별 세포외 EAP(빨간색 원)를 포함하여 확장된 시간 척도에서 파형을 보여주는 상위 기록(빨간색 막대로 표시됨)의 에포크입니다. LFP/EAP 파형 및 극성은 이러한 신호를 생성하는 뉴런의 수, 기록 전극과의 근접성 및 근접 전극과의 위치에 따라 달라집니다. 약어: MEA = 마이크로전극 어레이; EAP = 세포외 작용 전위; LFP = 로컬 필드 전위; 4-AP = 4-아미노피리딘; TTX = 테트로도톡신. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 동시성 분석
참고: 동시성 또는 두 전극 사이의 '일치' 이벤트의 수는 Satuvuori et al.에 의해 개략화된 A-SPIKE-동기화 방법 내의 우연의 일치 기준을 사용하여 결정되었다. 29. 여기에 사용 된 스크립트는 효율성을 위해 서로 인접한 전극 (즉, 수평, 수직 및 대각선 이웃)을 비교합니다. 그러나 필요한 경우 모든 전극을 비교하기 위해 스크립트를 다시 작성할 수 있습니다.- 사용자 지정 프로그래밍 스크립트를 사용하여 데이터 분석을 수행하여 .xlsx 파일에서 각 전극의 대기 시간 타임스탬프를 추출합니다.
참고: 이 작업은 수동으로 수행할 수 있습니다. - 단계 2.1.11에서, 하나의 LFP 파형에 대한 임계 교차의 최대 수 및 임계 교차의 최대 시간 분리를 기록한다. 스크립트를 실행하기 전에 각 슬라이스에 대해 이러한 LFP 정의 매개변수를 입력하기 위한 스크립트를 수정하십시오.
참고: 분석 소프트웨어에서 이전에 수행된 임계값은 EAP를 단일 이벤트로 명확하게 캡처합니다. 그러나, LFPs는 파형의 형상 및 하나의 이벤트에 의한 임계치 교차의 후속 개수에 따라 가변적인 수의 피크들로 구성된다. - 분석 전에 관심 전극을 입력하도록 스크립트를 수정합니다.
- 동기성(스크립트에서 동기식 활동이 발생할 수 있도록 수정 가능한 시간 프레임으로 정의됨)을 확인하려면 추출된 대기 시간을 분리하고 분석하여 일치 이벤트를 감지합니다.
참고: 스크립트를 사용하면 일치 이벤트 사이의 최대 시간을 설정할 수 있습니다. EAP의 경우 20ms, LFP의 경우 200ms로 설정됩니다. - 스크립트를 실행하여 대기 시간 타임스탬프를 추출합니다.
참고: .xlsx 출력 파일에는 개별 전극 및 전체 슬라이스에 대한 EAP 및 LFP 카운트, 주파수 및 일치 이벤트 카운트인 대기 시간 데이터의 해석이 포함되어 있습니다. 이러한 데이터는 주파수, EAP/LFP 카운트, 활성 전극 수, 일치 이벤트 수, 연결된 전극 수 및 이러한 결합의 평균 강도를 평가하는 데 사용됩니다.
- 사용자 지정 프로그래밍 스크립트를 사용하여 데이터 분석을 수행하여 .xlsx 파일에서 각 전극의 대기 시간 타임스탬프를 추출합니다.
결과
척수 등쪽 경적의 네트워크 활동 모델
4-AP의 적용은 척수 DH에서 동기식 리듬 활동을 확실하게 유도한다. 이러한 활동은 EAP 및 LFP의 증가로 나타납니다. 후술하는 신호는 MEA 기록(30)에서 이전에 설명되었던 저주파 파형이다. 약물 적용 후 EAP 및/또는 LFP 활성의 변화는 변경된 신경 활성을 반영한다. EAP 및 LFP의 예는 그림 3B 및 ?...
토론
통각적 신호전달, 처리 및 통증을 특징짓는 행동 및 정서적 반응에서 척추 DH의 중요성에도 불구하고, 이 영역 내의 회로는 여전히 잘 이해되지 않고 있습니다. 이 문제를 조사하는 데있어 중요한 도전은 이러한 회로 6,31,32를 구성하는 뉴런 집단의 다양성이었습니다. 광유전학과 화학유전학이 주도하는 트랜스제닉 기술의 최근...
공개
저자는 선언 할 이해 상충이 없습니다.
감사의 말
이 연구는 호주 국립 보건 의학 연구위원회 (NHMRC) (B.A.G. 및 R.J.C.에 대한 631000, 1043933, 1144638 및 1184974 보조금)와 헌터 의학 연구소 (B.A.G. 및 R.J.C.에 대한 보조금)가 자금을 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 4-aminopyridine | Sigma-Aldrich | 275875-5G | |
| 100% ethanol | Thermo Fisher | AJA214-2.5LPL | |
| CaCl2 1M | Banksia Scientific | 0430/1L | |
| Carbonox (Carbogen - 95% O2, 5% CO2) | Coregas | 219122 | |
| Curved long handle spring scissors | Fine Science Tools | 15015-11 | |
| Custom made air interface incubation chamber | |||
| Foetal bovine serum | Thermo Fisher | 10091130 | |
| Forceps Dumont #5 | Fine Science Tools | 11251-30 | |
| Glucose | Thermo Fisher | AJA783-500G | |
| Horse serum | Thermo Fisher | 16050130 | |
| Inverted microscope | Zeiss | Axiovert10 | |
| KCl | Thermo Fisher | AJA383-500G | |
| Ketamine | Ceva | KETALAB04 | |
| Large surgical scissors | Fine Science Tools | 14007-14 | |
| Loctite 454 Instant Adhesive | Bolts and Industrial Supplies | L4543G | |
| MATLAB | MathWorks | R2018b | |
| MEAs, 3-Dimensional | Multichannel Systems | 60-3DMEA100/12/40iR-Ti, 60-3DMEA200/12/50iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in an 8x8 square grid. Electrodes are 12 µm in diameter, 40 µm (100/12/40) or 50 µm (200/12/50) high and equidistantly spaced 100 µm (100/12/40) or 200 µm (200/12/50) apart. |
| MEA headstage | Multichannel Systems | MEA2100-HS60 | |
| MEA interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot | |
| MEA net | Multichannel Systems | ALA HSG-MEA-5BD | |
| MEA perfusion system | Multichannel Systems | PPS2 | |
| MEAs, Planar | Multichannel Systems | 60MEA200/30iR-Ti, 60MEA500/30iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in either a 8x8 square grid (200/30) or a 6x10 rectangular grid (500/30). Electrodes are 30 µm in diameter and equidistantly spaced 200 µm (200/30) or 500 µm (500/30) apart. |
| MgCl2 | Thermo Fisher | AJA296-500G | |
| Microscope camera | Motic | Moticam X Wi-Fi | |
| Multi Channel Analyser software | Multichannel Systems | V 2.17.4 | |
| Multi Channel Experimenter software | Multichannel Systems | V 2.17.4 | |
| NaCl | Thermo Fisher | AJA465-500G | |
| NaHCO3 | Thermo Fisher | AJA475-500G | |
| NaH2PO4 | Thermo Fisher | ACR207805000 | |
| Rongeurs | Fine Science Tools | 16021-14 | |
| Small spring scissors | Fine Science Tools | 91500-09 | |
| Small surgical scissors | Fine Science Tools | 14060-09 | |
| Sucrose | Thermo Fisher | AJA530-500G | |
| Superglue | cyanoacrylate adhesive | ||
| Tetrodotoxin | Abcam | AB120055 | |
| Vibration isolation table | Newport | VH3048W-OPT | |
| Vibrating microtome | Leica | VT1200 S |
참고문헌
- Smith, K. M., et al. Calretinin positive neurons form an excitatory amplifier network in the spinal cord dorsal horn. eLife. 8, 49190 (2019).
- Smith, K. M., et al. Functional heterogeneity of calretinin-expressing neurons in the mouse superficial dorsal horn: implications for spinal pain processing. The Journal of physiology. 593 (19), 4319-4339 (2015).
- Boyle, K. A., et al. Defining a spinal microcircuit that gates myelinated afferent input: Implications for tactile allodynia. Cell Reports. 28 (2), 526-540 (2019).
- Browne, T. J., et al. Transgenic cross-referencing of inhibitory and excitatory interneuron populations to dissect neuronal heterogeneity in the dorsal horn. Frontiers in Molecular Neuroscience. 13, 32 (2020).
- Graham, B. A., Hughes, D. I. Rewards, perils and pitfalls of untangling spinal pain circuits. Current Opinion in Physiology. 11, 35-41 (2019).
- Todd, A. J. Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience. 11 (12), 823-836 (2010).
- Hughes, D. I., Todd, A. J. Central nervous system targets: inhibitory interneurons in the spinal cord. Neurotherapeutics. 17 (3), 874-885 (2020).
- Duan, B., et al. Identification of spinal circuits transmitting and gating mechanical pain. Cell. 159 (6), 1417-1432 (2014).
- Hachisuka, J., Chiang, M. C., Ross, S. E. Itch and neuropathis itch. Pain. 159 (3), 603 (2018).
- Foster, E., et al. Targeted ablation, silencing, and activation establish glycinergic dorsal horn neurons as key components of a spinal gate for pain and itch. Neuron. 85 (6), 1289-1304 (2015).
- Bourane, S., et al. Identification of a spinal circuit for light touch and fine motor control. Cell. 160 (3), 503-515 (2015).
- Cheng, L., et al. Identification of spinal circuits involved in touch-evoked dynamic mechanical pain. Nature neuroscience. 20 (6), 804-814 (2017).
- Peirs, C., et al. Mechanical allodynia circuitry in the dorsal horn is defined by the nature of the injury. Neuron. 109 (1), 73-90 (2021).
- Huang, J., et al. Circuit dissection of the role of somatostatin in itch and pain. Nature Neuroscience. 21 (5), 707-716 (2018).
- Obien, M. E. J., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 8, 423 (2015).
- Nam, Y., Wheeler, B. C. In vitro microelectrode array technology and neural recordings. Critical Reviews in Biomedical Engineering. 39 (1), 45-61 (2011).
- Johnstone, A. F., et al. Microelectrode arrays: a physiologically based neurotoxicity testing platform for the 21st century. Neurotoxicology. 31 (4), 331-350 (2010).
- Stett, A., et al. Biological application of microelectrode arrays in drug discovery and basic research. Analytical and Bioanalytical Chemistry. 377 (3), 486-495 (2003).
- Xu, L., et al. Trends and recent development of the microelectrode arrays (MEAs). Biosensors and Bioelectronics. 175 (1), 112854 (2020).
- Chapman, R. J., Cilia La Corte, P. F., Asghar, A. U. R., King, A. E. Network-based activity induced by 4-aminopyridine in rat dorsal horn in vitro is mediated by both chemical and electrical synapses. The Journal of Physiology. 587, 2499-2510 (2009).
- Ruscheweyh, R., Sandkühler, J. Epileptiform activity in rat spinal dorsal horn in vitro has common features with neuropathic pain. Pain. 105 (1-2), 327-338 (2003).
- Kay, C. W., Ursu, D., Sher, E., King, A. E. The role of Cx36 and Cx43 in 4-aminopyridine-induced rhythmic activity in the spinal nociceptive dorsal horn: an electrophysiological study in vitro. Physiological Reports. 4 (14), 12852 (2016).
- Jankowska, E., Lundberg, A., Rudomin, P., Sykova, E. Effects of 4-aminopyridine on synaptic transmission in the cat spinal cord. Brain Research. 240 (1), 117-129 (1982).
- Semba, K., Geller, H. M., Egger, M. D. 4-Aminopyridine induces expansion of cutaneous receptive fields of dorsal horn cells. Brain Research. 343 (2), 398-402 (1985).
- Ruscheweyh, R., Sandkühler, J. Long-range oscillatory Ca2+ waves in rat spinal dorsal horn. European Journal of Neuroscience. 22 (8), 1967-1976 (2005).
- Egert, U., et al. A novel organotypic long-term culture of the rat hippocampus on substrate-integrated multielectrode arrays. Brain Research Protocols. 2 (4), 229-242 (1998).
- Thiebaud, P., De Rooij, N., Koudelka-Hep, M., Stoppini, L. Microelectrode arrays for electrophysiological monitoring of hippocampal organotypic slice cultures. IEEE Transactions on Biomedical Engineering. 44 (11), 1159-1163 (1997).
- Rey, H. G., Pedreira, C., Quiroga, R. Q. Past, present and future of spike sorting techniques. Brain Research Bulletin. 119, 106-117 (2015).
- Satuvuori, E., et al. Measures of spike train synchrony for data with multiple time scales. Journal of Neuroscience Methods. 287, 25-38 (2017).
- Mendis, G. D. C., Morrisroe, E., Reid, C. A., Halgamuge, S. K., Petrou, S. Use of local field potentials of dissociated cultures grown on multi-electrode arrays for pharmacological assays. 38th Annual International Conference of the IEEE Engineering in Medicine and Biology Society. , 952-956 (2016).
- Hughes, D. I., et al. Morphological, neurochemical and electrophysiological features of parvalbumin-expressing cells: a likely source of axo-axonic inputs in the mouse spinal dorsal horn. The Journal of Physiology. 590 (16), 3927-3951 (2012).
- Peirs, C., Seal, R. P. Neural circuits for pain: recent advances and current views. Science. 354 (6312), 578-584 (2016).
- Li, J., Baccei, M. L. Developmental regulation of membrane excitability in rat spinal lamina I projection neurons. Journal of Neurophysiology. 107 (10), 2604-2614 (2012).
- Li, J., Baccei, M. L. Pacemaker neurons within newborn spinal pain circuits. Journal of Neuroscience. 31 (24), 9010-9022 (2011).
- Sandkühler, J., Eblen-Zajjur, A. Identification and characterization of rhythmic nociceptive and non-nociceptive spinal dorsal horn neurons in the rat. Neuroscience. 61 (4), 991-1006 (1994).
- Lucas-Romero, J., Rivera-Arconada, I., Roza, C., Lopez-Garcia, J. A. Origin and classification of spontaneous discharges in mouse superficial dorsal horn neurons. Scientific Reports. 8 (1), 9735-9735 (2018).
- Antonio, L., et al. L. al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. 260, 33-44 (2016).
- Avoli, M., Jefferys, J. G. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. 260, 26-32 (2016).
- Taccola, G., Nistri, A. Low micromolar concentrations of 4-aminopyridine facilitate fictive locomotion expressed by the rat spinal cord in vitro. Neuroscience. 126 (2), 511-520 (2004).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. Journal of Neurophysiology. 107 (2), 728-741 (2012).
- Egert, U., Heck, D., Aertsen, A. Two-dimensional monitoring of spiking networks in acute brain slices. Experimental Brain Research. 142 (2), 268-274 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유