需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用微电极阵列记录脊髓伤害感受回路中的网络活动
摘要
概述了微电极阵列技术和4-氨基吡啶诱导的化学刺激相结合的使用,以研究脊髓背角的网络级伤害感受活性。
摘要
脊髓背角(DH)内特定类型神经元的作用和连接性正在快速描绘,以提供支撑脊柱疼痛处理的电路的越来越详细的视图。然而,这些连接对DH中更广泛的网络活动的影响仍然不太清楚,因为大多数研究集中在单个神经元和小微电路的活动上。或者,使用微电极阵列(MEAs)可以监测许多细胞的电活动,提供神经活动的高空间和时间分辨率。在这里,描述了使用具有小鼠脊髓切片的MEA来研究由化学刺激4-氨基吡啶(4-AP)的DH回路诱导的DH活性。由此产生的节律活性仅限于浅表DH,随时间稳定,被河豚毒素阻断,并且可以在不同的切片方向上进行研究。总之,该制剂提供了一个平台来研究来自幼稚动物,慢性疼痛动物模型和具有遗传改变的伤害感受功能的小鼠组织中的DH回路活性。此外,4-AP刺激脊髓切片中的MEA记录可用作快速筛选工具,以评估新型抗伤害感受化合物破坏脊髓DH活性的能力。
引言
特定类型的抑制性和兴奋性中间神经元在脊髓 DH 中的作用正在以1,2,3,4 的速度被发现。中间神经元共同占DH中神经元的95%以上,并参与感觉处理,包括伤害感受。此外,这些中间神经元回路对于确定周围信号是否上升神经轴到达大脑并有助于疼痛感知5,6,7非常重要。迄今为止,大多数研究已经使用体外细胞内电生理学,神经解剖学标记和体内行为分析1,3,8,9,10,11,12,13,14的组合,研究了DH神经元在单细胞或全生物体水平上的作用。.这些方法显着推进了对特定神经元群体在疼痛处理中的作用的理解。然而,在理解特定细胞类型和小宏观回路如何在微电路水平上影响大量神经元以随后塑造DH的输出,行为反应和疼痛体验方面仍然存在差距。
可以研究宏电路或多细胞级功能的一种技术是微电极阵列(MEA)15,16。几十年来,MEAs一直用于研究神经系统功能17,18.在大脑中,它们促进了神经元发育,突触可塑性,药理筛选和毒性测试的研究17,18。它们可用于 体外 和 体内 应用,具体取决于MEA的类型。此外,多边环境协定的发展发展迅速,现在有不同的电极编号和配置19.MEAs的一个关键优点是它们能够通过多个电极同时评估许多神经元的电活动,具有很高的空间和时间精度15,16。这提供了神经元如何在控制条件下以及在局部应用的化合物存在下在电路和网络中相互作用的更广泛读数。
体外DH制剂的一个挑战是持续的活性水平通常较低。在这里,使用电压门控K +通道阻滞剂4-氨基吡啶(4-AP)在脊髓DH电路中解决了这一挑战,以化学刺激DH电路。该药物先前已用于在急性脊髓切片的DH中以及在急性体内条件下建立节律性同步电活动20,21,22,23,24。这些实验使用单细胞贴片和细胞外记录或钙成像来表征4-AP诱导的活性20,21,22,23,24,25。总之,这项工作已经证明了兴奋性和抑制性突触传递和电突触对于有节奏的4-AP诱导活性的需求。因此,4-AP反应被视为一种揭示具有生物学相关性的天然多突触DH回路的方法,而不是药物诱导的偶发现象。此外,4-AP诱导的活性表现出与神经性疼痛状况相似的镇痛和抗癫痫药物的反应谱,并已被用于提出新的基于脊柱的镇痛药物靶标,例如连接蛋白20,21,22。
这里描述了一种将MEA和脊柱DH的化学活化与4-AP相结合的制剂,以在宏观回路或网络水平分析中研究这种伤害性回路。这种方法为研究幼稚和神经性"疼痛样"条件下的伤害性回路提供了一个稳定且可重复的平台。该制剂也容易地应用于测试已知镇痛药的回路级作用,并在过度活跃的脊髓中筛选新型镇痛药。
研究方案
对3-12个月的雄性和雌性c57Bl / 6小鼠进行了研究。所有实验程序均按照纽卡斯尔大学动物护理和伦理委员会(协议A-2013-312和A-2020-002)进行。
1. 体外 电生理学
- 脊髓切片制备和记录溶液的制备
- 人工脑脊液
注意:人工脑脊液(aCSF)用于界面培养室,切片被储存直到记录开始和实验期间作为药物的灌注液和稀释剂。详细组成见 表1 。
- 人工脑脊液
| 化学的 | a综合寄宿家庭(平方米) | a多氯联苯 (克/100 毫升) | 蔗糖取代的有机碳化物 | 蔗糖取代的氯化碳(克/100毫升) | 高钾氯化钾 | 高钾的酸溶液 (克/100 毫升) |
| 氯化钠(氯化钠) | 118 | 0.690 | - | - | 118 | 0.690 |
| 碳酸氢钠 (钠高3) | 25 | 0.210 | 25 | 0.210 | 25 | 0.210 |
| 葡萄糖 | 10 | 0.180 | 10 | 0.180 | 10 | 0.180 |
| 氯化钾(KCl) | 2.5 | 0.019 | 2.5 | 0.019 | 4.5 | 0.034 |
| 磷酸二氢钠(NaH2PO4) | 1 | 0.012 | 1 | 0.012 | 1 | 0.012 |
| 氯化镁(氯化镁2) | 1 | 0.01 | 1 | 0.01 | 1 | 0.01 |
| 氯化钙(氯化钙2) | 2.5 | 0.028 | 2.5 | 0.028 | 2.5 | 0.028 |
| 蔗糖 | - | - | 250 | 8.558 | - | - |
表1:人工脑脊液组合物。 缩写:aCSF = 人工脑脊液。
- 通过将上述所需量(不包括钙2)加入2L蒸馏水中,制备含有(毫M)118纳氯,25 NaHCO3,10葡萄糖,2.5 KCl,1 NaH2 PO4,1MgCl2和2.5 CaCl 2的CSF。
- 用碳原(95%O2,5%CO2)将上述溶液泡泡5分钟,并加入CaCl2。
注意:此步骤可防止CaCl2 沉淀,即溶液不应变浑浊。对于实验期间的药物应用,将acSF中的药物储备溶液稀释至所需的最终浓度。
- 蔗糖取代的人工脑脊液
注意:蔗糖取代的acSF用于解剖和脊髓切片。如名称所示,蔗糖被NaCl取代,以减少这些过程中的神经元兴奋,同时保持渗透压。详细组成见 表1 。- 通过将上述所有必需量(不包括钙氯化物2)加入300毫升蒸馏水来制备含有(以mM为单位)250蔗糖,25NaHCO 3,10葡萄糖,2.5千氯,1 NaH2 PO4,1毫克氯化物2和2.5氯化钙2的蔗糖取代的acSF。
- 用碳原菌将溶液泡泡5分钟,然后加入CaCl2。
- 将溶液储存在-80°C冰箱中约40分钟或直到溶液形成浆液。避免冷冻固体,并在浆料稠度下使用。
- 微电极阵列制备
注意:MEA的接触面需要预处理以使其亲水。- 在实验之前,用胎牛血清(FBS)或马血清(HS)填充MEA30分钟。
- 取出FBS或HS,用大约五次蒸馏水彻底冲洗MEA,直到蒸馏水不再起泡。用 aCSF 填充井,随时可以使用。
- 急性脊髓切片制备
注意:小鼠脊髓切片的制备如前所述,Smith等人2。理想情况下,去除腰骶部肿大不应超过8-10分钟(下面的步骤1.3.2-1.3.11)。- 用100mg / kg氯胺酮(i.p.)深度麻醉小鼠,然后使用大手术剪刀将其斩首。
- 通过在臀部水平处的皮肤上做一个小切口来去除腹部区域的皮肤。将切口两侧的皮肤拉扯,直到所有皮肤被移除,即从肋骨笼的顶部到骨盆的顶部(腹侧和背部)。
- 将身体放在冰上,使用腹侧方法通过去除所有内脏并切开肋骨到胸骨的肋骨来暴露脊柱。
- 切除腹肋骨,肩胛骨(在大约T2处切断)以及下肢和骨盆(在大约骶骨顶部切断)。
- 将椎体柱和肋骨制剂转移到含有冰冷蔗糖ACSF的解剖浴中。通过将针穿过下背部肌肉和连接的上肋骨,将准备工作的所有四个角(腹面向上)固定。
- 用隆氏体切除椎骨腹侧表面上部的所有肌肉和结缔组织,并识别腰骶部肿大上方的椎体区域,该肿大位于T12至L2椎体下方。
- 切除尾部到腰骶部扩大区域的椎体,以提供进入脊髓的通道,因为它位于椎管中。
- 使用弯曲的弹簧剪刀,双侧切开椎骨蒂,同时抬起并拉动椎体,以分离椎骨的腹侧和背侧并暴露脊髓。
- 一旦椎体被切除以露出腰骶部肿大,请小心地用弹簧剪刀清除锚定脊髓的其余根部,直到脊髓漂浮自由。
- 用喙骨和尾部切口远高于和低于腰骶部扩大来隔离脊髓,使脊髓的目标区域"自由漂浮"。
注:首选的切片方向将决定随后如何安装电源线以进行切片(图1)。 - 对于横向切片,通过连接的根部抬起腰骶段,并将其放在预先切割的聚苯乙烯(聚苯乙烯泡沫塑料)块(1 cm x 1 cm x 1 cm)上,并在中心切开浅通道。使用氰基丙烯酸酯粘合剂(参见 材料表)将块和绳索连接到切片平台上,并将其置于含有冰冷蔗糖acSF(浆料)的切割槽中。
注意:浅通道有助于固定和定向脊髓,背侧暴露在外,脊髓的胸端位于阻滞的底部。 - 对于矢状切片,在切片平台上铺设一条细线的氰基丙烯酸酯粘合剂,通过连接的根部抬起腰骶部扩大,并将绳索沿着胶线放置,确保一个侧表面在粘合剂中,另一个面朝上。将其置于含有冰冷蔗糖ACSF(浆料)的切割浴中。
- 对于水平切片,在切片平台上放置一条细线的氰基丙烯酸酯粘合剂。通过附着的根部抬起腰骶部肿大,并将腰骶部扩大沿粘合剂线放置,确保腹面在粘合剂中并且背面朝上。使用连接的根部定位电源线。将其置于含有冰冷蔗糖ACSF(浆料)的切割浴中。
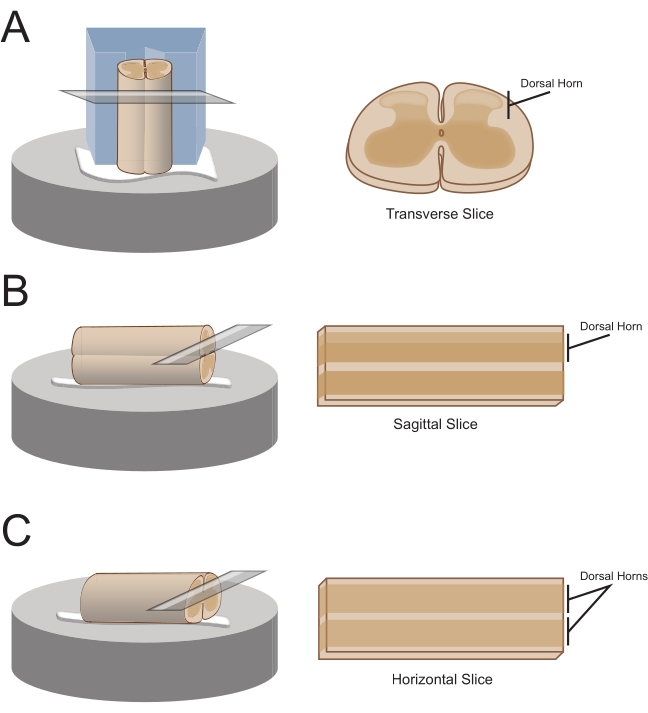
图 1:脊髓切片方向、安装和切割方法。 (A)横向切片需要一个聚苯乙烯泡沫塑料切割块,并在其中切割一个支撑槽。脊髓靠在支撑槽中的块上,脊髓的背侧朝向远离块。将块和绳索用氰基丙烯酸酯粘合剂粘在切割台上。(B)通过在切割阶段放置一条细线的氰基丙烯酸酯粘合剂,然后将脊髓侧放在胶水上来制备矢状切片。(C)通过在切割阶段放置一条细线的氰基丙烯酸酯粘合剂,然后将脊髓腹侧向下定位在胶上来制备水平切片。 请点击此处查看此图的大图。
- 使用以下设置的振动切片机获得300μm厚的切片(L1-L5,无论方向如何,厚度相同):速度0.06 mm / s,振幅2.50mm,并校准至±0.02高度振幅偏差以内。
- 将切片转移到含有含氧acSF的空气界面孵育室。
- 在记录之前,让切片在室温(20-24°C)下平衡1小时。
- 微电极阵列记录
注意:以下步骤详细介绍了如何在脊髓切片上使用基于MEA的实验的记录数据。根据实验情况,可以使用多种MEA设计。这些实验中使用的MEA的设计细节如 表 2 和 图2.详细的设计信息已由Egert等人发布。26 和蒂博等人。27 分别用于平面和三维 (3D) MEA。两种MEA类型均由60个氮化钛电极组成,带有氮化硅绝缘层和氮化钛轨道和接触垫。- 实验设置
- 打开计算机和接口板,然后启动录制软件。
- 加载预组装的录制模板(图3A)。在录制器选项卡中命名当天的文件。
- 在实验过程中用碳化物(5%CO2,95%O2)连续泡泡aCSF。
- 打开灌注系统,该系统由蠕动泵控制。将入口管路放入 aCSF 中,将入口端放入废烧杯中。用 aCSF 对灌注管线进行灌注。
- 通过将50 mL aCSF中的储备稀释至所需的最终浓度(例如,4-AP为200μM)来制备4-AP和任何其他药物溶液。
- 将药物溶液放入药罐中,并用卡本原将其打泡。
- 4-AP 活动
- 孵育后,使用装有 aCSF 的大头巴斯德移液器从培养箱中转移一片。
- 将切片放入 MEA 井中并添加其他 aCSF。
- 使用细短毛画笔将切片放在60电极记录阵列上。避免用画笔接触电极或将组织拖过电极,尤其是在使用3D阵列的情况下。
注意:根据MEA布局,这可以在显微镜的帮助下完成,也可以在没有显微镜的帮助下完成,以实现精确定位。 - 定位切片后,在组织上放置一个加权网以将其固定到位并促进与MEA电极的良好接触。
注:切片在净放置后可能需要重新定位。 - 将MEA放在录制的主机台上(图2A,B)。
- 使用倒置显微镜(2倍放大倍率)检查电极上方组织的位置,以确认尽可能多的电极位于表面DH(SDH)下。确保至少2-6个电极 不 接触切片,因为这些电极对于在分析过程中减去噪声和记录伪影非常重要(图2E)。
- 打开相机,将其连接到设备,然后相对于 MEA 拍摄切片的参考图像,以便在分析期间使用。
- 在 录音 软件 中 按 开始 DAQ , 并 确认 所有 电极 都 接收 了 清晰 的 信号。
注:如果信号有噪音,请松开主机,并用70%乙醇清洁MEA接触垫和金弹簧触点(使用实验室擦拭以确保清洁后垫和触点干燥)。如果信号仍然有噪音,请在记录软件中关闭故障电极,或记下以备稍后在分析过程中排除。 - 将灌注入口和出口管连接到MEA孔(以前填充了acSF)并打开灌注系统。检查流速,理想情况下为每分钟4-6个浴槽体积,并确保流出量足以防止超灌注物溢出。
- 让组织平衡5分钟,然后记录5分钟的原始,未过滤的基线数据。
- 将灌注入口管从aCSF移动到4-AP溶液中,等待12分钟以使4-AP诱导的节律活性达到稳定状态(药物到达浴池2分钟,活动达到峰值和平台化10分钟)。
- 记录5分钟的4-AP诱导的活动。为随后的记录做好准备,以测试药物或检查4-AP的稳定性。
- 实验设置
| 微电极阵列布局 | ||||
| 微电极阵列模型 | 60MEA 200/30iR-钛 | 60-3DMEA 100/12/40iR-钛 | 60-3DMEA 200/12/50iR-钛 | 60MEA 500/30iR-钛 |
| 平面或三维 (3D) | 平面的 | 三维 | 三维 | 平面的 |
| 电极栅 | 8 x 8 含泡沫塑料支架 | 8 x 8 含泡沫塑料支架 | 8 x 8 含泡沫塑料支架 | 6 x 10 含泡沫塑料支架 |
| 电极间距 | 200微米 | 100微米 | 200微米 | 500微米 |
| 电极直径 | 30微米 | 12微米 | 12微米 | 30微米 |
| 电极高度(3D) | 不适用 | 40微米 | 50微米 | 不适用 |
| 实验 | 横向切片 | 横向切片 | 矢状面 + 水平 | 矢状面 + 水平 |
表 2:微电极阵列布局。
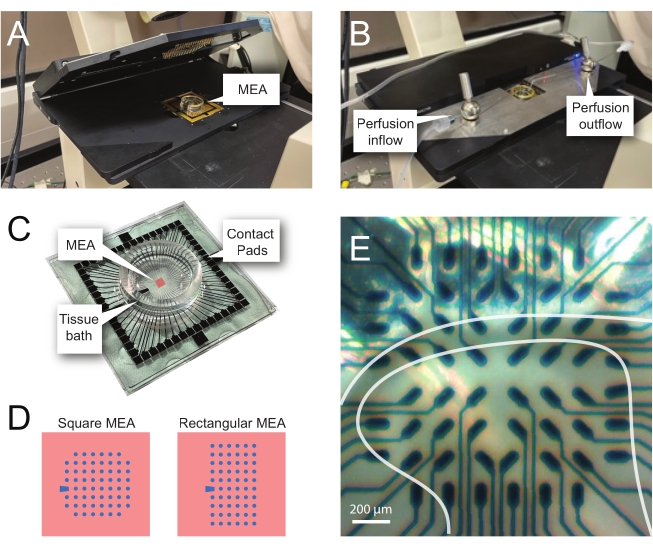
图 2:微电极阵列上的组织定位 (A) 图像显示了一个开放的 MEA 头级,其中 MEA 已就位。(B)与 A 相同,MEA头台关闭以进行记录和组织灌注系统。(C) 图像显示制造商提供的 MEA。图中显示了与头台的金弹簧相连接的接触垫,以及容纳组织浴溶液和组织切片的MEA组织浴。中心红色方块突出显示的区域是电极阵列的位置。(D)原理图显示了本研究中使用的两种MEA电极配置,进一步的细节见 表2。参比电极用蓝色梯形表示。左侧的 MEA 电极布局显示了 60 电极方形配置,在所展示的工作型号 60MEA200/30iR-Ti 中使用,其中 30 μm 直径的电极间隔 200 μm,或间隔 200 μm 和 100 μm 间隔的三维 MEA(60MEA200/12/50iR-Ti 和 60MEA100/12/40iR-Ti),电极直径为 12 μm,高度为 50 μm 或 40 μm, 分别。左侧的 MEA 电极布局显示了 6 x 10 电极矩形布局-60MEA500/30iR-Ti。(E) 60MEA100/12/40iR-Ti 方形 MEA 的高放大倍率图像,其中放置了横向脊髓切片以进行记录。切片位于电极排3-8上。不接触任何组织的顶行电极用作参比电极。SDH 区域显示为半透明波段。在这种情况下,SDH 覆盖 MEA 的第 4、5 和 6 行以及列 2、3、4、5 和 7 中的电极。比例尺 = 200 μm。缩略语:MEA =微电极阵列;SDH = 浅表背角。 请点击此处查看此图的大图。
- 更改切片
- 每次录制会话后,用 aCSF 冲洗线路。
- 从主机中移除 MEA。
- 从MEA中取出网和组织,用aCSF冲洗干净,然后用新切片重复上述步骤。
2. 数据处理和分析
注意:以下步骤详细介绍了如何使用分析软件对脊髓切片进行MEA实验。60个电极中的一个用作内部参考( 在图2 C,D中用梯形标记),而其余59个电极中的4到25个位于成年小鼠脊髓切片的SDH下方。随后的分析从该区域的原始信号中检测细胞外动作电位(EAP)和局部场电位(LFP)波形(例如参见 图3B )。
- 原始数据处理
- 打开分析软件并加载预制的分析布局(图3B)。
- 打开感兴趣的文件并取消选择参比电极(8 x 8 MEA 中的电极 15 或 6 x 10 MEA 配置的电极 E1)和任何被认为噪声过大的电极。
- 设置分析的时间窗口(0:00 → 5:00 分钟)。
- 移至 跨渠道过滤器 选项卡。选择 复杂参比 ,并根据实验期间拍摄的图像和笔记(即不在组织下的电极)选择 参比 电极。要申请并检查这一点,请按 探索 ,然后再继续。
- 移动到 EAP 滤波器 选项卡并应用二阶高 通巴特沃兹滤波器(200 Hz 截止)以删除 LFP 活动。
- 移动到 LFP 滤波器 选项卡并应用二 阶带通巴特沃兹滤波器(0.5-4 Hz 的增量频率)以消除 EAP 活动。
- 移动到 EAP 检测器选项卡,然后选择自动阈值。勾选上升沿和下降沿框,并将死区时间设置为 0.5 毫秒。
- 根据数据设置正阈值和负阈值。通过返回到原始数据分析器屏幕,移动时间标记,然后返回到 EAP 检测器选项卡并按"浏览"来检查数据。重复此步骤,直到确信设定的检测阈值正在捕获EAP,而不会捕获噪声/非生理活动。使用参比电极识别噪声/非生理活动。
注意:有必要确保在不会发生生理活动的参比电极中检测到最少数量的EAP。但是,基线的轻微偏差可能会被错误地检测为EAP。这仍然旨在最大限度地提高在有源电极中检测到的真实事件的数量。 - 移动到 LFP 检测器选项卡,选择手动阈值,勾选上升沿和下降沿框,然后将死区时间设置为 3 毫秒。
- 通过选择具有LFP活性的电极,对一个电极重复步骤2.1.8。满足后,选择" 应用于全部 ",因为在进行手动阈值设置时,阈值将仅应用于单个电极。
- 在" 检测器 "选项卡中检查 LFP 数据时,请注意一个 LFP 波形的最大阈值交叉数和一个 LFP 波形的阈值交叉的最大时间间隔,以便在以后的分析中使用。
- 按 开始分析。
- 分析完成后,移动到 EAP 分析器 选项卡并导出数据。在 LFP 分析器 选项卡上执行相同的操作。
- 对同一切片中的所有其他文件重复此过程。
- 数据导出后,将文件转换为 xlsx 格式,以便使用的编程脚本可以读取它们。根据以下约定命名文件,以便提供的脚本读取它们:实验名称(例如,样本数据)-切片编号(例如,S1)-记录编号(例如,R1)-活动类型(例如,尖峰或SP,分别对应于EAP或LFP)。
注意:这里描述的EAP分析将来自单个通道的峰值视为单个群体,即使这种活动通常来自靠近记录电极的多个神经元。如果需要通道中有助于EAP的神经元数量,则可以应用其他地方描述的多尖峰排序技术,根据波形特征28来区分不同的尖峰群体。
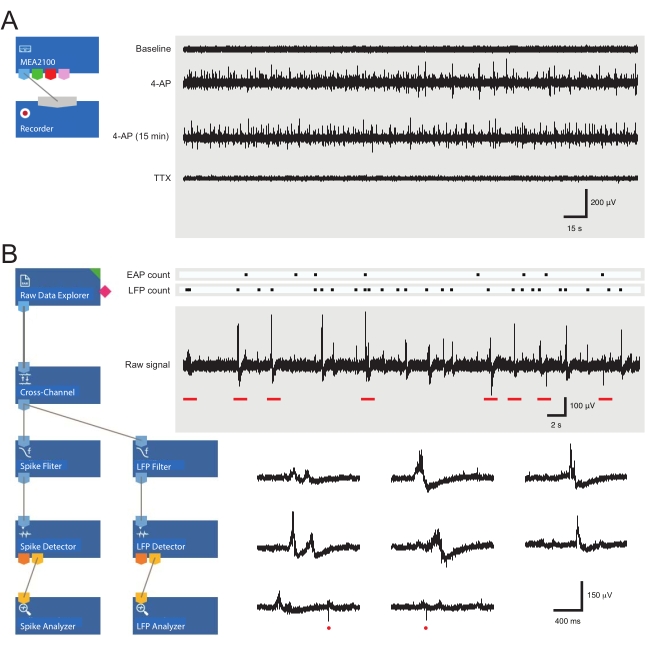
图 3:数据记录和分析工具布局以及显示细胞外动作电位和局部场电位波形的示例微电极阵列记录。通过连接 MEA2100 和记录(头级/放大器)工具,可以命名和保存数据。通过一个MEA通道收集原始数据的四个示例迹线(右,5分钟纪元),显示基线,4-AP应用后12分钟,建立4-AP活性后15分钟以及浴施用TTX(1μM)后的活性。请注意,添加 4-AP(第二条迹线)会导致背景噪声和 EAP/LFP 活动明显增加。重要的是,在建立4-AP诱导的活性后,活性保持相对稳定至少15分钟(第三条迹线)。添加TTX(1μM)可消除所有活性(底部迹线)。(B) 原理图(左)显示了用于数据分析的分析仪软件配置。原始数据浏览器工具用于导入录制软件收集的录制文件。然后,这些数据通过跨通道滤波器工具运行,该工具从其他电极中减去选定的参比电极信号,以消除背景噪声。数据通过EAP滤波器和LFP滤波器工具,以优化每个波形的信噪比关系。完成此步骤后,EAP 路径数据进入 EAP 检测器工具,其中设置了阈值。EAP 被检测到,然后发送到 EAP 分析器工具,其中记录了每个事件的延迟并导出为 txt。文件。使用相应的 LFP 工具包对 LFP 数据执行相同的工作流。右迹线显示来自包含各种细胞外波形的单个MEA通道的数据。EAP 和 LFP 信号的位置在上面的"计数栅格"中突出显示。下部迹线是来自上部记录(用红色条表示)的纪元,显示扩展时间尺度上的波形,包括各种LFP信号(注意各种外观)和单个细胞外EAP(红色圆圈)。请注意,LFP/EAP波形和极性随产生这些信号的神经元数量、它们与记录电极的距离以及它们相对于附近电极的位置而变化。缩略语:MEA =微电极阵列;EAP = 细胞外动作电位;LFP = 局部场电位;4-AP = 4-氨基吡啶;TTX = 河豚毒素。请点击此处查看此图的大图。
- 同步性分析
注意:同步性或两个电极之间的"重合"事件的数量是使用Satuvuori等人概述的A-SPIKE同步方法中的重合准则确定的。29. 此处使用的脚本仅比较彼此相邻的电极以提高效率(即水平,垂直和对角线邻居);但是,如果需要,可以重写脚本以比较所有电极。- 使用自定义编程脚本执行数据分析,该脚本从.xlsx文件中提取每个电极的延迟时间戳。
注意:这可以手动完成。 - 在步骤 2.1.11 中,记录一个 LFP 波形的最大阈值交叉次数和阈值交叉的最大时间间隔。在运行脚本之前,修改用于为每个切片输入这些 LFP 定义参数的脚本。
注意:以前在分析软件中执行的阈值将 EAP 清楚地捕获为单个事件。然而,LFP由可变数量的峰值组成,具体取决于波形的形状以及一个事件的阈值交叉的后续次数。 - 修改脚本以在分析前输入感兴趣的电极。
- 要确定同步性(在脚本中由同步活动发生的可修改时间范围定义),请分离并分析提取的延迟以检测重合事件。
注意:该脚本允许设置重合事件之间的最长时间。对于 EAP,这些参数设置为 20 ms,对于 LFP,这些值设置为 200 ms。 - 运行脚本以提取延迟时间戳。
注意:.xlsx输出文件包含对延迟数据的解释,即单个电极和整个切片的 EAP 和 LFP 计数、频率和重合事件计数。这些数据用于评估频率、EAP/LFP 计数、有源电极数、重合事件数、连接电极数以及这些连接的平均强度。
- 使用自定义编程脚本执行数据分析,该脚本从.xlsx文件中提取每个电极的延迟时间戳。
结果
脊髓背角网络活动模型
4-AP的应用可靠地诱导脊髓DH中的同步节律活动。这些活动表现为EAP和LFPs增加。后面的信号是低频波形,这在之前的MEA记录30中已经描述过。药物应用后EAP和/或LFP活性的变化反映了神经活动的改变。EAP 和 LFP 的示例如图 3B 和图 4 所示。这里的重点是EAP / LFP数据的以下参数或特征:频率,总数,活动?...
讨论
尽管脊髓DH在伤害性信号传导,处理以及由此产生的表征疼痛的行为和情绪反应中的重要性,但该区域内的回路仍然知之甚少。研究这个问题的一个关键挑战是构成这些电路的神经元群体的多样性6,31,32。以光遗传学和化学遗传学为首的转基因技术的最新进展开始解开这些重要的联系,并定义了处理感官信息的微电路
披露声明
作者没有利益冲突需要声明。
致谢
这项工作由澳大利亚国家卫生和医学研究委员会(NHMRC)资助(拨款631000,1043933,1144638,1184974给B.A.G.和R.J.C.)和亨特医学研究所(拨款给B.A.G.和R.J.C.)。
材料
| Name | Company | Catalog Number | Comments |
| 4-aminopyridine | Sigma-Aldrich | 275875-5G | |
| 100% ethanol | Thermo Fisher | AJA214-2.5LPL | |
| CaCl2 1M | Banksia Scientific | 0430/1L | |
| Carbonox (Carbogen - 95% O2, 5% CO2) | Coregas | 219122 | |
| Curved long handle spring scissors | Fine Science Tools | 15015-11 | |
| Custom made air interface incubation chamber | |||
| Foetal bovine serum | Thermo Fisher | 10091130 | |
| Forceps Dumont #5 | Fine Science Tools | 11251-30 | |
| Glucose | Thermo Fisher | AJA783-500G | |
| Horse serum | Thermo Fisher | 16050130 | |
| Inverted microscope | Zeiss | Axiovert10 | |
| KCl | Thermo Fisher | AJA383-500G | |
| Ketamine | Ceva | KETALAB04 | |
| Large surgical scissors | Fine Science Tools | 14007-14 | |
| Loctite 454 Instant Adhesive | Bolts and Industrial Supplies | L4543G | |
| MATLAB | MathWorks | R2018b | |
| MEAs, 3-Dimensional | Multichannel Systems | 60-3DMEA100/12/40iR-Ti, 60-3DMEA200/12/50iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in an 8x8 square grid. Electrodes are 12 µm in diameter, 40 µm (100/12/40) or 50 µm (200/12/50) high and equidistantly spaced 100 µm (100/12/40) or 200 µm (200/12/50) apart. |
| MEA headstage | Multichannel Systems | MEA2100-HS60 | |
| MEA interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot | |
| MEA net | Multichannel Systems | ALA HSG-MEA-5BD | |
| MEA perfusion system | Multichannel Systems | PPS2 | |
| MEAs, Planar | Multichannel Systems | 60MEA200/30iR-Ti, 60MEA500/30iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in either a 8x8 square grid (200/30) or a 6x10 rectangular grid (500/30). Electrodes are 30 µm in diameter and equidistantly spaced 200 µm (200/30) or 500 µm (500/30) apart. |
| MgCl2 | Thermo Fisher | AJA296-500G | |
| Microscope camera | Motic | Moticam X Wi-Fi | |
| Multi Channel Analyser software | Multichannel Systems | V 2.17.4 | |
| Multi Channel Experimenter software | Multichannel Systems | V 2.17.4 | |
| NaCl | Thermo Fisher | AJA465-500G | |
| NaHCO3 | Thermo Fisher | AJA475-500G | |
| NaH2PO4 | Thermo Fisher | ACR207805000 | |
| Rongeurs | Fine Science Tools | 16021-14 | |
| Small spring scissors | Fine Science Tools | 91500-09 | |
| Small surgical scissors | Fine Science Tools | 14060-09 | |
| Sucrose | Thermo Fisher | AJA530-500G | |
| Superglue | cyanoacrylate adhesive | ||
| Tetrodotoxin | Abcam | AB120055 | |
| Vibration isolation table | Newport | VH3048W-OPT | |
| Vibrating microtome | Leica | VT1200 S |
参考文献
- Smith, K. M., et al. Calretinin positive neurons form an excitatory amplifier network in the spinal cord dorsal horn. eLife. 8, 49190 (2019).
- Smith, K. M., et al. Functional heterogeneity of calretinin-expressing neurons in the mouse superficial dorsal horn: implications for spinal pain processing. The Journal of physiology. 593 (19), 4319-4339 (2015).
- Boyle, K. A., et al. Defining a spinal microcircuit that gates myelinated afferent input: Implications for tactile allodynia. Cell Reports. 28 (2), 526-540 (2019).
- Browne, T. J., et al. Transgenic cross-referencing of inhibitory and excitatory interneuron populations to dissect neuronal heterogeneity in the dorsal horn. Frontiers in Molecular Neuroscience. 13, 32 (2020).
- Graham, B. A., Hughes, D. I. Rewards, perils and pitfalls of untangling spinal pain circuits. Current Opinion in Physiology. 11, 35-41 (2019).
- Todd, A. J. Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience. 11 (12), 823-836 (2010).
- Hughes, D. I., Todd, A. J. Central nervous system targets: inhibitory interneurons in the spinal cord. Neurotherapeutics. 17 (3), 874-885 (2020).
- Duan, B., et al. Identification of spinal circuits transmitting and gating mechanical pain. Cell. 159 (6), 1417-1432 (2014).
- Hachisuka, J., Chiang, M. C., Ross, S. E. Itch and neuropathis itch. Pain. 159 (3), 603 (2018).
- Foster, E., et al. Targeted ablation, silencing, and activation establish glycinergic dorsal horn neurons as key components of a spinal gate for pain and itch. Neuron. 85 (6), 1289-1304 (2015).
- Bourane, S., et al. Identification of a spinal circuit for light touch and fine motor control. Cell. 160 (3), 503-515 (2015).
- Cheng, L., et al. Identification of spinal circuits involved in touch-evoked dynamic mechanical pain. Nature neuroscience. 20 (6), 804-814 (2017).
- Peirs, C., et al. Mechanical allodynia circuitry in the dorsal horn is defined by the nature of the injury. Neuron. 109 (1), 73-90 (2021).
- Huang, J., et al. Circuit dissection of the role of somatostatin in itch and pain. Nature Neuroscience. 21 (5), 707-716 (2018).
- Obien, M. E. J., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 8, 423 (2015).
- Nam, Y., Wheeler, B. C. In vitro microelectrode array technology and neural recordings. Critical Reviews in Biomedical Engineering. 39 (1), 45-61 (2011).
- Johnstone, A. F., et al. Microelectrode arrays: a physiologically based neurotoxicity testing platform for the 21st century. Neurotoxicology. 31 (4), 331-350 (2010).
- Stett, A., et al. Biological application of microelectrode arrays in drug discovery and basic research. Analytical and Bioanalytical Chemistry. 377 (3), 486-495 (2003).
- Xu, L., et al. Trends and recent development of the microelectrode arrays (MEAs). Biosensors and Bioelectronics. 175 (1), 112854 (2020).
- Chapman, R. J., Cilia La Corte, P. F., Asghar, A. U. R., King, A. E. Network-based activity induced by 4-aminopyridine in rat dorsal horn in vitro is mediated by both chemical and electrical synapses. The Journal of Physiology. 587, 2499-2510 (2009).
- Ruscheweyh, R., Sandkühler, J. Epileptiform activity in rat spinal dorsal horn in vitro has common features with neuropathic pain. Pain. 105 (1-2), 327-338 (2003).
- Kay, C. W., Ursu, D., Sher, E., King, A. E. The role of Cx36 and Cx43 in 4-aminopyridine-induced rhythmic activity in the spinal nociceptive dorsal horn: an electrophysiological study in vitro. Physiological Reports. 4 (14), 12852 (2016).
- Jankowska, E., Lundberg, A., Rudomin, P., Sykova, E. Effects of 4-aminopyridine on synaptic transmission in the cat spinal cord. Brain Research. 240 (1), 117-129 (1982).
- Semba, K., Geller, H. M., Egger, M. D. 4-Aminopyridine induces expansion of cutaneous receptive fields of dorsal horn cells. Brain Research. 343 (2), 398-402 (1985).
- Ruscheweyh, R., Sandkühler, J. Long-range oscillatory Ca2+ waves in rat spinal dorsal horn. European Journal of Neuroscience. 22 (8), 1967-1976 (2005).
- Egert, U., et al. A novel organotypic long-term culture of the rat hippocampus on substrate-integrated multielectrode arrays. Brain Research Protocols. 2 (4), 229-242 (1998).
- Thiebaud, P., De Rooij, N., Koudelka-Hep, M., Stoppini, L. Microelectrode arrays for electrophysiological monitoring of hippocampal organotypic slice cultures. IEEE Transactions on Biomedical Engineering. 44 (11), 1159-1163 (1997).
- Rey, H. G., Pedreira, C., Quiroga, R. Q. Past, present and future of spike sorting techniques. Brain Research Bulletin. 119, 106-117 (2015).
- Satuvuori, E., et al. Measures of spike train synchrony for data with multiple time scales. Journal of Neuroscience Methods. 287, 25-38 (2017).
- Mendis, G. D. C., Morrisroe, E., Reid, C. A., Halgamuge, S. K., Petrou, S. Use of local field potentials of dissociated cultures grown on multi-electrode arrays for pharmacological assays. 38th Annual International Conference of the IEEE Engineering in Medicine and Biology Society. , 952-956 (2016).
- Hughes, D. I., et al. Morphological, neurochemical and electrophysiological features of parvalbumin-expressing cells: a likely source of axo-axonic inputs in the mouse spinal dorsal horn. The Journal of Physiology. 590 (16), 3927-3951 (2012).
- Peirs, C., Seal, R. P. Neural circuits for pain: recent advances and current views. Science. 354 (6312), 578-584 (2016).
- Li, J., Baccei, M. L. Developmental regulation of membrane excitability in rat spinal lamina I projection neurons. Journal of Neurophysiology. 107 (10), 2604-2614 (2012).
- Li, J., Baccei, M. L. Pacemaker neurons within newborn spinal pain circuits. Journal of Neuroscience. 31 (24), 9010-9022 (2011).
- Sandkühler, J., Eblen-Zajjur, A. Identification and characterization of rhythmic nociceptive and non-nociceptive spinal dorsal horn neurons in the rat. Neuroscience. 61 (4), 991-1006 (1994).
- Lucas-Romero, J., Rivera-Arconada, I., Roza, C., Lopez-Garcia, J. A. Origin and classification of spontaneous discharges in mouse superficial dorsal horn neurons. Scientific Reports. 8 (1), 9735-9735 (2018).
- Antonio, L., et al. L. al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. 260, 33-44 (2016).
- Avoli, M., Jefferys, J. G. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. 260, 26-32 (2016).
- Taccola, G., Nistri, A. Low micromolar concentrations of 4-aminopyridine facilitate fictive locomotion expressed by the rat spinal cord in vitro. Neuroscience. 126 (2), 511-520 (2004).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. Journal of Neurophysiology. 107 (2), 728-741 (2012).
- Egert, U., Heck, D., Aertsen, A. Two-dimensional monitoring of spiking networks in acute brain slices. Experimental Brain Research. 142 (2), 268-274 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。