Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Spinal Nosiseptif Devrelerde Ağ Aktivitesini Mikroelektrot Dizileri Kullanarak Kaydetme
Bu Makalede
Özet
Omurilik dorsal boynuzunda ağ düzeyinde nosiseptif aktiviteyi araştırmak için mikroelektrot dizisi teknolojisinin ve 4-aminopiridin kaynaklı kimyasal stimülasyonun kombine kullanımı özetlenmiştir.
Özet
Omurilik dorsal boynuzundaki (DH) spesifik nöron tiplerinin rolleri ve bağlanabilirliği, spinal ağrı işlemeyi destekleyen devrelerin giderek daha ayrıntılı bir görünümünü sağlamak için hızlı bir şekilde tanımlanmaktadır. Bununla birlikte, bu bağlantıların DH'deki daha geniş ağ aktivitesi için etkileri daha az anlaşılmıştır, çünkü çoğu çalışma tek nöronların ve küçük mikro devrelerin aktivitesine odaklanmaktadır. Alternatif olarak, birçok hücredeki elektriksel aktiviteyi izleyebilen mikroelektrot dizilerinin (MEA'lar) kullanılması, nöral aktivitenin yüksek uzamsal ve zamansal çözünürlüğünü sağlar. Burada, 4-aminopiridin (4-AP) ile kimyasal olarak uyarılan DH devrelerinin indüklediği DH aktivitesini incelemek için fare omurilik dilimleri ile MEA'ların kullanımı açıklanmaktadır. Ortaya çıkan ritmik aktivite, zamanla stabil, tetrodotoksin tarafından bloke edilen yüzeysel DH ile sınırlıdır ve farklı dilim oryantasyonlarında araştırılabilir. Birlikte, bu preparat, naif hayvanlardan, kronik ağrının hayvan modellerinden ve genetik olarak değiştirilmiş nosiseptif fonksiyona sahip farelerden dokudaki DH devre aktivitesini araştırmak için bir platform sağlar. Ayrıca, 4-AP ile uyarılmış omurilik dilimlerindeki MEA kayıtları, yeni antinosiseptif bileşiklerin omurilik DH'deki aktiviteyi bozma kapasitesini değerlendirmek için hızlı bir tarama aracı olarak kullanılabilir.
Giriş
Spinal kord DH içindeki spesifik inhibitör ve uyarıcı internöron tiplerinin rolleri 1,2,3,4 oranında hızlı bir şekilde ortaya çıkarılmaktadır. Birlikte, internöronlar DH'deki nöronların% 95'inden fazlasını oluşturur ve nosiseptif de dahil olmak üzere duyusal işlemede rol oynarlar. Ayrıca, bu internöron devreleri, periferik sinyallerin beyne ulaşmak için nöroaksiye yükselip yükselmediğini ve ağrı algısına katkıda bulunup bulunmadığını belirlemek için önemlidir 5,6,7. Bugüne kadar, çoğu çalışma, in vitro hücre içi elektrofizyoloji, nöroanatomik etiketleme ve in vivo davranışsal analiz 1,3,8,9,10,11,12,13,14 kombinasyonlarını kullanarak DH nöronlarının tek hücreli veya tüm organizma analiz düzeyindeki rolünü araştırmıştır. . Bu yaklaşımlar, spesifik nöron popülasyonlarının ağrı işlemedeki rolünün anlaşılmasını önemli ölçüde geliştirmiştir. Bununla birlikte, spesifik hücre tiplerinin ve küçük makro devrelerin, DH'nin çıktısını, davranışsal tepkileri ve ağrı deneyimini şekillendirmek için mikrodevre düzeyinde büyük nöron popülasyonlarını nasıl etkilediğini anlamada bir boşluk kalmaktadır.
Makro devre veya çok hücreli seviye fonksiyonunu araştırabilen bir teknoloji, mikroelektrot dizisidir (MEA)15,16. MEA'lar birkaç on yıldır sinir sistemi fonksiyonunu araştırmak için kullanılmıştır17,18. Beyinde, nöronal gelişim, sinaptik plastisite, farmakolojik tarama ve toksisite testi17,18 çalışmasını kolaylaştırmışlardır. MEA tipine bağlı olarak hem in vitro hem de in vivo uygulamalar için kullanılabilirler. Ayrıca, MEA'ların gelişimi hızla gelişti, farklı elektrot sayıları ve konfigürasyonları artık mevcut19. MEA'ların önemli bir avantajı, birçok nörondaki elektriksel aktiviteyi aynı anda çoklu elektrotlar aracılığıyla yüksek uzamsal ve zamansal doğrulukla değerlendirme kapasiteleridir15,16. Bu, nöronların devrelerde ve ağlarda, kontrol koşulları altında ve yerel olarak uygulanan bileşiklerin varlığında nasıl etkileşime girdiğine dair daha geniş bir okuma sağlar.
İn vitro DH preparatlarının bir zorluğu, devam eden aktivite seviyelerinin tipik olarak düşük olmasıdır. Burada, bu zorluk, DH devrelerini kimyasal olarak uyarmak için voltaj kapılı K + kanal blokeri, 4-aminopryidine (4-AP) kullanan omurilik DH devrelerinde ele alınmaktadır. Bu ilaç daha önce akut omurilik dilimlerinin DH'sinde ve akut in vivo koşullar altında ritmik senkron elektriksel aktivite oluşturmak için kullanılmıştır20,21,22,23,24. Bu deneyler, 4-AP ile indüklenen aktivite 20,21,22,23,24,25'i karakterize etmek için tek hücreli yama ve hücre dışı kayıt veya kalsiyum görüntüleme kullanmıştır. Birlikte, bu çalışma ritmik 4-AP kaynaklı aktivite için uyarıcı ve inhibitör sinaptik iletim ve elektriksel sinapsların gerekliliğini göstermiştir. Bu nedenle, 4-AP yanıtı, doğal polisinaptik DH devrelerini ilaca bağlı bir epifenomen olarak değil, biyolojik alaka düzeyi ile maskeleyen bir yaklaşım olarak görülmüştür. Ayrıca, 4-AP ile indüklenen aktivite, nöropatik ağrı koşulları olarak analjezik ve antiepileptik ilaçlara benzer bir yanıt profili sergiler ve konneksinler20,21,22 gibi yeni spinal bazlı analjezik ilaç hedefleri önermek için kullanılmıştır.
Burada, bu nosiseptif devreyi makro devrede veya ağ analiz düzeyinde incelemek için MEA'ları ve spinal DH'nin kimyasal aktivasyonunu 4-AP ile birleştiren bir preparat açıklanmaktadır. Bu yaklaşım, naif ve nöropatik 'ağrı benzeri' koşullar altında nosiseptif devreleri araştırmak için kararlı ve tekrarlanabilir bir platform sağlar. Bu preparat aynı zamanda bilinen analjeziklerin devre seviyesindeki etkisini test etmek ve hiperaktif omurilikteki yeni analjezikleri taramak için de kolayca uygulanabilir.
Protokol
3-12 aylık erkek ve dişi c57Bl/6 fareler üzerinde çalışmalar yapıldı. Tüm deneysel prosedürler Newcastle Üniversitesi Hayvan Bakımı ve Etik Komitesi'ne (protokoller A-2013-312 ve A-2020-002) uygun olarak gerçekleştirilmiştir.
1. İn vitro elektrofizyoloji
- Omurilik dilimi hazırlama ve kayıt için çözeltilerin hazırlanması
- Yapay beyin omurilik sıvısı
NOT: Yapay beyin omurilik sıvısı (aCSF), dilimlerin kayıt başlayana kadar ve deneyler sırasında ilaçlar için hem serpiştirici hem de seyreltici olarak saklandığı bir arayüz inkübasyon odasında kullanılır. Ayrıntılı kompozisyon için Tablo 1'e bakın.
- Yapay beyin omurilik sıvısı
| Kimyasal | aCSF (mM) | aCSF (g/100 mL) | Sakkaroz ikame edilmiş aCSF (mM) | Sakkaroz yerine geçen aCSF (g/100 mL) | Yüksek potasyumlu aCSF (mM) | Yüksek potasyumlu aCSF (g/100 mL) |
| Sodyum klorür (NaCl) | 118 | 0.690 | - | - | 118 | 0.690 |
| Sodyum hidrojen karbonat (NaHCO3) | 25 | 0.210 | 25 | 0.210 | 25 | 0.210 |
| Glikoz | 10 | 0.180 | 10 | 0.180 | 10 | 0.180 |
| Potasyum klorür (KCl) | 2.5 | 0.019 | 2.5 | 0.019 | 4.5 | 0.034 |
| Sodyum dihidrojen fosfat (NaH2PO4) | 1 | 0.012 | 1 | 0.012 | 1 | 0.012 |
| Magnezyum klorür (MgCl2) | 1 | 0.01 | 1 | 0.01 | 1 | 0.01 |
| Kalsiyum klorür (CaCl2) | 2.5 | 0.028 | 2.5 | 0.028 | 2.5 | 0.028 |
| Sakaroz | - | - | 250 | 8.558 | - | - |
Tablo 1: Suni Beyin Omurilik Sıvısı bileşimleri. Kısaltma: aCSF = yapay beyin omurilik sıvısı.
- CaCl 2 hariç yukarıdakilerin gerekli miktarlarını 2 L damıtılmış suya ekleyerek 118 NaCl, 25 NaHCO3, 10 glikoz, 2.5 KCl, 1 NaH 2 PO4, 1 MgCl 2 ve2.5 CaCl2 içeren aCSF'yi hazırlayın.
- Yukarıdaki çözeltiyi 5 dakika boyunca karbojenle (% 95 O 2,% 5 CO 2) kabarcıklayın ve CaCl2 ekleyin.
NOT: Bu adım CaCl2 yağışını önler, yani çözelti bulutlu hale gelmemelidir. Deneyler sırasında ilaç uygulaması için, aCSF'deki ilaç stok çözeltilerini istenen son konsantrasyonlara kadar seyreltin.
- Sakkaroz yerine geçen yapay beyin omurilik sıvısı
NOT: Sakkaroz yerine geçen aCSF, diseksiyon ve omurilik dilimleme sırasında kullanılır. Adından da anlaşılacağı gibi, sakaroz, ozmolariteyi korurken bu prosedürler sırasında nöronal uyarılmayı azaltmak için NaCl yerine geçer. Ayrıntılı kompozisyon için Tablo 1'e bakın.- CaCl 2 hariç yukarıdakilerin tümünün gerekli miktarlarını300 mL damıtılmış suya ekleyerek 250 sakaroz, 25 NaHCO 3, 10 glikoz, 2.5 KCl, 1 NaH 2 PO4, 1 MgCl 2 ve2.5 CaCl 2 içeren (mM cinsinden) sakkaroz ikame edilmiş aCSF hazırlayın.
- Çözeltiyi 5 dakika boyunca karbojenle kabarcıklayın ve ardından CaCl2 ekleyin.
- Çözeltiyi -80 °C'lik bir dondurucuda yaklaşık 40 dakika veya çözelti bir bulamaç oluşturana kadar saklayın. Katı dondurmaktan kaçının ve bulamaç kıvamındayken kullanın.
- Mikroelektrot dizisi hazırlama
NOT: MEA'nın temas yüzeyi, hidrofilik hale getirmek için bir ön işlem gerektirir.- Deneyden önce, MEA'yı 30 dakika boyunca fetal sığır serumu (FBS) veya at serumu (HS) ile doldurun.
- FBS veya HS'yi çıkarın ve damıtılmış su artık köpüklü kalmayana kadar MEA'yı yaklaşık beş yıkama damıtılmış suyla iyice durulayın. Kuyuyu kullanıma hazır aBOSOF ile doldurun.
- Akut omurilik dilimi hazırlığı
NOT: Fare omurilik dilimi hazırlığı daha önce Smith ve ark.2 tarafından tanımlandığı gibidir. İdeal olarak, lumbosakral genişlemenin çıkarılması 8-10 dakikadan fazla sürmemelidir (aşağıdaki adımlar 1.3.2-1.3.11).- Fareyi 100 mg / kg ketamin (i.p.) ile derinlemesine uyuşturun ve ardından büyük cerrahi makas kullanarak kafasını kesin.
- Kalça hizasında deride küçük bir kesi yaparak karın bölgesi üzerindeki cildi çıkarın. Tüm cilt çıkarılana kadar kesimin her iki tarafındaki cildi rostral olarak çekin, yani göğüs kafesinin üstünden pelvisin tepesine (hem ventralal hem de dorsal) kadar.
- Vücudu buz üzerine yerleştirin ve tüm iç organları çıkararak ve sternuma yanal kaburgaları keserek vertebral kolonu açığa çıkarmak için ventral bir yaklaşım kullanın.
- Ventral göğüs kafesini, hem kürek kemiğini (yaklaşık T2'de kesilir) hem de alt ekstremiteleri ve pelvisi (sakrumun yaklaşık tepesinde kesilir) çıkarın.
- Vertebral kolon ve kaburga preparatını, buz gibi soğuk sakkaroz aCSF içeren bir diseksiyon banyosuna aktarın. Alt sırt kaslarından ve bağlı üst kaburgalardan pimler yerleştirerek preparatın dört köşesini de (ventral yüzey yukarı doğru) sabitleyin.
- Omurların ventral yüzeyini kaplayan tüm kas ve bağ dokusunu rongeurlarla çıkarın ve yaklaşık olarak T12 ila L2 vertebral cisimlerinin altında yatan lumbosakral genişleme üzerindeki vertebral bölgeyi tanımlayın.
- Vertebral kanalda otururken omuriliğe erişim sağlamak için lumbosakral genişleme bölgesine kaudal olan bir vertebral gövdeyi çıkarın.
- Kavisli yay makası kullanarak, omurların ventral ve dorsal yönlerini ayırmak ve omuriliği açığa çıkarmak için vertebral gövdeyi rostral olarak kaldırırken ve çekerken vertebral pedikülleri iki taraflı olarak kesin.
- Lumbosakral genişlemeyi ortaya çıkarmak için vertebral cisimler çıkarıldıktan sonra, kordon serbest yüzene kadar omuriliği yay makası ile sabitleyen kalan kökleri dikkatlice temizleyin.
- Omuriliği, lumbosakral genişlemenin çok üstünde ve altında rostral ve kaudal kesiklerle izole edin ve kordonun hedef bölgesinin 'serbest yüzmesine' izin verin.
NOT: Tercih edilen dilim oryantasyonu, kablonun daha sonra kesitleme için nasıl monte edileceğini belirleyecektir (Şekil 1). - Enine dilimler için, lumbosakral segmenti bağlı bir kök ile kaldırın ve ortada sığ bir kanal kesimi ile önceden kesilmiş bir polistiren (Strafor) blok (1 cm x 1 cm x 1 cm) üzerine yerleştirin. Bloğu ve kordonu kesit platformuna tutturmak için siyanoakrilat yapıştırıcı kullanın ( Malzeme Tablosuna bakınız) ve buz gibi soğuk sakkaroz aCSF (bulamaç) içeren kesme banyosuna yerleştirin.
NOT: Sığ kanal, omuriliğin sabitlenmesine ve yönlendirilmesine yardımcı olur, dorsal taraf açıkta ve kordonun torasik ucu bloğun dibinde. - Sagital dilimler için, kesit platformuna ince bir siyanoakrilat yapıştırıcı çizgisi koyun, lumbosakral genişlemeyi bağlı bir kök ile kaldırın ve kordonu tutkal çizgisi boyunca yerleştirin, böylece bir yanal yüzeyin yapıştırıcıda olmasını ve diğerinin yukarı bakmasını sağlayın. Buz gibi soğuk sakkaroz aCSF (bulamaç) içeren kesme banyosuna yerleştirin.
- Yatay dilimler için, kesit platformuna ince bir siyanoakrilat yapıştırıcı çizgisi koyun. Lumbosakral genişlemeyi bağlı bir kök ile kaldırın ve lumbosakral genişlemeyi yapıştırıcı çizgisi boyunca yerleştirin, ventral yüzeyin yapıştırıcıda olduğundan ve dorsal yüzeyin yukarı baktığından emin olun. Kabloyu konumlandırmak için bağlı kökleri kullanın. Buz gibi soğuk sakkaroz aCSF (bulamaç) içeren kesme banyosuna yerleştirin.
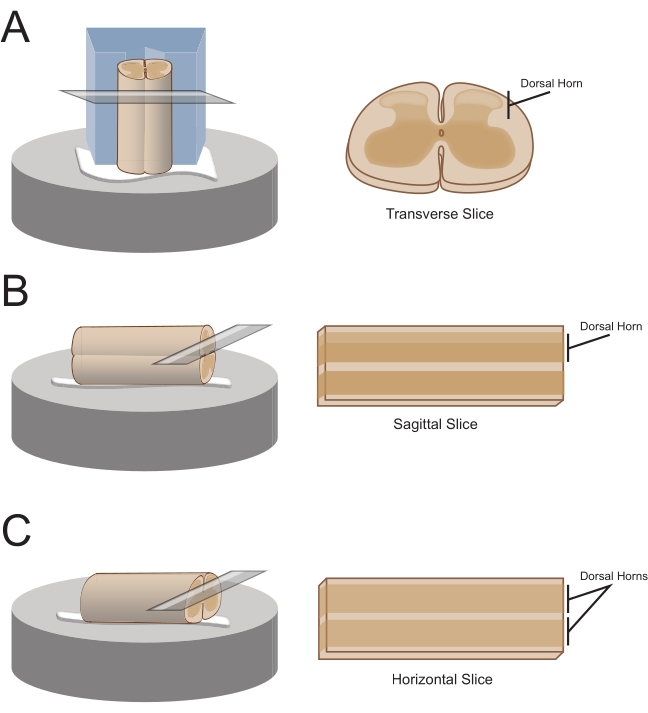
Resim 1: Omurilik dilimi oryantasyonları, montaj ve kesme yöntemleri. (A) Enine dilimler, içine bir destek oluğu kesilmiş bir strafor kesme bloğu gerektirir. Omurilik, destek oluğundaki bloğa yaslanır, kordonun dorsal tarafı bloktan uzağa bakar. Blok ve kordon, siyanoakrilat yapıştırıcı ile bir kesme aşamasına yapıştırılır. (B) Sagital dilimler, kesme aşamasına ince bir siyanoakrilat yapıştırıcı çizgisi yerleştirilerek ve daha sonra omuriliğin tutkal üzerinde yan tarafına konumlandırılmasıyla hazırlanır. (C) Yatay dilimler, kesme aşamasına ince bir siyanoakrilat yapıştırıcı çizgisi yerleştirilerek ve daha sonra omurilik ventral tarafının tutkal üzerine yerleştirilmesiyle hazırlanır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Aşağıdaki ayarlarla titreşimli bir mikrotom kullanarak 300 μm kalınlığında dilimler (L1-L5, yönelimden bağımsız olarak aynı kalınlıkta) elde edin: hız 0,06 mm / s, genlik 2,50 mm ve ±0,02 yükseklik genlik sapması içinde kalibre edilmiştir.
- Dilimleri, oksijenli aCSF içeren bir hava arayüzü inkübasyon odasına aktarın.
- Kaydetmeden önce, dilimlerin oda sıcaklığında (20-24 ° C) 1 saat boyunca dengelenmesine izin verin.
- Mikroelektrot dizisi kayıtları
NOT: Aşağıdaki adımlarda, omurilik dilimleri üzerinde MEA tabanlı deneylerden elde edilen kayıt verilerinin nasıl kullanılacağı ayrıntılı olarak açıklanmaktadır. Deneye bağlı olarak çeşitli MEA tasarımları kullanılabilir. Bu deneylerde kullanılan MEA'lar için tasarım detayları Tablo 2 ve Şekil 2. Detaylı tasarım bilgileri Egert ve ark. tarafından yayınlanmıştır.26 ve Thiebaud ve ark.27 sırasıyla düzlemsel ve 3 boyutlu (3B) MEA'lar için. Her iki MEA tipi de silikon nitrür yalıtım tabakası ve titanyum nitrür izleri ve temas pedleri ile 60 titanyum nitrür elektrotundan oluşur.- Deney düzeni
- Bilgisayarı ve arayüz kartını açın ve kayıt yazılımını başlatın.
- Önceden monte edilmiş kayıt şablonunu yükleyin (Şekil 3A). Kaydedici sekmesinde günün dosyalarını adlandırın.
- Deney süresince aCSF'yi karbojenle (% 5 CO2,% 95O2) sürekli olarak kabarcıklayın.
- Peristaltik bir pompa tarafından kontrol edilen perfüzyon sistemini açın. Giriş hattını aCSF'ye yerleştirin ve giriş ucu bir atık kabına yerleştirin. Perfüzyon hatlarını aCSF ile astarlayın.
- 50 mL aCSF'deki stokları gerekli nihai konsantrasyona (örneğin, 4-AP için 200 μM) seyrelterek 4-AP ve diğer ilaç çözeltilerini hazırlayın.
- İlaç çözeltilerini ilaç kaplarına yerleştirin ve karbojenle kabartın.
- 4-AP aktivitesi
- Kuluçkayı takiben, aCSF ile doldurulmuş büyük uçlu bir Pasteur pipeti kullanarak inkübatörden tek bir dilim aktarın.
- Dilimi MEA'ya iyice yerleştirin ve ek aCSF ekleyin.
- İnce bir kısa saç boya fırçası kullanarak dilimi 60 elektrotlu kayıt dizisinin üzerine yerleştirin. Elektrotları boya fırçasıyla temas ettirmekten veya özellikle 3D diziler kullanıyorsanız, dokuyu elektrotlar boyunca sürüklemekten kaçının.
NOT: MEA düzenine bağlı olarak, doğru konumlandırma için mikroskop yardımı ile veya yardımı olmadan bu yapılabilir. - Dilimi yerleştirdikten sonra, yerinde tutmak ve MEA elektrotlarıyla iyi teması teşvik etmek için dokunun üzerine ağırlıklı bir ağ yerleştirin.
NOT: Net yerleşimin ardından dilimin yeniden konumlandırılması gerekebilir. - MEA'yı kayıt merkezine yerleştirin (Şekil 2A,B).
- Yüzeysel DH (SDH) altında mümkün olduğunca çok elektrotun bulunduğunu doğrulamak için ters çevrilmiş bir mikroskop (2x büyütme) kullanarak dokunun elektrotlar üzerindeki konumunu kontrol edin. En az 2-6 elektrotun dilimle temas etmediğinden emin olun, çünkü bu elektrotlar analiz sırasında gürültüyü çıkarmak ve artefaktları kaydetmek için önemlidir (Şekil 2E).
- Fotoğraf makinesini açın, cihaza bağlayın ve analiz sırasında kullanmak üzere MEA'ya göre dilimin referans görüntüsünü alın.
- Kayıt yazılımında DAQ'yı Başlat'a basın ve tüm elektrotların net bir sinyal aldığını onaylayın.
NOT: Sinyal gürültülüyse, baş belini çıkarın ve hem MEA temas pedlerini hem de altın yay kontaklarını %70 etanol ile temizleyin (temizlemeden sonra pedlerin ve kontakların kuruduğundan emin olmak için laboratuvar mendili kullanın). Sinyal hala gürültülüyse, kayıt yazılımındaki arızalı elektrotları kapatın veya analiz sırasında daha sonra hariç tutulmak üzere not alın. - Perfüzyon giriş ve çıkış hatlarını MEA kuyucuğuna (daha önce aCSF ile doldurulmuş) takın ve perfüzyon sistemini açın. Akış hızını, ideal olarak dakikada 4-6 banyo hacmini kontrol edin ve çıkışın süperfüzyonun taşmasını önlemek için yeterli olduğundan emin olun.
- Dokunun 5 dakika boyunca dengelenmesine izin verin ve ardından 5 dakikalık ham, filtrelenmemiş temel verileri kaydedin.
- Perfüzyon giriş hattını aCSF'den 4-AP'lik bir çözeltiye taşıyın ve 4-AP kaynaklı ritmik aktivitenin sabit duruma ulaşması için 12 dakika bekleyin (ilaçların banyoya ulaşması için 2 dakika ve aktivitenin zirveye ulaşması için 10 dakika ve daha sonra plato).
- 5 dakikalık 4-AP kaynaklı aktivite kaydedin. İlaçları test etmek veya 4-AP'nin stabilitesini kontrol etmek için sonraki kayıtlara hazırlıklı olun.
- Deney düzeni
| Mikroelektrot Dizi Düzenekleri | ||||
| Mikroelektrot Dizi Modeli | 60MEA 200/30iR-Ti | 60-3DMEA 100/12/40iR-Ti | 60-3DMEA 200/12/50iR-Ti | 60MEA 500/30iR-Ti |
| Düzlemsel veya 3 Boyutlu (3D) | Düzlemsel | 3D | 3D | Düzlemsel |
| Elektrot Izgarası | 8 x 8 | 8 x 8 | 8 x 8 | 6 x 10 |
| Elektrot Aralığı | 200 μm | 100 μm | 200 μm | 500 μm |
| Elektrot Çapı | 30 μm | 12 μm | 12 μm | 30 μm |
| Elektrot Yüksekliği (3D) | Yok | 40 μm | 50 μm | Yok |
| Deney | Enine dilim | Enine dilim | Sagital + Yatay | Sagital + Yatay |
Tablo 2: Mikroelektrot dizi düzenleri.
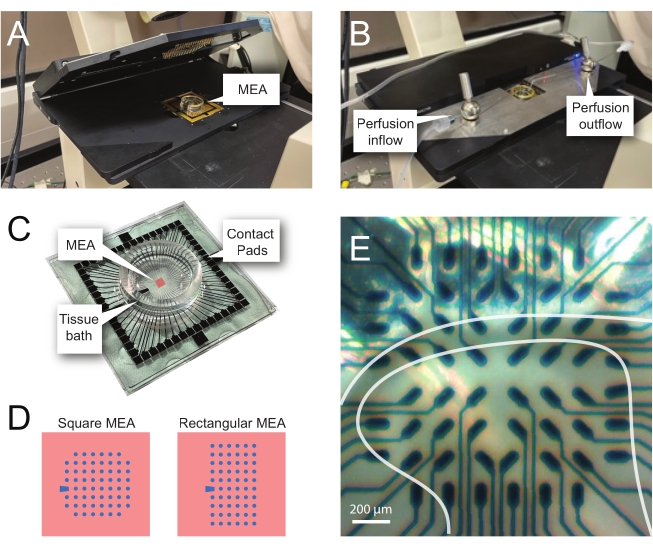
Şekil 2: Mikroelektrot dizisi üzerinde doku konumlandırması . (A) Görüntü, bir MEA'nın yerine yerleştirildiği açık bir MEA başlığını göstermektedir. (B) Kayıtlar için MEA baş sahnesi kapalı olan A ile aynıdır ve doku perfüzyon sistemi mevcuttur. (C) Resim, üretici tarafından sağlanan bir MEA'yı göstermektedir. Başın altın yayları ile arayüz oluşturan temas pedleri ve doku banyosu solüsyonunu ve doku dilimini tutan MEA doku banyosu gösterilmiştir. Merkezdeki kırmızı kare ile vurgulanan alan, elektrot dizisinin yeridir. (D) Şemalar, bu çalışmada kullanılan iki MEA elektrot konfigürasyonunu göstermektedir ve daha fazla ayrıntı Tablo 2'de sunulmuştur. Referans elektrodu mavi yamuk ile gösterilir. Sol MEA elektrot düzeni, sunulan çalışma modellerinde en çok kullanılan 60 elektrot kare konfigürasyonunu gösterir 60MEA200/30iR-Ti, 200 μm aralıklı 30 μm çaplı elektrotlar veya 200 μm aralıklı ve 100 μm aralıklı 3 boyutlu MEA'lar (60MEA200/12/50iR-Ti ve 60MEA100/12/40iR-Ti), 12 μm çapında ve 50 μm veya 40 μm yüksekliğinde elektrotlarla, sırasıyla. Sol MEA elektrot düzeni, 6 x 10 elektrot dikdörtgen düzeni-60MEA500/30iR-Ti gösterir. (E) Kayıt için konumlandırılmış enine omurilik dilimine sahip 60MEA100/12/40iR-Ti kare MEA'nın yüksek büyütmeli görüntüsü. Dilim elektrot sıraları 3-8 üzerine oturur. Herhangi bir dokuya temas etmeyen elektrotların üst sırası, referans elektrotları görevi görür. SDH alanı yarı saydam bir bant olarak görünür. Bu durumda, SDH, MEA'nın 4, 5 ve 6. satırlarındaki ve 2, 3, 4, 5 ve 7. sütunlarındaki elektrotların üzerine biner. Ölçek çubuğu = 200 μm. Kısaltmalar: MEA = mikroelektrot dizisi; SDH = yüzeysel sırt boynuzu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Dilimleri değiştirme
- Her kayıt oturumunun ardından satırları aBOFF ile durulayın.
- MEA'yı baş sahneden çıkarın.
- Ağı ve dokuyu MEA'dan iyice çıkarın, aCSF ile iyice durulayın ve yukarıdaki adımları yeni bir dilimle tekrarlayın.
2. Veri işleme ve analizi
NOT: Aşağıdaki adımlarda, omurilik dilimleri üzerinde MEA deneyleri için analiz yazılımının nasıl kullanılacağı ayrıntılı olarak açıklanmaktadır. 60 elektrottan biri iç referans görevi görürken ( Şekil 2 C, D'de bir yamuk ile işaretlenmiştir), kalan 59'un dört ila yirmi beşi arasında ise yetişkin bir fare omurilik diliminde SDH'nin altına yerleştirilmiştir. Sonraki analizler, bu bölgedeki ham sinyalden hücre dışı aksiyon potansiyelini (EAP) ve yerel alan potansiyeli (LFP) dalga formlarını (örnekler için Şekil 3B'ye bakın) tespit eder.
- Ham veri işleme
- Analiz yazılımını açın ve önceden hazırlanmış analiz düzenini yükleyin (Şekil 3B).
- İlgilenilen dosyayı açın ve referans elektrodunun (8 x 8 MEA'da 15 elektrot veya 6 x 10 MEA konfigürasyonunda E1 elektrodu) ve aşırı gürültülü olduğu düşünülen elektrotların seçimini kaldırın.
- Analiz için zaman aralığını ayarlayın (0:00 → 5:00 dk).
- Kanallar arası filtre sekmesine gidin. Karmaşık referans'ı seçin ve Referans Elektrotları'nı deney sırasında çekilen görüntüye ve yapılan notlara (yani, doku altında olmayan elektrotlar) göre seçin. Bunu uygulamak ve kontrol etmek için devam etmeden önce Keşfet'e basın.
- EAP filtresi sekmesine gidin ve LFP etkinliğini kaldırmak için 2. dereceden yüksek geçişli bir Butterworth filtresi (200 Hz kesilmiş) uygulayın.
- LFP filtresi sekmesine gidin ve EAP etkinliğini kaldırmak için 2. dereceden bir bant geçişli Butterworth filtresi (0,5-4 Hz delta frekansları) uygulayın.
- EAP algılayıcısı sekmesine gidin ve Otomatik eşik'i seçin. Yükselen ve Düşen kenar kutularını işaretleyin ve Ölü zamanı 0,5 ms'ye ayarlayın.
- Verilere dayalı olarak Pozitif ve Negatif eşikleri ayarlayın. Ham veri çözümleyicisi ekranına dönerek, zaman işaretçisini hareket ettirerek ve ardından EAP algılayıcısı sekmesine dönüp Araştır'a basarak verileri inceleyin. Ayarlanan algılama eşiğinin gürültü/fizyolojik olmayan etkinlik yakalamadan EAP'leri yakaladığından emin olana kadar bu işlemi tekrarlayın. Gürültü/fizyolojik olmayan aktiviteyi tanımlamak için referans elektrotlarını kullanın.
NOT: Fizyolojik aktivitenin oluşmayacağı referans elektrotlarında minimum sayıda EAP tespit edildiğinden emin olmak gerekir. Ancak, taban çizgisindeki oldukça küçük sapmalar yanlış bir şekilde EAP olarak algılanabilir. Bu, aktif elektrotlarda tespit edilen gerçek olayların sayısını en üst düzeye çıkarmayı hedeflerken. - LFP algılayıcısı sekmesine gidin, Manuel eşiği seçin, Yükselen ve Düşen kenar kutularını işaretleyin ve Ölü süreyi 3 ms'ye ayarlayın.
- LFP aktivitesine sahip bir elektrot seçerek bir elektrot için adım 2.1.8'i tekrarlayın. Karşılandıktan sonra, manuel eşik oluşturma işlemi gerçekleştirilirken eşikler yalnızca tek bir elektroda uygulanacağı için Tümüne uygula'yı seçin.
- Dedektör sekmesindeki LFP verilerini incelerken, bir LFP dalga formu için maksimum eşik geçişi sayısını ve daha sonraki analizlerde kullanılmak üzere bir LFP dalga formu için eşik geçişlerinin maksimum zaman ayrımını not edin.
- Analizi başlat'a basın.
- Çözümleme tamamlandığında, EAP çözümleyicisi sekmesine gidin ve verileri dışarı aktarın. Aynısını LFP analizörü sekmesinde de yapın.
- Aynı dilimdeki diğer tüm dosyalar için bu işlemi yineleyin.
- Veri dışa aktarmanın ardından, dosyaları xlsx biçimine dönüştürün, böylece kullanılan programlama komut dosyası tarafından okunabilirler. Sağlanan komut dosyasının bunları okuması için dosyaları aşağıdaki kurala göre adlandırın: deneme adı (örneğin, örnek veriler) - dilim numarası (örneğin, S1) - kayıt numarası (örneğin, R1) - etkinlik türü (örneğin, sırasıyla EAP'lere veya LFP'lere karşılık gelen ani artışlar veya SP'ler).
NOT: Burada açıklanan EAP analizi, bu aktivite genellikle kayıt elektroduna yakın olan birden fazla nörondan kaynaklansa da, bireysel kanallardan gelen ani yükselmeyi tek bir popülasyon olarak ele alır. Bir kanaldaki EAP'lere katkıda bulunan nöronların sayısı isteniyorsa, dalga formu özelliklerine göre farklı sivri uçlu popülasyonları ayırt etmek için başka bir yerde açıklanan çoklu başak sıralama teknikleri uygulanabilir28.
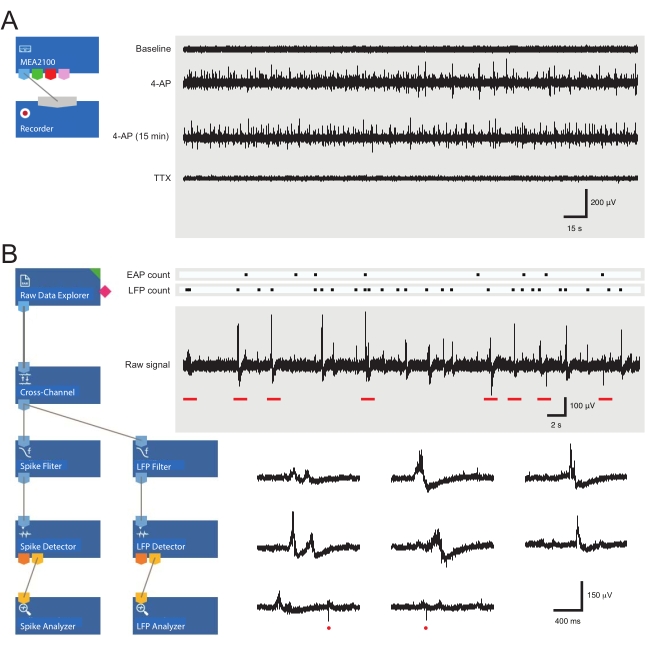
Şekil 3: Veri kayıt ve analiz aracı düzenleri ve hücre dışı aksiyon potansiyelini ve yerel alan potansiyeli dalga formlarını gösteren örnek mikroelektrot dizisi kayıtları . (A) Şematik, MEA verilerinin elde edilmesi için kullanılan önceden yapılandırılmış kayıt şablonunu gösterir. MEA2100 ve kayıt (headstage/amplifikatör) aracının birbirine bağlanması, verilerin adlandırılmasını ve kaydedilmesini sağlar. Dört örnek ham veri izi (sağda, 5 dakikalık dönemler), başlangıçta aktivite gösteren bir MEA kanalı tarafından, 4-AP uygulamasından 12 dakika sonra, 4-AP aktivitesi kurulduktan sonra 15 dakika daha ve TTX'in banyo uygulamasını (1 μM) takiben toplanmıştır. Not, 4-AP (ikinci izleme) eklenmesi, arka plan gürültüsünde ve EAP / LFP etkinliğinde net bir artış sağlar. Önemli olarak, aktivite 4-AP kaynaklı aktivite kurulduktan sonra en az 15 dakika boyunca nispeten sabit kalır (üçüncü iz). TTX'in (1 μM) eklenmesi tüm aktiviteyi (alt iz) ortadan kaldırır. (B) Şematik (solda), veri analizi için analizör yazılım yapılandırmasını gösterir. Ham veri gezgini aracı, kayıt yazılımı tarafından toplanan kayıtları içe aktarmak için kullanılır. Bu veriler daha sonra arka plan gürültüsünü gidermek için seçilen referans elektrot sinyallerini diğer elektrotlardan çıkaran bir çapraz kanal filtre aracından geçirilir. Her dalga formu için sinyal-gürültü ilişkilerini optimize etmek üzere EAP filtresinden ve LFP filtre araçlarından veri geçişi. Bu adımın ardından, EAP yol verileri, eşiklerin ayarlandığı EAP algılayıcı aracına girer. EAP'ler algılanır ve ardından her olayın gecikme sürelerinin kaydedildiği ve txt olarak verildiği EAP çözümleyici aracına gönderilir. dosya. Karşılık gelen bir LFP araç seti kullanılarak LFP verileri için aynı iş akışı oluşur. Sağ izler, çeşitli hücre dışı dalga formları içeren tek bir MEA kanalından gelen verileri gösterir. EAP ve LFP sinyallerinin konumu yukarıdaki 'sayım rasterleri'nde vurgulanmıştır. Alt izler, çeşitli LFP sinyalleri (görünüm çeşitliliğine dikkat edin) ve bireysel hücre dışı EAP'ler (kırmızı daireler) dahil olmak üzere genişletilmiş bir zaman ölçeğinde dalga formlarını gösteren üst kayıttan (kırmızı çubuklarla gösterilir) gelen dönemlerdir. Not, LFP / EAP dalga formu ve polarite, bu sinyalleri üreten nöronların sayısına, kayıt elektroduna yakınlıklarına ve yakındaki elektrotlara göre konumlarına göre değişir. Kısaltmalar: MEA = mikroelektrot dizisi; EAP = hücre dışı aksiyon potansiyeli; LFP = yerel alan potansiyeli; 4-AP = 4-aminopiridin; TTX = tetrodotoksin. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Eşzamanlılık analizi
NOT: Eşzamanlılık veya iki elektrot arasındaki 'tesadüf' olaylarının sayısı, Satuvuori ve ark. tarafından özetlenen A-SPIKE-senkronizasyon yöntemindeki tesadüf kriteri kullanılarak belirlenmiştir. 29. Burada kullanılan komut dosyası yalnızca verimlilik için birbirine bitişik elektrotları karşılaştırır (yani, yatay, dikey ve çapraz komşular); ancak, gerekirse tüm elektrotları karşılaştırmak için komut dosyası yeniden yazılabilir.- .xlsx dosyalarından her elektrot için gecikme zaman damgalarını ayıklayan özel bir programlama komut dosyası kullanarak veri analizi gerçekleştirin.
NOT: Bu manuel olarak yapılabilir. - Adım 2.1.11'de, bir LFP dalga formu için maksimum eşik geçişi sayısını ve eşik geçişlerinin maksimum zaman ayrımını kaydedin. Komut dosyasını çalıştırmadan önce her dilim için bu LFP tanımlayıcı parametreleri girmek üzere komut dosyasını değiştirin.
NOT: Daha önce analiz yazılımında gerçekleştirilen eşikleme, EAP'leri tek bir olay olarak açıkça yakalar. Bununla birlikte, LFP'ler, dalga formunun şekline ve ardından bir olay tarafından eşik geçişlerinin sayısına bağlı olarak değişken sayıda tepe noktasından oluşur. - Analizden önce ilgilendiğiniz elektrotları girmek için komut dosyasını değiştirin.
- Eşzamanlılığı belirlemek için (komut dosyasında zaman uyumlu etkinliğin içinde gerçekleşmesi için değiştirilebilir zaman dilimleriyle tanımlanır), çakışma olaylarını algılamak için ayıklanan gecikmeleri ayırın ve analiz edin.
NOT: Komut dosyası, çakışma olayları arasındaki maksimum sürenin ayarlanmasına izin verir. Bunlar EAP'ler için 20 ms ve LFP'ler için 200 ms olarak ayarlanır. - Gecikme süresi zaman damgalarını ayıklamak için komut dosyasını çalıştırın.
NOT: .xlsx çıktı dosyası, tek tek elektrotlar ve tüm dilimler için EAP ve LFP sayımları, frekansları ve çakışma olayı sayıları olan gecikme verilerinin yorumlarını içerir. Bu veriler, frekansı, EAP / LFP sayılarını, aktif elektrot sayısını, tesadüf olaylarının sayısını, bağlı elektrotların sayısını ve bu bağlantıların ortalama gücünü değerlendirmek için kullanılır.
- .xlsx dosyalarından her elektrot için gecikme zaman damgalarını ayıklayan özel bir programlama komut dosyası kullanarak veri analizi gerçekleştirin.
Sonuçlar
Omurilik dorsal boynuzunda ağ aktivitesi modeli
4-AP uygulaması, omurilik DH'sinde senkron ritmik aktiviteyi güvenilir bir şekilde indükler. Bu tür faaliyetler artan EAP'ler ve LFP'ler olarak ortaya çıkar. Daha sonraki sinyal, daha önce MEA kayıtları30'da açıklanan düşük frekanslı bir dalga şeklidir. İlaç uygulamasından sonra EAP ve/veya LFP aktivitesindeki değişiklikler değişmiş nöral aktiviteyi yansıtır. EAP ve LFP örnekleri Şekil
Tartışmalar
Spinal DH'nin nosiseptif sinyalleme, işleme ve bunun sonucunda ağrıyı karakterize eden davranışsal ve duygusal tepkilerdeki önemine rağmen, bu bölgedeki devreler tam olarak anlaşılamamıştır. Bu konunun araştırılmasında önemli bir zorluk, bu devreleri oluşturan nöron popülasyonlarının çeşitliliği olmuştur 6,31,32. Optogenetik ve kemogenetik tarafından yönetilen transgenik teknolojilerdeki son gelişm...
Açıklamalar
Yazarların beyan edecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Avustralya Ulusal Sağlık ve Tıbbi Araştırma Konseyi (NHMRC) (B.A.G. ve R.J.C.'ye 631000, 1043933, 1144638 ve 1184974 hibe) ve Hunter Tıbbi Araştırma Enstitüsü (B.A.G. ve R.J.C.'ye hibe) tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4-aminopyridine | Sigma-Aldrich | 275875-5G | |
| 100% ethanol | Thermo Fisher | AJA214-2.5LPL | |
| CaCl2 1M | Banksia Scientific | 0430/1L | |
| Carbonox (Carbogen - 95% O2, 5% CO2) | Coregas | 219122 | |
| Curved long handle spring scissors | Fine Science Tools | 15015-11 | |
| Custom made air interface incubation chamber | |||
| Foetal bovine serum | Thermo Fisher | 10091130 | |
| Forceps Dumont #5 | Fine Science Tools | 11251-30 | |
| Glucose | Thermo Fisher | AJA783-500G | |
| Horse serum | Thermo Fisher | 16050130 | |
| Inverted microscope | Zeiss | Axiovert10 | |
| KCl | Thermo Fisher | AJA383-500G | |
| Ketamine | Ceva | KETALAB04 | |
| Large surgical scissors | Fine Science Tools | 14007-14 | |
| Loctite 454 Instant Adhesive | Bolts and Industrial Supplies | L4543G | |
| MATLAB | MathWorks | R2018b | |
| MEAs, 3-Dimensional | Multichannel Systems | 60-3DMEA100/12/40iR-Ti, 60-3DMEA200/12/50iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in an 8x8 square grid. Electrodes are 12 µm in diameter, 40 µm (100/12/40) or 50 µm (200/12/50) high and equidistantly spaced 100 µm (100/12/40) or 200 µm (200/12/50) apart. |
| MEA headstage | Multichannel Systems | MEA2100-HS60 | |
| MEA interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot | |
| MEA net | Multichannel Systems | ALA HSG-MEA-5BD | |
| MEA perfusion system | Multichannel Systems | PPS2 | |
| MEAs, Planar | Multichannel Systems | 60MEA200/30iR-Ti, 60MEA500/30iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in either a 8x8 square grid (200/30) or a 6x10 rectangular grid (500/30). Electrodes are 30 µm in diameter and equidistantly spaced 200 µm (200/30) or 500 µm (500/30) apart. |
| MgCl2 | Thermo Fisher | AJA296-500G | |
| Microscope camera | Motic | Moticam X Wi-Fi | |
| Multi Channel Analyser software | Multichannel Systems | V 2.17.4 | |
| Multi Channel Experimenter software | Multichannel Systems | V 2.17.4 | |
| NaCl | Thermo Fisher | AJA465-500G | |
| NaHCO3 | Thermo Fisher | AJA475-500G | |
| NaH2PO4 | Thermo Fisher | ACR207805000 | |
| Rongeurs | Fine Science Tools | 16021-14 | |
| Small spring scissors | Fine Science Tools | 91500-09 | |
| Small surgical scissors | Fine Science Tools | 14060-09 | |
| Sucrose | Thermo Fisher | AJA530-500G | |
| Superglue | cyanoacrylate adhesive | ||
| Tetrodotoxin | Abcam | AB120055 | |
| Vibration isolation table | Newport | VH3048W-OPT | |
| Vibrating microtome | Leica | VT1200 S |
Referanslar
- Smith, K. M., et al. Calretinin positive neurons form an excitatory amplifier network in the spinal cord dorsal horn. eLife. 8, 49190 (2019).
- Smith, K. M., et al. Functional heterogeneity of calretinin-expressing neurons in the mouse superficial dorsal horn: implications for spinal pain processing. The Journal of physiology. 593 (19), 4319-4339 (2015).
- Boyle, K. A., et al. Defining a spinal microcircuit that gates myelinated afferent input: Implications for tactile allodynia. Cell Reports. 28 (2), 526-540 (2019).
- Browne, T. J., et al. Transgenic cross-referencing of inhibitory and excitatory interneuron populations to dissect neuronal heterogeneity in the dorsal horn. Frontiers in Molecular Neuroscience. 13, 32 (2020).
- Graham, B. A., Hughes, D. I. Rewards, perils and pitfalls of untangling spinal pain circuits. Current Opinion in Physiology. 11, 35-41 (2019).
- Todd, A. J. Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience. 11 (12), 823-836 (2010).
- Hughes, D. I., Todd, A. J. Central nervous system targets: inhibitory interneurons in the spinal cord. Neurotherapeutics. 17 (3), 874-885 (2020).
- Duan, B., et al. Identification of spinal circuits transmitting and gating mechanical pain. Cell. 159 (6), 1417-1432 (2014).
- Hachisuka, J., Chiang, M. C., Ross, S. E. Itch and neuropathis itch. Pain. 159 (3), 603 (2018).
- Foster, E., et al. Targeted ablation, silencing, and activation establish glycinergic dorsal horn neurons as key components of a spinal gate for pain and itch. Neuron. 85 (6), 1289-1304 (2015).
- Bourane, S., et al. Identification of a spinal circuit for light touch and fine motor control. Cell. 160 (3), 503-515 (2015).
- Cheng, L., et al. Identification of spinal circuits involved in touch-evoked dynamic mechanical pain. Nature neuroscience. 20 (6), 804-814 (2017).
- Peirs, C., et al. Mechanical allodynia circuitry in the dorsal horn is defined by the nature of the injury. Neuron. 109 (1), 73-90 (2021).
- Huang, J., et al. Circuit dissection of the role of somatostatin in itch and pain. Nature Neuroscience. 21 (5), 707-716 (2018).
- Obien, M. E. J., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 8, 423 (2015).
- Nam, Y., Wheeler, B. C. In vitro microelectrode array technology and neural recordings. Critical Reviews in Biomedical Engineering. 39 (1), 45-61 (2011).
- Johnstone, A. F., et al. Microelectrode arrays: a physiologically based neurotoxicity testing platform for the 21st century. Neurotoxicology. 31 (4), 331-350 (2010).
- Stett, A., et al. Biological application of microelectrode arrays in drug discovery and basic research. Analytical and Bioanalytical Chemistry. 377 (3), 486-495 (2003).
- Xu, L., et al. Trends and recent development of the microelectrode arrays (MEAs). Biosensors and Bioelectronics. 175 (1), 112854 (2020).
- Chapman, R. J., Cilia La Corte, P. F., Asghar, A. U. R., King, A. E. Network-based activity induced by 4-aminopyridine in rat dorsal horn in vitro is mediated by both chemical and electrical synapses. The Journal of Physiology. 587, 2499-2510 (2009).
- Ruscheweyh, R., Sandkühler, J. Epileptiform activity in rat spinal dorsal horn in vitro has common features with neuropathic pain. Pain. 105 (1-2), 327-338 (2003).
- Kay, C. W., Ursu, D., Sher, E., King, A. E. The role of Cx36 and Cx43 in 4-aminopyridine-induced rhythmic activity in the spinal nociceptive dorsal horn: an electrophysiological study in vitro. Physiological Reports. 4 (14), 12852 (2016).
- Jankowska, E., Lundberg, A., Rudomin, P., Sykova, E. Effects of 4-aminopyridine on synaptic transmission in the cat spinal cord. Brain Research. 240 (1), 117-129 (1982).
- Semba, K., Geller, H. M., Egger, M. D. 4-Aminopyridine induces expansion of cutaneous receptive fields of dorsal horn cells. Brain Research. 343 (2), 398-402 (1985).
- Ruscheweyh, R., Sandkühler, J. Long-range oscillatory Ca2+ waves in rat spinal dorsal horn. European Journal of Neuroscience. 22 (8), 1967-1976 (2005).
- Egert, U., et al. A novel organotypic long-term culture of the rat hippocampus on substrate-integrated multielectrode arrays. Brain Research Protocols. 2 (4), 229-242 (1998).
- Thiebaud, P., De Rooij, N., Koudelka-Hep, M., Stoppini, L. Microelectrode arrays for electrophysiological monitoring of hippocampal organotypic slice cultures. IEEE Transactions on Biomedical Engineering. 44 (11), 1159-1163 (1997).
- Rey, H. G., Pedreira, C., Quiroga, R. Q. Past, present and future of spike sorting techniques. Brain Research Bulletin. 119, 106-117 (2015).
- Satuvuori, E., et al. Measures of spike train synchrony for data with multiple time scales. Journal of Neuroscience Methods. 287, 25-38 (2017).
- Mendis, G. D. C., Morrisroe, E., Reid, C. A., Halgamuge, S. K., Petrou, S. Use of local field potentials of dissociated cultures grown on multi-electrode arrays for pharmacological assays. 38th Annual International Conference of the IEEE Engineering in Medicine and Biology Society. , 952-956 (2016).
- Hughes, D. I., et al. Morphological, neurochemical and electrophysiological features of parvalbumin-expressing cells: a likely source of axo-axonic inputs in the mouse spinal dorsal horn. The Journal of Physiology. 590 (16), 3927-3951 (2012).
- Peirs, C., Seal, R. P. Neural circuits for pain: recent advances and current views. Science. 354 (6312), 578-584 (2016).
- Li, J., Baccei, M. L. Developmental regulation of membrane excitability in rat spinal lamina I projection neurons. Journal of Neurophysiology. 107 (10), 2604-2614 (2012).
- Li, J., Baccei, M. L. Pacemaker neurons within newborn spinal pain circuits. Journal of Neuroscience. 31 (24), 9010-9022 (2011).
- Sandkühler, J., Eblen-Zajjur, A. Identification and characterization of rhythmic nociceptive and non-nociceptive spinal dorsal horn neurons in the rat. Neuroscience. 61 (4), 991-1006 (1994).
- Lucas-Romero, J., Rivera-Arconada, I., Roza, C., Lopez-Garcia, J. A. Origin and classification of spontaneous discharges in mouse superficial dorsal horn neurons. Scientific Reports. 8 (1), 9735-9735 (2018).
- Antonio, L., et al. L. al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. 260, 33-44 (2016).
- Avoli, M., Jefferys, J. G. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. 260, 26-32 (2016).
- Taccola, G., Nistri, A. Low micromolar concentrations of 4-aminopyridine facilitate fictive locomotion expressed by the rat spinal cord in vitro. Neuroscience. 126 (2), 511-520 (2004).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. Journal of Neurophysiology. 107 (2), 728-741 (2012).
- Egert, U., Heck, D., Aertsen, A. Two-dimensional monitoring of spiking networks in acute brain slices. Experimental Brain Research. 142 (2), 268-274 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır