É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Atividade de rede de gravação em circuitos nociceptivos da coluna vertebral usando matrizes de microeletrodos
Neste Artigo
Resumo
O uso combinado da tecnologia de matriz de microeletrodos e estimulação química induzida por 4 aminopirdina para investigar a atividade nociceptiva em nível de rede no chifre dorsal da medula espinhal é delineado.
Resumo
As funções e a conectividade de tipos específicos de neurônios dentro do chifre dorsal da medula espinhal (DH) estão sendo delineados em uma velocidade rápida para fornecer uma visão cada vez mais detalhada dos circuitos que sustentam o processamento da dor na coluna vertebral. No entanto, os efeitos dessas conexões para uma atividade de rede mais ampla no DH permanecem menos bem compreendidos porque a maioria dos estudos se concentra na atividade de neurônios únicos e microcircuitos pequenos. Alternativamente, o uso de matrizes de microeletrodos (MEAs), que podem monitorar a atividade elétrica em muitas células, proporciona alta resolução espacial e temporal da atividade neural. Aqui, descreve-se o uso de MEAs com fatias de medula espinhal de camundongos para estudar a atividade de DH induzida por circuitos dh quimicamente estimulantes com 4-aminopirridina (4-AP). A atividade rítmica resultante é restrita ao DH superficial, estável ao longo do tempo, bloqueada por tetrodotoxina, e pode ser investigada em diferentes orientações de fatias. Em conjunto, esta preparação fornece uma plataforma para investigar a atividade do circuito de DH em tecidos de animais ingênuos, modelos animais de dor crônica e camundongos com função nociceptiva geneticamente alterada. Além disso, gravações de MEA em fatias de medula espinhal estimuladas por 4-AP podem ser usadas como uma ferramenta de triagem rápida para avaliar a capacidade de novos compostos antinociceptivos para interromper a atividade na DH medular.
Introdução
Os papéis de tipos específicos de interneurônios inibitórios e excitatórios dentro da DH medula espinhal estão sendo descobertos a uma velocidade rápidade 1,2,3,4. Juntos, os interneurônios compõem mais de 95% dos neurônios no DH e estão envolvidos no processamento sensorial, incluindo a nocicepção. Além disso, esses circuitos interneurônios são importantes para determinar se os sinais periféricos ascendem ao neuroaxis para atingir o cérebro e contribuem para a percepção da dor 5,6,7. Até o momento, a maioria dos estudos investigou o papel dos neurônios DH no nível de análise unicelular ou organismo inteiro usando combinações de eletrofisiologia intracelular in vitro, rotulagem neuroanatomética e análise comportamental in vivo 1,3,8,9,10,11,12,13,14 . Essas abordagens avançaram significativamente na compreensão do papel das populações específicas de neurônios no processamento da dor. No entanto, permanece uma lacuna na compreensão de como tipos celulares específicos e pequenos macro-circuitos influenciam grandes populações de neurônios em um nível de microcircuito para posteriormente moldar a saída do DH, respostas comportamentais e a experiência de dor.
Uma tecnologia que pode investigar a função de macro-circuito ou nível multicelular é a matriz de microeletrodos (MEA)15,16. Os MEAs têm sido usados para investigar a função do sistema nervoso por várias décadas17,18. No cérebro, eles facilitaram o estudo do desenvolvimento neuronal, plasticidade sináptica, triagem farmacológica e teste de toxicidade17,18. Eles podem ser usados tanto para aplicações in vitro quanto in vivo, dependendo do tipo de MEA. Além disso, o desenvolvimento de MEAs evoluiu rapidamente, com diferentes números de eletrodos e configurações agora disponíveis19. Uma vantagem fundamental dos MEAs é sua capacidade de avaliar simultaneamente a atividade elétrica em muitos neurônios com alta precisão espacial e temporal através de múltiplos eletrodos15,16. Isso fornece uma leitura mais ampla de como os neurônios interagem em circuitos e redes, sob condições de controle e na presença de compostos aplicados localmente.
Um desafio das preparações in vitro de DH é que os níveis de atividade contínuos são tipicamente baixos. Aqui, este desafio é abordado em circuitos DH da medula espinhal usando o bloqueador de canal K+ com espaço de tensão, 4-aminopryidina (4-AP), para estimular quimicamente circuitos DH. Esta droga tem sido usada anteriormente para estabelecer atividade elétrica síncronica rítmica no DH de fatias agudas da medula espinhal e sob condições in vivo agudas 20,21,22,23,24. Esses experimentos utilizaram patch unicelular e gravação extracelular ou imagem de cálcio para caracterizar atividade induzida por 4-AP 20,21,22,23,24,25. Juntos, este trabalho demonstrou a exigência de transmissão sináptica excitatória e inibitória e sinapses elétricas para atividade rítmica induzida por 4-AP. Assim, a resposta 4-AP tem sido vista como uma abordagem que desmascara circuitos de DH polissinápticos nativos com relevância biológica e não como um epifenomenon induzido por drogas. Além disso, a atividade induzida por 4-AP exibe um perfil de resposta semelhante às drogas analgésicas e antiepilépticas como condições de dor neuropática e tem sido usada para propor novos alvos de drogas analgésicas de base espinhal, como connexins 20,21,22.
Aqui, é descrita uma preparação que combina MEAs e ativação química do DH espinhal com 4-AP para estudar este circuito nociceptivo no macro-circuito, ou nível de rede de análise. Esta abordagem fornece uma plataforma estável e reprodutível para investigar circuitos nociceptivos sob condições ingênuas e neuropáticas "semelhantes à dor". Esta preparação também é prontamente aplicável para testar a ação em nível de circuito de analgésicos conhecidos e para exibir novos analgésicos na medula espinhal hiperativa.
Protocolo
Foram realizados estudos em camundongos c57Bl/6 do sexo masculino e feminino de 3 a 12 meses. Todos os procedimentos experimentais foram realizados de acordo com o Comitê de Ética e Cuidados com Animais da Universidade de Newcastle (protocolos A-2013-312 e A-2020-002).
1. Eletrofisiologia in vitro
- Preparação de soluções para preparação e gravação de fatias de medula espinhal
- Fluido cefalorraquidiano artificial
NOTA: O fluido cerebrospinal artificial (aCSF) é usado em uma câmara de incubação de interface, onde as fatias são armazenadas até o início da gravação e durante experimentos como perfusado e diluído para drogas. Consulte a Tabela 1 para a composição detalhada.
- Fluido cefalorraquidiano artificial
| Químico | aCSF (mM) | aCSF (g/100 mL) | ACSF (mM) substituída por sacarose | ACSF substituída por sacarose (g/100 mL) | ACSF de potássio alto (mM) | ACSF de potássio alto (g/100 mL) |
| Cloreto de sódio (NaCl) | 118 | 0.690 | - | - | 118 | 0.690 |
| Carbonato de hidrogênio de sódio (NaHCO3) | 25 | 0.210 | 25 | 0.210 | 25 | 0.210 |
| Glicose | 10 | 0.180 | 10 | 0.180 | 10 | 0.180 |
| Cloreto de potasium (KCl) | 2.5 | 0.019 | 2.5 | 0.019 | 4.5 | 0.034 |
| Fosfato de dihidrogênio de sódio (NaH2PO4) | 1 | 0.012 | 1 | 0.012 | 1 | 0.012 |
| Cloride de magnésio (MgCl2) | 1 | 0.01 | 1 | 0.01 | 1 | 0.01 |
| Cloreto de cálcio (CaCl2) | 2.5 | 0.028 | 2.5 | 0.028 | 2.5 | 0.028 |
| Sacarose | - | - | 250 | 8.558 | - | - |
Tabela 1: Composições artificiais de fluidos cerebrospinais. Abreviação: aCSF = fluido cerebrospinal artificial.
- Prepare aCSF contendo (em mM) 118 NaCl, 25 NaHCO3, 10 glicose, 2,5 KCl, 1 NaH2PO4, 1 MgCl2 e 2,5 CaCl2 adicionando as quantidades necessárias do acima, excluindo CaCl2, a 2 L de água destilada.
- Bolha a solução acima com carbogen (95% O2, 5% CO2) por 5 min e adicione CaCl2.
NOTA: Esta etapa evita a precipitação da CCl2 , ou seja, a solução não deve ficar nublada. Para a aplicação de medicamentos durante os experimentos, diluir as soluções de estoque de drogas em aCSF para as concentrações finais desejadas.
- Fluido cerebrospinal artificial substituído por sacarose
NOTA: O ACSF substituído por sacarose é usado durante a dissecção e o corte da medula espinhal. Como indicado pelo nome, a sacarose é substituída por NaCl para reduzir a excitação neuronal durante esses procedimentos, mantendo a osmolaridade. Consulte a Tabela 1 para a composição detalhada.- Prepare aCSF substituída por sacarose contendo (em mM) 250 sacarose, 25 NaHCO3, 10 glicose, 2,5 KCl, 1 NaH2PO4, 1 MgCl2 e 2,5 CaCl2 adicionando as quantidades necessárias de todas as anteriores, excluindo CaCl2, a 300 mL de água destilada.
- Bolha a solução com carbogen por 5 min e, em seguida, adicione CaCl2.
- Armazene a solução em um congelador de -80 °C por aproximadamente 40 minutos ou até que a solução forme um chorume. Evite congelar sólido e use enquanto estiver em consistência de chorume.
- Preparação da matriz de microeletrídro
NOTA: A superfície de contato do MEA requer um pré-tratamento para torná-lo hidrofílico.- Antes do experimento, encha bem o MEA com soro bovino fetal (FBS) ou soro de cavalo (HS) por 30 minutos.
- Remova o FBS ou HS e enxágue completamente o MEA com aproximadamente cinco lavagens de água destilada até que a água destilada não esteja mais espuma. Encha o poço com aCSF, pronto para uso.
- Preparação aguda da fatia da medula espinhal
NOTA: A preparação da fatia da medula espinhal do camundongo é como descrito anteriormente por Smith et al.2. Idealmente, a remoção do alargamento lumbosacral não deve levar mais de 8-10 min (etapas 1.3.2-1.3.11 abaixo).- Anestesia profundamente o rato com 100 mg/kg de cetamina (i.p.) e, em seguida, decapitá-lo usando uma tesoura cirúrgica grande.
- Remova a pele sobre a região abdominal fazendo um pequeno corte na pele ao nível dos quadris. Puxe a pele de ambos os lados do corte rostrally até que toda a pele seja removida, ou seja, do topo da caixa torácica até o topo da pelve (tanto ventricamente quanto dorsalmente).
- Coloque o corpo no gelo e use uma abordagem ventral para expor a coluna vertebral removendo todas as vísceras e cortando as costelas lateralmente ao esterno.
- Remova a caixa torácica ventral, tanto escápula (cortada a aproximadamente T2), quanto os membros inferiores e pélvis (cortados aproximadamente na parte superior do sacro).
- Transfira a coluna vertebral e a preparação da costela para um banho dissecando contendo sacarose gelada aCSF. Fixar todos os quatro cantos da preparação (superfície ventral para cima) colocando pinos através dos músculos inferiores das costas e das costelas superiores presas.
- Remova todo o músculo e tecido conjuntivo sobre a superfície ventral das vértebras com rongeurs e identifique a região vertebral sobre o alargamento lumbosacral, que fica aproximadamente abaixo dos corpos vertebrais T12 a L2.
- Remova um corpo vertebral que é caudal para a região de alargamento lumbosacral para fornecer acesso à medula espinhal enquanto ela está no canal vertebral.
- Usando uma tesoura de mola curva, corte os pedículos vertebrais bilateralmente enquanto levanta e puxa o corpo vertebral rostrally para separar os aspectos ventral e dorsal das vértebras e expor a medula espinhal.
- Uma vez que os corpos vertebrais são removidos para revelar o alargamento lumbosacral, limpe cuidadosamente as raízes restantes que ancoram a medula espinhal com uma tesoura de mola até que a medula flutue livre.
- Isole a medula espinhal com cortes rostrais e caudais bem acima e abaixo do alargamento lumbosacral, permitindo que a região alvo do cordão -alvo 'flutue livre'.
NOTA: A orientação de fatia preferencial determinará como o cabo é posteriormente montado para seção (Figura 1). - Para fatias transversais, levante o segmento lumbosacral por uma raiz anexada e coloque-o em um bloco de poliestireno pré-cortado (isopor) (1 cm x 1 cm x 1 cm) com um canal raso cortado no centro. Use o adesivo de cianoacrilato (ver a Tabela de Materiais) para anexar o bloco e o cabo à plataforma de secção e colocá-lo no banho de corte contendo sacarose gelada aCSF (chorume).
NOTA: O canal raso ajuda a proteger e orientar a medula espinhal, com o lado dorsal exposto e a extremidade torácica do cordão na parte inferior do bloco. - Para fatias sagitárias, coloque uma linha fina de adesivo de cianoacrilato na plataforma de secção, levante o alargamento lumbosacral por uma raiz anexada e coloque o cabo ao longo da linha de cola, garantindo que uma superfície lateral esteja no adesivo e as outras faces para cima. Coloque-o no banho de corte contendo sacarose gelada aCSF (chorume).
- Para fatias horizontais, coloque uma linha fina de adesivo de cianoacrila na plataforma de secção. Levante o alargamento lumbosacral por uma raiz anexada e coloque o alargamento lumbosacral ao longo da linha de adesivo, garantindo que a superfície ventral esteja no adesivo e a superfície dorsal virada para cima. Use raízes anexadas para posicionar o cabo. Coloque-o no banho de corte contendo sacarose gelada aCSF (chorume).
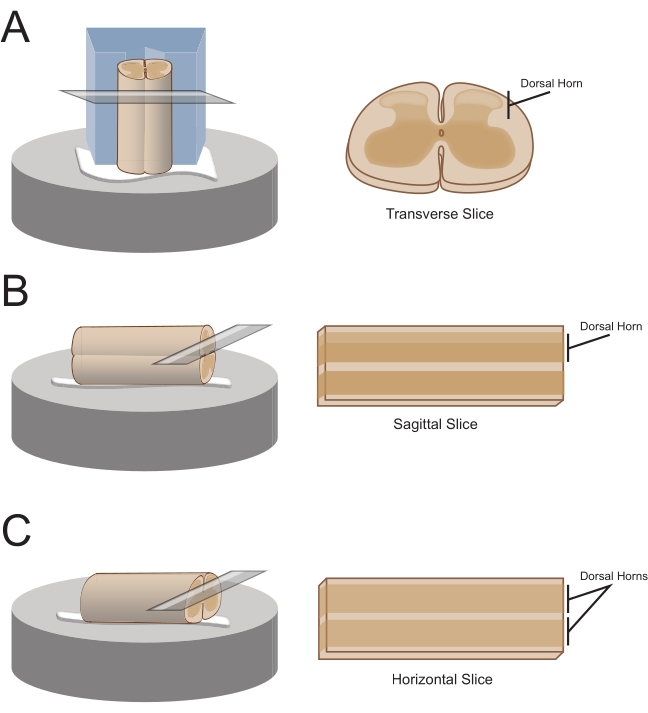
Figura 1: Orientações de fatia da medula espinhal, métodos de montagem e corte. (A) As fatias transversais requerem um bloco de corte de isopor com um sulco de suporte cortado nele. A medula espinhal está apoiada contra o bloco na ranhura de suporte, o lado dorsal da cordão voltado para longe do bloco. O bloco e o cabo são colados em um estágio de corte com adesivo de cianoacrilato. (B) As fatias de sagitar são preparadas colocando uma linha fina de adesivo de cianoacrilato no estágio de corte e, em seguida, posicionando a medula espinhal de lado na cola. (C) As fatias horizontais são preparadas colocando uma linha fina de adesivo de cianoacrilato no estágio de corte e, em seguida, posicionando o lado ventral da medula espinhal para baixo na cola. Clique aqui para ver uma versão maior desta figura.
- Obtenha fatias de 300 μm de espessura (L1-L5, mesma espessura independente da orientação) utilizando um microtoma vibratório com as seguintes configurações: velocidade de 0,06 mm/s, amplitude de 2,50 mm e calibrada para dentro de ±0,02 desvio de amplitude de altura.
- Transfira as fatias para uma câmara de incubação de interface de ar contendo aCSF oxigenada.
- Antes de gravar, deixe as fatias equilibrarem por 1h à temperatura ambiente (20-24 °C).
- Gravações de matriz de microeletrísmo
NOTA: As seguintes etapas detalham como usar dados de registro de experimentos baseados em MEA em fatias de medula espinhal. Vários projetos MEA podem ser usados dependendo do experimento. Detalhes de design para MEAs usados nesses experimentos são mostrados em Tabela 2 e Figura 2. Informações detalhadas sobre o design foram publicadas pela Egert et al.26 e Thiebaud et al.27 para MEAs planar e tridimensionais (3D), respectivamente. Ambos os tipos mea são compostos de 60 eletrodos de nitreto de titânio, com uma camada isolante de nitreto de silício e faixas de nitreto de titânio e almofadas de contato.- Configuração experimental
- Ligue o computador e a placa de interface e inicie o software de gravação.
- Carregue o modelo de gravação pré-montado (Figura 3A). Nomeie os arquivos do dia na guia do gravador.
- Bolha contínua aCSF com carbogen (5% CO2, 95% O2) durante a duração do experimento.
- Ligue o sistema de perfusão, que é controlado por uma bomba peristáltica. Coloque a linha de entrada em aCSF e a entrada final em um béquer de resíduo. Prime as linhas de perfusão com aCSF.
- Prepare 4-AP e quaisquer outras soluções medicamentosas diluindo estoques em 50 mL de aCSF para a concentração final necessária (por exemplo, 200 μM para 4-AP).
- Coloque as soluções de drogas em potes de drogas e borbulhe-as com carbogen.
- Atividade 4-AP
- Após a incubação, transfira uma única fatia da incubadora usando uma pipeta Pasteur de ponta grande preenchida com aCSF.
- Coloque bem a fatia no MEA e adicione aCSF adicional.
- Posicione a fatia sobre a matriz de gravação de 60 eletrodos usando uma escova de pintura de cabelo fina e curta. Evite entrar em contato com os eletrodos com o pincel ou arrastar o tecido através dos eletrodos, especialmente se usar matrizes 3D.
NOTA: Dependendo do layout MEA, isso pode ser feito com ou sem a ajuda de um microscópio para um posicionamento preciso. - Após o posicionamento da fatia, coloque uma rede ponderada sobre o tecido para mantê-la no lugar e promover um bom contato com eletrodos MEA.
NOTA: A fatia pode precisar de reposicionamento após a colocação da rede. - Coloque o MEA no headstage da gravação (Figura 2A,B).
- Verifique a posição do tecido sobre os eletrodos usando um microscópio invertido (ampliação 2x) para confirmar que o maior número possível de eletrodos estão sob o DH superficial (SDH). Certifique-se de que pelo menos 2-6 eletrodos não entrem em contato com a fatia, pois esses eletrodos são importantes para subtrair ruídos e registrar artefatos durante a análise (Figura 2E).
- Ligue a câmera, conecte-a ao dispositivo e tire uma imagem de referência da fatia em relação ao MEA para uso durante a análise.
- Pressione o DAQ inicial no software de gravação e confirme que todos os eletrodos estão recebendo um sinal claro.
NOTA: Se o sinal estiver barulhento, despreite o headstage e limpe tanto as almofadas de contato MEA quanto os contatos de mola de ouro com 70% de etanol (use uma limpeza de laboratório para garantir que as almofadas e contatos estejam secos após a limpeza). Se o sinal ainda estiver barulhento, desligue os eletrodos defeituosos no software de gravação ou note para exclusão mais tarde durante a análise. - Conecte as linhas de entrada e saída de perfusão ao poço MEA (previamente preenchido com aCSF) e ligue o sistema de perfusão. Verifique a vazão, idealmente 4-6 volumes de banho por minuto, e certifique-se de que a vazão é suficiente para evitar o estouro do superfusato.
- Deixe o tecido equilibrar por 5 minutos e, em seguida, registrar 5 min de dados brutos e não filtrados da linha de base.
- Mova a linha de entrada de perfusão da ACSF para uma solução de 4-AP e espere 12 minutos para que a atividade rítmica induzida por 4-AP atinja um estado estável (2 minutos para as drogas chegarem ao banho e 10 minutos para a atividade atingir o pico e, em seguida, o planalto).
- Registo 5 min de atividade induzida por 4-AP. Prepare-se para gravações subsequentes para testar as drogas ou para verificar a estabilidade do 4-AP.
- Configuração experimental
| Layouts de matriz de microeletrodo | ||||
| Modelo de matriz de microeletrodo | 60MEA 200/30iR-Ti | 60-3DMEA 100/12/40iR-Ti | 60-3DMEA 200/12/50iR-Ti | 60MEA 500/30iR-Ti |
| Planar ou 3-Dimensional (3D) | Planar | 3D | 3D | Planar |
| Grade de Eletrodos | 8 x 8 | 8 x 8 | 8 x 8 | 6 x 10 |
| Espaçamento de eletrodos | 200 μm | 100 μm | 200 μm | 500 μm |
| Diâmetro do eletrodo | 30 μm | 12 μm | 12 μm | 30 μm |
| Altura do eletrodo (3D) | N/A | 40 μm | 50 μm | N/A |
| Experiências | Fatia transversal | Fatia transversal | Sagitário + Horizontal | Sagitário + Horizontal |
Tabela 2: Layouts de matriz de microeletrodes.
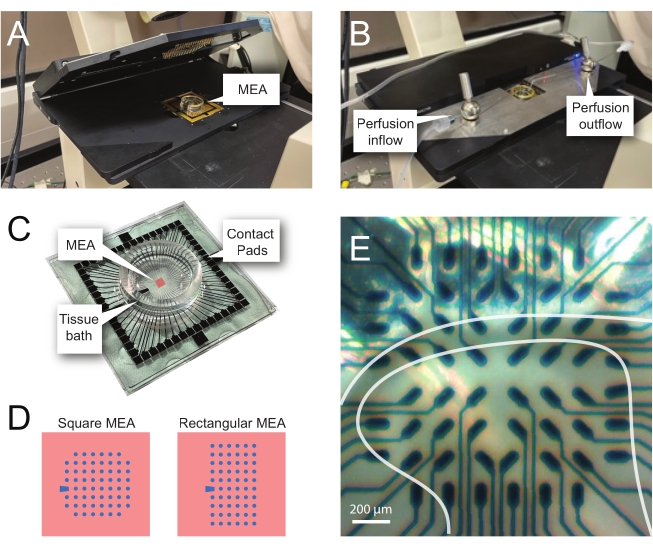
Figura 2: Posicionamento tecidual na matriz de microeletrídrica. (A) A imagem mostra um headstage MEA aberto com um MEA colocado na posição. (B) O mesmo que A com o headstage MEA fechado para gravações e sistema de perfusão de tecido no lugar. (C) A imagem mostra um MEA fornecido pelo fabricante. As almofadas de contato, que interagem com as molas de ouro do headstage, e o banho de tecido MEA que contém a solução de banho de tecido e fatia de tecido são mostrados. A área destacada pelo quadrado vermelho no centro é a localização da matriz de eletrodos. (D) Os esquemas mostram as duas configurações de eletrodos MEA utilizadas neste estudo, com maiores detalhes apresentados na Tabela 2. O eletrodo de referência é denotado pelo trapézio azul. O layout do eletrodo MEA esquerdo mostra uma configuração quadrada de 60 eletrodos, mais utilizada nos modelos de trabalho apresentados 60MEA200/30iR-Ti com eletrodos de 30 μm de diâmetro espaçados a 200 μm de distância, ou 200 μm espaçados e 100 μm espaçados MEAs tridimensionais (60MEA200/12/50iR-Ti e 60MEA100/12/40iR-Ti) com eletrodos de 12 μm de diâmetro e 50 μm ou 40 μm de altura, respectivamente. O layout do eletrodo MEA esquerdo mostra um layout retangular 6 x 10 eletrode-60MEA500/30iR-Ti. (E) Imagem de alta ampliação de um MEA quadrado 60MEA100/12/40iR-Ti com fatia de medula espinhal transversa posicionada para gravação. A fatia fica nas linhas de eletrodos 3-8. A linha superior de eletrodos, que não entram em contato com nenhum tecido, servem como eletrodos de referência. A área de SDH aparece como uma banda semitransparente. Neste caso, o SDH sobrepõe eletrodos nas linhas 4, 5 e 6 e colunas 2, 3, 4, 5 e 7 do MEA. Barra de escala = 200 μm. Abreviaturas: MEA = matriz de microeletrodos; SDH = chifre dorsal superficial. Clique aqui para ver uma versão maior desta figura.
- Trocando fatias
- Após cada sessão de gravação, enxágue as linhas com aCSF.
- Remova o MEA do headstage.
- Retire bem a rede e o tecido do MEA, enxágue-os bem com aCSF e repita os passos acima com uma nova fatia.
2. Processamento e análise de dados
NOTA: As seguintes etapas detalham como usar o software de análise para experimentos MEA em fatias de medula espinhal. Um dos 60 eletrodos serve como referência interna (marcado por um trapézio na Figura 2 C,D), enquanto entre quatro e vinte e cinco dos 59 restantes estão posicionados sob o SDH em uma fatia de medula espinhal de camundongo adulto. A análise subsequente detecta formas de onda de potencial de ação extracelular (EAP) e de potencial de campo local (ver Figura 3B , por exemplo) a partir do sinal bruto nesta região.
- Processamento de dados brutos
- Abra o software de análise e carregue o layout de análise pré-feito (Figura 3B).
- Abra o arquivo de interesse e desmarque o eletrodo de referência (eletrodo 15 em 8 x 8 MEA- ou eletrodo E1 em 6 x 10 MEA-configuração) e quaisquer eletrodos considerados excessivamente barulhentos.
- Defina o horário para análise (0:00 → 5:00 min).
- Mova-se para a guia do filtro cross-channel . Selecione a referência complexa e selecione os Eletrodos de referência com base na imagem tirada e nas notas feitas durante o experimento (ou seja, aqueles eletrodos não sob tecido). Para aplicar e verificar isso, pressione Explorar antes de continuar.
- Mova-se para a guia do filtro EAP e aplique um filtro Butterworth de2ª ordem (corte de 200 Hz) para remover a atividade LFP.
- Mova-se para a guia do filtro LFP e aplique um filtro Butterworth de2ª ordem (frequências delta de 0,5-4 Hz) para remover a atividade EAP.
- Mova-se para a guia detector EAP e selecione limiar automático. Tick Rising and Falling edge boxes e definir o tempo morto para 0,5 ms.
- Definir limiares positivos e negativos com base nos dados. Inspecione os dados retornando à tela do analisador de dados Raw, movendo o marcador de tempo e, em seguida, retornando à guia do detector EAP e pressionando Explorar. Repita até que se afirme que o limiar de detecção do conjunto está capturando EAPs sem capturar ruído/atividade não fisiológica. Use os eletrodos de referência para identificar ruído/atividade não fisiológica.
NOTA: É necessário garantir que um número mínimo de EAPs sejam detectados em eletrodos de referência onde a atividade fisiológica não ocorrerá. No entanto, desvios bastante leves na linha de base podem ser falsamente detectados como EAPs. Isto é, enquanto ainda visa maximizar o número de eventos reais detectados nos eletrodos ativos. - Mova-se para a guia do detector LFP, selecione o limiar Manual, marque caixas de borda subindo e caindo e ajuste o tempo morto para 3 ms.
- Repita o passo 2.1.8 para um eletrodo selecionando um eletrodo com atividade LFP. Uma vez satisfeito, selecione Aplicar a todos como limiares só será aplicado a um único eletrodo ao realizar o limiar manual.
- Ao examinar os dados LFP na guia Detector , observe o número máximo de cruzamentos de limiar para uma forma de onda LFP e a separação de tempo máximo de cruzamentos de limiar para uma forma de onda LFP para uso em análise posterior.
- Análise pressione start.
- Quando a análise estiver concluída, mova-se para a guia analisador EAP e exporte os dados. Faça o mesmo na guia analisador LFP .
- Repita este processo para todos os outros arquivos da mesma fatia.
- Após a exportação de dados, converta os arquivos em formato xlsx para que possam ser lidos pelo script de programação usado. Nomeie os arquivos de acordo com a seguinte convenção para o script fornecido para lê-los: nome do experimento (por exemplo, dados de amostra) - número de fatia (por exemplo, S1) - número de gravação (por exemplo, R1) - tipo de atividade (por exemplo, picos ou SPs, correspondentes a EAPs ou LFPs, respectivamente).
NOTA: A análise EAP descrita aqui trata o espetamento de canais individuais como uma única população, embora essa atividade normalmente surgiria de múltiplos neurônios próximos ao eletrodo de gravação. Se o número de neurônios que contribuem para os EAPs em um canal for desejado, técnicas de triagem multispike descritas em outros lugares podem ser aplicadas para distinguir populações distintas de picos com base nas características de forma de onda28.
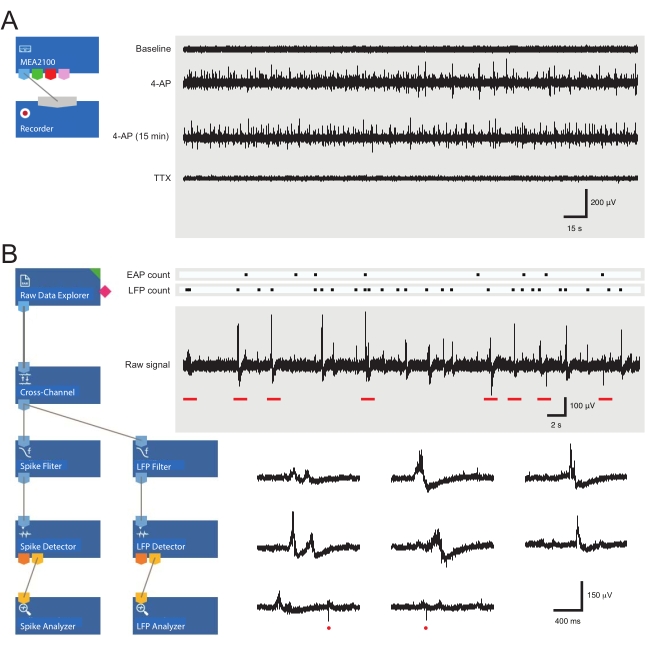
Figura 3: Layouts de ferramentas de gravação e análise de dados e gravações de matriz de microeletríndias que mostram potencial de ação extracelular e formas de onda potenciais de campo locais. (A) Esquema mostra modelo de gravação pré-configurado para aquisição de dados MEA. A vinculação do MEA2100 e da ferramenta de gravação (headstage/amplificador) permite que os dados sejam nomeados e salvos. Quatro traços de exemplo de dados brutos (à direita, épocas de 5 min) foram coletados por um canal MEA mostrando atividade na linha de base, 12 minutos após a aplicação de 4-AP, mais 15 min após a atividade estabelecida de 4-AP e após a aplicação de banho de TTX (1 μM). Note que a adição de 4-AP (segundo traço) produz um claro aumento no ruído de fundo e na atividade EAP/LFP. É importante ressaltar que a atividade permanece relativamente estável por pelo menos 15 minutos após a atividade induzida por 4-AP (terceiro traço). A adição de TTX (1 μM) aboli toda a atividade (traço inferior). (B) O esquema (à esquerda) mostra a configuração do software analisador para análise de dados. A ferramenta de explorador de dados brutos é usada para importar gravações coletadas por software de gravação. Esses dados são então executados através de uma ferramenta de filtro transversal que subtrai os sinais de eletrodos de referência selecionados de outros eletrodos para remover o ruído de fundo. Os dados passam pelo filtro EAP e pelas ferramentas de filtro LFP para otimizar as relações sinal-ruído para cada forma de onda. Após esta etapa, os dados de caminho EAP entram na ferramenta detector EAP, onde os limiares são definidos. Os EAPs são detectados e enviados para a ferramenta analisador EAP, onde as latências de cada evento são registradas e exportadas como um txt. arquivo. Um fluxo de trabalho idêntico ocorre para dados LFP usando um kit de ferramentas LFP correspondente. Traços certos mostram dados de um único canal MEA contendo várias formas de onda extracelulares. A localização dos sinais EAP e LFP são destacadas nos 'rasters de contagem' acima. Traços inferiores são épocas de gravação superior (denotadas por barras vermelhas) mostrando formas de onda em uma escala de tempo expandida, incluindo vários sinais LFP (note a variedade de aparências) e EAPs extracelulares individuais (círculos vermelhos). Note que a forma de onda lFP/EAP e a polaridade variam em relação ao número de neurônios que produzem esses sinais, sua proximidade com o eletrodo de gravação e sua localização em relação aos eletrodos próximos. Abreviaturas: MEA = matriz de microeletrodos; EAP = potencial de ação extracelular; LFP = potencial de campo local; 4-AP = 4-aminopirridina; TTX = tetrodotoxina. Clique aqui para ver uma versão maior desta figura.
- Análise de sincronicidade
NOTA: A sincronicidade, ou o número de eventos 'coincidentes' entre dois eletrodos, foi determinado usando o critério de coincidência dentro do método de sincronização A-SPIKE delineado por Satuvuori et al. 29. O script utilizado aqui só compara eletrodos adjacentes uns aos outros para eficiência (ou seja, vizinhos horizontais, verticais e diagonais); no entanto, o script poderia ser reescrito para comparar todos os eletrodos, se necessário.- Execute a análise de dados usando um script de programação personalizado, que extrai horários de latência para cada eletrodo a partir dos arquivos .xlsx.
NOTA: Isso pode ser feito manualmente. - Na etapa 2.1.11, registo o número máximo de cruzamentos de limiares e a separação de tempo máximo de cruzamentos de limiar para uma forma de onda LFP. Modifique o script para inserir esses parâmetros de definição de LFP para cada fatia antes de executar o script.
NOTA: O limiar realizado anteriormente no software de análise captura claramente os EAPs como um único evento. No entanto, os LFPs são compostos por um número variável de picos, dependendo da forma da forma de onda e do número subsequente de cruzamentos de limiares por um evento. - Modifique o script para inserir os eletrodos de interesse antes da análise.
- Para determinar a sincronicidade (definida no script por períodos de tempo modificáveis para que a atividade síncronana ocorra dentro), separe e analise as latências extraídas para detectar eventos coincidentes.
NOTA: O script permite que o tempo máximo entre eventos coincidentes seja definido. Estes são definidos em 20 ms para EAPs e 200 ms para LFPs. - Execute o script para extrair horários de latência.
NOTA: O arquivo de saída .xlsx contém as interpretações de dados de latência, que são contagens de EAP e LFP, frequências e contagem de eventos coincidentes para eletrodos individuais e fatias inteiras. Esses dados são usados para avaliar a frequência, contagens de EAP/LFP, número de eletrodos ativos, número de eventos coincidentes, número de eletrodos ligados e a força média dessas ligações.
- Execute a análise de dados usando um script de programação personalizado, que extrai horários de latência para cada eletrodo a partir dos arquivos .xlsx.
Resultados
Modelo de atividade de rede no chifre dorsal da medula espinhal
A aplicação de 4-AP induz de forma confiável a atividade rítmica síncronica na medula espinhal DH. Tal atividade apresenta-se como aumento de EAPs e LFPs. O sinal posterior é uma forma de onda de baixa frequência, que já foi descrita nas gravações do MEA30. Alterações na atividade EAP e/ou LFP após a aplicação da droga refletem a atividade neural alterada. Exemplos de EAPs e LFPs são mostrados na
Discussão
Apesar da importância da DH espinhal na sinalização nociceptiva, no processamento e nas respostas comportamentais e emocionais resultantes que caracterizam a dor, os circuitos nessa região permanecem mal compreendidos. Um dos principais desafios na investigação desta questão tem sido a diversidade de populações de neurônios que compõem esses circuitos 6,31,32. Os recentes avanços nas tecnologias transgênicas, lidera...
Divulgações
Os autores não têm conflitos de interesse para declarar.
Agradecimentos
Este trabalho foi financiado pelo National Health and Medical Research Council (NHMRC) da Austrália (bolsas 631000, 1043933, 1144638 e 1184974 para B.A.G. e R.J.C.) e o Hunter Medical Research Institute (bolsa para B.A.G. e R.J.C.).
Materiais
| Name | Company | Catalog Number | Comments |
| 4-aminopyridine | Sigma-Aldrich | 275875-5G | |
| 100% ethanol | Thermo Fisher | AJA214-2.5LPL | |
| CaCl2 1M | Banksia Scientific | 0430/1L | |
| Carbonox (Carbogen - 95% O2, 5% CO2) | Coregas | 219122 | |
| Curved long handle spring scissors | Fine Science Tools | 15015-11 | |
| Custom made air interface incubation chamber | |||
| Foetal bovine serum | Thermo Fisher | 10091130 | |
| Forceps Dumont #5 | Fine Science Tools | 11251-30 | |
| Glucose | Thermo Fisher | AJA783-500G | |
| Horse serum | Thermo Fisher | 16050130 | |
| Inverted microscope | Zeiss | Axiovert10 | |
| KCl | Thermo Fisher | AJA383-500G | |
| Ketamine | Ceva | KETALAB04 | |
| Large surgical scissors | Fine Science Tools | 14007-14 | |
| Loctite 454 Instant Adhesive | Bolts and Industrial Supplies | L4543G | |
| MATLAB | MathWorks | R2018b | |
| MEAs, 3-Dimensional | Multichannel Systems | 60-3DMEA100/12/40iR-Ti, 60-3DMEA200/12/50iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in an 8x8 square grid. Electrodes are 12 µm in diameter, 40 µm (100/12/40) or 50 µm (200/12/50) high and equidistantly spaced 100 µm (100/12/40) or 200 µm (200/12/50) apart. |
| MEA headstage | Multichannel Systems | MEA2100-HS60 | |
| MEA interface board | Multichannel Systems | MCS-IFB 3.0 Multiboot | |
| MEA net | Multichannel Systems | ALA HSG-MEA-5BD | |
| MEA perfusion system | Multichannel Systems | PPS2 | |
| MEAs, Planar | Multichannel Systems | 60MEA200/30iR-Ti, 60MEA500/30iR-Ti | 60 titanium nitride (TiN) electrodes with 1 internal reference electrode, organised in either a 8x8 square grid (200/30) or a 6x10 rectangular grid (500/30). Electrodes are 30 µm in diameter and equidistantly spaced 200 µm (200/30) or 500 µm (500/30) apart. |
| MgCl2 | Thermo Fisher | AJA296-500G | |
| Microscope camera | Motic | Moticam X Wi-Fi | |
| Multi Channel Analyser software | Multichannel Systems | V 2.17.4 | |
| Multi Channel Experimenter software | Multichannel Systems | V 2.17.4 | |
| NaCl | Thermo Fisher | AJA465-500G | |
| NaHCO3 | Thermo Fisher | AJA475-500G | |
| NaH2PO4 | Thermo Fisher | ACR207805000 | |
| Rongeurs | Fine Science Tools | 16021-14 | |
| Small spring scissors | Fine Science Tools | 91500-09 | |
| Small surgical scissors | Fine Science Tools | 14060-09 | |
| Sucrose | Thermo Fisher | AJA530-500G | |
| Superglue | cyanoacrylate adhesive | ||
| Tetrodotoxin | Abcam | AB120055 | |
| Vibration isolation table | Newport | VH3048W-OPT | |
| Vibrating microtome | Leica | VT1200 S |
Referências
- Smith, K. M., et al. Calretinin positive neurons form an excitatory amplifier network in the spinal cord dorsal horn. eLife. 8, 49190 (2019).
- Smith, K. M., et al. Functional heterogeneity of calretinin-expressing neurons in the mouse superficial dorsal horn: implications for spinal pain processing. The Journal of physiology. 593 (19), 4319-4339 (2015).
- Boyle, K. A., et al. Defining a spinal microcircuit that gates myelinated afferent input: Implications for tactile allodynia. Cell Reports. 28 (2), 526-540 (2019).
- Browne, T. J., et al. Transgenic cross-referencing of inhibitory and excitatory interneuron populations to dissect neuronal heterogeneity in the dorsal horn. Frontiers in Molecular Neuroscience. 13, 32 (2020).
- Graham, B. A., Hughes, D. I. Rewards, perils and pitfalls of untangling spinal pain circuits. Current Opinion in Physiology. 11, 35-41 (2019).
- Todd, A. J. Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience. 11 (12), 823-836 (2010).
- Hughes, D. I., Todd, A. J. Central nervous system targets: inhibitory interneurons in the spinal cord. Neurotherapeutics. 17 (3), 874-885 (2020).
- Duan, B., et al. Identification of spinal circuits transmitting and gating mechanical pain. Cell. 159 (6), 1417-1432 (2014).
- Hachisuka, J., Chiang, M. C., Ross, S. E. Itch and neuropathis itch. Pain. 159 (3), 603 (2018).
- Foster, E., et al. Targeted ablation, silencing, and activation establish glycinergic dorsal horn neurons as key components of a spinal gate for pain and itch. Neuron. 85 (6), 1289-1304 (2015).
- Bourane, S., et al. Identification of a spinal circuit for light touch and fine motor control. Cell. 160 (3), 503-515 (2015).
- Cheng, L., et al. Identification of spinal circuits involved in touch-evoked dynamic mechanical pain. Nature neuroscience. 20 (6), 804-814 (2017).
- Peirs, C., et al. Mechanical allodynia circuitry in the dorsal horn is defined by the nature of the injury. Neuron. 109 (1), 73-90 (2021).
- Huang, J., et al. Circuit dissection of the role of somatostatin in itch and pain. Nature Neuroscience. 21 (5), 707-716 (2018).
- Obien, M. E. J., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 8, 423 (2015).
- Nam, Y., Wheeler, B. C. In vitro microelectrode array technology and neural recordings. Critical Reviews in Biomedical Engineering. 39 (1), 45-61 (2011).
- Johnstone, A. F., et al. Microelectrode arrays: a physiologically based neurotoxicity testing platform for the 21st century. Neurotoxicology. 31 (4), 331-350 (2010).
- Stett, A., et al. Biological application of microelectrode arrays in drug discovery and basic research. Analytical and Bioanalytical Chemistry. 377 (3), 486-495 (2003).
- Xu, L., et al. Trends and recent development of the microelectrode arrays (MEAs). Biosensors and Bioelectronics. 175 (1), 112854 (2020).
- Chapman, R. J., Cilia La Corte, P. F., Asghar, A. U. R., King, A. E. Network-based activity induced by 4-aminopyridine in rat dorsal horn in vitro is mediated by both chemical and electrical synapses. The Journal of Physiology. 587, 2499-2510 (2009).
- Ruscheweyh, R., Sandkühler, J. Epileptiform activity in rat spinal dorsal horn in vitro has common features with neuropathic pain. Pain. 105 (1-2), 327-338 (2003).
- Kay, C. W., Ursu, D., Sher, E., King, A. E. The role of Cx36 and Cx43 in 4-aminopyridine-induced rhythmic activity in the spinal nociceptive dorsal horn: an electrophysiological study in vitro. Physiological Reports. 4 (14), 12852 (2016).
- Jankowska, E., Lundberg, A., Rudomin, P., Sykova, E. Effects of 4-aminopyridine on synaptic transmission in the cat spinal cord. Brain Research. 240 (1), 117-129 (1982).
- Semba, K., Geller, H. M., Egger, M. D. 4-Aminopyridine induces expansion of cutaneous receptive fields of dorsal horn cells. Brain Research. 343 (2), 398-402 (1985).
- Ruscheweyh, R., Sandkühler, J. Long-range oscillatory Ca2+ waves in rat spinal dorsal horn. European Journal of Neuroscience. 22 (8), 1967-1976 (2005).
- Egert, U., et al. A novel organotypic long-term culture of the rat hippocampus on substrate-integrated multielectrode arrays. Brain Research Protocols. 2 (4), 229-242 (1998).
- Thiebaud, P., De Rooij, N., Koudelka-Hep, M., Stoppini, L. Microelectrode arrays for electrophysiological monitoring of hippocampal organotypic slice cultures. IEEE Transactions on Biomedical Engineering. 44 (11), 1159-1163 (1997).
- Rey, H. G., Pedreira, C., Quiroga, R. Q. Past, present and future of spike sorting techniques. Brain Research Bulletin. 119, 106-117 (2015).
- Satuvuori, E., et al. Measures of spike train synchrony for data with multiple time scales. Journal of Neuroscience Methods. 287, 25-38 (2017).
- Mendis, G. D. C., Morrisroe, E., Reid, C. A., Halgamuge, S. K., Petrou, S. Use of local field potentials of dissociated cultures grown on multi-electrode arrays for pharmacological assays. 38th Annual International Conference of the IEEE Engineering in Medicine and Biology Society. , 952-956 (2016).
- Hughes, D. I., et al. Morphological, neurochemical and electrophysiological features of parvalbumin-expressing cells: a likely source of axo-axonic inputs in the mouse spinal dorsal horn. The Journal of Physiology. 590 (16), 3927-3951 (2012).
- Peirs, C., Seal, R. P. Neural circuits for pain: recent advances and current views. Science. 354 (6312), 578-584 (2016).
- Li, J., Baccei, M. L. Developmental regulation of membrane excitability in rat spinal lamina I projection neurons. Journal of Neurophysiology. 107 (10), 2604-2614 (2012).
- Li, J., Baccei, M. L. Pacemaker neurons within newborn spinal pain circuits. Journal of Neuroscience. 31 (24), 9010-9022 (2011).
- Sandkühler, J., Eblen-Zajjur, A. Identification and characterization of rhythmic nociceptive and non-nociceptive spinal dorsal horn neurons in the rat. Neuroscience. 61 (4), 991-1006 (1994).
- Lucas-Romero, J., Rivera-Arconada, I., Roza, C., Lopez-Garcia, J. A. Origin and classification of spontaneous discharges in mouse superficial dorsal horn neurons. Scientific Reports. 8 (1), 9735-9735 (2018).
- Antonio, L., et al. L. al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. 260, 33-44 (2016).
- Avoli, M., Jefferys, J. G. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. 260, 26-32 (2016).
- Taccola, G., Nistri, A. Low micromolar concentrations of 4-aminopyridine facilitate fictive locomotion expressed by the rat spinal cord in vitro. Neuroscience. 126 (2), 511-520 (2004).
- Mitra, P., Brownstone, R. M. An in vitro spinal cord slice preparation for recording from lumbar motoneurons of the adult mouse. Journal of Neurophysiology. 107 (2), 728-741 (2012).
- Egert, U., Heck, D., Aertsen, A. Two-dimensional monitoring of spiking networks in acute brain slices. Experimental Brain Research. 142 (2), 268-274 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados