A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحسين قابلية التكرار والدقة في القياس الكمي عالي الإنتاجية لبيانات نمو البكتيريا باستخدام قارئ الألواح الدقيقة
In This Article
Summary
هنا ، يتم تقديم بروتوكول عالي الإنتاجية لقياس بيانات النمو ، بما في ذلك منحنيات النمو ومعدل النمو والحد الأقصى لمعدل النمو. تم التحقق من البروتوكول والتحقق من صحته باستخدام بكتيريا منتجة للأغشية الحيوية. يمكن توسيع النتائج والنهج المطبق في هذه الدراسة ليشمل بروتوكولات أخرى عالية الإنتاجية باستخدام قارئات الألواح الدقيقة.
Abstract
هدفت هذه الدراسة إلى تطوير بروتوكول قابل للتكرار وموثوق به وعالي الإنتاجية لمراقبة نمو البكتيريا في ألواح 96 بئرا وتحليل الحد الأقصى لمعدل النمو. تم تحديد منحنيات النمو ومعدلات النمو القصوى لنوعين من البكتيريا. تم التحقيق في القضايا بما في ذلك (أنا) تكثيف الغطاء ، (ثانيا) تصحيح طول المسار ، (ثالثا) حجم التلقيح ، (رابعا) الفاصل الزمني لأخذ العينات ، و (ت) التحيز المكاني. تم تقييم قابلية تكرار البروتوكول بثلاث تكرارات فنية مستقلة ، مع انحراف معياري قدره 0.03 بين عمليات التشغيل. تم تحديد الحد الأقصى لمعدلات نمو Bacillus mycoides و Paenibacillus tundrae لتكون (متوسط ± SD) 0.99 ساعة −1 ± 0.03 ساعة −1 و 0.85 ساعة −1 ± 0.025 ساعة −1 ، على التوالي. هذه البكتيريا أكثر صعوبة في المراقبة بصريا بسبب تقاربها في التكتل معا. توضح هذه الدراسة الأهمية الحاسمة لحجم التلقيح ، وتصحيح طول المسار ، وتسخين الغطاء ، والفترات الزمنية لأخذ العينات ، والتحيز المكاني للوحة البئر للحصول على بيانات موثوقة ودقيقة وقابلة للتكرار على قارئات الألواح الدقيقة. يمكن توسيع البروتوكول المطور وخطوات التحقق الخاصة به ليشمل طرقا أخرى باستخدام قارئات الألواح الدقيقة والبروتوكولات عالية الإنتاجية ، مما يقلل من الأخطاء الفطرية للباحثين وتكاليف المواد.
Introduction
يؤكد الاهتمام بمعالجة البكتيريا المتعددة ، بما في ذلك دراسات الآلية والتمثيل الغذائي للبكتيريا ، على أهمية الإنتاجية العالية والأساليب الآلية مثل تسجيل بيانات النمو1،2. يمكن أن تساعد بيانات النمو التي تشتمل على معلمات حركية ، مثل معدلات النمو القصوى ، في توصيف الاستجابات البكتيرية لمختلف الظروف الفيزيائية والكيميائية والمضادة للبكتيريا. بيانات معدل النمو هي متغير استجابة قياسي يستخدم للكشف عن روابط النمط الجيني والأنماط الظاهريةالمحتملة 1 أو الإشارة إلى السلامة الميكروبية والعمر الافتراضي لإنتاج الأغذية3،4. تعتمد تقنيات مثل تطور المختبر التكيفي5،6،7 ، والفحص على مستوى الجينوم ، وبعض المقايسات الكيميائية8 ، والشاشات الجينية الأماميةالمختلفة 9 على معدلات النمو لتقييم النتائج.
تعد قياسات الكثافة الضوئية (OD) للثقافات البكتيرية طريقة ميكروبيولوجية قياسية لمراقبة نمو البكتيريا. غالبا ما يتم تسجيل قياسات OD بطول موجي يبلغ 600 نانومتر ، بالاعتماد على تشتت الضوء وكثافة الخلية10،11. يشرح قانون Beer-Lambert اعتماد قيم OD على التركيز (أي كثافة الخلية وعدد الخلية) وطول المسار ومعامل الامتصاص. تؤثر الهندسة والنظام البصري لمقياس الطيف الضوئي على قراءات OD11. يمكن أن تكون الطرق الكلاسيكية لقياسات OD كثيفة الاستخدام للوقت والعمالة ، ويمكن أن تحمل البيانات مجموعة متنوعة من الأخطاء البشرية. في هذا البروتوكول ، يتم استخدام قارئ الصفيحة الدقيقة لتقليل وقت المحلل12،13 وفرصة التلوث البيولوجي. يتم تطبيق تحليل الإنتاجية العالية باستخدام قارئات الألواح الدقيقة على نطاق واسع في مجالات علم الأحياء الدقيقة المختلفة ، مثل فحص البكتيريا المنتجة للأغشية الحيوية14،15 ، وتثبيط نمو البكتيريا16 ، ونمو خلايا الخميرة17 ، وتحديد القابلية المضادة للفطريات18 ، وفحص سمية الموادالنانوية 19.
نشر عدد قليل من الباحثين بروتوكولات معدل نمو البكتيريا باستخدام قارئ صفيحة دقيقة12،20،21. ومع ذلك، لم يتم وضع بروتوكول شامل يفحص موثوقية البيانات التي تم جمعها بشكل كامل. يذكر أن عوامل مثل نوع الأنواع22،23،24 وأشرطة الختم تؤثر على التكرار بسبب عدم كفاية نقل الأكسجين في صفيحة 96 بئرا25،26. أبلغ Delaney et al. عن مجموعات كبيرة من Methylorubrum extorquens (سلالة من النوع البري) في وسط النمو عند استخدام قارئ الصفيحة الدقيقة ، مما تسبب في بيانات نمو صاخبةللغاية 24. تم حل المشكلة عن طريق إزالة الجينات المرتبطة بإنتاج الأغشيةالحيوية 24. بسبب إفراز المواد البوليمرية خارج الخلية ، فإن البكتيريا المنتجة للأغشية الحيوية لها تقارب أكبر للاندماج معا وتكوين مجموعات الخلايا. لذلك ، من الصعب مراقبة نموها باستخدام تقنيات تشتت الضوء (على سبيل المثال ، مقاييس الطيف الضوئي وقارئات الصفائح الدقيقة).
يهدف هذا البروتوكول إلى وضع خطوات للحصول على بيانات قابلة للتكرار بطريقة عالية الإنتاجية باستخدام قارئ الألواح الدقيقة. تم استخدام Bacillus mycoides و Paenibacillus tundrae نظرا لنموهما السريع وقدرتهما على إنتاج الأغشية الحيوية ، والتي تمثل تحديا تقليديا في الأساليب اليدوية والآلية. تم التحقيق في عوامل مثل (أنا) تصحيح طول المسار ، (ثانيا) التكثيف على الغطاء ، (ثالثا) حجم اللقاح ، (رابعا) الفاصل الزمني لأخذ العينات ، و (ت) التحيز المكاني لتقييم موثوقية البيانات وقابليتها للتكرار. يقدم هذا البروتوكول خطوات لمراقبة نمو البكتيريا بدقة وقياس معدلات نمو محددة باستخدام قارئ صفيحة دقيقة.
Protocol
ملاحظة: يجب اتباع جميع الخطوات الواردة في هذا البروتوكول في ظروف معقمة (أي بين لهبين أو خزانة للسلامة البيولوجية). يتم تعقيم جميع المواد والأدوات لمدة 20 دقيقة. راجع جدول المواد للحصول على تفاصيل حول جميع المواد والمعدات والبرامج المستخدمة في هذا البروتوكول. يتم تطهير الأيدي التي ترتدي القفازات وحفظها مبللة بمطهر اليدين أو محلول كحول بنسبة 70٪ لمدة دقيقة واحدة على الأقل ، ولا يتم إزالتها من خزانة الأمان بعد ذلك. خلاف ذلك ، يجب تكرار إجراء التطهير قبل إعادة اليدين إلى خزانة الأمان. تنبيه: تأكد من تبخير المطهر تماما قبل استخدام اللهب المكشوف.
ملاحظة: تم عزل بكتيريا من الترشيح الحيوي لمياه الشرب كما هو موضح سابقا27 لقدرتهما على إنتاج الأغشية الحيوية. تم تحديدها من خلال تسلسل الحمض النووي الريبي الكامل 16S وتم تقديمها إلى NCBI باسم Bacillus mycoides (SAMN10518261) و Paenibacillus tundrae (SAMN10452279).
1. تحضير المخزون البكتيري في الجلسرين
- قم بوزن 3 جم من مسحوق مرق الصويا التربتي (TSB) وقم بإذابه في 100 مل من الماء المقطر. قم بتعقيم المرق لمدة 20 دقيقة واتركه يبرد حتى يصل إلى درجة حرارة الغرفة. أضف 50 مل من TSB إلى قارورة سعة 50 مل.
- نقل البكتيريا إلى لوحات أجار27،28. باستخدام حلقة ، اختر مستعمرة من البكتيريا من صفيحة الأجار. أضف محتوى الحلقة إلى القارورة عن طريق تدوير الحلقة برفق. احتضن القارورة طوال الليل عند 30 درجة مئوية ± 1 درجة مئوية مع اهتزاز مداري عند 150 دورة في الدقيقة.
ملاحظة: يجب ضبط درجة الحرارة والاهتزاز وفقا لنوع الإجهاد. - قم بإعداد قارورة أخرى سعة 50 مل مع 47.5 مل من TSB. انقل 2.5 مل من المزرعة الليلية إلى القارورة. احتضانه لمدة 5-6 ساعات للوصول إلى OD600 = 0.6 0.05 (للوصول إلى المرحلة الأسية المتوسطة).
- انقل المزرعة إلى أنبوب طرد مركزي معقم سعة 50 مل. جهاز الطرد المركزي للثقافة عند 2,200 × جم لمدة 10 دقائق. صب المرق برفق لتجنب فقدان أي خلايا مجمعة في قاع الأنبوب.
- أضف 5 مل من المحلول الملحي المخزن بالفوسفات (PBS) إلى نفس الأنبوب وجهاز الطرد المركزي عند 2,200 × جم لمدة 10 دقائق. كرر هذه الخطوة 3x.
- اضبط OD600 للخلايا على 0.6 0.05 باستخدام ماصة لمعايرة كمية كافية من محلول PBS. سجل بدقة الكمية المضافة من PBS للاستخدام في المستقبل.
- قم بمعايرة الجلسرين إلى المعلق لتصل إلى 20٪ من حجم / حجم. قم بتغطية الأنبوب والدوامة لمدة 15 ثانية.
- انقل 1.5 مل من المعلق إلى 2 مل من cryovials. ضع المبردات في صندوق مناسب وقم بتخزينها في الفريزر عند درجة حرارة -80 درجة مئوية.
2. تحضير ثقافة بين عشية وضحاها.
- دع المبردات ذات المخزون البكتيري تذوب في درجة حرارة الغرفة لمدة 30 دقيقة أو حتى يصبح المحتوى سائلا.
ملاحظة: يوصى بعدم تسريع عملية الذوبان. - تحضير أنبوب معقم مع 10 مل من TSB. انقل 50 ميكرولتر من تعليق المخزون إلى الأنبوب. احتضان الأنبوب طوال الليل (16-18 ساعة) عند 30 درجة مئوية ± 1 درجة مئوية مع اهتزاز مداري عند 150 دورة في الدقيقة.
3. تحضير اللقاح.
- تحضير أنبوب به 10 مل من TSB المعقم. انقل 500 ميكرولتر من المزرعة الليلية إلى الأنبوب. احتضنها لمدة 6-8 ساعات للوصول إلى OD600 = 0.6 0.05 (أو الوصول إلى منتصف المرحلة الأسية).
- انقل المزرعة إلى أنبوب طرد مركزي سعة 15 مل. جهاز الطرد المركزي للأنبوب عند 2,200 × جم لمدة 10 دقائق. صب المرق برفق.
- أضف 5 مل من PBS وأجهزة الطرد المركزي عند 2,200 × جم لمدة 10 دقائق. كرر هذه الخطوة 3x.
- اضبط OD600 للخلايا على 0.6 0.05 عن طريق معايرة محلول PBS باستخدام ماصة. سجل بدقة الكمية المضافة من PBS للاستخدام في المستقبل.
4. نقل وسيط النمو إلى قارئ الصفيحة الدقيقة
- اختر صفيحة بئر شفافة ومعقمة ومسطحة القاع بغطاء (أي صفيحة 96 بئرا ، صفيحة 6 آبار ، صفيحة 12 بئر).
- قم بقياس تصحيح طول المسار للصفيحة الدقيقة باستخدام DI water قبل تشغيل البروتوكول ، كما هو موضح في الخطوة 1.10.
- ارسم جدولا مرجعيا بناء على لوحة البئر المحددة لتحديد مواضع العينات قبل التحميل. على سبيل المثال ، ارسم طاولة 8 × 12 للوحة 96 بئرا.
ملاحظة: يتجنب الجدول المرجعي الالتباس أثناء خطوات الحضانة وجمع النتائج. - ضع العناصر التالية في خزانة السلامة الحيوية: صفيحة دقيقة بغطاء ، ماصة 1,000 ميكرولتر و 200 ميكرولتر ، 1,000 ميكرولتر و 200 ميكرولتر أطراف ماصة ، العديد من المبردات ، دورق 25 مل ، وسط النمو ، واللقاح.
ملاحظة: يجب نقل العناصر المذكورة إلى خزانة السلامة الحيوية بشكل معقم. - أضف 10 مل من وسط النمو إلى الدرق. انقل الكمية المحسوبة من اللقاح إلى الدورق باستخدام وسط النمو.
ملاحظة: نسب التلقيح في هذا البروتوكول هي 1٪ و 5٪. على سبيل المثال ، لتحقيق نسبة لقاح 5٪ و 1٪ ، أضف 500 ميكرولتر و 100 ميكرولتر من اللقاح إلى 9.5 مل و 9.9 مل من وسط النمو ، على التوالي. - بعد إضافة اللقاح ، رج الدورق برفق للحصول على توزيع موحد. قم بتوزيع 200 ميكرولتر من الوسط الملقح في الآبار المخصصة باستخدام الجدول المرجعي. اختر ثلاثة آبار على الأقل لتكون بمثابة عناصر تحكم عن طريق إضافة 200 ميكرولتر من وسط النمو (بدون لقاح).
ملاحظة: تأكد من أن آبار التحكم محددة بوضوح في الجدول المرجعي. إذا لوحظ أي نمو (تلوث) في هذه الآبار ، فيجب تكرار التجربة. - قم بتوزيع 200 ميكرولتر من ماء DI في آبار الحواف حيث يكون معدل التبخر أعلى. ضع الغطاء برفق قبل إزالة اللوحة المكونة من 96 بئرا من خزانة الأمان. ضع اللوحة المكونة من 96 بئرا في قارئ اللوحة بعناية ، مع ضمان عدم حدوث حركات مفاجئة.
5. إعدادات قارئ الصفيحة الدقيقة
- قم بتشغيل قارئ اللوحة الدقيقة ثم استخدم البرنامج المضمن لإنشاء البروتوكول المخصص. في إدارة المهام، افتح البروتوكول واختر إنشاء جديد | البروتوكول القياسي. افتح الإجراء واضبط الإعدادات على النحو التالي:
- اضبط درجة الحرارة على 30 درجة مئوية (أو القيم المستهدفة) باستخدام ضبط درجة الحرارة.
- انقر فوق حاضنة تشغيل ثم اضبط التدرج على 1 درجة مئوية.
ملاحظة: لتجنب البيانات غير الموثوقة بسبب التكثيف على الغطاء، تأكد من ضبط التدرج على 1 درجة مئوية. - اختر خيار التسخين المسبق ، مما يضمن توزيعا موحدا للحرارة على طول لوحة البئر.
- افتح Start Kinetic واختر مدة الحضانة المطلوبة باستخدام وقت التشغيل (على سبيل المثال ، 12:00:00 أو 24:00:00 ، إلخ) والفاصل الزمني بين القراءات ل 00:30:00 (يمثل 30 دقيقة) أو 01:00:00 (يمثل 1 ساعة).
ملاحظة: تستغرق قراءة كل طبق مكون من 96 بئرا حوالي 1 دقيقة. - اضبط إعدادات الاهتزاز على النحو التالي: افتح Shake ؛ اضبط وضع الاهتزاز على خطي ؛ انقر فوق الاهتزاز المستمر ؛ واضبط التردد على 567 نسخة في الدقيقة (أو أي قيمة مطلوبة).
- اضبط إعدادات قراءة OD على النحو التالي: انقر فوق قراءة | الامتصاص. حدد نقطة النهاية/الحركية وأحادية اللون؛ اضبط الطول الموجي على 600 نانومتر ؛ وانقر فوق التحقق من صحة | حفظ لحفظه كبروتوكول جديد بالاسم والتاريخ المناسبين.
6. تسجيل بيانات النمو
- افتح مدير المهام | اقرأ الآن.
- اختر البروتوكول المحفوظ ، ثم انقر فوق "موافق " لبدء البروتوكول.
- احفظ القراءات لتحليل البيانات.
7. تحليل البيانات
- نقل نتائج OD600 (بيانات النمو) إلى تنسيق جدول بيانات. في قسم النتائج ، انقر فوق خيار الصورة لكل بئر لمراقبة منحنيات النمو النهائية.
- افتح ملف جدول البيانات وأعد ترتيب البيانات المسجلة بناء على الجدول المرجعي. اطرح القيمة المتوسطة للقراءات الفارغة من القراءات الأخرى.
ملاحظة: الفراغات هي قراءات OD في الوقت صفر. في هذا البروتوكول ، يتم النظر في قيم OD600 للحساب. يمكن إستخدام كثافة الخلية إذا كان منحنى المعايرة ل OD600 مقابل عدد الخلايا متاحا.
8. تحديد معدل النمو
- استخدم البيانات المنقولة في جدول البيانات الذي تم إنشاؤه في الخطوة 1.6. استخدم الطريقة الموضحة أدناه والمعادلة (1) لتقييم معدل النمو.
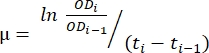 (1)
(1)
حيث μ هو معدل النمو، فإن ODi هو OD600 في كل نقطة زمنية، OD i-1 هي قيمة OD600 الأولية في النقطة الزمنية الأخيرة، ti و ti-1 هما الفروق الزمنية بين النقطتين المذكورتين (على سبيل المثال، 0.5 لفترات زمنية مدتها 30 دقيقة، 1 لفترات زمنية قدرها ساعة واحدة). - احسب المتوسط والانحراف المعياري لخمسة معدلات نمو متتالية باستخدام برنامج تحليل البيانات المطلوب. لاحظ أن أكبر متوسط مع أقل انحراف معياري هو الحد الأقصى لمعدل النمو (μم) 12.
9. تحديد التحيز المكاني
ملاحظة: تقدم قارئات الألواح الدقيقة والألواح تحيزا في النتائج. من الأهمية بمكان تقييم التحيزات المكانية للألواح المستخدمة في قارئ صفيحة دقيقة معين لضمان موثوقية النتائج وقابليتها للتكرار. لتحقيق ذلك ، استخدم الخطوات التالية:
- كرر الخطوات 1.2-1.6.
- سجل البيانات وقم بتحليلها وفقا للخطوة 1.7 والخطوة 1.8 لحساب معدل النمو لكل بئر.
- قم بإنشاء خريطة حرارية لتصور تغيرات معدل النمو في اللوحة المكونة من 96 بئرا.
- قم بإجراء التحليل الإحصائي (انظر الجداول التكميلية) ، مع التأكد من عدم وجود فروق ذات دلالة إحصائية بين الآبار.
ملاحظة: من الضروري استخدام نفس النوع من البكتيريا ونفس حجم اللقاح في جميع الآبار.
10. التحقق من صحة قراءة OD وعامل تصحيح طول المسار
ملاحظة: يعد تحديد عامل تصحيح طول المسار أمرا بالغ الأهمية للتحقق من صحة البيانات وضمان الموثوقية والصلاحية عبر الأجهزة المختلفة.
- استخدم الخطوتين 1.2 والخطوة 1.3 لتحضير اللقاح الليلي ل B. mycoides.
- قم بإعداد ثلاث قوارير معقمة سعة 50 مل وأضف 49.5 مل من TSB الطازج إلى كل قارورة. أضف 500 ميكرولتر من اللقاح إلى كل قارورة في خزانة الأمان بشكل معقم. أضف 50 مل من TSB غير الملقح إلى قارورة معقمة ، والتي ستكون بمثابة عنصر التحكم.
- احتضان القوارير عند 30 درجة مئوية و 150 دورة في الدقيقة. كل 30 دقيقة ، خذ عينات من كل قارورة بشكل معقم واقرأ وسجل OD600 في مقياس الطيف الضوئي.
- أضف 9.9 مل من TSB إلى دورق سعة 25 مل. أضف 100 ميكرولتر من اللقاح إلى الدورق ورجه برفق.
- أضف 200 ميكرولتر من الخليط في الدورق إلى الآبار الستة في عمود محدد في صفيحة سعة 96 بئرا. أضف 200 ميكرولتر من TSB غير الملقح إلى ثلاثة آبار كعنصر تحكم. املأ آبار الحواف ب 200 ميكرولتر من ماء DI.
- ضع الغطاء وانقل اللوحة المكونة من 96 بئرا برفق إلى قارئ الصفيحة الدقيقة. اتبع الخطوتين 1.5 والخطوة 1.6 لتسجيل بيانات النمو.
- ارسم OD600 من قارئ الصفيحة الدقيقة مقابل OD600 من مقياس الطيف الضوئي. لاحظ أن الميل هو الإزاحة بين مجموعتي القراءات ، والتي تسمى عامل تصحيح طول المسار.
ملاحظة: يجب أن تتم حضانة الحاضنة وقارئ الألواح الدقيقة في نفس اليوم في نفس اليوم.
النتائج
التحقق من صحة قراءة OD وعامل تصحيح طول المسار
تم أخذ عينات منقسمة من B. mycoides ثقافة في نقاط زمنية مختلفة وتم قياسها باستخدام قارئ الصفيحة الدقيقة ومقياس الطيف الضوئي (الشكل 1 أ). تم اتخاذ هذه الخطوة للتحقق من صحة النتائج عبر الأجهزة المختلفة. ب...
Discussion
تسمح قارئات الألواح الدقيقة بالحصول على معدلات نمو متسقة وقابلة للتكرار. تقلل هذه التقنية من الخطأ البشري وتتيح أخذ العينات عالية الإنتاجية. إن الكمية الصغيرة من الثقافة المطلوبة لكل عينة تجعل هذا النهج بديلا جذابا ومنخفض التكلفة لعدد الخلايا باستخدام القوارير أو أناب...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم تمويل هذا العمل من قبل مجلس أبحاث العلوم الطبيعية والهندسة (NSERC) / كرسي هاليفاكس للبحوث الصناعية للمياه في جودة المياه ومعالجتها (رقم المنحة. IRCPJ 349838-16). يود فريق المؤلفين أيضا أن يعرب عن تقديره لمساعدة أنيتا تايلور في مراجعة هذه المقالة.
Materials
| Name | Company | Catalog Number | Comments |
| Centrifuge | Eppendorf | 5810 R | |
| Centrifuge tubes - 15 mL | ThermoFisher- Scientific | 339650 | Sterile |
| Centriguge tubes - 50 mL | ThermoFisher- Scientific | 339652 | Sterile |
| Disposable inoculating loop , 10 µL | Cole-Parmer | UZ-06231-08 | Sterile |
| Erlenmeyer flasks - 250 mL | Cole-Parmer | UZ-34502-59 | Glass |
| Isopropanol | ThermoFisher- Scientific | 396982500 | ≥99.0 |
| Phosphate Buffer Saline | Sigma-Aldrich | P4417 | |
| Pipett tips 1,000 µL | ThermoFisher- Scientific | UZ-25001-76 | |
| Pipett tips 10 mL | ThermoFisher- Scientific | UZ-25001-83 | |
| Pipett tips 200 µL | ThermoFisher- Scientific | UZ-25001-85 | |
| Pipett tips 5 mL | ThermoFisher- Scientific | UZ-25001-80 | |
| Pipettor 1,000 µL | Cole-Parmer | UZ-07909-11 | |
| Pipettor 10 mL | Cole-Parmer | UZ-07909-15 | |
| Pipettor 200 µL | Cole-Parmer | UZ-07909-09 | |
| Pipettor 5 mL | Cole-Parmer | UZ-07859-30 | |
| Tryptic Soy Broth | Millipore | 22091 | Suitable for microbiology |
References
- Reuß, D. R., et al. Large-scale reduction of the Bacillus subtilis genome: Consequences for the transcriptional network, resource allocation, and metabolism. Genome Research. 27 (2), 289-299 (2017).
- Sparkes, A., et al. Towards Robot Scientists for autonomous scientific discovery. Automated Experimentation. 2 (1), (2010).
- Zwietering, M. H., Jongenburger, I., Rombouts, F. M., van t Riet, K. Modeling of the bacterial growth curve. Applied and Environmental Microbiology. 56 (6), 1875-1881 (1990).
- Pla, M., Oltra, S., Esteban, M., Andreu, S., Palop, A. Comparison of primary models to predict microbial growth by the plate count and absorbance methods. BioMed Research International. 2015 (6), 1-14 (2015).
- Choe, D., et al. Adaptive laboratory evolution of a genome-reduced Escherichia coli. Nature Communications. 10 (1), 935 (2019).
- Dykhuizen, D. E., Dean, A. M. Enzyme activity and fitness: Evolution in solution. Trends in Ecology and Evolution. 5 (8), 257-262 (1990).
- McDonald, M. J. Microbial experimental evolution - A proving ground for evolutionary theory and a tool for discovery. EMBO Reports. 20 (8), 1-14 (2019).
- Lum, P. Y., et al. Discovering modes of action for therapeutic compounds using a genome-wide screen of yeast heterozygotes. Cell. 116 (1), 121-137 (2004).
- Cagnon, C., et al. Development of a forward genetic screen to isolate oil mutants in the green microalga Chlamydomonas reinhardtii. Biotechnology for Biofuels. 6 (1), 178 (2013).
- Stevenson, K., McVey, A. F., Clark, I. B. N., Swain, P. S., Pilizota, T. General calibration of microbial growth in microplate readers. Scientific Reports. 6 (1), 38828 (2016).
- Matlock, B. C., Beringer, R. W., Ash, D. L., Page, A. F., Allen, M. W. Differences in Bacterial Optical Density Measurements between Spectrophotometers. Technical Note. ThermoScientific. , (2011).
- Hall, B. G., Acar, H., Nandipati, A., Barlow, M. Growth rates made easy. Molecular Biology and Evolution. 31 (1), 232-238 (2014).
- Rolfe, M. D., et al. Lag phase is a distinct growth phase that prepares bacteria for exponential growth and involves transient metal accumulation. Journal of Bacteriology. 194 (3), 686-701 (2012).
- Djordjevic, D., Wiedmann, M., Mclandsborough, L. A. Microtiter plate assay for assessment of Listeria monocytogenes biofilm formation. Applied and Environmental Microbiology. 68 (6), 2950-2958 (2002).
- O'Toole, G. A. Microtiter dish biofilm formation assay. Journal of Visualized Experiments. (47), e2437 (2011).
- Campbell, J. High-throughput assessment of bacterial growth inhibition by optical density measurements. Current Protocols in Chemical Biology. 3 (3), 1-20 (2012).
- Toussaint, M., Conconi, A. High-throughput and sensitive assay to measure yeast cell growth: A bench protocol for testing genotoxic agents. Nature Protocols. 1 (4), 1922-1928 (2006).
- Goughenour, K. D., Balada-Llasat, J. -. M., Rappleye, C. A. Quantitative microplate-based growth assay for determination of antifungal susceptibility of Histoplasma capsulatum yeasts. Journal of Clinical Microbiology. 53 (10), 3286-3295 (2015).
- Qiu, T. A., et al. Growth-based bacterial viability assay for interference-free and high-throughput toxicity screening of nanomaterials. Analytical Chemistry. 89 (3), 2057-2064 (2017).
- Kurokawa, M., Precise Ying, B. -. W. Precise, high-throughput analysis of bacterial growth. Journal of Visualized Experiments. (127), e56197 (2017).
- Bredit, F., Romick, T. L., Fleming, H. P. A rapid method for determination of bacterial growth kinetics. Journal of Rapid Methods and Automation in Microbiology. 3, 59-68 (1994).
- Delaney, N. F., et al. Development of an optimized medium, strain and high-throughput culturing methods for Methylobacterium extorquens. PLOS ONE. 8 (4), 62957 (2013).
- Haire, T. C., et al. Robust microplate-based methods for culturing and in vivo phenotypic screening of Chlamydomonas reinhardtii. Frontiers in Plant Science. 9, 235 (2018).
- McBirney, S. E., Trinh, K., Wong-Beringer, A., Armani, A. M. Wavelength-normalized spectroscopic analysis of Staphylococcus aureus and Pseudomonas aeruginosa growth rates. Biomedical Optics Express. 7 (10), 4034 (2016).
- Sieben, M., Giese, H., Grosch, J. H., Kauffmann, K., Büchs, J. Permeability of currently available microtiter plate sealing tapes fail to fulfil the requirements for aerobic microbial cultivation. Biotechnology Journal. 11 (12), 1525-1538 (2016).
- Zimmermann, H. F., John, G. T., Trauthwein, H., Dingerdissen, U., Huthmacher, K. Rapid evaluation of oxygen and water permeation through microplate sealing tapes. Biotechnology Progress. 19 (3), 1061-1063 (2003).
- Abkar, L., Gagnon, G. A. Biological responses to P-limitation in indigenous bacteria isolated from drinking water. AWWA Water Science. 3 (5), 1248 (2021).
- Sanders, E. R. Aseptic laboratory techniques: Plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Hart, S. F. M., Skelding, D., Waite, A. J., Burton, J. C., Shou, W. High-throughput quantification of microbial birth and death dynamics using fluorescence microscopy. Quantitative Biology. 7 (1), 69-81 (2019).
- Periago, P. M., Abee, T., Wouters, J. A. Analysis of the heat-adaptive response of psychrotrophic Bacillus weihenstephanensis. International Journal of Food Microbiology. 79 (1-2), 17-26 (2002).
- Mira, P., Barlow, M., Meza, J. C., Hall, B. G. Statistical package for growth rates made easy. Molecular Biology and Evolution. 34 (12), 3303-3309 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved