Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Повышенная воспроизводимость и точность высокопроизводительной количественной оценки данных о росте бактерий с помощью считывателя микропланшетов
В этой статье
Резюме
Здесь представлен протокол с высокой пропускной способностью для измерения данных о росте, включая кривые роста, темпы роста и максимальные темпы роста. Протокол был проверен и валидирован с использованием двух бактерий, продуцирующих биопленку. Результаты и подход, примененные в этом исследовании, могут быть распространены на другие протоколы с высокой пропускной способностью с использованием считывателей микропланшетов.
Аннотация
Это исследование было направлено на разработку воспроизводимого, надежного, высокопроизводительного протокола для мониторинга роста бактерий в 96-луночных планшетах и анализа максимальной скорости роста. Определены кривые роста и максимальные темпы роста двух видов бактерий. Были исследованы такие проблемы, как (i) конденсация крышки, (ii) коррекция длины пути, (iii) размер инокуляции, (iv) временной интервал отбора проб и (v) пространственное смещение. Повторяемость протокола оценивалась с помощью трех независимых технических повторений со стандартным отклонением 0,03 между прогонами. Максимальные темпы роста Bacillus mycoides и Paenibacillus tundrae составили (среднее значение ± SD) 0,99 ч−1 ± 0,03 ч−1 и 0,85 ч−1 ± 0,025 ч−1 соответственно. Эти бактерии сложнее контролировать оптически из-за их склонности к слипанию. Это исследование демонстрирует критическую важность размера инокуляции, коррекции длины пути, нагрева крышки, временных интервалов отбора проб и пространственного смещения скважинной пластины для получения надежных, точных и воспроизводимых данных на микропланшетах. Разработанный протокол и этапы его верификации могут быть расширены на другие методы с использованием микропланшетных ридеров и протоколов с высокой пропускной способностью, что снижает врожденные ошибки исследователей и материальные затраты.
Введение
Растущий интерес к мультиомиксным манипуляциям, включая исследования механизмов и метаболизма бактерий, подчеркивает важность высокопроизводительных и автоматизированных методов, таких как запись данных о росте 1,2. Данные о росте, включающие кинетические параметры, такие как максимальные темпы роста, могут помочь охарактеризовать реакцию бактерий на различные физические, химические и антибактериальные условия. Данные о темпах роста являются стандартной переменной отклика, используемой для выявления потенциальных связей генотип и фенотипы1 или указания на микробную безопасность и срок годности пищевых продуктов 3,4. Такие методы, как адаптивная лабораторная эволюция 5,6,7, полногеномный скрининг, определенные химические анализы8 и различные прямые генетические скрининги9, полагаются на темпы роста для оценки результатов.
Измерение оптической плотности (OD) бактериальных культур является стандартным микробиологическим методом мониторинга роста бактерий. Измерения наружного диаметра часто записываются на длине волны 600 нм, полагаясь на рассеяние света и плотность ячеек10,11. Закон Бира-Ламберта объясняет зависимость значений OD от концентрации (т. е. плотности ячеек, количества ячеек), длины пути и коэффициента поглощения. Геометрия и оптическая система спектрофотометра влияют на показания наружного диаметра11. Классические методы измерения наружного диаметра могут быть очень трудоемкими и трудоемкими, а данные могут содержать множество человеческих ошибок. В этом протоколе считыватель микропланшетов используется для уменьшения времени анализа12,13 и вероятности биологического загрязнения. Высокопроизводительный анализ с использованием считывателей микропланшетов широко применяется в различных областях микробиологии, таких как скрининг бактерий, продуцирующих биопленку14,15, ингибирование роста бактерий16, рост дрожжевых клеток17, определение чувствительности к противогрибковым препаратам18 и скрининг токсичности наноматериалов19.
Несколько исследователей опубликовали протоколы скорости роста бактерий с использованием считывателя микропланшетов 12,20,21. Тем не менее, тщательный протокол, который проверяет достоверность собранных данных, не был полностью установлен. Сообщается, что такие факторы, как тип видов 22,23,24 и уплотнительные ленты, влияют на повторяемость из-за недостаточности переноса кислорода в 96-луночной пластине 25,26. Delaney et al. сообщили о больших скоплениях Methylorubrum extorquens (штамм дикого типа) в питательной среде при использовании считывателя микропланшетов, что вызывало чрезвычайно зашумленные данные о росте24. Проблема была решена путем удаления генов, связанных с производством биопленки24. Благодаря секреции внеклеточных полимерных веществ, бактерии, продуцирующие биопленку, имеют большее сродство к слиянию и созданию клеточных кластеров. Поэтому отслеживать их рост с помощью методов светорассеяния (например, спектрофотометров и считывателей микропланшетов) сложнее.
Этот протокол направлен на установление шагов для получения воспроизводимых данных методом с высокой пропускной способностью с использованием считывателя микропланшетов. Bacillus mycoides и Paenibacillus tundrae были использованы из-за их быстрого роста и способности производить биопленку, что традиционно сложно при ручном и автоматизированном подходе. Для оценки надежности и воспроизводимости данных были исследованы такие факторы, как (i) коррекция длины пути, (ii) конденсация на крышке, (iii) размер инокулюма, (iv) временной интервал отбора проб и (v) пространственное смещение. В этом протоколе представлены шаги для точного мониторинга роста бактерий и измерения конкретных темпов роста с помощью считывателя микропланшетов.
протокол
ПРИМЕЧАНИЕ: Все шаги в этом протоколе должны выполняться в стерильных условиях (т.е. между двумя огнями или в шкафу биобезопасности). Все материалы и инструменты подвергаются автоклавированию в течение 20 минут. Подробные сведения обо всех материалах, оборудовании и программном обеспечении, используемых в этом протоколе, см. в Таблице материалов . Руки в перчатках дезинфицируют, хранят влажными дезинфицирующим средством для рук или 70% спиртовым раствором не менее 1 минуты, после чего не вынимают из защитного шкафа. В противном случае процедуру дезинфекции необходимо повторить перед тем, как вернуть руки обратно в защитный шкаф. ВНИМАНИЕ: Перед использованием открытого огня убедитесь, что дезинфицирующее средство полностью испарилось.
Примечание: Две бактерии были выделены из биофильтрации питьевой воды, как объяснялось ранее27, из-за их способности производить биопленку. Они были идентифицированы с помощью полного секвенирования рРНК 16S и представлены в NCBI как Bacillus mycoides (SAMN10518261) и Paenibacillus tundrae (SAMN10452279).
1. Приготовление бактериального материала в глицерине
- Взвесьте 3 г порошка соевого бульона Триптик (TSB) и растворите его в 100 мл дистиллированной воды. Отвар автоклавировать в течение 20 минут и дать ему остыть до комнатной температуры. Добавьте 50 мл TSB в колбу объемом 50 мл.
- Перенос бактерий на агаровые пластины27,28. С помощью петли выберите колонию бактерий из агаровой пластины. Добавьте содержимое петли в колбу, аккуратно поворачивая петлю. Инкубируйте колбу в течение ночи при температуре 30 °C ± 1 °C с встряхиванием орбиты при 150 об/мин.
ПРИМЕЧАНИЕ: Температуру и встряхивание необходимо регулировать в соответствии с типом деформации. - Приготовьте еще одну колбу объемом 50 мл с 47,5 мл TSB. Переложите в колбу 2,5 мл ночной культуры. Инкубируйте его в течение 5-6 часов, чтобы достичь OD600 = 0,6 0,05 (чтобы добраться до среднеэкспоненциальной фазы).
- Переложите культуру в стерилизованную центрифужную пробирку объемом 50 мл. Центрифугируйте культуру при 2 200 × г в течение 10 минут. Осторожно сцедите бульон, чтобы не потерять клетки, собранные на дне пробирки.
- Добавьте 5 мл фосфатно-солевого буфера (PBS) в ту же пробирку и центрифугируйте при температуре 2200 × г в течение 10 минут. Повторите этот шаг 3 раза.
- Отрегулируйте внешний диаметр600 элементов до 0,6 0,05 с помощью пипетки для титрования достаточного количества раствора PBS. Точно записывайте добавленное количество PBS для использования в будущем.
- Титруйте глицерин до суспензии до 20% v/v. Закупорьте трубку и вортекс на 15 с.
- Переложите 1,5 мл суспензии в 2 мл криовиалов. Поместите криовиалы в соответствующую коробку и храните их в морозильной камере при температуре −80 °C.
2. Подготовьте культуру на ночь.
- Дайте криовиалам с бактериальным бульоном оттаять при комнатной температуре в течение 30 минут или до тех пор, пока содержимое не станет жидким.
ПРИМЕЧАНИЕ: Рекомендуется не ускорять процесс размораживания. - Приготовьте стерилизованную пробирку с 10 мл TSB. Перенесите 50 μл стоковой суспензии в пробирку. Инкубировать пробирку в течение ночи (16-18 ч) при температуре 30 °C ± 1 °C с встряхиванием орбиты при 150 об/мин.
3. Подготовьте инокулятив.
- Приготовьте пробирку с 10 мл стерилизованного TSB. Перенесите 500 μл ночной культуры в пробирку. Инкубируйте его в течение 6-8 часов, чтобы достичь OD600 = 0,6 0,05 (или дойти до среднеэкспоненциальной фазы).
- Переложите культуру в центрифужную пробирку объемом 15 мл. Центрифугируйте пробирку при 2 200 × г в течение 10 минут. Осторожно сцедите бульон.
- Добавьте 5 мл PBS и центрифугируйте при 2 200 × г в течение 10 минут. Повторите этот шаг 3 раза.
- Отрегулируйте внешний диаметр600 элементов до 0,6 0,05, титруя раствор PBS с помощью пипетки. Точно записывайте добавленное количество PBS для использования в будущем.
4. Перенос питательной среды на считыватель микропланшетов
- Выберите прозрачный, стерильный луночный планшет с плоским дном и крышкой (т.е. 96-луночный планшет, 6-луночный планшет, 12-луночный планшет).
- Измерьте коррекцию длины пути для микропланшета с помощью воды DI перед запуском протокола, как описано в шаге 1.10.
- Составьте справочную таблицу на основе выбранной пластины скважины, чтобы указать положение образцов перед загрузкой. Например, нарисуйте таблицу 8 x 12 для 96-луночного планшета.
ПРИМЕЧАНИЕ: Справочная таблица позволяет избежать путаницы на этапах инкубации и сбора результатов. - Поместите в шкаф для биобезопасности следующие предметы: микропланшет с крышкой, пипетку объемом 1 000 л и 200 мкл, наконечники для пипеток объемом 1 000 мкл и 200 мкл, несколько криовиалов, стакан объемом 25 мл, питательную среду и инокулюм.
ПРИМЕЧАНИЕ: Указанные предметы должны быть перенесены в бокс биобезопасности в асептическом порядке. - Добавьте в стакан 10 мл питательной среды. Переложите рассчитанное количество инокулюма в стакан со средой для выращивания.
ПРИМЕЧАНИЕ: Соотношения инокулята в этом протоколе составляют 1% и 5%. Например, для достижения соотношения инокулюма 5% и 1% добавьте 500 мкл и 100 мкл инокулюма к 9,5 мл и 9,9 мл питательной среды соответственно. - После добавления инокулюма аккуратно встряхните стакан, чтобы получить равномерное распределение. Дозируйте 200 мкл модифицированной среды в предназначенные для этого лунки с использованием справочной таблицы. Выберите не менее трех лунок в качестве контрольных, добавив 200 мкл питательной среды (без инокулята).
ПРИМЕЧАНИЕ: Убедитесь, что контрольные скважины четко обозначены в справочной таблице. Если в этих колодцах наблюдается какой-либо рост (загрязнение), эксперимент следует повторить. - Слейте 200 мкл деионизионной воды в краевые лунки, где скорость испарения выше. Осторожно закройте крышку, прежде чем вынимать 96-луночный планшет из защитного шкафа. Осторожно поместите 96-луночный планшет в считыватель планшетов, не допуская резких движений.
5. Настройки считывателя микропланшетов
- Включите считыватель микропланшетов, а затем используйте встроенное программное обеспечение для создания настраиваемого протокола. В диспетчере задач откройте протокол и выберите «Создать новый | Стандартный протокол. Откройте «Процедура » и настройте параметры следующим образом:
- Установите температуру на 30 °C (или целевые значения) с помощью функции «Задать температуру».
- Нажмите « Инкубатор включен», а затем установите Градиент на 1 °C.
ПРИМЕЧАНИЕ: Чтобы избежать недостоверных данных из-за конденсации на крышке, убедитесь, что Градиент установлен на 1 °C. - Выберите опцию Предварительный нагрев , обеспечивающую равномерное распределение тепла по пластине лунки.
- Откройте Start Kinetic и выберите желаемую продолжительность инкубации с помощью параметров Время выполнения (например, 12:00:00 или 24:00:00 и т. д.) и Интервал между показаниями для 00:30:00 (30 минут) или 01:00:00 (1 час).
ПРИМЕЧАНИЕ: Чтение каждого 96-луночного планшета занимает примерно 1 минуту. - Установите настройки Тряски следующим образом: откройте Shake; установите режим встряхивания в положение Линейный; нажмите на «Непрерывное встряхивание»; и отрегулируйте Частоту на 567 cpm (или любое желаемое значение).
- Установите настройки чтения OD следующим образом: нажмите на Читать | Абсорбция; выберите конечные/кинетические и монохроматоры; установить длину волны на 600 нм; и нажмите «Подтвердить» | Сохраните , чтобы сохранить его как новый протокол с соответствующим именем и датой.
6. Запись данных о росте
- Открыть диспетчер задач | Читать сейчас.
- Выберите сохраненный протокол, затем нажмите « ОК», чтобы начать протокол.
- Сохраните показания для анализа данных.
7. Анализ данных
- Перенесите результаты OD600 (данные о росте) в формат электронной таблицы. В разделе результатов нажмите на опцию изображения для каждой скважины, чтобы увидеть окончательные кривые роста.
- Откройте файл электронной таблицы и переупорядочьте записанные данные на основе ссылочной таблицы. Вычтите среднее значение пустых прочтений из других прочтений.
ПРИМЕЧАНИЕ: Пробелы — это показания наружного диаметра в нулевой момент времени. В этом протоколе для расчета учитываются значения наружного диаметра600 . Плотность ячеек можно использовать, если доступна калибровочная кривая для зависимости наружного диаметра600 от количества ячеек.
8. Определение темпов роста
- Используйте переданные данные в таблице, созданной на шаге 1.6. Используйте описанный ниже метод и уравнение (1) для оценки темпов роста.
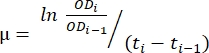 (1)
(1)
где μ – темп роста, ODi – OD 600 в каждой временной точке, ODi-1 – начальное значение OD600 в последней временной точке, ti и ti-1 – разница во времени между двумя упомянутыми точками (например, 0,5 для 30-минутных временных интервалов, 1 для 1-часовых временных интервалов). - Рассчитайте среднее значение и стандартное отклонение пяти последовательных темпов роста с помощью программного обеспечения для анализа данных. Обратите внимание, что наибольшее среднее значение с наименьшим стандартным отклонением — это максимальная скорость роста (μм) 12.
9. Определение пространственного смещения
ПРИМЕЧАНИЕ: Считыватели микропланшетов и планшеты вносят смещение в результаты. Крайне важно оценить пространственные смещения пластин, используемых в конкретном считывателе микропланшетов, чтобы обеспечить надежность и воспроизводимость результатов. Для этого выполните следующие действия:
- Повторите шаги 1.2-1.6.
- Запишите данные и проанализируйте их в соответствии с шагами 1.7 и 1.8 для расчета темпов роста для каждой скважины.
- Создайте тепловую карту для визуализации изменений скорости роста в 96-луночном планшете.
- Проведите статистический анализ (см. Дополнительные таблицы), убедившись в отсутствии существенных различий между скважинами.
ПРИМЕЧАНИЕ: Важно использовать один и тот же тип бактерий и одинаковый размер инокулята во всех лунках.
10. Валидация показаний OD и поправочный коэффициент длины пути
ПРИМЕЧАНИЕ: Определение поправочного коэффициента длины пути имеет решающее значение для проверки данных и обеспечения надежности и валидности на различных устройствах.
- Используйте шаги 1.2 и 1.3 для приготовления ночного инокулюма B. mycoides.
- Приготовьте три стерилизованных колбы объемом 50 мл и добавьте в каждую колбу по 49,5 мл свежего математического масла. Добавьте 500 μL инокулюма в каждую колбу в безопасном шкафу асептическим способом. Добавьте 50 мл неинокулированного TSB в стерилизованную колбу, которая будет служить контролем.
- Инкубируйте колбы при температуре 30 °C и 150 об/мин. Каждые 30 минут асептически отбирайте пробы из каждой колбы, считывайте и записывайте наружный диаметр600 в спектрофотометр.
- Добавьте 9,9 мл TSB в стакан объемом 25 мл. Добавьте в стакан 100 μл инокулюма и осторожно встряхните.
- Добавьте 200 мкл смеси из стакана в шесть лунок в выбранной колонке в 96-луночной пластине. Добавьте 200 мкл неинокулированного TSB в три лунки в качестве контроля. Заполните краевые лунки 200 μл деионизированной воды.
- Закройте крышку и аккуратно перенесите 96-луночный планшет к считывателю микропланшетов. Следуйте шагам 1.5 и 1.6 для записи данных о росте.
- Постройте график внешнего диаметра600 от считывателя микропланшетов против внешнего диаметра600 от спектрофотометра. Обратите внимание, что наклон – это смещение между двумя наборами показаний, называемое поправочным коэффициентом длины пути.
ПРИМЕЧАНИЕ: Инкубация инкубатора и считывателя микропланшетов должна проводиться одновременно в один и тот же день.
Результаты
Валидация показаний OD и поправочный коэффициент длины пути
Разделенные образцы культуры B. mycoides были взяты в разные моменты времени и измерены с помощью считывателя микропланшетов и спектрофотометра (рис. 1A). Этот шаг был предпринят для...
Обсуждение
Считыватели микропланшетов позволяют получать стабильные и повторяемые темпы роста. Эта технология сводит к минимуму человеческие ошибки и обеспечивает высокопроизводительный отбор проб. Небольшое количество культуры, необходимое для каждого образца, делает этот ...
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Эта работа была профинансирована Советом по естественным наукам и инженерным исследованиям (NSERC) / Кафедрой промышленных исследований в области водных ресурсов Галифакса в области качества и очистки воды (грант No. IRCPJ 349838-16). Коллектив авторов также выражает признательность Аните Тейлор за помощь в рецензировании этой статьи.
Материалы
| Name | Company | Catalog Number | Comments |
| Centrifuge | Eppendorf | 5810 R | |
| Centrifuge tubes - 15 mL | ThermoFisher- Scientific | 339650 | Sterile |
| Centriguge tubes - 50 mL | ThermoFisher- Scientific | 339652 | Sterile |
| Disposable inoculating loop , 10 µL | Cole-Parmer | UZ-06231-08 | Sterile |
| Erlenmeyer flasks - 250 mL | Cole-Parmer | UZ-34502-59 | Glass |
| Isopropanol | ThermoFisher- Scientific | 396982500 | ≥99.0 |
| Phosphate Buffer Saline | Sigma-Aldrich | P4417 | |
| Pipett tips 1,000 µL | ThermoFisher- Scientific | UZ-25001-76 | |
| Pipett tips 10 mL | ThermoFisher- Scientific | UZ-25001-83 | |
| Pipett tips 200 µL | ThermoFisher- Scientific | UZ-25001-85 | |
| Pipett tips 5 mL | ThermoFisher- Scientific | UZ-25001-80 | |
| Pipettor 1,000 µL | Cole-Parmer | UZ-07909-11 | |
| Pipettor 10 mL | Cole-Parmer | UZ-07909-15 | |
| Pipettor 200 µL | Cole-Parmer | UZ-07909-09 | |
| Pipettor 5 mL | Cole-Parmer | UZ-07859-30 | |
| Tryptic Soy Broth | Millipore | 22091 | Suitable for microbiology |
Ссылки
- Reuß, D. R., et al. Large-scale reduction of the Bacillus subtilis genome: Consequences for the transcriptional network, resource allocation, and metabolism. Genome Research. 27 (2), 289-299 (2017).
- Sparkes, A., et al. Towards Robot Scientists for autonomous scientific discovery. Automated Experimentation. 2 (1), (2010).
- Zwietering, M. H., Jongenburger, I., Rombouts, F. M., van t Riet, K. Modeling of the bacterial growth curve. Applied and Environmental Microbiology. 56 (6), 1875-1881 (1990).
- Pla, M., Oltra, S., Esteban, M., Andreu, S., Palop, A. Comparison of primary models to predict microbial growth by the plate count and absorbance methods. BioMed Research International. 2015 (6), 1-14 (2015).
- Choe, D., et al. Adaptive laboratory evolution of a genome-reduced Escherichia coli. Nature Communications. 10 (1), 935 (2019).
- Dykhuizen, D. E., Dean, A. M. Enzyme activity and fitness: Evolution in solution. Trends in Ecology and Evolution. 5 (8), 257-262 (1990).
- McDonald, M. J. Microbial experimental evolution - A proving ground for evolutionary theory and a tool for discovery. EMBO Reports. 20 (8), 1-14 (2019).
- Lum, P. Y., et al. Discovering modes of action for therapeutic compounds using a genome-wide screen of yeast heterozygotes. Cell. 116 (1), 121-137 (2004).
- Cagnon, C., et al. Development of a forward genetic screen to isolate oil mutants in the green microalga Chlamydomonas reinhardtii. Biotechnology for Biofuels. 6 (1), 178 (2013).
- Stevenson, K., McVey, A. F., Clark, I. B. N., Swain, P. S., Pilizota, T. General calibration of microbial growth in microplate readers. Scientific Reports. 6 (1), 38828 (2016).
- Matlock, B. C., Beringer, R. W., Ash, D. L., Page, A. F., Allen, M. W. Differences in Bacterial Optical Density Measurements between Spectrophotometers. Technical Note. ThermoScientific. , (2011).
- Hall, B. G., Acar, H., Nandipati, A., Barlow, M. Growth rates made easy. Molecular Biology and Evolution. 31 (1), 232-238 (2014).
- Rolfe, M. D., et al. Lag phase is a distinct growth phase that prepares bacteria for exponential growth and involves transient metal accumulation. Journal of Bacteriology. 194 (3), 686-701 (2012).
- Djordjevic, D., Wiedmann, M., Mclandsborough, L. A. Microtiter plate assay for assessment of Listeria monocytogenes biofilm formation. Applied and Environmental Microbiology. 68 (6), 2950-2958 (2002).
- O'Toole, G. A. Microtiter dish biofilm formation assay. Journal of Visualized Experiments. (47), e2437 (2011).
- Campbell, J. High-throughput assessment of bacterial growth inhibition by optical density measurements. Current Protocols in Chemical Biology. 3 (3), 1-20 (2012).
- Toussaint, M., Conconi, A. High-throughput and sensitive assay to measure yeast cell growth: A bench protocol for testing genotoxic agents. Nature Protocols. 1 (4), 1922-1928 (2006).
- Goughenour, K. D., Balada-Llasat, J. -. M., Rappleye, C. A. Quantitative microplate-based growth assay for determination of antifungal susceptibility of Histoplasma capsulatum yeasts. Journal of Clinical Microbiology. 53 (10), 3286-3295 (2015).
- Qiu, T. A., et al. Growth-based bacterial viability assay for interference-free and high-throughput toxicity screening of nanomaterials. Analytical Chemistry. 89 (3), 2057-2064 (2017).
- Kurokawa, M., Precise Ying, B. -. W. Precise, high-throughput analysis of bacterial growth. Journal of Visualized Experiments. (127), e56197 (2017).
- Bredit, F., Romick, T. L., Fleming, H. P. A rapid method for determination of bacterial growth kinetics. Journal of Rapid Methods and Automation in Microbiology. 3, 59-68 (1994).
- Delaney, N. F., et al. Development of an optimized medium, strain and high-throughput culturing methods for Methylobacterium extorquens. PLOS ONE. 8 (4), 62957 (2013).
- Haire, T. C., et al. Robust microplate-based methods for culturing and in vivo phenotypic screening of Chlamydomonas reinhardtii. Frontiers in Plant Science. 9, 235 (2018).
- McBirney, S. E., Trinh, K., Wong-Beringer, A., Armani, A. M. Wavelength-normalized spectroscopic analysis of Staphylococcus aureus and Pseudomonas aeruginosa growth rates. Biomedical Optics Express. 7 (10), 4034 (2016).
- Sieben, M., Giese, H., Grosch, J. H., Kauffmann, K., Büchs, J. Permeability of currently available microtiter plate sealing tapes fail to fulfil the requirements for aerobic microbial cultivation. Biotechnology Journal. 11 (12), 1525-1538 (2016).
- Zimmermann, H. F., John, G. T., Trauthwein, H., Dingerdissen, U., Huthmacher, K. Rapid evaluation of oxygen and water permeation through microplate sealing tapes. Biotechnology Progress. 19 (3), 1061-1063 (2003).
- Abkar, L., Gagnon, G. A. Biological responses to P-limitation in indigenous bacteria isolated from drinking water. AWWA Water Science. 3 (5), 1248 (2021).
- Sanders, E. R. Aseptic laboratory techniques: Plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Hart, S. F. M., Skelding, D., Waite, A. J., Burton, J. C., Shou, W. High-throughput quantification of microbial birth and death dynamics using fluorescence microscopy. Quantitative Biology. 7 (1), 69-81 (2019).
- Periago, P. M., Abee, T., Wouters, J. A. Analysis of the heat-adaptive response of psychrotrophic Bacillus weihenstephanensis. International Journal of Food Microbiology. 79 (1-2), 17-26 (2002).
- Mira, P., Barlow, M., Meza, J. C., Hall, B. G. Statistical package for growth rates made easy. Molecular Biology and Evolution. 34 (12), 3303-3309 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены