Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir mikroplaka okuyucu kullanarak bakteri üreme verilerinin yüksek verimli nicelleştirilmesinin gelişmiş tekrarlanabilirliği ve hassasiyeti
Bu Makalede
Özet
Burada, büyüme eğrileri, büyüme oranı ve maksimum büyüme oranı dahil olmak üzere büyüme verilerini ölçmek için yüksek verimli bir protokol sunulmaktadır. Protokol, iki biyofilm üreten bakteri kullanılarak doğrulandı ve onaylandı. Bu çalışmada uygulanan sonuçlar ve yaklaşım, mikroplaka okuyucular kullanılarak diğer yüksek verimli protokollere genişletilebilir.
Özet
Bu çalışma, 96 oyuklu plakalarda bakteri üremesini izlemek ve maksimum büyüme oranını analiz etmek için tekrarlanabilir, güvenilir, yüksek verimli bir protokol geliştirmeyi amaçladı. İki bakteri türünün büyüme eğrileri ve maksimum büyüme hızları belirlendi. (i) kapak yoğunlaşması, (ii) yol uzunluğu düzeltmesi, (iii) aşılama boyutu, (iv) örnekleme zaman aralığı ve (v) uzamsal yanlılık gibi konular araştırıldı. Protokolün tekrarlanabilirliği, çalıştırmalar arasında 0,03'lük bir standart sapma ile üç bağımsız teknik çoğaltma ile değerlendirildi. Bacillus mycoides ve Paenibacillus tundrae'nin maksimum büyüme oranları (ortalama ± SD) sırasıyla 0.99 h-1 ± 0.03 h-1 ve 0.85 h-1 ± 0.025 h-1 olarak belirlenmiştir. Bu bakterilerin bir araya toplanma afiniteleri nedeniyle optik olarak izlenmesi daha zordur. Bu çalışma, mikroplaka okuyucular hakkında güvenilir, doğru ve tekrarlanabilir veriler elde etmek için aşılama boyutunun, yol uzunluğu düzeltmesinin, kapak ısınmasının, örnekleme zaman aralıklarının ve kuyu plakası uzamsal yanlılığının kritik önemini göstermektedir. Geliştirilen protokol ve doğrulama adımları, mikroplaka okuyucular ve yüksek verimli protokoller kullanılarak diğer yöntemlere genişletilebilir ve bu da araştırmacıların doğuştan gelen hatalarını ve malzeme maliyetlerini azaltır.
Giriş
Bakterilerin mekanizması ve metabolik çalışmaları da dahil olmak üzere multi-omik manipülasyona ilginin artması, büyüme verilerinin kaydedilmesi gibi yüksek verimli ve otomatik yöntemlerin önemini vurgulamaktadır 1,2. Maksimum büyüme oranları gibi kinetik parametreleri içeren büyüme verileri, bakterilerin farklı fiziksel, kimyasal ve antibakteriyel koşullara verdiği tepkileri karakterize etmeye yardımcı olabilir. Büyüme hızı verileri, potansiyel genotip-fenotip bağlantılarını1 ortaya çıkarmak veya gıda ürünlerininmikrobiyal güvenliğini ve raf ömrünü belirtmek için kullanılan standart bir yanıt değişkenidir 3,4. Uyarlanabilir laboratuvar evrimi 5,6,7, genom çapında tarama, belirli kimyasal tahliller8 ve çeşitli ileri genetik taramalar9 gibi teknikler, sonuçları değerlendirmek için büyüme oranlarına güvenir.
Bakteri kültürlerinin optik yoğunluk (OD) ölçümleri, bakteri üremesini izlemek için standart bir mikrobiyolojik yöntemdir. OD ölçümleri genellikle ışık saçılımına ve hücre yoğunluğuna bağlı olarak 600 nm dalga boyunda kaydedilir10,11. Beer-Lambert yasası, OD değerlerinin konsantrasyona (yani hücre yoğunluğu, hücre sayısı), yol uzunluğuna ve emicilik katsayısına bağımlılığını açıklar. Bir spektrofotometrenin geometrisi ve optik sistemi, OD okumalarını11 etkiler. OD ölçümlerinin klasik yöntemleri çok zaman ve emek yoğun olabilir ve veriler çeşitli insan hataları taşıyabilir. Bu protokolde, analist süresini12,13 ve biyolojik kontaminasyon olasılığını azaltmak için bir mikroplaka okuyucu kullanılır. Mikroplaka okuyucular kullanılarak yapılan yüksek verimli analiz, biyofilm üreten bakterilerintaranması 14,15, bakteri büyümesinin engellenmesi16, maya hücresi büyümesi17, antifungal duyarlılığın belirlenmesi 18 ve nanomalzemelerin toksisite taraması19 gibi farklı mikrobiyoloji alanlarında yaygın olarak uygulanmaktadır.
Birkaç araştırmacı, bir mikroplaka okuyucu 12,20,21 kullanarak bakteri üreme hızı protokolleri yayınlamıştır. Bununla birlikte, toplanan verilerin güvenilirliğini inceleyen kapsamlı bir protokol tam olarak oluşturulmamıştır. Türün türü 22,23,24 ve sızdırmazlık bantları gibi faktörlerin, 96 oyuklu bir plakada25,26 oksijen transfer yetersizliğine bağlı tekrarlanabilirliği etkilediği bildirilmektedir. Delaney ve ark. bir mikroplaka okuyucu kullanıldığında büyüme ortamında büyük Methylorubrum extorquens kümeleri (vahşi tip suş) bildirdi ve bu da aşırı gürültülü büyüme verilerine neden oldu24. Sorun, biyofilm üretimi ile ilişkili genlerin çıkarılmasıyla çözüldü24. Hücre dışı polimerik maddelerin salgılanması nedeniyle, biyofilm üreten bakteriler bir araya gelmek ve hücre kümeleri oluşturmak için daha büyük bir afiniteye sahiptir. Bu nedenle, ışık saçılma teknikleri (örneğin, spektrofotometreler ve mikroplaka okuyucular) kullanarak büyümelerini izlemek daha zordur.
Bu protokol, bir mikroplaka okuyucu kullanarak yüksek verimli bir yöntemle tekrarlanabilir veri elde etmek için adımlar oluşturmayı amaçlamaktadır. Bacillus mycoides ve Paenibacillus tundrae , geleneksel olarak manuel ve otomatik yaklaşımlarda zorlayıcı olan hızlı büyüme ve biyofilm üretme yetenekleri nedeniyle kullanılmıştır. Verilerin güvenilirliğini ve tekrarlanabilirliğini değerlendirmek için (i) yol uzunluğu düzeltmesi, (ii) kapakta yoğunlaşma, (iii) aşı boyutu, (iv) örnekleme zaman aralığı ve (v) uzamsal yanlılık gibi faktörler araştırılmıştır. Bu protokol, bakteri üremesini doğru bir şekilde izlemek ve bir mikroplaka okuyucu kullanarak belirli büyüme oranlarını ölçmek için adımlar sunar.
Protokol
NOT: Bu protokoldeki tüm adımlar steril koşullarda (yani iki alev veya bir biyogüvenlik kabini arasında) izlenmelidir. Tüm malzemeler ve aletler 20 dakika boyunca otoklavlanır. Bu protokolde kullanılan tüm malzemeler, ekipmanlar ve yazılımlar hakkında ayrıntılı bilgi için Malzeme Tablosu'na bakın. Eldivenli eller dezenfekte edilir, el dezenfektanı veya %70 alkol solüsyonu ile en az 1 dakika ıslak tutulur ve daha sonra güvenlik kabininden çıkarılmaz. Aksi takdirde, eller güvenlik kabinine tekrar sokulmadan önce dezenfeksiyon prosedürü tekrarlanmalıdır. DİKKAT: Açık alev kullanmadan önce dezenfektanın tamamen buharlaştığından emin olun.
NOT: Biyofilm üretme yetenekleri nedeniyledaha önce 27 açıklandığı gibi içme suyu biyofiltrasyonundan iki bakteri izole edilmiştir. Tam 16S rRNA dizilimi ile tanımlandılar ve NCBI'ye Bacillus mycoides (SAMN10518261) ve Paenibacillus tundrae (SAMN10452279) olarak gönderildiler.
1. Gliserolde bakteri stoğunun hazırlanması
- 3 g Triptik soya suyu (TSB) tozunu tartın ve 100 mL damıtılmış suda çözün. Et suyunu 20 dakika otoklavlayın ve oda sıcaklığına soğumaya bırakın. 50 mL'lik bir şişeye 50 mL TSB ekleyin.
- Bakterileri agar plakalarına27,28 aktarın. Bir halka kullanarak, agar plakasından bir bakteri kolonisi seçin. Döngüyü hafifçe döndürerek ilmeğin içeriğini şişeye ekleyin. Şişeyi gece boyunca 30 °C ± 1 °C'de 150 rpm'de orbital sallama ile inkübe edin.
NOT: Sıcaklık ve sarsıntı, gerinim tipine göre ayarlanmalıdır. - 47,5 mL TSB içeren 50 mL'lik başka bir şişe hazırlayın. Gece boyunca kültürün 2,5 mL'sini şişeye aktarın. OD600 = 0.6 0.05'e ulaşmak için 5-6 saat inkübe edin (orta üstel faza geçmek için).
- Kültürü 50 mL'lik sterilize edilmiş bir santrifüj tüpüne aktarın. Kültürü 10 dakika boyunca 2.200 × g'da santrifüjleyin. Tüpün dibinde toplanan hücreleri kaybetmemek için suyu nazikçe boşaltın.
- Aynı tüpe 5 mL fosfat tamponlu salin (PBS) ekleyin ve 2.200 × g'da 10 dakika santrifüjleyin. Bu adımı 3 kez tekrarlayın.
- Yeterli miktarda PBS çözeltisini titre etmek için bir pipet kullanarak hücrelerin OD600'ünü 0.6 0.05'e ayarlayın. Eklenen PBS miktarını ileride kullanmak üzere doğru bir şekilde kaydedin.
- %20 v/v'ye ulaşmak için gliserolü süspansiyona titre edin. Tüpü kapatın ve 15 saniye boyunca girdap yapın.
- Süspansiyonun 1.5 mL'sini 2 mL kriyoviallere aktarın. Kriyovialleri uygun bir kutuya koyun ve -80 °C'de bir dondurucuda saklayın.
2. Gece kültürünü hazırlayın.
- Bakteri stoğu içeren kriyoviyallerin oda sıcaklığında 30 dakika veya içerik sıvı olana kadar çözülmesine izin verin.
NOT: Çözdürme işleminin hızlandırılmaması tavsiye edilir. - 10 mL TSB içeren sterilize bir tüp hazırlayın. Stok süspansiyonunun 50 μL'sini tüpe aktarın. Tüpü gece boyunca (16-18 saat) 30 °C ± 1 °C'de 150 rpm'de orbital sallama ile inkübe edin.
3. İnokulumu hazırlayın.
- 10 mL sterilize TSB içeren bir tüp hazırlayın. Gece boyunca 500 μL kültürü tüpe aktarın. OD600 = 0.6 0.05'e ulaşmak (veya orta üstel faza geçmek) için 6-8 saat inkübe edin.
- Kültürü 15 mL'lik bir santrifüj tüpüne aktarın. Tüpü 10 dakika boyunca 2.200 × g'da santrifüjleyin. Et suyunu yavaşça boşaltın.
- 5 mL PBS ekleyin ve 2.200 × g'da 10 dakika santrifüjleyin. Bu adımı 3 kez tekrarlayın.
- Bir pipet kullanarak PBS çözeltisini titre ederek hücrelerin OD600'ünü 0.6 0.05'e ayarlayın. Eklenen PBS miktarını ileride kullanmak üzere doğru bir şekilde kaydedin.
4. Büyüme ortamının mikroplaka okuyucuya aktarılması
- Kapaklı şeffaf, steril, düz tabanlı bir kuyu plakası seçin (yani, 96 oyuklu plaka, 6 oyuklu plaka, 12 oyuklu plaka).
- Protokolü çalıştırmadan önce, adım 1.10'da açıklandığı gibi, DI suyu kullanarak mikroplaka için yol uzunluğu düzeltmesini ölçün.
- Yüklemeden önce numunelerin konumlarını belirtmek için seçilen kuyu plakasına göre bir referans tablosu çizin. Örneğin, 96 oyuklu bir plaka için 8 x 12 boyutunda bir tablo çizin.
NOT: Referans tablosu, inkübasyon ve sonuç toplama adımları sırasında karışıklığı önler. - Aşağıdaki öğeleri bir biyogüvenlik kabinine yerleştirin: kapaklı bir mikroplaka, pipetleyici 1.000 μL ve 200 μL, 1.000 μL ve 200 μL pipet uçları, birkaç kriyoviyal, 25 mL'lik bir beher, büyüme ortamı ve aşılama.
NOT: Belirtilen öğeler aseptik olarak biyogüvenlik kabinine aktarılmalıdır. - Behere 10 mL büyüme ortamı ekleyin. Hesaplanan inokülum miktarını büyüme ortamı ile behere aktarın.
NOT: Bu protokoldeki aşı oranları %1 ve %5'tir. Örneğin, %5 ve %1'lik bir aşılama oranı elde etmek için, sırasıyla 9,5 mL ve 9,9 mL büyüme ortamına 500 μL ve 100 μL aşı ekleyin. - Aşıyı ekledikten sonra, düzgün bir dağılım elde etmek için kabı hafifçe sallayın. Referans tablosunu kullanarak 200 μL aşılanmış ortamı belirlenen kuyucuklara dağıtın. 200 μL büyüme ortamı ekleyerek (aşı olmadan) kontrol görevi görmesi için en az üç kuyu seçin.
NOT: Kontrol kuyularının referans tablosunda açıkça işaretlendiğinden emin olun. Bu kuyucuklarda herhangi bir büyüme (kirlenme) gözlenirse deney tekrarlanmalıdır. - Buharlaşma hızının daha yüksek olduğu kenar kuyularına 200 μL DI su dağıtın. 96 oyuklu plakayı güvenlik kabininden çıkarmadan önce kapağı yavaşça yerleştirin. 96 oyuklu plakayı, ani hareketler olmamasını sağlayacak şekilde plaka okuyucuya dikkatlice yerleştirin.
5. Mikroplaka Okuyucu Ayarları
- Mikroplaka okuyucuyu açın ve ardından özelleştirilmiş protokolü oluşturmak için gömülü yazılımı kullanın. Görev Yöneticisi'nde protokolü açın ve Yeni Oluştur | Standart Protokol. Prosedürü açın ve ayarları aşağıdaki gibi yapın:
- Sıcaklığı Ayarla'yı kullanarak sıcaklığı 30 °C'ye (veya hedeflenen değerlere) ayarlayın.
- İnkübatör Açık'a tıklayın ve ardından Gradyanı 1 °C'ye ayarlayın.
NOT: Kapaktaki yoğuşma nedeniyle güvenilmez verileri önlemek için Gradyan'ın 1 °C'ye ayarlandığından emin olun. - Kuyu plakası boyunca eşit ısı dağılımı sağlayan Ön Isıtma seçeneğini seçin.
- Start Kinetic'i açın ve Çalışma süresini (örn. 12:00:00 veya 24:00:00 vb.) ve 00:30:00 (30 dakikayı temsil eder) veya 01:00:00 (1 saati temsil eder) okumaları arasındaki aralığı kullanarak istediğiniz inkübasyon süresini seçin.
NOT: Her 96 oyuklu plakanın okunması yaklaşık 1 dakika sürer. - Sallama ayarlarını aşağıdaki gibi ayarlayın: Salla'yı açın; Sarsıntı Modunu Doğrusal olarak ayarlayın; Sürekli Sarsıntı'ya tıklayın; ve Frekansı 567 cpm'ye (veya istenen herhangi bir değere) ayarlayın.
- OD okuma ayarlarını aşağıdaki gibi ayarlayın: Oku'ya tıklayın | Emicilik; Uç Nokta/Kinetik ve Monokromatörleri seçin; Dalga Boyunu 600 nm'ye ayarlayın; ve Doğrula | Uygun ad ve tarihle yeni bir protokol olarak kaydetmek için kaydedin.
6. Büyüme Verilerinin Kaydedilmesi
- Görev Yöneticisi'ni Aç | Şimdi Oku.
- Kaydedilen protokolü seçin, ardından protokolü başlatmak için Tamam'a tıklayın.
- Veri analizi için okumaları kaydedin.
7. Veri Analizi
- OD600 sonuçlarını (büyüme verileri) elektronik tablo formatına aktarın. Sonuçlar bölümünde, son büyüme eğrilerini gözlemlemek için her kuyu için resim seçeneğine tıklayın.
- Elektronik tablo dosyasını açın ve kaydedilen verileri referans tablosuna göre yeniden düzenleyin. Boş okumaların ortalama değerini diğer okumalardan çıkarın.
NOT: Boşluklar, sıfır zamanındaki OD okumalarıdır. Bu protokolde hesaplama için OD600 değerleri dikkate alınır. OD600 ve hücre sayısı için kalibrasyon eğrisi mevcutsa hücre yoğunluğu kullanılabilir.
8. Büyüme Oranı Belirleme
- Adım 1.6'da oluşturulan elektronik tabloda aktarılan verileri kullanın. Büyüme oranını değerlendirmek için aşağıda açıklanan yöntemi ve denklemi (1) kullanın.
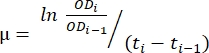 (1)
(1)
μ büyüme oranı olduğunda, ODi her zaman noktasındaki OD600'dür, ODi-1 son zaman noktasındaki ilk OD600 değeridir, ti ve ti-1, belirtilen iki nokta arasındaki zaman farklarıdır (örneğin, 30 dakikalık zaman aralıkları için 0,5, 1 saatlik zaman aralıkları için 1). - İstenen veri analizi yazılımını kullanarak art arda beş büyüme oranının ortalama ve standart sapmasını hesaplayın. En düşük standart sapmaya sahip en büyük ortalamanın maksimum büyüme hızı (μm) 12 olduğunu unutmayın.
9. Mekansal Önyargının Belirlenmesi
NOT: Mikroplaka okuyucular ve plakalar sonuçlarda yanlılığa neden olur. Sonuçların güvenilirliğini ve tekrarlanabilirliğini sağlamak için belirli bir mikroplaka okuyucuda kullanılan plakaların uzamsal yanlılıklarını değerlendirmek çok önemlidir. Bunu başarmak için aşağıdaki adımları kullanın:
- 1.2-1.6 adımlarını tekrarlayın.
- Verileri kaydedin ve her kuyu için büyüme oranını hesaplamak için adım 1.7 ve adım 1.8'e göre analiz edin.
- 96 oyuklu plakadaki büyüme hızı değişikliklerini görselleştirmek için bir ısı haritası oluşturun.
- Kuyular arasında önemli farklılıklar olmadığından emin olarak istatistiksel analizi gerçekleştirin ( Ek Tablolara bakın).
NOT: Tüm kuyucuklarda aynı tip bakteri ve aynı aşı boyutunun kullanılması esastır.
10. OD okuma doğrulaması ve yol uzunluğu düzeltme faktörü
NOT: Yol uzunluğu düzeltme faktörünün belirlenmesi, verileri doğrulamak ve farklı cihazlar arasında güvenilirlik ve geçerliliği sağlamak için çok önemlidir.
- B. mycoides'in gece boyunca aşılanmasını hazırlamak için adım 1.2 ve adım 1.3'ü kullanın.
- Üç adet sterilize edilmiş 50 mL şişe hazırlayın ve her şişeye 49,5 mL taze TSB ekleyin. Aseptik olarak bir güvenlik kabinindeki her şişeye 500 μL aşı ekleyin. Kontrol görevi görecek sterilize edilmiş bir şişeye 50 mL aşılanmamış TSB ekleyin.
- Şişeleri 30 °C ve 150 rpm'de inkübe edin. Her 30 dakikada bir, her şişeden aseptik olarak numune alın ve spektrofotometrede OD600'ü okuyun ve kaydedin.
- 25 mL'lik bir behere 9.9 mL TSB ekleyin. Behere 100 μL aşı ekleyin ve hafifçe çalkalayın.
- Beherdeki karışımın 200 μL'sini, 96 oyuklu bir plakadaki seçilmiş bir sütundaki altı oyuklara ekleyin. Kontrol olarak üç kuyucuğa 200 μL aşılanmamış TSB ekleyin. Kenar kuyularını 200 μL DI su ile doldurun.
- Kapağı yerleştirin ve 96 oyuklu plakayı yavaşça mikroplaka okuyucuya aktarın. Büyüme verilerini kaydetmek için adım 1.5 ve adım 1.6'yı izleyin.
- Mikroplaka okuyucudan gelen OD600'ü spektrofotometreden gelen OD600 ile karşılaştırın. Eğimin, yol uzunluğu düzeltme faktörü olarak adlandırılan iki okuma kümesi arasındaki uzaklık olduğuna dikkat edin.
NOT: İnkübatör ve mikroplaka okuyucu inkübasyonu aynı gün aynı anda yapılmalıdır.
Sonuçlar
OD okuma doğrulaması ve yol uzunluğu düzeltme faktörü
B. mycoides kültürünün bölünmüş örnekleri farklı zaman noktalarında alındı ve mikroplaka okuyucu ve spektrofotometre kullanılarak ölçüldü (Şekil 1A). Bu adım, sonuçları farklı cihazlarda doğrulamak için atıldı. OD600 verileri korelasyon gösterdi ancak eşleşmedi (Şekil 1B). Korelasyon, 0.55'lik bir e?...
Tartışmalar
Mikroplaka okuyucular, tutarlı ve tekrarlanabilir büyüme oranları elde edilmesini sağlar. Bu teknoloji, insan hatasını en aza indirir ve yüksek verimli örneklemeye olanak tanır. Numune başına gereken az miktarda kültür, bu yaklaşımı şişeler veya test tüpleri kullanan hücre sayımlarına çekici, düşük maliyetli bir alternatif haline getirir. Mikroplaka okuyucular, büyük bir örneklem boyutuna izin verir, istatistiksel gücü artırır ve ardından maliyetleri ve...
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Doğa Bilimleri ve Mühendislik Araştırma Konseyi (NSERC) / Halifax Su Kalitesi ve Arıtımı Sanayi Araştırma Kürsüsü (Hibe No. IRCPJ 349838-16). Yazarlar ekibi ayrıca bu makaleyi gözden geçirirken Anita Taylor'ın yardımına teşekkür etmek ister.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Centrifuge | Eppendorf | 5810 R | |
| Centrifuge tubes - 15 mL | ThermoFisher- Scientific | 339650 | Sterile |
| Centriguge tubes - 50 mL | ThermoFisher- Scientific | 339652 | Sterile |
| Disposable inoculating loop , 10 µL | Cole-Parmer | UZ-06231-08 | Sterile |
| Erlenmeyer flasks - 250 mL | Cole-Parmer | UZ-34502-59 | Glass |
| Isopropanol | ThermoFisher- Scientific | 396982500 | ≥99.0 |
| Phosphate Buffer Saline | Sigma-Aldrich | P4417 | |
| Pipett tips 1,000 µL | ThermoFisher- Scientific | UZ-25001-76 | |
| Pipett tips 10 mL | ThermoFisher- Scientific | UZ-25001-83 | |
| Pipett tips 200 µL | ThermoFisher- Scientific | UZ-25001-85 | |
| Pipett tips 5 mL | ThermoFisher- Scientific | UZ-25001-80 | |
| Pipettor 1,000 µL | Cole-Parmer | UZ-07909-11 | |
| Pipettor 10 mL | Cole-Parmer | UZ-07909-15 | |
| Pipettor 200 µL | Cole-Parmer | UZ-07909-09 | |
| Pipettor 5 mL | Cole-Parmer | UZ-07859-30 | |
| Tryptic Soy Broth | Millipore | 22091 | Suitable for microbiology |
Referanslar
- Reuß, D. R., et al. Large-scale reduction of the Bacillus subtilis genome: Consequences for the transcriptional network, resource allocation, and metabolism. Genome Research. 27 (2), 289-299 (2017).
- Sparkes, A., et al. Towards Robot Scientists for autonomous scientific discovery. Automated Experimentation. 2 (1), (2010).
- Zwietering, M. H., Jongenburger, I., Rombouts, F. M., van t Riet, K. Modeling of the bacterial growth curve. Applied and Environmental Microbiology. 56 (6), 1875-1881 (1990).
- Pla, M., Oltra, S., Esteban, M., Andreu, S., Palop, A. Comparison of primary models to predict microbial growth by the plate count and absorbance methods. BioMed Research International. 2015 (6), 1-14 (2015).
- Choe, D., et al. Adaptive laboratory evolution of a genome-reduced Escherichia coli. Nature Communications. 10 (1), 935 (2019).
- Dykhuizen, D. E., Dean, A. M. Enzyme activity and fitness: Evolution in solution. Trends in Ecology and Evolution. 5 (8), 257-262 (1990).
- McDonald, M. J. Microbial experimental evolution - A proving ground for evolutionary theory and a tool for discovery. EMBO Reports. 20 (8), 1-14 (2019).
- Lum, P. Y., et al. Discovering modes of action for therapeutic compounds using a genome-wide screen of yeast heterozygotes. Cell. 116 (1), 121-137 (2004).
- Cagnon, C., et al. Development of a forward genetic screen to isolate oil mutants in the green microalga Chlamydomonas reinhardtii. Biotechnology for Biofuels. 6 (1), 178 (2013).
- Stevenson, K., McVey, A. F., Clark, I. B. N., Swain, P. S., Pilizota, T. General calibration of microbial growth in microplate readers. Scientific Reports. 6 (1), 38828 (2016).
- Matlock, B. C., Beringer, R. W., Ash, D. L., Page, A. F., Allen, M. W. Differences in Bacterial Optical Density Measurements between Spectrophotometers. Technical Note. ThermoScientific. , (2011).
- Hall, B. G., Acar, H., Nandipati, A., Barlow, M. Growth rates made easy. Molecular Biology and Evolution. 31 (1), 232-238 (2014).
- Rolfe, M. D., et al. Lag phase is a distinct growth phase that prepares bacteria for exponential growth and involves transient metal accumulation. Journal of Bacteriology. 194 (3), 686-701 (2012).
- Djordjevic, D., Wiedmann, M., Mclandsborough, L. A. Microtiter plate assay for assessment of Listeria monocytogenes biofilm formation. Applied and Environmental Microbiology. 68 (6), 2950-2958 (2002).
- O'Toole, G. A. Microtiter dish biofilm formation assay. Journal of Visualized Experiments. (47), e2437 (2011).
- Campbell, J. High-throughput assessment of bacterial growth inhibition by optical density measurements. Current Protocols in Chemical Biology. 3 (3), 1-20 (2012).
- Toussaint, M., Conconi, A. High-throughput and sensitive assay to measure yeast cell growth: A bench protocol for testing genotoxic agents. Nature Protocols. 1 (4), 1922-1928 (2006).
- Goughenour, K. D., Balada-Llasat, J. -. M., Rappleye, C. A. Quantitative microplate-based growth assay for determination of antifungal susceptibility of Histoplasma capsulatum yeasts. Journal of Clinical Microbiology. 53 (10), 3286-3295 (2015).
- Qiu, T. A., et al. Growth-based bacterial viability assay for interference-free and high-throughput toxicity screening of nanomaterials. Analytical Chemistry. 89 (3), 2057-2064 (2017).
- Kurokawa, M., Precise Ying, B. -. W. Precise, high-throughput analysis of bacterial growth. Journal of Visualized Experiments. (127), e56197 (2017).
- Bredit, F., Romick, T. L., Fleming, H. P. A rapid method for determination of bacterial growth kinetics. Journal of Rapid Methods and Automation in Microbiology. 3, 59-68 (1994).
- Delaney, N. F., et al. Development of an optimized medium, strain and high-throughput culturing methods for Methylobacterium extorquens. PLOS ONE. 8 (4), 62957 (2013).
- Haire, T. C., et al. Robust microplate-based methods for culturing and in vivo phenotypic screening of Chlamydomonas reinhardtii. Frontiers in Plant Science. 9, 235 (2018).
- McBirney, S. E., Trinh, K., Wong-Beringer, A., Armani, A. M. Wavelength-normalized spectroscopic analysis of Staphylococcus aureus and Pseudomonas aeruginosa growth rates. Biomedical Optics Express. 7 (10), 4034 (2016).
- Sieben, M., Giese, H., Grosch, J. H., Kauffmann, K., Büchs, J. Permeability of currently available microtiter plate sealing tapes fail to fulfil the requirements for aerobic microbial cultivation. Biotechnology Journal. 11 (12), 1525-1538 (2016).
- Zimmermann, H. F., John, G. T., Trauthwein, H., Dingerdissen, U., Huthmacher, K. Rapid evaluation of oxygen and water permeation through microplate sealing tapes. Biotechnology Progress. 19 (3), 1061-1063 (2003).
- Abkar, L., Gagnon, G. A. Biological responses to P-limitation in indigenous bacteria isolated from drinking water. AWWA Water Science. 3 (5), 1248 (2021).
- Sanders, E. R. Aseptic laboratory techniques: Plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Hart, S. F. M., Skelding, D., Waite, A. J., Burton, J. C., Shou, W. High-throughput quantification of microbial birth and death dynamics using fluorescence microscopy. Quantitative Biology. 7 (1), 69-81 (2019).
- Periago, P. M., Abee, T., Wouters, J. A. Analysis of the heat-adaptive response of psychrotrophic Bacillus weihenstephanensis. International Journal of Food Microbiology. 79 (1-2), 17-26 (2002).
- Mira, P., Barlow, M., Meza, J. C., Hall, B. G. Statistical package for growth rates made easy. Molecular Biology and Evolution. 34 (12), 3303-3309 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır