A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ملاحظة السلوك الضوئي في الكلاميدوموناس reinhardtii
* These authors contributed equally
In This Article
Summary
تظهر معظم الكائنات الحية ذاتية التغذية الضوئية السباحة تغيرات سلوكية مستحثة بالصور (السلوك الضوئي). يلاحظ البروتوكول الحالي السلوك الضوئي المذكور في الكائن الحي النموذجي Chlamydomonas reinhardtii.
Abstract
من أجل بقاء الكائنات الحية الدقيقة الضوئية المتحركة ، فإن التواجد في ظروف الإضاءة المناسبة أمر بالغ الأهمية. وبالتالي ، فإنها تظهر السلوكيات التي تسببها الصور (أو السلوك الضوئي) وتغير اتجاه حركتها استجابة للضوء. تشمل السلوكيات الضوئية النموذجية استجابة الصدمة الضوئية (أو رهاب الضوء) والتاكسي الضوئي. الصدمة الضوئية هي استجابة للتغير المفاجئ في شدة الضوء (على سبيل المثال ، إضاءة الفلاش) ، حيث تتوقف الكائنات الحية بشكل عابر عن الحركة أو تتحرك إلى الوراء. أثناء التاكسي الضوئي ، تتحرك الكائنات الحية نحو مصدر الضوء أو في الاتجاه المعاكس (تسمى phototaxis الإيجابية أو السلبية ، على التوالي). الطحالب الخضراء أحادية الخلية Chlamydomonas reinhardtii هي كائن حي ممتاز لدراسة السلوك الضوئي لأنها تغير بسرعة نمط السباحة الخاص بها عن طريق تعديل ضرب الأهداب (المعروفة أيضا باسم السوط) بعد الاستقبال الضوئي. هنا ، يتم عرض طرق بسيطة مختلفة لمراقبة السلوكيات الضوئية في C. reinhardtii. أدت الأبحاث التي أجريت على السلوكيات الضوئية ل C. reinhardtii إلى اكتشاف آليات تنظيمية مشتركة بين الأهداب حقيقية النواة و channelrhodopsins ، والتي قد تسهم في فهم أفضل لاعتلالات الأهداب وتطوير طرق جديدة لعلم البصريات الوراثي.
Introduction
الضوء هو مصدر طاقة لا غنى عنه للكائنات الحية الضوئية ، ولكن الكثير من الضوء قد يسبب أضرارا مؤكسدة للضوء. وبالتالي ، تحتاج الكائنات الحية الضوئية إلى البقاء على قيد الحياة تحت ضوء معتدل الكثافة ، حيث يمكنها التمثيل الضوئي ولكن لا تعاني من أضرار الأكسدة الضوئية1. في النباتات البرية ، لا يمكن للبلاستيدات الخضراء الخروج من الورقة وإظهار حركات الصور في الخلية ؛ تنتقل البلاستيدات الخضراء إلى محيط الخلية تحت الضوء العالي وسطح الخلية تحت الإضاءة المنخفضة2 ، في حين أن العديد من الطحالب المتحركة تظهر سلوكيات ضوئية تسمح لها بإيجاد ظروف إضاءة مناسبة لعملية التمثيل الضوئي ، وبالتالي تسهيل بقائها على قيد الحياة3.
Chlamydomonas reinhardtii هي طحالب خضراء أحادية الخلية تعتبر كائنا نموذجيا في مجالات البحث مثل الأهداب (المعروفة أيضا باسم السوط) ، والتمثيل الضوئي ، والسلوك الضوئي. C. reinhardtii يقدم مع بقعة عين واحدة واثنين من الأهداب لكل خلية ، وتستخدم للاستقبال الضوئي والسباحة ، على التوالي. تحتوي بقعة العين على مكونين: channelrhodopsins (ChRs) ، والقنوات الأيونية ذات البوابات الضوئية في غشاء البلازما ، وطبقات الحبيبات الغنية بالكاروتينات الموجودة خلف ChRs مباشرة. تعمل بقعة العين كمستقبل ضوء اتجاهي لأن طبقات الحبيبات الغنية بالكاروتينات تعمل كعاكس للضوء 4,5.
تم تحديد ChRs في البداية على أنها مستقبلات ضوئية تسبب سلوكيات ضوئية في C. reinhardtii 6,7,8,9. على الرغم من وجود شكلين متساويين ، ChR1 و ChR2 ، في بقعة العين ، أظهرت تجارب الضربة القاضية أن ChR1 هو المستقبل الضوئي الأساسي للسلوكيات الضوئية10. على الرغم من ذلك ، تلقى ChR2 المزيد من الاهتمام ولعب دورا مركزيا في تطوير علم البصريات الوراثي ، وهي تقنية للتحكم في إثارة الخلايا بواسطة الضوء11. لذلك ، فإن دراسة الآليات التنظيمية التي تحكم السلوكيات الضوئية في C. reinhardtii ستعزز فهم وظيفة ChR وتحسن علم البصريات الوراثي.
بعد الاستقبال الضوئي ، تظهر خلايا C. reinhardtii نوعين من السلوكيات الضوئية: phototaxis واستجابة photoshock12. Phototaxis هو سلوك الخلايا التي تسبح في اتجاه مصدر الضوء أو الاتجاه المعاكس ، وتسمى phototaxis الإيجابية أو السلبية ، على التوالي. استجابة الصدمة الضوئية هي سلوك تظهره الخلايا بعد استشعار تغير مفاجئ في شدة الضوء ، مثل عند إضاءتها بواسطة فلاش. تتوقف الخلايا عن السباحة أو السباحة للخلف (أي السباحة مع جسم الخلية إلى الأمام) لفترة قصيرة ، عادة ما <1 ثانية.
تشارك الحركات الهضبية في C. reinhardtii في سلوكياتها الضوئية. عادة ما تضرب أهداب اثنين مثل سباحة الصدر البشري ، ويتم تعديل هذا للسلوكيات الضوئية. بالنسبة للتاكسي الضوئي ، فإن القوى الناتجة عن الأهداب غير متوازنة بسبب تعديل تردد الضرب وسعة الشكل الموجي لكل سيليوم13. يسمى السيليوم الأقرب إلى بقعة العين cis cilium ، والآخر يسمى cilium trans. تختلف هاتان الأهداب في نقاط مختلفة. على سبيل المثال ، تردد الضرب الهدبي للسيليوم العابر في المختبر أعلى بنسبة 30٪ -40٪14. بالإضافة إلى ذلك ، تختلف حساسية Ca2 +. أظهرت إعادة تنشيط نماذج الخلايا المزمنة 15 أن cilium cis يدق بقوة أكبر من cilium trans ل Ca 2 + <1 × 10−8 M ، في حين أن العكس صحيح بالنسبة ل Ca2 + >1 ×10−7 M. ربما يكون هذا التباين في حساسية Ca2 + مهما للتحولات الضوئية لأن الطفرات التي تفتقر إلى هذا التباين لا تظهر التاكسي الضوئي العادي16,17. على العكس من ذلك ، فإن تحويل الشكل الموجي ضروري للصدمة الضوئية. يتحول الشكل الموجي الهدبي من الشكل الموجي غير المتماثل في السباحة الأمامية إلى الشكل الموجي المتماثل في السباحة الخلفية. يتم تنظيم تحويل الشكل الموجي هذا أيضا بواسطة Ca2 + ، عند عتبة 1 × 10−4 M18,19. نظرا لأن العيوب في تنظيم الحركات الهدبية تسبب خلل الحركة الهدبية الأولية لدى البشر ، فإن دراسة السلوكيات الضوئية في C. reinhardtii قد تساعد في فهم أفضل لهذه الأمراض والتطورات العلاجية20.
هنا ، يتم توضيح أربع طرق بسيطة لمراقبة السلوكيات الضوئية في C. reinhardtii. أولا ، يتم عرض فحص phototaxis باستخدام أطباق Petri ، وثانيا ، فحص phototaxis ضد قطرات تعليق الخلايا. الظاهرة التي لوحظت في كلتا الحالتين ليست تاكسي ضوئي صارم ولكن تراكم الصور ، حيث تميل الخلايا إلى التراكم بالقرب من جانب مصدر الضوء أو الجانب الآخر. في C. reinhardtii ، يحدث تراكم الصور بشكل رئيسي بسبب التاكسي الضوئي بطريقة يمكن استخدامها كتقريب لسيارات الأجرة الضوئية. ثالثا ، يتم عرض فحص أكثر صرامة للتاكسي الضوئي تحت المجهر ، وأخيرا هو فحص الصدمة الضوئية تحت المجهر.
Access restricted. Please log in or start a trial to view this content.
Protocol
في هذه الدراسة ، تم استخدام سلالة من النوع البري من Chlamydomonas reinhardtii ، وهي ذرية من الصليب CC-124 x CC-125 مع agg1 + mt-،21. تم الحصول على CC-124 و CC-125 من مركز موارد الكلاميدوموناس (انظر جدول المواد) وتم الاحتفاظ بهما على ثلاثي خلات الفوسفات (TAP) 22 ، 1.5 ٪ من وسط الأغاروز عند 20-25 درجة مئوية. يمكن استخدام أي سلالة متحركة لهذا البروتوكول.
1. زراعة الخلايا
- استزرع سلالة من الكلاميدوموناس رينهاردتي في وسط سائل TAP مع تهوية عن طريق فقاعات الهواء المعقم في فترة 12 ساعة / 12 ساعة من الضوء المظلم (فترة الضوء ، ~ 50 ميكرومول فوتونات · م − 2 · ق − 1 ضوء أبيض) في 20-25 درجة مئوية لمدة يومين.
ملاحظة: يجب استخدام الخلايا في مرحلة النمو اللوغاريتمي المتوسط. إن الزراعة الطويلة (>3 أيام ، في مرحلة النمو اللوغاريتمي المتأخر) تجعل الخلايا أقل حساسية للتحفيز الضوئي وتزيد من عدد الخلايا الميتة في الثقافة ، مما يعوق قراءة النتائج.

الشكل 1: الثقافة السائلة بعد زراعة لمدة يومين. من صفيحة أجار TAP-1.5٪ ، تم تلقيح جزء من الخلايا البرية التي تملأ حلقة البلاتين في ~ 150 مل من وسط سائل TAP في قارورة. كانت كثافة الخلايا بعد زراعة يومين ~ 5.0 × 106 خلايا / مل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. المعالجة المسبقة للخلايا
- امزج ~ 10 ميكرولتر من المزرعة مع حجم متساو من محلول التحلل لمنع الخلايا من السباحة وقياس كثافة الخلية باستخدام عداد الخلايا أو مقياس الدم.
ملاحظة: هناك ما يقرب من 1-5 × 106 خلايا / مل بعد ثقافة يومين (الشكل 1). تكوين محلول الإهليلة هو كما يلي23: 40 mM خلات البوتاسيوم ، 1 mM CaCl2 ، الرقم الهيدروجيني 4.5 المعدل مع HCl. - جهاز طرد مركزي الكمية المطلوبة من الثقافة السائلة عند 1000 × g لمدة 3 دقائق في درجة حرارة الغرفة.
ملاحظة: تتطلب إحدى التجارب 3 مل من 2 × 107 خلايا/مل للشروط القياسية لفحص التاكسي الضوئي في طبق بتري. إذا كان سيتم إجراء تجربتين مع 1 × 106 خلايا / مل ، فيجب طرد 120 مل من الزراعة. - قم بتعليق بيليه الخلية بالكمية المطلوبة من الحل التجريبي للسلوك الضوئي إلى ~ 2 × 107 خلايا / مل (لفحص التاكسي الضوئي للأطباق) أو 1 × 106 خلايا / مل (لفحص التاكسي الضوئي على مستوى الخلية أو فحص استجابة الصدمة الضوئية) ووضع تعليق الخلية في أنبوب مخروطي.
ملاحظة: لا تحتاج كثافة الخلايا إلى التحكم فيها بدقة شديدة لإجراء تقدير تقريبي للسلوكيات الضوئية أو يمكن أن تتغير اعتمادا على الغرض من الفحص. الحل التجريبي للسلوك الضوئي14: 5 mM HEPES (الرقم الهيدروجيني 7.4) ، 0.2 mM EGTA ، 1 mM KCl ، 0.3 mM CaCl2. يمكن حذف خطوة التبادل المؤقت هذه لإجراء فحص بسيط حول القدرة على عرض السلوكيات الضوئية ، ويمكن إجراء التجربة باستخدام وسيط الثقافة. ومع ذلك ، نظرا لأن التركيب الأيوني للمحلول يؤثر على علامات التكتيك الضوئي24 ، وقد لا يكون التركيب الأيوني للوسط بعد الزراعة ثابتا ، يوصى باستخدام هذا الحل لإجراء فحص أكثر صرامة. يمكن أن يكون الاستبدال بوسيط TAP جديد خيارا. - ضع الأنبوب تحت ضوء أحمر خافت (فوتونات 10-30 ميكرومول·m−2·s−1) لمدة ~ 1 ساعة (الشكل 2).
ملاحظة: تزيد هذه الخطوة من حساسية الخلايا للمحفز الضوئي.

الشكل 2: تعليق الخلية تحت الضوء الأحمر. ضوء أبيض فلورسنت منتظم مغطى بورقة من السيلوفان الأحمر. يتم وضع أنبوب يحتوي على تعليق الخلية تحت ~ 10 ميكرومول فوتونات·m−2·s−1 ضوء أحمر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. فحص التاكسي الضوئي باستخدام طبق بتري (ما يسمى "فحص الطبق")
- ضع تعليق خلية 2-3 مل في طبق بتري (3.5 سم) ، وضعه على صندوق إضاءة (بدلا من ذلك ، ورقة بيضاء أو صفيحة بلاستيكية بيضاء) ، رج بلطف لتوزيع الخلايا بشكل موحد ، واحصل على صورة قبل الإضاءة.
ملاحظة: يمكن أن يتغير حجم الطبق حسب الغرض. اعتمادا على الإجهاد وحالة المزرعة ، قد تلتصق الخلايا بالجزء السفلي من طبق بيتري. في مثل هذه الحالة ، يجب إزالة الخلايا العالقة عن طريق السحب قبل الفحص. - قم بإضاءة الطبق من جانب واحد باستخدام صمام ثنائي باعث للضوء الأخضر (LED ، انظر جدول المواد) في غرفة مظلمة على سطح المكتب (الشكل 3).
ملاحظة: ظروف الإضاءة النموذجية هي λ = 525 نانومتر وفوتونات 50-100 ميكرومول·m−2·s−1. راجع المناقشة حول تحديد الطول الموجي لمصدر الضوء في قسم المناقشة. قم بتغطية كل من الأطباق و LED بصندوق أو قطعة قماش سوداء عند استخدام مصباح LED صغير. - اتركها لمدة ≥5 دقيقة ثم احصل على الصور.
ملاحظة: يمكن تغيير وقت الإضاءة الضوئية اعتمادا على حجم طبق بتري أو الغرض منه (الشكل 4). - استيراد ملف الصورة إلى فيجي (انظر جدول المواد) لقياسه كميا.
ملاحظة: فيجي هو توزيع ImageJ2 ، وتجميع العديد من المكونات الإضافية. - قم بتغيير الصورة الملونة إلى تدرج رمادي من خلال > الصورة اكتب > 8 بت (الشكل 5).
- عكس الأبيض والأسود من خلال تحرير > عكس.
- أحط الطبق بأكمله كمنطقة ذات أهمية (ROI) وقم بقياس الكثافة من خلال تحليل > القياس.
ملاحظة: يمكن حساب كثافة الطبق الكلي على أنها (مساحة) × (متوسط). - أحط نصف الطبق الأقرب إلى مصدر الضوء كعائد استثمار وقم بقياس الكثافة.
- احسب مؤشر التكتيك الضوئي على أنه (كثافة الخلايا الضوئية) لكل (كثافة الخلايا الكلية).

الشكل 3: الإضاءة الجانبية لفحص طبق التاكسي الضوئي . (أ) طبق بتري يحتوي على تعليق خلوي يوضع على صندوق إضاءة في غرفة مظلمة على سطح المكتب. ضوء أخضر (لوحة LED 525 نانومتر ، فوتونات ~ 100 ميكرومول ·m−2·s−1) مضاء من الجانب. (ب) طريقة الإضاءة البديلة. مصباح LED من نوع كرة المدفع مقاس 5 مم. (ج) لمنع الضوء من الخارج ، يمكن استخدام صندوق بقطعة قماش سوداء في الداخل بدلا من غرفة مظلمة لسطح المكتب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: مثال على التاكسي الضوئي السلبي بعد 5 دقائق من الإضاءة الجانبية . (أ) تعليق خلية من النوع البري في طبق بتري مضاء لمدة 5 دقائق. معظم الخلايا المتراكمة على الجانب الآخر من مصدر الضوء. يمكن تفسير هذه البيانات على أنها تاكسي ضوئي سلبي. (ب) صورة الطبق من الأعلى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
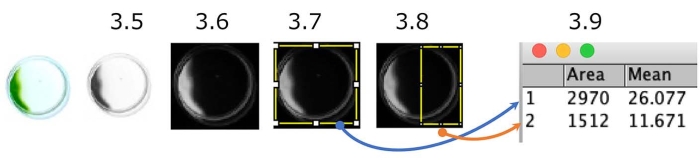
الشكل 5: تحديد كمية فحص التاكسي الضوئي للأطباق. مثال على الخلايا التي تظهر التاكسي الضوئي السلبي (مصدر الضوء على الجانب الأيمن). يتم تحويل الصورة الملونة إلى تدرج رمادي (الخطوة 3.5.) ثم مقلوبة (الخطوة 3.6). تم تحديد المناطق ذات الأهمية (ROI) ، والطبق بأكمله (الخطوة 3.7) ، والنصف الجانبي من مصدر الضوء من الطبق (الخطوة 3.8). تم قياس كثافة كل عائد استثمار (الخطوة 3.9). في هذه الحالة ، يبلغ مؤشر التكتيك الضوئي (PI) حوالي 0.18 ([1,512 × 11.671] / [2,970 × 26.077]). PI هو 1 أو 0 عندما تظهر جميع الخلايا سيارات الأجرة الضوئية الإيجابية أو السلبية ، على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. فحص التاكسي الضوئي باستخدام قطرات زراعة الخلايا
- ضع 25 ميكرولتر من قطرات تعليق الخلايا (الخطوة 2.4) مباشرة على صفيحة بلاستيكية بيضاء باستخدام ماصة دقيقة.
- قم بإضاءة القطرات من جانب واحد باستخدام مصباح LED أخضر في غرفة مظلمة على سطح المكتب (الشكل 6).
ملاحظة: ظروف الإضاءة النموذجية هي λ = 525 نانومتر وفوتونات 50-100 ميكرومول m−2 s−1. قم بتغطية كل من الألواح و LED بصندوق أو قطعة قماش سوداء عند استخدام مؤشر LED صغير. - اتركها لمدة 3 دقائق ثم احصل على الصور.
ملاحظة: هذا الفحص مناسب لإجراء فحص سريع للتاكسي الضوئي للعديد من العينات في وقت واحد ، كما هو الحال في فحص الطفرات أو تحليل tetrad. يمكن إضاءة مزرعة الخلايا في مرحلة منتصف السجل المزروعة في صفيحة 96 بئرا مباشرة لتسهيل الأداء. في كلتا الحالتين ، يمكن حذف الخطوة 2 (المعالجة المسبقة للخلية).

الشكل 6: فحص التاكسي الضوئي بالقطيرات . (أ) تسع قطرات من تعليق خلوي 25 ميكرولتر موضوعة على ورقة بلاستيكية بيضاء ومضاءة من الجانب بواسطة مصباح LED أخضر. (ب) بعد 3 دقائق من الإضاءة. في كل قطرة ، تتراكم الخلايا إما على جانب مصدر الضوء (التاكسي الضوئي الإيجابي) ، أو المتراكمة على الجانب الآخر (التاكسي الضوئي السلبي) ، أو تنتشر في القطرة (بدون تاكسي ضوئي). شريط المقياس = 1 سم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
5. فحص التاكسي الضوئي تحت المجهر
- خذ ~ 30 ميكرولتر من تعليق الخلية (1 × 106 خلايا / مل في محلول تجريبي للسلوك الضوئي) على شريحة زجاجية وضع غطاء (18 مم × 18 مم) مع فواصل في الأعلى (الشكل 7).
ملاحظة: يمكن صنع الفواصل باستخدام البترول الأبيض أو الأشرطة اللاصقة على الوجهين على جانبين متقابلين من الغطاء الزجاجي. يجب أن يأتي الضوء من اتجاه لا توجد فيه فواصل. - قم بإلقاء الضوء على العينة من جانب واحد من الغطاء بدون فاصل مع LED أخضر ومراقبة الخلايا تحت مجهر المجال المظلم باستخدام عدسة موضوعية 10x تحت الضوء الأحمر الخافت (λ > 630 نانومتر ، ~ 5 ميكرومول فوتونات ·m−2·s−1 ، الشكل 8).
ملاحظة: تجنب تعريض الخلايا الموجودة على المسرح لضوء آخر غير ضوء LED أو ضوء المراقبة، مثل إضاءة الغرفة أو الضوء الصادر عن شاشة الكمبيوتر. يعتمد التكبير المناسب للعدسة الموضوعية على زاوية رؤية الكاميرا. حدد عدسة ذات تكبير يسمح للخلية بالسباحة لمدة ~ 2 ثانية دون مغادرة مجال الرؤية. لتتبع الخلايا ، من المستحسن وجود صورة عالية التباين ؛ وبالتالي ، يوصى باستخدام مكثف المجال المظلم للمراقبة المجهرية. ومع ذلك ، يمكن استخدام مكثفات أخرى ، مثل المجال الساطع ، لمراقبة التاكسي الضوئي. تأكد من أن الضوء الصادر عن LED ساطع على الخلايا. - سجل حركة الخلية لمدة 20 ثانية تقريبا بعد إضاءة الضوء باستخدام مجهر مجهز بالكاميرا.
ملاحظة: بعد بضع ثوان من بداية إضاءة LED الخضراء ، قد تحدث استجابة للصدمة الضوئية ، و / أو أن الاتجاه الضوئي (أو العلامة) غير مستقر ؛ وبالتالي ، يوصى بتسجيل 20 ثانية لتحقيق استقرار الاستجابة (الفيلم 1).

الشكل 7: عمل فواصل على حواف الغطاء (أ) تم تطبيق طبقة رقيقة من الفازلين على راحة اليد. تم كشط كمية صغيرة من البترول الأبيض بحافة الغطاء. (ب) فاصل على حافة الغطاء. (ج) فاصل آخر على الحافة المقابلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: الإضاءة الجانبية تحت المجهر . (أ) إعداد مصباح LED أخضر. يتم تثبيت مصباح LED أخضر من نوع كرة المدفع على الكمامة وتثبيته على الحامل بجوار المجهر. لوحظت الخلايا تحت مجهر المجال المظلم مع مرشح قطع حاد (λ > 630 نانومتر). (ب) الإضاءة الجانبية بواسطة LED الأخضر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الفيلم 1: فحص التاكسي الضوئي تحت المجهر. ضوء أخضر مضاء في ~ 0 ثانية من اليمين. في تلك المرحلة، كانت الخلايا تميل إلى السباحة في اتجاه عشوائي. بعد 0 ثانية في عداد الوقت ، سبحت الخلايا إما إلى اليمين أو اليسار ، وتظهر سيارات الأجرة الضوئية الإيجابية أو السلبية. تم إيقاف تشغيل الضوء في ~ 15 ثانية عندما بدأت الخلايا في السباحة في اتجاه عشوائي مرة أخرى. شريط المقياس = 100 ميكرومتر .
6. تتبع الخلايا الضوئية والرسم البياني القطبي
- استخرج 1.5 ثانية من الفيديو المسجل، بدءا من 15 ثانية بعد الإضاءة.
ملاحظة: يمكن أن تتغير مدة المسار اعتمادا على سرعة سباحة الخلية. يحتوي الفيديو الذي تبلغ مدته 1.5 ثانية على 46 إطارا عند تسجيل 30 إطارا في الثانية. - استيراد الملف إلى فيجي كتسلسل صورة بتنسيق ملف صورة العلامة من خلال > استيراد > تسلسل الصورة.
- قم بتشغيل المكون الإضافي "التتبع اليدوي" لتتبع الخلايا باستخدام المكونات الإضافية > التتبع > التتبع اليدوي.
- انقر فوق إضافة مسار ، ويظهر الإطار الأول.
- انقر فوق خلية ذات أهمية ، ويظهر الإطار الثاني.
- حرك شريط التمرير إلى الإطار الأخير وانقر فوق نفس الخلية كما في الخطوة 6.5.
ملاحظة: ليس من الضروري تتبع الخلايا في كل إطار. فقط الزاوية بين محور الضوء ومقطع الخط الذي يتكون من نقاط البداية والنهاية ضرورية. - كرر الخطوات 6.4.-6.6. ل ~ 30 خلية.
ملاحظة: حدد الخلايا التي تبقى ضمن زاوية الرؤية ل 1.5 ثانية بأكملها. إذا كانت كثافة الخلية منخفضة بما فيه الكفاية ولم تتقاطع مسارات السباحة الخلوية لمدة 1.5 ثانية ، فيمكن إجراء التتبع التلقائي. في هذه الحالة ، اختر المكون الإضافي "MTrack2" (الإعدادات النموذجية: الحد الأدنى لحجم الكائن = 1 ؛ الحد الأقصى لحجم الكائن = 10000 ؛ السرعة القصوى = 100 ؛ الحد الأدنى لطول المسمار [الإطارات] = 46). يوصى بالتحقق من المراسلات بين الخلايا الموجودة على الفيديو ونتائج التتبع عن طريق الحصول على البيانات عن طريق التحقق من إظهار النص؟ > تراكب النقاط والخطوط. - انسخ النتائج والصقها في برنامج جداول البيانات (على سبيل المثال، Excel).
ملاحظة: هنا ، يتم عرض كيفية رسم رسم مدرج تكراري قطبي باستخدام Excel. - قم بقياس الزاوية بين محور الضوء واتجاه السباحة للخلية بواسطة "= الدرجات (atan2(x2-x1),-(y2-y1))"، حيث يكون موضع بدء الخلية (الشريحة #1) هو (x1، y1)، والموضع الأخير (الشريحة #46) هو (x2، y1).
ملاحظة: في صورة فيجي، الزاوية العلوية اليسرى هي الأصل (0، 0). - كرر الخطوة 6.9. لجميع الخلايا التي تم قياسها (عادة ~ 30 خلية).
- قم بإعداد جدول توزيع ترددي لجميع البيانات التي تم الحصول عليها باستخدام الصناديق من -180 درجة إلى +180 درجة ، مقسمة إلى 15 درجة في كلا الطرفين و 30 درجة لبقية النطاق باستخدام وظيفة "التردد".
ملاحظة: بعد تحديد الأعمدة مباشرة إلى أعمدة سلة المهملات، أدخل ما يلي في العمود العلوي =FREQUENCY (data_array، bins_array) واضغط على shift + ctrl + enter (الشكل التكميلي 1). - أعد إنشاء جدول توزيع تكراري مع القيم المحسوبة في الخطوة 6.8. استدار −90 ° لضبط الجانب الأيمن على 0 ° (أي تحويل الرقم في النطاق من -15 ° إلى 15 ° ، إلى النطاق من -105 ° إلى -75 °) ، لأنه ، بالطريقة المذكورة أعلاه ، تعتبر الخلايا التي تسبح لأعلى تسبح بزاوية 0 ° للضوء (أي تظهر تاكسي ضوئي إيجابي) ، على الرغم من أن الضوء قادم من اليمين (الشكل التكميلي 2).
- أدخل قيمة الزاوية في منتصف نطاق حاوية 30 درجة (على سبيل المثال، 30 درجة ل 15 درجة -45 درجة)، وتخطي عمودا واحدا، وأدخل عدد العينات المقابل على يمينه (الشكل التكميلي 3).
- قم بتحويل كل قيمة عد عينة إلى نسبة مئوية، وأدخل 0 في العمود المقابل للعمود الفارغ بين المهملات.
- ارسم مخططا راداريا باستخدام قيم الزاوية كتسميات المحور الأفقي والقيم المئوية (٪) كوسيلة إيضاح (الشكل التكميلي 4).
- احسب مؤشر التكتيك الضوئي (PI) لمزيد من القياس الكمي عن طريق حساب متوسط cosθ (θ = الزاوية بين محور الضوء واتجاه السباحة)16.
ملاحظة: PI هو 0 عندما تسبح الخلايا في اتجاه عشوائي و 1 أو -1 عندما تظهر 100٪ من الخلايا تاكسي ضوئي إيجابي أو سلبي ، على التوالي.
7. فحص استجابة الصدمة الضوئية تحت المجهر
- ضع ~ 30 ميكرولتر تعليق خلوي (1 × 106 خلايا / مل في الحل التجريبي للسلوك الضوئي) على شريحة زجاجية ، وضع غطاء (18 مم × 18 مم) مع فواصل في الأعلى ، كما هو الحال في الخطوة 4.1.
- راقب الخلايا تحت المجهر بضوء أحمر خافت (λ > 630 نانومتر، ~ 5 ميكرومول فوتونات·m−2·s−1).
- تطبيق إضاءة الفلاش باستخدام فلاش الكاميرا (الفيلم 2,3).
ملاحظة: هناك طريقة أخرى للحث على استجابة الصدمة الضوئية وهي إزالة مرشح أحمر بسرعة باليد من مسار ضوء المراقبة. ومع ذلك ، فإن هذه الطريقة أكثر تنوعا لأن سرعة إزالة المرشح تختلف من شخص لآخر (الفيلم 4,5). - سجل حركة الخلايا باستخدام مجهر مجهز بالكاميرا.
- للقياس الكمي ، قم بإجراء أي مما يلي أو كليهما: (1) حساب نسبة الخلايا التي تظهر استجابة الصدمة الضوئية لكل خلية إجمالية16 ؛ (2) بالنسبة للخلايا التي تظهر استجابة الصدمة الضوئية ، قم بقياس الوقت من حافز الصدمة الضوئية إلى استعادة السباحة الأمامية25.
الفيلم 2: إضاءة الصدمة الضوئية بواسطة فلاش الكاميرا. تم رفع فلاش الكاميرا إلى مرحلة المجهر وتشغيله. يرجى النقر هنا لتنزيل هذا الفيلم.
الفيلم 3: استجابة الصدمة الضوئية الناجمة عن وميض تحت المجهر. لوحظت الخلايا تحت الضوء الأحمر الخافت. انبعث وميض في ~ 0 ثانية. توقفت جميع الزنازين تقريبا عن السباحة إلى الأمام ، وسبحت إلى الخلف لفترة قصيرة ، وتعافت من السباحة إلى الأمام. شريط المقياس = 100 ميكرومتر .
الفيلم 4: استجابة الصدمة الضوئية الناجمة عن إزالة مرشح أحمر تحت المجهر. لوحظت الخلايا تحت الضوء الأحمر الخافت. تمت إزالة المرشح الأحمر في ~ 5 ثانية. توقفت جميع الزنازين تقريبا عن السباحة إلى الأمام ، وسبحت إلى الخلف لفترة قصيرة ، وتعافت من السباحة إلى الأمام. شريط المقياس = 100 ميكرومتر .
الفيلم 5: إزالة مرشح أحمر. إزالة سريعة لمرشح أحمر مضبوط في مسار الضوء لتوصيل صدمة ضوئية. يرجى النقر هنا لتنزيل هذا الفيلم.
Access restricted. Please log in or start a trial to view this content.
النتائج
يتم عرض سيارات الأجرة الضوئية النموذجية C. reinhardtii واختبارات الاستجابة للصدمة الضوئية هنا. بعد تقدير كثافة الخلية ، تم غسل زراعة الخلايا من النوع البري (ذرية من CC-124 × CC-125 مع agg1 + mt -)23 بمحلول تجريبي للسلوك الضوئي لفحص طبق التاكسي الضوئي. تم وضع تعليق الخلية تحت الضوء الأحمر ال...
Access restricted. Please log in or start a trial to view this content.
Discussion
والبروتوكول الحالي سهل ولا يستغرق وقتا طويلا. إذا اشتبه في وجود متحور C. reinhardtii مع عيوب في الاستقبال الضوئي أو الحركة الهدبية ، يمكن أن تكون هذه الطريقة بمثابة تحليل ظاهري أولي.
ومع ذلك، توجد بعض الخطوات الحاسمة. الأول هو استخدام الخلايا في التجربة في مرحلة النمو المبكرة...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذه الدراسة من خلال منح من الجمعية اليابانية لتعزيز العلوم KAKENHI (https://www.jsps.go.jp/english/index.html) إلى NU (19K23758 و 21K06295) و TH (16H06556) و KW (19H03242 و 20K21420 و 21H00420) ومن مؤسسة Ohsumi Frontier Science Foundation (https://www.ofsf.or.jp/en/) إلى KW ، ومن التحالف الديناميكي للابتكار المفتوح الذي يربط بين الإنسان والبيئة والمواد (http://alliance.tagen.tohoku.ac.jp/english/) إلى NU و TH و KW.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| 5 mm Cannonball green LED | Optosupply | OSPG5161P | |
| 50 mL conical tube | SARSTEDT | 62.547.254 | |
| AC adaptor for the light box | ATTO | 2196161 | |
| Auto cell counter | DeNovix | CellDrop BF | |
| CaCl2 | Nakalai tesque | 06731-05 | |
| Camera flash | NEWWER | TT560 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strains CC-124 and CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| C-mout CCD camera | Wraymer | 1129HMN1/3 | |
| Desktop darkroom | Scientex | B-S8 | |
| Digital still camera | SONY | RX100II | |
| EGTA | Dojindo | G002 | |
| Fiji | https://fiji.sc/ | ||
| Green LED plate | CCS | ISLM-150X150-GG | |
| HCl | Fujifilm WAKO | 080-01066 | |
| HEPES | Dojindo | GB70 | |
| KCl | Nakalai tesque | 238514-75 | |
| Lightbox (Flat viewer) | ATTO | 2196160 | |
| Microscope | Olympus | BX-53 | |
| Petri dish (φ3.5 cm) | IWAKI | 1000-035 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Power supply for the green LED plate | CCS | ISC-201-2 | |
| Red filter | Shibuya Optical | S-RG630 |
References
- Demmig-Adams, B., Adams, W. W. Photoprotection and other responses of plants to high light stress. Annual Reviews Plant Physiology and Plant Molecular Biology. 43, 599-626 (1992).
- Wada, M. Chloroplast movement. Plant Science. 210, 177-182 (2013).
- Sgarbossa, A., Checcucci, G., Lenci, F. Photoreception and photomovements of microorganisms. Photochemical & Photobiological Sciences. 1 (7), 459-467 (2002).
- Ueki, N., et al. Eyespot-dependent determination of the phototactic sign in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 113 (19), 5299-5304 (2016).
- Foster, K. W., Smyth, R. D. Light antennas in phototactic algae. Microbiological Reviews. 44 (4), 572-630 (1980).
- Nagel, G., et al. Channelrhodopsin-1: a light-gated proton channel in green algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Sineshchekov, O. A., Jung, K. -H., Spudich, J. L. Two rhodopsins mediate phototaxis to low- and high-intensity light in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 99 (13), 8689-8694 (2002).
- Suzuki, T., et al. Archaeal-type rhodopsins in Chlamydomonas: model structure and intracellular localization. Biochemical and Biophysical Research Communications. 301 (3), 711-717 (2003).
- Berthold, P., et al. Channelrhodopsin-1 initiates phototaxis and photophobic responses in Chlamydomonas by immediate light-induced depolarization. Plant Cell. 20 (6), 1665-1677 (2008).
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. Journal of Neuroscience. 26 (41), 10380-10386 (2006).
- Wakabayashi, K., Isu, A., Ueki, N. Channelrhodopsin-dependent photo-behavioral responses in the unicellular green alga Chlamydomonas reinhardtii. Optogenetics (Advances in Experimental Medicine and Biology), 2nd ed. , Springer. 21-33 (2021).
- Rüffer, U., Nultsch, W. Flagellar photoresponses of Chlamydomonas cells held on micropipettes: II. Change in flagellar beat pattern. Cell Motility and the Cytoskeleton. 18 (4), 269-278 (1991).
- Kamiya, R., Hasegawa, E. Intrinsic difference in beat frequency between the two flagella of Chlamydomonas reinhardtii. Experimental Cell Research. 173, 299-304 (1987).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Horst, C. J., Witman, G. B. ptx1, a nonphototactic mutant of Chlamydomonas, lacks control of flagellar dominance. Journal of Cell Biology. 120 (3), 733-741 (1993).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature Reviews Molecular Cell Biology. 18 (9), 533-547 (2017).
- Ide, T., et al. Identification of the agg1 mutation responsible for negative phototaxis in a "wild-type" strain of Chlamydomonas reinhardtii. Biochemistry and Biophysics Reports. 7, 379-385 (2016).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Finst, R. J., Kim, P. J., Quarmby, L. M. Genetics of the deflagellation pathway in Chlamydomonas. Genetics. 149 (2), 927-936 (1998).
- Morel-Laurens, N. Calcium control of phototactic orientation in Chlamydomonas reinhardtii: sign and strength of response. Photochemistry and Photobiology. 45 (1), 119-128 (1987).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Wakabayashi, K., Misawa, Y., Mochiji, S., Kamiya, R. Reduction-oxidation poise regulates the sign of phototaxis in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 108 (27), 11280-11284 (2011).
- Harris, E. H. in The Chlamydomonas Sourcebook Second Edition. 1, Academic Press. Ch. 2 25-64 (2009).
- Mergenhagen, D. Circadian clock: genetic characterization of a short period mutant of Chlamydomonas reinhardii. European Journal of Cell Biology. 33 (1), 13-18 (1984).
- Ozasa, K., Lee, J., Song, S., Hara, M., Maeda, M. Two-dimensional optical feedback control of Euglena confined in closed-type microfluidic channels. Lab on a Chip. 11 (11), 1933-1940 (2011).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138(2021).
- Ueno, Y., Aikawa, S., Kondo, A., Akimoto, S. Adaptation of light-harvesting functions of unicellular green algae to different light qualities. Photosynthesis Research. 139 (1-3), 145-154 (2019).
- Takahashi, T., Watanabe, M. Photosynthesis modulates the sign of phototaxis of wild-type Chlamydomonas reinhardtii. Effects of red background illumination and 3-(3',4'-dichlorophenyl)-1,1-dimethylurea. FEBS Letters. 336 (3), 516-520 (1993).
- Morishita, J., Tokutsu, R., Minagawa, J., Hisabori, T., Wakabayashi, K. I. Characterization of Chlamydomonas reinhardtii mutants that exhibit strong positive phototaxis. Plants (Basel). 10 (7), (2021).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Inaba, K. Calcium sensors of ciliary outer arm dynein: functions and phylogenetic considerations for eukaryotic evolution. Cilia. 4 (1), 6(2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved