A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תצפית על פוטו-בהביור בכלמידומונס ריינהרדטי
* These authors contributed equally
In This Article
Summary
רוב האורגניזמים הפוטו-אוטוטרופיים השוחים מראים שינויים התנהגותיים הנגרמים על ידי פוטו-אבה(photobehavior). הפרוטוקול הנוכחי מתבונן בפוטו-בהביור האמור באורגניזם המודל Chlamydomonas reinhardtii.
Abstract
להישרדותם של המיקרואורגניזמים הפוטוטרופיים תנועתיים, להיות בתנאי אור תקינים הוא חיוני. כתוצאה מכך, הם מראים התנהגויות המושרות על ידי תמונות (או פוטו-התנהגותיות) ומשנים את כיוון התנועה שלהם בתגובה לאור. פוטו-התנהגותיים טיפוסיים כוללים תגובה פוטוסהוק (או פוטופובית) ופוטוטקסיס. פוטוסשוק הוא תגובה לשינוי פתאומי בעוצמת האור (למשל, תאורת הבזק), שבו אורגניזמים מפסיקים באופן ארעי לזוז או לנוע לאחור. במהלך פוטוטקסיס, אורגניזמים נעים לעבר מקור האור או בכיוון ההפוך (הנקרא פוטוטקסיס חיובי או שלילי, בהתאמה). האצה הירוקה החד-תאית Chlamydomonas reinhardtii היא אורגניזם מצוין לחקר פוטו-בהביור מכיוון שהיא משנה במהירות את תבנית השחייה שלה על ידי ויסות הכאת הריסונים (a.k.a., flagella) לאחר פוטו-רהוט. כאן, שיטות פשוטות שונות מוצגות כדי לצפות photobehaviors ב C. reinhardtii. מחקר על פוטו-התנהגותיים של C. reinhardtii הוביל לגילוי מנגנוני ויסות נפוצים בין ריסונים אאוקריוטים ותעלות, אשר עשויים לתרום להבנה טובה יותר של ציליאופתיות ולפיתוח שיטות אופטוגנטיקה חדשות.
Introduction
אור הוא מקור אנרגיה חיוני עבור אורגניזמים פוטוסינתטיים, אך יותר מדי אור עלול לגרום לנזק פוטו-חמצוני. לפיכך, אורגניזמים פוטוטרופיים צריכים לשרוד תחת אור בעוצמה בינונית, שם הם יכולים לבצע פוטוסינתזה אך לא לסבול מנזק פוטו-חמצוני1. בצמחי יבשה, כלורופלסטים אינם יכולים לצאת מהעלה ולהראות תנועות צילום בתא; כלורופלסטים נעים לפריפריה של התא תחת אור גבוה ולפני השטח של התא תחת אור נמוך2, בעוד שאצות תנועתיות רבות מציגות פוטו-התנהגותיות המאפשרות להם למצוא תנאי אור מתאימים לפוטוסינתזה, ובכך להקל על הישרדותם3.
כלמידומונס ריינהרדטיי (Chlamydomonas reinhardtii) היא אצה ירוקה חד-תאית הנחשבת לאורגניזם מודל בתחומי מחקר כמו ריסונים (כלומר, פלגלה), פוטוסינתזה ופוטו-בהביאור. C. reinhardtii מציג עם כתם עיניים אחד ושני ריסונים לכל תא, המשמשים לתפיסה ושחייה, בהתאמה. לתעלת העיניים יש שני מרכיבים: תעלות תיעול(ChRs), תעלות יונים מגודרות אור בקרום הפלזמה, ושכבות הגרגירים העשירות בקרוטנואידים הממוקמות ממש מאחורי ה-ChRs. כתם העיניים פועל כקולטן אור כיווני מכיוון ששכבות הגרגירים העשירות בקרוטנואידים מתפקדות כמחזיר אור 4,5.
ChRs זוהו בתחילה כפוטורצפטורים הגורמים לפוטו-בהביורים ב-C. reinhardtii 6,7,8,9. אף על פי ששני איזופורמים, ChR1 ו-ChR2, נמצאים בנקודת העין, ניסויי הפלה הראו כי ChR1 הוא הפוטורצפטור העיקרי של פוטו-בהביורים10. למרות זאת, ChR2 זכה לתשומת לב רבה יותר ומילא תפקיד מרכזי בפיתוח אופטוגנטיקה, טכניקה לשליטה בעירור תאים על ידי אור11. לכן, לימוד מנגנוני הרגולציה השולטים בפוטו-בהביורים ב- C. reinhardtii יקדם את ההבנה של פונקציית ChR וישפר את האופטוגנטיקה.
לאחר פוטו-תפיסה, תאי C. reinhardtii מראים שני סוגים של פוטו-התנהגותיים: פוטוטקסיס ותגובת פוטושוק12. פוטוטקסיס היא התנהגות של תאים השוחים בכיוון מקור האור או בכיוון ההפוך, הנקראת פוטוטקסיס חיובית או שלילית, בהתאמה. תגובת פוטושוק היא התנהגות שהתאים מראים לאחר שחשו שינוי פתאומי בעוצמת האור, למשל כאשר הם מוארים על ידי הבזק. תאים מפסיקים לשחות או לשחות לאחור (כלומר, לשחות עם גוף התא קדימה) לתקופה קצרה, בדרך כלל <1 שניות.
תנועות סילאריות ב- C. reinhardtii מעורבות בפוטו-התנהגותיות שלה. שני ריסונים בדרך כלל מכים כמו מכת חזה של אדם שוחה, וזה מווסת עבור פוטו-באביורים. עבור פוטוטקסיס, הכוחות הנוצרים על ידי שני הריסונים אינם מאוזנים על ידי אפנון תדר הפעימה ומשרעת צורת הגל של כל ציליום13. הסיליום הקרוב ביותר לכתם העיניים נקרא ציס סיליום, והשני נקרא טרנס סיליום. שני ריסונים אלה נבדלים זה מזה בנקודות שונות. לדוגמה, תדירות ההכאה הסילארית של טרנס סיליום במבחנה גבוהה ב-30%-40%14. בנוסף, הרגישות שלהם Ca2+ שונה. הפעלה מחדש של מודלים של תאים מפורקים15 הראתה כי ה-cis cilium פועם חזק יותר מהטרנס-סיליום עבור Ca2+ <1 x 10−8 M, בעוד שההפך הוא הנכון עבור Ca2+ >1 x 10−7 M. אסימטריה זו ברגישות Ca2+ עשויה להיות חשובה לסיבובים פוטוטקטיים מכיוון שמוטנטים חסרי אסימטריה זו אינם מפגינים פוטוטקסיס תקין16,17. לעומת זאת, המרת צורת גל נחוצה לצילום. צורת הגל הסילארית משתנה מצורת הגל האסימטרית בשחייה קדימה לצורת הגל הסימטרית בשחייה לאחור. המרת צורת גל זו מוסדרת גם על ידי Ca2+, בסף של 1 x 10−4 M18,19. מאחר שפגמים בוויסות התנועות הציליאריות גורמים לדיסקינזיה סילארית ראשונית בבני אדם, חקר פוטו-בהביורים ב-C. reinhardtii עשוי לסייע בהבנה טובה יותר של מחלות אלה ושל התפתחויות טיפוליות20.
כאן, ארבע שיטות פשוטות להתבוננות ב- Photobehaviors ב- C. reinhardtii מוצגות. ראשית, מוצגת בדיקת פוטוטקסיס באמצעות צלחות פטרי, ושנית, בדיקת פוטוטקסיס נגד טיפות תרחיף התא. התופעה שנצפתה בשני המקרים אינה פוטוטקסיס בלבד אלא הצטברות תמונות, שבה התאים נוטים להצטבר קרוב לצד מקור האור או לצד הנגדי. ב - C. reinhardtii, הצטברות תמונות נגרמת בעיקר על ידי פוטוטקסיס באופן שיכול לשמש כקירוב לפוטוטקסיס. שלישית, מוצגת בדיקה קפדנית יותר עבור פוטוטקסיס תחת מיקרוסקופ, והאחרונה היא בדיקת פוטושוק מתחת למיקרוסקופ.
Access restricted. Please log in or start a trial to view this content.
Protocol
במחקר הנוכחי, זן מסוג פראי של Chlamydomonas reinhardtii, צאצא של הצלב CC-124 x CC-125 עם agg1+mt-, שימש21. CC-124 ו- CC-125 התקבלו ממרכז המשאבים של כלמידומונס (ראה טבלת חומרים) ונשמרו על טריס-אצטט-פוספט (TAP)22, 1.5% מדיום אגרוז בטמפרטורה של 20-25 מעלות צלזיוס. כל זן תנועתי יכול לשמש עבור פרוטוקול זה.
1. תרבית תאים
- תרבית זן של עניין של Chlamydomonas reinhardtii במדיום נוזלי TAP עם אוורור על ידי אוורור על ידי מבעבע אוויר סטרילי בתקופה של 12 שעות /12 שעות בהיר-כהה (תקופת אור, ~ 50 μmol פוטונים·m−2·s−1 אור לבן) ב 20-25 מעלות צלזיוס למשך יומיים.
הערה: יש להשתמש בתאים בשלב גדילה לוגריתמי באמצע. תרבית ארוכה (>3 ימים, בשלב הגדילה הלוגריתמית המאוחרת) הופכת את התאים לפחות רגישים לגירוי האור ומגדילה את מספר התאים המתים בתרבית, מה שמעכב את קריאת התוצאות.

איור 1: תרבית נוזלית לאחר התבגרות של יומיים. מתוך צלחת אגר TAP-1.5%, נתח של תאים מסוג פרא הממלאים את לולאת הפלטינה חוסן לכ-150 מ"ל של מדיום נוזלי TAP בבקבוקון. צפיפות התא לאחר תרבית של יומיים הייתה ~ 5.0 x 106 תאים / מ"ל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
2. טיפול מקדים בתאים
- מערבבים כ-10 μL של התרבית עם נפח שווה של תמיסת דצילציה כדי לעצור את התאים משחייה ולמדוד את צפיפות התא באמצעות מונה תאים או המוציטומטר.
הערה: ישנם בערך 1-5 x 106 תאים/מ"ל לאחר תרבית של יומיים (איור 1). ההרכב של תמיסת הדצילציה הוא כדלקמן23: 40 mM אשלגן אצטט, 1 mM CaCl2, pH 4.5 מותאם עם HCl. - צנטריפוגה את הכמות הנדרשת של תרבית נוזלית ב 1000 x g במשך 3 דקות בטמפרטורת החדר.
הערה: ניסוי אחד דורש 3 מ"ל של 2 x 107 תאים /מ"ל עבור תנאים סטנדרטיים לבדיקת פוטוטקסיס בצלחת פטרי. אם שני ניסויים הולכים להתבצע עם תרבית של 1 x 106 תאים /מ"ל, 120 מ"ל של תרבית צריכים להיות בצנטריפוגה. - השהו את גלולת התא עם הכמות הנדרשת של תמיסה ניסיונית פוטו-התנהגותית ל~2 x 107 תאים/מ"ל (לצורך בדיקת פוטוטקסיס צלחת) או 1 x 106 תאים/מ"ל (לצורך בדיקת פוטוטקסיס ברמת התא או בדיקת תגובת פוטושוק) והכניסו את תרחיף התא לצינור חרוטי.
הערה: אין צורך לשלוט בצפיפות התאים בקפדנות רבה לצורך הערכה גסה של פוטו-התנהגותיים או שהיא יכולה להשתנות בהתאם למטרת הבדיקה. תמיסת ניסוי פוטובהאביור14: 5 mM HEPES (pH 7.4), 0.2 mM EGTA, 1 mM KCl, 0.3 mM CaCl2. ניתן להשמיט את שלב חילופי החיץ הזה לצורך בדיקה פשוטה על היכולת להציג פוטו-התנהגותיים, וניתן לבצע את הניסוי עם מדיום התרבות. עם זאת, מכיוון שההרכב היוני של התמיסה משפיע על סימנים פוטוטקטיים24, וההרכב היוני של המדיום לאחר התרבות עשוי שלא להיות קבוע, מומלץ להשתמש בתמיסה זו לבדיקה קפדנית יותר. החלפה במדיום TAP טרי יכולה להיות אופציה. - מקם את הצינור תחת אור אדום עמום (10-30 μmol פוטונים·m−2·s−1) במשך כשעה אחת (איור 2).
הערה: שלב זה מגביר את רגישות התאים לגירוי האור.

איור 2: מתלי תאים תחת אור אדום. אור לבן פלואורסצנטי רגיל מכוסה בסדין של צלופן אדום. צינור המכיל את תרחיף התא ממוקם תחת ~ 10 μmol פוטונים·m−2·s−1 אור אדום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
3. בדיקת פוטוטקסיס באמצעות צלחת פטרי (מה שמכונה "בדיקת כלים")
- מניחים תרחיף של 2-3 מ"ל בצלחת פטרי (3.5 ס"מ), מניחים אותה על תיבת אור (לחלופין, גיליון נייר לבן או צלחת פלסטיק לבנה), מנענעים בעדינות כדי לפזר את התאים באופן אחיד, ורוכשים תמונה לפני ההארה.
הערה: גודל המנה יכול להשתנות בהתאם למטרה. בהתאם לזן ולמצב התרבית, התאים עשויים להידבק לתחתית צלחת הפטרי. במקרה כזה, יש להסיר את התאים התקועים על ידי צנרת לפני הבדיקה. - האירו את המנה מצד אחד באמצעות דיודה ירוקה פולטת אור (LED, ראו טבלת חומרים) בחדר חושך שולחני (איור 3).
הערה: תנאי אור אופייניים הם λ = 525 ננומטר ו- 50-100 μmol פוטונים·m−2·s−1. ראה את הדיון על בחירת אורך הגל של מקור האור בפרק הדיון. מכסים גם את הכלים וגם את ה-LED בקופסה או בבד שחור כאשר נעשה שימוש ב-LED קטן. - השאירו אותם למשך ≥5 דקות ואז רכשו תמונות.
הערה: ניתן לשנות את זמן ההארה של האור בהתאם לגודל או למטרה של צלחת פטרי (איור 4). - יבא את קובץ התמונה לפיג'י (ראה טבלת חומרים) לצורך כימות.
הערה: פיג'י היא הפצה של ImageJ2, המאגדת תוספים רבים. - שנה את תמונת הצבע לגווני אפור באמצעות > תמונה סוג > 8 סיביות (איור 5).
- היפוך שחור-לבן באמצעות עריכה > הפוך.
- הקיפו את המנה כולה כאזור עניין (ROI) ומדדו את הצפיפות באמצעות ניתוח > מדידה.
הערה: ניתן לחשב את צפיפות המנה הכוללת כ- (שטח) x (ממוצע). - הקיפו את מחצית המנה הקרובה ביותר למקור האור כהחזר על ההשקעה ומדדו את הצפיפות.
- חשב את האינדקס הפוטוטקטי כ(צפיפות התאים הפוטוטקטיים) לכל (צפיפות התאים הכוללת).

איור 3: תאורה צדדית לתבשיל פוטוטקסיס. (A) צלחת פטרי המכילה תרחיף תא המונחת על תיבת אור בחדר חושך שולחני. אור ירוק (צלחת LED של 525 ננומטר, ~100 μmol פוטונים·m−2·s−1) מואר מהצד. (ב) שיטת תאורה חלופית. נורית LED מסוג כדור תותח 5 מ"מ. (C) כדי לחסום אור מבחוץ, ניתן להשתמש בקופסה עם מטלית שחורה מבפנים במקום בחדר חושך שולחני. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: דוגמה לפוטוטקסיס שלילי לאחר הארה צדדית של 5 דקות. רוב התאים הצטברו בצד הנגדי של מקור האור. נתונים אלה יכולים להתפרש כפוטוטקסיס שלילי. (B) תמונה של המנה מלמעלה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
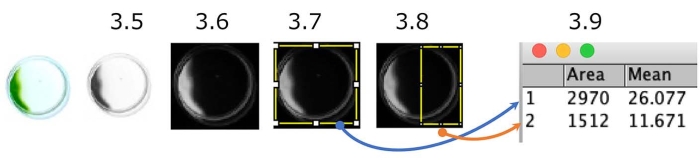
איור 5: כימות מבחן הפוטוטקסיס של המנה. דוגמה לתאים המציגים פוטוטקסיס שלילי (מקור האור נמצא בצד ימין). התמונה הצבעונית מומרת לגווני אפור (שלב 3.5.) ולאחר מכן הפוכה (שלב 3.6.). אזורי עניין (ROI), המנה כולה (שלב 3.7.) והמחצית הקלה של המנה (שלב 3.8.) היו מופרדים. הצפיפות של כל החזר השקעה נמדדה (שלב 3.9.). במקרה זה, האינדקס הפוטוטקטי (PI) הוא בערך 0.18 ([1,512 x 11.671] / [2,970 x 26.077]). PI הוא 1 או 0 כאשר כל התאים מראים פוטוטקסיס חיובי או שלילי, בהתאמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
4. בדיקת פוטוטקסיס באמצעות טיפות תרבית תאים
- יש להניח 25 μL של טיפות תרחיף התא (שלב 2.4.) ישירות על צלחת פלסטיק לבנה באמצעות מיקרופיפט.
- האירו את הטיפות מצד אחד באמצעות נורית LED ירוקה בחדר חושך שולחני (איור 6).
הערה: תנאי אור אופייניים הם λ = 525 ננומטר ו- 50-100 מיקרומול פוטונים m−2 s−1. כסו את שתי הצלחות ואת ה-LED בקופסה או בבד שחור כאשר נעשה שימוש בנורית LED קטנה. - השאירו אותם למשך 3 דקות ואז רכשו תמונות.
הערה: בדיקה זו מתאימה לבדיקה מהירה של פוטוטקסיס של דגימות רבות בבת אחת, כגון בהקרנה מוטנטית או בניתוח טטרד. תרבית תאים בשלב אמצע הלוג שגדלה בצלחת של 96 בארות יכולה להיות מוארת ישירות לביצועים קלים יותר. בשני המקרים, ניתן להשמיט את שלב 2 (טיפול מקדים בתא).

איור 6: בדיקת פוטוטקסיס טיפתית. (A) תשע טיפות של תרחיף תא של 25 μL המונחות על יריעת פלסטיק לבנה ומוארות מהצד על ידי נורית LED ירוקה. (ב) לאחר 3 דקות תאורה. בכל טיפה, תאים שהצטברו בצד מקור האור (פוטוטקסיס חיובי), הצטברו בצד הנגדי (פוטוטקסיס שלילי), או התפזרו לתוך הטיפה (ללא פוטוטקסיס). סרגל קנה מידה = 1 ס"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
5. בדיקת פוטוטקסיס תחת מיקרוסקופ
- קחו כ-30 μL של תרחיף התא (1 x 106 תאים/מ"ל בתמיסה ניסיונית של Photobehavior) על מגלשת זכוכית והניחו מכסה (18 מ"מ x 18 מ"מ) עם ספייסרים למעלה (איור 7).
הערה: ניתן להכין את המרווחים עם נפט לבן או סרטי דבק דו-צדדיים בשני צדדים מנוגדים של מכסה. האור צריך להגיע מכיוון שבו אין ספייסרים. - האירו את הדגימה מצד אחד של הכיסוי ללא ספייסר עם נורית LED ירוקה והתבוננו בתאים מתחת למיקרוסקופ שדה כהה עם עדשה אובייקטיבית של פי 10 תחת אור אדום עמום (λ > 630 ננומטר, ~5 μmol photons·m−2·s−1, איור 8).
הערה: הימנע מחשיפת התאים על הבמה לאור שאינו תאורת LED או תצפית, כגון תאורת חדר או אור מצג מחשב. ההגדלה המתאימה של עדשה אובייקטיבית תלויה בזווית הראייה של המצלמה. בחר עדשה עם הגדלה המאפשרת לתא לשחות במשך ~ 2 שניות מבלי לצאת משדה הראייה. כדי לעקוב אחר תאים, תמונה בניגודיות גבוהה רצויה; לפיכך, השימוש במעבה שדה כהה מומלץ לתצפית מיקרוסקופית. עם זאת, מעבים אחרים, כגון שדה בהיר, ניתן להשתמש כדי לצפות phototaxis. ודאו שהאור מ-LED זורח על התאים. - תעד את תנועת התאים במשך כ-20 שניות לאחר תאורת האור באמצעות מיקרוסקופ המצויד במצלמה.
הערה: מספר שניות לאחר תחילת תאורת ה-LED הירוקה, עלולה להתרחש תגובת פוטוסהוק, ו/או הכיוון הפוטוטקטי (או הסימן) אינו יציב; לפיכך, הקלטה של 20 שניות מומלצת לייצוב תגובה (סרט 1).

איור 7: יצירת מרווחים על קצוות כיסויים. (A) שכבה דקה של וזלין הוחלה על כף יד. כמות קטנה של נפט לבן נשרטה עם קצה של מכסה. (B) ספייסר בקצה של קליפת כיסוי. (C) ספייסר נוסף בקצה הנגדי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 8: תאורת צד מתחת למיקרוסקופ. נורית LED ירוקה מסוג כדור תותח מקובעת לעיסה ומקובעת למעמד שליד המיקרוסקופ. התאים נצפו תחת מיקרוסקופ שדה כהה עם מסנן חתך חד (λ > 630 ננומטר). (B) תאורת צד על ידי הנורית הירוקה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
סרט 1: בדיקת פוטוטקסיס תחת מיקרוסקופ. אור ירוק נדלק ב~0 שניות מימין. בשלב זה, התאים נטו לשחות בכיוון אקראי. לאחר 0 שניות במונה הזמן, התאים שחו ימינה או שמאלה, והראו פוטוטקסיס חיובי או שלילי. האור כבה במהירות של כ-15 שניות כאשר התאים החלו לשחות שוב בכיוון אקראי. סרגל קנה מידה = 100 μm. אנא לחץ כאן כדי להוריד סרט זה.
6. מעקב אחר תאים פוטוטקטיים וציור היסטוגרמה קוטבית
- חלץ 1.5 שניות מהסרטון המוקלט, החל מ-15 שניות לאחר ההארה.
הערה: משך המסלול יכול להשתנות בהתאם למהירות השחייה של התא. סרטון בגודל 1.5 שניות מכיל 46 פריימים בהקלטה של 30 פריימים לשנייה. - ייבא את הקובץ לפיג'י כרצף תמונות בתבנית קובץ תמונה של Tag Image באמצעות קובץ > ייבוא רצף תמונות >.
- הפעל את התוסף "מעקב ידני" למעקב אחר תאים באמצעות תוספים > מעקב > מעקב ידני.
- לחץ על הוסף רצועה, והמסגרת הראשונה תופיע.
- לחץ על תא עניין, והמסגרת השנייה מופיעה.
- הזז את המחוון למסגרת האחרונה ולחץ על אותו תא כמו בשלב 6.5.
הערה: אין צורך לעקוב אחר תאים בכל מסגרת. רק הזווית בין ציר האור למקטע הקו הנוצר על ידי נקודות ההתחלה והקצה היא חיונית. - חזור על שלבים 6.4.-6.6. עבור כ-30 תאים.
הערה: בחר תאים שנשארים בזווית הראייה עבור כל 1.5 שניות. אם צפיפות התא נמוכה מספיק ואין מסלולי שחייה של תאים שמצטלבים במשך 1.5 שניות, ניתן לבצע מעקב אוטומטי. במקרה כזה, בחר את התוסף "MTrack2" (הגדרות אופייניות: גודל אובייקט מינימלי = 1; גודל אובייקט מרבי = 10,000; מהירות מקסימלית = 100; אורך תיק מינימלי [מסגרות] = 46). מומלץ לאמת את ההתאמה בין התאים בסרטון ואת תוצאות המעקב על ידי קבלת הנתונים על ידי בדיקת טקסט הצג? > נקודות וקווים בשכבת-על. - העתק והדבק את התוצאות לתוכנת גיליון אלקטרוני (לדוגמה, Excel).
הערה: כאן מוצגת אופן הציור של היסטוגרמה קוטבית באמצעות Excel. - מדוד את הזווית בין ציר האור לבין כיוון השחייה של התא ב-"=degrees(atan2(x2-x1),-(y2-y1))", כאשר מיקום ההתחלה של התא (פרוסה מס' 1) הוא (x1, y1), והמיקום האחרון (פרוסה מס' 46) הוא (x2, y1).
הערה: בתמונת פיג'י, הפינה השמאלית העליונה היא המקור (0, 0). - חזור על שלב 6.9. עבור כל התאים שנמדדו (בדרך כלל כ-30 תאים).
- הכן טבלת התפלגות תדרים עבור כל הנתונים המתקבלים עם הפחים מ- −180° עד +180°, המחולקים ל- 15° בשני הקצוות ו- 30° עבור שאר הטווח באמצעות הפונקציה "תדר".
הערה: לאחר בחירת העמודות באופן מיידי לעמודות הסל, הזן את הפריטים הבאים בעמודה העליונה =תדר (data_array, bins_array) והקש shift + ctrl + Enter (איור משלים 1). - צור מחדש טבלת התפלגות תדרים עם הערכים המחושבים בשלב 6.8. סובב −90° כדי להגדיר את הצד הימני ל-0° (כלומר, להמיר את המספר בטווח שבין −15° ל-15°, לטווח שבין −105° ל-−75°), מכיוון שבשיטה הנ"ל, תאים ששוחים כלפי מעלה נחשבים לשחייה בזווית של 0° לאור (כלומר, מראים פוטוטקסיס חיובי), אם כי האור מגיע מימין (איור משלים 2).
- הזן את ערך הזווית באמצע הטווח של סל 30° (לדוגמה, 30° עבור 15°-45°), תוך דילוג על עמודה אחת והזן את ספירת הדגימות המתאימה מימינו (איור משלים 3).
- המר כל ערך ספירת דגימות לאחוז, והזן 0 בעמודה המתאימה לעמודה הריקה בין סלים.
- צייר תרשים מכ"ם תוך שימוש בערכי הזווית כתוויות הציר האופקי ובערכים האחוזיים (%) כמקרא (איור משלים 4).
- חשב את האינדקס הפוטוטקטי (PI) לכימות נוסף על ידי ממוצע cosθ (θ = הזווית בין ציר האור לבין כיוון השחייה)16.
הערה: PI הוא 0 כאשר תאים שוחים בכיוון אקראי ו-1 או −1 כאשר 100% מהתאים מראים פוטוטקסיס חיובי או שלילי, בהתאמה.
7. בדיקת תגובת פוטושוק תחת מיקרוסקופ
- הניחו כ-30 μL תרחיף תא (1 x 106 תאים/מ"ל בתמיסת הניסוי של Photobehavior) על מגלשת זכוכית, והניחו מכסה (18 מ"מ x 18 מ"מ) עם ספייסרים למעלה, כמו בשלב 4.1.
- התבונן בתאים תחת מיקרוסקופ עם אור אדום עמום (λ > 630 ננומטר, ~5 μmol פוטונים·m−2·s−1).
- החלת תאורת פלאש באמצעות מבזק מצלמה (סרט 2,3).
הערה: דרך נוספת לגרום לתגובת פוטוסהוק היא להסיר במהירות מסנן אדום ביד מנתיב תאורת התצפית. עם זאת, שיטה זו משתנה יותר מכיוון שמהירות הסרת המסנן משתנה מאדם לאדם (סרט 4,5). - תעדו את תנועת התאים באמצעות מיקרוסקופ המצויד במצלמה.
- לצורך כימות, בצע אחת מהפעולות הבאות או את שתיהן: (1) חשב את היחס בין התאים המציגים את תגובת הפוטשוק לכל סך כל התאים16; (2) עבור תאים המציגים את תגובת הפוטושוק, מדוד את הזמן מגירוי הפוטושוק ועד להתאוששות של שחייה קדימה25.
סרט 2: תאורת פוטושוק על ידי פלאש מצלמה. מבזק המצלמה הוחזק על במת המיקרוסקופ ונדלק. אנא לחץ כאן כדי להוריד את הסרט הזה.
סרט 3: תגובת פוטושוק הנגרמת על ידי הבזק מתחת למיקרוסקופ. התאים נצפו תחת אור אדום עמום. הבזק נפלט ב~ 0 שניות. כמעט כל התאים הפסיקו לשחות קדימה, שחו לאחור לתקופה קצרה והתאוששו בשחייה קדימה. סרגל קנה מידה = 100 μm. אנא לחץ כאן כדי להוריד סרט זה.
סרט 4: תגובת פוטושוק הנגרמת על ידי הסרת מסנן אדום מתחת למיקרוסקופ. התאים נצפו תחת אור אדום עמום. המסנן האדום הוסר ב~ 5 שניות. כמעט כל התאים הפסיקו לשחות קדימה, שחו לאחור לתקופה קצרה והתאוששו בשחייה קדימה. סרגל קנה מידה = 100 μm. אנא לחץ כאן כדי להוריד סרט זה.
סרט 5: הסרת מסנן אדום. הסרה מהירה של מסנן אדום הממוקם בנתיב האור כדי לספק צילום. אנא לחץ כאן כדי להוריד את הסרט הזה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
מבחני פוטוטקסיס טיפוסיים של C. reinhardtii ומבחני תגובה של פוטושוק מוצגים כאן. לאחר הערכת צפיפות התאים, תרבית תאים מסוג פרא (צאצא של הצלב CC-124 × CC-125 עם agg1+ mt -)23 נשטפה בתמיסה ניסיונית פוטו-התנהגותית לבדיקת צלחת הפוטוטקסיס. מתלי התא הונחו תחת אור אדום עמום במשך כשעה אחת. תרחיף של 2 מ"?...
Access restricted. Please log in or start a trial to view this content.
Discussion
הפרוטוקול הנוכחי קל ולא גוזל זמן. אם מוטנט C. reinhardtii חשוד בכך שהוא מציג פגמים בתפיסה פוטורציונלית או בתנועה ציליארית, שיטה זו יכולה לשמש כניתוח פנוטיפי ראשוני.
עם זאת, קיימים כמה צעדים קריטיים. האחת היא להשתמש בתאים בניסוי בשלב הצמיחה המוקדם עד אמצע הלוג. לאחר התרבות במשך...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך על ידי מענקים מהחברה היפנית לקידום המדע KAKENHI (https://www.jsps.go.jp/english/index.html) ל- NU (19K23758, 21K06295), TH (16H06556) ו- KW (19H03242, 20K21420, 21H00420), מקרן המדע של Ohsumi Frontier (https://www.ofsf.or.jp/en/) ל- KW, ומהברית הדינמית לחדשנות פתוחה המגשרת על האדם, הסביבה והחומרים (http://alliance.tagen.tohoku.ac.jp/english/) ל- NU, TH ו- KW.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| 5 mm Cannonball green LED | Optosupply | OSPG5161P | |
| 50 mL conical tube | SARSTEDT | 62.547.254 | |
| AC adaptor for the light box | ATTO | 2196161 | |
| Auto cell counter | DeNovix | CellDrop BF | |
| CaCl2 | Nakalai tesque | 06731-05 | |
| Camera flash | NEWWER | TT560 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strains CC-124 and CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| C-mout CCD camera | Wraymer | 1129HMN1/3 | |
| Desktop darkroom | Scientex | B-S8 | |
| Digital still camera | SONY | RX100II | |
| EGTA | Dojindo | G002 | |
| Fiji | https://fiji.sc/ | ||
| Green LED plate | CCS | ISLM-150X150-GG | |
| HCl | Fujifilm WAKO | 080-01066 | |
| HEPES | Dojindo | GB70 | |
| KCl | Nakalai tesque | 238514-75 | |
| Lightbox (Flat viewer) | ATTO | 2196160 | |
| Microscope | Olympus | BX-53 | |
| Petri dish (φ3.5 cm) | IWAKI | 1000-035 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Power supply for the green LED plate | CCS | ISC-201-2 | |
| Red filter | Shibuya Optical | S-RG630 |
References
- Demmig-Adams, B., Adams, W. W. Photoprotection and other responses of plants to high light stress. Annual Reviews Plant Physiology and Plant Molecular Biology. 43, 599-626 (1992).
- Wada, M. Chloroplast movement. Plant Science. 210, 177-182 (2013).
- Sgarbossa, A., Checcucci, G., Lenci, F. Photoreception and photomovements of microorganisms. Photochemical & Photobiological Sciences. 1 (7), 459-467 (2002).
- Ueki, N., et al. Eyespot-dependent determination of the phototactic sign in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 113 (19), 5299-5304 (2016).
- Foster, K. W., Smyth, R. D. Light antennas in phototactic algae. Microbiological Reviews. 44 (4), 572-630 (1980).
- Nagel, G., et al. Channelrhodopsin-1: a light-gated proton channel in green algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Sineshchekov, O. A., Jung, K. -H., Spudich, J. L. Two rhodopsins mediate phototaxis to low- and high-intensity light in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 99 (13), 8689-8694 (2002).
- Suzuki, T., et al. Archaeal-type rhodopsins in Chlamydomonas: model structure and intracellular localization. Biochemical and Biophysical Research Communications. 301 (3), 711-717 (2003).
- Berthold, P., et al. Channelrhodopsin-1 initiates phototaxis and photophobic responses in Chlamydomonas by immediate light-induced depolarization. Plant Cell. 20 (6), 1665-1677 (2008).
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. Journal of Neuroscience. 26 (41), 10380-10386 (2006).
- Wakabayashi, K., Isu, A., Ueki, N. Channelrhodopsin-dependent photo-behavioral responses in the unicellular green alga Chlamydomonas reinhardtii. Optogenetics (Advances in Experimental Medicine and Biology), 2nd ed. , Springer. 21-33 (2021).
- Rüffer, U., Nultsch, W. Flagellar photoresponses of Chlamydomonas cells held on micropipettes: II. Change in flagellar beat pattern. Cell Motility and the Cytoskeleton. 18 (4), 269-278 (1991).
- Kamiya, R., Hasegawa, E. Intrinsic difference in beat frequency between the two flagella of Chlamydomonas reinhardtii. Experimental Cell Research. 173, 299-304 (1987).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Horst, C. J., Witman, G. B. ptx1, a nonphototactic mutant of Chlamydomonas, lacks control of flagellar dominance. Journal of Cell Biology. 120 (3), 733-741 (1993).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature Reviews Molecular Cell Biology. 18 (9), 533-547 (2017).
- Ide, T., et al. Identification of the agg1 mutation responsible for negative phototaxis in a "wild-type" strain of Chlamydomonas reinhardtii. Biochemistry and Biophysics Reports. 7, 379-385 (2016).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Finst, R. J., Kim, P. J., Quarmby, L. M. Genetics of the deflagellation pathway in Chlamydomonas. Genetics. 149 (2), 927-936 (1998).
- Morel-Laurens, N. Calcium control of phototactic orientation in Chlamydomonas reinhardtii: sign and strength of response. Photochemistry and Photobiology. 45 (1), 119-128 (1987).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Wakabayashi, K., Misawa, Y., Mochiji, S., Kamiya, R. Reduction-oxidation poise regulates the sign of phototaxis in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 108 (27), 11280-11284 (2011).
- Harris, E. H. in The Chlamydomonas Sourcebook Second Edition. 1, Academic Press. Ch. 2 25-64 (2009).
- Mergenhagen, D. Circadian clock: genetic characterization of a short period mutant of Chlamydomonas reinhardii. European Journal of Cell Biology. 33 (1), 13-18 (1984).
- Ozasa, K., Lee, J., Song, S., Hara, M., Maeda, M. Two-dimensional optical feedback control of Euglena confined in closed-type microfluidic channels. Lab on a Chip. 11 (11), 1933-1940 (2011).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138(2021).
- Ueno, Y., Aikawa, S., Kondo, A., Akimoto, S. Adaptation of light-harvesting functions of unicellular green algae to different light qualities. Photosynthesis Research. 139 (1-3), 145-154 (2019).
- Takahashi, T., Watanabe, M. Photosynthesis modulates the sign of phototaxis of wild-type Chlamydomonas reinhardtii. Effects of red background illumination and 3-(3',4'-dichlorophenyl)-1,1-dimethylurea. FEBS Letters. 336 (3), 516-520 (1993).
- Morishita, J., Tokutsu, R., Minagawa, J., Hisabori, T., Wakabayashi, K. I. Characterization of Chlamydomonas reinhardtii mutants that exhibit strong positive phototaxis. Plants (Basel). 10 (7), (2021).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Inaba, K. Calcium sensors of ciliary outer arm dynein: functions and phylogenetic considerations for eukaryotic evolution. Cilia. 4 (1), 6(2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved