Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Chlamydomonas reinhardtii'de Fotodavranışın Gözlemlenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Çoğu yüzme fotoototrofik organizması, foto-kaynaklı davranış değişiklikleri (fotodavranış) gösterir. Mevcut protokol, Chlamydomonas reinhardtii model organizmasında söz konusu fotodavranışı gözlemlemektedir.
Özet
Hareketli fototrofik mikroorganizmaların hayatta kalması için, uygun ışık koşulları altında olmak çok önemlidir. Sonuç olarak, foto-kaynaklı davranışlar (veya fotodavranış) gösterirler ve ışığa tepki olarak hareket yönlerini değiştirirler. Tipik fotodavranışlar fotoşok (veya fotofobik) tepki ve fototaksileri içerir. Fotoşok, organizmaların geçici olarak hareket etmeyi bıraktığı veya geriye doğru hareket ettiği ışık yoğunluğundaki ani bir değişikliğe (örneğin, flaş aydınlatması) bir cevaptır. Fototaksiler sırasında, organizmalar ışık kaynağına doğru veya ters yönde hareket eder (sırasıyla pozitif veya negatif fototaksi olarak adlandırılır). Tek hücreli yeşil alg Chlamydomonas reinhardtii , foto-davranışı incelemek için mükemmel bir organizmadır, çünkü fotoresepsiyondan sonra kirpiklerin (diğer adıyla flagella) dövülmesini modüle ederek yüzme düzenini hızla değiştirir. Burada, C. reinhardtii'deki fotodavranışları gözlemlemek için çeşitli basit yöntemler gösterilmiştir. C. reinhardtii'nin fotodavranışları üzerine yapılan araştırmalar, ökaryotik kirpikler ve kanalrodopsinler arasında ortak düzenleyici mekanizmaların keşfedilmesine yol açmıştır, bu da siliyopatilerin daha iyi anlaşılmasına ve yeni optogenetik yöntemlerin geliştirilmesine katkıda bulunabilir.
Giriş
Işık, fotosentetik organizmalar için vazgeçilmez bir enerji kaynağıdır, ancak çok fazla ışık foto-oksidatif hasara neden olabilir. Bu nedenle, fototrofik organizmaların, fotosentez yapabilecekleri ancak foto-oksidatif hasara maruz kalmayabilecekleri orta yoğunluklu ışık altında hayatta kalmaları gerekir1. Kara bitkilerinde, kloroplastlar yapraktan dışarı çıkamaz ve hücredeki fotoğraf hareketlerini gösteremez; kloroplastlar, yüksek ışık altında hücrenin çevresine ve düşük ışık altında hücre yüzeyine hareket eder2, oysa birçok hareketli alg, fotosentez için uygun ışık koşullarını bulmalarını sağlayan ve böylece hayatta kalmalarını kolaylaştıran fotodavranışlar gösterir3.
Chlamydomonas reinhardtii, kirpikler (a.k.a., flagella), fotosentez ve fotodavranış gibi araştırma alanlarında model organizma olarak kabul edilen tek hücreli yeşil bir algdir. C. reinhardtii, sırasıyla fotoresepsiyon ve yüzme için kullanılan hücre başına bir göz lekesi ve iki kirpik sunar. Göz lekesinin iki bileşeni vardır: kanalrodopsinler (ChR'ler), plazma zarındaki ışık kapılı iyon kanalları ve ChR'lerin hemen arkasında bulunan karotenoid bakımından zengin granül tabakaları. Göz lekesi, karotenoid bakımından zengin granül tabakaları bir ışık reflektörü olarak işlev gördüğü için yönlü bir ışık reseptörü görevi görür 4,5.
ChR'ler başlangıçta C. reinhardtii 6,7,8,9'da fotobehaviors'a neden olan fotoreseptörler olarak tanımlandı. Göz çukurunda iki izoform, ChR1 ve ChR2 bulunmasına rağmen, yıkma deneyleri, ChR1'in fotodavranışlar10 için birincil fotoreseptör olduğunu göstermiştir. Buna rağmen, ChR2 daha fazla dikkat çekti ve ışık11 ile hücre uyarımını kontrol etmek için bir teknik olan optogenetiğin geliştirilmesinde merkezi bir rol oynadı. Bu nedenle, C. reinhardtii'deki fotodavranışları yöneten düzenleyici mekanizmaların incelenmesi, ChR fonksiyonunun anlaşılmasını daha da ileri götürecek ve optogenetiği geliştirecektir.
Fotoresepsiyondan sonra, C. reinhardtii hücreleri iki tür fotodavranış gösterir: fototaksis ve fotoşok tepkisi12. Fototaksis, sırasıyla pozitif veya negatif fototaksis olarak adlandırılan ışık kaynağı yönünde veya ters yönde yüzen hücrelerin davranışıdır. Fotoşok tepkisi, hücrelerin bir flaşla aydınlatıldığında olduğu gibi ışık yoğunluğundaki ani bir değişikliği algıladıktan sonra gösterdiği bir davranıştır. Hücreler yüzmeyi bırakır veya geriye doğru yüzer (yani, hücre gövdesi ileri doğru yüzer), tipik olarak <1 s.
C. reinhardtii'deki siliyer hareketler fotodavranışlarında rol oynar. İki kirpik genellikle bir insanın kurbağalama yüzmeye çarpması gibi yener ve bu fotodavranışlar için modüle edilir. Fototaksiler için, iki kirpik tarafından üretilen kuvvetler, atma frekansının modülasyonu ve her bir siliyum13'ün dalga formu genliği ile dengesizdir. Göz noktasına en yakın siliuma cis cilium, diğerine trans cilium denir. Bu iki kirpik çeşitli noktalarda farklılık gösterir. Örneğin, in vitro transsiliumun siliyer atma sıklığı% 30 -% 40 daha yüksektir14. Ek olarak, Ca2 + hassasiyetleri farklıdır. Hatırlanan hücre modellerininreaktivasyonu 15, cis siliumunun Ca 2+ <1 x 10−8 M için trans siliumdan daha güçlü bir şekilde attığını, bunun tersinin ise Ca2+ >1 x 10−7 M için geçerli olduğunu göstermiştir. Ca2+ duyarlılığındaki bu asimetri, fototaktik dönüşler için muhtemelen önemlidir, çünkü bu asimetriye sahip olmayan mutantlar normal fototaksis16,17 göstermez. Tersine, fotoşok için dalga formu dönüşümü gereklidir. Siliyer dalga formu, ileri yüzmedeki asimetrik dalga formundan geriye doğru yüzmedeki simetrik dalga formuna dönüşür. Bu dalga formu dönüşümü aynı zamanda Ca2+ tarafından 1 x 10−4 M18,19 eşiğinde düzenlenir. Siliyer hareketlerin düzenlenmesindeki kusurlar insanlarda primer siliyer diskineziye neden olduğundan, C. reinhardtii'deki fotodavranışların incelenmesi bu hastalıkların ve terapötik gelişmelerin daha iyi anlaşılmasına yardımcı olabilir20.
Burada, C. reinhardtii'deki fotodavranışları gözlemlemek için dört basit yöntem gösterilmiştir. İlk olarak, Petri kaplarını kullanan bir fototaksis testi gösterilir ve ikincisi, hücre süspansiyon damlacıklarına karşı bir fototaksis testi gösterilir. Her iki durumda da gözlemlenen fenomen kesinlikle fototaksis değil, hücrelerin ışık kaynağı tarafına veya karşı tarafa yakın birikme eğiliminde olduğu fotoğraf birikimidir. C. reinhardtii'de, fotoğraf birikimi esas olarak fototaksilere bir yaklaşım olarak kullanılabilecek şekilde fototaksislerden kaynaklanır. Üçüncüsü, mikroskop altında fototaksiler için daha titiz bir tahlil gösterilir ve sonuncusu mikroskop altında bir fotoşok testidir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu çalışmada, çapraz CC-124 x CC-125'in agg1+mt- ile soyundan gelen Chlamydomonas reinhardtii'nin vahşi tipte bir suşu21 kullanılmıştır. CC-124 ve CC-125, Chlamydomonas Kaynak Merkezi'nden elde edildi ( Malzeme Tablosuna bakınız) ve 20-25 ° C'de bir Tris-asetat-fosfat (TAP) 22,% 1.5 agaroz ortamında tutuldu. Bu protokol için herhangi bir hareketli gerinim kullanılabilir.
1. Hücre kültürü
- Kültür, Chlamydomonas reinhardtii'nin TAP sıvı ortamında, steril havayı 12 saat / 12 saat açık-karanlık dönemde (ışık periyodu, ~ 50 μmol fotonlar · m − 2 · s − 1 beyaz ışık) 2 gün boyunca 20-25 ° C'de köpürterek havalandırma ile ilgilendiği bir suş kültürüdür.
NOT: Logaritmik büyüme evresinin ortasındaki hücrelerin kullanılması gerekir. Uzun kültür (>3 gün, geç logaritmik büyüme aşamasında), hücreleri ışık uyaranına karşı daha az duyarlı hale getirir ve kültürdeki ölü hücrelerin sayısını artırarak sonuçların okunmasını engeller.

Resim 1: 2 günlük kültürlemeden sonra sıvı kültür. Bir TAP-1.5% agar plakasından, platin döngüsünü dolduran vahşi tip hücrelerin bir parçası, bir şişede ~ 150 mL TAP sıvı ortamına aşılandı. 2 günlük kültürden sonra hücre yoğunluğu ~ 5.0 x 106 hücre / mL idi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. Hücrelerin ön tedavisi
- Hücrelerin yüzmesini durdurmak ve bir hücre sayacı veya hemositometre kullanarak hücre yoğunluğunu ölçmek için kültürün ~ 10 μL'sini eşit hacimli bir desiliasyon çözeltisi ile karıştırın.
NOT: 2 günlük bir kültürden sonra yaklaşık 1-5 x 106 hücre/mL vardır (Şekil 1). Sapma çözeltisinin bileşimi aşağıdaki gibidir23: 40 mM potasyum asetat, 1 mM CaCl2, pH 4.5 HCl ile ayarlanmış. - Gerekli sıvı kültür miktarını oda sıcaklığında 3 dakika boyunca 1000 x g'da santrifüj edin.
NOT: Bir deney, Petri kabında fototaksis testi için standart koşullar için 3 mL'lik 2 x 107 hücre/mL gerektirir. 1 x 106 hücre/mL kültür ile iki deney yapılacaksa, 120 mL kültürün santrifüj edilmesi gerekir. - Hücre peletini gerekli miktarda fotodavranış deneysel çözeltisi ile ~ 2 x 107 hücre / mL (çanak fototaksis testi için) veya 1 x 106 hücre / mL'ye (hücre düzeyinde fototaksis testi veya fotoşok yanıt testi için) askıya alın ve hücre süspansiyonunu konik bir tüpe koyun.
NOT: Fotodavranışların kabaca tahmin edilmesi için hücre yoğunluğunun çok sıkı bir şekilde kontrol edilmesine gerek yoktur veya tahlilin amacına bağlı olarak değişebilir. Fotodavranışsal deneysel çözelti14: 5 mM HEPES (pH 7.4), 0.2 mM EGTA, 1 mM KCl, 0.3 mM CaCl2. Bu tampon değişim adımı, fotodavranışlar sergileme yeteneği üzerine basit bir test için atlanabilir ve deney kültür ortamı ile gerçekleştirilebilir. Bununla birlikte, çözeltinin iyonik bileşimi fototaktik işaretleri24 etkilediğinden ve kültürlemeden sonra ortamın iyonik bileşimi sabit olmayabileceğinden, bu çözeltinin daha titiz bir tahlil için kullanılması önerilir. Taze TAP ortamı ile değiştirme bir seçenek olabilir. - Tüpü ~1 saat boyunca loş kırmızı ışığın (10-30 μmol fotonlar·m−2·s−1) altına yerleştirin (Şekil 2).
NOT: Bu adım, hücrelerin ışık uyaranına duyarlılığını arttırır.

Şekil 2: Kırmızı ışık altında hücre süspansiyonu. Bir kırmızı selofan tabakası ile kaplı normal bir floresan beyaz ışık. Hücre süspansiyonunu içeren bir tüp ~ 10 μmol foton · m − 2 · s − 1 kırmızı ışığın altına yerleştirilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
3. Petri kabını kullanarak fototaksis testi ("çanak testi" olarak adlandırılır)
- Bir Petri kabına (3,5 cm) 2-3 mL hücre süspansiyonu koyun, bir ışık kutusuna (alternatif olarak, beyaz bir kağıt yaprağı veya beyaz bir plastik plaka) yerleştirin, hücreleri düzgün bir şekilde dağıtmak için hafifçe sallayın ve aydınlatmadan önce bir resim elde edin.
NOT: Çanak boyutu amaca bağlı olarak değişebilir. Suşa ve kültürün durumuna bağlı olarak, hücreler Petri kabının dibine yapışabilir. Böyle bir durumda, sıkışmış hücrelerin tahlilden önce pipetleme ile çıkarılması gerekir. - Çanağı bir taraftan masaüstünün karanlık odasında yeşil ışık yayan bir diyot (LED, bkz. Malzeme Tablosu) ile aydınlatın (Şekil 3).
NOT: Tipik ışık koşulları λ = 525 nm ve 50-100 μmol fotonlar·m−2·s−1'dir. Tartışma bölümündeki ışık kaynağı dalga boyunun seçilmesiyle ilgili tartışmaya bakın. Küçük bir LED kullanıldığında hem bulaşıkları hem de LED'i bir kutu veya siyah bezle örtün. - Onları ≥5 dakika bekletin ve ardından görüntüleri alın.
NOT: Işık aydınlatma süresi, Petri kabının boyutuna veya amacına bağlı olarak değiştirilebilir (Şekil 4). - Nicelik için resim dosyasını Fiji'ye aktarın (bkz.
NOT: Fiji, birçok eklentiyi bir araya getiren ImageJ2'nin bir dağıtımıdır. - Resim > Türü > 8 bit (Şekil 5) aracılığıyla renkli resmi gri tonlamalı olarak değiştirin.
- Düzenle ve Ters Çevir > siyah beyazı tersine çevirin.
- Tüm yemeği bir ilgi alanı (ROI) olarak çevreleyin ve yoğunluğu Analiz > Ölçüm ile ölçün.
NOT: Toplam çanağın yoğunluğu (Alan) x (Ortalama) olarak hesaplanabilir. - Çanağın yarısını ışık kaynağına en yakın kısmını ROI olarak çevreleyin ve yoğunluğu ölçün.
- Fototaktik indeksi (toplam hücrelerin yoğunluğu) başına (fototaktik hücrelerin yoğunluğu) olarak hesaplayın.

Şekil 3: Fototaksis çanağı testi için yan aydınlatma . (A) Masaüstü karanlık odadaki bir ışık kutusuna yerleştirilmiş bir hücre süspansiyonu içeren bir Petri kabı. Yeşil ışık (525 nm LED plaka, ~100 μmol fotonlar·m−2·s−1) yandan aydınlatılır. (B) Alternatif aydınlatma yöntemi. 5 mm'lik top mermisi tipi LED. (C) Dışarıdan gelen ışığı engellemek için, masaüstü karanlık odası yerine içinde siyah bez bulunan bir kutu kullanılabilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: 5 dakikalık yan aydınlatmadan sonra negatif fototaksi örneği . (A) 5 dakika boyunca aydınlatılmış bir Petri kabındaki vahşi tip hücre süspansiyonu. Çoğu hücre ışık kaynağının karşı tarafında birikmiştir. Bu veriler negatif fototaksiler olarak yorumlanabilir. (B) Çanağın üstten görüntüsü. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
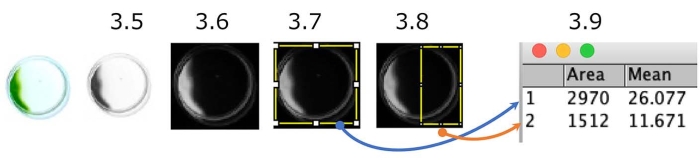
Şekil 5: Çanak fototaksi testinin nicelleştirilmesi. Negatif fototaksis gösteren hücrelere bir örnek (ışık kaynağı sağ taraftadır). Renkli resim gri tonlamaya dönüştürülür (Adım 3.5.) ve sonra ters çevrilir (Adım 3.6.). İlgilenilen bölgeler (ROI), tüm yemek (Adım 3.7.) ve yemeğin ışık kaynağı tarafı yarısı (Adım 3.8.) sınırlandırıldı. Her ROI'nin yoğunluğu ölçüldü (Adım 3.9.). Bu durumda, fototaktik indeks (PI) yaklaşık 0,18'dir ([1.512 x 11.671] / [2.970 x 26.077]). PI, tüm hücreler sırasıyla pozitif veya negatif fototaksis gösterdiğinde 1 veya 0'dır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. Hücre kültürü damlacıkları kullanarak fototaksis testi
- 25 μL hücre süspansiyon damlacıklarını (Adım 2.4.) bir mikropipet kullanarak doğrudan beyaz plastik bir plakaya yerleştirin.
- Masaüstü karanlık odasında damlacıkları bir taraftan yeşil bir LED ile aydınlatın (Şekil 6).
NOT: Tipik ışık koşulları λ = 525 nm ve 50-100 μmol fotonlar m−2 s−1'dir. Küçük bir LED kullanıldığında hem plakaları hem de LED'i bir kutu veya siyah bir bezle örtün. - Onları 3 dakika bekletin ve ardından görüntüleri alın.
NOT: Bu tahlil, mutant tarama veya tetrad analizi gibi birçok numunenin fototaksisinin aynı anda hızlı bir şekilde kontrol edilmesi için uygundur. 96 delikli bir plakada yetiştirilen orta kütük fazındaki bir hücre kültürü, daha kolay performans için doğrudan aydınlatılabilir. Her iki durumda da, Adım 2 (hücre ön işlemi) atlanabilir.

Şekil 6: Damlacık fototaksis testi . (A) Beyaz plastik bir tabaka üzerine yerleştirilmiş ve yandan yeşil bir LED ile aydınlatılmış 25 μL hücre süspansiyonunun dokuz damlacığı. (B) 3 dakikalık aydınlatmadan sonra. Her damlacıkta, hücreler ya ışık kaynağı tarafında birikmiş (pozitif fototaksis), karşı tarafta birikmiş (negatif fototaksis) ya da damlacığa yayılmıştır (fototaksi yoktur). Ölçek çubuğu = 1 cm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
5. Mikroskop altında fototaksis testi
- Bir cam slayt üzerine ~ 30 μL hücre süspansiyonu (fotodavranışsal deneysel çözeltide 1 x 106 hücre / mL) alın ve üstüne ara parçalar içeren bir kapak kayması (18 mm x 18 mm) yerleştirin (Şekil 7).
NOT: Ara parçalar, bir kapak kapağının iki zıt tarafında beyaz petrol veya çift taraflı yapışkan bantlarla yapılabilir. Işığın, ara parçaların olmadığı bir yönden gelmesi gerekir. - Numuneyi yeşil LED'li bir ara parça olmadan kapak kapağının bir tarafından aydınlatın ve loş kırmızı ışık altında 10x objektif lensle karanlık alan mikroskobu altındaki hücreleri gözlemleyin (λ > 630 nm, ~5 μmol fotonlar · m − 2 · s − 1, Şekil 8).
NOT: Sahnedeki hücreleri, oda aydınlatması veya PC monitöründen gelen ışık gibi LED veya gözlem ışığı dışındaki ışığa maruz bırakmaktan kaçının. Objektif bir lensin uygun şekilde büyütülmesi, kameranın görüş açısına bağlıdır. Hücrenin görüş alanından çıkmadan ~ 2 s yüzmesini sağlayan büyütmeli bir lens seçin. Hücreleri izlemek için yüksek kontrastlı bir görüntü arzu edilir; Bu nedenle, mikroskobik gözlem için karanlık alan kondenserinin kullanılması önerilir. Bununla birlikte, parlak alan gibi diğer kondansatörler fototaksileri gözlemlemek için kullanılabilir. LED'den gelen ışığın hücreler üzerinde parladığından emin olun. - Kamera donanımlı bir mikroskop kullanarak ışık aydınlatmasından sonra ~ 20 s hücre hareketini kaydedin.
NOT: Yeşil LED aydınlatmanın başlamasından birkaç saniye sonra, bir fotoşok tepkisi oluşabilir ve/veya fototaktik yönelim (veya işaret) sabit değildir; bu nedenle, yanıt sabitleme için 20 sn'lik bir kayıt önerilir (Film 1).

Şekil 7: Kapak kayma kenarlarında ara parçalar yapılması . (A) Bir elin avucuna ince bir vazelin tabakası uygulandı. Az miktarda beyaz petrol, bir kapak kapağının kenarı ile kazındı. (B) Bir kapak kapağının kenarındaki ara parça. (C) Karşı kenardaki başka bir ara parça. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 8: Mikroskop altında yan aydınlatma . (A) Yeşil LED'in kurulumu. Top mermisi tipi yeşil bir LED, muff ve mikroskop yanındaki standa sabitlenir. Hücreler, keskin bir kesme filtresine sahip karanlık alan mikroskobu altında gözlendi (λ > 630 nm). (B) Yeşil LED ile yandan aydınlatma. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Film 1: Mikroskop altında fototaksis tahlili. Yeşil ışık sağdan ~ 0 sn hızla yanıyordu. Bu noktada, hücreler rastgele bir yönde yüzmeye meyilliydi. Zaman sayacında 0 s'den sonra, hücreler pozitif veya negatif fototaksiler göstererek sağa veya sola yüzdüler. Işık, hücreler tekrar rastgele bir yönde yüzmeye başladığında ~ 15 s'de kapatıldı. Ölçek çubuğu = 100 μm. Bu Filmi indirmek için lütfen buraya tıklayın.
6. Fototaktik hücrelerin izlenmesi ve polar histogram çizimi
- Aydınlatmadan sonra 15 sn başlayarak kaydedilen videodan 1,5 s ayıklayın.
NOT: Yörünge süresi, hücrenin yüzme hızına bağlı olarak değişebilir. 1,5 sn'lik bir video, 30 fps kayıtta 46 kare içerir. - Dosya > İçe Aktar > Görüntü Dizisi aracılığıyla dosyayı Fiji'ye Etiket Görüntü Dosyası Biçimi görüntü dizisi olarak içe aktarın.
- Manuel İzleme Eklentileri > Manuel İzleme kullanarak hücre izleme için " Manuel İzleme" > çalıştırın.
- Parça ekle'ye tıklayın ve ilk kare görünür.
- İlgilendiğiniz bir hücreye tıklayın ve ikinci kare görünür.
- Kaydırıcıyı son kareye taşıyın ve Adım 6.5'teki hücreyle aynı hücreyi tıklatın.
NOT: Her karedeki hücreleri izlemek gerekli değildir. Sadece ışık ekseni ile başlangıç ve bitiş noktalarının oluşturduğu çizgi segmenti arasındaki açı esastır. - 6.4.-6.6 arasındaki adımları yineleyin. ~ 30 hücre için.
NOT: 1,5 saniyenin tamamı için görüş açısı içinde kalan hücreleri seçin. Hücre yoğunluğu yeterince düşükse ve hücre yüzme yörüngeleri 1,5 sn boyunca kesişmiyorsa, otomatik izleme yapılabilir. Bu durumda, "MTrack2" eklentisini seçin (tipik ayarlar: Minimum Nesne Boyutu = 1; Maksimum nesne boyutu = 10.000; Maksimum Hız = 100; Minimum Yapışma Uzunluğu [Çerçeveler] = 46). Videodaki hücreler arasındaki yazışmaları ve izleme sonuçlarını, Metni göster? > Bindirme Noktaları ve Çizgileri'ni işaretleyerek verileri elde ederek doğrulamanız önerilir. - Sonuçları kopyalayıp elektronik tablo yazılımına (ör. Excel) yapıştırın.
NOT: Burada, Excel ile kutupsal histogramın nasıl çizileceği gösterilmektedir. - Işık ekseni ile hücrenin yüzme yönü arasındaki açıyı "= derece(atan2(x2-x1),-(y2-y1))" ile ölçün, burada hücrenin başlangıç konumu (dilim #1) (x1, y1) ve son konum (dilim #46) (x2, y1) olur.
NOT: Fiji görüntüsünde, sol üst köşe orijindir (0, 0). - Adım 6.9'u yineleyin. ölçülen tüm hücreler için (tipik olarak ~ 30 hücre).
- "FREQUENCY" fonksiyonunu kullanarak -180° ila +180° arasındaki bölmelerle elde edilen, her iki uçta 15°'ye ve aralığın geri kalanı için 30°'ye bölünmüş tüm veriler için bir frekans dağılım tablosu hazırlayın.
NOT: Sütunları hemen bölme sütunlarına seçtikten sonra, üst sütuna = SIKLIK (data_array, bins_array) içine aşağıdakileri girin ve shift + ctrl + enter tuşlarına basın (Ek Şekil 1). - Adım 6.8'de hesaplanan değerlerle bir frekans dağılım tablosunu yeniden oluşturun. sağ tarafı 0°'ye ayarlamak için -90° döndürülür (yani, -15° ila 15° aralığındaki sayıyı -105° ila -75° aralığına dönüştürün), çünkü yukarıdaki yöntemle, yukarı doğru yüzen hücrelerin, ışık sağdan gelmesine rağmen ışığa 0° açıyla yüzdüğü (yani, pozitif fototaksiler gösteren) kabul edilir (Ek Şekil 2).
- Bir sütunu atlayarak 30° bölme aralığının ortasına açı değerini girin (örneğin, 15°-45° için 30°), ve sağına karşılık gelen örnek sayısını girin (Ek Şekil 3).
- Her örnek sayısı değerini bir yüzdeye dönüştürün ve kutular arasındaki boş sütuna karşılık gelen sütuna 0 girin.
- Açı değerlerini yatay eksen etiketleri olarak ve yüzdelik (%) değerlerini gösterge olarak kullanarak bir radar grafiği çizin (Ek Şekil 4).
- Cosθ'nun ortalamasını alarak daha fazla niceleme için fototaktik indeksi (PI) hesaplayın (θ = ışık ekseni ile yüzme yönü arasındaki açı)16.
NOT: PI, hücreler rastgele bir yönde yüzerken 0 ve hücrelerin% 100'ü sırasıyla pozitif veya negatif fototaksis gösterdiğinde 1 veya -1'dir.
7. Mikroskop altında fotoşok yanıt testi
- Bir cam slayt üzerine ~ 30 μL hücre süspansiyonu (fotodavranış deneysel çözeltisinde 1 x 106 hücre / mL) yerleştirin ve Adım 4.1'de olduğu gibi üstüne ara parçalar içeren bir kapak kayması (18 mm x 18 mm) yerleştirin.
- Hücreleri mikroskop altında loş kırmızı ışıkla gözlemleyin (λ > 630 nm, ~5 μmol fotonlar·m−2·s−1).
- Fotoğraf makinesi flaşı kullanarak flaş aydınlatması uygulayın (Film 2,3).
NOT: Fotoşok tepkisini tetiklemenin bir başka yolu da gözlem ışığı yolundan kırmızı bir filtreyi elle hızlı bir şekilde çıkarmaktır. Ancak filtre çıkarma hızı kişiden kişiye değiştiği için bu yöntem daha değişkendir (Film 4,5). - Kamera donanımlı bir mikroskop kullanarak hücre hareketini kaydedin.
- Niceleme için, aşağıdakilerden birini veya her ikisini de gerçekleştirin: (1) toplam hücreler başına fotoşok tepkisini gösteren hücrelerin oranını hesaplayın16; (2) Fotoşok tepkisini gösteren hücreler için, fotoşok uyaranından ileri yüzmenin iyileşmesine kadar geçen süreyi ölçün25.
Film 2: Kamera flaşı ile fotoşok aydınlatma. Kamera flaşı mikroskop aşamasına kadar tutuldu ve açıldı. Bu Filmi indirmek için lütfen tıklayınız.
Film 3: Mikroskop altında bir flaşın neden olduğu fotoşok tepkisi. Hücreler loş kırmızı ışık altında gözlendi. ~0 s'de bir flaş yayıldı. Hemen hemen tüm hücreler ileri yüzmeyi bıraktı, kısa bir süre geriye doğru yüzdü ve ileri yüzmeyi bıraktı. Ölçek çubuğu = 100 μm. Bu Filmi indirmek için lütfen buraya tıklayın.
Film 4: Kırmızı bir filtrenin mikroskop altında çıkarılmasından kaynaklanan fotoşok tepkisi. Hücreler loş kırmızı ışık altında gözlendi. Kırmızı filtre ~ 5 sn'de kaldırıldı. Hemen hemen tüm hücreler ileri yüzmeyi bıraktı, kısa bir süre geriye doğru yüzdü ve ileri yüzmeyi bıraktı. Ölçek çubuğu = 100 μm. Bu Filmi indirmek için lütfen buraya tıklayın.
Film 5: Kırmızı filtrenin kaldırılması. Fotoşok sağlamak için ışık yolunda ayarlanan kırmızı filtrenin hızlı bir şekilde çıkarılması. Bu Filmi indirmek için lütfen tıklayınız.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Tipik C. reinhardtii fototaksileri ve fotoşok yanıt testleri burada gösterilmiştir. Hücre yoğunluğu tahmininden sonra, vahşi tip hücre kültürü (çapraz CC-124 × CC-125'in agg1 + mt -) 23 soyu, fototaksis çanağı testi için fotodavranışsal deneysel çözelti ile yıkandı. Hücre süspansiyonu ~ 1 saat boyunca loş kırmızı ışık altında yerleştirildi. 3.5 cm'lik bir Petri kabına 2 mL'lik bir hücre süspansiyonu yerleştirildi. Petri kabı nazikçe çalkalandı, b...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Mevcut protokol kolaydır ve zaman alıcı değildir. Bir C. reinhardtii mutantının fotoalımda veya siliyer harekette kusurlarla ortaya çıktığından şüpheleniliyorsa, bu yöntem birincil fenotipik analiz olarak hizmet edebilir.
Ancak, bazı kritik adımlar mevcuttur. Birincisi, deneydeki hücreleri erken ila orta günlük büyüme aşamasında kullanmaktır. Uzun süre kültürlendikten sonra, hücreler daha az hareketli, daha az ışığa duyarlı hale gelir ve hatta palmell...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, Japonya Bilimi Geliştirme Derneği KAKENHI'den (https://www.jsps.go.jp/english/index.html) NU'ya (19K23758, 21K06295), TH (16H06556) ve KW (19H03242, 20K21420, 21H00420), Ohsumi Sınır Bilim Vakfı'ndan (https://www.ofsf.or.jp/en/) KW'ye ve İnsan, Çevre ve Malzeme Köprüsü için Dinamik İttifak'tan (http://alliance.tagen.tohoku.ac.jp/english/) NU, TH'ye ve KW'ye hibelerle desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| 5 mm Cannonball green LED | Optosupply | OSPG5161P | |
| 50 mL conical tube | SARSTEDT | 62.547.254 | |
| AC adaptor for the light box | ATTO | 2196161 | |
| Auto cell counter | DeNovix | CellDrop BF | |
| CaCl2 | Nakalai tesque | 06731-05 | |
| Camera flash | NEWWER | TT560 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strains CC-124 and CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| C-mout CCD camera | Wraymer | 1129HMN1/3 | |
| Desktop darkroom | Scientex | B-S8 | |
| Digital still camera | SONY | RX100II | |
| EGTA | Dojindo | G002 | |
| Fiji | https://fiji.sc/ | ||
| Green LED plate | CCS | ISLM-150X150-GG | |
| HCl | Fujifilm WAKO | 080-01066 | |
| HEPES | Dojindo | GB70 | |
| KCl | Nakalai tesque | 238514-75 | |
| Lightbox (Flat viewer) | ATTO | 2196160 | |
| Microscope | Olympus | BX-53 | |
| Petri dish (φ3.5 cm) | IWAKI | 1000-035 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Power supply for the green LED plate | CCS | ISC-201-2 | |
| Red filter | Shibuya Optical | S-RG630 |
Referanslar
- Demmig-Adams, B., Adams, W. W. Photoprotection and other responses of plants to high light stress. Annual Reviews Plant Physiology and Plant Molecular Biology. 43, 599-626 (1992).
- Wada, M. Chloroplast movement. Plant Science. 210, 177-182 (2013).
- Sgarbossa, A., Checcucci, G., Lenci, F. Photoreception and photomovements of microorganisms. Photochemical & Photobiological Sciences. 1 (7), 459-467 (2002).
- Ueki, N., et al. Eyespot-dependent determination of the phototactic sign in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 113 (19), 5299-5304 (2016).
- Foster, K. W., Smyth, R. D. Light antennas in phototactic algae. Microbiological Reviews. 44 (4), 572-630 (1980).
- Nagel, G., et al. Channelrhodopsin-1: a light-gated proton channel in green algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Sineshchekov, O. A., Jung, K. -H., Spudich, J. L. Two rhodopsins mediate phototaxis to low- and high-intensity light in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 99 (13), 8689-8694 (2002).
- Suzuki, T., et al. Archaeal-type rhodopsins in Chlamydomonas: model structure and intracellular localization. Biochemical and Biophysical Research Communications. 301 (3), 711-717 (2003).
- Berthold, P., et al. Channelrhodopsin-1 initiates phototaxis and photophobic responses in Chlamydomonas by immediate light-induced depolarization. Plant Cell. 20 (6), 1665-1677 (2008).
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. Journal of Neuroscience. 26 (41), 10380-10386 (2006).
- Wakabayashi, K., Isu, A., Ueki, N. Channelrhodopsin-dependent photo-behavioral responses in the unicellular green alga Chlamydomonas reinhardtii. Optogenetics (Advances in Experimental Medicine and Biology), 2nd ed. , Springer. 21-33 (2021).
- Rüffer, U., Nultsch, W. Flagellar photoresponses of Chlamydomonas cells held on micropipettes: II. Change in flagellar beat pattern. Cell Motility and the Cytoskeleton. 18 (4), 269-278 (1991).
- Kamiya, R., Hasegawa, E. Intrinsic difference in beat frequency between the two flagella of Chlamydomonas reinhardtii. Experimental Cell Research. 173, 299-304 (1987).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Horst, C. J., Witman, G. B. ptx1, a nonphototactic mutant of Chlamydomonas, lacks control of flagellar dominance. Journal of Cell Biology. 120 (3), 733-741 (1993).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature Reviews Molecular Cell Biology. 18 (9), 533-547 (2017).
- Ide, T., et al. Identification of the agg1 mutation responsible for negative phototaxis in a "wild-type" strain of Chlamydomonas reinhardtii. Biochemistry and Biophysics Reports. 7, 379-385 (2016).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Finst, R. J., Kim, P. J., Quarmby, L. M. Genetics of the deflagellation pathway in Chlamydomonas. Genetics. 149 (2), 927-936 (1998).
- Morel-Laurens, N. Calcium control of phototactic orientation in Chlamydomonas reinhardtii: sign and strength of response. Photochemistry and Photobiology. 45 (1), 119-128 (1987).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Wakabayashi, K., Misawa, Y., Mochiji, S., Kamiya, R. Reduction-oxidation poise regulates the sign of phototaxis in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 108 (27), 11280-11284 (2011).
- Harris, E. H. in The Chlamydomonas Sourcebook Second Edition. 1, Academic Press. Ch. 2 25-64 (2009).
- Mergenhagen, D. Circadian clock: genetic characterization of a short period mutant of Chlamydomonas reinhardii. European Journal of Cell Biology. 33 (1), 13-18 (1984).
- Ozasa, K., Lee, J., Song, S., Hara, M., Maeda, M. Two-dimensional optical feedback control of Euglena confined in closed-type microfluidic channels. Lab on a Chip. 11 (11), 1933-1940 (2011).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138(2021).
- Ueno, Y., Aikawa, S., Kondo, A., Akimoto, S. Adaptation of light-harvesting functions of unicellular green algae to different light qualities. Photosynthesis Research. 139 (1-3), 145-154 (2019).
- Takahashi, T., Watanabe, M. Photosynthesis modulates the sign of phototaxis of wild-type Chlamydomonas reinhardtii. Effects of red background illumination and 3-(3',4'-dichlorophenyl)-1,1-dimethylurea. FEBS Letters. 336 (3), 516-520 (1993).
- Morishita, J., Tokutsu, R., Minagawa, J., Hisabori, T., Wakabayashi, K. I. Characterization of Chlamydomonas reinhardtii mutants that exhibit strong positive phototaxis. Plants (Basel). 10 (7), (2021).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Inaba, K. Calcium sensors of ciliary outer arm dynein: functions and phylogenetic considerations for eukaryotic evolution. Cilia. 4 (1), 6(2015).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır