É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Observação do Comportamento Fotográfico em Clamídomonas reinhardtii
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A maioria dos organismos fotoautotróficos da natação apresentam alterações comportamentais induzidas por foto (comportamento fotográfico). O presente protocolo observa o referido comportamento fotográfico no organismo modelo Chlamydomonas reinhardtii.
Resumo
Para a sobrevivência dos microrganismos fototróficos motile, estar sob condições adequadas de luz é crucial. Consequentemente, eles mostram comportamentos induzidos por foto (ou comportamento fotográfico) e alteram sua direção de movimento em resposta à luz. Os comportamentos típicos de fotobehtos incluem resposta fotofóbica (ou fotofóbica) e fototaxis. Photoshock é uma resposta a uma mudança repentina na intensidade da luz (por exemplo, iluminação de flash), onde organismos param de se mover ou se movem para trás. Durante a fototaxis, os organismos se movem em direção à fonte de luz ou na direção oposta (chamada fototáxi positiva ou negativa, respectivamente). A alga verde unicelular Chlamydomonas reinhardtii é um excelente organismo para estudar o comportamento fotográfico porque muda rapidamente seu padrão de natação modulando a batida de cílios (também conhecido como flagela) após a fotorrecepção. Aqui, vários métodos simples são mostrados para observar os comportamentos fotofoitos em C. reinhardtii. Pesquisas sobre os comportamentos fotográficos de C. reinhardtii levaram à descoberta de mecanismos regulatórios comuns entre cílios eucarióticos e channelrhodopsins, o que pode contribuir para uma melhor compreensão das ciliopatias e o desenvolvimento de novos métodos optogenéticos.
Introdução
A luz é uma fonte de energia indispensável para organismos fotossintéticos, mas muita luz pode causar danos foto-oxidativos. Assim, os organismos fototróficos precisam sobreviver sob luz de intensidade moderada, onde podem fotossintestar, mas não sofrer danos foto-oxidativos1. Em plantas terrestres, cloroplastos não podem sair da folha e mostrar movimentos fotográficos na célula; cloroplastos se movem para a periferia da célula sob alta luz e a superfície celular sob baixa luz2, enquanto muitas algas motile mostram comportamentos fotográficos que lhes permitem encontrar condições adequadas de luz para fotossíntese e, assim, facilitam sua sobrevivência3.
Clamídoonas reinhardtii é uma alga verde unicelular considerada como um organismo modelo em campos de pesquisa como cílio (também conhecido como flagela), fotossíntese e comportamento fotográfico. C. reinhardtii apresenta uma mancha operária e duas cílias por célula, usadas para fotorecepção e natação, respectivamente. A mancha olenta tem dois componentes: canalrhodopsinas (ChRs), canais de íons com a luz na membrana plasmática, e as camadas de grânulo ricas em carotenoides localizadas logo atrás dos ChRs. A mancha olhenta atua como um receptor de luz direcional, uma vez que as camadas de grânulo ricas em carotenoides funcionam como um refletor de luz 4,5.
As RS foram inicialmente identificadas como fotorreceptores causando comportamentos fotográficos em C. reinhardtii 6,7,8,9. Embora dois isoformes, ChR1 e ChR2, sejam encontrados na mancha obentou, experimentos de knock-down mostraram que ChR1 é o principal fotorreceptor para fotobehaviors10. Apesar disso, o ChR2 tem recebido mais atenção e desempenhado um papel central no desenvolvimento da optogenética, uma técnica para controlar a excitação celular pela luz11. Portanto, estudar os mecanismos regulatórios que regem os comportamentos fotográficos em C. reinhardtii irá promover a compreensão da função chr e melhorar a optogenética.
Após a fotorrecepção, as células C. reinhardtii mostram dois tipos de comportamentos fotográficos: fototaxis e resposta ao choquede fotos 12. Fototaxis é o comportamento das células nadando na direção da fonte de luz ou na direção oposta, chamada fototáxi positiva ou negativa, respectivamente. Resposta de photoshock é um comportamento que as células mostram depois de sentir uma mudança repentina na intensidade da luz, como quando iluminada por um flash. As células param de nadar ou nadam para trás (ou seja, nadando com o corpo celular para a frente) por um curto período, normalmente <1 s.
Movimentos ciliares em C. reinhardtii estão envolvidos em seus comportamentos fotográficos. Dois cílios geralmente batem como nado de peito de um humano, e isso é modulado para fotofossores. Para fototaxis, as forças geradas pelas duas cílios são desequilibrados pela modulação da frequência de batida e pela amplitude de forma de onda de cada círio13. O cílio mais próximo da mancha é chamado cílio cis, e o outro é chamado de trans cilium. Estes dois cilia diferem em vários pontos. Por exemplo, a frequência de batimentos ciliar de trans cilium in vitro é 30%-40% maior14. Além disso, sua sensibilidade ca2+ é diferente. A reativação dos modelos de células demembradas15 mostrou que o círio cis bate mais fortemente do que o cilium trans para Ca2+ <1 x 10-8 M, enquanto o oposto é verdadeiro para Ca2+ >1 x 10-7 M. Essa assimetria na sensibilidade ca2+ é possivelmente importante para as curvas fototáticas, uma vez que mutantes sem essa assimetria não exibem fototaxis normais16,17. Por outro lado, a conversão de forma de onda é necessária para o choque de fotos. A forma de onda ciliar se transforma da forma de onda assimétrica na natação dianteira para a forma de onda simétrica na natação retrógrada. Esta conversão de forma de onda também é regulada por Ca2+, em um limiar de 1 x 10-4 M18,19. Uma vez que os defeitos na regulação dos movimentos ciliares causam diskinesia ciliar primária em humanos, estudar comportamentos fotográficos em C. reinhardtii pode ajudar na melhor compreensão dessas doenças e desenvolvimentos terapêuticos20.
Aqui, são demonstrados quatro métodos simples para observar os comportamentos fotográficos em C. reinhardtii . Primeiro, um ensaio de fototaxis usando placas de Petri é mostrado, e segundo, um ensaio de fototaxis contra gotículas de suspensão celular. O fenômeno observado em ambos os casos não é estritamente fototaxis, mas o acúmulo de fotos, onde as células tendem a se acumular perto do lado da fonte de luz ou do lado oposto. Em C. reinhardtii, o acúmulo de fotos é causado principalmente por fototaxis de uma forma que pode ser usada como aproximação à fototaxis. Em terceiro lugar, um ensaio mais rigoroso para fototátega sob um microscópio é mostrado, e por último é um ensaio de fotoshock sob um microscópio.
Access restricted. Please log in or start a trial to view this content.
Protocolo
No presente estudo, foi utilizada uma cepa de Clamídonas reinhardtii, uma prole da cruz CC-124 x CC-125 com agg1+mt-,21. CC-124 e CC-125 foram obtidos do Centro de Recursos Clamídonas (ver Tabela de Materiais) e mantidos em um Tris-acetato-fosfato (TAP)22, 1,5% de agarose médio a 20-25 °C. Qualquer cepa motile pode ser usada para este protocolo.
1. Cultura celular
- Cultura uma tensão de interesse de Chlamydomonas reinhardtii em meio líquido TAP com aeração borbulhando ar estéril em um período claro-escuro de 12 h/12 h (período claro, ~50 fótons μmol·m−2·s−1 luz branca) a 20-25 °C por 2 dias.
NOTA: As células em uma fase de crescimento logarítmico médio precisam ser usadas. A cultura longa (>3 dias, na fase de crescimento logarítmico tardio) torna as células menos sensíveis ao estímulo da luz e aumenta o número de células mortas na cultura, dificultando a leitura dos resultados.

Figura 1: Cultura líquida após 2 dias de cultivo. A partir de uma placa de ágar TAP-1,5%, um pedaço de células do tipo selvagem que preenchem o laço de platina foi inoculado em ~150 mL de meio líquido TAP em um frasco. A densidade celular após 2 dias de cultura foi ~5,0 x 106 células/mL. Clique aqui para ver uma versão maior desta figura.
2. Pré-tratamento das células
- Misture ~10 μL da cultura com um volume igual de solução de decilidação para impedir que as células nadem e meça a densidade celular usando um contador celular ou hemótmetro.
NOTA: Existem aproximadamente 1-5 x 106 células/mL após uma cultura de 2 dias (Figura 1). A composição da solução de decilidação é a seguinte23: 40 mM de acetato de potássio, 1 mM CaCl2, pH 4.5 ajustado com HCl. - Centrifugar a quantidade necessária de cultura líquida a 1000 x g por 3 min a temperatura ambiente.
NOTA: Um experimento requer 3 mL de 2 x 107 células/mL para condições padrão para ensaio de fototaxis em uma placa de Petri. Se dois experimentos serão realizados com cultura 1 x 106 células/mL, 120 mL de cultura precisam ser centrifugados. - Suspenda a pelota celular com a quantidade necessária de solução experimental de comportamento fotográfico para ~2 x 107 células/mL (para ensaio de fototaxis) ou 1 x 106 células/mL (para ensaio de ensaio de fototaxis de nível celular ou ensaio de resposta a fotoshock) e coloque a célula de suspensão em um tubo cônico.
NOTA: A densidade celular não precisa ser controlada muito estritamente para uma estimativa aproximada de comportamentos fotobehantes ou pode mudar dependendo da finalidade do ensaio. Fotofobehfoto solução experimental14: 5 mM HEPES (pH 7.4), 0,2 mM EGTA, 1 mM KCl, 0,3 mM CaCl2. Esta etapa de troca de buffer pode ser omitida para um simples ensaio sobre a capacidade de exibir comportamentos fotoporulentos, e o experimento pode ser realizado com o meio de cultura. No entanto, como a composição iônica da solução afeta sinais fototáticos24, e a composição iônica do meio após a cultura pode não ser constante, recomenda-se usar essa solução para um ensaio mais rigoroso. A substituição por um meio TAP fresco pode ser uma opção. - Coloque o tubo sob luz vermelha fraca (10-30 μmol fótons·m−2·s−1) por ~1 h (Figura 2).
NOTA: Esta etapa aumenta a sensibilidade das células ao estímulo da luz.

Figura 2: Suspensão celular sob luz vermelha. Uma luz branca fluorescente regular coberta com uma folha de celofane vermelho. Um tubo contendo a suspensão celular é colocado sob ~10 μmol fótons·m−2·s−1 luz vermelha. Clique aqui para ver uma versão maior desta figura.
3. Ensaio de fototaxis usando a placa de Petri (o chamado "ensaio de pratos")
- Coloque suspensão celular de 2-3 mL em uma placa de Petri (3,5 cm), coloque-a em uma caixa de luz (alternativamente, uma folha branca de papel ou uma placa de plástico branca), agite suavemente para distribuir uniformemente as células e adquira uma imagem antes da iluminação.
NOTA: O tamanho do prato pode mudar dependendo do propósito. Dependendo da tensão e do estado da cultura, as células podem ficar no fundo da placa de Petri. Nesse caso, as células presas precisam ser removidas por pipetação antes do ensaio. - Ilumine o prato de um lado com um diodo emissor de luz verde (LED, veja Tabela de Materiais) em uma sala escura de desktop (Figura 3).
NOTA: As condições típicas de luz são λ = 525 nm e 50-100 fótons μmol·m−2·s−1. Veja a discussão sobre a seleção do comprimento de onda da fonte de luz na seção de discussão. Cubra os pratos e o LED com uma caixa ou pano preto quando um PEQUENO LED for usado. - Deixe-os por ≥5 minutos e, em seguida, adquira imagens.
NOTA: O tempo para iluminação da luz pode ser alterado dependendo do tamanho ou propósito da placa de Petri (Figura 4). - Importe o arquivo de imagem para Fiji (ver Tabela de Materiais) para quantificação.
NOTA: Fiji é uma distribuição de ImageJ2, agrupando muitos plugins. - Altere a imagem de cor para escala de cinza através do Tipo > de imagem > 8 bits (Figura 5).
- Inverter preto e branco através de Editar > Inverter.
- Cerque todo o prato como uma região de interesse (ROI) e meça a densidade através de Analisar > Medida.
NOTA: A densidade do prato total pode ser calculada como (Área) x (Média). - Cerque a metade do prato mais próximo da fonte de luz como um ROI e meça a densidade.
- Calcule o índice fototático como a (densidade de células fototáticas) por (densidade de células totais).

Figura 3: Iluminação lateral para ensaio de placa de fototaxis. (A) Uma placa de Petri contendo uma suspensão celular colocada em uma caixa de luz em uma sala escura de desktop. Luz verde (placa LED de 525 nm, ~100 fótons μmol·m−2·s−1) iluminados do lado. (B) Método de iluminação alternativa. Um LED tipo bala de canhão de 5 mm. (C) Para bloquear a luz do lado de fora, uma caixa com um pano preto no interior pode ser usada em vez de uma sala escura de desktop. Clique aqui para ver uma versão maior desta figura.

Figura 4: Exemplo de fototaxis negativas após 5 min de iluminação lateral. (A) Suspensão celular tipo selvagem em uma placa de Petri iluminada por 5 minutos. A maioria das células se acumulou no lado oposto da fonte de luz. Esses dados podem ser interpretados como fototaxis negativas. (B) Imagem do prato de cima. Clique aqui para ver uma versão maior desta figura.
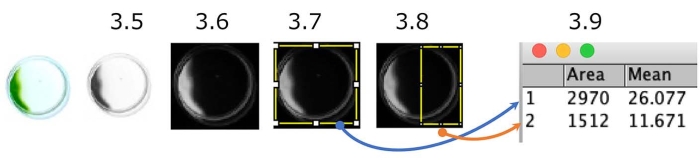
Figura 5: Quantificação do ensaio de fototáxi do prato. Um exemplo de células que mostram fototáxis negativas (a fonte de luz está no lado direito). A imagem colorida é convertida em uma escala de cinza (Passo 3.5.) e depois invertida (Passo 3.6.). Regiões de interesse (ROI), todo o prato (Passo 3.7.), e a metade do lado da fonte leve do prato (Passo 3.8.) foram delimitados. A densidade de cada ROI foi medida (Passo 3.9.). Neste caso, o índice fototático (PI) é de cerca de 0,18 ([1.512 x 11.671] / [2.970 x 26.077]). Pi é 1 ou 0 quando todas as células apresentam fototáxis positivas ou negativas, respectivamente. Clique aqui para ver uma versão maior desta figura.
4. Ensaio de fototaxis usando gotículas de cultura celular
- Coloque 25 μL de gotículas de suspensão celular (Passo 2.4.) diretamente sobre uma placa de plástico branca usando uma micropipette.
- Ilumine as gotículas de um lado com um LED verde em uma sala escura de desktop (Figura 6).
NOTA: As condições típicas de luz são λ = 525 nm e 50-100 fótons μmol m−2 s−1. Cubra ambas as placas e led com uma caixa ou um pano preto quando um LED pequeno é usado. - Deixe-os por 3 minutos e, em seguida, adquira imagens.
NOTA: Este ensaio é adequado para uma verificação rápida de fototáxis de muitas amostras ao mesmo tempo, como na triagem mutante ou na análise de tetrad. Uma cultura celular na fase de tronco médio cultivada em uma placa de 96 poços pode ser diretamente iluminada para um desempenho mais fácil. Em ambos os casos, o Passo 2 (pré-tratamento celular) pode ser omitido.

Figura 6: Ensaio de fototáxi de gotícula. (A) Nove gotículas de uma suspensão celular de 25 μL colocadas em uma folha de plástico branca e iluminadas do lado por um LED verde. (B) Após 3 min de iluminação. Em cada gotícula, as células se acumulavam no lado da fonte de luz (fototáxi positiva), acumuladas no lado oposto (fototáxi negativa) ou difundidas na gotícula (sem fototaxis). Barra de escala = 1 cm. Clique aqui para ver uma versão maior desta figura.
5. Ensaio de fototaxis sob um microscópio
- Leve ~30 μL de suspensão celular (1 x 106 células/mL em solução experimental de comportamento fotográfico) em um slide de vidro e coloque um deslizamento de tampa (18 mm x 18 mm) com espaçadores em cima (Figura 7).
NOTA: Os espaçadores podem ser feitos com petróleo branco ou fitas adesivas de dois lados em dois lados opostos de uma mancha de cobertura. A luz precisa vir de uma direção onde não há espaçadores. - Ilumine a amostra de um lado do deslizamento sem um espaçador com um LED verde e observe as células sob um microscópio de campo escuro com uma lente objetiva de 10x sob luz vermelha fraca (λ > 630 nm, ~5 fótons μmol·m−2·s−1, Figura 8).
NOTA: Evite expor as células do palco à luz diferente do LED ou da luz de observação, como iluminação da sala ou luz de um monitor de PC. A ampliação adequada de uma lente objetiva depende do ângulo de visão da câmera. Selecione uma lente com uma ampliação que permite que a célula nade por ~2 s sem sair do campo de visão. Para rastrear células, uma imagem de alto contraste é desejável; assim, recomenda-se o uso de um condensador de campo escuro para observação microscópica. No entanto, outros condensadores, como o campo brilhante, podem ser usados para observar a fototaxis. Certifique-se de que a luz do LED está brilhando nas células. - Grave o movimento da célula para ~20 s após a iluminação da luz usando um microscópio equipado com câmera.
NOTA: Alguns segundos após o início da iluminação verde do LED, uma resposta de choque fotográfico pode ocorrer e/ou a orientação fototática (ou sinal) não está estável; assim, recomenda-se uma gravação de 20 s para estabilização de resposta (Filme 1).

Figura 7: Fazer espaçadores nas bordas do deslizamento de tampa. (A) Uma fina camada de vaselina foi aplicada na palma da mão. Uma pequena quantidade de petróleo branco foi raspada com a borda de uma mancha de cobertura. (B) Um espaçador na borda de uma mancha de cobertura. (C) Outro espaçador na borda oposta. Clique aqui para ver uma versão maior desta figura.

Figura 8: Iluminação lateral sob um microscópio. (A) Configuração de um LED verde. Um LED verde do tipo bala de canhão é fixado no muff e fixado no suporte ao lado do microscópio. As células foram observadas sob um microscópio de campo escuro com um filtro de corte afiado (λ > 630 nm). (B) Iluminação lateral pelo LED verde. Clique aqui para ver uma versão maior desta figura.
Filme 1: Ensaio de fototaxis sob um microscópio. Luz verde iluminada a ~0 s da direita. Naquele momento, as células tendiam a nadar em uma direção aleatória. Após 0 s no contador de tempo, as células nadavam para a direita ou para a esquerda, mostrando fototaxis positivas ou negativas. A luz foi desligada em ~15 s quando as células começaram a nadar em uma direção aleatória novamente. Barra de escala = 100 μm. Clique aqui para baixar este Filme.
6. Rastreamento de células fototáticas e desenho de histograma polar
- Extraia 1,5 s do vídeo gravado, começando 15 s após a iluminação.
NOTA: A duração da trajetória pode mudar dependendo da velocidade de natação da célula. Um vídeo de 1,5 s contém 46 quadros a 30 fps de gravação. - Importe o arquivo para Fiji como uma sequência de imagem em formato de arquivo de imagem através da sequência de > de arquivo > de arquivo.
- Execute o plugin "Rastreamento Manual" para rastreamento de células usando Plugins > Rastreamento > Rastreamento Manual.
- Clique em Adicionar faixa e o primeiro quadro é exibido.
- Clique em um celular de interesse, e o segundo quadro aparece.
- Mova o controle deslizante para o último quadro e clique na mesma célula da etapa 6.5.
NOTA: Não é necessário rastrear células em cada quadro. Apenas o ângulo entre o eixo de luz e o segmento de linha formado pelos pontos de partida e extremidade é essencial. - Repetição passos 6.4.-6.6. para ~30 células.
NOTA: Selecione células que permanecem dentro do ângulo de visão para todos os 1,5 s. Se a densidade celular for suficientemente baixa e nenhuma trajetória de natação celular se cruze por 1,5 s, o rastreamento automático pode ser realizado. Nesse caso, escolha o plugin "MTrack2" (configurações típicas: Tamanho mínimo do objeto = 1; Tamanho máximo do objeto = 10.000; Velocidade máxima = 100; Comprimento mínimo da aderência [Quadros] = 46). Recomenda-se verificar a correspondência entre as células no vídeo e os resultados de rastreamento obtendo os dados verificando o texto do Show? > Overlay Dots & Lines. - Copie e cole os resultados para o software de planilha (por exemplo, Excel).
NOTA: Aqui, como desenhar um histograma polar com o Excel é mostrado. - Meça o ângulo entre o eixo de luz e a direção de natação de uma célula por "=graus(x2-x1),-(y2-y1)", onde a posição inicial da célula (fatia #1) é (x1, y1), e a última posição (fatia #46) é (x2, y1).
NOTA: Em uma imagem fiji, o canto superior esquerdo é a origem (0, 0). - Repita o passo 6.9. para todas as células medidas (tipicamente ~30 células).
- Prepare uma tabela de distribuição de frequência para todos os dados obtidos com as lixeiras de −180° a +180°, dividida em 15° em ambas as extremidades e 30° para o resto da faixa usando a função "FREQUÊNCIA".
NOTA: Após selecionar as colunas imediatamente para as colunas de lixo, digite o seguinte na coluna superior =FREQUENCY (data_array, bins_array) e pressione shift + ctrl + enter (Figura Suplementar 1). - Recriar uma tabela de distribuição de frequência com os valores calculados na Etapa 6.8. girado −90° para definir o lado direito para 0° (ou seja, converter o número na faixa de −15° a 15°, para a faixa de −105° a −75°), uma vez que, com o método acima, as células que nadam para cima são consideradas nadando em um ângulo de 0° à luz (ou seja, mostrando fototaxis positivas), embora a luz esteja vindo da direita (Figura Suplementar 2).
- Digite o valor do ângulo no meio da faixa de uma caixa de 30° (por exemplo, 30° por 15°-45°), pulando uma coluna e digite a contagem amostral correspondente à sua direita (Figura Suplementar 3).
- Converta cada valor da contagem de amostras em uma porcentagem e digite 0 na coluna correspondente à coluna em branco entre as lixeiras.
- Desenhe um gráfico de radar utilizando os valores angulares como os rótulos do eixo horizontal e os valores percentuais (%) como a legenda (Figura Suplementar 4).
- Calcule o índice fototático (PI) para maior quantificação, com uma média do cosφ (φ = o ângulo entre o eixo de luz e a direção de natação)16.
NOTA: Pi é 0 quando as células estão nadando em uma direção aleatória e 1 ou −1 quando 100% das células apresentam fototaxis positivas ou negativas, respectivamente.
7. Ensaio de resposta de choque de fotos sob um microscópio
- Coloque ~30 μL de suspensão celular (1 x 106 células/mL na solução experimental do comportamento fotográfico) em um slide de vidro e coloque um deslizamento de tampa (18 mm x 18 mm) com espaçadores em cima, como na Etapa 4.1.
- Observe as células sob um microscópio com luz vermelha fraca (λ > 630 nm, ~5 μmol photons·m−2·s−1).
- Aplique iluminação flash usando um flash de câmera (Filme 2,3).
NOTA: Outra maneira de induzir uma resposta de choque de fotosh é remover rapidamente um filtro vermelho manualmente do caminho da luz de observação. No entanto, este método é mais variável, pois a velocidade de remoção do filtro varia de pessoa para pessoa (Filme 4,5). - Grave o movimento da célula usando um microscópio equipado com câmera.
- Para quantificação, realize ou ambos os seguintes: (1) calcular a razão de células que mostram a resposta de photoshock por células totais16; (2) para células que mostram a resposta ao photoshock, meça o tempo desde o estímulo do photoshock até a recuperação da natação dianteira25.
Filme 2: Iluminação de choque de fotos por um flash de câmera. O flash da câmera foi mantido até o estágio do microscópio e ligado. Clique aqui para baixar este Filme.
Filme 3: Resposta de choque de fotos causada por um flash sob um microscópio. As células foram observadas sob luz vermelha fraca. Um flash foi emitido a ~0 s. Quase todas as células pararam na natação, nadaram para trás por um curto período, e se recuperaram na natação para a frente. Barra de escala = 100 μm. Clique aqui para baixar este Filme.
Filme 4: Resposta de choque de fotos causada pela remoção de um filtro vermelho sob um microscópio. As células foram observadas sob luz vermelha fraca. O filtro vermelho foi removido em ~5 s. Quase todas as células pararam na natação, nadaram para trás por um curto período, e se recuperaram na natação para a frente. Barra de escala = 100 μm. Clique aqui para baixar este Filme.
Filme 5: Removendo um filtro vermelho. Remoção rápida de um filtro vermelho definido no caminho da luz para entregar o choque de fotos. Clique aqui para baixar este Filme.
Access restricted. Please log in or start a trial to view this content.
Resultados
Típicos ensaios de fototáxi c. reinhardtii e fotoshock são mostrados aqui. Após a estimativa de densidade celular, a cultura celular do tipo selvagem (uma prole da cruz CC-124 × CC-125 com agg1+ mt -)23 foi lavada com solução experimental fotobehportora para o ensaio do prato fototaxis. A suspensão celular foi colocada sob luz vermelha fraca por ~1 h. Uma suspensão de célula de 2 mL foi colocada em uma placa de Petri de 3,5 cm. A placa de Petri foi sacudida suavemente, colocada ...
Access restricted. Please log in or start a trial to view this content.
Discussão
O presente protocolo é fácil e não demorado. Se um mutante C. reinhardtii é suspeito de apresentar defeitos em fotorrecepção ou movimento ciliar, este método pode servir como análise fenotípica primária.
No entanto, existem alguns passos críticos. Uma delas é usar células no experimento na fase inicial e intermediária de crescimento do registro. Após a cultivo por longos períodos, as células tornam-se menos motile, menos sensíveis à luz, e até mesmo formam palmello...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este estudo foi apoiado por bolsas da Japan Society for the Promotion of Science KAKENHI (https://www.jsps.go.jp/english/index.html) para NU (19K23758, 21K06295), TH (16H06556) e KW (19H03242, 20K21420, 21H00420), da Ohsumi Frontier Science Foundation (https://www.ofsf.or.jp/en/) à KW, e da Aliança Dinâmica para Inovação Aberta Conectando Humanos, Ambientais e Materiais (http://alliance.tagen.tohoku.ac.jp/english/) à NU, TH e KW.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| 5 mm Cannonball green LED | Optosupply | OSPG5161P | |
| 50 mL conical tube | SARSTEDT | 62.547.254 | |
| AC adaptor for the light box | ATTO | 2196161 | |
| Auto cell counter | DeNovix | CellDrop BF | |
| CaCl2 | Nakalai tesque | 06731-05 | |
| Camera flash | NEWWER | TT560 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strains CC-124 and CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| C-mout CCD camera | Wraymer | 1129HMN1/3 | |
| Desktop darkroom | Scientex | B-S8 | |
| Digital still camera | SONY | RX100II | |
| EGTA | Dojindo | G002 | |
| Fiji | https://fiji.sc/ | ||
| Green LED plate | CCS | ISLM-150X150-GG | |
| HCl | Fujifilm WAKO | 080-01066 | |
| HEPES | Dojindo | GB70 | |
| KCl | Nakalai tesque | 238514-75 | |
| Lightbox (Flat viewer) | ATTO | 2196160 | |
| Microscope | Olympus | BX-53 | |
| Petri dish (φ3.5 cm) | IWAKI | 1000-035 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Power supply for the green LED plate | CCS | ISC-201-2 | |
| Red filter | Shibuya Optical | S-RG630 |
Referências
- Demmig-Adams, B., Adams, W. W. Photoprotection and other responses of plants to high light stress. Annual Reviews Plant Physiology and Plant Molecular Biology. 43, 599-626 (1992).
- Wada, M. Chloroplast movement. Plant Science. 210, 177-182 (2013).
- Sgarbossa, A., Checcucci, G., Lenci, F. Photoreception and photomovements of microorganisms. Photochemical & Photobiological Sciences. 1 (7), 459-467 (2002).
- Ueki, N., et al. Eyespot-dependent determination of the phototactic sign in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 113 (19), 5299-5304 (2016).
- Foster, K. W., Smyth, R. D. Light antennas in phototactic algae. Microbiological Reviews. 44 (4), 572-630 (1980).
- Nagel, G., et al. Channelrhodopsin-1: a light-gated proton channel in green algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Sineshchekov, O. A., Jung, K. -H., Spudich, J. L. Two rhodopsins mediate phototaxis to low- and high-intensity light in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 99 (13), 8689-8694 (2002).
- Suzuki, T., et al. Archaeal-type rhodopsins in Chlamydomonas: model structure and intracellular localization. Biochemical and Biophysical Research Communications. 301 (3), 711-717 (2003).
- Berthold, P., et al. Channelrhodopsin-1 initiates phototaxis and photophobic responses in Chlamydomonas by immediate light-induced depolarization. Plant Cell. 20 (6), 1665-1677 (2008).
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. Journal of Neuroscience. 26 (41), 10380-10386 (2006).
- Wakabayashi, K., Isu, A., Ueki, N. Channelrhodopsin-dependent photo-behavioral responses in the unicellular green alga Chlamydomonas reinhardtii. Optogenetics (Advances in Experimental Medicine and Biology), 2nd ed. , Springer. 21-33 (2021).
- Rüffer, U., Nultsch, W. Flagellar photoresponses of Chlamydomonas cells held on micropipettes: II. Change in flagellar beat pattern. Cell Motility and the Cytoskeleton. 18 (4), 269-278 (1991).
- Kamiya, R., Hasegawa, E. Intrinsic difference in beat frequency between the two flagella of Chlamydomonas reinhardtii. Experimental Cell Research. 173, 299-304 (1987).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Horst, C. J., Witman, G. B. ptx1, a nonphototactic mutant of Chlamydomonas, lacks control of flagellar dominance. Journal of Cell Biology. 120 (3), 733-741 (1993).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature Reviews Molecular Cell Biology. 18 (9), 533-547 (2017).
- Ide, T., et al. Identification of the agg1 mutation responsible for negative phototaxis in a "wild-type" strain of Chlamydomonas reinhardtii. Biochemistry and Biophysics Reports. 7, 379-385 (2016).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Finst, R. J., Kim, P. J., Quarmby, L. M. Genetics of the deflagellation pathway in Chlamydomonas. Genetics. 149 (2), 927-936 (1998).
- Morel-Laurens, N. Calcium control of phototactic orientation in Chlamydomonas reinhardtii: sign and strength of response. Photochemistry and Photobiology. 45 (1), 119-128 (1987).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Wakabayashi, K., Misawa, Y., Mochiji, S., Kamiya, R. Reduction-oxidation poise regulates the sign of phototaxis in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 108 (27), 11280-11284 (2011).
- Harris, E. H. in The Chlamydomonas Sourcebook Second Edition. 1, Academic Press. Ch. 2 25-64 (2009).
- Mergenhagen, D. Circadian clock: genetic characterization of a short period mutant of Chlamydomonas reinhardii. European Journal of Cell Biology. 33 (1), 13-18 (1984).
- Ozasa, K., Lee, J., Song, S., Hara, M., Maeda, M. Two-dimensional optical feedback control of Euglena confined in closed-type microfluidic channels. Lab on a Chip. 11 (11), 1933-1940 (2011).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138(2021).
- Ueno, Y., Aikawa, S., Kondo, A., Akimoto, S. Adaptation of light-harvesting functions of unicellular green algae to different light qualities. Photosynthesis Research. 139 (1-3), 145-154 (2019).
- Takahashi, T., Watanabe, M. Photosynthesis modulates the sign of phototaxis of wild-type Chlamydomonas reinhardtii. Effects of red background illumination and 3-(3',4'-dichlorophenyl)-1,1-dimethylurea. FEBS Letters. 336 (3), 516-520 (1993).
- Morishita, J., Tokutsu, R., Minagawa, J., Hisabori, T., Wakabayashi, K. I. Characterization of Chlamydomonas reinhardtii mutants that exhibit strong positive phototaxis. Plants (Basel). 10 (7), (2021).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Inaba, K. Calcium sensors of ciliary outer arm dynein: functions and phylogenetic considerations for eukaryotic evolution. Cilia. 4 (1), 6(2015).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados