Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Observation du photocomportement chez Chlamydomonas reinhardtii
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La plupart des organismes photoautotrophes nageant présentent des changements de comportement photo-induits (photocomportement). Le présent protocole observe ledit photocomportement chez l’organisme modèle Chlamydomonas reinhardtii.
Résumé
Pour la survie des micro-organismes phototrophes mobiles, il est crucial d’être dans de bonnes conditions de lumière. Par conséquent, ils montrent des comportements photo-induits (ou photocomportement) et modifient leur direction de mouvement en réponse à la lumière. Les photocomportements typiques comprennent la réponse photochoc (ou photophobe) et la phototaxie. Le photochoc est une réponse à un changement soudain de l’intensité lumineuse (p. ex., l’éclairage du flash), dans lequel les organismes cessent de bouger ou reculent transitoirement. Pendant la phototaxie, les organismes se déplacent vers la source lumineuse ou dans la direction opposée (phototaxie positive ou négative, respectivement). L’algue verte unicellulaire Chlamydomonas reinhardtii est un excellent organisme pour étudier le photocomportement car elle change rapidement son schéma de nage en modulant le battement des cils (alias flagelles) après photoréception. Ici, diverses méthodes simples sont montrées pour observer les photocomportements chez C. reinhardtii. La recherche sur les photocomportements de C. reinhardtii a conduit à la découverte de mécanismes de régulation communs entre les cils eucaryotes et les channelrhodopsines, ce qui pourrait contribuer à une meilleure compréhension des ciliopathies et au développement de nouvelles méthodes optogénétiques.
Introduction
La lumière est une source d’énergie indispensable pour les organismes photosynthétiques, mais trop de lumière peut causer des dommages photo-oxydatifs. Ainsi, les organismes phototrophes doivent survivre sous une lumière d’intensité modérée, où ils peuvent photosynthétiser mais ne pas subir de dommages photo-oxydatifs1. Chez les plantes terrestres, les chloroplastes ne peuvent pas sortir de la feuille et montrer des mouvements photographiques dans la cellule; les chloroplastes se déplacent vers la périphérie de la cellule sous haute lumière et la surface de la cellule sous faible luminosité2, tandis que de nombreuses algues mobiles présentent des photocomportements qui leur permettent de trouver des conditions de lumière appropriées pour la photosynthèse et, ainsi, facilitent leur survie3.
Chlamydomonas reinhardtii est une algue verte unicellulaire considérée comme un organisme modèle dans des domaines de recherche tels que les cils (alias flagelles), la photosynthèse et le photocomportement. C. reinhardtii se présente avec une tache oculaire et deux cils par cellule, utilisés respectivement pour la photoréception et la natation. La tache oculaire a deux composants: les channelrhodopsines (ChR), les canaux ioniques à barrière lumineuse dans la membrane plasmique et les couches de granules riches en caroténoïdes situées juste derrière les ChR. La tache oculaire agit comme un récepteur de lumière directionnelle puisque les couches de granules riches en caroténoïdes fonctionnent comme un réflecteur de lumière 4,5.
Les ChR ont d’abord été identifiés comme des photorécepteurs provoquant des photocomportements chez C. reinhardtii 6,7,8,9. Bien que deux isoformes, ChR1 et ChR2, se trouvent dans la tache oculaire, des expériences de knock-down ont montré que ChR1 est le photorécepteur principal pour les photocomportements10. Malgré cela, ChR2 a reçu plus d’attention et a joué un rôle central dans le développement de l’optogénétique, une technique permettant de contrôler l’excitation cellulaire par la lumière11. Par conséquent, l’étude des mécanismes de régulation régissant les photocomportements chez C. reinhardtii permettra de mieux comprendre la fonction ChR et d’améliorer l’optogénétique.
Après photoréception, les cellules de C. reinhardtii présentent deux types de photocomportements : la phototaxie et la réponse au photochoc12. La phototaxie est le comportement des cellules nageant dans la direction de la source lumineuse ou dans la direction opposée, appelée phototaxie positive ou négative, respectivement. La réponse au choc photochoc est un comportement que les cellules montrent après avoir détecté un changement soudain de l’intensité lumineuse, par exemple lorsqu’elles sont éclairées par un flash. Les cellules cessent de nager ou nagent vers l’arrière (c.-à-d. nager avec le corps cellulaire vers l’avant) pendant une courte période, généralement <1 s.
Les mouvements ciliaires chez C. reinhardtii sont impliqués dans ses photocomportements. Deux cils battent généralement comme la nage de brasse d’un humain, et cela est modulé pour les photocomportements. Pour la phototaxie, les forces générées par les deux cils sont déséquilibrées par la modulation de la fréquence de battement et l’amplitude de la forme d’onde de chaque cilium13. Le cil le plus proche de la tache oculaire est appelé cis cilium, et l’autre est appelé transcilium. Ces deux cils diffèrent sur différents points. Par exemple, la fréquence de battement ciliaire du transcilium in vitro est de 30% à 40% plus élevée14. De plus, leur sensibilité au Ca2+ est différente. La réactivation des modèles cellulaires démembranés15 a montré que le cis cilium bat plus fortement que le transcilium pour Ca2+ <1 x 10−8 M, tandis que l’inverse est vrai pour Ca2+ >1 x 10−7 M. Cette asymétrie dans la sensibilité au Ca2+ est peut-être importante pour les virages phototaxiques puisque les mutants dépourvus de cette asymétrie ne présentent pas de phototaxie normale16,17. Inversement, la conversion de la forme d’onde est nécessaire pour les photochocs. La forme d’onde ciliaire se transforme de la forme d’onde asymétrique en nage vers l’avant à la forme d’onde symétrique en nage arrière. Cette conversion de forme d’onde est également régulée par Ca2+, à un seuil de 1 x 10−4 M18,19. Étant donné que les défauts de régulation des mouvements ciliaires provoquent une dyskinésie ciliaire primaire chez l’homme, l’étude des photocomportements chez C. reinhardtii pourrait aider à mieux comprendre ces maladies et les développements thérapeutiques20.
Ici, quatre méthodes simples pour observer les photocomportements chez C. reinhardtii sont démontrées. Premièrement, un test de phototaxie utilisant des boîtes de Petri est montré, et deuxièmement, un test de phototaxie contre des gouttelettes de suspension cellulaire. Le phénomène observé dans les deux cas n’est pas strictement phototaxis mais photoaccumulation, où les cellules ont tendance à s’accumuler près du côté de la source lumineuse ou du côté opposé. Chez C. reinhardtii, l’accumulation de photos est principalement causée par la phototaxie d’une manière qui peut être utilisée comme approximation de la phototaxie. Troisièmement, un test plus rigoureux pour la phototaxie au microscope est montré, et le dernier est un test de photochoc sous un microscope.
Access restricted. Please log in or start a trial to view this content.
Protocole
Dans la présente étude, une souche de type sauvage de Chlamydomonas reinhardtii, une progéniture du croisement CC-124 x CC-125 avec agg1 + mt-, a été utilisée21. CC-124 et CC-125 ont été obtenus du Centre de ressources de Chlamydomonas (voir Tableau des matériaux) et maintenus sur un milieu d’agarose tris-acétate-phosphate (TAP)22, à 1,5 % à 20-25 °C. Toute souche mobile peut être utilisée pour ce protocole.
1. Culture cellulaire
- Culture d’une souche d’intérêt de Chlamydomonas reinhardtii en milieu liquide TAP avec aération par bouillonnement d’air stérile dans une période clair-sombre de 12 h/12 h (période de lumière, ~50 photons μmol·m−2·s−1 lumière blanche) à 20-25 °C pendant 2 jours.
REMARQUE: Les cellules dans une phase de croissance mi-logarithmique doivent être utilisées. Une culture longue (>3 jours, dans la phase de croissance logarithmique tardive) rend les cellules moins sensibles au stimulus lumineux et augmente le nombre de cellules mortes dans la culture, ce qui entrave la lecture des résultats.

Figure 1 : Culture liquide après 2 jours de culture. À partir d’une plaque de gélose TAP-1,5%, un morceau de cellules de type sauvage remplissant la boucle de platine a été inoculé dans environ 150 mL de milieu liquide TAP dans une fiole. La densité cellulaire après une culture de 2 jours était d’environ 5,0 x 106 cellules/ mL. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Prétraitement des cellules
- Mélanger ~10 μL de la culture avec un volume égal de solution de déciliation pour empêcher les cellules de nager et mesurer la densité cellulaire à l’aide d’un compteur cellulaire ou d’un hémocytomètre.
REMARQUE: Il y a environ 1-5 x 106 cellules / mL après une culture de 2 jours (Figure 1). La composition de la solution de déciliation est la suivante: 23 : 40 mM d’acétate de potassium, 1 mM deCaCl2, pH 4,5 ajusté avec du HCl. - Centrifuger la quantité requise de culture liquide à 1000 x g pendant 3 min à température ambiante.
REMARQUE: Une expérience nécessite 3 mL de 2 x 107 cellules / mL pour les conditions standard de dosage de la phototaxie dans une boîte de Pétri. Si deux expériences doivent être réalisées avec une culture de 1 x 106 cellules/mL, 120 mL de culture doivent être centrifugés. - Suspendez la pastille cellulaire avec la quantité requise de solution expérimentale de photocomportement à ~2 x 107 cellules/mL (pour le test de phototaxie par plat) ou 1 x 106 cellules/mL (pour le test de phototaxie au niveau cellulaire ou le test de réponse au photochoc) et mettez la suspension cellulaire dans un tube conique.
REMARQUE: La densité cellulaire n’a pas besoin d’être contrôlée très strictement pour une estimation approximative des photocomportements ou peut changer en fonction de l’objectif du test. Solution expérimentale de photocomportement14 : 5 mM HEPES (pH 7,4), 0,2 mM EGTA, 1 mM KCl, 0,3 mM CaCl2. Cette étape d’échange de tampon peut être omise pour un test simple sur la capacité à présenter des photocomportements, et l’expérience peut être réalisée avec le milieu de culture. Cependant, étant donné que la composition ionique de la solution affecte les signes phototactiques24 et que la composition ionique du milieu après la culture peut ne pas être constante, il est recommandé d’utiliser cette solution pour un dosage plus rigoureux. La substitution par un milieu TAP frais peut être une option. - Placer le tube sous une faible lumière rouge (photons de 10-30 μmol·m−2·s−1) pendant environ 1 h (Figure 2).
REMARQUE: Cette étape augmente la sensibilité des cellules au stimulus lumineux.

Figure 2 : Suspension de la cellule sous un feu rouge. Une lumière blanche fluorescente ordinaire recouverte d’une feuille de cellophane rouge. Un tube contenant la suspension cellulaire est placé sous ~10 μmol photons·m−2·s−1 lumière rouge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Essai photographique à l’aide de la boîte de Pétri (appelée « essai à vaisselle »)
- Mettez une suspension cellulaire de 2 à 3 mL dans une boîte de Petri (3,5 cm), placez-la sur une boîte à lumière (alternativement, une feuille de papier blanche ou une plaque de plastique blanche), secouez doucement pour répartir uniformément les cellules et obtenez une image avant l’éclairage.
REMARQUE: La taille du plat peut changer en fonction de l’objectif. Selon la souche et l’état de la culture, les cellules peuvent coller au fond de la boîte de Pétri. Dans un tel cas, les cellules coincées doivent être enlevées par pipetage avant le test. - Éclairez l’antenne parabolique d’un côté avec une diode électroluminescente verte (LED, voir Tableau des matériaux) dans une chambre noire de bureau (Figure 3).
REMARQUE: Les conditions d’éclairage typiques sont λ = 525 nm et 50-100 photons μmol·m−2·s−1. Voir la discussion sur la sélection de la longueur d’onde de la source lumineuse dans la section de discussion. Couvrez à la fois la vaisselle et la LED avec une boîte ou un chiffon noir lorsqu’une petite LED est utilisée. - Laissez-les pendant ≥5 min, puis acquérez des images.
REMARQUE: L’heure d’éclairage de la lumière peut être modifiée en fonction de la taille ou de l’objectif de la boîte de Pétri (Figure 4). - Importez le fichier image aux Fidji (voir Table des matériaux) pour la quantification.
REMARQUE: Fiji est une distribution d’ImageJ2, regroupant de nombreux plugins. - Remplacez l’image couleur par des niveaux de gris via Image > Type > 8 bits (Figure 5).
- Inverser le noir et blanc via Modifier > Inverser.
- Entourez l’ensemble du plat en tant que région d’intérêt (ROI) et mesurez la densité grâce à Analyze > Measure.
REMARQUE: La densité du plat total peut être calculée comme (Surface) x (Moyenne). - Entourez la moitié de la parabole la plus proche de la source lumineuse comme roi et mesurez la densité.
- Calculez l’indice phototactique comme le (densité des cellules phototaxtiques) par (densité des cellules totales).

Figure 3 : Éclairage latéral pour le dosage de la boîte phototaxique. (A) Boîte de Petri contenant une suspension cellulaire placée sur une boîte à lumière dans une chambre noire de bureau. Lumière verte (plaque LED de 525 nm, ~100 photons μmol·m−2·s−1) éclairée par le côté. B) Méthode d’éclairage alternative. Une LED de type boulet de canon de 5 mm. (C) Pour bloquer la lumière de l’extérieur, une boîte avec un tissu noir à l’intérieur peut être utilisée à la place d’une chambre noire de bureau. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Exemple de phototaxie négative après 5 min d’éclairage latéral. (A) Suspension cellulaire de type sauvage dans une boîte de Petri éclairée pendant 5 min. La plupart des cellules se sont accumulées du côté opposé de la source lumineuse. Ces données peuvent être interprétées comme des photostaxies négatives. (B) Image du plat par le haut. Veuillez cliquer ici pour voir une version agrandie de cette figure.
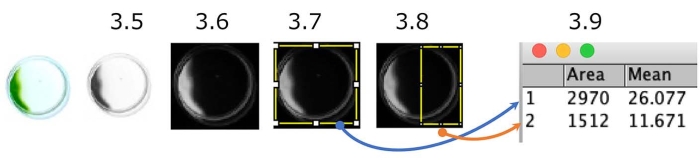
Figure 5 : Quantification du test de phototaxie par plat. Un exemple de cellules montrant une phototaxie négative (la source de lumière est sur le côté droit). L’image couleur est convertie en niveaux de gris (étape 3.5.), puis inversée (étape 3.6.). Les régions d’intérêt (ROI), l’ensemble du plat (étape 3.7.) et la moitié côté source lumineuse du plat (étape 3.8.) ont été délimités. La densité de chaque ROI a été mesurée (étape 3.9.). Dans ce cas, l’indice phototactique (IP) est d’environ 0,18 ([1 512 x 11,671] / [2 970 x 26,077]). PI est de 1 ou 0 lorsque toutes les cellules présentent une phototaxie positive ou négative, respectivement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Dosage de phototaxie à l’aide de gouttelettes de culture cellulaire
- Placer 25 μL de gouttelettes de suspension cellulaire (étape 2.4.) directement sur une plaque de plastique blanc à l’aide d’une micropipette.
- Éclairez les gouttelettes d’un côté avec un voyant vert dans une chambre noire de bureau (Figure 6).
REMARQUE: Les conditions d’éclairage typiques sont λ = 525 nm et 50-100 μmol photons m−2 s−1. Couvrez les deux plaques et les LED avec une boîte ou un chiffon noir lorsqu’une petite LED est utilisée. - Laissez-les pendant 3 min, puis acquérez des images.
REMARQUE: Ce test convient à une vérification rapide de la phototaxie de plusieurs échantillons à la fois, comme dans le criblage de mutants ou l’analyse de tétrades. Une culture cellulaire à mi-logarithmique cultivée dans une plaque de 96 puits peut être directement éclairée pour des performances plus faciles. Dans les deux cas, l’étape 2 (prétraitement cellulaire) peut être omise.

Figure 6 : Essai de phototaxie par gouttelettes. (A) Neuf gouttelettes d’une suspension cellulaire de 25 μL placées sur une feuille de plastique blanche et éclairées sur le côté par une LED verte. (B) Après 3 min d’éclairage. Dans chaque gouttelette, les cellules s’accumulaient du côté de la source lumineuse (phototaxie positive), s’accumulaient du côté opposé (phototaxie négative) ou se diffusaient dans la gouttelette (pas de phototaxie). Barre d’échelle = 1 cm. Veuillez cliquer ici pour agrandir cette figure.
5. Dosage de la phototaxie au microscope
- Prendre environ 30 μL de suspension cellulaire (1 x 106 cellules/mL dans une solution expérimentale de photocomportement) sur une lame de verre et placer un couvercle (18 mm x 18 mm) avec des entretoises sur le dessus (Figure 7).
REMARQUE: Les entretoises peuvent être fabriquées avec du pétrole blanc ou des rubans adhésifs double face sur deux côtés opposés d’un couvercle. La lumière doit provenir d’une direction où il n’y a pas d’entretoises. - Illuminez l’échantillon d’un côté du couvercle sans espaceur avec une LED verte et observez les cellules sous un microscope à champ sombre avec une lentille d’objectif 10x sous une faible lumière rouge (λ > 630 nm, ~5 photons μmol·m−2·s−1, Figure 8).
REMARQUE: Évitez d’exposer les cellules de la scène à une lumière autre que la LED ou la lumière d’observation, telle que l’éclairage de la pièce ou la lumière d’un moniteur de PC. Le grossissement approprié d’un objectif dépend de l’angle de vue de l’appareil photo. Sélectionnez un objectif avec un grossissement qui permet à la cellule de nager pendant environ 2 s sans quitter le champ de vision. Pour suivre les cellules, une image à contraste élevé est souhaitable; ainsi, l’utilisation d’un condensateur en champ sombre est recommandée pour l’observation microscopique. Cependant, d’autres condensateurs, tels que les champs lumineux, peuvent être utilisés pour observer la phototaxie. Assurez-vous que la lumière de la LED brille sur les cellules. - Enregistrez le mouvement de la cellule pendant environ 20 s après l’éclairage lumineux à l’aide d’un microscope équipé d’une caméra.
REMARQUE: Quelques secondes après le début de l’éclairage LED vert, une réponse de photochoc peut se produire et / ou l’orientation phototactique (ou le signe) n’est pas stable; ainsi, un enregistrement de 20 s est recommandé pour la stabilisation de la réponse (film 1).

Figure 7: Fabrication d’entretoises sur les bords des couvercles. (A) Une fine couche de vaseline a été appliquée sur la paume d’une main. Une petite quantité de pétrole blanc a été grattée avec le bord d’un couvercle. (B) Une entretoise sur le bord d’un couvercle. (C) Une autre entretoise sur le bord opposé. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Éclairage latéral au microscope. (A) Configuration d’une LED verte. Une LED verte de type boulet de canon est fixée au manchon et fixée au support à côté du microscope. Les cellules ont été observées sous un microscope à champ sombre avec un filtre à coupe nette (λ > 630 nm). (B) Éclairage latéral par la LED verte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Film 1: Test de phototaxis au microscope. La lumière verte s’est allumée à ~0 s à partir de la droite. À ce stade, les cellules avaient tendance à nager dans une direction aléatoire. Après 0 s dans le compteur de temps, les cellules ont nagé vers la droite ou la gauche, montrant une phototaxie positive ou négative. La lumière a été éteinte à ~ 15 s lorsque les cellules ont recommencé à nager dans une direction aléatoire. Barre d’échelle = 100 μm. Veuillez cliquer ici pour télécharger ce film.
6. Suivi des cellules phototaxiques et dessin de l’histogramme polaire
- Extrayez 1,5 s de la vidéo enregistrée, en commençant 15 s après l’éclairage.
REMARQUE: La durée de la trajectoire peut changer en fonction de la vitesse de nage de la cellule. Une vidéo de 1,5 s contient 46 images à 30 ips d’enregistrement. - Importez le fichier aux Fidji en tant que séquence d’images au format de fichier d’image de balise via Fichier > Importer > Séquence d’images.
- Exécutez le plugin « Manual Tracking » pour le suivi des cellules à l’aide de Plugins > Tracking > Manual Tracking.
- Cliquez sur Ajouter une piste et la première image apparaît.
- Cliquez sur une cellule d’intérêt et la deuxième image apparaît.
- Déplacez le curseur vers la dernière image et cliquez sur la même cellule que dans l’étape 6.5.
REMARQUE: Il n’est pas nécessaire de suivre les cellules dans chaque image. Seul l’angle entre l’axe lumineux et le segment de ligne formé par le début et les extrémités est essentiel. - Répétez les étapes 6.4.-6.6. pour ~30 cellules.
Remarque : Sélectionnez les cellules qui restent dans l’angle de vue pendant toute la durée de 1,5 s. Si la densité cellulaire est suffisamment faible et qu’aucune trajectoire de nage cellulaire ne se croise pendant 1,5 s, un suivi automatique peut être effectué. Dans ce cas, choisissez le plugin « MTrack2 » (paramètres typiques: Taille minimale de l’objet = 1; Taille maximale de l’objet = 10 000 ; Vitesse maximale = 100; Longueur minimale [Cadres] = 46). Il est recommandé de vérifier la correspondance entre les cellules de la vidéo et les résultats de suivi en obtenant les données en cochant Afficher le texte? > Superposition de points et de lignes. - Copiez et collez les résultats dans un tableur (par exemple, Excel).
REMARQUE: Ici, comment dessiner un histogramme polaire avec Excel est affiché. - Mesurez l’angle entre l’axe de la lumière et la direction de nage d’une cellule par « =degrés(atan2(x2-x1),-(y2-y1)) », où la position de départ de la cellule (tranche #1) est (x1, y1), et la dernière position (tranche #46) est (x2, y1).
REMARQUE: Dans une image Fidji, le coin supérieur gauche est l’origine (0, 0). - Répétez l’étape 6.9. pour toutes les cellules mesurées (généralement ~30 cellules).
- Préparez un tableau de distribution de fréquence pour toutes les données obtenues avec les bacs de −180° à +180°, divisé en 15° aux deux extrémités et 30° pour le reste de la gamme en utilisant la fonction « FRÉQUENCE ».
REMARQUE: Après avoir sélectionné les colonnes immédiatement dans les colonnes de la corbeille, entrez ce qui suit dans la colonne supérieure = FRÉQUENCE (data_array, bins_array) et appuyez sur Maj + Ctrl + Entrée (Figure supplémentaire 1). - Recréez une table de distribution de fréquence avec les valeurs calculées à l’étape 6.8. pivoté de −90° pour régler le côté droit sur 0° (c.-à-d. convertir le nombre dans la plage de −15° à 15°, à la plage de −105° à −75°), puisque, avec la méthode ci-dessus, les cellules nageant vers le haut sont considérées comme nageant à un angle de 0° par rapport à la lumière (c.-à-d. montrant une phototaxie positive), bien que la lumière provienne de la droite (figure supplémentaire 2).
- Entrez la valeur d’angle au milieu de la plage d’un bac de 30° (par exemple, 30° pour 15°-45°), en sautant une colonne, et entrez le nombre d’échantillons correspondant à sa droite (Figure supplémentaire 3).
- Convertissez chaque valeur de nombre d’échantillons en pourcentage et entrez 0 dans la colonne correspondant à la colonne vide entre les bacs.
- Dessinez un graphique radar en utilisant les valeurs d’angle comme étiquettes d’axe horizontal et les valeurs en pourcentage (%) comme légende (figure supplémentaire 4).
- Calculer l’indice phototactique (IP) pour une quantification plus poussée en faisant la moyenne du cosθ (θ = l’angle entre l’axe de la lumière et la direction de nage)16.
REMARQUE: PI est de 0 lorsque les cellules nagent dans une direction aléatoire et de 1 ou -1 lorsque 100% des cellules présentent une phototaxie positive ou négative, respectivement.
7. Test de réponse au choc photomicrocoque au microscope
- Placez une suspension cellulaire d’environ 30 μL (1 x 106 cellules/mL dans la solution expérimentale de photocomportement) sur une lame de verre et placez un couvercle (18 mm x 18 mm) avec des entretoises sur le dessus, comme à l’étape 4.1.
- Observez les cellules au microscope avec une faible lumière rouge (λ > 630 nm, ~5 photons μmol·m−2·s−1).
- Appliquez l’éclairage du flash à l’aide d’un flash d’appareil photo (Film 2,3).
REMARQUE: Une autre façon d’induire une réponse de photochoc est de retirer rapidement un filtre rouge à la main du chemin de la lumière d’observation. Cependant, cette méthode est plus variable car la vitesse de retrait du filtre varie d’une personne à l’autre (film 4,5). - Enregistrez le mouvement des cellules à l’aide d’un microscope équipé d’une caméra.
- Pour la quantification, effectuer l’une ou l’autre des opérations suivantes ou les deux : (1) calculer le rapport des cellules montrant la réponse au photochoc par nombre total de cellules16; (2) pour les cellules montrant la réponse au photochoc, mesurer le temps écoulé entre le stimulus du photochoc et la récupération de la nage vers l’avant25.
Film 2: Éclairage Photoshock par un flash d’appareil photo. Le flash de l’appareil photo a été maintenu jusqu’à l’étage du microscope et allumé. Veuillez cliquer ici pour télécharger ce film.
Film 3 : Réponse au choc photo provoqué par un flash sous un microscope. Des cellules ont été observées sous une faible lumière rouge. Un flash a été émis à ~0 s. Presque toutes les cellules ont cessé de nager vers l’avant, ont nagé vers l’arrière pendant une courte période et ont récupéré en nageant vers l’avant. Barre d’échelle = 100 μm. Veuillez cliquer ici pour télécharger ce film.
Film 4 : Réponse au choc photo provoqué par le retrait d’un filtre rouge sous un microscope. Des cellules ont été observées sous une faible lumière rouge. Le filtre rouge a été retiré à ~5 s. Presque toutes les cellules ont cessé de nager vers l’avant, ont nagé vers l’arrière pendant une courte période et ont récupéré en nageant vers l’avant. Barre d’échelle = 100 μm. Veuillez cliquer ici pour télécharger ce film.
Film 5 : Suppression d’un filtre rouge. Retrait rapide d’un filtre rouge défini dans le chemin de la lumière pour délivrer un photochoc. Veuillez cliquer ici pour télécharger ce film.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les tests typiques de phototaxie et de réponse au photochoc de C. reinhardtii sont présentés ici. Après estimation de la densité cellulaire, la culture cellulaire de type sauvage (une progéniture du croisement CC-124 × CC-125 avec agg1+ mt -)23 a été lavée avec une solution expérimentale de photocomportement pour le test de la boîte phototaxis. La suspension de la cellule a été placée sous une faible lumière rouge pendant environ 1 h. Une suspension cellulaire de 2 mL a é...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le protocole actuel est facile et ne prend pas beaucoup de temps. Si un mutant de C. reinhardtii est suspecté de présenter des défauts de photoréception ou de mouvement ciliaire, cette méthode pourrait servir d’analyse phénotypique primaire.
Cependant, certaines étapes critiques existent. L’une consiste à utiliser des cellules dans l’expérience dans la phase de croissance du début au milieu du logarithme. Après avoir cultivé pendant de longues périodes, les cellules...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été soutenue par des subventions de la Société japonaise pour la promotion de la science KAKENHI (https://www.jsps.go.jp/english/index.html) à NU (19K23758, 21K06295), TH (16H06556) et KW (19H03242, 20K21420, 21H00420), de la Ohsumi Frontier Science Foundation (https://www.ofsf.or.jp/en/) à KW, et de la Dynamic Alliance for Open Innovation Bridging Human, Environment and Materials (http://alliance.tagen.tohoku.ac.jp/english/) à NU, TH et KW.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| 5 mm Cannonball green LED | Optosupply | OSPG5161P | |
| 50 mL conical tube | SARSTEDT | 62.547.254 | |
| AC adaptor for the light box | ATTO | 2196161 | |
| Auto cell counter | DeNovix | CellDrop BF | |
| CaCl2 | Nakalai tesque | 06731-05 | |
| Camera flash | NEWWER | TT560 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strains CC-124 and CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| C-mout CCD camera | Wraymer | 1129HMN1/3 | |
| Desktop darkroom | Scientex | B-S8 | |
| Digital still camera | SONY | RX100II | |
| EGTA | Dojindo | G002 | |
| Fiji | https://fiji.sc/ | ||
| Green LED plate | CCS | ISLM-150X150-GG | |
| HCl | Fujifilm WAKO | 080-01066 | |
| HEPES | Dojindo | GB70 | |
| KCl | Nakalai tesque | 238514-75 | |
| Lightbox (Flat viewer) | ATTO | 2196160 | |
| Microscope | Olympus | BX-53 | |
| Petri dish (φ3.5 cm) | IWAKI | 1000-035 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Power supply for the green LED plate | CCS | ISC-201-2 | |
| Red filter | Shibuya Optical | S-RG630 |
Références
- Demmig-Adams, B., Adams, W. W. Photoprotection and other responses of plants to high light stress. Annual Reviews Plant Physiology and Plant Molecular Biology. 43, 599-626 (1992).
- Wada, M. Chloroplast movement. Plant Science. 210, 177-182 (2013).
- Sgarbossa, A., Checcucci, G., Lenci, F. Photoreception and photomovements of microorganisms. Photochemical & Photobiological Sciences. 1 (7), 459-467 (2002).
- Ueki, N., et al. Eyespot-dependent determination of the phototactic sign in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 113 (19), 5299-5304 (2016).
- Foster, K. W., Smyth, R. D. Light antennas in phototactic algae. Microbiological Reviews. 44 (4), 572-630 (1980).
- Nagel, G., et al. Channelrhodopsin-1: a light-gated proton channel in green algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Sineshchekov, O. A., Jung, K. -H., Spudich, J. L. Two rhodopsins mediate phototaxis to low- and high-intensity light in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 99 (13), 8689-8694 (2002).
- Suzuki, T., et al. Archaeal-type rhodopsins in Chlamydomonas: model structure and intracellular localization. Biochemical and Biophysical Research Communications. 301 (3), 711-717 (2003).
- Berthold, P., et al. Channelrhodopsin-1 initiates phototaxis and photophobic responses in Chlamydomonas by immediate light-induced depolarization. Plant Cell. 20 (6), 1665-1677 (2008).
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. Journal of Neuroscience. 26 (41), 10380-10386 (2006).
- Wakabayashi, K., Isu, A., Ueki, N. Channelrhodopsin-dependent photo-behavioral responses in the unicellular green alga Chlamydomonas reinhardtii. Optogenetics (Advances in Experimental Medicine and Biology), 2nd ed. , Springer. 21-33 (2021).
- Rüffer, U., Nultsch, W. Flagellar photoresponses of Chlamydomonas cells held on micropipettes: II. Change in flagellar beat pattern. Cell Motility and the Cytoskeleton. 18 (4), 269-278 (1991).
- Kamiya, R., Hasegawa, E. Intrinsic difference in beat frequency between the two flagella of Chlamydomonas reinhardtii. Experimental Cell Research. 173, 299-304 (1987).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Horst, C. J., Witman, G. B. ptx1, a nonphototactic mutant of Chlamydomonas, lacks control of flagellar dominance. Journal of Cell Biology. 120 (3), 733-741 (1993).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature Reviews Molecular Cell Biology. 18 (9), 533-547 (2017).
- Ide, T., et al. Identification of the agg1 mutation responsible for negative phototaxis in a "wild-type" strain of Chlamydomonas reinhardtii. Biochemistry and Biophysics Reports. 7, 379-385 (2016).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Finst, R. J., Kim, P. J., Quarmby, L. M. Genetics of the deflagellation pathway in Chlamydomonas. Genetics. 149 (2), 927-936 (1998).
- Morel-Laurens, N. Calcium control of phototactic orientation in Chlamydomonas reinhardtii: sign and strength of response. Photochemistry and Photobiology. 45 (1), 119-128 (1987).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Wakabayashi, K., Misawa, Y., Mochiji, S., Kamiya, R. Reduction-oxidation poise regulates the sign of phototaxis in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 108 (27), 11280-11284 (2011).
- Harris, E. H. in The Chlamydomonas Sourcebook Second Edition. 1, Academic Press. Ch. 2 25-64 (2009).
- Mergenhagen, D. Circadian clock: genetic characterization of a short period mutant of Chlamydomonas reinhardii. European Journal of Cell Biology. 33 (1), 13-18 (1984).
- Ozasa, K., Lee, J., Song, S., Hara, M., Maeda, M. Two-dimensional optical feedback control of Euglena confined in closed-type microfluidic channels. Lab on a Chip. 11 (11), 1933-1940 (2011).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138(2021).
- Ueno, Y., Aikawa, S., Kondo, A., Akimoto, S. Adaptation of light-harvesting functions of unicellular green algae to different light qualities. Photosynthesis Research. 139 (1-3), 145-154 (2019).
- Takahashi, T., Watanabe, M. Photosynthesis modulates the sign of phototaxis of wild-type Chlamydomonas reinhardtii. Effects of red background illumination and 3-(3',4'-dichlorophenyl)-1,1-dimethylurea. FEBS Letters. 336 (3), 516-520 (1993).
- Morishita, J., Tokutsu, R., Minagawa, J., Hisabori, T., Wakabayashi, K. I. Characterization of Chlamydomonas reinhardtii mutants that exhibit strong positive phototaxis. Plants (Basel). 10 (7), (2021).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Inaba, K. Calcium sensors of ciliary outer arm dynein: functions and phylogenetic considerations for eukaryotic evolution. Cilia. 4 (1), 6(2015).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon