JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
클라미도모나스 라인하르티이에서의 광행동 관찰
* 이 저자들은 동등하게 기여했습니다
요약
대부분의 수영 광독립영양 유기체는 광유도 행동 변화 (광행동)를 보여줍니다. 본 프로토콜은 모델 유기체 클라미도모나스 라인하르티이에서 상기 광거동을 관찰한다.
초록
운동성 광영양 미생물의 생존을 위해서는 적절한 조명 조건 하에있는 것이 중요합니다. 결과적으로, 그들은 광으로 유발 된 행동 (또는 광행동)을 보여주고 빛에 반응하여 운동 방향을 변경합니다. 일반적인 광동작에는 포토쇼크(또는 포토포빅) 반응과 포토택시가 포함됩니다. 광충격은 광도의 갑작스런 변화 (예를 들어, 플래시 조명)에 대한 반응이며, 여기서 유기체는 일시적으로 움직이지 않거나 뒤로 움직입니다. 광택시 동안, 유기체는 광원을 향해 또는 반대 방향으로 움직입니다 (각각 양성 또는 음수 광택시라고 함). 단세포 녹색 알가 클라미도모나스 라인하르티 이는 광수신 후 섬모(일명 편모)의 박동을 조절하여 수영 패턴을 빠르게 변화시키기 때문에 광행동을 연구하는 데 탁월한 유기체입니다. 여기에서는 C. reinhardtii의 광행동을 관찰하기 위해 다양한 간단한 방법이 나와 있습니다. C. reinhardtii의 광행동에 대한 연구는 진핵 섬모와 채널로돕신 사이의 공통적 인 조절 메커니즘의 발견으로 이어졌으며, 이는 섬모 병증에 대한 더 나은 이해와 새로운 광유전학 방법의 개발에 기여할 수 있습니다.
서문
빛은 광합성 유기체에 없어서는 안될 에너지원이지만 너무 많은 빛은 광산화 손상을 일으킬 수 있습니다. 따라서, 광영양 유기체는 광합성을 할 수 있지만 광산화 손상을 겪지 않는 적당한 강도의 빛 아래에서 생존해야합니다1. 육상 식물에서 엽록체는 잎에서 벗어나 세포에서 사진 움직임을 보여줄 수 없습니다. 엽록체는 높은 빛 아래에서 세포의 주변부로 이동하고 낮은 빛 2에서는 세포 표면으로 이동하는 반면, 많은 운동성 조류는 광합성을위한 적절한 조명 조건을 찾아 생존을 촉진 할 수있는 광행동을 보입니다3.
Chlamydomonas reinhardtii는 섬모 (일명 편모), 광합성 및 광행동과 같은 연구 분야에서 모델 유기체로 간주되는 단세포 녹색 알가입니다. C. reinhardtii는 각각 광수신 및 수영에 사용되는 세포 당 하나의 눈반과 두 개의 섬모를 나타냅니다. 아이스팟에는 채널로돕신(ChRs), 원형질막의 라이트 게이티드 이온 채널, ChRs 바로 뒤에 위치한 카로티노이드가 풍부한 과립층의 두 가지 구성 요소가 있습니다. 아이스팟은 카로티노이드가 풍부한 과립층이 광 반사체(4,5)로서 기능하기 때문에 방향성 광 수용체로서 작용한다.
ChRs 는 처음에 C. reinhardtii 6,7,8,9에서 광행동을 일으키는 광수용체로 확인되었다. 두 개의 이소형인 ChR1과 ChR2가 아이스팟에서 발견되지만, 녹다운 실험은 ChR1이 광거동(10)에 대한 1차 광수용체임을 보여주었다. 그럼에도 불구하고, ChR2는 더 많은 주목을 받았으며 광유전학 개발에 중심적인 역할을 했으며, 이는 빛(11)에 의한 세포 자극을 조절하는 기술이다. 따라서 C. reinhardtii의 광행동을 지배하는 규제 메커니즘을 연구하면 ChR 기능에 대한 이해를 높이고 광유전학을 향상시킬 수 있습니다.
광수신 후, C. reinhardtii 세포는 두 가지 유형의 광행동을 보여줍니다 : 광택시와 광충격 반응12. 광택시는 광원의 방향 또는 반대 방향으로 수영하는 세포의 거동으로, 각각 양성 또는 음성 광택시라고 불린다. 광충격 반응은 섬광에 의해 조명될 때와 같이 광도의 급격한 변화를 감지한 후에 세포가 보여주는 행동이다. 세포는 짧은 기간 동안, 전형적으로 <1초 동안 수영을 멈추거나 뒤로 수영(즉, 세포 몸을 앞으로 수영)한다.
C. reinhardtii의 섬모 운동은 그 광행동에 관여합니다. 두 개의 섬모는 보통 인간의 가슴 스트로크 수영처럼 뛰며, 이것은 사진 행동을 위해 변조됩니다. 광택시의 경우, 두 섬모에 의해 생성된 힘은 각 실륨(13)의 박동 주파수 및 파형 진폭의 변조에 의해 불균형해진다. 아이스팟에 가장 가까운 실륨은 시스 실륨이라고 불리고, 다른 하나는 트랜스 실륨이라고합니다. 이 두 섬모는 다양한 점에서 다릅니다. 예를 들어, 시험관 내에서 트랜스 실륨의 섬모 박동 빈도는 30 % -40 % 더 높은14입니다. 또한, 그들의Ca2+ 감도는 다르다. 탈취된 세포 모델(15)의 재활성화는 시스실륨이 Ca2+ <1 x 10-8 M에 대한 트랜스 실륨보다 더 강하게 박동하는 반면, 그 반대는 Ca2+ >1 x 10-7 M에 대해 사실임을 보여주었다. Ca2+ 감도에서의 이러한 비대칭성은 이러한 비대칭성이 결여된 돌연변이체가 정상적인 광택시(16,17)를 나타내지 않기 때문에 광전술 회전에 중요할 수 있다. 반대로, 파형 변환은 광충격을 위해 필요합니다. 섬모 파형은 전방 수영의 비대칭 파형에서 후진 수영의 대칭 파형으로 변환됩니다. 이 파형 변환은 또한 1 x 10-4 M18,19의 임계값에서Ca2+에 의해 조절된다. 섬모 운동 조절의 결함은 인간에게 원발성 섬모 운동 장애를 유발하기 때문에 C. reinhardtii의 광행동을 연구하면 이러한 질병과 치료 개발을 더 잘 이해하는 데 도움이 될 수 있습니다20.
여기에서, C. reinhardtii 에서 광행동을 관찰하는 네 가지 간단한 방법이 시연된다. 첫째, 페트리 접시를 이용한 광택시 분석법이 도시되고, 둘째, 세포 현탁액 방울에 대한 광택시 분석법이 도시된다. 두 경우 모두 관찰 된 현상은 엄격하게 광탁증이 아니라 세포가 광원 측 또는 반대편에 가깝게 축적되는 경향이있는 사진 축적입니다. C. reinhardtii에서 사진 축적은 주로 포토 택시에 대한 근사치로 사용할 수있는 방식으로 포토 택시에 의해 발생합니다. 셋째, 현미경으로 광택시에 대한보다 엄격한 분석이 표시되고, 마지막으로 현미경으로 광충격 분석이 표시됩니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
본 연구에서, 클라미도모나스 라인하르티이의 야생형 균주로서, CC-124 x CC-125의 자손인 글라 미도모나스 라인하르티이(glammydomonas reinhardtii)와 agg1+mt-,21을 사용하였다. CC-124 및 CC-125는 클라미도모나스 자원 센터( 표 자료 참조)로부터 수득하고, 20-25°C에서 트리스-아세테이트-포스페이트(TAP)22, 1.5% 아가로스 배지 상에서 유지하였다. 임의의 모타일 변형이 이 프로토콜에 사용될 수 있다.
1. 세포 배양
- 클라미도모나스 라인하르티이(Chlamydomonas reinhardtii)의 관심 균주를 20-25°C에서 2일 동안 12h/12h 광암기(광기, ~50μmol 광자·m-2·s-1 백색광)에서 멸균 공기를 버블링하여 폭기시킨 TAP 액체 배지에서 배양한다.
참고: 중간 대수 성장 단계에 있는 세포는 사용되어야 합니다. 긴 배양 (>3 일, 후기 로그 성장 단계에서)은 세포를 광 자극에 덜 민감하게 만들고 배양물에서 죽은 세포의 수를 증가시켜 결과의 판독을 방해합니다.

도 1: 2-일 배양 후의 액체 배양. TAP-1.5% 한천 플레이트로부터, 백금 루프를 채우는 야생형 세포 덩어리를 플라스크에 ∼150 mL의 TAP 액체 배지에 접종하였다. 2일 배양 후의 세포 밀도는 ∼5.0 x 106 세포/mL이었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 세포의 전처리
- 배양물을 동량의 데실레이션 용액과 ∼10 μL를 혼합하여 세포가 수영하는 것을 막고 세포 계수기 또는 혈구측정기를 사용하여 세포 밀도를 측정한다.
참고: 2일 배양 후 약 1-5 x 106 cells/mL가 있습니다(그림 1). 데실레이션 용액의 조성은 다음과 같이23:40 mM 아세트산칼륨, 1 mMCaCl2, HCl로 조정된 pH 4.5이다. - 필요한 양의 액체 배양물을 실온에서 3분 동안 1000 x g 에서 원심분리한다.
참고: 한 번의 실험에서는 페트리 접시에서 광택시 분석을 위한 표준 조건을 위해 3mL의 2 x 107 세포/mL가 필요합니다. 1 x 106 cells/mL 배양으로 두 가지 실험을 수행하려는 경우 120mL의 배양물을 원심분리해야 합니다. - ~2 x 107 cells/mL (접시 광택시 분석용) 또는 1 x 106 cells/mL (세포 수준 광택시 분석 또는 광충격 반응 분석용)에 필요한 양의 광거동 실험 용액으로 세포 펠릿을 현탁시키고 세포 현탁액을 원뿔형 튜브에 넣습니다.
참고: 세포 밀도는 광거동을 대략적으로 추정하기 위해 매우 엄격하게 제어할 필요가 없으며 분석의 목적에 따라 변경될 수 있습니다. 광거동 실험 용액14: 5 mM HEPES (pH 7.4), 0.2 mM EGTA, 1 mM KCl, 0.3 mMCaCl2. 이 버퍼 교환 단계는 광거동을 나타내는 능력에 대한 간단한 분석을 위해 생략 될 수 있으며, 실험은 배양 배지로 수행 될 수 있습니다. 그러나, 용액의 이온성 조성이 광주성 징후24에 영향을 미치고, 배양 후 매질의 이온성 조성이 일정하지 않을 수 있기 때문에, 보다 엄격한 분석을 위해 이 용액을 사용하는 것이 좋다. 신선한 TAP 매체로 대체하는 것이 옵션이 될 수 있습니다. - 튜브를 희미한 적색광(10-30μmol 광자·m-2·s−1) 아래에 놓고 ~1시간 동안 놓습니다(그림 2).
참고: 이 단계는 빛 자극에 대한 세포의 민감도를 증가시킵니다.

그림 2: 적색광 아래의 세포 현탁액. 붉은 셀로판 시트로 덮인 일반 형광 백색광. 세포 현탁액을 포함하는 튜브는 ~10 μmol 광자·m−2·s−1 적색광 아래에 놓인다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 페트리 접시를 이용한 광택시 분석(소위 "접시 분석")
- 2-3 mL 세포 현탁액을 페트리 접시 (3.5cm)에 넣고 라이트 박스 (또는 흰색 종이 또는 흰색 플라스틱 판)에 놓고 부드럽게 흔들어 세포를 균일하게 분포시키고 조명 전에 사진을 얻습니다.
참고: 접시 크기는 목적에 따라 변경될 수 있습니다. 균주와 배양 상태에 따라 세포는 페트리 접시의 바닥에 달라 붙을 수 있습니다. 그러한 경우에, 붙어있는 세포는 분석 전에 피펫팅에 의해 제거될 필요가 있다. - 데스크탑 암실에서 녹색 발광 다이오드(LED, 재료 표 참조)로 접시를 한쪽에서 비춥니다(그림 3).
참고: 일반적인 조명 조건은 λ = 525 nm 및 50-100 μmol 광자·m-2·s-1입니다. 토론 섹션에서 광원 파장 선택에 대한 토론을 참조하십시오. 작은 LED를 사용할 때 접시와 LED를 상자 또는 검은 천으로 덮으십시오. - ≥5 분 동안 방치 한 다음 이미지를 얻으십시오.
참고: 조명 시간은 페트리 접시의 크기나 용도에 따라 변경할 수 있습니다(그림 4). - 정량화를 위해 그림 파일을 피지로 가져옵니다( 재료 표 참조).
참고 : 피지는 많은 플러그인을 묶는 ImageJ2의 배포판입니다. - 이미지 > 유형 > 8비트를 통해 컬러 그림을 회색조로 변경합니다(그림 5).
- 편집 > 반전을 통해 흑백 을 반전시킵니다.
- 전체 접시를 관심 영역 (ROI)으로 둘러싸고 분석 > 측정을 통해 밀도를 측정하십시오.
참고: 전체 접시의 밀도는 (면적) x (평균)로 계산할 수 있습니다. - 광원에 가장 가까운 접시의 절반을 ROI로 둘러싸고 밀도를 측정하십시오.
- 광택틱 지수를 (전체 세포의 밀도) 당 (광전술 세포의 밀도)로 계산한다.

그림 3: 광택시 접시 분석을 위한 측면 조명 . (A) 데스크탑 암실의 라이트박스에 놓인 세포 현탁액이 들어있는 페트리 접시. 녹색 빛 (525 nm LED 플레이트, ~ 100 μmol 광자 · m-2 · - 1)이 측면에서 조명되었습니다. (B) 대체 조명 방법. 5mm 캐논볼 타입 LED. (C) 외부로부터의 빛을 차단하기 위해 바탕 화면 암실 대신 안쪽에 검은 천이있는 상자를 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: 네거티브 광택시의 예 5분 후 측면 조명. (A) 페트리 접시에 야생형 세포 현탁액을 5분 동안 조명하였다. 대부분의 세포는 광원의 반대편에 축적됩니다. 이러한 데이터는 네거티브 포토택시로 해석될 수 있다. (B) 상단에서 접시의 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
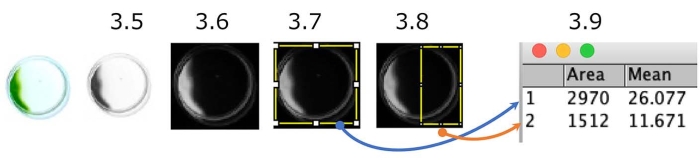
도 5: 접시 광택시 분석의 정량화. 네거티브 포토택시를 보여주는 셀의 예(광원은 오른쪽에 있음). 컬러 그림이 회색조로 변환되고(단계 3.5.) 반전됩니다(단계 3.6.). 관심 영역(ROI), 전체 디쉬(단계 3.7.), 및 광원측 디쉬의 절반(단계 3.8)을 구분하였다. 각 ROI의 밀도를 측정하였다(단계 3.9.). 이 경우, 광택틱 지수(PI)는 약 0.18([1,512 x 11.671]/[2,970 x 26.077])이다. PI는 모든 세포가 각각 양성 또는 음성 광택시를 보일 때 1 또는 0이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 세포 배양 액적을 이용한 광택시 분석
- 25 μL의 세포 현탁액 액적(단계 2.4)을 마이크로피펫을 이용하여 백색 플라스틱 플레이트 상에 직접 놓는다.
- 데스크톱 암실에서 녹색 LED로 한쪽의 물방울을 비춥니다(그림 6).
참고: 일반적인 광 조건은 λ = 525 nm 및 50-100 μmol 광자 m-2 s-1입니다. 작은 LED를 사용할 때 플레이트와 LED를 상자 또는 검은 천으로 덮으십시오. - 3 분 동안 방치 한 다음 이미지를 얻으십시오.
참고: 이 분석은 돌연변이 스크리닝 또는 테트라드 분석과 같이 많은 샘플의 광택시를 한 번에 빠르게 검사하는 데 적합합니다. 96-웰 플레이트에서 성장한 중간 로그 페이즈에서의 세포 배양물은 더 쉬운 성능을 위해 직접 조명될 수 있다. 두 경우 모두, 단계 2(세포 전처리)는 생략될 수 있다.

도 6: 액적 광택시 분석. (A) 25 μL 세포 현탁액의 아홉 개의 액적을 백색 플라스틱 시트 상에 놓고 녹색 LED에 의해 측면에서 조명하였다. (B) 3 분 조명 후. 각 물방울에서 세포는 광원 측면 (포지티브 포토 택시)에 축적되거나 반대쪽에 축적되거나 (음의 포토 택시) 물방울로 확산됩니다 (광택시 없음). 배율 막대 = 1cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 현미경으로 광택시 분석
- ~30μL의 세포 현탁액(광거동 실험 용액에서 1 x 106 cells/mL)을 유리 슬라이드에 넣고 위에 스페이서가 있는 커버슬립(18mm x 18mm)을 놓습니다(그림 7).
참고: 스페이서는 커버슬립의 양쪽 반대편에 흰색 석유 또는 양면 접착 테이프로 만들 수 있습니다. 빛은 스페이서가없는 방향에서 나와야합니다. - 녹색 LED로 스페이서가 없는 커버슬립의 한쪽 면에서 샘플을 비추고 어두운 적색광 하에서 10x 대물 렌즈로 암장 현미경으로 세포를 관찰합니다(λ > 630nm, ~5μmol 광자·m−2·s−1, 그림 8).
주: 무대의 셀을 LED 또는 실내 조명 또는 PC 모니터의 조명과 같은 관측 조명 이외의 빛에 노출시키지 마십시오. 대물 렌즈의 적절한 배율은 카메라의 화각에 따라 다릅니다. 셀이 시야각을 벗어나지 않고 ~ 2 초 동안 수영 할 수있게 해주는 배율의 렌즈를 선택하십시오. 셀을 추적하려면 고대비 이미지가 바람직합니다. 따라서 현미경 관찰을 위해 암장 응축기를 사용하는 것이 좋습니다. 그러나 밝은 필드와 같은 다른 응축기를 사용하여 광택시를 관찰 할 수 있습니다. LED의 표시등이 셀에 비치고 있는지 확인합니다. - 카메라가 장착 된 현미경을 사용하여 조명 후 ~ 20 초 동안 세포 움직임을 기록하십시오.
참고: 녹색 LED 조명이 시작된 후 몇 초 후에 포토쇼크 반응이 발생할 수 있으며 그리고/또는 포토택틱 방향(또는 기호)이 안정적이지 않습니다. 따라서 응답 안정화를 위해 20 초 녹화가 권장됩니다 (동영상 1).

그림 7: 커버슬립 가장자리에 스페이서 만들기 . (A) 바셀린의 얇은 층을 손바닥에 적용했습니다. 소량의 백색 석유가 커버 슬립의 가장자리로 긁어 냈습니다. (B) 커버슬립의 가장자리에 있는 스페이서. (C) 반대쪽 가장자리에 있는 또 다른 스페이서. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: 현미경을 이용한 측면 조명 . (A) 녹색 LED 설정. 캐논볼형 녹색 LED는 머프에 고정되어 현미경 옆의 스탠드에 고정됩니다. 세포를 날카로운 절단 필터 (λ > 630 nm)로 암장 현미경 하에서 관찰하였다. (B) 녹색 LED에 의한 측면 조명. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
영화 1 : 현미경으로 포토 택시 분석. 녹색 빛은 오른쪽에서 ~ 0 초에 비춥니 다. 그 시점에서 세포는 임의의 방향으로 수영하는 경향이있었습니다. 시간 카운터에서 0 초 후, 세포는 오른쪽 또는 왼쪽으로 수영하여 양성 또는 음성 광택시를 보여줍니다. 세포가 임의의 방향으로 다시 수영하기 시작했을 때 ~ 15 초에서 빛이 꺼졌습니다. 스케일 바 = 100 μm. 이 동영상을 다운로드하려면 여기를 클릭하십시오.
6. 포토택틱 세포 및 극성 히스토그램 도면의 추적
- 녹화 된 비디오에서 1.5 초를 추출하고 조명 후 15 초부터 시작합니다.
참고: 궤적 지속 시간은 셀의 수영 속도에 따라 변경될 수 있습니다. 1.5 s 비디오에는 30fps 레코딩에서 46 프레임이 포함되어 있습니다. - 파일 > 가져오기 > 이미지 시퀀스를 통해 태그 이미지 파일 형식 이미지 시퀀스로 파일을 피지로 가져옵니다.
- 플러그인 > 추적 > 수동 추적을 사용하여 셀 추적을위한 플러그인 "수동 추적"을 실행하십시오.
- 트랙 추가를 클릭하면 첫 번째 프레임이 나타납니다.
- 관심 있는 셀을 클릭하면 두 번째 프레임이 나타납니다.
- 슬라이더를 마지막 프레임으로 이동하고 6.5단계와 동일한 셀을 클릭합니다.
참고: 모든 프레임에서 셀을 추적할 필요는 없습니다. 광축과 시작점과 끝점에 의해 형성된 선분 사이의 각도만 필수적입니다. - 6.4.-6.6단계를 반복합니다. ~ 30 셀.
참고: 전체 1.5초 동안 화각 내에 남아 있는 셀을 선택합니다. 세포 밀도가 충분히 낮고 세포 수영 궤적이 1.5 초 동안 교차하지 않으면 자동 추적을 수행 할 수 있습니다. 이 경우 플러그인 "MTrack2"를 선택하십시오 (일반적인 설정 : 최소 객체 크기 = 1; 최대 개체 크기 = 10,000; 최대 속도 = 100; 최소 압정 길이 [프레임] = 46). 텍스트 표시? > Overlay Dots & Lines를 선택하여 데이터를 얻어 비디오의 셀과 추적 결과 간의 일치를 확인하는 것이 좋습니다. - 결과를 복사하여 스프레드시트 소프트웨어(예: Excel)에 붙여넣습니다.
참고: 여기에서는 Excel로 극성 히스토그램을 그리는 방법이 나와 있습니다. - 셀의 시작 위치(슬라이스 #1)가 (x1, y1)이고 마지막 위치(슬라이스 #46)가 (x2, y1)인 "=도(atan2(x2-x1),-(y2-y1)"로 셀의 광축과 수영 방향 사이의 각도를 측정합니다.
참고: 피지 이미지에서 왼쪽 위 모서리는 원점(0, 0)입니다. - 6.9단계를 반복합니다. 측정 된 모든 세포 (일반적으로 ~ 30 세포)에 대해.
- "FREQUENCY" 기능을 사용하여 빈으로 얻은 모든 데이터에 대해 -180° ~ +180°에서 양쪽 끝에서 15°, 나머지 범위의 경우 30°로 나뉘어 주파수 분포표를 준비합니다.
참고: 빈 열에 대한 열을 즉시 선택한 후 위쪽 열 =FREQUENCY(data_array, bins_array) 에 다음을 입력하고 Shift + Ctrl + Enter 키를 누릅니다(보충 그림 1). - 6.8단계에서 계산된 값으로 주파수 분포 테이블을 다시 만듭니다. -90°를 회전시켜 오른쪽을 0°로 설정(즉, -15°에서 15°까지의 범위의 숫자를 -105°에서 -75° 범위로 변환)한 후, 위의 방법으로 위쪽으로 수영하는 세포는 빛이 오른쪽에서 오더라도 빛에 대해 0°의 각도로 수영하는 것으로 간주되기 때문입니다(즉, 포지티브 포토택시를 나타냄).
- 30° bin 범위의 중간에 각도 값을 입력하고(예: 15°-45°의 경우 30°), 한 열을 건너뛰고, 해당 샘플 카운트를 오른쪽에 입력합니다(보충 그림 3).
- 각 샘플 개수 값을 백분율로 변환하고 빈 사이의 빈 열에 해당하는 열에 0을 입력합니다.
- 각도 값을 가로 축 레이블로, 백분율(%) 값을 범례로 사용하여 레이더 차트를 그립니다(보충 그림 4).
- cosθ(θ = 광축과 수영 방향 사이의 각도)16을 평균화하여 추가 정량화를 위한 광택틱 지수(PI)를 계산한다.
참고: PI는 세포가 임의의 방향으로 수영할 때 0이고, 세포의 100%가 각각 양성 또는 음성 광택시를 보일 때 1 또는 -1입니다.
7. 현미경으로 광충격 반응 분석
- 유리 슬라이드에 ~30 μL 세포 현탁액(광거동 실험 용액 중 1 x 106 cells/mL)을 놓고 4.1 단계에서와 같이 스페이서가 있는 커버슬립(18mm x 18 mm)을 위에 놓습니다.
- 희미한 적색광 (λ > 630 nm, ~ 5 μmol 광자 · m-2 · s-1)으로 현미경으로 세포를 관찰하십시오.
- 카메라 플래시를 사용하여 플래시 조명을 적용합니다(동영상 2,3).
참고: 광충격 반응을 유도하는 또 다른 방법은 관측광 경로에서 손으로 빨간색 필터를 빠르게 제거하는 것입니다. 그러나이 방법은 필터 제거 속도가 사람마다 다르기 때문에 더 다양합니다 (영화 4,5). - 카메라가 장착된 현미경을 사용하여 세포 움직임을 기록합니다.
- 정량화를 위해, 다음 중 어느 하나 또는 둘 다를 수행한다: (1) 전체 세포당 광충격 반응을 나타내는 셀의 비율을 계산(16); (2) 광충격 반응을 나타내는 세포에 대해, 광충격 자극으로부터 전방 수영(25)의 회복까지의 시간을 측정한다.
영화 2 : 카메라 플래시에 의한 포토 쇼크 조명. 카메라 플래시가 현미경 단계까지 유지되어 켜졌습니다. 이 영화를 다운로드하려면 여기를 클릭하십시오.
영화 3 : 현미경으로 플래시로 인한 광충격 반응. 세포는 희미한 적색광 하에서 관찰되었다. 플래시가 ~0초에서 방출되었습니다. 거의 모든 세포는 전방 수영을 멈추고 짧은 기간 동안 뒤로 수영하며 앞으로 수영을 회복했습니다. 스케일 바 = 100 μm. 이 동영상을 다운로드하려면 여기를 클릭하십시오.
영화 4 : 현미경으로 빨간색 필터를 제거하여 발생하는 광충격 반응. 세포는 희미한 적색광 하에서 관찰되었다. 빨간색 필터는 ~5 초에서 제거되었습니다. 거의 모든 세포는 전방 수영을 멈추고 짧은 기간 동안 뒤로 수영하며 앞으로 수영을 회복했습니다. 스케일 바 = 100 μm. 이 동영상을 다운로드하려면 여기를 클릭하십시오.
동영상 5: 빨간색 필터 제거. 광충격을 전달하기 위해 조명 경로에 설정된 빨간색 필터를 빠르게 제거합니다. 이 영화를 다운로드하려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
전형적인 C. reinhardtii 광택시 및 광충격 반응 분석이 여기에 제시되어 있다. 세포 밀도 추정 후, 야생형 세포 배양물(CC-124의 자손을 agg1+mt-로 교차 CC-125×)23 광택시 접시 분석을 위해 광거동 실험액으로 세척하였다. 세포 현탁액을 ∼1 h 동안 희미한 적색광 하에 두었다. 2 mL 세포 현탁액을 3.5 cm 페트리 디쉬에 넣었다. 페트리 접시는 부드럽게 흔들리고 라이트 박스를 착용하?...
Access restricted. Please log in or start a trial to view this content.
토론
현재 프로토콜은 쉽고 시간이 많이 걸리지 않습니다. C. reinhardtii 돌연변이가 광수신 또는 섬모 운동에 결함을 나타내는 것으로 의심되는 경우,이 방법은 일차 표현형 분석으로 작용할 수 있습니다.
그러나 몇 가지 중요한 단계가 있습니다. 하나는 초기 내지 중간 로그 성장 단계에서 실험에서 세포를 사용하는 것이다. 오랜 기간 동안 배양한 후, 세포는 덜 운동성이되고...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 일본 과학 진흥 협회 KAKENHI (https://www.jsps.go.jp/english/index.html)에서 NU (19K23758, 21K06295), TH (16H06556) 및 KW (19H03242, 20K21420, 21H00420), Ohsumi Frontier Science Foundation (https://www.ofsf.or.jp/en/)에서 KW로, 그리고 인간, 환경 및 재료 (http://alliance.tagen.tohoku.ac.jp/english/)를 NU, TH 및 KW로 연결하는 개방형 혁신을위한 동적 동맹에서 보조금으로 지원되었습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| 5 mm Cannonball green LED | Optosupply | OSPG5161P | |
| 50 mL conical tube | SARSTEDT | 62.547.254 | |
| AC adaptor for the light box | ATTO | 2196161 | |
| Auto cell counter | DeNovix | CellDrop BF | |
| CaCl2 | Nakalai tesque | 06731-05 | |
| Camera flash | NEWWER | TT560 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strains CC-124 and CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| C-mout CCD camera | Wraymer | 1129HMN1/3 | |
| Desktop darkroom | Scientex | B-S8 | |
| Digital still camera | SONY | RX100II | |
| EGTA | Dojindo | G002 | |
| Fiji | https://fiji.sc/ | ||
| Green LED plate | CCS | ISLM-150X150-GG | |
| HCl | Fujifilm WAKO | 080-01066 | |
| HEPES | Dojindo | GB70 | |
| KCl | Nakalai tesque | 238514-75 | |
| Lightbox (Flat viewer) | ATTO | 2196160 | |
| Microscope | Olympus | BX-53 | |
| Petri dish (φ3.5 cm) | IWAKI | 1000-035 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Power supply for the green LED plate | CCS | ISC-201-2 | |
| Red filter | Shibuya Optical | S-RG630 |
참고문헌
- Demmig-Adams, B., Adams, W. W. Photoprotection and other responses of plants to high light stress. Annual Reviews Plant Physiology and Plant Molecular Biology. 43, 599-626 (1992).
- Wada, M. Chloroplast movement. Plant Science. 210, 177-182 (2013).
- Sgarbossa, A., Checcucci, G., Lenci, F. Photoreception and photomovements of microorganisms. Photochemical & Photobiological Sciences. 1 (7), 459-467 (2002).
- Ueki, N., et al. Eyespot-dependent determination of the phototactic sign in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 113 (19), 5299-5304 (2016).
- Foster, K. W., Smyth, R. D. Light antennas in phototactic algae. Microbiological Reviews. 44 (4), 572-630 (1980).
- Nagel, G., et al. Channelrhodopsin-1: a light-gated proton channel in green algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Sineshchekov, O. A., Jung, K. -H., Spudich, J. L. Two rhodopsins mediate phototaxis to low- and high-intensity light in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 99 (13), 8689-8694 (2002).
- Suzuki, T., et al. Archaeal-type rhodopsins in Chlamydomonas: model structure and intracellular localization. Biochemical and Biophysical Research Communications. 301 (3), 711-717 (2003).
- Berthold, P., et al. Channelrhodopsin-1 initiates phototaxis and photophobic responses in Chlamydomonas by immediate light-induced depolarization. Plant Cell. 20 (6), 1665-1677 (2008).
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. Journal of Neuroscience. 26 (41), 10380-10386 (2006).
- Wakabayashi, K., Isu, A., Ueki, N. Channelrhodopsin-dependent photo-behavioral responses in the unicellular green alga Chlamydomonas reinhardtii. Optogenetics (Advances in Experimental Medicine and Biology), 2nd ed. , Springer. 21-33 (2021).
- Rüffer, U., Nultsch, W. Flagellar photoresponses of Chlamydomonas cells held on micropipettes: II. Change in flagellar beat pattern. Cell Motility and the Cytoskeleton. 18 (4), 269-278 (1991).
- Kamiya, R., Hasegawa, E. Intrinsic difference in beat frequency between the two flagella of Chlamydomonas reinhardtii. Experimental Cell Research. 173, 299-304 (1987).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Horst, C. J., Witman, G. B. ptx1, a nonphototactic mutant of Chlamydomonas, lacks control of flagellar dominance. Journal of Cell Biology. 120 (3), 733-741 (1993).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature Reviews Molecular Cell Biology. 18 (9), 533-547 (2017).
- Ide, T., et al. Identification of the agg1 mutation responsible for negative phototaxis in a "wild-type" strain of Chlamydomonas reinhardtii. Biochemistry and Biophysics Reports. 7, 379-385 (2016).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Finst, R. J., Kim, P. J., Quarmby, L. M. Genetics of the deflagellation pathway in Chlamydomonas. Genetics. 149 (2), 927-936 (1998).
- Morel-Laurens, N. Calcium control of phototactic orientation in Chlamydomonas reinhardtii: sign and strength of response. Photochemistry and Photobiology. 45 (1), 119-128 (1987).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Wakabayashi, K., Misawa, Y., Mochiji, S., Kamiya, R. Reduction-oxidation poise regulates the sign of phototaxis in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 108 (27), 11280-11284 (2011).
- Harris, E. H. in The Chlamydomonas Sourcebook Second Edition. 1, Academic Press. Ch. 2 25-64 (2009).
- Mergenhagen, D. Circadian clock: genetic characterization of a short period mutant of Chlamydomonas reinhardii. European Journal of Cell Biology. 33 (1), 13-18 (1984).
- Ozasa, K., Lee, J., Song, S., Hara, M., Maeda, M. Two-dimensional optical feedback control of Euglena confined in closed-type microfluidic channels. Lab on a Chip. 11 (11), 1933-1940 (2011).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138(2021).
- Ueno, Y., Aikawa, S., Kondo, A., Akimoto, S. Adaptation of light-harvesting functions of unicellular green algae to different light qualities. Photosynthesis Research. 139 (1-3), 145-154 (2019).
- Takahashi, T., Watanabe, M. Photosynthesis modulates the sign of phototaxis of wild-type Chlamydomonas reinhardtii. Effects of red background illumination and 3-(3',4'-dichlorophenyl)-1,1-dimethylurea. FEBS Letters. 336 (3), 516-520 (1993).
- Morishita, J., Tokutsu, R., Minagawa, J., Hisabori, T., Wakabayashi, K. I. Characterization of Chlamydomonas reinhardtii mutants that exhibit strong positive phototaxis. Plants (Basel). 10 (7), (2021).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Inaba, K. Calcium sensors of ciliary outer arm dynein: functions and phylogenetic considerations for eukaryotic evolution. Cilia. 4 (1), 6(2015).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유