Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Наблюдение за фотоповедением в Chlamydomonas reinhardtii
* Эти авторы внесли равный вклад
В этой статье
Резюме
Большинство плавающих фотоавтотрофных организмов демонстрируют фотоиндуцированные поведенческие изменения (фотоповедение). Настоящий протокол наблюдает указанное фотоповедение в модельном организме Chlamydomonas reinhardtii.
Аннотация
Для выживания подвижных фототрофных микроорганизмов решающее значение имеет нахождение в надлежащих условиях освещения. Следовательно, они показывают поведение, вызванное фотографией (или фотоповедение) и изменяют направление движения в ответ на свет. Типичные фотоповедения включают фотошок (или фотофобную) реакцию и фототаксис. Фотошок — это реакция на внезапное изменение интенсивности света (например, вспышка освещения), при котором организмы временно перестают двигаться или движутся назад. Во время фототаксиса организмы движутся к источнику света или в противоположном направлении (называемом положительным или отрицательным фототаксисом соответственно). Одноклеточная зеленая водоросль Chlamydomonas reinhardtii является отличным организмом для изучения фотоповедения, поскольку она быстро меняет свой характер плавания, модулируя биение ресничек (также известных как жгутики) после фоторецепции. Здесь показаны различные простые методы наблюдения за фотоповедением у C. reinhardtii. Исследования фотоповедения C. reinhardtii привели к открытию общих регуляторных механизмов между эукариотическими ресничками и канальными родопсинами, что может способствовать лучшему пониманию цилиопатий и разработке новых методов оптогенетики.
Введение
Свет является незаменимым источником энергии для фотосинтезирующих организмов, но слишком много света может вызвать фотоокислительное повреждение. Таким образом, фототрофные организмы должны выживать при свете умеренной интенсивности, где они могут фотосинтезировать, но не страдать от фотоокислительного повреждения1. В наземных растениях хлоропласты не могут выходить из листа и показывать фотодвижения в клетке; хлоропласты перемещаются на периферию клетки при сильном освещении и на поверхность клетки при слабом освещении2, тогда как многие подвижные водоросли демонстрируют фотоповедение, которое позволяет им находить надлежащие условия освещения для фотосинтеза и, таким образом, облегчают их выживание3.
Chlamydomonas reinhardtii - это одноклеточные зеленые водоросли, рассматриваемые как модельный организм в таких областях исследований, как реснички (также известные как жгутики), фотосинтез и фотоповедение. C. reinhardtii имеет одно глазное пятно и две реснички на клетку, используемые для фоторецепции и плавания соответственно. Глазное пятно имеет два компонента: канальныеродопсины (ChRs), световые ионные каналы в плазматической мембране и богатые каротиноидами гранулярные слои, расположенные прямо за ChRs. Глазное пятно действует как рецептор направленного света, поскольку богатые каротиноидами гранулярные слои функционируют как светоотражатель 4,5.
ChRs были первоначально идентифицированы как фоторецепторы, вызывающие фотоповедение у C. reinhardtii 6,7,8,9. Хотя две изоформы, ChR1 и ChR2, обнаружены в глазном пятне, эксперименты показали, что ChR1 является основным фоторецептором для фотоповедения10. Несмотря на это, ChR2 получил больше внимания и сыграл центральную роль в развитии оптогенетики, техники контроля возбуждения клеток светом11. Таким образом, изучение регуляторных механизмов, регулирующих фотоповедение у C. reinhardtii, будет способствовать пониманию функции ChR и улучшению оптогенетики.
После фоторецепции клетки C. reinhardtii показывают два типа фотоповедения: фототаксис и фотошоковый ответ12. Фототаксис — это поведение клеток, плавающих в направлении источника света или в противоположном направлении, называемое положительным или отрицательным фототаксисом соответственно. Реакция фотошока — это поведение, которое клетки демонстрируют после внезапного изменения интенсивности света, например, при освещении вспышкой. Клетки перестают плавать или плыть назад (т.е. плавают с телом клетки вперед) в течение короткого периода, обычно <1 с.
Цилиарные движения у C. reinhardtii участвуют в его фотоповедении. Две реснички обычно бьются, как при плавании человека брассом, и это модулируется для фотоповедения. Для фототаксиса силы, генерируемые двумя ресничками, несбалансированы модуляцией частоты биения и амплитуды формы волны каждой реснички13. Ресничка, ближайшая к глазному пятну, называется цис-ресничкой, а другая называется транс-ресничкой. Эти две реснички различаются по разным пунктам. Например, частота цилиарного биения реснички in vitro на 30%-40% выше14. Кроме того, их чувствительность Ca2+ отличается. Реактивация моделей15 демембранированных клеток показала, что цис-ресничка бьется сильнее, чем транс-ресничка для Ca2+ <1 x 10−8 M, в то время как для Ca2+ >1 x 10−7 M верно обратное. Эта асимметрия в чувствительности Ca2+, возможно, важна для фототаксических поворотов, поскольку мутанты, лишенные этой асимметрии, не проявляют нормального фототаксиса16,17. И наоборот, преобразование формы сигнала необходимо для фотошока. Цилиарная форма сигнала преобразуется из асимметричной формы сигнала в прямом плавании в симметричную форму волны в обратном плавании. Это преобразование формы сигнала также регулируется Ca2+, при пороге 1 x 10−4 M18,19. Поскольку дефекты в регулировании цилиарных движений вызывают первичную цилиарную дискинезию у людей, изучение фотоповедения у C. reinhardtii может помочь в лучшем понимании этих заболеваний и терапевтических разработок20.
Здесь демонстрируются четыре простых метода наблюдения фотоповедения у C. reinhardtii . Во-первых, показан фототаксисный анализ с использованием чашек Петри, а во-вторых, фототаксисный анализ на наличие капель клеточной суспензии. Явление, наблюдаемое в обоих случаях, не является строго фототаксисом, а фотоаккумуляцией, где клетки имеют тенденцию накапливаться близко к стороне источника света или противоположной стороне. У C. reinhardtii накопление фотографий в основном вызвано фототаксисом таким образом, что может быть использовано в качестве приближения к фототаксису. В-третьих, показан более строгий анализ фототаксиса под микроскопом, и последний - фотошок под микроскопом.
протокол
В настоящем исследовании был использован штамм дикого типа Chlamydomonas reinhardtii, потомство кросса CC-124 x CC-125 с agg1+mt-,21. CC-124 и CC-125 были получены из Ресурсного центра Chlamydomonas (см. Таблицу материалов) и поддерживались на трис-ацетат-фосфате (TAP)22, 1,5% агарозной среде при 20-25 °C. Для этого протокола может быть использована любая подвижная деформация.
1. Клеточная культура
- Культивируйте интересующий штамм Chlamydomonas reinhardtii в жидкой среде TAP с аэрацией путем пузырькового стерильного воздуха в светло-темный период 12 ч/12 ч (светлый период, ~50 мкмоль фотонов·м−2·с−1 белого света) при 20-25 °C в течение 2 дней.
ПРИМЕЧАНИЕ: Необходимо использовать клетки в среднелогарифмической фазе роста. Длительная культура (>3 дня, в фазе позднего логарифмического роста) делает клетки менее чувствительными к световому стимулу и увеличивает количество мертвых клеток в культуре, препятствуя считыванию результатов.

Рисунок 1: Жидкая культура после 2-дневного культивирования. Из пластины агара TAP-1,5% кусок клеток дикого типа, заполняющих платиновую петлю, инокулировали в ~150 мл жидкой среды TAP в колбе. Плотность клеток после 2-дневной культуры составила ~5,0 х 106 клеток/мл. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Предварительная обработка клеток
- Смешайте ~ 10 мкл культуры с равным объемом дециляционного раствора, чтобы остановить плавание клеток и измерить плотность клеток с помощью счетчика клеток или гемоцитометра.
ПРИМЕЧАНИЕ: Есть приблизительно 1-5 х 106 клеток / мл после 2-дневной культуры (рисунок 1). Состав дециляционного раствора выглядит следующим образом: 40 мМ ацетата калия, 1 мМCaCl2, рН 4,5, скорректированный с HCl. - Центрифугировать необходимое количество жидкой культуры при 1000 х г в течение 3 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Для одного эксперимента требуется 3 мл 2 х 107 клеток/мл для стандартных условий анализа фототаксиса в чашке Петри. Если два эксперимента будут проводиться с культурой 1 x 106 клеток/мл, необходимо центрифугировать 120 мл культуры. - Приостановить гранулу ячейки с необходимым количеством экспериментального раствора фотоповедения до ~2 х 107 клеток/мл (для анализа фототаксиса чашки) или 1 х 106 клеток/мл (для анализа фототаксиса на клеточном уровне или анализа реакции фотошока) и поместить клеточную суспензию в коническую трубку.
ПРИМЕЧАНИЕ: Плотность клеток не нуждается в строгом контроле для приблизительной оценки фотоповедения или может изменяться в зависимости от цели анализа. Фотоповедение экспериментального раствора14: 5 мМ HEPES (рН 7,4), 0,2 мМ EGTA, 1 мМ KCl, 0,3 мМ CaCl2. Этот этап буферного обмена может быть опущен для простого анализа на способность проявлять фотоповедение, и эксперимент может быть выполнен с культуральной средой. Однако, поскольку ионный состав раствора влияет на фототаксические признаки24, а ионный состав среды после культивирования может быть не постоянным, рекомендуется использовать этот раствор для более строгого анализа. Замена на свежую среду TAP может быть вариантом. - Поместите трубку под тусклый красный свет (10-30 мкмоль фотонов·м−2·с−1) на ~1 ч (рисунок 2).
ПРИМЕЧАНИЕ: Этот шаг увеличивает чувствительность клеток к световому стимулу.

Рисунок 2: Суспензия ячейки под красным светом. Обычный флуоресцентный белый свет, покрытый листом красного целлофана. Трубку, содержащую клеточную суспензию, помещают под ~10 мкмоль фотонов·м−2·с−1 красного света. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Фототаксисовый анализ с использованием чашки Петри (так называемый «тест на чашку»)
- Поместите 2-3 мл клеточной суспензии в чашку Петри (3,5 см), поместите ее на лайтбокс (альтернативно, белый лист бумаги или белую пластиковую тарелку), аккуратно встряхните, чтобы равномерно распределить клетки, и приобретите рисунок перед освещением.
ПРИМЕЧАНИЕ: Размер блюда может меняться в зависимости от цели. В зависимости от штамма и состояния культуры клетки могут прилипать к дну чашки Петри. В таком случае застрявшие клетки необходимо удалить путем пипетирования перед анализом. - Осветите блюдо с одной стороны зеленым светодиодом (светодиод, см. Таблицу материалов) в настольной темной комнате (рисунок 3).
ПРИМЕЧАНИЕ: Типичные условия освещения: λ = 525 нм и 50-100 мкмоль фотонов·м−2·с−1. Смотрите обсуждение выбора длины волны источника света в разделе обсуждения. Накройте как посуду, так и светодиод коробкой или черной тканью, когда используется небольшой светодиод. - Оставьте их на ≥5 минут, а затем получите изображения.
ПРИМЕЧАНИЕ: Время светового освещения может быть изменено в зависимости от размера или назначения чашки Петри (рисунок 4). - Импортируйте файл изображения на Фиджи (см. Таблицу материалов) для количественной оценки.
ПРИМЕЧАНИЕ: Fiji является дистрибутивом ImageJ2, объединяющим множество плагинов. - Измените цвет изображения на оттенки серого с помощью Image > Type > 8-bit (рисунок 5).
- Переверните черно-белое с помощью функции «Изменить > инвертировать».
- Окружите все блюдо как область интереса (ROI) и измерьте плотность с помощью анализа > измерения.
ПРИМЕЧАНИЕ: Плотность общего блюда может быть рассчитана как (Площадь) x (Среднее). - Окружите половину тарелки ближе всего к источнику света в качестве ROI и измерьте плотность.
- Рассчитайте фототаксический индекс как (плотность фототаксических клеток) на (плотность общих ячеек).

Рисунок 3: Боковое освещение для анализа фототаксисной чашки. (A) Чашка Петри, содержащая клеточную суспензию, помещенную на лайтбокс в настольной темной комнате. Зеленый свет (светодиодная пластина 525 нм, ~100 мкмоль фотонов·м−2·с−1) освещается сбоку. B) Альтернативный метод освещения. 5-мм светодиод пушечного ядра. (C) Чтобы блокировать свет снаружи, вместо настольной темной комнаты можно использовать коробку с черной тканью внутри. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Пример отрицательного фототаксиса после 5 мин бокового освещения. (А) Клеточная суспензия дикого типа в чашке Петри, освещенная в течение 5 мин. Большинство клеток скапливается на противоположной стороне источника света. Эти данные можно интерпретировать как отрицательный фототаксис. (B) Изображение блюда сверху. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
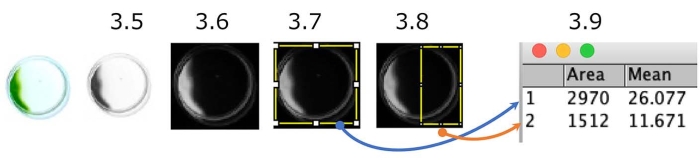
Рисунок 5: Количественная оценка фототаксиса тарелки. Пример клеток, показывающих отрицательный фототаксис (источник света находится с правой стороны). Цветное изображение преобразуется в оттенки серого (шаг 3.5.), а затем инвертируется (шаг 3.6.). Области интереса (ROI), все блюдо (шаг 3.7.) и половина блюда со стороны источника света (шаг 3.8.) были разграничены. Была измерена плотность каждого ROI (Шаг 3.9.). В этом случае фототаксический индекс (PI) составляет около 0,18 ([1,512 x 11.671] / [2,970 x 26.077]). PI равен 1 или 0, когда все клетки показывают положительный или отрицательный фототаксис соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Фототаксисовый анализ с использованием капель клеточной культуры
- Поместите 25 мкл капель клеточной суспензии (этап 2.4.) непосредственно на белую пластиковую пластину с помощью микропипетки.
- Осветите капли с одной стороны зеленым светодиодом в настольной темной комнате (рисунок 6).
ПРИМЕЧАНИЕ: Типичные условия освещения составляют λ = 525 нм и 50-100 мкмоль фотонов m−2 s−1. Накройте обе пластины и светодиод коробкой или черной тканью, когда используется небольшой светодиод. - Оставьте их на 3 минуты, а затем получите изображения.
ПРИМЕЧАНИЕ: Этот анализ подходит для быстрой проверки фототаксиса многих образцов одновременно, например, при мутантном скрининге или анализе тетрад. Клеточная культура в середине бревенчатой фазы, выращенная в 96-луночной пластине, может быть непосредственно освещена для облегчения производительности. В обоих случаях шаг 2 (предварительная обработка клеток) может быть опущен.

Рисунок 6: Анализ капельной фототаксии. (А) Девять капель клеточной суспензии объемом 25 мкл помещены на белый пластиковый лист и освещены сбоку зеленым светодиодом. (B) После 3 мин освещения. В каждой капле клетки либо накапливались на стороне источника света (положительный фототаксис), накапливались на противоположной стороне (отрицательный фототаксис), либо рассеивались в каплю (без фототаксиса). Шкала = 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Фототаксисовый анализ под микроскопом
- Возьмите ~30 мкл клеточной суспензии (1 x 106 клеток/мл в экспериментальном растворе для фотоповедения) на стеклянный слайд и поместите крышку (18 мм x 18 мм) с распорками сверху (рисунок 7).
ПРИМЕЧАНИЕ: Распорки могут быть изготовлены из белых нефтяных или двусторонних клейких лент на двух противоположных сторонах крышки. Свет должен исходить с направления, где нет распорок. - Осветите образец с одной стороны крышки без распорки зеленым светодиодом и наблюдайте за ячейками под микроскопом темного поля с 10-кратной объективом при тусклом красном свете (λ > 630 нм, ~5 мкмоль фотонов·м−2·с−1, рисунок 8).
ПРИМЕЧАНИЕ: Избегайте воздействия на ячейки на сцене света, отличного от светодиодного или наблюдательного света, такого как освещение комнаты или свет от монитора ПК. Подходящее увеличение объектива зависит от угла обзора камеры. Выберите объектив с увеличением, которое позволяет ячейке плавать ~2 с, не покидая поля зрения. Для отслеживания ячеек желательно высококонтрастное изображение; таким образом, для микроскопического наблюдения рекомендуется использовать конденсатор темного поля. Однако другие конденсаторы, такие как яркое поле, могут быть использованы для наблюдения фототаксиса. Убедитесь, что свет от светодиода светит на ячейки. - Записывайте движение клеток в течение ~ 20 с после светового освещения с помощью микроскопа, оснащенного камерой.
ПРИМЕЧАНИЕ: Через несколько секунд после начала зеленого светодиодного освещения может произойти реакция фотошока, и/или фототаксическая ориентация (или знак) неустойчива; таким образом, для стабилизации отклика рекомендуется запись за 20 с (ролик 1).

Рисунок 7: Изготовление распорок по краям чехла. (А) Тонкий слой вазелина наносили на ладонь. Небольшое количество белой нефти было соскоблено краем крышки. (B) Проставка на краю крышки. (C) Еще одна распорка на противоположном краю. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8: Боковое освещение под микроскопом. (A) Настройка зеленого светодиода. Зеленый светодиод пушечного ядра крепится к муфте и крепится к подставке рядом с микроскопом. Клетки наблюдались под микроскопом темного поля с фильтром резкого разреза (λ > 630 нм). (B) Боковое освещение зеленым светодиодом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Фильм 1: Фототаксис под микроскопом. Зеленый свет горит в ~0 с справа. В этот момент клетки имели тенденцию плыть в случайном направлении. Через 0 с в счетчике времени клетки плыли либо вправо, либо влево, показывая положительный или отрицательный фототаксис. Свет был выключен в ~ 15 с, когда клетки снова начали плыть в случайном направлении. Шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы загрузить этот фильм.
6. Отслеживание фототаксических клеток и рисование полярной гистограммы
- Извлеките 1,5 с из записанного видео, начиная с 15 с после освещения.
ПРИМЕЧАНИЕ: Продолжительность траектории может меняться в зависимости от скорости плавания клетки. Видео 1,5 с содержит 46 кадров при частоте 30 кадров в секунду. - Импортируйте файл на Фиджи в виде последовательности изображений в формате файла tag Image Через > Импорт файлов > Последовательность изображений.
- Запустите плагин «Ручное отслеживание» для отслеживания клеток с помощью плагинов > отслеживания > ручного отслеживания.
- Нажмите « Добавить дорожку», и появится первый кадр.
- Нажмите на интересующую ячейку, и появится второй кадр.
- Переместите ползунок к последнему кадру и щелкните ту же ячейку, что и на шаге 6.5.
ПРИМЕЧАНИЕ: Нет необходимости отслеживать ячейки в каждом кадре. Важен только угол между осью света и отрезком линии, образованным начальной и конечной точками. - Повторите шаги 6.4.-6.6. для ~30 ячеек.
ПРИМЕЧАНИЕ: Выберите ячейки, которые остаются в пределах угла обзора в течение всех 1,5 с. Если плотность клеток достаточно низкая и траектории плавания клеток не пересекаются в течение 1,5 с, может быть выполнено автоматическое отслеживание. В этом случае выберите плагин "MTrack2" (типичные настройки: Минимальный размер объекта = 1; Максимальный размер объекта = 10 000; Максимальная скорость = 100; Минимальная длина [кадры] = 46). Рекомендуется проверить соответствие между ячейками на видео и результатами отслеживания, получив данные, установив флажок Показать текст? > Overlay Dots & Lines. - Скопируйте и вставьте результаты в программное обеспечение для работы с электронными таблицами (например, Excel).
ПРИМЕЧАНИЕ: Здесь показано, как нарисовать полярную гистограмму с помощью Excel. - Измерьте угол между осью света и направлением движения ячейки по "=градусам(atan2(x2-x1),-(y2-y1))", где начальное положение ячейки (срез #1) равно (x1, y1), а последнее положение (срез #46) равно (x2, y1).
ПРИМЕЧАНИЕ: На изображении Фиджи верхний левый угол является началом (0, 0). - Повторите шаг 6.9. для всех измеряемых ячеек (обычно ~30 ячеек).
- Подготовьте таблицу распределения частот для всех данных, полученных с помощью бункеров от −180° до +180°, разделенных на 15° на обоих концах и 30° для остальной части диапазона с помощью функции «ЧАСТОТА».
ПРИМЕЧАНИЕ: После выбора столбцов сразу в столбцы bin, введите следующее в верхнем столбце = FREQUENCY (data_array, bins_array) и нажмите Shift + CTRL + ENTER (Дополнительный рисунок 1). - Повторно создайте таблицу распределения частот со значениями, рассчитанными на шаге 6.8. поворачивается на −90°, чтобы установить правую сторону на 0° (т.е. преобразовать число в диапазоне от −15° до 15°, в диапазон от −105° до −75°), так как при вышеуказанном методе клетки, плывущие вверх, считаются плавающими под углом 0° к свету (т.е. показывающими положительный фототаксис), хотя свет идет справа (дополнительный рисунок 2).
- Введите значение угла в середине диапазона 30° бункера (например, 30° для 15°-45°), пропустив одну колонку, и введите соответствующее количество образцов справа от него (дополнительный рисунок 3).
- Преобразуйте каждое значение счетчика образцов в процент и введите 0 в столбец, соответствующий пустому столбцу между корзинами.
- Нарисуйте радиолокационную диаграмму, используя значения углов в качестве меток горизонтальной оси и процентные значения (%) в качестве легенды (дополнительный рисунок 4).
- Рассчитайте фототаксический индекс (PI) для дальнейшей количественной оценки путем усреднения cosθ (θ = угол между осью света и направлением плавания)16.
ПРИМЕЧАНИЕ: PI равен 0, когда клетки движутся в случайном направлении, и 1 или −1, когда 100% клеток показывают положительный или отрицательный фототаксис, соответственно.
7. Анализ реакции фотошока под микроскопом
- Поместите ~30 мкл клеточной суспензии (1 x 106 ячеек/мл в экспериментальном растворе для фотоповедения) на стеклянный предметный предмет и поместите крышку (18 мм x 18 мм) с распорками сверху, как в Шаге 4.1.
- Наблюдайте за клетками под микроскопом с тусклым красным светом (λ > 630 нм, ~5 мкмоль фотонов·м−2·с−1).
- Примените вспышку с помощью вспышки камеры (Ролик 2,3).
ПРИМЕЧАНИЕ: Еще один способ вызвать реакцию фотошока - быстро удалить красный фильтр вручную с траектории освещения наблюдения. Однако этот метод более изменчив, так как скорость удаления фильтра варьируется от человека к человеку (Фильм 4,5). - Записывайте движение клеток с помощью микроскопа, оснащенного камерой.
- Для количественной оценки выполните одно или оба из следующих действий: (1) рассчитать соотношение клеток, показывающих реакцию фотошока на общее количество клеток16; (2) для клеток, показывающих реакцию фотошока, измерьте время от стимула фотошока до восстановления плавания вперед25.
Фильм 2: Подсветка фотошока вспышкой камеры. Вспышка камеры была поднята на ступень микроскопа и включена. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Фильм 3: Реакция фотошока, вызванная вспышкой под микроскопом. Клетки наблюдались при тусклом красном свете. Вспышка излучалась при ~0 с. Почти все клетки перестали плавать вперед, плавали назад в течение короткого периода и восстановились в плавании вперед. Шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы загрузить этот фильм.
Фильм 4: Реакция фотошока, вызванная удалением красного фильтра под микроскопом. Клетки наблюдались при тусклом красном свете. Красный фильтр был удален через ~5 с. Почти все клетки перестали плавать вперед, плавали назад в течение короткого периода и восстановились в плавании вперед. Шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы загрузить этот фильм.
Фильм 5: Удаление красного фильтра. Быстрое удаление красного фильтра, установленного в световом контуре для доставки фотошока. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Результаты
Типичные фототаксии C. reinhardtii и анализы реакции фотошока показаны здесь. После оценки плотности клеток культуру клеток дикого типа (потомство кросса CC-124 × CC-125 с agg1+ mt -)23 промывали фотоповеденным экспериментальным раствором для анализа фототаксиса. Клеточную суспензию ...
Обсуждение
Настоящий протокол прост и не отнимает много времени. Если мутант C. reinhardtii подозревается в наличии дефектов фоторецепции или цилиарного движения, этот метод может служить в качестве первичного фенотипического анализа.
Тем не менее, некоторые критические шаги сущес?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано грантами Японского общества содействия развитию науки KAKENHI (https://www.jsps.go.jp/english/index.html) для NU (19K23758, 21K06295), TH (16H06556) и KW (19H03242, 20K21420, 21H00420), от Ohsumi Frontier Science Foundation (https://www.ofsf.or.jp/en/) до KW и от Динамического альянса за открытые инновации, соединяющие человека, окружающую среду и материалы (http://alliance.tagen.tohoku.ac.jp/english/) с NU, TH и KW.
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| 5 mm Cannonball green LED | Optosupply | OSPG5161P | |
| 50 mL conical tube | SARSTEDT | 62.547.254 | |
| AC adaptor for the light box | ATTO | 2196161 | |
| Auto cell counter | DeNovix | CellDrop BF | |
| CaCl2 | Nakalai tesque | 06731-05 | |
| Camera flash | NEWWER | TT560 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strains CC-124 and CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| C-mout CCD camera | Wraymer | 1129HMN1/3 | |
| Desktop darkroom | Scientex | B-S8 | |
| Digital still camera | SONY | RX100II | |
| EGTA | Dojindo | G002 | |
| Fiji | https://fiji.sc/ | ||
| Green LED plate | CCS | ISLM-150X150-GG | |
| HCl | Fujifilm WAKO | 080-01066 | |
| HEPES | Dojindo | GB70 | |
| KCl | Nakalai tesque | 238514-75 | |
| Lightbox (Flat viewer) | ATTO | 2196160 | |
| Microscope | Olympus | BX-53 | |
| Petri dish (φ3.5 cm) | IWAKI | 1000-035 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Power supply for the green LED plate | CCS | ISC-201-2 | |
| Red filter | Shibuya Optical | S-RG630 |
Ссылки
- Demmig-Adams, B., Adams, W. W. Photoprotection and other responses of plants to high light stress. Annual Reviews Plant Physiology and Plant Molecular Biology. 43, 599-626 (1992).
- Wada, M. Chloroplast movement. Plant Science. 210, 177-182 (2013).
- Sgarbossa, A., Checcucci, G., Lenci, F. Photoreception and photomovements of microorganisms. Photochemical & Photobiological Sciences. 1 (7), 459-467 (2002).
- Ueki, N., et al. Eyespot-dependent determination of the phototactic sign in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 113 (19), 5299-5304 (2016).
- Foster, K. W., Smyth, R. D. Light antennas in phototactic algae. Microbiological Reviews. 44 (4), 572-630 (1980).
- Nagel, G., et al. Channelrhodopsin-1: a light-gated proton channel in green algae. Science. 296 (5577), 2395-2398 (2002).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences of the United States of America. 100 (24), 13940-13945 (2003).
- Sineshchekov, O. A., Jung, K. -. H., Spudich, J. L. Two rhodopsins mediate phototaxis to low- and high-intensity light in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 99 (13), 8689-8694 (2002).
- Suzuki, T., et al. Archaeal-type rhodopsins in Chlamydomonas: model structure and intracellular localization. Biochemical and Biophysical Research Communications. 301 (3), 711-717 (2003).
- Berthold, P., et al. Channelrhodopsin-1 initiates phototaxis and photophobic responses in Chlamydomonas by immediate light-induced depolarization. Plant Cell. 20 (6), 1665-1677 (2008).
- Deisseroth, K., et al. Next-generation optical technologies for illuminating genetically targeted brain circuits. Journal of Neuroscience. 26 (41), 10380-10386 (2006).
- Wakabayashi, K., Isu, A., Ueki, N. Channelrhodopsin-dependent photo-behavioral responses in the unicellular green alga Chlamydomonas reinhardtii. Optogenetics (Advances in Experimental Medicine and Biology), 2nd ed. , 21-33 (2021).
- Rüffer, U., Nultsch, W. Flagellar photoresponses of Chlamydomonas cells held on micropipettes: II. Change in flagellar beat pattern. Cell Motility and the Cytoskeleton. 18 (4), 269-278 (1991).
- Kamiya, R., Hasegawa, E. Intrinsic difference in beat frequency between the two flagella of Chlamydomonas reinhardtii. Experimental Cell Research. 173, 299-304 (1987).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Horst, C. J., Witman, G. B. ptx1, a nonphototactic mutant of Chlamydomonas, lacks control of flagellar dominance. Journal of Cell Biology. 120 (3), 733-741 (1993).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Reiter, J. F., Leroux, M. R. Genes and molecular pathways underpinning ciliopathies. Nature Reviews Molecular Cell Biology. 18 (9), 533-547 (2017).
- Ide, T., et al. Identification of the agg1 mutation responsible for negative phototaxis in a "wild-type" strain of Chlamydomonas reinhardtii. Biochemistry and Biophysics Reports. 7, 379-385 (2016).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Finst, R. J., Kim, P. J., Quarmby, L. M. Genetics of the deflagellation pathway in Chlamydomonas. Genetics. 149 (2), 927-936 (1998).
- Morel-Laurens, N. Calcium control of phototactic orientation in Chlamydomonas reinhardtii: sign and strength of response. Photochemistry and Photobiology. 45 (1), 119-128 (1987).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Wakabayashi, K., Misawa, Y., Mochiji, S., Kamiya, R. Reduction-oxidation poise regulates the sign of phototaxis in Chlamydomonas reinhardtii. Proceedings of the National Academy of Sciences of the United States of America. 108 (27), 11280-11284 (2011).
- Harris, E. H. . in The Chlamydomonas Sourcebook Second Edition. 1, 25-64 (2009).
- Mergenhagen, D. Circadian clock: genetic characterization of a short period mutant of Chlamydomonas reinhardii. European Journal of Cell Biology. 33 (1), 13-18 (1984).
- Ozasa, K., Lee, J., Song, S., Hara, M., Maeda, M. Two-dimensional optical feedback control of Euglena confined in closed-type microfluidic channels. Lab on a Chip. 11 (11), 1933-1940 (2011).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138 (2021).
- Ueno, Y., Aikawa, S., Kondo, A., Akimoto, S. Adaptation of light-harvesting functions of unicellular green algae to different light qualities. Photosynthesis Research. 139 (1-3), 145-154 (2019).
- Takahashi, T., Watanabe, M. Photosynthesis modulates the sign of phototaxis of wild-type Chlamydomonas reinhardtii. Effects of red background illumination and 3-(3',4'-dichlorophenyl)-1,1-dimethylurea. FEBS Letters. 336 (3), 516-520 (1993).
- Morishita, J., Tokutsu, R., Minagawa, J., Hisabori, T., Wakabayashi, K. I. Characterization of Chlamydomonas reinhardtii mutants that exhibit strong positive phototaxis. Plants (Basel). 10 (7), (2021).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Inaba, K. Calcium sensors of ciliary outer arm dynein: functions and phylogenetic considerations for eukaryotic evolution. Cilia. 4 (1), 6 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены